微生物污染是食品工业亟待解决的一个重要问题,其不仅会导致食品的保质期缩短,还可能引起一系列健康风险。金黄色葡萄球菌(Staphylococcus aureus)是一种常见的食源性致病微生物,能够引起食品腐败变质以及人类和动物的食物中毒事件。常用的化学防腐剂,如苯甲酸及其钠盐等,虽在抑制食源性致病菌的生长方面效果显著,但对健康及环境构成潜在威胁。因此,绿色安全的天然抗菌剂开发与应用已成为当前领域的研究热点。
薄荷是唇形科植物薄荷(Mentha haplocalyx Briq.)的干燥地上部分,其挥发油(Mentha essential oil, MEO)因独特的气味和抗菌特性,近年来在食品保鲜领域引起了广泛关注。由于其天然来源和抗菌、抗氧化等多种生物活性,被认为是合成防腐剂的有效替代品。研究表明,MEO能够有效抑制多种食源性致病菌的生长,如大肠杆菌[1]、沙门氏菌[2]和金黄色葡萄球菌[3]等。此外,MEO还可以通过与其他植物提取物的协同作用[4],增强其抗菌效果,有效提高食品的安全性和保鲜期。本研究探讨了MEO对S.aureus药敏检测标准菌ATCC 25923的体外抑制作用及对细胞形态的影响,采用基于气相色谱-飞行时间质谱(gas chromatography-time of flight mass spectrometry, GC-TOFMS)的代谢指纹分析技术,结合多维和单维统计方法,筛选了亚抑菌浓度MEO暴露前后显著性差异代谢物,进一步通过网络分析和分子对接,深入挖掘MEO抗S.aureus的分子机制,研究结果为MEO的进一步开发及其在食品工业中的应用提供参考数据。
1 材料与方法
1.1 实验试剂及菌种
薄荷挥发油,赣州华汉生物科技有限公司;营养肉汤培养基,杭州百思生物技术有限公司;甲醇、氯仿、吡啶(HPLC级),上海阿拉丁生化科技股份有限公司;4-氯苯丙氨酸、甲氧基胺盐酸盐、无水硫酸钠(AR级)、N,O-双(三甲基硅基)三氟乙酰胺[bis(trimethylsilyl) trifluoroacetamide,BSTFA,≥99%],美国Sigma-Aldrich公司;DMSO(AR级),阿拉丁试剂有限公司。
S.aureus ATCC 25923菌种,上海工业微生物研究所。
1.2 仪器与设备
QP2020 NX气相色谱质谱联用仪,日本Shimadzu公司;7890B 气相色谱仪,美国Agilent公司;Pegasus BT Time-of-Flight 质谱仪,美国 Leco 公司;VD-850型超净台,苏州净化设备有限公司;DSX-18L手提式高压蒸汽灭菌锅,上海申安医疗器械厂;GNP-9050恒温培养箱,上海精宏实验设备有限公司;SPH-200B恒温培养摇床,上海世平实验设备有限公司;V5000可见分光光度计,上海元析仪器有限公司;SU8010扫描电子显微镜,日本Hitachi公司;Microfuge 20R 高速冷冻离心机,德国 Backman 公司;MD200-2氮吹仪、MSC-100恒温混匀仪,杭州奥盛仪器有限公司;恒温摇床,上海一恒科学仪器有限公司;LNG-T98台式快速离心浓缩干燥器,太仓市华美生化仪器厂;超低温冷冻柜,美国Thermo Scientific公司。
1.3 MEO的化学成分分析
采用GC-MS进行MEO成分分析[5]。色谱条件:色谱柱为DB-5MS(30 m×0.25 mm×0.25 μm),程序升温条件设置如下:柱温50 ℃保持1 min,然后以10 ℃/min升到100 ℃,保持3 min, 以2 ℃/min升到180 ℃,再以20 ℃/min升到300 ℃,保持5 min。载气为超纯氦气(99.999%),流速为5 mL/min。使用全自动进样器,进样量1 μL,分流比5∶1,进样口温度250 ℃。质谱条件:EI离子源,电子能量70 eV,离子源温度200 ℃,接口温度260 ℃,溶剂延迟时间4 min,扫描方式为全扫描,间隔0.3 s,质谱扫描范围为30~500 m/z。通过NIST数据库进行相似度对比,鉴定MEO的化学成分,并按照峰面积归一化法,计算各成分相对含量。
1.4 抑菌效力的测定
1.4.1 抑菌圈直径
采用Kirby-Bauer药敏纸片法测定抑菌圈大小,用游标卡尺测量抑菌圈直径。每组设置3个重复。
1.4.2 最小抑菌浓度(minimum inhibitory concentration, MIC)
采用常量肉汤稀释法[6]测定MIC,二甲基亚砜(dimethyl sulfoxide,DMSO)为助溶溶剂。用二倍稀释法将MEO溶液加入菌悬液中,37 ℃,120 r/min培养过夜,肉眼观察无菌生长的最低浓度为MIC。
1.4.3 生长曲线分析
采用分光光度法测定 MEO 体外抑制 S.aureus 的生长曲线。用营养肉汤培养基将S.aureus菌悬液稀释到 OD600=0.03。在菌液中加入MEO溶液,使其终浓度分别为 0.1×MIC、0.5×MIC 和1.0×MIC,同时以加入DMSO 溶剂的菌液作为对照。将菌液在 37 ℃、120 r/min振荡培养10 h,每间隔1 h,用可见分光光度计测定菌液在600 nm处的吸光度。以时间为横坐标,OD600值为纵坐标绘制生长曲线。
1.5 扫描电镜(scanning electron microscope,SEM)分析
将S.aureus在37 ℃、120 r/min条件下培养至生长对数期后,加入DMSO溶解的MEO,使其终浓度分别为0.5×MIC和1.0×MIC。以DMSO为对照,于37 ℃、120 r/min培养4 h,1 000×g离心5 min,菌体用PBS洗涤2次后,加入适量2.5%(质量分数)戊二醛,4 ℃冰箱中固定过夜。
用PBS洗涤2次,除去戊二醛,再用30%、50%、70%、90%和100%(体积分数)乙醇梯度脱水。在锡箔纸上滴加上述菌液,晾干后,剪下置于导电胶上,喷金,进行SEM观察[7]。每组设置3个重复。
1.6 微生物代谢组学分析
1.6.1 样本收集
将S.aureus菌株接种于营养肉汤培养基,于37 ℃摇床(120 r/min)培养过夜后,稀释至菌液在600 nm波长处的吸光度约为0.03。将菌液分为MEO干预组和对照组,分别用亚抑菌浓度(0.1×MIC)MEO和空白溶剂处理。将2组样本培养至对数生长期OD600~0.8(菌液在600 nm波长处的吸光度约为0.8),4 ℃、12 000 r/min 离心10 min,除去液体培养基。加入PBS缓冲液洗涤2次,离心,进行细胞计数。液氮淬灭后,于-80 ℃冻存。每组样本平行取样6次。
1.6.2 样本前处理
按照文献方法进行样本前处理[8]。在样本管中加入一定量研磨珠、内标4-氯苯丙氨酸(1 mg/mL)10 μL和100 μL超纯水,低温研磨3 min。加入甲醇/氯仿混合溶液(体积比为3∶1) 200 μL,于-20 ℃放置10 min,超声后,4 ℃、12 000 r/min离心15 min。取200 μL上清液至进样瓶,真空冷冻干燥机浓缩挥干。加入二氯甲烷复溶,氮吹仪吹干。在进样瓶中加入甲氧胺吡啶溶液(15 mg/mL)40 μL,涡旋,37 ℃摇床振荡2 h;加入BSTFA(1%四甲基硅烷,质量分数)80 μL,涡旋,70 ℃ 充分反应1 h。常温放置2 h 后上机分析。
1.6.3 GC-TOFMS分析条件
参照文献方法进行GC-TOFMS分析[8]。色谱条件:Restek Rxi-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气为超纯氦气(99.999%),流量为1 mL/min;进样体积为1 μL;程序升温条件:初始柱温 80 ℃,保持2 min,然后以12 ℃/min升高至300 ℃,保持5.7 min。质谱分析离子源采用EI(电子轰击离子源),其温度为220 ℃,电子能量为70 eV;基于全扫描的扫描方式、50~500 m/z的扫描范围、每秒20个光谱的扫描速率完成检测分析。质谱条件:EI为离子源,离子源温度为220 ℃,传输线温度270 ℃,溶剂延迟时间4.6 min;质量扫描范围为50~500 m/z,速率为20个光谱/s。
1.6.4 数据处理与统计分析
使用ChromaTOF软件进行数据采集、基线校正、信号去噪、色谱峰解卷积以及面积计算等。采用NIST标准谱图库、Fiehn代谢物谱图库,通过对比保留指数和质谱碎片离子,对代谢物进行鉴定。导出含代谢物名称、质荷比、峰强度、保留时间等信息的数据矩阵表,用于后续分析。
1.6.5 统计分析
通过SIMCA-P软件(Version 14.1,Umetrics,Umea,Sweden)进行多维统计分析,包括主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),并计算变量权重值(variable importance for the projection, VIP)。VIP>1.0的变量表示对组间分类有显著贡献。采用Student’s t检验进行单变量统计分析,P<0.05表示具有统计学差异。利用MetaboAnalyst 5.0(http://www.metaboanalyst.ca/)对差异性代谢物进行代谢通路分析。通过GraphPad Prism软件(Inc., La Jolla, CA, USA)绘制箱式图。
1.7 网络的构建与分析
通过STITCH(http://stitch.embl.de/)、SEA(http://sea.bkslab.org/)、SwissTargetPrediction(http://www.swisstargetprediction.ch/)和TCMSP数据库(https://tcmspw.com/index.php)获得MEO化学成分相关的靶标基因。利用HMDB数据库(https://hmdb.ca/)检索与差异性代谢物相关的靶点。通过Uniprot数据库(https://www.uniprot.org/)对靶标基因名称进行标准化,并去重。通过对MEO成分靶标和差异性代谢物靶标的映射分析获得关键靶标。将这些关键靶标导入STRING数据库(https://string-db.org/),分析其相互作用关系,并进一步筛选置信评分>0.4的靶标,采用Cytoscape 3.7.1软件构建蛋白相互作用网络(protein-protein interactive network)并进行可视化。
利用DAVID数据库(https://david.ncifcrf.gov/),对关键靶点进行GO功能富集分析和KEGG通路富集分析。最后,采用Cytoscape 3.7.1软件构建“成分-靶标-通路”互作网络相互作用网络,并确定各成分、靶点和通路的网络拓扑参数。
1.8 分子对接
通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得MEO抗S.aureus关键成分的三维结构。通过PDB蛋白质结构数据库(http://www.rcsb.org)获得关键蛋白的晶体结构。对关键成分和靶标进行预处理,删除原配体和水分子,添加极性氢原子,赋予电荷和磁场。使用AutoDock Tools 1.5.6软件完成小分子与蛋白的对接,并获得结合能(binding energy)评分。通过PyMol软件对关键成分与靶标的相互作用进行可视化。
2 结果与讨论
2.1 MEO的化学成分
采用GC-MS对MEO的化学成分进行分析,总离子流色谱(total ion chromatogram,TIC)图如图1所示。通过NIST数据库,结合Kovats保留指数,从MEO中共鉴定73种成分,主要包括单萜类(74.63%)、倍半萜类(4.37%)、酯类(3.37%)和其他类(9.8%),占MEO总成分的92.17%。主要包括薄荷醇(27.98%)、香芹酚(8.26%)、胡椒烯酮(3.73%)、胡椒薄荷酮(2.73%)、乙酸薄荷酯(2.48%)、薄荷酮(2.07%)、3-辛醇(1.08%)、石竹烯(0.91%)及柠檬烯(0.84%)等。更多化学成分信息如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.041612)所示。
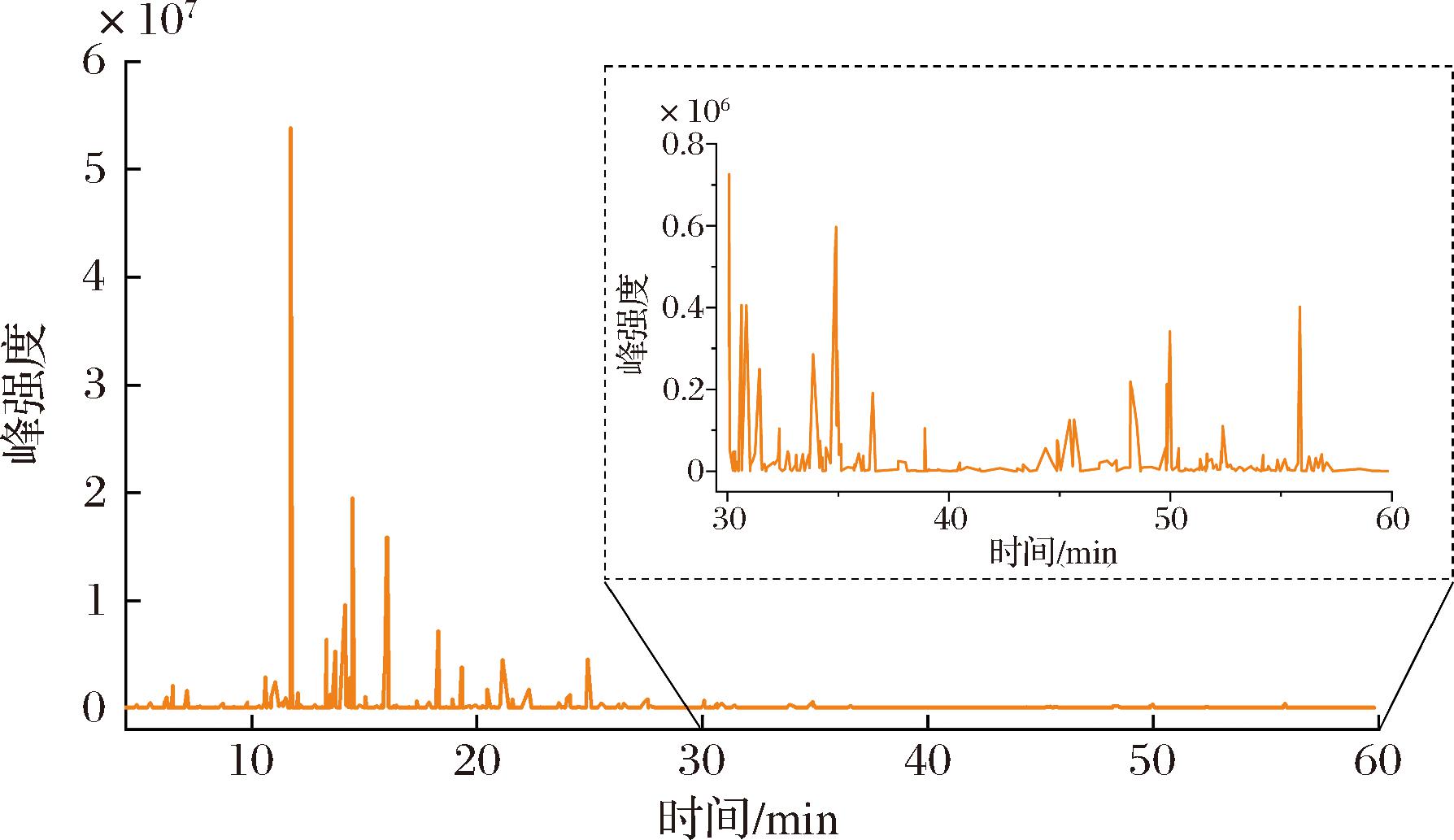
图1 MEO的GC-MS分析总离子流色谱图
Fig.1 TIC of MEO by GC-MS
2.2 MEO对S.aureus的抗菌活性
MEO抗S.aureus的抑菌圈直径为(12.9±0.4) mm,根据Kirby-Bauer法判断标准,S.aureus对MEO表现为中度敏感,MIC为0.4%(体积分数)。
MEO对 S.aureus 生长曲线如图2 所示。与对照组相比,0.1×、0.5×和1.0×MIC浓度下的 MEO处理对S.aureus的生长表现出不同程度的抑制作用,细菌进入对数生长期的时间显著延迟,且MEO浓度越高,延迟时间越长,0.4%(体积分数)的MEO在10 h内对S.aureus抑制率仍可达到94%。
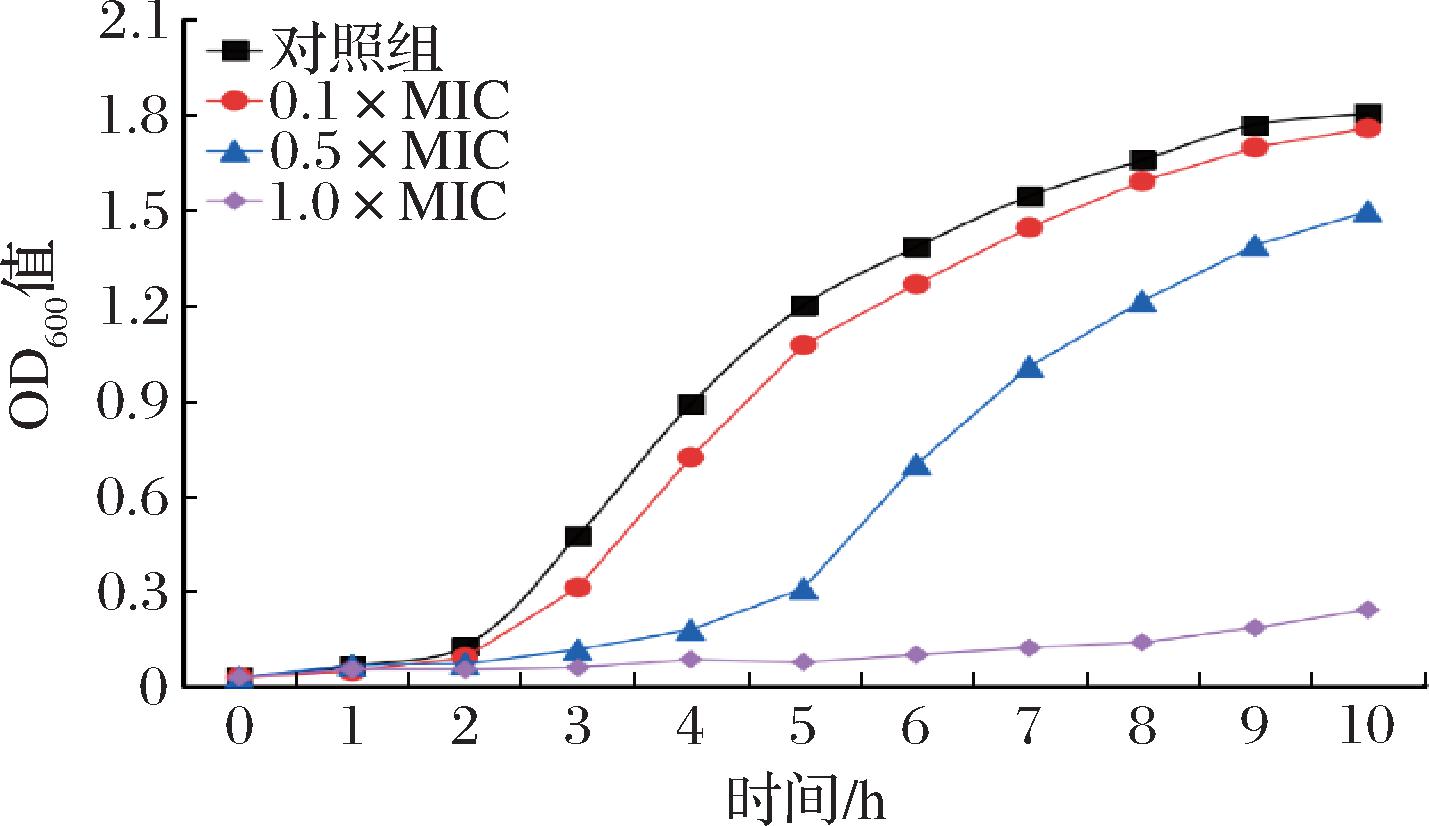
图2 不同浓度MEO暴露的S.aureus生长曲线
Fig.2 Growth curve of S.aureus exposed to different concentrations of MEO
2.3 MEO对S.aureus细胞形态的影响
采用SEM观察MEO对S.aureus细胞形态和细胞膜的影响(图3)。结果表明,对照组S.aureus菌体表面光滑、饱满,形态完整。在0.5×MIC浓度的MEO暴露下,S.aureus 细胞产生轻微变形,细胞表面出现皱缩,凹陷,说明MEO对S.aureus具有影响作用。在1.0×MIC浓度下,S.aureus细胞变形和凹陷情况进一步加剧,甚至部分细胞出现破裂情况。先前的研究也证实MEO分子可增加细菌细胞膜的通透性[9],影响膜电位、外排活动和呼吸活动。
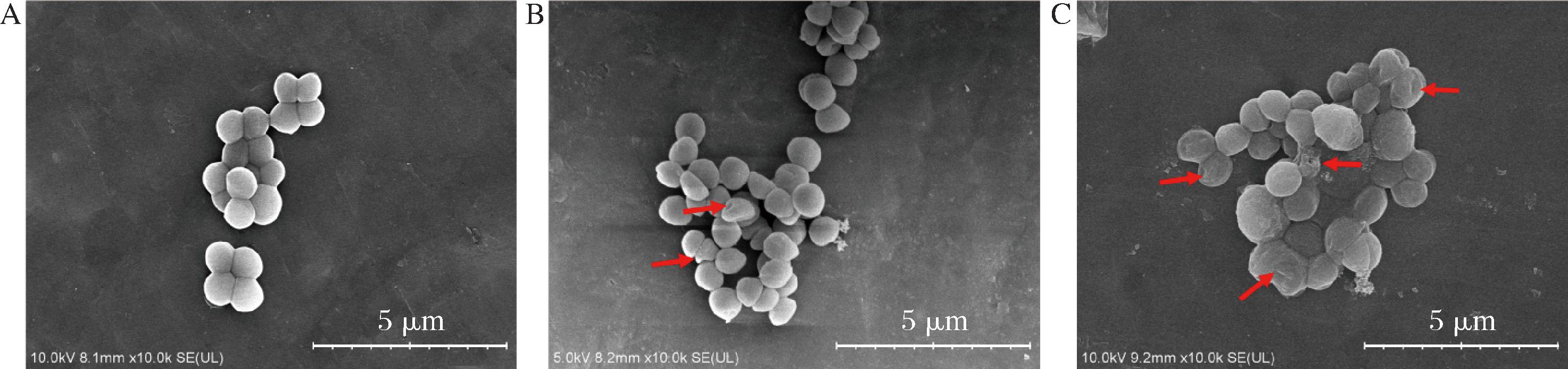
A-对照组;B- MEO干预组(0.5×MIC);C-MEO干预组(1.0×MIC)
图3 MEO对S.aureus细胞形态的影响
Fig.3 Effects of different concentrations of MEO on the cellular morphology of S.aureus
2.4 微生物代谢组学分析
2.4.1 TIC图
收集亚抑菌浓度(0.1×MIC)MEO作用下处于对数生长期的S.aureus细胞,此时抑菌率约18.4 %,并与对照组细胞样本交叉排序,进行代谢组学分析。GC-MS分析的TIC图如图4-A所示。2组样本的色谱峰容量大、峰形好。MEO干预组的代谢指纹与对照组相比存在明显差异。
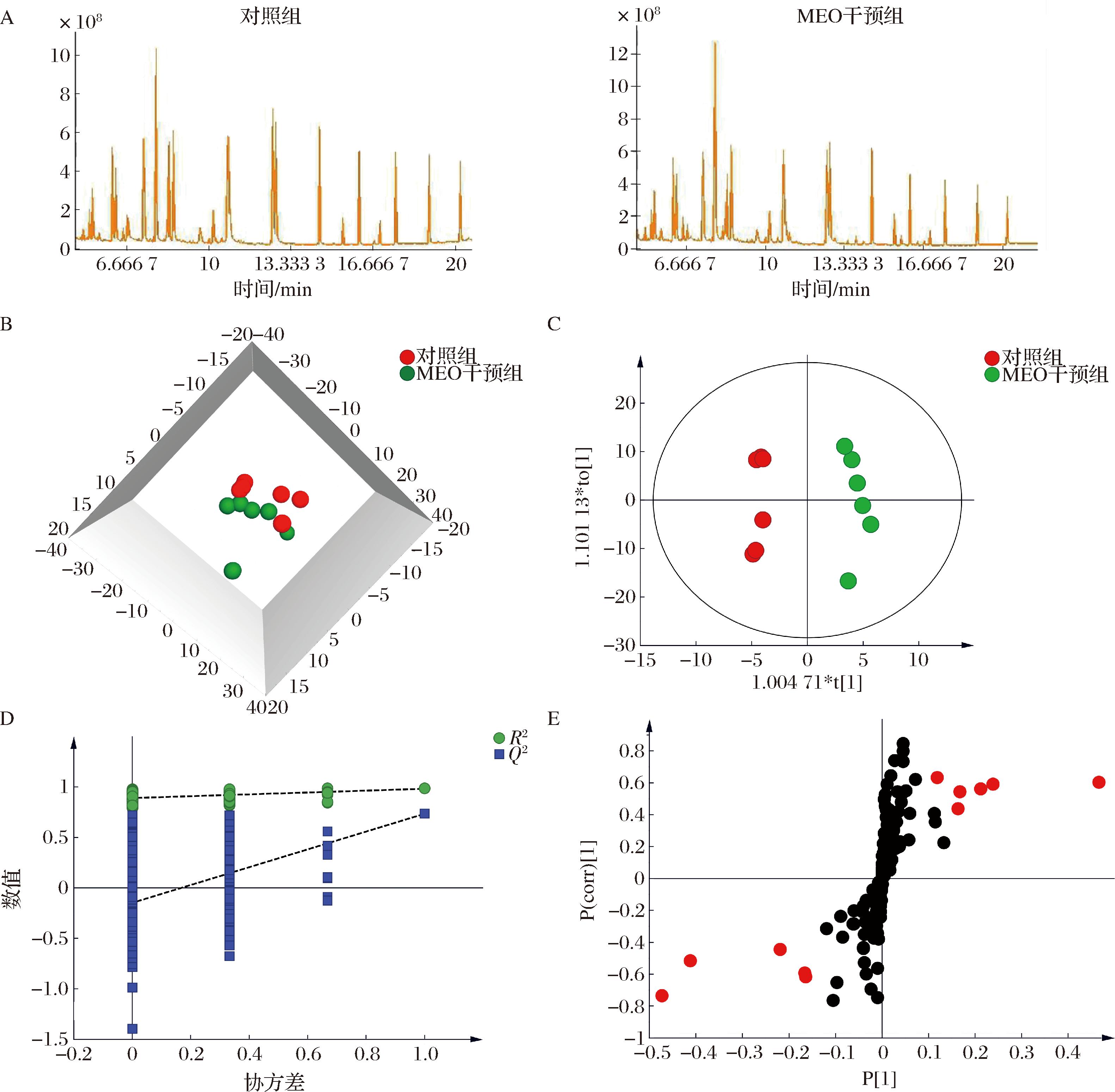
A-对照组和MEO干预组的GC-TOFMS分析总离子流图;B-3D-PCA图;C-OPLS-DA得分图;D-置换检验结果(R2,可释方差; Q2,模型预测能力);E-S-plot 图
图4 微生物代谢组学结果(n=6)
Fig.4 Microbial metabolomics results (n=6)
注:其中红色点表示对区分2组样本最有贡献的代谢物(VIP>1.0)。

A-MEO组相比对照组的显著差异性代谢物;B-亚抑菌浓度MEO暴露显著影响的代谢通路
图5 显著差异性代谢物及代谢通路分析结果
Fig.5 Results of the significantly differential metabolites and metabolic pathways
注:L-glutamic acid:L-谷氨酸;L-malic acid:L-苹果酸;fumaric acid:富马酸;myo-inositol:肌醇;ethanolamine:乙醇胺;putrescine:腐胺;pyrophosphate:焦磷酸盐;threitol:苏糖醇;N-acetylarylamine:N-乙酰芳胺;heptadecanoic acid:十七烷酸;arginine biosynthesis:精氨酸生物合成;citrate cycle (TCA cycle):三羧酸循环(TCA循环);alanine, aspartate and glutamate metabolism:丙氨酸、天冬氨酸和谷氨酸代谢;pyruvate metabolism:丙酮酸代谢;inositol phosphate metabolism:肌醇磷酸代谢;glutathione metabolism:谷胱甘肽代谢;*表示P<0.05;**表示P<0.01;***表示P<0.001。
2.4.2 差异代谢物筛选
采用自建和商业数据库,从2组样本中共鉴定出192个代谢物。对鉴定的所有代谢物进行无监督的PCA和有监督的OPLS-DA,结果分别如图4-B、图4-C 所示。模型参数分别为R2X=0.738, Q2=0.306以及R2X=0.669,R2Y=0.981,Q2=0.733。置换检验(图4-D)结果表明,OPLS-DA模型稳健,不存在过拟合情况。样本在 95%的置信区间内呈现组内聚类、组间离散的特征。S-plot进一步证实MEO暴露对S.aureus 代谢具有显著影响,图中位于两端的红色点表示对该多变量模型贡献度最大的代谢物(图4-E)。此外,通过非参检验和变异倍数进行单变量统计分析。
结合多维和单变量统计分析结果,将满足OPLS-DA模型VIP>1.0、非参检验P<0.05、倍数变化FC>1.2或FC<0.8作为筛选显著性差异代谢物的标准。结果表明,相比对照组,10个代谢物在MEO干预组出现显著变化,主要包括L-谷氨酸、苹果酸、肌醇、富马酸、乙醇胺等。其中7个代谢物在MEO干预组显著增加,3个代谢物显著减少。这些差异性代谢物的具体信息如图5-A以及附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.041612)所示,它们可能对MEO抑制S.aureus生长有重要影响。
2.4.3 代谢通路分析
将所有差异性代谢物导入MetaboAnalyst 5.0中进行代谢通路分析,以impact value>0.01为标准筛选,发现涉及的代谢通路主要包括肌醇磷酸代谢(impact value=0.625)、三羧酸循环(impact value=0.075)、丙酮酸代谢(impact value=0.046)、丙氨酸、天冬氨酸和谷氨酸代谢(impact value=0.330)、精氨酸生物合成(impact value=0.110)和谷胱甘肽代谢(impact value=0.172),结果如图5-B和附表3(https://doi.org/10.13995/j.cnki.11-1802/ts.041612)所示。亚抑菌浓度MEO暴露可能通过诱导肌醇磷酸代谢异常、能量代谢紊乱(三羧酸循环、丙酮酸代谢)、氨基酸代谢紊乱和氧化应激损伤,抑制S.aureus的正常生长。
S.aureus可通过代谢重编程调节其对营养物质的摄取和利用,从而提高其在营养贫乏环境中的生存能力。肌醇磷酸作为一种重要的信号分子和代谢中间体,在细菌生长中扮演着多种角色。肌醇及其代谢产物可直接与膜蛋白相互作用,精准调控细胞活性状态[10]。同时,可参与细胞能量代谢,并在细胞周期调控、渗透压调节和细胞膜稳定性方面发挥作用[11]。此外,肌醇磷酸代谢的变化可能会影响细菌对环境压力的适应性响应,进而调节其毒力相关表型的表现[12]。
能量代谢对于生物体的生理活动、分子功能、生长和存活至关重要[13]。三羧酸循环作为能量代谢的核心途径,不仅连接着糖异生和糖酵解[14],还为糖类、脂肪酸和氨基酸氧化分解等代谢过程提供必需的前体物质[15]。这种影响增加了用于氨基酸和核酸生物合成的前体物质的可用性,从而对细菌的生长和分裂增殖起到了至关重要的作用[16]。丙酮酸是糖酵解的最终产物,在细胞质中生成后,被转运至线粒体中,成为三羧酸循环的主要碳源输入,从而维持三羧酸循环的碳流量[17]。富马酸和苹果酸是三羧酸循环和丙酮酸代谢的关键中间体。富马酸含量变化可影响黄素腺嘌呤二核苷酸递氢体的电子传递和ATP的产生[17],而苹果酸通过苹果酸脱氢酶的作用脱氢生成草酰乙酸,并伴随NADH的产生[18],对维持细胞能量代谢至关重要。精氨酸生物合成以及丙氨酸、天冬氨酸和谷氨酸代谢不仅涉及细菌生长所必需的多种氨基酸,而且与能量代谢有密切联系[19]。在精氨酸生物合成途径中,鸟氨酸与氨基甲酰磷酸酯反应生成瓜氨酸,随后,瓜氨酸与天冬氨酸反应形成精氨琥珀酸,最终裂解成精氨酸和富马酸[20]。L-谷氨酸是丙氨酸合成的直接前体,通过转氨酶作用与丙酮酸反应生成丙氨酸。同时,L-谷氨酸也可通过转氨酶转化为天冬氨酸,并参与天冬氨酸代谢途径[21]。此外,L-谷氨酸能在谷氨酸脱氢酶作用下转化为α-酮戊二酸,进而参与三羧酸循环[22]。
谷胱甘肽代谢对维持细菌正常生长有重要作用。谷胱甘肽是一种普遍存在的抗氧化剂,可中和细胞内的活性氧(reactive oxygen species,ROS)[23]。本研究中,谷胱甘肽合成的关键前体物质——L-谷氨酸含量显著降低,可能影响谷胱甘肽合成,削弱细菌对ROS的清除能力,导致菌体氧化应激损伤,诱导DNA损伤,包括碱基的氧化、DNA单链和双链断裂等[24]。DNA损伤的累积可能导致核酸合成过程中的错误,还可能干扰细胞周期的调控,导致细胞分裂过程中的异常[25]。此外,谷胱甘肽代谢异常还会影响其他与氧化还原平衡相关的代谢途径,加剧细菌氧化应激反应,从而影响其正常生长。
2.5 网络分析
通过对MEO化学成分以及关键差异代谢物相关的基因和蛋白靶标的映射分析,发现其中38个可能是亚抑菌浓度MEO干扰S.aureus正常生长的潜在靶点。构建上述重要靶标的相互作用网络,如图6-A所示。该网络共有33个节点,通过55条边交互。节点大小和颜色表示该节点介度值,节点越大,颜色越深,表示对应的介度值越大。通过DAVID数据库对关键靶标进行GO功能富集分析。按照P<0.05筛选,得到生物过程(biological process, BP)相关条目36个、分子功能(molecular function, MF)相关条目30个和细胞组成(cellular component, CC)相关条目6个。生物过程相关的主要涉及了脂质分解代谢过程、胆固醇生物合成过程、蛋白质法尼酰化和花生四烯酸代谢过程等。分子功能相关的主要包括甾醇酯酶活力、催化活性、溶血磷脂酶活力、与酶、磷脂、锌离子、受损DNA的结合等。细胞组成相关的主要包括细胞质、内质网、突触后致密区膜、脂滴等,结果如图6-B所示。KEGG通路富集分析结果,按照P<0.05筛选得到14条通路,如图6-C所示,涉及谷氨酸能突触信号通路(hsa04724)、亚麻酸代谢通路(hsa00592)、亚油酸代谢通路(hsa00591)、醚脂代谢通路(hsa00565)、花生四烯酸代谢通路(hsa00590)、甘油磷脂代谢通路(hsa00564)、Ras信号通路(hsa04014)等。最后,构建了“活性成分-靶点-通路”互作网络,如图6-D所示。该网络有93个节点,通过223条边连接,涉及41个成分、38个靶标和14条重要通路。
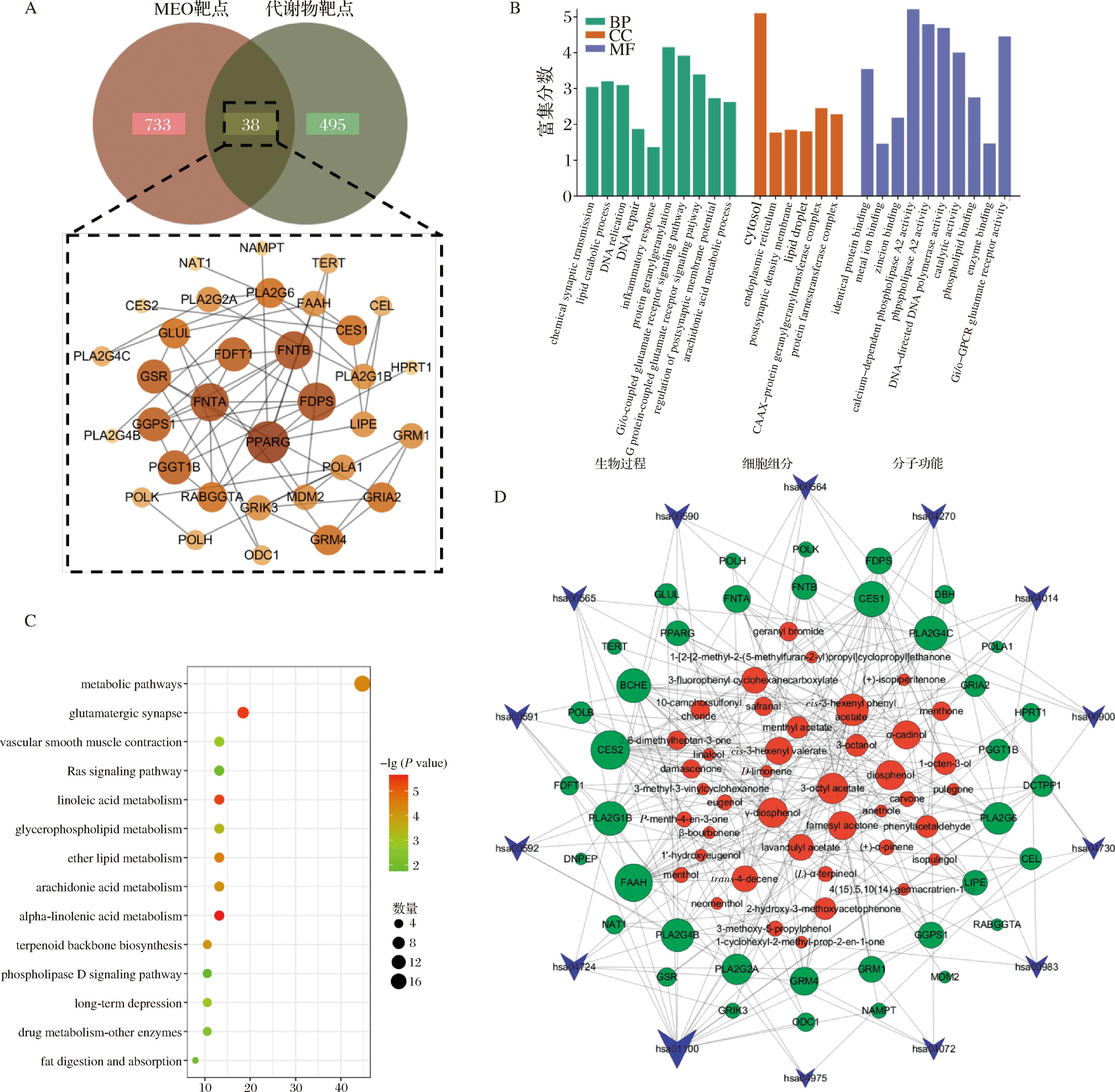
A-MEO化学成分与差异代谢物对应靶点的映射及关键靶标互作网络;B-GO功能富集分析;C-KEGG通路富集分析;D-“成分-靶标-通路”互作网络
图6 网络分析结果
Fig.6 Network analysis results
注:metabolic pathways:代谢通路;glutamatergic synapse:谷氨酸能突触;vascular smooth muscle contraction:血管平滑肌收缩;Ras signaling pathway:Ras信号通路;linoleic acid metabolism:亚油酸代谢;glycerophospholipid metabolism:甘油磷脂代谢;ether lipid metabolism:醚脂代谢;arachidonic acid metabolism:花生四烯酸代谢;alpha-linolenic acid metabolism:α-亚麻酸代谢;terpenoid backbone biosynthesis:萜类化合物骨架生物合成;phospholipase D signaling pathway:磷脂酶D信号通路;long-term depression:长时程抑制;drug metabolism-other enzymes:药物代谢-其他酶;fat digestion and absorption:脂肪消化与吸收。
2.6 分子对接验证
通过分子对接方法,对网络分析发现的关键成分和靶标之间的相互作用进行验证。两者结合能越小,表示成分与靶标的结合越稳定。结果表明,薄荷醇、薄荷酮、α-杜松醇、大马酮、香芹酮、β-波旁烯等成分可能在抑制S.aureus中发挥重要作用,主要涉及的靶标包括丁酰胆碱酯酶(butyrylcholinesterase,BCHE)、法尼基转移酶α亚基(farnesyltransferase alpha subunit,FNTA)、羧酸酯酶1(carboxylesterase 1,CES1)、CES2、脂肪酸酰胺水解酶( fatty acid amide hydrolase,FAAH)等。使用PyMol软件直观展现了这些成分与靶标的结合模式,如图7所示。它们的结合能为-8.2~-5.9 kcal/mol,具体如附表4(https://doi.org/10.13995/j.cnki.11-1802/ts.041612)所示。
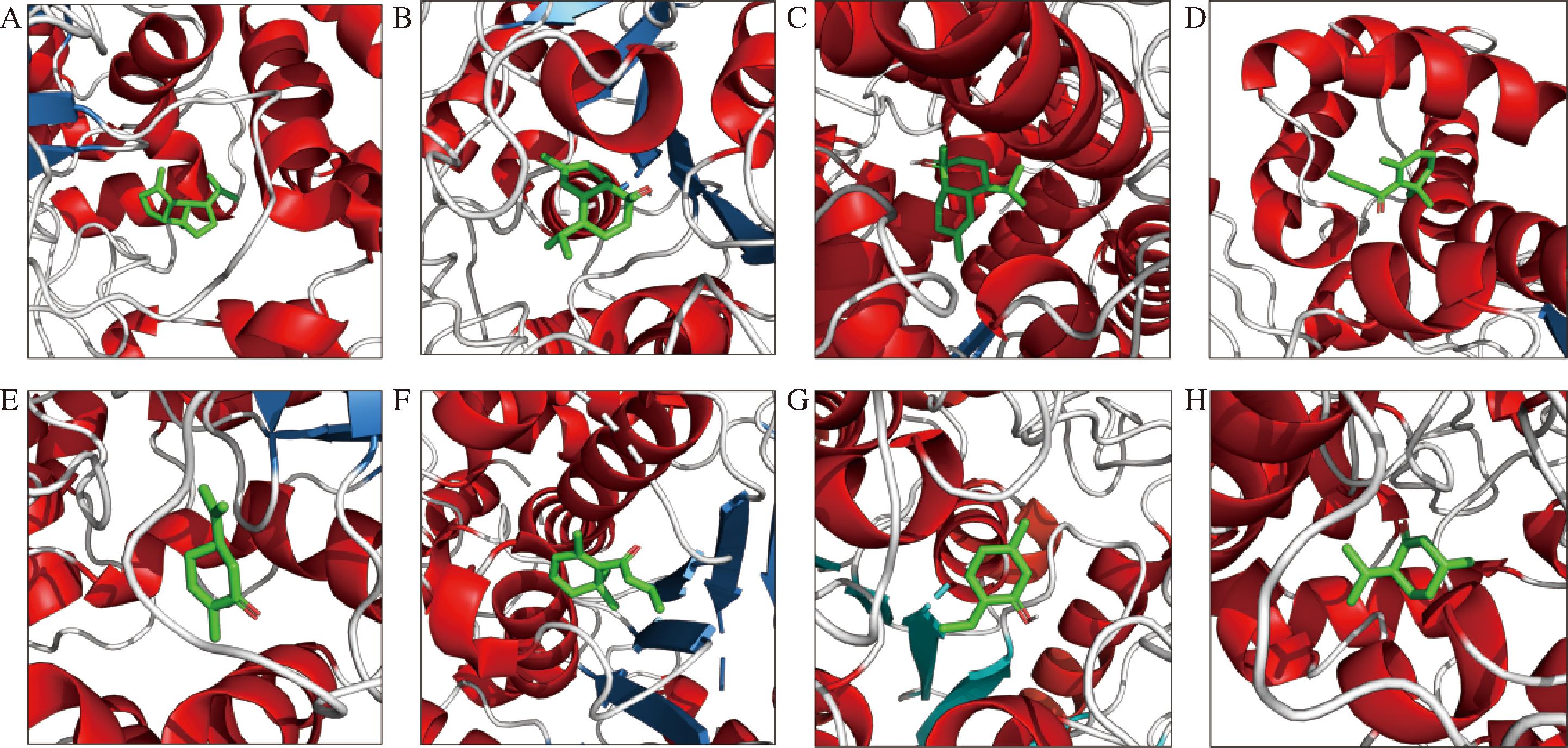
A-β-波旁烯与FAAH;B-α-杜松醇与BCHE;C-FNTA;D-大马酮与CES1;E-CES2;F-香芹酮与FAAH;G-薄荷醇与BCHE;H-薄荷酮与CES1
图7 分子对接结果:配体-蛋白相互作用3D图
Fig.7 Molecular docking results:3D diagram of ligand-protein interaction
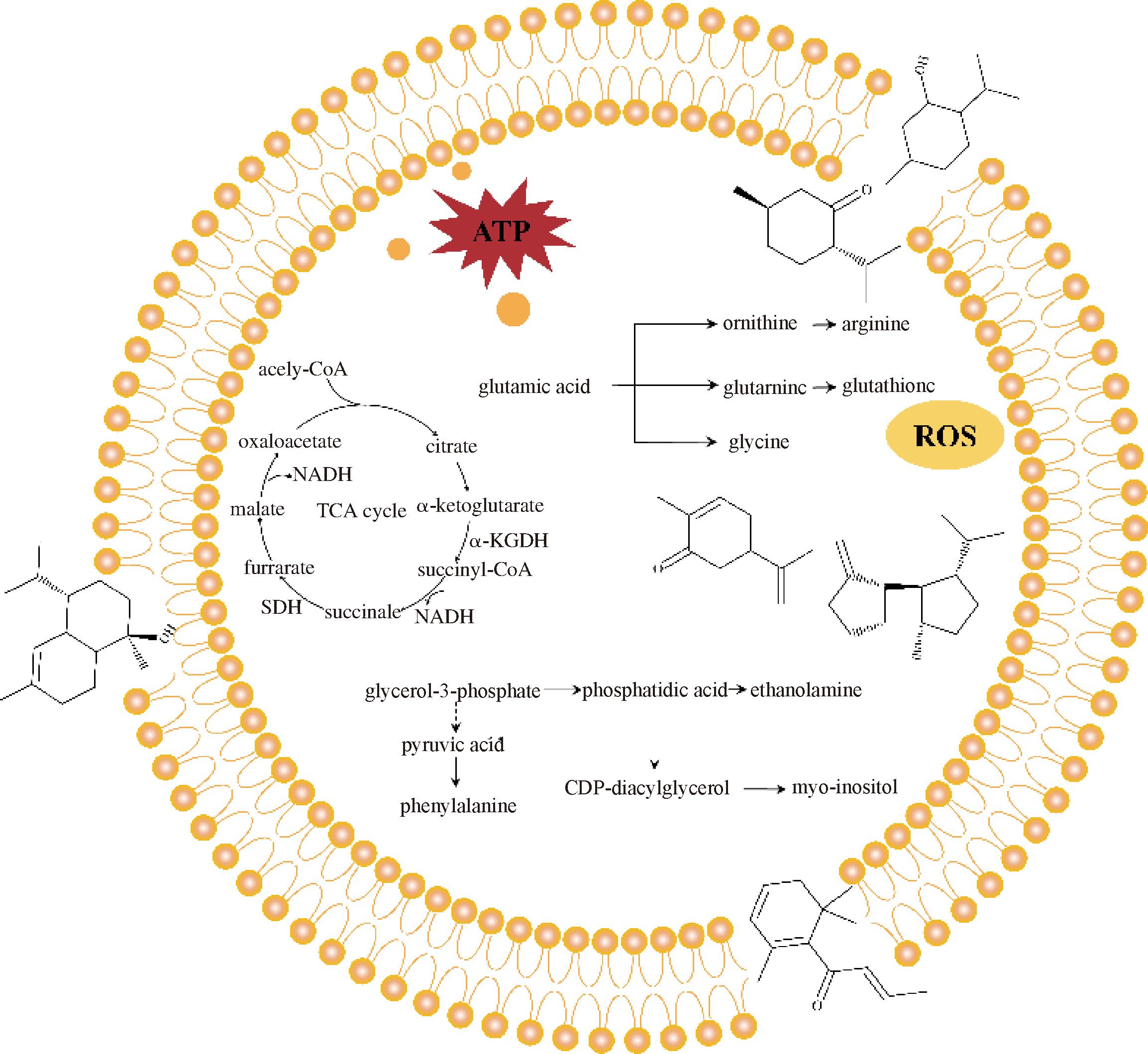
图8 MEO活性成分对S.aureus代谢调控作用示意图
Fig.8 Schematic diagram of the metabolic regulation of active constituents in MEO on S.aureus
注:acetyl-CoA-乙酰辅酶A;oxaloacetate-草酰乙酸;citrate-柠檬酸;malate-苹果酸;fumarate-延胡索酸;SDH-琥珀酸脱氢酶;succinate-琥珀酸;succinyl-CoA-琥珀酰辅酶A;α-ketoglutarate-α-酮戊二酸;α-KGDH-α-酮戊二酸脱氢酶;TCA cycle-三羧酸循环;glutamic acid-谷氨酸;ornithine-鸟氨酸;arginine-精氨酸;glutamine-谷氨酰胺;glutathione-谷胱甘肽;glycine-甘氨酸;glycerol-3-phosphate-3-磷酸甘油;phosphatidic acid-磷脂酸;ethanolamine-乙醇胺;pyruvic acid-丙酮酸;phenylalanine-苯丙氨酸;CDP-diacylglycerol-胞苷二磷酸二酰基甘油;myo-inositol-肌醇。
薄荷醇、薄荷酮、香芹酮均具有广泛的抗菌性,可通过破坏细胞膜、导致细胞膜电位去极化和产生ROS诱导氧化应激从而达到抑菌效果[26-27]。大马酮可完全抑制大肠杆菌的生长并对突变型大肠杆菌菌株的生长产生部分抑制,可将其抗菌特性与其对ATP合酶的结合和抑制作用联系起来[28]。α-杜松醇可完全抑制真菌的菌丝生长[29],β-波旁烯也是潜在的抗菌活性物质[30]。
3 结论
采用扫描电镜和基于质谱的高灵敏度微生物代谢组学方法,研究了亚抑菌浓度MEO对S.aureus细胞形态和代谢指纹的影响,并整合网络分析和分子对接技术,初步揭示MEO抗菌作用的分子机理。结果表明,MEO对S.aureus细胞形态和完整性有显著影响,在0.1×MIC MEO暴露下,S.aureus细胞中多个代谢物发生显著变化,主要涉及肌醇磷酸代谢、能量代谢(三羧酸循环、丙酮酸代谢)、氨基酸代谢和氧化应激损伤。MEO中含有的薄荷醇、薄荷酮、α-杜松醇、大马酮、香芹酮、β-波旁烯可能通过调控多种靶标,干扰了S.aureus 正常生长。研究结果为MEO在食品领域的综合开发和应用提供了参考数据。
[1] ASHRAFUDOULLA M, MEVO S I U, SONG M S, et al.Antibiofilm mechanism of peppermint essential oil to avert biofilm developed by foodborne and food spoilage pathogens on food contact surfaces[J].Journal of Food Science, 2023, 88(9):3935-3955.
[2] KACHKOUL R, TOUIMI G B, BENNANI B, et al.Optimisation of three essential oils against Salmonella spp.and Escherichia coli by mixture designa[J].Chemistry &Biodiversity, 2023, 20(11):e202301221.
[3] ALI-SHTAYEH M S, JAMOUS R M, ABU-ZAITOUN S Y, et al.Biological properties and bioactive components of Mentha spicata L.essential oil:Focus on potential benefits in the treatment of obesity, Alzheimer’s disease, dermatophytosis, and drug-resistant infections[J].Evidence-Based Complementary and Alternative Medicine, 2019, 2019(1):3834265.
[4] 李文茹, 施庆珊, 谢小保, 等.植物精油化学成分及其抗菌活性的研究进展[J].微生物学通报, 2016, 43(6):1339-1344.LI W R, SHI Q S, XIE X B, et al.Progress on the antimicrobial properties of essential oils[J].Microbiology China, 2016, 43(6):1339-1344.
[5] LIN C H, CHAO L K, LIN L Y, et al.Analysis of volatile compounds from different parts of Houttuynia cordata thunb[J].Molecules, 2022, 27(24):8893.
[6] PAUL S, DUBEY R C, MAHESWARI D K, et al.Trachyspermum ammi (L.) fruit essential oil influencing on membrane permeability and surface characteristics in inhibiting food-borne pathogens[J].Food Control, 2011, 22(5):725-731.
[7] BAJPAI V K, AL-REZA S M, CHOI U K, et al.Chemical composition, antibacterial and antioxidant activities of leaf essential oil and extracts of Metasequioa glyptostroboides Miki ex Hu[J].Food and Chemical Toxicology, 2009, 47(8):1876-1883.
[8] MIAO Q D, ZHAO L J, WANG Y T, et al.Microbial metabolomics and network analysis reveal fungistatic effect of basil (Ocimum basilicum) oil on Candida albicans[J].Journal of Ethnopharmacology, 2020, 260:113002.
[9] KANG J M, JIN W Y, WANG J F, et al.Antibacterial and anti-biofilm activities of peppermint essential oil against Staphylococcus aureus[J].LWT, 2019, 101:639-645.
[10] TARIQ K, LUIKART B W.Striking a balance:PIP2 and PIP3 signaling in neuronal health and disease[J].Exploration of Neuroprotective Therapy, 2021, 1:86-100.
[11] NAGPAL L, HE S N, RAO F, et al.Inositol pyrophosphates as versatile metabolic messengers[J].Annual Review of Biochemistry, 2024, 93(1):317-338.
[12] LI F, XIONG X S, YANG Y Y, et al.Effects of NaCl concentrations on growth patterns, phenotypes associated with virulence, and energy metabolism in Escherichia coli BW25113[J].Frontiers in Microbiology, 2021, 12:705326.
[13] YANG S Q, TIAN L, WANG X Y, et al.Metabolomics analysis and membrane damage measurement reveal the antibacterial mechanism of lipoic acid against Yersinia enterocolitica[J].Food &Function, 2022, 13(22):11476-11488.
[14] BAI J R, WU Y P, BU Q, et al.Comparative study on antibacterial mechanism of shikimic acid and quinic acid against Staphylococcus aureus through transcriptomic and metabolomic approaches[J].LWT, 2022, 153:112441.
[15] GUO F Y, LIANG Q, ZHANG M, et al.Antibacterial activity and mechanism of linalool against Shewanella putrefaciens[J].Molecules, 2021, 26(1):245.
[16] SOMERVILLE G A, PROCTOR R A.At the crossroads of bacterial metabolism and virulence factor synthesis in Staphylococci[J].Microbiology and Molecular Biology Reviews, 2009, 73(2):233-248.
[17] GRAY L R, TOMPKINS S C, TAYLOR E B.Regulation of pyruvate metabolism and human disease[J].Cellular and Molecular Life Sciences, 2014, 71(14):2577-2604.
[18] AKRAM M.Citric acid cycle and role of its intermediates in metabolism[J].Cell Biochemistry and Biophysics, 2014, 68(3):475-478.
[19] XIONG L F, TENG J L L, BOTELHO M G, et al.Arginine metabolism in bacterial pathogenesis and cancer therapy[J].International Journal of Molecular Sciences, 2016, 17(3):363.
[20] MICHIMORI Y, YOKOOJI Y, ATOMI H.An energy-conserving reaction in amino acid metabolism catalyzed by arginine synthetase[J].Proceedings of the National Academy of Sciences of the United States of America, 2024, 121(16):e2401313121.
[21] LING Z N, JIANG Y F, RU J N, et al.Amino acid metabolism in health and disease[J].Signal Transduction and Targeted Therapy, 2023, 8:345.
[22] YOO H C, YU Y C, SUNG Y, et al.Glutamine reliance in cell metabolism[J].Experimental &Molecular Medicine, 2020, 52(9):1496-1516.
[23] LIAO S J, ZHANG Y P, PAN X H, et al.Antibacterial activity and mechanism of silver nanoparticles against multidrug-resistant Pseudomonas aeruginosa[J].International Journal of Nanomedicine, 2019, 14:1469-1487.
[24] VAN HOUTEN B, SANTA-GONZALEZ G A, CAMARGO M.DNA repair after oxidative stress:Current challenges[J].Current Opinion in Toxicology, 2018, 7:9-16.
[25] DONG M X, SUN X H, XU C, et al.DNA damage repair and cell cycle arrest[J].Progress in Biochemistry and Biophysics, 1999, 26(4):1.
[26] KHAN I, BAHUGUNA A, KUMAR P, et al.Antimicrobial potential of carvacrol against uropathogenic Escherichia coli via membrane disruption, depolarization, and reactive oxygen species generation[J].Frontiers in Microbiology, 2017, 8:2421.
[27] ZHAO W M, YANG C W, ZHANG N, et al.Menthone exerts its antimicrobial activity against methicillin resistant Staphylococcus aureus by affecting cell membrane properties and lipid profile[J].Drug Design, Development and Therapy, 2023, 17:219-236.
[28] LIU M, AMINI A, AHMAD Z.Safranal and its analogs inhibit Escherichia coli ATP synthase and cell growth[J].International Journal of Biological Macromolecules, 2017, 95:145-152.
[29] JIANG L Y, WEN Y H, PENG Y, et al.Advances in biosynthesis of cadinane sesquiterpenes[J].Chinese Journal of Biotechnology, 2021, 37(6):1952-1967.
[30] JIANU C, STOIN D, COCAN I, et al.In silico and in vitro evaluation of the antimicrobial and antioxidant potential of Mentha×smithiana R.GRAHAM essential oil from western Romania[J].Foods, 2021, 10(4):815.