枣(Ziziphus jujuba Mill.)属于鼠李科枣属植物,落叶小乔木或稀灌木。枣果实营养丰富、味道甘美。目前,除鲜食和药用外,枣果的加工产品主要为枣脯、枣干、枣醋和枣酒[1-2]等产品。另外,枣果中富含挥发性酸类以及酯类等香气物质[3],常作为一种天然香料原料。然而,与枣相关的食品加工和香料提取过程中会产生大量的枣渣,约有80%的枣渣因难以再利用而被废弃,造成资源浪费和环境污染。
近年来,将微生物发酵技术应用于果渣发酵的研究逐渐成为行业热点,苹果、橙子、猕猴桃等水果的副产物通过发酵进行二次加工利用,可提高其感官和风味。李传霞[4]利用植物乳植杆菌发酵苹果渣制备饮料;张晟等[5]利用酿酒酵母发酵五味子果渣制备低醇饮料;张丽萍等[6]利用植物乳植杆菌发酵猕猴桃果渣以制备果饮。此类发酵一般是用于果饮的制备,此外也有用于香精香料的制备,如,孙强[7]利用酵母菌发酵甜玉米制备香精香料;LINDSAY等[8]利用布鲁塞尔酒香酵母发酵苹果渣、胡萝卜渣和橙子渣生产以苯乙醇为主的香精香料。
枣渣中含有大量膳食纤维、多糖、蛋白质等营养成分,同时,含有丰富的β胡萝卜素、黄酮和糖苷等香味前体物质[9],具有较高的再利用价值,因此,枣渣可作为优良的培养基,应用微生物发酵技术开发枣渣香料。应用微生物发酵技术开发枣渣香料尚未报道,本研究采用嗅香评价和GC-MS法[10-11]筛选发酵枣渣产香的微生物,开发微生物发酵枣渣发酵工艺条件,分析微生物基因组推测功能酶基因,以期为枣渣香料的开发提供参考。
1 材料与方法
1.1 原料与试剂
土壤样品,采自郑州某枣果园(东经112°42′~114°14′,北纬34°16′~34°58′);二氯甲烷(色谱纯),天津市科密欧化学试剂有限公司;蛋白胨、酵母提取物,赛默飞世尔科技公司;2,6-二氯甲苯(内标物,≥99%)、乙酸异戊酯、戊二醛固定液,上海麦克林生化科技有限公司。枣渣由河南省新郑金叶香料有限公司提供。
1.2 仪器与设备
DH-400型恒温培养箱,北京中兴伟业仪器有限公司;ZWYR-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;同时蒸馏萃取装置,上海亚荣生化仪器厂;8890-5977B型GC-MS联用仪,美国安捷伦科技有限公司;LDZX-30KBS立式高压蒸汽灭菌器,上海申安医疗器械厂;Regulus-8100型冷冻型高分辨率场发射扫描电镜,日立科学仪器有限公司。
1.3 培养基的配制
YPD培养基(g/L):葡萄糖20、蛋白胨20、酵母浸粉10,121 ℃灭菌20 min。
YPD固体培养基(g/L):蛋白胨20,葡萄糖20,酵母浸粉10,琼脂20,121 ℃灭菌20 min。
枣渣培养基:枣渣50 g,蒸馏水500 mL,摇匀后离心(6 000 r/min,10 min)取上清液,121 ℃灭菌20 min。
1.4 实验方法
1.4.1 产香菌株筛选
1.4.1.1 产香菌株初筛
将1 g土壤添加到100 mL无菌水中,于30 ℃、150 r/min条件下振荡2~4 h,获得菌源。将菌源按1%接种量接入30 mL YPD培养基中,富集培养48 h,获得富集菌源。将富集菌源进行梯度稀释后涂布于YPD固体培养基,30 ℃培养1~2 d至长出单菌落,采用划线法进行纯化后编号保存。纯化后菌株按1%接种量接入枣渣培养基中,于30 ℃、150 r/min条件下培养36 h后,取10 mL不同菌株发酵液由7位专家进行嗅香评价。
1.4.1.2 产香菌株复筛
将初筛菌株以1%接种量接入枣渣培养基中,对照组则接种等量无菌水。根据嗅香评价和GC-MS分析结果筛选产香效果最佳的菌株。
1.4.1.3 嗅香评价
按照GB/T 14454.2—2008《香料 香气评定法》,从花香、果香、酒香、青香、甜香5个方面对发酵后的枣渣发酵液进行嗅香评价。每个方面最高分5分,最低分0分,结果用雷达图表示。
1.4.1.4 GC-MS分析[12-13]
取15 mL发酵液,加入15 mL二氯甲烷溶液(≥99.9%),涡旋振荡萃取10 min,收集二氯甲烷萃取液,重复3次后合并,并加入无水Na2SO4干燥过夜,加入50 μL 2,6-二氯甲苯(0.642 6 mg/mL)为内标,常压浓缩至1 mL后进行GC-MS分析。每个样品均设3组平行。GC条件:DB-5MS色谱柱 (60 m×250 μm×0.25 μm);进样口温度为280 ℃;分流比为3∶1;分流流量为3.0 mL/min;载气为He,流速为1.0 mL/min;升温程序为初始温度50 ℃,保持3 min,以2 ℃/min的速率升温至130 ℃,保持3 min;再以5 ℃/min的速率升温至180 ℃,保持2 min,最后以3 ℃/min的速率升温至280 ℃,保持5 min。MS条件:电离方式为电子轰击(electron impact,EI),电子能量为70 eV;离子源温度为230 ℃;四极杆温度为150 ℃;溶剂延迟7 min;全扫描检测,扫描质量范围为35~500 amu。
定性分析:利用NIST20标准谱库进行检索,以匹配度>70%的结果予以定性分析。
定量分析:以2,6-二氯甲苯(0.642 6 mg/mL)为内标采用内标半定量法按公式(1)进行半定量分析:
(1)
式中:Ci,香气物质的质量浓度,μg/mL;Cn,内标物的质量浓度,μg/mL;Ai,香气物质的峰面积;An,内标物的峰面积。
1.4.2 产香菌株鉴定
形态学鉴定:取1 mL培养后菌液,离心后弃上清液,倒入1 mL预冷后的2.5%(体积分数)戊二醛固定液,在4 ℃环境下固定4 h后,用0.2 mol/L pH 7.2的磷酸缓冲液漂洗1 h,换液3~4次。加入乙醇逐级梯度脱水,再用乙酸异戊酯置换2次,离心后弃上清液,取微量液体滴加在干净载玻片上,放入烘箱中干燥过夜,用导电胶将有生物样品的载玻片黏在样品台上,对载玻片喷金后,通过扫描电镜观察菌株细胞形态。
分子生物学鉴定:将纯化后的菌株委托上海生工生物科技公司进行26S rDNA测序,在NCBI数据库对测序结果进行序列同源性BLAST比对,初步确定菌株的分类地位,并通过MEGA11软件构建系统发育树[14-15]。
1.4.3 发酵工艺条件优化
单因素试验设计:在发酵温度30 ℃、初始pH 5.0的条件下设置发酵时间(12、24、36、48、60 h),考察不同发酵时间对发酵液中挥发性香气物质含量的影响;在确定的发酵时间、初始pH 5.0的条件下设置发酵温度(25、28、30、32、35 ℃),考察不同发酵温度对发酵液中挥发性香气物质含量的影响;在确定发酵温度和发酵时间的条件下设置初始pH(5.0、6.0、7.0、8.0和9.0),考察不同初始pH对发酵液中挥发性香气物质含量的影响。
Box-Behnken响应面试验设计[16]:在单因素试验的基础上,选择发酵时间(A)、发酵温度(B)、初始pH(C)为自变量,以发酵液中挥发性香气物质含量(Y)为响应值,进行3因素3水平响应面试验。Box-Behnken响应面试验设计因素与水平如表1所示。
表1 Box-Behnken响应面实验设计因素与水平
Table 1 Experimental design factors and levels of Box-Behnken response surface

水平因素A(发酵时间)/hB(发酵温度)/℃C(初始pH)-124286.0036307.0148328.0
1.4.4 响应面数据处理与分析
采用Microsoft Excel 2020软件对试验数据进行整理,Design-Expert 8软件对实验数据进行分析,利用Origin 2021进行绘图。
1.4.5 基因组测序、基因预测以及功能注释
基因组提取后,送至上海生工采用Illumina HiSeq和纳米孔组合测序技术进行基因组测序。采用GeneMark ES/ET 软件对真菌基因组的蛋白质编码基因进行预测,使用Diamond 软件在KEGG数据库中进行蛋白编码基因的序列比对,序列比对的临界值为E-value<10-6。碳水化合物活性酶(carbohydrate active enzymes,CAZy)基因的预测使用hmmscan 软件进行,结果选取对象为ORF序列长度>80个氨基酸时E-value<10-5、序列比对长度<80个氨基酸时E-value<10-3且氨基酸序列比对长度大于数据库当中氨基酸序列的30%的序列。在进行CAZy分析过后,通过KEGG代谢通路结合宏基因组对比NCBI已知酶基因,推测香气物质与其关键酶以及基因的关系。
2 结果与分析
2.1 产香菌株筛选结果分析
通过嗅香评价筛选出4株能产生明显香气的菌株,分别编号为XL2、XL4、YPD1-1和YPD6-1,4株产香菌株发酵液以及CK(CK为无菌水发酵的对照组)的嗅香评价雷达图如图1所示,菌株XL2发酵液的评分优于其他菌株发酵液,其花香和甜香最为突出,且花香、青香和酒香也处于最好水平。
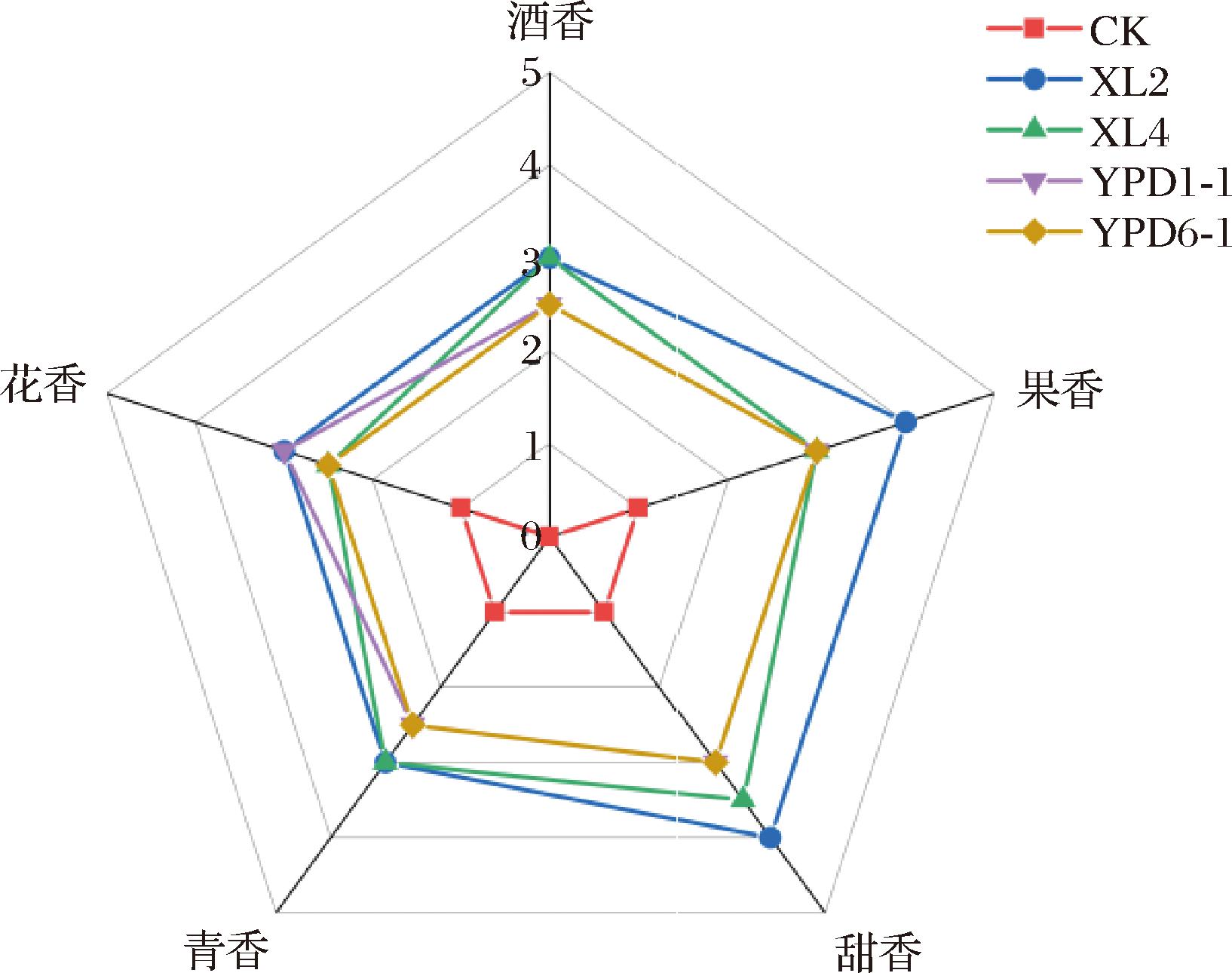
图1 产香菌株发酵液的嗅香评价雷达图
Fig.1 Radar chart for olfactory evaluation of fermentation broths of aroma-producing strains
4株产香菌株发酵液中的挥发性香气物质分析结果如表2所示,菌株XL2、XL4、YPD1-1和YPD6-1发酵液中分别检测到24、11、5、6种挥发性香气物质,这些挥发性香气物质含量分别为24.706、8.451、13.358、7.251 μg/mL。
表2 产香菌株发酵液中的挥发性香气物质GC-MS分析结果 单位:μg/mL
Table 2 GC-MS analysis results of volatile aroma compounds in fermentation broths of aroma-producing stains

类别化合物CKXL2XL4YPD1-1YPD6-1醇类 异戊醇0.083±0.0041.947±0.0461.802±0.036——丙二醇———2.051±0.1023.005±0.093(2R,3R)-(-)-2,3-丁二醇—0.581±0.0120.267±0.011——2,2-二甲基-1-戊醇—0.048±0.005———苯乙醇—0.509±0.002———4-吡咯烷-1-基苯-1,3-二醇——0.356±0.012——Z-9-十五烯醇—0.067±0.006———酯类 硫酸二丁酯—1.986±0.009———乙酸异丁酯—0.066±0.007———乙酸异戊酯—0.605±0.0060.195±0.006——乙酸苯乙酯—0.296±0.011———乙酸十八酯0.115±0.0040.462±0.0050.279±0.010——邻苯二甲酸二辛酯0.122±0.0020.48±0.008—0.252±0.013—癸酸苯乙酯——0.068±0.005——甘油三丁酸酯————1.93±0.080肉豆蔻酸异丙酯————0.351±0.008酮类 3-羟基-2-丁酮—11.418±0.1544.424±0.028——3-乙酰基-2-丁酮—0.162±0.0060.044±0.004——甲基环戊烯醇酮—0.091±0.008———2,3-二氢-3,5二羟基-6-甲基-4(H)-吡喃-4-酮—0.194±0.005—1.01±0.0670.991±0.0484-乙氧基-2-(甲基氨基)托酮0.231±0.0050.773±0.021———酸类 异丁酸—0.102±0.006———正己酸—0.064±0.004———月桂酸0.082±0.0030.446±0.0110.131±0.004——正十六烷酸0.356±0.0061.414±0.0160.368±0.019—0.885±0.013十八烷酸—0.534±0.009——醛类 5-甲基糠醛———9.892±0.139—4-乙基苯甲醛————0.089±0.005苯甲醛—0.066±0.005———其他类2,4-二叔丁基苯酚1.342±0.0082.318±0.0610.521±0.0270.153±0.007—2,3-二氢-2,2,4,6-四甲基苯并呋喃0.033±0.0050.077±0.003———总量 2.36424.7068.45113.3587.251
注:“—”表示未检测到该成分,CK为无菌水发酵的对照组;所有数据为3次重复的“平均值±标准差”。
3-羟基-2-丁酮、异戊醇是菌株XL2和XL4发酵枣渣的主要代谢产物,其中3-羟基-2-丁酮呈牛奶香气[17],可用于奶油、干酪、咖啡、果实的香味增强剂,作为配制奶油、乳品、酸奶和草莓型等的香精;异戊醇有苹果白兰地香气和辛辣味[18],是茶鲜叶、红茶、绿茶香气成分之一,主要用以配制苹果和香蕉型香精。苯乙醇是4个菌株中XL2独有的香气物质,因具有柔和、愉快而持久的玫瑰香气[19]而广泛用于各种食用香精和烟用香精中。5-甲基糠醛是菌株YPD1-1的主要代谢物质,其具有持久的焦糖和水果香味[20],可使香气丰满、柔和、清润和协调,广泛存在于食品中。
综上所述菌株XL2的挥发性香气物质含量最高,香气物质种类最丰富。最终,选择菌株XL2为枣渣的产香菌株。
2.2 产香菌株XL2形态鉴定及26SrDNA分子鉴定分析
菌株XL2的形态如图2所示。菌株XL2在YPD固体培养基上的菌落形态呈圆形,颜色为乳白色,边缘光滑,而在扫描电镜下的形态为椭圆形。
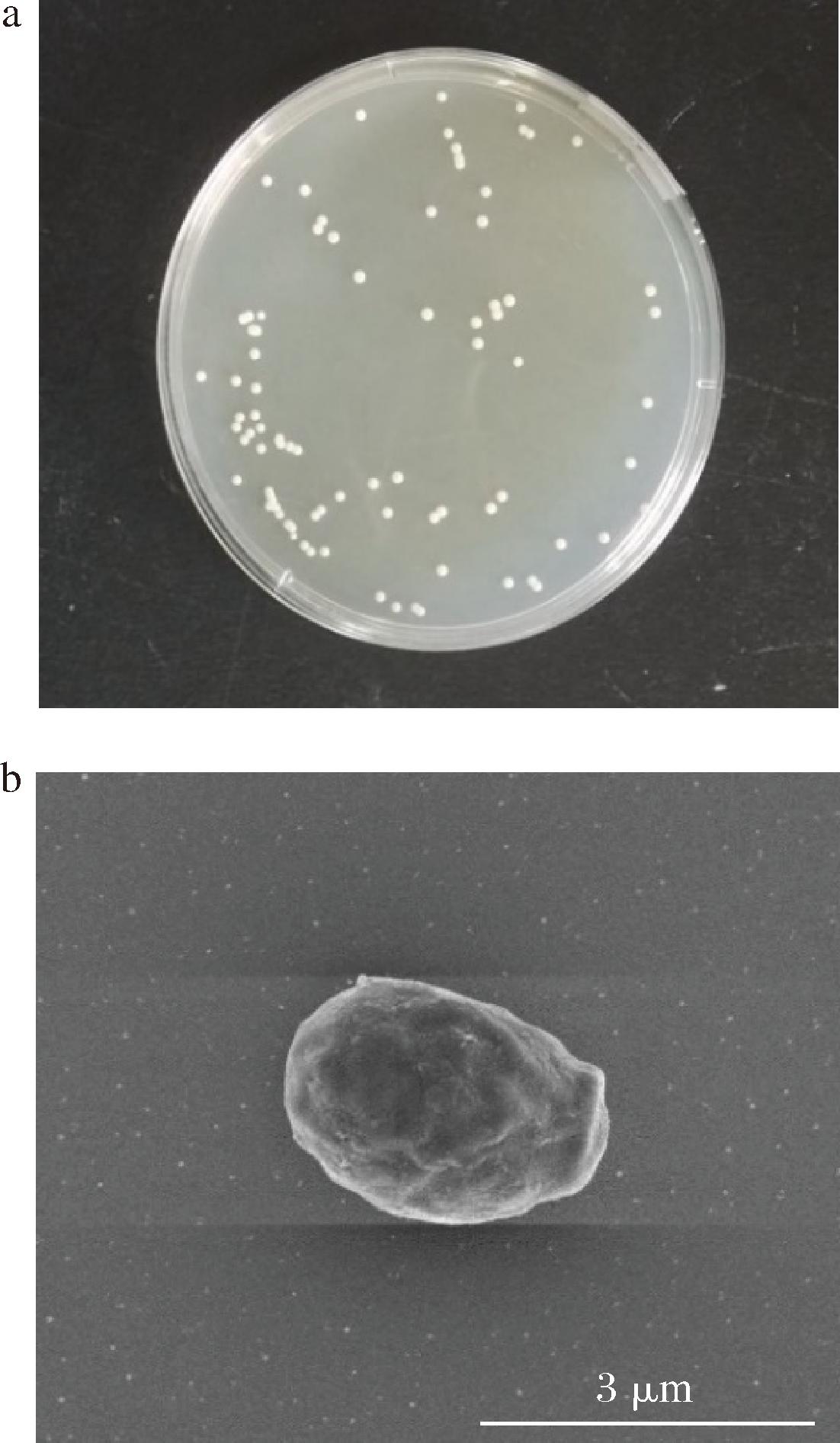
a-菌落形态;b-细胞形态
图2 菌株XL2的形态
Fig.2 Morphology of strain XL2
进一步基于26S rDNA基因序列构建的系统发育树如图3所示。XL2菌株的26S rDNA序列长度为587 bp,此序列与威克汉姆酵母28S rDNA序列的相似性高达99%,显示菌株XL2与威克汉姆酵母的亲缘关系最近,且在一个分支上。结合形态学特征,初步鉴定菌株XL2为威克汉姆酵母菌。

图3 基于26S rDNA基因序列构建的系统发育树
Fig.3 Phylogenetic tree based on 26S rDNA gene sequences
2.3 利用Box-Behnken响应面法优化发酵液中香气物质含量
2.3.1 单因素试验分析
实验分别选取不同发酵时间、温度以及初始pH,研究其对发酵液中挥发性香气物质含量的影响。结果如图4所示,当发酵时间为12~60 h时,发酵液中挥发性香气物质含量呈先增高后降低的趋势,当发酵时间达到36 h时,挥发性香气物质含量最高,为25.037 μg/mL;温度为30 ℃时,挥发性香气物质含量最高,为34.654 μg/mL;发酵初始最佳pH值为7.0,其挥发性香气物质含量最高,为41.71 μg/mL。最终实验选择发酵时间为24、36、48 h,发酵温度为28、30、32 ℃以及发酵初始pH值为6.0、7.0、8.0进行后续Box-Behnken响应面试验。
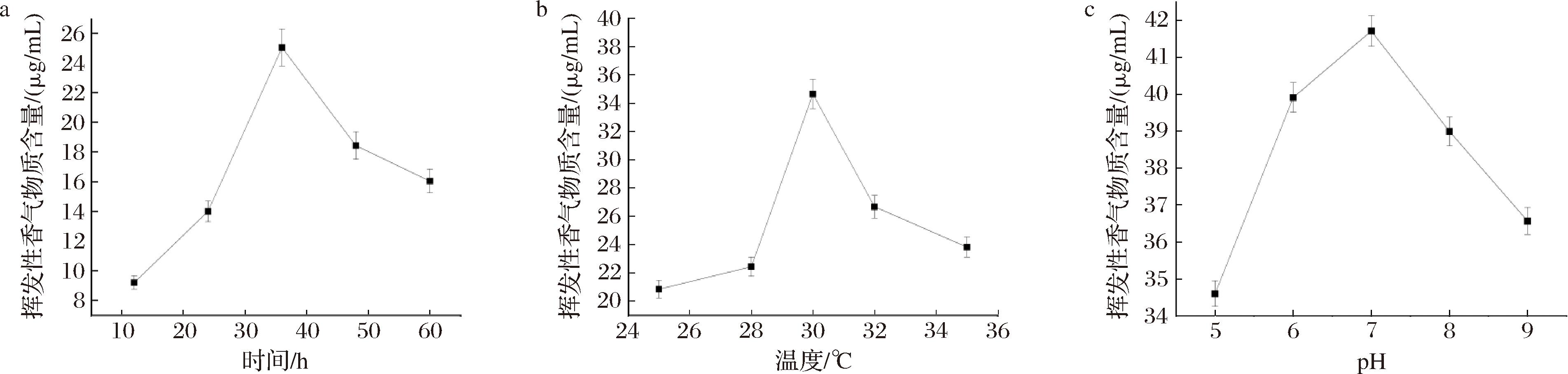
a-时间;b-温度;c-pH
图4 各单因素对发酵液中挥发性香气物质含量的影响
Fig.4 Effect of single factors on the contents of volatile aroma substances in fermentation broths
2.3.2 Box-Behnken响应面试验结果分析
产香菌株XL2发酵工艺Box-Behnken响应面试验设计及结果如表3所示。对表3结果进行拟合,得到发酵温度(A)、发酵时间(B)、初始pH(C)与挥发性香气物质含量(Y)的二次多项回归方程:Y=40.56+2.62A+7.57B-3.95C+6.32AB+1.24AC+6.85BC-7.84A2-13.72B2-6.05C2。回归方程的方差分析结果如表4所示,回归模型的F值为245,且P值<0.000 1,失拟项的P值>0.05,表明该模型拟合程度较好。回归系数R2=0.996 8,校正系数Radj2=0.992 8,表明该模型准确可靠,可用于预测各因素对挥发性香气物质含量的影响。由P值可知,A、B、C、AB、BC、A2、B2和C2对挥发性香气物质含量的影响极显著(P<0.01),AC对挥发性香气物质含量的影响显著(P<0.05)。根据F值,各因素对挥发性香气物质含量的影响顺序为:发酵温度(B)>初始pH(C)>发酵时间(A)。
表3 产香菌株XL2发酵工艺Box-Behnken响应面试验设计及结果
Table 3 Box-Behnken response surface test design and results of fermentation process of aroma-producing strain XL2
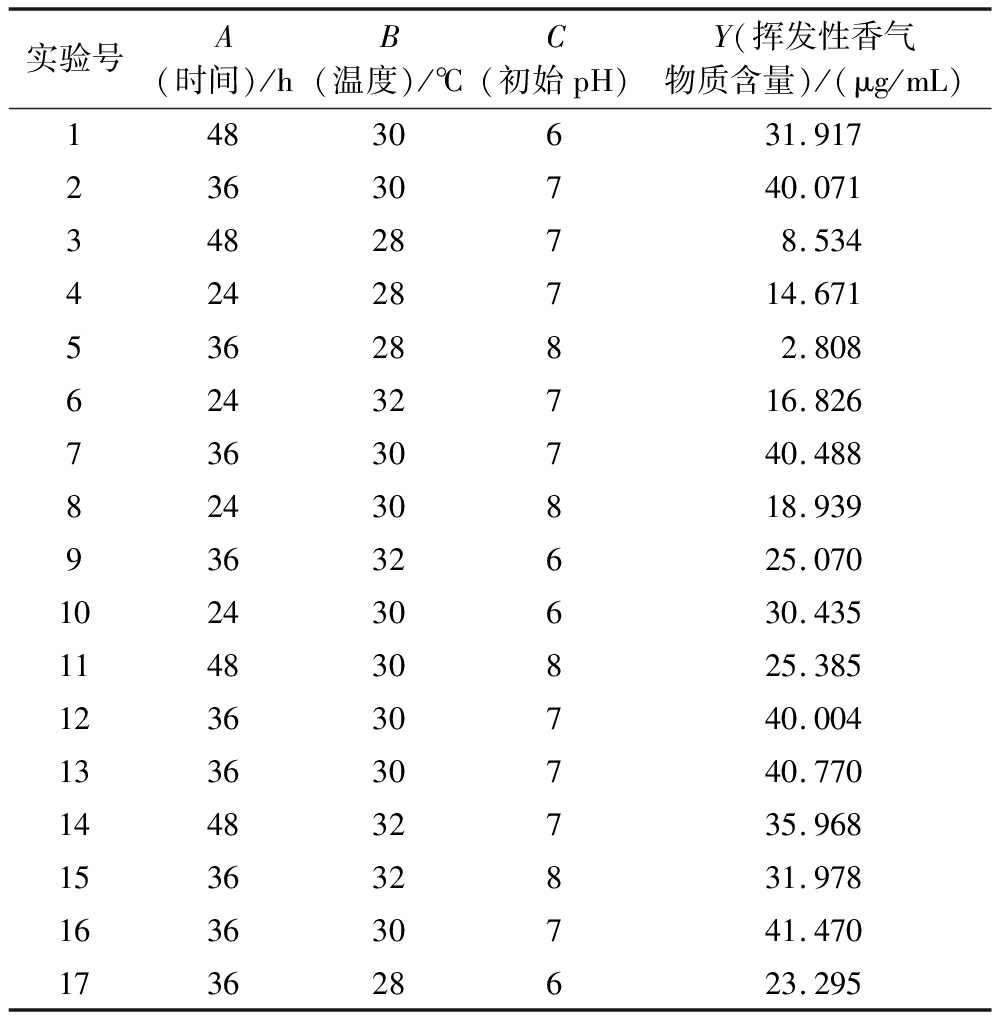
实验号A(时间)/hB(温度)/℃C(初始pH)Y(挥发性香气物质含量)/(μg/mL)14830631.91723630740.0713482878.53442428714.6715362882.80862432716.82673630740.48882430818.93993632625.070102430630.435114830825.385123630740.004133630740.770144832735.968153632831.978163630741.470173628623.295
表4 回归方程的方差分析结果
Table 4 The ANOVA results of the regression model
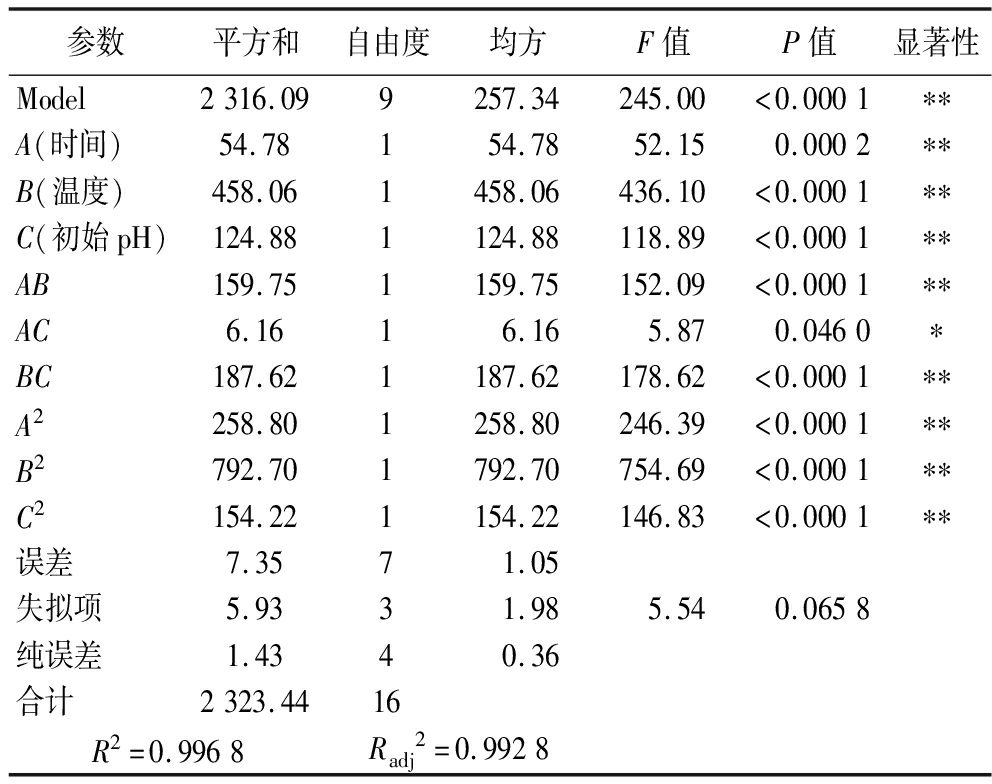
参数平方和自由度均方F值P值显著性Model2316.099257.34245.00<0.0001∗∗A(时间)54.78154.7852.150.0002∗∗B(温度)458.061458.06436.10<0.0001∗∗C(初始pH)124.881124.88118.89<0.0001∗∗AB159.751159.75152.09<0.0001∗∗AC6.1616.165.870.0460∗BC187.621187.62178.62<0.0001∗∗A2258.801258.80246.39<0.0001∗∗B2792.701792.70754.69<0.0001∗∗C2154.221154.22146.83<0.0001∗∗误差7.3571.05失拟项5.9331.985.540.0658纯误差1.4340.36合计2323.4416R2=0.9968Radj2=0.9928
注:*表示影响显著(P<0.05),**表示影响极显著(P<0.01)。
进一步通过响应面图集等高线判断发酵时间、发酵温度及初始pH值之间的交互作用。由图5可知,发酵时间与发酵温度之间的交互作用及发酵温度与初始pH之间的交互作用的响应面曲面相对陡峭,表明发酵时间与发酵温度之间的交互作用及发酵温度与初始pH之间的交互作用因素变化对响应值影响显著(P<0.01)。
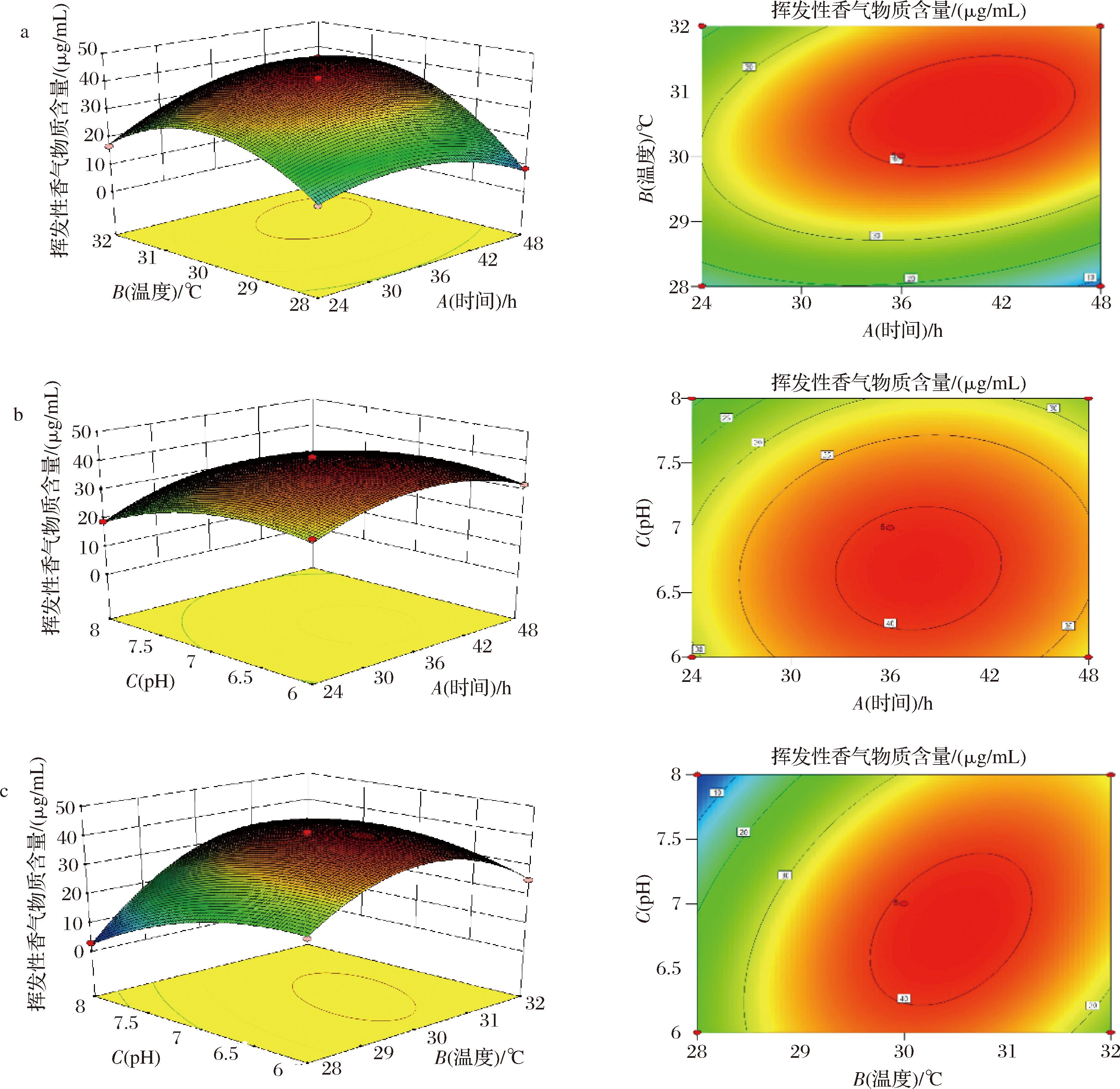
a-发酵时间与发酵温度的交互作用;b-发酵时间与初始pH的交互作用;c-初始pH与发酵温度的交互作用
图5 各因素交互作用的相应曲面图集等高线图
Fig.5 Contour map of corresponding surface atlas for interaction of various factors
通过回归模型对响应值进行优化预测得到最佳发酵工艺为:发酵时间40.51 h、发酵温度30.35 ℃、初始pH 6.85。在此工艺下,预测挥发性香气物质总量为41.966 μg/mL。为了方便实际操作,将最佳发酵工艺修正为:发酵时间40 h、发酵温度30 ℃、初始pH 6.9。在此工艺下,进行3次重复实验,挥发性香气含量为41.8 μg/mL,与软件预测值基本接近,表明响应面模型的建立稳定且优化方案可行。
2.4 菌株XL2全基因组测序结果分析
2.4.1 基因组基本信息
异常威克汉姆酵母XL2的基因组基因序列长度是21 586 650 bp,N50为12 888 bp,N90为2 906 bp。GC含量是34.52%, 预测基因数为7 072个。其中CAZy 162个(表5)。
表5 异常威克汉姆酵母XL2基因组基本信息
Table 5 Basic genome information of W.anomalus XL2
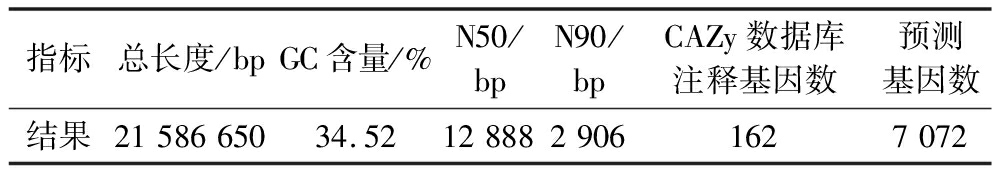
指标总长度/bpGC含量/%N50/bpN90/bpCAZy数据库注释基因数预测基因数结果2158665034.521288829061627072
2.4.2 蛋白编码基因的KEGG注释
通过KEGG数据库对比获得分子网络的相关信息进行跨物种注释,发现XL2基因编码蛋白主要有遗传信息处理、新陈代谢、信号传导和细胞过程4种代谢功能,其注释结果如图6所示。其中,共注释到蛋白编码基因3 332个,在一级分类中注释到的与微生物新陈代谢有关的基因最多共1 568个,其次为遗传信息处理1 034个、细胞过程512个、环境信号处理183个以及生物体系统35个。
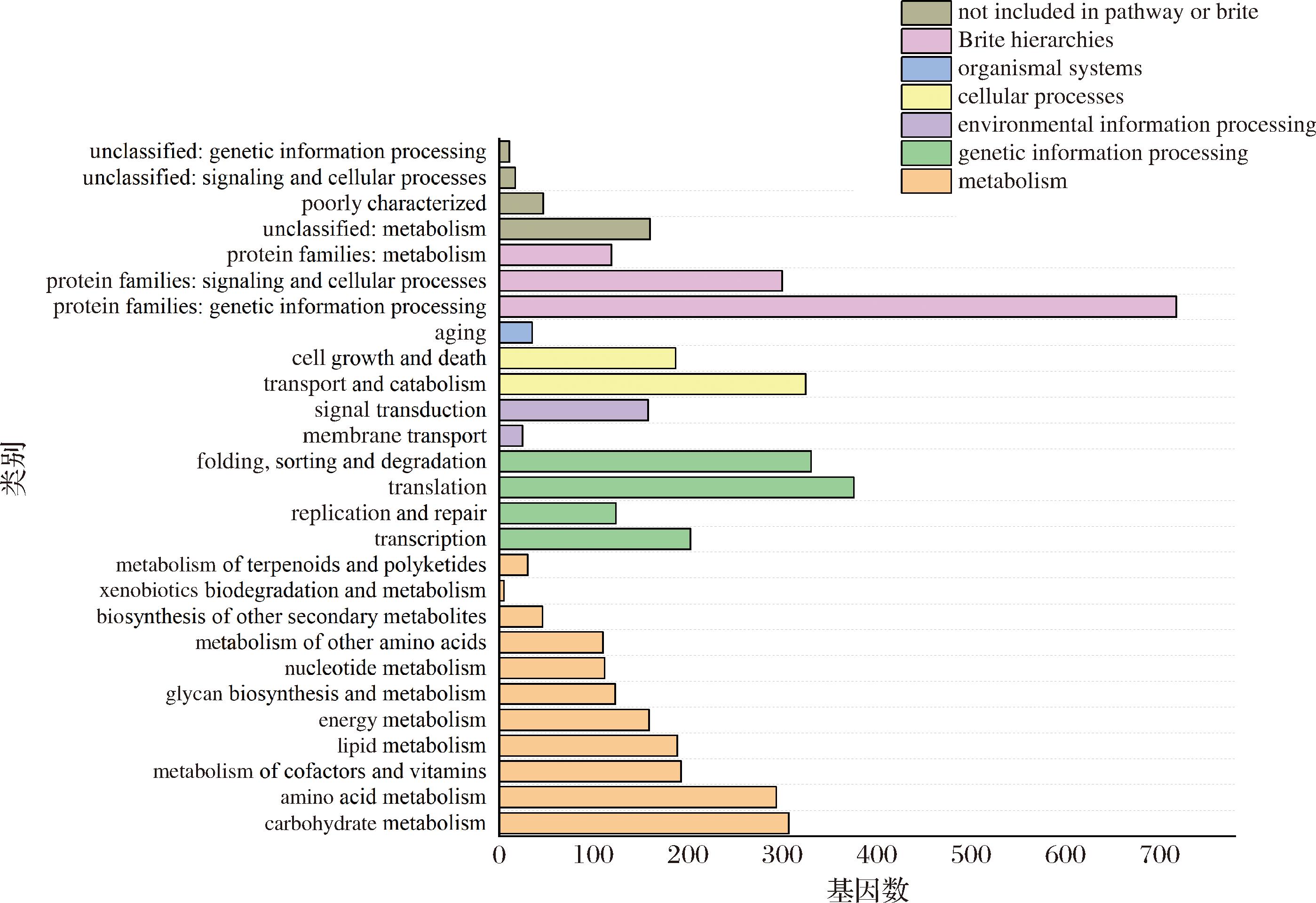
图6 蛋白编码基因的KEGG注释图
Fig.6 KEGG annotation diagram of protein coding genes
注:not included in pathway or brite(未归类):unclassified:genetic information processing(未分类:遗传信息处理);unclassified:signaling and cellular processes(未分类:信号传导与细胞过程);poorly characterized(特征描述不清);unclassified:metabolism(未分类:代谢);Brite hierarchies(Brite 层级体系):protein families:metabolism(蛋白质家族:代谢);protein families:signaling and cellular processes(蛋白质家族:信号传导与细胞过程);protein families:genetic information processing(蛋白质家族:遗传信息处理);organismal systems(有机体系统):aging(衰老相关通路); cellular processes(细胞过程):cell growth and death(细胞生长与死亡);transport and catabolism(运输与分解代谢); environmental information processing(环境信息处理):signal transduction(信号转导);membrane transport(膜运输);genetic information processing(遗传信息处理):folding; sorting and degradation(折叠、分选与降解);translation(翻译);replication and repair(复制与修复);transcription(转录);metabolism(代谢):metabolism of terpenoids and polyketides(萜类化合物和聚酮化合物代谢);xenobiotics biodegradation and metabolism(外源生物降解与代谢 ); biosynthesis of other secondary metabolites(其他次生代谢物生物合成);metabolism of other amino acids(其他氨基酸代谢);nucleotide metabolism(核苷酸代谢);glycan biosynthesis and metabolism(聚糖生物合成与代谢);energy metabolism(能量代谢);lipid metabolism(脂质代谢);metabolism of cofactors and vitamins(辅因子与维生素代谢);amino acid metabolism(氨基酸代谢);carbohydrate metabolism(碳水化合物代谢)。
在二级分类中,与碳水化合物代谢相关基因共307个,其次为与氨基酸代谢294个、辅助因子和维生素代谢193个、脂质代谢189个、能量代谢159个、聚糖生物合成和代谢123个、核苷酸代谢112个、其他次生代谢物的生物合成46个以及酮类代谢30个。
2.4.3 CAZy分析
采用hmmscan软件预测在XL2基因组序列中存在的CAZy酶类基因,绘制其CAZy功能分类图,结果如图7所示。该菌株的CAZy酶类相关基因共有162个,其中糖基转移酶(glycosyl transferases, GT)相关编码蛋白基因含量最多,为76个;其次为糖苷水解酶(glycoside hydrolases,GH)相关编码蛋白基因66个、糖基聚集模块(carbohydr-atebinding modules,CBM)相关基因12个、辅助功能的酶(auxiliary activities,AA)相关基因9个、糖脂酶(carbohydrate esterases,CE)相关基因2个以及多糖裂合酶(polysaccharide lyases,PL)相关基因2个。由于CAZy对碳水化合物的降解作用,淀粉、蔗糖等物质可被CAZy酶类降解,从而进一步被微生物代谢为香味化合物分泌到发酵液中。
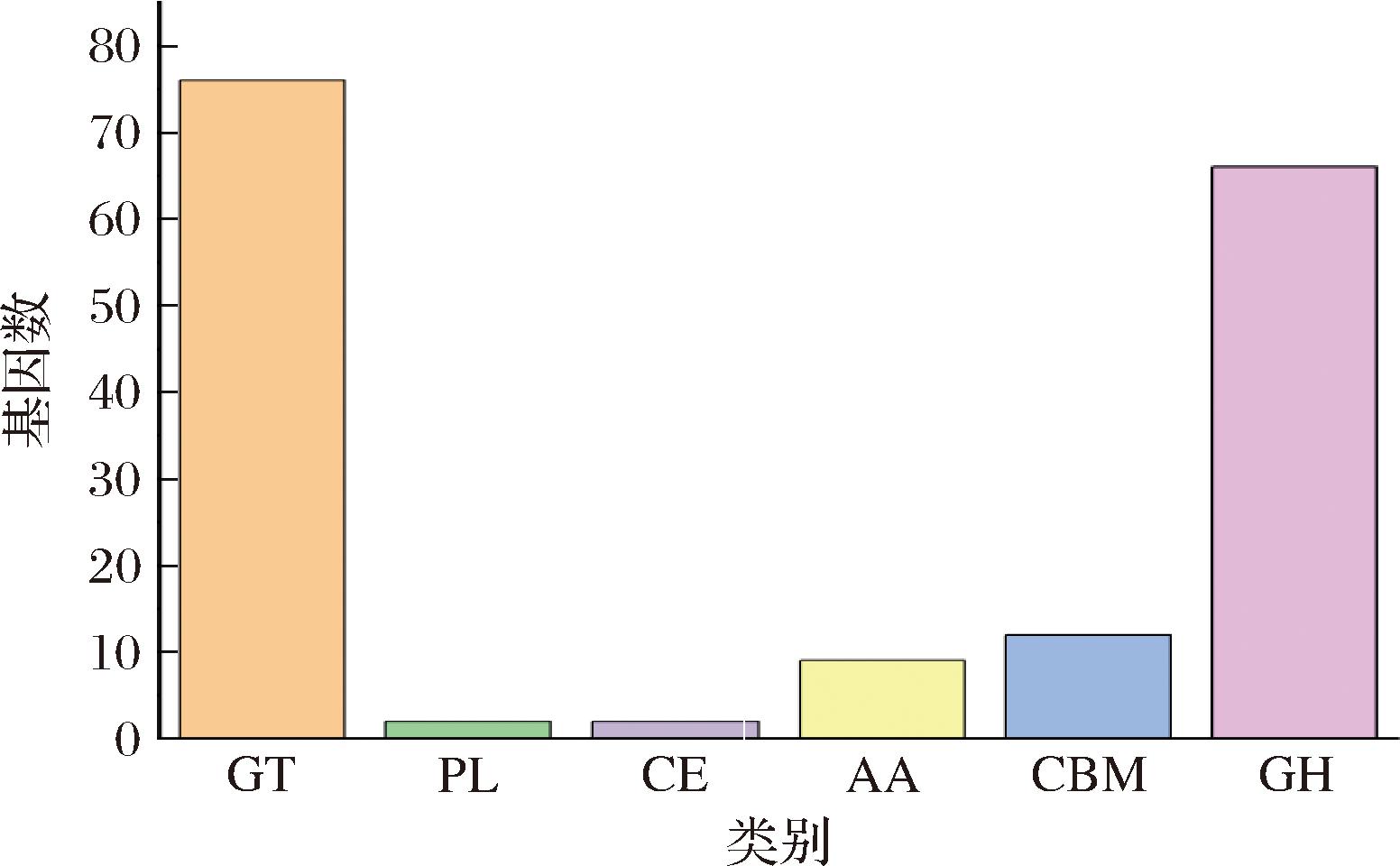
图7 CAZy 功能分类图
Fig.7 CAZy functional classification diagram
进一步对菌株XL2的CAZy 酶类进行基因簇分析,注释结果如表6所示。通过注释发现XL2菌株的CAZy酶类主要包括葡聚糖1,3-β-葡萄糖苷酶(GH5_9家族)、β-葡萄糖苷酶(GH3、GH5_12家族)、α-葡萄糖苷酶(GH31_1家族)、1,3-β-葡聚糖合酶(GT48家族)、葡聚糖内切-1,3-β-D-葡萄糖苷酶(GH81、GH17以及GH16_18家族)以及葡萄糖淀粉酶(EC 3.2.1.3 GH15家族)。在上述酶一系列的作用下,淀粉、蔗糖等碳水化合物的糖苷键断裂生成单分子葡萄糖,进入酵母细胞经糖酵解产生丙酮酸等香气前体物质。上述酶中,α-葡萄糖苷酶和β-葡萄糖苷酶能够直接水解糖苷键释放出葡萄糖,其中β-葡萄糖苷酶还能水解糖苷结合态香气物质释放游离态香气物质[21-23]。此2种酶对香气物质的产生发挥重大作用。
表6 CAZy基因簇注释结果
Table 6 CAZy gene cluster annotation results
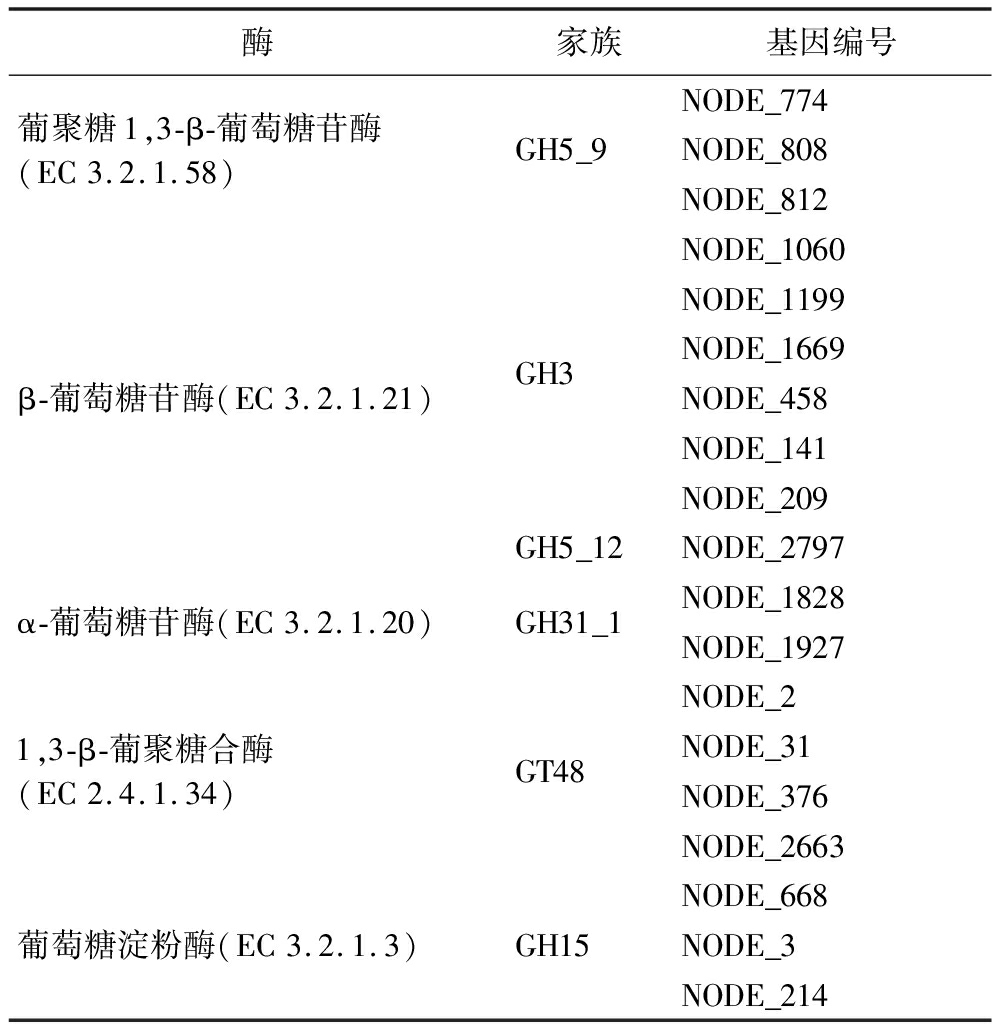
酶家族基因编号葡聚糖1,3-β-葡萄糖苷酶(EC3.2.1.58)GH5_9NODE_774NODE_808NODE_812β-葡萄糖苷酶(EC3.2.1.21)GH3NODE_1060NODE_1199NODE_1669NODE_458NODE_141NODE_209GH5_12NODE_2797α-葡萄糖苷酶(EC3.2.1.20)GH31_1NODE_1828NODE_19271,3-β-葡聚糖合酶(EC2.4.1.34)GT48NODE_2NODE_31NODE_376NODE_2663葡萄糖淀粉酶(EC3.2.1.3)GH15NODE_668NODE_3NODE_214
2.4.4 菌株XL2发酵枣渣产香关键酶推测
通过KEGG代谢通路结合相关文献可推测出香气物质的代谢途径以及关键酶,主要香气物质代谢途径如下。丙酮酸经乙酰乳酸合酶作用生成乙酰乳酸,乙酰乳酸自发生成二乙酮,再经二乙酰还原酶作用而生成3-羟基-2-丁酮[24];糖酵解途径的磷酸烯醇式丙酮酸和磷酸戊糖途径的4-磷酸赤藓糖经4步酶促反应生成莽草酸,莽草酸进一步经5步酶促反应生成苯丙酮酸,然后在苯丙酮酸脱羧酶催化下生成苯乙醛,最后在醇脱氢酶作用下脱氢生成苯乙醇[25];糖酵解终产物 α-酮酸,经酮酸脱羧酶脱羧、醇脱氢酶脱氢还原成活性戊醇、异丁醇、异戊醇等高级醇[26];醇和乙酰辅酶A通过醇乙酰转移酶(Atf1p)催化生成乙酸盐酯,如乙酸异戊酯(香蕉般的香气)和乙酸异丁酯(果香)等。其中醇乙酰转移酶是乙酸盐合成的关键酶[27];2,3-二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮(2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one,DDMP)是美拉德反应极其重要的中间体之一。麦芽酚通过酯化保护、氢化还原、乙酰氧化、酶水解和碱水解5步反应合成了DDMP,其中脂肪酶是该过程中的关键酶[28]。
在此基础上,利用XL2基因组对比NCBI已知关键酶基因,从而推测香气物质与其关键酶以及基因的关系。结果如表7所示。
表7 主要香气物质产香关键酶以及基因
Table 7 Key aroma-producing enzymes and genes of main aroma substances
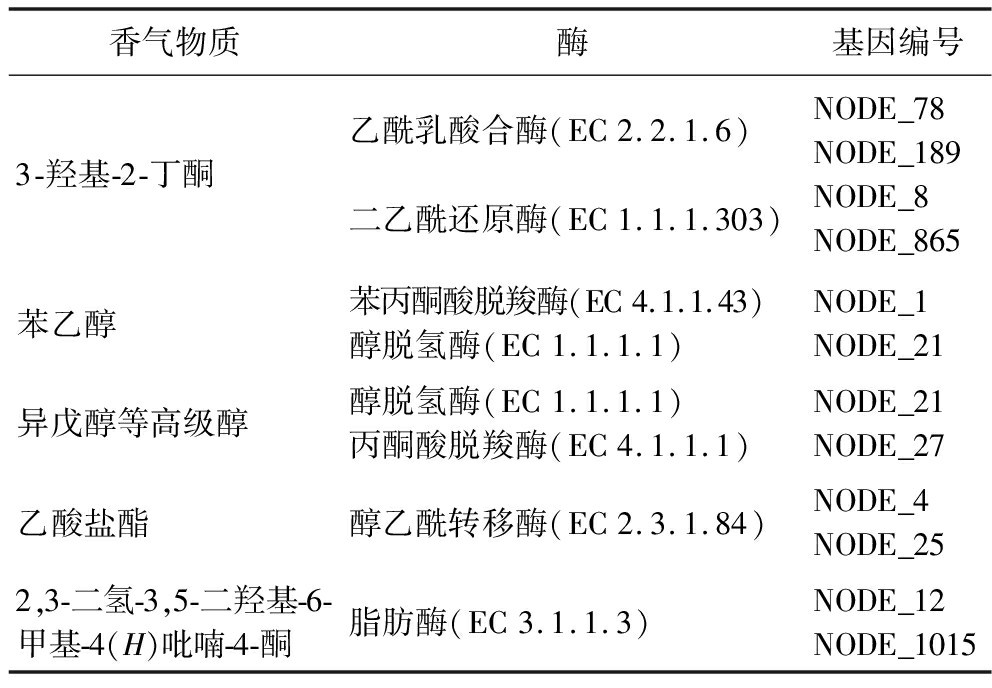
香气物质酶基因编号3-羟基-2-丁酮乙酰乳酸合酶(EC2.2.1.6)二乙酰还原酶(EC1.1.1.303)NODE_78NODE_189NODE_8NODE_865苯乙醇苯丙酮酸脱羧酶(EC4.1.1.43)醇脱氢酶(EC1.1.1.1)NODE_1NODE_21异戊醇等高级醇醇脱氢酶(EC1.1.1.1)丙酮酸脱羧酶(EC4.1.1.1)NODE_21NODE_27乙酸盐酯醇乙酰转移酶(EC2.3.1.84)NODE_4NODE_252,3-二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮脂肪酶(EC3.1.1.3)NODE_12NODE_1015
3 结论
本文以嗅香评价和挥发性香气物质含量为指标,从枣林土壤中分离筛选出1株具有明显产香能力的菌株XL2,经形态学和分子生物学鉴定为异常威克汉姆酵母菌(Wickerhamomyces anomalus)。经全基因组测序,异常威克汉姆酵母XL2的基因组基因序列长度是21 586 650 bp,N50为12 888 bp,N90为2 906 bp。GC含量是34.52%,预测基因数为7 072。KEGG 数据库共注释到3 332个蛋白编码基因,其中与代谢相关的基因占全部基因的比例最高,而在代谢相关基因中,碳水化合物和氨基酸的代谢相关基因最多;将基因组序列与CAZy数据库进行比对,发现菌株XL2的基因组中共有162个基因编码的蛋白质属于CAZy家族,推测与香味成分相关的酶有β-葡萄糖酶7个、α-葡萄糖水解酶2个、关键香味成分相关酶12个。
枣渣经该菌株发酵后,主要产生异戊醇、苯乙醇等醇类和3-羟基-2-丁酮等酮类物质,呈现丰富的甜香、果香和花香。通过单因素试验和Box-Behnken响应面试验得到的最佳发酵工艺为:发酵时间40 h、发酵温度30 ℃、初始pH 6.9,在此工艺下,挥发性香气物质含量为41.8 μg/mL,是优化前的1.6倍。本研究可为水果副产物发酵香料的开发提供借鉴,促进水果副产物多样化利用的研发。
[1] 张江宁, 柳青, 丁卫英, 等.不同干燥方法下红枣蜜饯水分状态变化研究[J].保鲜与加工, 2021, 21(10):64-68.ZHANG J N, LIU Q, DING W Y, et al.Study on changes of moisture state of preserved jujube fruit by different drying methods[J].Storage and Process, 2021, 21(10):64-68.
[2] 钟佳敏, 张汉禹, 郝海, 等.不同发酵方式对骏枣果脯品质的影响[J].食品研究与开发, 2023, 44(16):48-52.ZHONG J M, ZHANG H Y, HAO H, et al.Effects of different fermentation methods on the quality of preserved fruits of Ziziphus jujube ‘Junzao’[J].Food Research and Development, 2023, 44(16):48-52.
[3] 贾宇尧, 石然启, 高京草, 等.不同品种红枣香气分析与评价[J].食品研究与开发, 2023, 44(18):165-171.JIA Y Y, SHI R Q, GAO J C, et al.Aromas and quality of different jujube cultivars[J].Food Research and Development, 2023, 44(18):165-171.
[4] 李传霞.发酵苹果渣饮料的制备及功能特性研究[D].上海:上海应用技术大学, 2021.LI C X.Preparation and functional characteristics of fermented apple pomace beverage[D].Shanghai:Shanghai Institute of Technology, 2021.
[5] 张晟, 马雪, 李杨, 等.五味子果渣低醇饮料发酵工艺优化[J].食品工业, 2020, 41(6):175-179.ZHANG S, MA X, LI Y, et al.Optimization of fermentation conditions for Schisandra chinensis pomace low-alcohol beverage[J].The Food Industry, 2020, 41(6):175-179.
[6] 张丽萍, 刘瑞玲, 孟祥红, 等.益生菌发酵猕猴桃果渣饮料及其营养品质与风味分析[J].食品工业科技, 2022, 43(20):252-262. ZHANG L P, LIU R L, MENG X H, et al.Probiotic fermented beverage based on kiwifruit residue and analysis of its nutritional quality and flavor[J].Science and Technology of Food Industry, 2022, 43(20):252-262.
[7] 孙强.利用酵母菌发酵甜玉米制备新型烟用香精香料[D].南宁:广西大学, 2020.SUN Q.Preparation of new tobacco flavors and spices by fermenting sweet corn with yeast[D].Nanning:Guangxi University, 2020.
[8] LINDSAY M A, GRANUCCI N, GREENWOOD D R, et al.Fermentative production of volatile metabolites using Brettanomyces bruxellensis from fruit and vegetable by-products[J].Fermentation, 2022, 8(9):457.
[9] 贾祥堑.枣果色素物质及主要功能性成分分析[D].太原:山西农业大学, 2022.JIA X Y.Analysis of jujube pigment substances and main functional components[D].Taiyuan:Shanxi Agricultural University, 2022.
[10] 刘莹, 焦梦悦, 王丽霞, 等.响应面法优化乳酸菌发酵胡萝卜原浆工艺及香气成分变化分析[J].食品工业科技, 2017, 38(15):85-92;116.LIU Y, JIAO M Y, WANG L X, et al.Optimization of lactic acid bacteria fermentation carrot protoplasmic technology using the response surface method and the analysis of main volatile components[J].Science and Technology of Food Industry, 2017, 38(15):85-92;116.
[11] YUAN H Y, SUN Q, WANG L S, et al.Optimization of high-density fermentation conditions for Saccharomycopsis fibuligera Y1402 through response surface analysis[J].Foods, 2024, 13(10):1546.
[12] 马宁原, 姚凌云, 孙敏, 等.基于GC-IMS和GC-MS分析不同发酵方式对黄桃酒香气成分的影响[J].食品科学, 2023, 44(12):306-314.MA N Y, YAO L Y, SUN M, et al.Effect of different fermentation methods on aroma composition of yellow peach wine analyzed by gas chromatography-mass spectrometry and gas chromatography-ion mobility spectrometry[J].Food Science, 2023, 44(12):306-314.
[13] 郭林青, 朴永革, 朱春阳, 等.烟草产香酵母YG-4的筛选鉴定及香气成分分析[J].轻工学报, 2019, 34(5):27-31.GUO L Q, PIAO Y G, ZHU C Y, et al.Screening and identification of aroma-producing yeast YG-4 and analysis of its aroma components[J].Journal of Light Industry, 2019, 34(5):27-31.
[14] 王琪, 蔡建, 高秀, 等.黄泡野生酵母菌的筛选鉴定及其发酵性能研究[J].中国酿造, 2024, 43(6):182-188.WANG Q, CAI J, GAO X, et al.Screening,identification and fermentation performance of wild yeasts from Rubus pectinellus Maxim[J].China Brewing, 2024, 43(6):182-188.
[15] 闫洪洋, 黄启蒙, 蔡兴华, 等.产香菌株的分离鉴定及其发酵产物在卷烟加香中的应用[J].轻工学报, 2021, 36(6):47-54.YAN H Y, HUANG Q M, CAI X H, et al.Isolation and identification of aroma-producing strains and application of fermentation products in cigarette flavoring[J].Journal of Light Industry, 2021, 36(6):47-54.
[16] 李明瑕, 刘春凤, 王壬, 等.黄桃果酒发酵工艺优化及香气成分分析[J].食品与生物技术学报, 2021, 40(10):39-49.LI M X, LIU C F, WANG R, et al.Optimization of fermentation process and analysis of aroma components of yellow peach wine[J].Journal of Food Science and Biotechnology, 2021, 40(10):39-49.
[17] ZHENG S S, WANG C Y, HU Y Y, et al.Enhancement of fermented sausage quality driven by mixed starter cultures:Elucidating the perspective of flavor profile and microbial communities[J].Food Research International, 2024, 178:113951.
[18] 万兵, 孙浩, 王慧琳, 等.白酒酿造过程中产高级醇微生物及调控技术研究进展[J].酿酒, 2024, 51(4):25-30.WAN B, SUN H, WANG H L, et al.Research progress on microorganisms and regulation techniques of higher alcohols produced in Baijiu brewing[J].Liquor Making, 2024, 51(4):25-30.
[19] HU L J, CHEN X D, CAO Y L, et al.Lactiplantibacillus plantarum exerts strain-specific effects on malolactic fermentation, antioxidant activity, and aroma profile of apple cider[J].Food Chemistry:X, 2024, 23:101575.
[20] 刘真, 朱丽霞.5-羟甲基糠醛、糠醛、乙酰呋喃、呋喃酮、5-甲基糠醛的高效液相检测方法[J].食品研究与开发, 2019, 40(18):166-170.LIU Z, ZHU L X.High performance liquid phase method for determination of pentahydroxymethylfurfural, furfural, acetylfuran, furanone and pentamethylfurfural[J].Food Research and Development, 2019, 40(18):166-170.
[21] 李林波, 张士双, 杨天佑, 等.α-葡萄糖苷酶的异源表达及应用研究进展[J].食品与发酵工业, 2023, 49(2):325-332.LI L B, ZHANG S S, YANG T Y, et al.Advances in heterologous expression and application of α-glucosidase[J].Food and Fermentation Industries, 2023, 49(2):325-332.
[22] 何芒芒.柑橘中糖苷香气前体物质及β-葡萄糖苷酶活性变化相关性研究[D].武汉:华中农业大学, 2013.HE M M.Study on the changes of glycosidic aroma precursors and β-glucosidase activitiy in citrus and their correlations[D].Wuhan:Huazhong Agricultural University,2013.
[23] 缪月梅.产β-葡萄糖苷酶非酿酒酵母分离鉴定及对发酵芒果汁香气影响[D].海口:海南大学, 2023.MIAO Y M.Isolation and identification of β-glucosidases-producing non-Saccharomyces yeast strains and its influence on the aroma of fermented mango juice[D].Haikou:Hainan University, 2023.
[24] 林源.酿酒酵母乙偶姻、高级醇的协同代谢调控研究[D].济南:齐鲁工业大学, 2024.LIN Y.Synergistic metabolic regulation of acetoin and higher alcohols in Saccharomyces cerevisiae[D].Jinan:Qilu University of Technology, 2024.
[25] 陈先锐, 王肇悦, 何秀萍.酵母菌合成2-苯乙醇的研究进展[J].生物工程学报, 2016, 32(9):1151-1163.CHEN X R, WANG Z Y, HE X P.Advances in biosynthesis of 2-phenylethanol by yeasts[J].Chinese Journal of Biotechnology, 2016, 32(9):1151-1163.
[26] 孙中贯, 刘琳, 王亚平, 等.酿酒酵母高级醇代谢研究进展[J].生物工程学报, 2021, 37(2):429-447.SUN Z G, LIU L, WANG Y P, et al.Higher alcohols metabolism by Saccharomyces cerevisiae:A mini review[J].Chinese Journal of Biotechnology, 2021, 37(2):429-447.
[27] LI W, WANG J H, ZHANG C Y, et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].Journal of Industrial Microbiology &Biotechnology, 2017, 44(6):949-960.
[28] 白冰, 何静, 杨静, 等.美拉德反应中间体2,3-二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮的研究进展[J].食品与发酵工业, 2024, 50(5):326-333.BAI B, HE J, YANG J, et al.Advances in the research of Maillard intermediate 2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one[J].Food and Fermentation Industries, 2024, 50(5):326-333.