虾青素(3,3′-二羟基-β,β-胡萝卜素-4,4′-二酮)是一种橙红色的亲脂性酮类胡萝卜素[1],是一种强效抗氧化剂和营养补充剂,同时也具有良好的治疗潜力。研究表明,虾青素在对抗多种疾病和失调方面表现出显著效果,包括抗氧化、抗癌、抗衰老、抗炎和增强免疫功能,以及预防心血管疾病和动脉粥样硬化等[2-3]。因此,虾青素在多个行业中展现出良好的应用前景。红法夫酵母因具有生命周期短,合成虾青素速率较快,可以利用各种糖类作为碳源以及可以进行高密度发酵等特征,已成为目前工业化生产虾青素的优质菌株[4]。
为满足工业对天然虾青素日益增长的需求,研究者们正积极开发经济有效的生产工艺以促进红法夫酵母的虾青素合成,包括筛选高产虾青素的菌株、优化培养基和发酵条件、筛选胁迫条件,以及基于虾青素合成途径进行基因改造[5]。由于其成本低、生产稳定且操作简便,胁迫条件已成为促使红法夫酵母积累虾青素的首选方法[6]。ZHANG等[7]的研究发现,在培养基中添加500 mg/L二氧化钛可以诱导红法夫酵母细胞产生氧化应激反应,从而显著提升其虾青素产量,达到14.74 mg/L。利用脂肪底物作为碳源培养酵母可将低级脂肪底物生物转化为更高价值的胞内脂类副产品[8]。KIKUKAWA等[2]研究发现,向培养基中添加0.01%(质量分数)的白芒花籽油,可以显著促进红法夫酵母的生长速度,总脂肪酸产量增加2.7倍,虾青素产量增加1.4倍。LI等[9]的研究表明,向培养基中添加10 mL/L的大豆油,可以显著提高红法夫酵母的虾青素产量,达到7.35 mg/L,较对照组增加1.4倍,番茄红素和β-胡萝卜素含量也显著增加。同时有研究表明,微生物可以将有机碳源甘油作为共生生长的底物[10]。ZHANG等[10]的研究表明,甘油可通过促进底物丙酮酸的形成和脂肪酸的生物合成,间接促进虾青素的合成。若将甘油用作发酵底物合成具有附加值的代谢化合物,可为其增值提供可行方案。粗甘油是生物柴油生产中的主要“废物”,在微生物发酵的作用下可转化为用于食品和生物燃料生产的次级代谢物[11]。
本研究探讨了外源甘油与二氧化钛的联合胁迫对红法夫酵母PR106的生物量和积累虾青素的影响。采用LC-MS/MS技术,对甘油与二氧化钛胁迫条件下PR106细胞内的类胡萝卜素进行了定量分析。此外,通过流式细胞术检测甘油与二氧化钛对PR106的细胞凋亡、活性氧(reactive oxygen species,ROS)生成的影响。并且测定了相关抗氧化酶活力。本研究为红法夫酵母虾青素的工业化生产奠定了理论基础,并具有重要的实践价值。
1 材料与方法
1.1 材料与试剂
红法夫酵母PR106从吉林省食品生物制造科技创新中心获取。
酵母浸粉、麦芽浸粉、蛋白胨、葡萄糖、琼脂粉、甘油、3,5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、苯酚、亚硫酸钠,国药集团化学试剂有限公司;二氧化钛,西陇科学股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒,南京建成有限公司;活性氧探针(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)、碘化丙啶(propidium iodide,PI),索莱宝试剂有限公司。
YEPD培养基(g/L):酵母浸粉2,麦芽浸粉3,蛋白胨5,葡萄糖10;YPD培养基:在YEPD培养基的基础上补充琼脂粉20 g/L。
1.2 仪器与设备
QTRAP6500+液相色谱质谱(LC-MS)联用仪,美国SCIEX公司;C30色谱柱,日本YMC公司;MM400球磨仪,德国Retsch公司;Attune NxT流式细胞仪,塞默飞世尔科技公司;Biosafer650-92超声波破碎仪,南京赛飞生物科技有限公司;5424R离心机,德国艾本德公司;TU-1810紫外分光光度仪,北京普析通用仪器有限责任公司;FC酶标仪,塞多利斯科学仪器有限公司;SPX-250B-Z恒温培养箱,上海博讯医疗生物仪器股份有限公司;ZQLY-300恒温摇床,上海知楚仪器有限公司;BXM-30R高压灭菌锅,上海博讯医疗生物仪器股份有限公司。
1.3 实验方法
1.3.1 菌株培养
取存于-80 ℃冰箱的PR106菌种用YPD培养基活化,置于恒温培养箱中20 ℃培养7 d。挑取活化的单菌落接种于装有30 mL YEPD培养基的100 mL三角瓶中发酵,具体的培养方法可以参考ZHANG等[7]的研究。
1.3.2 甘油浓度的筛选
研究了不同添加量甘油(0、5、10、15、20、25、30、35、40、45 mL/L)对PR106的生物量和虾青素产量的影响。接菌量为2%(体积分数),培养方法如1.3.1节。使用紫外分光光度计测定生物量(OD600值)和虾青素(OD475值)。
1.3.3 甘油-二氧化钛联合刺激红法夫酵母PR106
在培养基中分别加入筛选出最佳添加量的甘油和500 mg/L二氧化钛,接菌量为2%,培养方法如1.3.1节。使用紫外分光光度计测定红法夫酵母的生物量(OD600值)和虾青素(OD475值)。
1.3.4 生长曲线测定
将PR106分别培养至0、8、12、16、20、24、32、40、48、52、56、60、64、72、76、80、88 h,测定其生长曲线。
1.3.5 不同时间添加甘油刺激PR106
首先在培养基中先加入500 mg/L二氧化钛,随后将PR106培养至0、16和30 h添加甘油,培养方法如1.3.1节,使用紫外分光光度计测定红法夫酵母的生物量(OD600值)和虾青素(OD475值)。
1.3.6 生物量测定
PR106的生物量采用干重法测定[12]。
1.3.7 残糖的测定
葡萄糖浓度采用3,5-二硝基水杨酸比色法测定[13]。取1 mL培养至72 h的菌液于10 mL容量瓶或具塞刻度试管中,加水至2 mL,加入4 mL 3,5-二硝基水杨酸试剂,置沸水浴中加热5 min取出,立即使用冷水冷却至室温,定容,摇匀,用紫外分光光度计测定OD540值。
1.3.8 类胡萝卜素测定
采用LC-MS/MS方法检测PR106中类胡萝卜素的含量,提取方法及液相条件参考INBARAJ等[14]、RIVERA等[15]和RODRIGUES等[16]的研究。
1.3.9 红法夫酵母细胞凋亡及ROS水平的测定
通过流式细胞术研究了甘油和二氧化钛联合刺激后PR106不同生长阶段的细胞凋亡和ROS水平的变化情况。将PR106细胞进行离心并用PBS洗涤2次,然后将细胞浓度调整为1×105 CFU/mL,与100 μmoL/L DCFH-DA一起在黑暗中于37 ℃孵育30 min。随后,样品在低温条件下用PBS洗涤2次,再悬浮于PBS中,用20 μg/mL PI进行染色。在流式细胞仪的FL1通道[(525±20) nm]和FL3通道[(625±20) nm]分别采集细胞的绿色荧光(DCFH-DA)和红色荧光(PI)。每个样本检测10 000个细胞,所得数据用FlowJo软件(v10.8.1版)进行分析。
1.3.10 酵母细胞抗氧化活性测定
将不同生长阶段的PR106在4 000 r/min,4 ℃条件下离心10 min以获得酵母细胞,并用蒸馏水洗涤2次。将细胞重悬于PBS中,并在480 W的超声功率下破碎40 min(5 s,10 s间隔),收集上清液,即为粗蛋白溶液。使用南京建成检测试剂盒对SOD活力和CAT活力进行测定。
1.4 数据处理与分析
所有试验均重复3次,得出数据用“平均值±标准差”表示。通过GraphPad Prism 8.0软件进行单因素多元方差分析以及使用IBM SPSS Statistics 24软件进行t-检验分析数据的显著性,P<0.05为差异显著,并进行作图分析。
2 结果与分析
2.1 甘油对PR106生物量和虾青素产量的影响
ZHANG等[10]研究发现,外源性甘油可通过增加底物(如丙酮酸)的形成促进虾青素的产生。故测定了不同浓度甘油对PR106的影响。由图1-a可知,与对照相比,甘油有效提高了PR106生物量和虾青素产量。随着甘油添加量的增加,PR106的生物量和虾青素产量也呈现出同步增长的趋势。当添加30 mL/L甘油时,PR106的生物量和虾青素产量达到最高,分别为14.28和14.83,是对照组的1.40倍和1.32倍。然而,当甘油添加量超过30 mL/L后,PR106的生物量和虾青素产量开始逐渐下降。红法夫酵母是一种专性好氧菌,高浓度的甘油会导致发酵液中溶氧水平的下降,从而抑制酵母的生长[17]。故甘油添加量为30 mL/L是红法夫酵母生产虾青素的最佳条件。
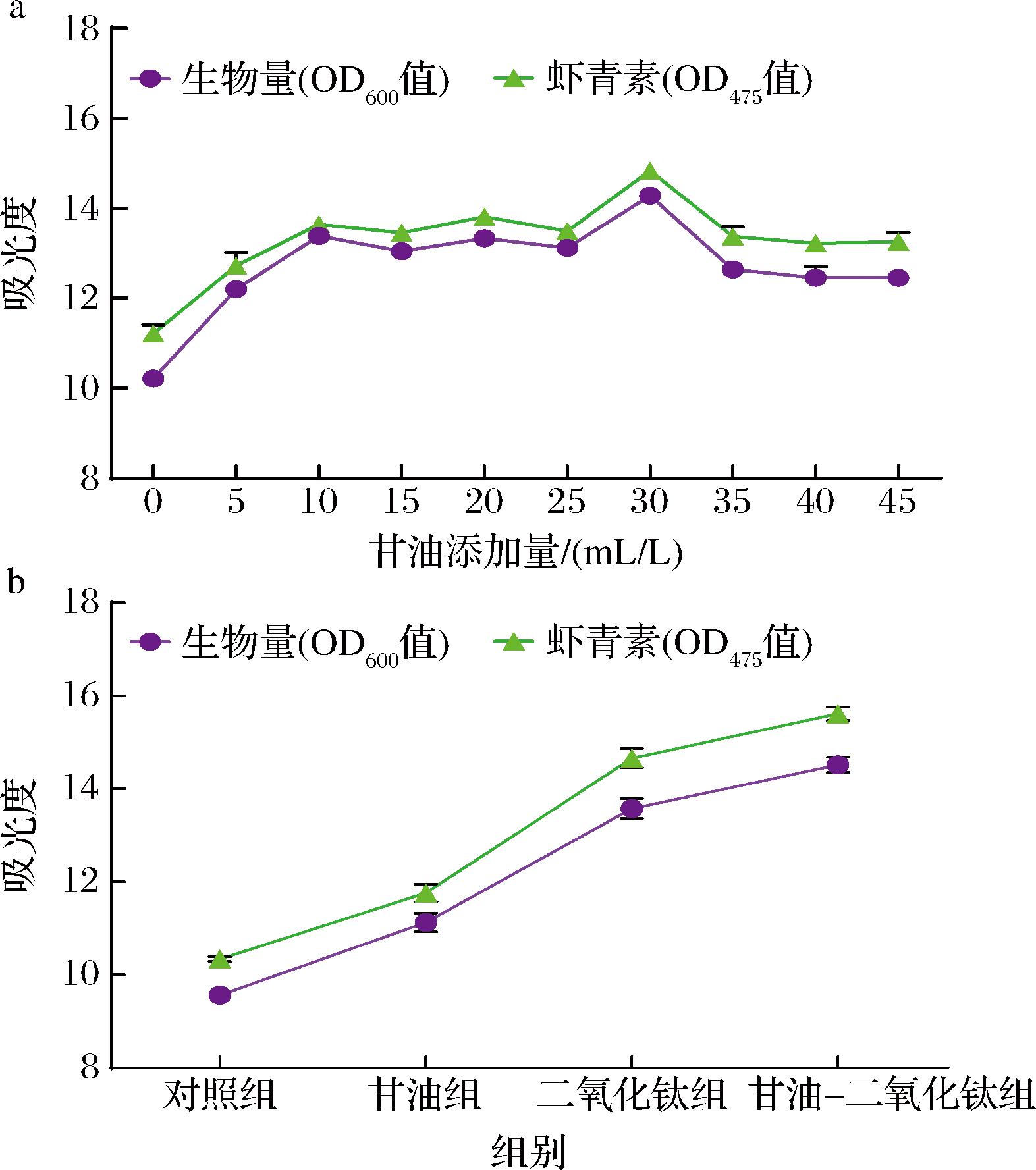
a-甘油添加量对PR106生物量和虾青素产量的影响;b-甘油-二氧化钛对PR106生物量和虾青素产量的影响
图1 胁迫条件对PR106生物量和虾青素产量的影响
Fig.1 Effects of stress conditions on the biomass and astaxanthin yield of PR106
单一的刺激因子虽有效,但其对红法夫酵母虾青素产量的影响有限,某些刺激物对酵母的虾青素生产具有促进或竞争作用,可进一步优化这些刺激物的组合,以实现更佳的发酵效果[6]。团队前期研究发现500 mg/L二氧化钛是促进PR106快速积累虾青素的最佳质量浓度[7],因此,将500 mg/L二氧化钛与筛选出的最佳甘油添加量进行组合。由图1-b可知,甘油-二氧化钛处理组比对照组显著增加了PR106生物量和虾青素产量。添加500 mg/L二氧化钛和30 mL/L甘油至YEPD培养基,PR106的生物量和虾青素产量分别为14.51和15.61,是对照组的1.52倍和1.51倍。
2.2 不同时间添加甘油对PR106生物量和虾青素产量的影响
为了深入探讨双重胁迫对酵母生长周期的影响,并确定甘油添加的最佳时机,故测定了甘油-二氧化钛胁迫下PR106的生长曲线。由图2-a可知,对照组中PR106培养至18 h进入对数期,并于54 h进入稳定期。而在甘油和二氧化钛的协同作用下,PR106的生长速度明显加快,仅需16 h便进入对数期,并在64 h后达到稳定期,从而显著延长了其对数期。基于生长曲线的结果,进一步分析了在不同培养时间添加30 mL/L甘油对PR106发酵效果的影响。由图2-b可知,当0 h添加甘油时,PR106的生物量和虾青素产量分别为13.57和14.65,分别是16 h添加组的1.07倍和1.07倍,30 h添加组的1.06倍和1.06倍。
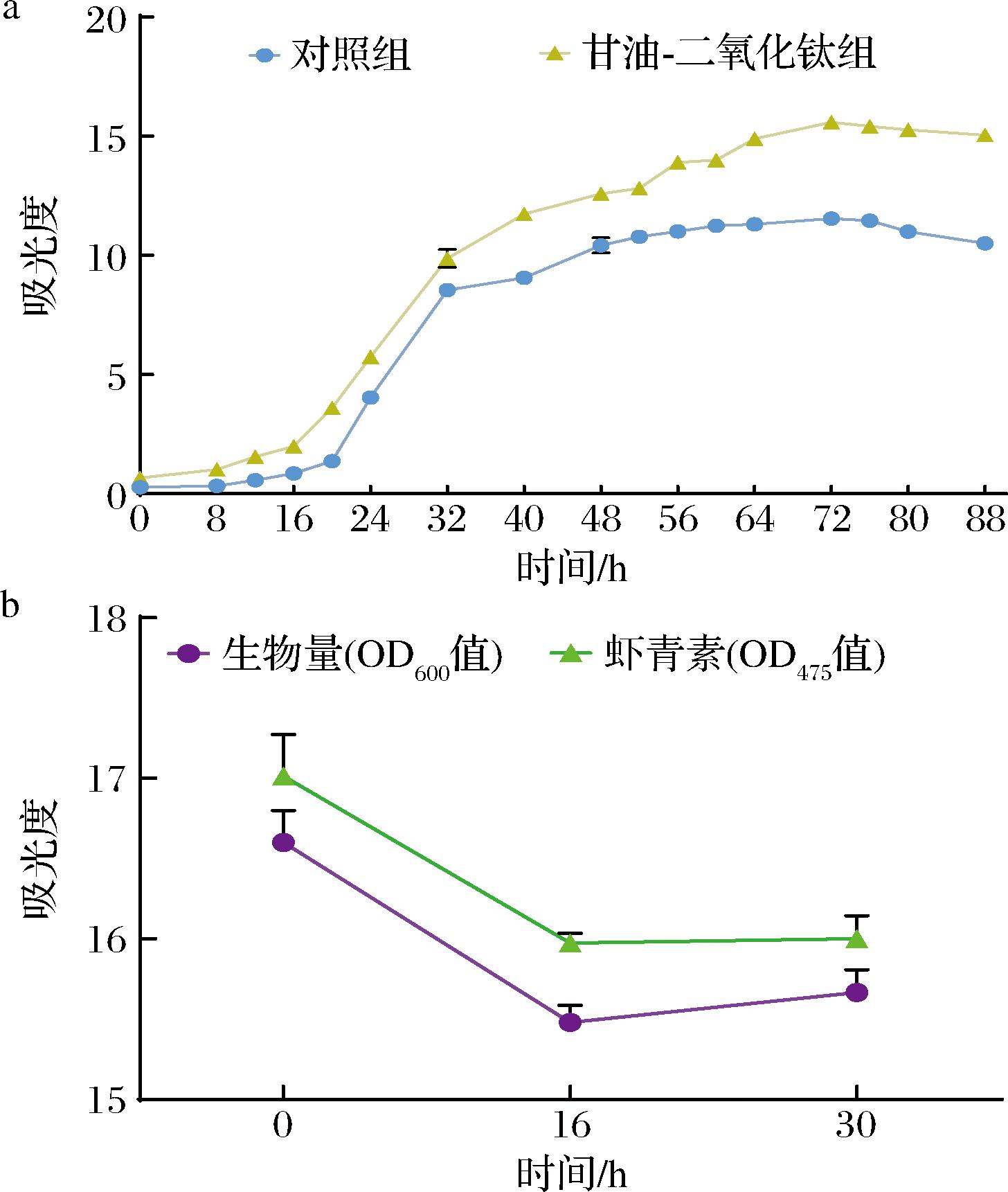
a-甘油-二氧化钛胁迫下PR106的生长曲线[生物量(OD600值)];b-不同培养时间添加甘油对PR106生物量和虾青素产量的影响
图2 PR106在双重胁迫条件下的生长情况
Fig.2 Growth of PR106 under dual stress conditions
根据结果显示,在0 h添加甘油对PR106产虾青素促进效果最佳,这极大地简化了发酵流程,降低了生产环节的复杂性,不仅节省了时间,还有效减少了人为操作造成其他微生物污染的可能性,从而提升了整体的生产效率。
2.3 甘油-二氧化钛对 PR106 生长和葡萄糖利用的影响
外源胁迫条件在影响微生物生长方面起着至关重要的作用,是判断胁迫有效性的关键指标[2]。因此,测定了甘油-二氧化钛胁迫PR106不同培养时间的生物量和残糖量。如图3-a所示,添加500 mg/L的二氧化钛和30 mL/L的甘油后,在16 h和30 h时,PR106的生物量与对照组并无显著差异。经过72 h的培养,PR106的生物量显著提升至4.78 g/L,是对照组的1.16倍,这说明甘油和二氧化钛的添加有效促进了酵母的生长。测定对照组和处理组对葡萄糖的消耗(图3-b)发现,在培养酵母16 h时,甘油-二氧化钛组消耗的葡萄糖更多,但当PR106生长至30 h时,甘油-二氧化钛组的残糖量为7.29 g/L,是对照组1.31倍,显著低于对照组。PR106在30~72 h生长过程中,其生物量平均增加速率为1.63 g/L/h,是对照组的1.16倍(图3-a),这是因为甘油可以作为碳源为微生物的生长提供额外的能量[10]。
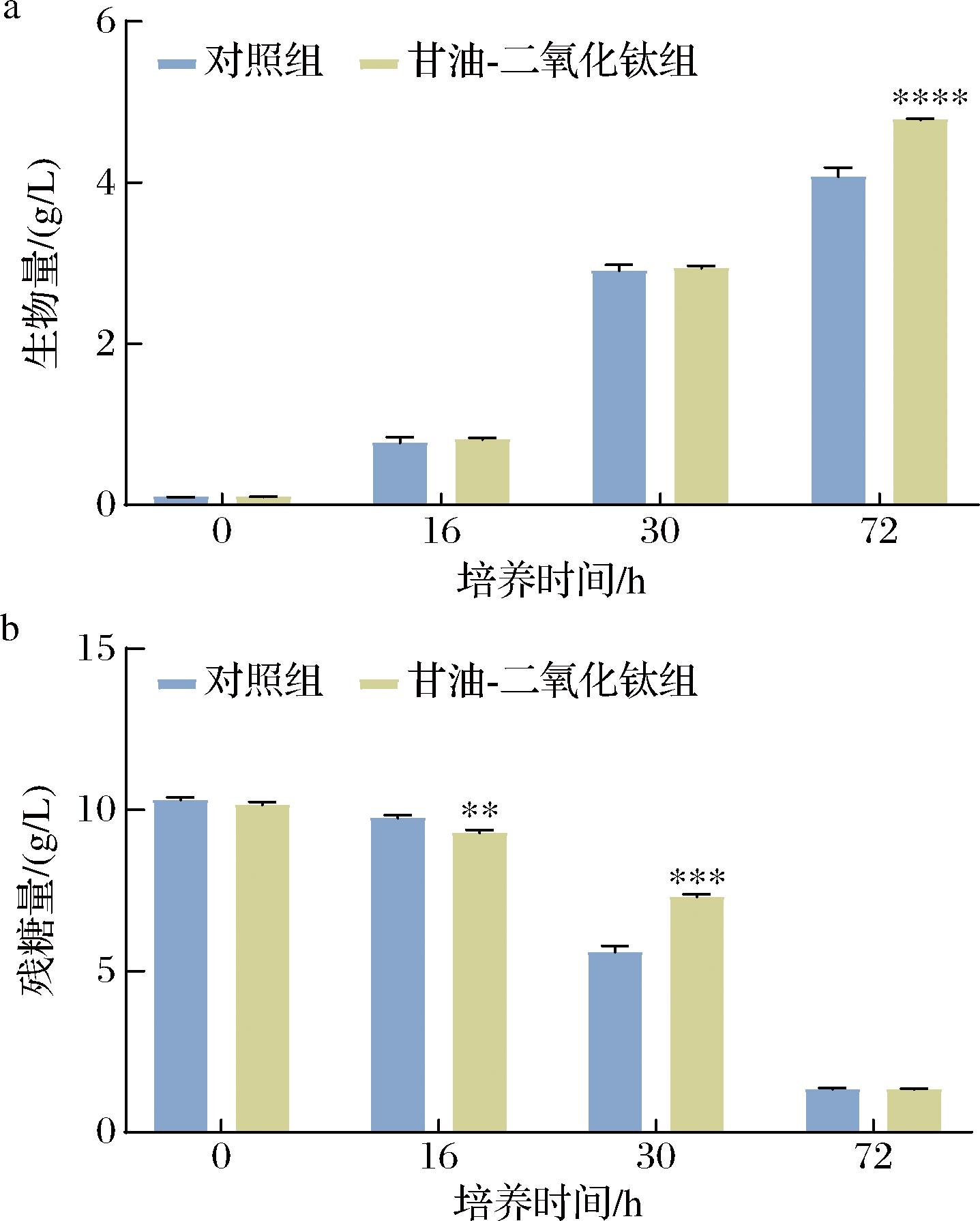
a-甘油-二氧化钛胁迫下PR106的生物量;b-甘油-二氧化钛胁迫下PR106的葡萄糖消耗
图3 PR106在甘油和二氧化钛胁迫下的生物量和葡萄糖消耗
Fig.3 Biomass and glucose consumption of PR106 under glycerol and titanium dioxide stress
注:单因素多元方差分析结果显示,当P<0.05时有显著性意义,图中*表示甘油-二氧化钛组与对照组的差异显著性,其中*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1(下同)。
2.4 甘油-二氧化钛胁迫对PR106类胡萝卜素产量的影响
类胡萝卜素如β-胡萝卜素、番茄红素和玉米黄素等是虾青素生物合成途径中必不可少的中间化合物[18]。八氢番茄红素、番茄红素和β-胡萝卜素都是虾青素合成的前体物质,其中八氢番茄红素在八氢番茄红素脱氢酶的作用下转化为番茄红素,再通过番茄红素环化酶进一步转化为β-胡萝卜素,随后再进一步被转化为虾青素[19]。由图4可知,甘油-二氧化钛组中PR106的类胡萝卜素产量为221.03 mg/L,是对照组的1.07倍。值得注意的是,在甘油-二氧化钛胁迫下,虾青素占类胡萝卜素总量的6.98%,是对照组的3.25倍。与此同时,番茄红素产量显著下降,其占类胡萝卜素总量的35%,是对照组的0.64倍;而β-胡萝卜素的产量则明显上升,占类胡萝卜素总量的56%,是对照组的1.74倍。由此可见,在甘油与二氧化钛的共同胁迫下,PR106中番茄红素的显著减少与β-胡萝卜素的增加形成了一个相互促进的过程,共同推动了虾青素的合成。
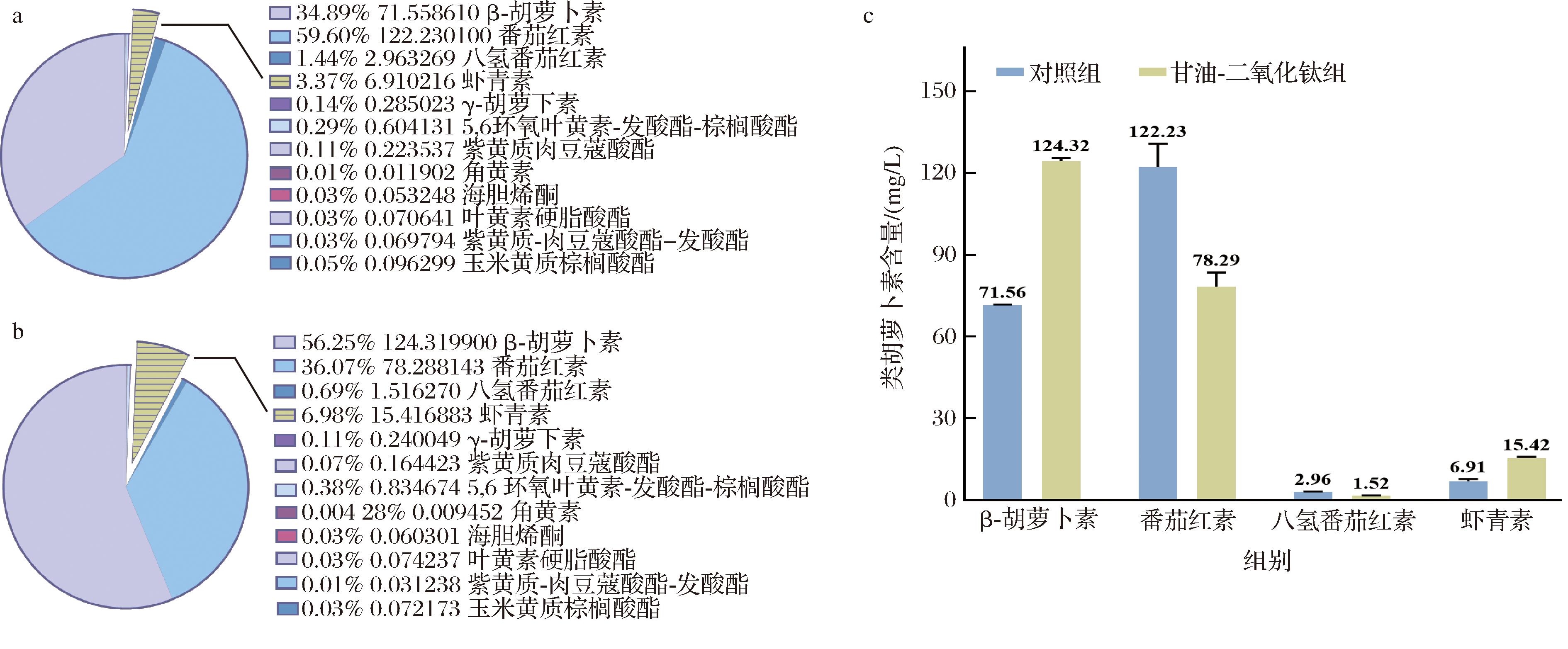
a-对照组中的类胡萝卜素产量;b-甘油-二氧化钛组中的类胡萝卜素产量;c-占总类胡萝卜素产量1%~60%的类胡萝卜素
图4 甘油和二氧化钛双重胁迫对PR106类胡萝卜素产量的影响
Fig.4 Effect of dual stress of glycerol and titanium dioxide on the carotenoid yield of PR106
注:a、b图中百分比用于表征某一组分在整体体系中的相对占比,而对应的数值则表示该组分的实际产量,单位mg/L。
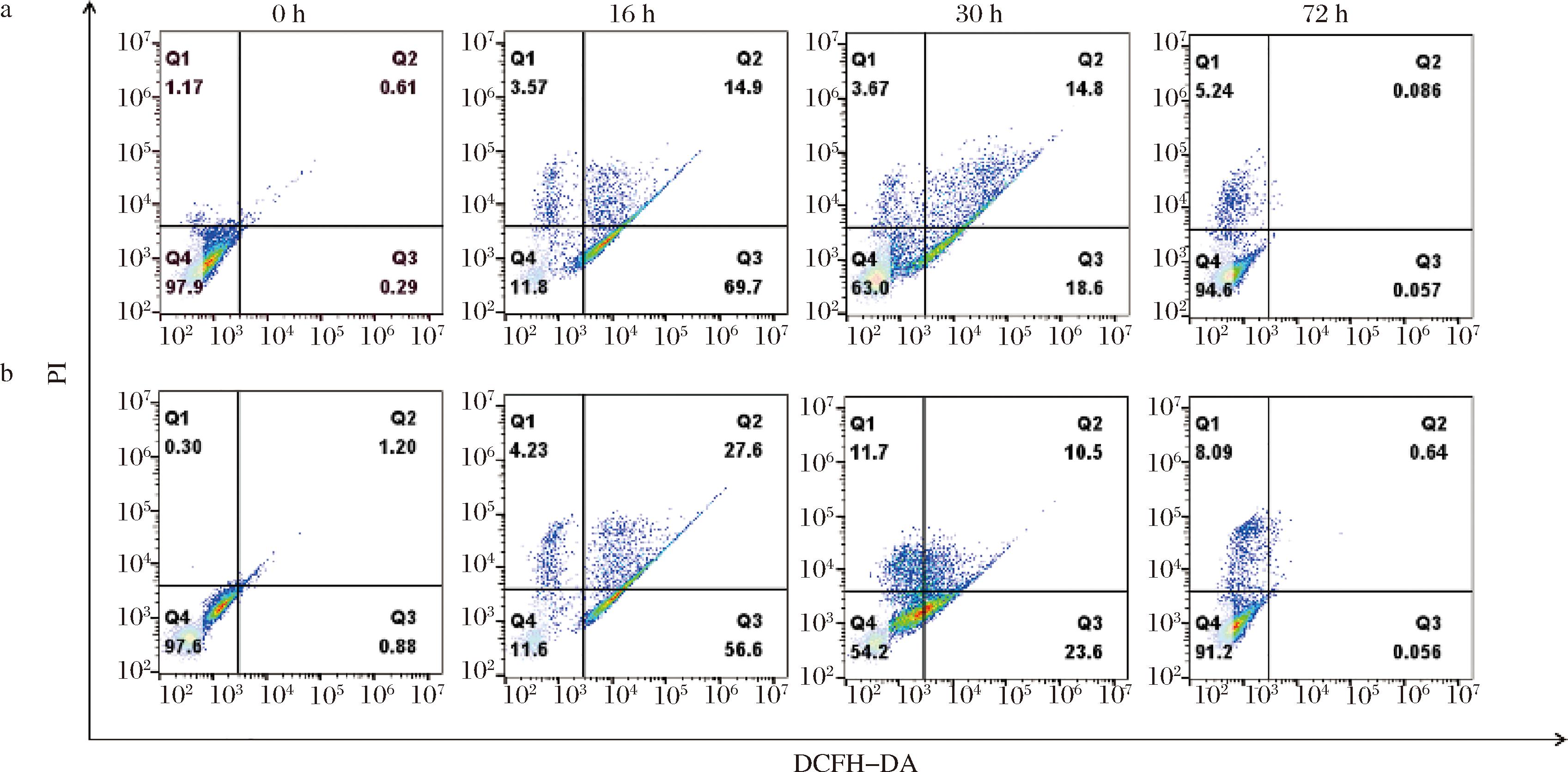
a-对照组;b-甘油-二氧化钛组
图5 甘油和二氧化钛联合刺激对PR106细胞凋亡和ROS产生的影响
Fig.5 Effect of glycerol and titanium dioxide combined stimulation on apoptosis and ROS production in PR106 cells
2.5 甘油-二氧化钛双重胁迫对PR106氧化还原稳态的影响
二氧化钛能够刺激细胞产生ROS,从而诱导细胞死亡[20]。因此,为了进一步研究甘油和二氧化钛对酵母细胞生命力的影响,测定了PR106不同生长阶段的细胞凋亡情况(图5)。当酵母生长至16 h,对照组和甘油-二氧化钛组分别有18%和32%的酵母细胞发生凋亡,这说明外源物质的添加增加了PR106细胞凋亡的程度。细胞凋亡在细胞与其环境的交流中也起着至关重要的作用[21]。因此,甘油-二氧化钛组中凋亡细胞数量的增加是PR106适应外部环境变化并努力维持内部代谢平衡的结果。当酵母细胞生长到30 h,对照组的细胞凋亡程度依然为18%,而甘油-二氧化钛组的细胞凋亡率降至22%,这一变化表明酵母细胞对外界环境的适应性逐渐增强。一方面可能是由于虾青素的大量合成,从而改善了PR106对不利生长条件的抵御能力[22]。另一方面也可能是甘油可作为渗透保护剂,可以逆转环境压力的有害影响[23]。
研究表明胁迫条件通常会导致ROS水平上升来促进虾青素的合成[24]。因此,本文进一步研究了甘油与二氧化钛对PR106中ROS生成的影响。由图5可知,在0 h时,对照组和甘油-二氧化钛组的ROS水平没有显著差异,分别为1%和2%。当PR106生长至16 h,PR106表现出强烈的氧化应激反应,85%(对照组)和84%(甘油-二氧化钛组)的酵母细胞产生了较高水平的ROS。在30 h时,2组之间的ROS水平分别为33%和34%。经过72 h培养后,对照组和甘油-二氧化钛组的ROS水平恢复到正常范围(0%~1%)。以上结果表明,甘油-二氧化钛促进PR106虾青素的生成与ROS水平无关。
2.6 甘油-二氧化钛双重胁迫对PR106抗氧化酶活性的影响
HASSANPOUR等[25]研究表明,虾青素的生成与抗氧酶活力密切相关。细胞的酶系防御体系防御氧化主要通过抗氧化物酶清除自由基,如SOD、CAT等,这些机制可以解除因外源刺激导引起的不良反应[26]。为了进一步探究甘油-二氧化钛促进虾青素生成的机制,测定了不同生长时间段的PR106中的CAT和SOD活力。由图6可知,随着发酵的进行,酵母细胞中CAT活力呈上升趋势。在72 h时,甘油-二氧化钛组的CAT活力显著高于对照组。与此同时,SOD活力则呈现为先上升后下降的趋势。在30 h和72 h时,甘油-二氧化钛组的SOD活力均显著高于对照组。综上所述,添加甘油和二氧化钛显著促进了酵母细胞中CAT和SOD的活力,从而增强了PR106的抗氧化能力。甘油和二氧化钛通过促进SOD活力和CAT活力的增加,促进虾青素的产生,提高红法夫酵母细胞的抗逆性,使酵母菌株表现出对外界环境变化较强的适应性[24]。
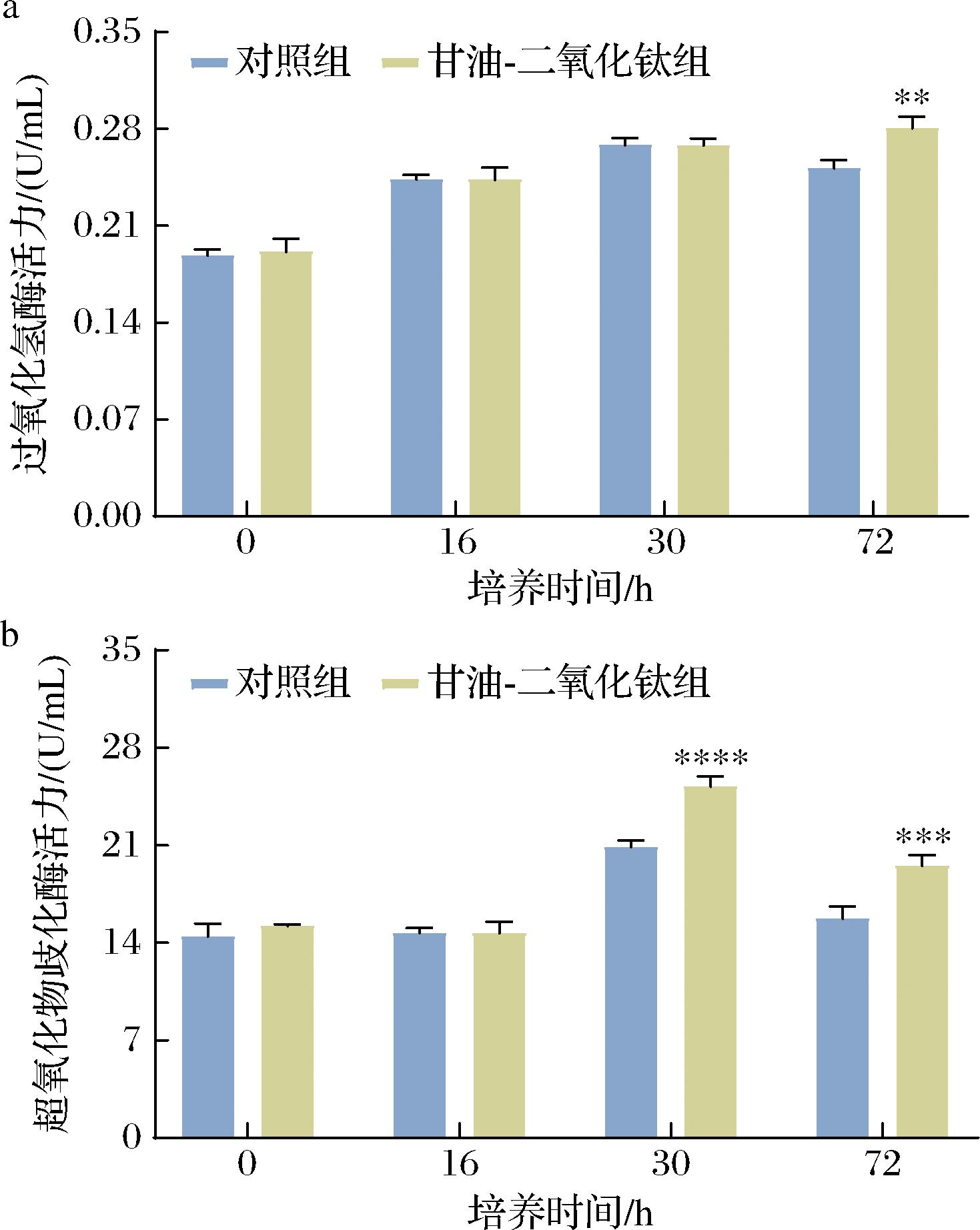
a-过氧化氢酶活力;b-超氧化物歧化酶活力
图6 甘油和二氧化钛胁迫对PR106细胞中抗氧化酶活力的影响
Fig.6 Effect of glycerol and titanium dioxide stress on the activity of antioxidant enzymes in PR106 cells
3 结论
本研究结果表明,30 mL/L甘油和500 mg/L二氧化钛显著促进了PR106对葡萄糖的有效利用,同时对酵母细胞凋亡未产生显著性影响。更重要的是,甘油和二氧化钛能够延长红法夫酵母PR106的生长对数期,有利于酵母菌株快速适应环境并高效繁殖,显著提升了细胞活力。在甘油和二氧化钛胁迫下,PR106的生物量和虾青素产量分别达到了4.78 g/L和15.42 mg/L,是对照组的1.17倍和3.25倍;类胡萝卜素产量是对照组的1.07倍。值得注意的是,在甘油-二氧化钛促进PR106产生虾青素过程中,细胞内的ROS水平无显著变化,但提高了细胞中SOD和CAT的活力,表明甘油和二氧化钛通过酶系防御系统来清除ROS。本研究证实了甘油和二氧化钛的添加有效促进了红法夫酵母虾青素前体物的合成,从而提高了虾青素产量,这为甘油副产物的有效利用开辟了新的应用前景。本研究为红法夫酵母低成本、高效率地生产虾青素提供了一种可行的方法,具有重要的应用价值。
[1] PATIL A D, KASABE P J, DANDGE P B.Pharmaceutical and nutraceutical potential of natural bioactive pigment:Astaxanthin[J].Natural Products and Bioprospecting, 2022, 12(1):25.
[2] KIKUKAWA H, SHIMIZU C, HIRONO-HARA Y, et al.Screening of plant oils promoting growth of the red yeast Xanthophyllomyces dendrorhous with astaxanthin and fatty acid production[J].Biocatalysis and Agricultural Biotechnology, 2021, 35:102101.
[3] FARAONE I, SINISGALLI C, OSTUNI A, et al.Astaxanthin anticancer effects are mediated through multiple molecular mechanisms:A systematic review[J].Pharmacological Research, 2020, 155:104689.
[4] 王军, 张晴龙, 李曦月, 等.高产虾青素红法夫酵母的代谢工程育种研究进展[J].化学与生物工程, 2022, 39(10):1-5.WANG J, ZHANG Q L, LI X Y, et al.Research progress in metabolic engineering breeding of high-yield astaxanthin-producing Xanthophyllomyces dendrorhous[J].Chemical &Bioengineering, 2022, 39(10):1-5.
[5] 杨立鑫, 周大伟, 崔心江, 等.利用酵母生物合成虾青素的研究进展[J].食品与发酵工业, 2024, 50(22):368-379.YANG L X, ZHOU D W, CUI X J, et al.Research progress on biosynthesis of astaxanthin by yeast[J].Food and Fermentation Industries, 2024, 50(22):368-379.
[6] LI Z P, YANG H Y, ZHENG C H, et al.Effectively improve the astaxanthin production by combined additives regulating different metabolic nodes in Phaffia rhodozyma[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:812309.
[7] ZHANG J, LI Q R, ZHANG M H, et al.Enhancement of carotenoid biosynthesis in Phaffia rhodozyma PR106 under stress conditions[J].Bioscience, Biotechnology, and Biochemistry, 2019, 83(12):2375-2385.
[8] VASILIADOU I A, BELLOU S, DASKALAKI A, et al.Biomodification of fats and oils and scenarios of adding value on renewable fatty materials through microbial fermentations:Modelling and trials with Yarrowia lipolytica[J].Journal of Cleaner Production, 2018, 200:1111-1129.
[9] LI Q R, ZHANG J, GUAN X Y, et al.Metabolite analysis of soybean oil on promoting astaxanthin production of Phaffia rhodozyma[J].Journal of the Science of Food and Agriculture, 2023, 103(6):2997-3005.
[10] ZHANG L T, ZHANG C H, LIU J G, et al.A strategy for stimulating astaxanthin and lipid production in Haematococcus pluvialis by exogenous glycerol application under low light[J].Algal Research, 2020, 46:101779.
[11] PAPANIKOLAOU S, KAMPISOPOULOU E, BLANCHARD F, et al.Production of secondary metabolites through glycerol fermentation under carbon-excess conditions by the yeasts Yarrowia lipolytica and Rhodosporidium toruloides[J].European Journal of Lipid Science and Technology, 2017, 119(9):1600507.
[12] 张晶.红法夫酵母菌株筛选及TiO2胁迫提高其虾青素产量的作用机制[D].长春:吉林农业大学, 2022.ZHANG J.Screening of Phaffia rhodozyma and the mechanism of action of TiO2 stress to increase their astaxanthin production[D].Changchun:Jilin Agricultural University, 2022.
[13] SMITH JR W T, CHENG C.Use of 3,5-dinitrosalicylate reagent for glucose determination in mixed solvents[J].Analytical Letters, 1978, 11(2):191-194.
[14] INBARAJ B S, LU H, HUNG C F, et al.Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLC-DAD-APCI-MS[J].Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(4-5):812-818.
[15] RIVERA S M, CHRISTOU P, CANELA-GARAYOA R.Identification of carotenoids using mass spectrometry[J].Mass Spectrometry Reviews, 2014, 33(5):353-372.
[16] RODRIGUES D B, MARIUTTI L R B, MERCADANTE A Z.Two-step cleanup procedure for the identification of carotenoid esters by liquid chromatography-atmospheric pressure chemical ionization-tandem mass spectrometry[J].Journal of Chromatography A, 2016, 1457:116-124.
[17] HUANG T Y, LU W C, CHU I M.A fermentation strategy for producing docosahexaenoic acid in Aurantiochytrium limacinum SR21 and increasing C22:6 proportions in total fatty acid[J].Bioresource Technology, 2012, 123:8-14.
[18] BARREDO J L, GARC A-ESTRADA C, KOSALKOVA K, et al.Biosynthesis of astaxanthin as a main carotenoid in the heterobasidiomycetous yeast Xanthophyllomyces dendrorhous[J].Journal of Fungi, 2017, 3(3):44.
A-ESTRADA C, KOSALKOVA K, et al.Biosynthesis of astaxanthin as a main carotenoid in the heterobasidiomycetous yeast Xanthophyllomyces dendrorhous[J].Journal of Fungi, 2017, 3(3):44.
[19] 周琳, 梁轩铭, 赵磊.天然类胡萝卜素的生物合成研究进展[J].生物技术通报, 2022, 38(7):119-127.ZHOU L, LIANG X M, ZHAO L.Biosynthesis of natural carotenoids:Progress and perspective[J].Biotechnology Bulletin, 2022, 38(7):119-127.
[20] ZIENTAL D, CZARCZYNSKA-GOSLINSKA B, MLYNARCZYK D T, et al.Titanium dioxide nanoparticles:Prospects and applications in medicine[J].Nanomaterials, 2020, 10(2):387.
[21] RILEY J S, BOCK F J.Voices from beyond the grave:The impact of apoptosis on the microenvironment[J].Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2022, 1869(11):119341.
[22] KUMAR S, KUMAR R, DIKSHA, et al.Astaxanthin:A super antioxidant from microalgae and its therapeutic potential[J].Journal of Basic Microbiology, 2022, 62(9):1064-1082.
[23] NAKAMURA M, FARNUM J L, OKE M A.Protective action of glycerol in the freezing of Shigella sonnei[J].Nature, 1962, 194(4826):405.
[24] LI Q Q, LI L P, ZHANG Y, et al.Chemical inducers regulate ROS signalling to stimulate astaxanthin production in Haematococcus pluvialis under environmental stresses:A review[J].Trends in Food Science &Technology, 2023, 136:181-193.
[25] HASSANPOUR H, POURHABIBIAN R.Impact of sodium pyrophosphate and static magnetic field on Haematococcus pluvialis:Enhancement of astaxanthin accumulation, PAL, and antioxidant enzyme activities[J].Physiology and Molecular Biology of Plants, 2022, 28(6):1207-1216.
[26] SIES H, BERNDT C, JONES D P.Oxidative stress[J].Annual Review of Biochemistry, 2017, 86:715-748.