无醇啤酒(non-alcoholic beer, NAB),即酒精度≤0.5%(体积分数)的新型啤酒(GB/T 4927—2008《啤酒》)。随着消费者对健康和个性化饮品的需求增加、法规政策的完善和无醇啤酒工艺技术的进步,无醇啤酒市场呈现出积极的发展态势[1]。年轻消费者群体对新口味和体验的追求,以及对健康饮品的关注,促使啤酒生产商开发低热量的无醇啤酒产品[2]。由于无醇啤酒中酒精含量极少,对于孕妇、备孕期男士或需要避免酒精摄入的人群,无醇啤酒是一个较好的选择。此外政府倡导健康生活方式,包括适量饮酒或选择无醇饮品。无醇啤酒作为新型的无酒精饮品,符合这一健康倡导[3]。如今随着酿造工艺的进步,无醇啤酒的风味更加多元化,可以满足不同消费者的口味和需求[4],无醇啤酒正受到越来越广泛的关注。
目前,工业上主要是通过2种方法生产无醇啤酒,分别是物理方法和生物方法[5]。常用的物理脱醇方法包括热处理和膜过滤,其中常用的热处理法包括薄层蒸发、降膜蒸发、连续真空蒸馏[6-7],但这种方法会使制得的脱醇啤酒在风味物质含量、口感和新鲜度上损失较大。膜过滤作为一种新的物理脱醇方法,相较于热处理法,风味损失较低,但是膜处理设备较为昂贵,啤酒脱醇过程复杂。目前来说,物理法脱醇需要昂贵的设备和能源消耗,且脱醇技术操作复杂,需要专业的设备和技术人员进行操作和维护,使得这种方法生产无醇啤酒的成本大大增加,中小型啤酒厂难以使用这种方法生产无醇啤酒[8]。生物法包括终止发酵法或限制发酵法,主要控制酵母对麦汁中糖组分的利用;终止发酵法就是在发酵过程的早期阶段人为地终止啤酒酵母的代谢活动,从而限制酒精的产生,但是,终止发酵法只是限制啤酒酵母的发酵过程,导致成品啤酒风味口感寡淡,消费者难以接受[3]。限制发酵法通过筛选使用特殊的低产乙醇酵母菌株进行发酵,这种低产乙醇的酵母不能或者只能少量利用麦芽糖,从而获得无醇啤酒[2]。且通过筛选特定的低产乙醇酵母酿造无醇啤酒,可以产生一些特殊的风味,并且产生一些特殊口感物质,如甘油[9],缓解无醇啤酒口感风味方面的缺陷。商用无醇啤酒酵母LA-01作为广泛应用于工业生物法酿造无醇啤酒的低产乙醇酵母菌株,该菌株生产出的无醇啤酒平衡感良好、具有轻微的酚类气味,消费者接受度较广。但是由于该菌株无法同化麦芽糖和麦芽三糖,成品啤酒中残糖量高,麦芽异味较明显且口感较甜腻[10]。
生物法酿造无醇啤酒可以直接用特殊酵母代替啤酒酵母,发酵工艺简单,且省去物理除醇设备,成本低,此外生物法可以通过使用不同的菌株以及多种菌株的混合发酵,可以改善风味,使无醇啤酒风味更加多元化。因此本研究采用生物法,从水果来源中筛选一株可以用于无醇啤酒生产的新型无醇啤酒酵母。旨在利用新型无醇啤酒酵母酿造出新型风味的无醇啤酒且在控制酒精度的基础上,提高发酵度,缓解生物法酿造无醇啤酒中普遍存在的口感风味问题。以商用无醇啤酒酵母路德类LA-01[11]作为对比,测定其在麦汁中的发酵能力以及发酵液的理化性质和风味物质组成情况,并进行感官品评实验。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
原料:澳大利亚进口皮尔森麦芽;90型颗粒酒花青岛大花(苦型)与萨兹(香型),雅基玛酒花有限公司;正常可饮用自来水;苹果、香蕉、猕猴桃、葡萄、梨、蜜桔、水蜜桃、蓝莓、甜橙、草莓、橙子、枇杷,超市。
菌株:啤酒酵母W-34/70、无醇啤酒酵母LA-01均为活性干酵母,保藏于实验室。
1.1.2 试剂与培养基
葡萄糖、琼脂粉、酵母浸膏、酸性磷酸钾、硫酸镁、柠檬酸,纯度为AR,国药集团化学试剂有限公司;三苯基四唑氯化物(2,3,5-triphenyltetrazolium chloride,TTC),纯度为97%,北京伊诺凯科技有限公司;酵母基因组提取试剂盒,生工生物工程股份有限公司;蛋白胨、酵母粉,纯度为FMB Grade,生工生物工程股份有限公司。
YPD培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0。
YPD培养基固体(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0,琼脂粉20.0。
TTC底层培养基(g/L)[12]:葡萄糖50.5,蛋白胨10.0,酵母浸膏7.5,酸性磷酸钾5.0,硫酸镁2.0,柠檬酸1.35,氨苄青霉素1.0,调整pH>4.0,琼脂30.0。
TTC上层培养基(g/L)[12]:葡萄糖0.5,琼脂15.0;灭菌后冷却后加入TTC 0.5。
麦汁培养基[13]:糖化后的麦汁,调整原麦汁浓度至10 °P。
1.2 仪器与设备
BXH-65S便携式离心机,上海力申科学仪器有限公司;H1500安东帕酒类测定仪,安东帕有限公司;HHS全玻璃双乙酰蒸馏器,建湖县明特玻璃仪器厂;RV 10 auto V麦芽粉碎机,泰安市泰山农业机械厂;Centrifuge 5804 R附温度计密度瓶(25 mL),长城玻璃仪器制造厂;Synergy H4 Counterstar细胞计数仪,上海睿钰生物科技有限公司;SW-CJ标准型超净工作台,苏州净化设备有限公司;KjeltecTM 8400低温离心机,上海力申科学仪器有限公司;Agilent 1100高效液相色谱仪,日本岛津有限公司;QYC2012电热鼓风干燥箱,北京市永光明医疗仪器有限公司;PL2002 Sugar-Pak色谱柱,美国安捷伦科技有限公司;S400-B立式高压蒸汽灭菌锅,上海博迅医疗生物仪器股份有限公司;AL204电子天平,瑞安市英衡电器有限公司;A-17828万用电子炉,中山市金立人电器有限公司;V400-A电子舌,日本INSENT公司。
1.3 实验方法
1.3.1 菌株分离
购买苹果、葡萄、猕猴桃、香蕉等12种不同种类的水果。分别取2 g水果果肉添加至含玻璃珠的50 mL无菌生理盐水中,搅碎成浑浊液,25 ℃、180 r/min培养20 min后,将浑浊液稀释涂布至添加含有1 g/L丙酸钠、1 g/L氨苄的抗菌YPD固体平板中,28 ℃培养48 h,观察菌落生长情况。将培养后呈圆形、表明光滑、边缘整齐的菌落挑出,在YPD平板中进行二次划线分离,纯化的分离物编号保藏于YPD方形平板上。
1.3.2 菌株筛选
1.3.2.1 杜氏小管产气实验
在杜氏小管中分别加入YPD培养基,并将保存在YPD方形平板上的菌株挑入杜氏小管中28 ℃静置培养72 h,并每隔12 h统计1次杜氏小管中的菌株产气情况[14](杜氏小管中的液体排空情况),以评价菌株的起酵能力。筛选出产气能力较强的菌株作为下一级筛选的菌株来源。
1.3.2.2 麦芽糖阴性菌株筛选
将YPD培养基中的葡萄糖替换为相同浓度的麦芽糖配制麦芽糖琼脂培养基,以麦芽糖为唯一碳源来判断菌株对麦芽糖的利用情况。麦芽糖培养基中的麦芽糖质量浓度为20 g/L。将上一级筛选出的菌株在YPD液体培养基中活化18 h后用去离子水清洗菌泥,在28 ℃下培养3 d进行饥饿处理,随后在麦芽糖平板上梯度稀释点板,初始浓度用酵母计数仪精确控制。在28 ℃下培养72 h,观察菌株生长情况,考察不同菌株的麦芽糖利用性能,筛选出不利用麦芽糖或者利用程度较低的菌株作为下一级筛选的来源菌株。
1.3.2.3 低产乙醇菌株的筛选
在1.3.2.2节中筛选出的麦芽糖阴性菌株在液体YPD培养基中活化18 h,用接种环在TTC下层平板上划线,28 ℃倒置培养2 d。每个下层板划线4~6个菌株,之后在长有菌落的TTC下层平板上倒入TTC上层培养基,在28 ℃下避光培养2~3 h,观察显色反应。颜色越深代表产酒精能力越强,反之则越弱[12]。通过TTC平板显色反应,挑选无色或者浅色的菌株即低产乙醇菌株作为下一级的菌株筛选来源。
1.3.2.4 分子生物学鉴定
挑取保存在YPD方形平板上的菌株单菌落接种于YPD液体中活化18 h,用酵母基因提取试剂盒提取待测菌株的基因组DNA进行检测,提取操作按照说明书进行。
提取酵母基因组后进行PCR扩增,具体扩增体系为,F:TCCTCCGCTTATTGATATGC;R:TCCGTAGG-TGAACCTGCGG。
PCR扩增条件[15]:98 ℃ 2 min预变性;98 ℃ 10 s变性,Tm 60~65 ℃ 10 s退火,72 ℃ 5~15 s/kb延伸,32个循环;72 ℃延伸2 min。扩增产物采用0.9%琼脂糖凝胶电泳进行检测。
扩增后的基因组交由金唯智公司检测测序,测序结果在NCBI官网上进行DNA Blast,确定菌株种类。
1.3.3 筛选菌株的发酵性能测定
麦汁糖化工艺:将粉碎麦芽与水按照1∶(4~5)的质量比,于45 ℃投料,升温至48 ℃,保温30 min,升温至63 ℃,保温60 min;升温至72 ℃,保温20 min,升温至78 ℃,保温10 min,过滤,洗糟。麦汁打回煮沸加入酒花,过滤,在105 ℃,10 min灭菌,备用。在实验室制备原麦汁浓度为10 °P的麦汁发酵培养基,将活化好的菌株离心得到菌泥,按照1%的接种量接种到麦汁培养基中,每天测量失重,并在失重低于0.1 g/150 mL后停止发酵,获得发酵液,并检测其他指标。以LA-01为对照,每组设2个平行。
1.3.3.1 菌株耐酒花性能测定
在100 mL麦汁体系中分别添加不同量的异-α-酸,使麦汁苦味值分别为0、20、40 IBU,分别接种1%的菌株,测定其OD600值,判断生长情况,并以啤酒酵母W-34/70和无醇啤酒酵母LA-01为对照。
1.3.3.2 菌株糖利用率测定
利用HPLC对各菌株发酵液进行残糖含量的测定[16],判断各菌株对麦汁中的各种糖组分的利用情况。高效液相色谱法条件:Waters Sugar-Pak液相色谱柱(250 mm×4.6 mm×5 μm);流动相:超纯水;流速0.5 mL/min;视差折光检测器;参比池温度:85 ℃。糖利用率计算如公式(1)所示:
(1)
式中:A,利用率,%;C,发酵后麦汁中残糖含量,g/L;M,原麦汁中糖含量,g/L。
1.3.3.3 菌株发酵速率测定
每天测定发酵液失重,以CO2生成速度判断麦汁发酵速度,确定发酵终点,评估发酵程度。
1.3.4 发酵液基本理化指标测定
利用安东帕酒类测定仪测定发酵液的原麦汁浓度、酒精度、发酵度等基本理化性质。
1.3.5 发酵液风味物质分析
利用GC-MS测定发酵液中的风味物质含量[17]。
顶空进样条件:样品瓶平衡温度50 ℃;定量环温度100 ℃;传输线温度120 ℃;样品瓶体积20 mL,样品平衡时间25.0 min;样品瓶填充时间0.14 min;定量环体积1.0 mL,定量环平衡时间0.05 min;进样持续时间0.5 min;样品瓶填充压力139.28 kPa。
色谱条件:载气流速5 mL/min,恒定压力模式,氢气流速30 mL/min,空气流速400 mL/min;进样口温度150 ℃;检测器温度200 ℃;程序升温起始条件温度35 ℃,以10 ℃/min升温至135 ℃,再以5 ℃/min升温至150 ℃,最后以10 ℃/min升温至180 ℃,保持5 min;采用分流进样,分流比2∶1。
利用电子舌测定无醇啤酒六味,并评价指标。
2 结果与分析
2.1 菌株的分离富集
为了得到低产乙醇的产香酵母,从苹果、梨、香蕉等多种水果来源[18]中经过富集培养,共得到682株菌株并保存点板于36格方形平板上,作为下一级菌株筛选来源。
2.2 菌株筛选
2.2.1 杜氏小管产气实验
啤酒酿造过程中,监测啤酒发酵过程中的失重是确保产品质量、优化生产过程的重要手段,此外,不同的酵母菌株可能具有不同的发酵特性,监测失重有助于了解特定酵母在实际生产中的性能,因此需要对发酵体系失重进行监测[19]。同时对菌株发酵产气能力进行筛选。
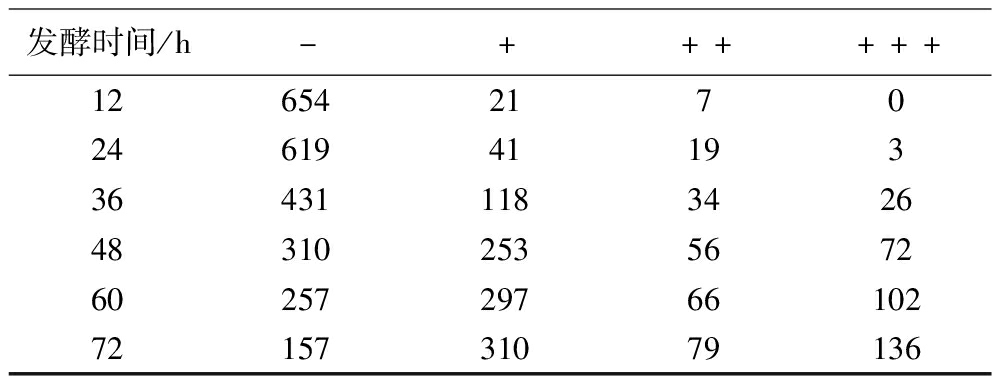
每12 h跟踪测定不同菌株的产气能力,结果如表1所示。在12 h内682株菌株中没有菌株可以将杜氏小管排空(+++),而达到较好起酵性能的(++)的也只有7株菌;随着发酵时间的延长,可以排空杜氏小管的菌株越来越多(+++),在24、48、72 h分别有3、72、136株菌;有19株菌在24 h内产气较多,有56株菌在48 h内产气较多,最终有79株菌产气较多(++);选取排空(+++)和起酵性能较好的(++)菌株,最终确定215菌株进入下一轮筛选。菌株杜氏小管发酵示意图如附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.041314,下同)所示。

a-Cyberlindnera jadinii;b-Pichia rarassimilans;c-Hanseniaspora uvarum;d-Wickerhamomyces ochangensis
图1 四种菌株与相关菌种的系统进化树
Fig.1 Phylogenetic tree of four strains and related strains
表1 杜氏小管产气实验结果
Table 1 Results of Du′s small tube gas production experiment
发酵时间/h-++++++126542170246194119336431118342648310253567260257297661027215731079136
注:”-“指杜氏小管中液体未排;“+”代表杜氏小管中液体排除1/4到1/3;“++”指杜氏小管中液体排出4/5左右;“+++”指杜氏小管中液体排空。
2.2.2 麦芽糖阴性菌株筛选
由于麦汁中麦芽糖占总发酵糖的60%~70%,因此必须选择不利用麦芽糖或者对麦芽糖利用率较低的菌株即麦芽糖阴性菌株进行后续啤酒发酵,否则不能控制发酵液的酒精度,无法达到无醇啤酒的要求[20]。
为具体展示不同菌株在麦芽糖平板上的生长情况,将不同菌株饥饿处理后的菌液梯度稀释点板于麦芽糖平板上生长72 h,观察其生长情况,麦芽糖阴性菌株筛选结果如表2所示。菌株在麦芽糖平板上不同生长状态如附图2所示。
a-未添加酒花;b-酒花苦味值为20 IBU;c-酒花苦味值为40 IBU
图2 不同酒花添加量的菌株生长曲线
Fig.2 Growth curves of strains with different amounts of hops added
表2 麦芽糖阴性菌株筛选结果表
Table 2 Maltotriose-Negative Strain Selection Results Table
生长状态-+++总菌株数2772116
注:“-”代表无法生长的菌株;“+”代表可以生长但是生长状况不好的菌株;“++”代表可以正常生长的菌株。
选取在麦芽糖平板上不能生长或者生长情况不好的菌株进行下一步筛选。筛选结果如表3所示,在以麦芽糖为唯一碳源的平板上点板生长72 h之后,无法生长(-)的菌株有27株;可以生长,但是生长情况较弱(+)的菌株有72株;可以正常生长(++)的菌株有116株。选取不生长(-)以及生长情况较弱(+)的菌株,最终确定99株麦芽糖阴性菌株进入下一级筛选。
表3 TTC平板筛选结果
Table 3 TTC agar plate screening results
显色状态-+++总菌株数3789
注:“-”指TTC平板不显色;“+”指TTC平板显色淡;“++”指TTC平板变红。
2.2.3 低产乙醇菌株的筛选
TTC平板常被用于高产乙醇酵母的筛选[20]。TTC能对酵母的代谢产物产生显色反应,通过颜色的深浅可以判断其胞内转化酶的活力大小,颜色越深胞内转化酶活力越强,产乙醇能力越强。确定菌株有一定的起酵能力之后,还需要确定菌株不产酒精或者产酒精能力较弱,以达到无醇啤酒的标准。因此选择TTC平板,将筛选出的99株菌株点板到TTC平板上,根据颜色的深浅确定其产酒精能力,结果如表3所示。不同菌株在TTC平板上生长情况如附图3所示。
a-筛选的6株非酿酒酵母的失重变化;b-啤酒酵母W-34/70与非酿酒酵母LA-01的失重变化对比
图3 不同菌株在麦汁发酵中的失重
Fig.3 Weight loss of different strains in wort fermentation
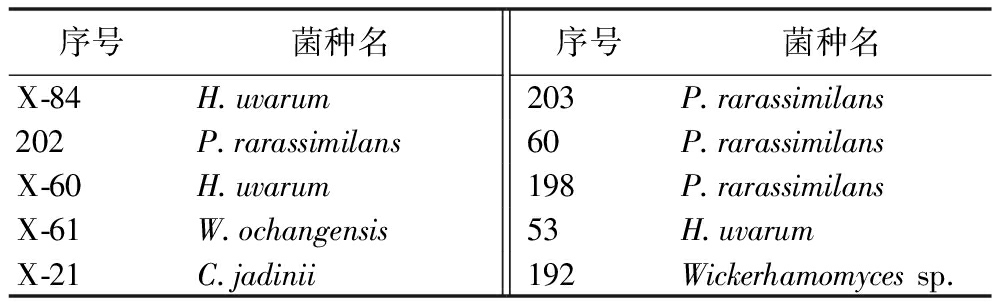
由表4可以看出,有89株菌株TTC平板完全变红(++),产酒精能力强,不属于低产乙醇菌株,所以筛除;有3株菌完全不产乙醇(-),有7株菌株低产乙醇(+),最终确定10株菌株符合酿造无醇啤酒的要求,进行分子生物学鉴定,确定菌株的种类。
表4 菌株分子生物学类别鉴定
Table 4 Molecular biology classification strains
序号菌种名序号菌种名X-84H.uvarum203P.rarassimilans202P.rarassimilans60P.rarassimilansX-60H.uvarum198P.rarassimilansX-61W.ochangensis53H.uvarumX-21C.jadinii192Wickerhamomycessp.
2.3 分子生物学鉴定
将这10株菌进行DNA测序鉴定,最终发现4种具有开发无醇啤酒潜力的非酿酒酵母类型:杰丁塞伯林德纳氏酵母(Cyberlindnera jadinii)、毕赤酵母(Pichia rarassimilans)、威克汉姆酵母(Wickerhamomyces ochangensis)和葡萄酒有孢汉逊酵母(Hanseniaspora uvarum),其数目分别为1株、4株、2株、3株。具体菌株的种属如表4所示。后续需进行进一步发酵实验确定性能最好的菌株。
为了更好地显示菌株系统发育关系,实验从4种酵母中各选取了一株菌株(Cyberlindnera jadinii、Pichia rarassimilans、Hanseniaspora uvarum、Wickerhamomyces ochangensis),利用MEGA 11软件绘制了它们的系统发育树,结果如图1所示。
2.4 菌株发酵性能测定
2.4.1 酒花耐受性测定
麦汁中添加酒花除了增添特殊的风味之外,也有一定的抑菌作用,增加啤酒的保质期[19]。
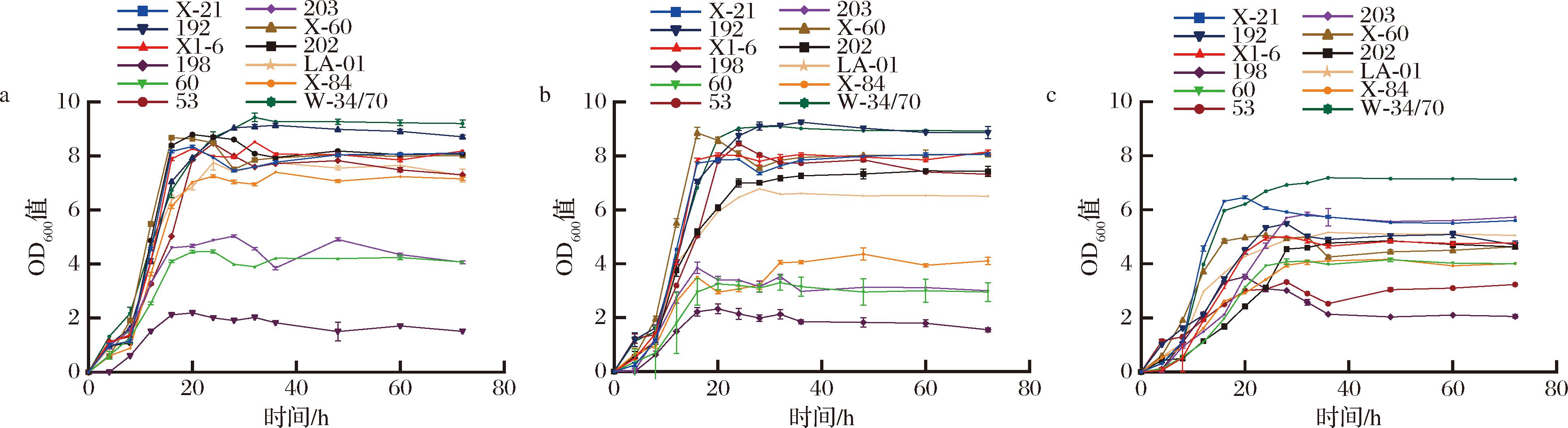
因此,在筛选出符合要求的初始菌株之后,需要对菌株的酒花耐受性进行测定,以确定菌株在麦汁中是否可以正常生长,测定结果如图2所示。
由图2-a可以看出,在未添加酒花的麦汁中,203、60和198号菌株生长受到一定影响,其中203和60号2株菌OD600值均为4.10,而198号菌株几乎不生长,OD600值仅有1.50,其余菌株生长OD值均高于7.00,属于正常生长范围;203、60和198号菌株均属于P.rarassimilans,这类菌株无法利用麦芽糖,而麦汁中葡萄糖含量仅为10%,碳源不足,导致这几株菌株无法正常生长。当麦汁中酒花苦味值达到20 IBU时,属于P.rarassimilans 的202号菌株的OD600值由8.10下降为4.00,生长受到明显抑制;此外,商用无醇啤酒酵母LA-01的OD600值由7.51下降到6.40,说明酒花的加入对该菌株的生长有所抑制;其余菌株生长曲线波动不大,OD600值高于7.00,均可以正常生长(图2-b);而当麦汁酒花苦味值达到40 IBU时,X-21的OD600值由8.1下降到5.60,其余非酿酒酵母OD600值也下降到4.50左右,LA-01的OD值也由6.40下降到4.20,说明随着酒花添加量的增加,非酿酒酵母生长受到明显抑制,且啤酒酵母W-34/70的OD600值由9.70下降到7.10,生长也受到一定的抑制(图2-c)。所以在制备麦汁的过程中,应注意酒花的添加量,将麦汁的苦味值控制在20 IBU以下,非酿酒酵母才可以正常地生长发酵。此外,P.rarassimilans这类菌株在麦汁中无法正常生长且受酒花抑制效果明显,不适合麦汁发酵体系,故选择另外6株菌株进行后续实验。
2.4.2 糖转化率测定
由于前期筛选得到的无醇啤酒酵母是麦芽糖阴性非酿酒酵母,所以需要对菌株利用麦汁中各种糖组分的具体情况进行测定。麦汁中麦芽糖、异麦芽糖、麦芽三糖、麦芽四糖等物质占60%~70%,葡萄糖占约15%,其他糖如果糖、蔗糖等占10%左右。对筛选的不同菌株进行麦汁发酵实验,结果如表5所示。
表5 不同非酿酒酵母麦汁发酵残糖组分
Table 5 Different non brewing yeast wort fermentation residual sugar components

组别葡萄糖含量/(g/L)果糖含量/(g/L)蔗糖含量/(g/L)麦芽糖含量/(g/L)麦芽三糖含量/(g/L)总糖含量/(g/L)总糖利用率/%麦汁(10°P)10.01±0.21g2.16±0.02c1.24±0.32h69.47±0.04g15.03±0.34c97.91±0.01i—X-210.12±0.03d1.01±0.01i0.72±0.72g59.13±0.33f12.75±0.42b67.73±0.21a30.83±0.14cX-845.21±0.16h2.19±0.24g1.11±0.31f66.73±0.87e14.76±0.71d90.00±0.07g8.08±0.24aX-614.63±0.45a1.83±0.54a1.13±0.25e63.15±0.43b14.02±0.38f84.76±0.19h13.43±0.89i535.40±0.02b1.49±0.13d0.87±0.17d67.20±0.25d13.57±0.41e88.53±0.11c9.58±0.43dX-605.10±0.16c2.01±0.10b0.90±0.20c62.99±0.19i13.8±0.81g84.8±0.36d13.39±0.61b1924.46±0.03e1.44±0.21e0.54±0.02b70.18±0.11h14.16±0.64i90.78±0.49f7.28±0.18eW-34/700.55±0.11f——4.26±0.05a1.32±0.49a6.13±0.15b93.74±0.04gLA-011.26±0.32i0.33±0.08f0.17±0.13a64.59±0.16c13.18±0.33h79.53±0.07e18.77±0.85f
注:数据为“平均值±标准差”;同一列中字母不同的数值表示显著差异(P<0.05);—表示未检出(下同)。
在表5的残糖测定中,除啤酒酵母W-34/70糖利用率可以达到93.74%外,其余的非酿酒酵母糖利用率均偏低,最高X-21菌株为30.83%,最低192号菌株只有7.28%;非酿酒酵母均优先利用葡萄糖、果糖和蔗糖,麦芽糖以及麦芽三糖基本不利用;从残糖测定数据来看,X-21菌株利用了少量麦芽糖,且总糖利用率相较于LA-01来说,X-21糖利用率更高,提高了64.25%。而X-84、53和192号菌株糖利用率均在10%以下,这3株菌在麦汁中糖利用率过低,可能并不能生成其他有利于口感和风味的物质,需要后续进一步测定发酵液的性质。
2.4.3 发酵速率测定
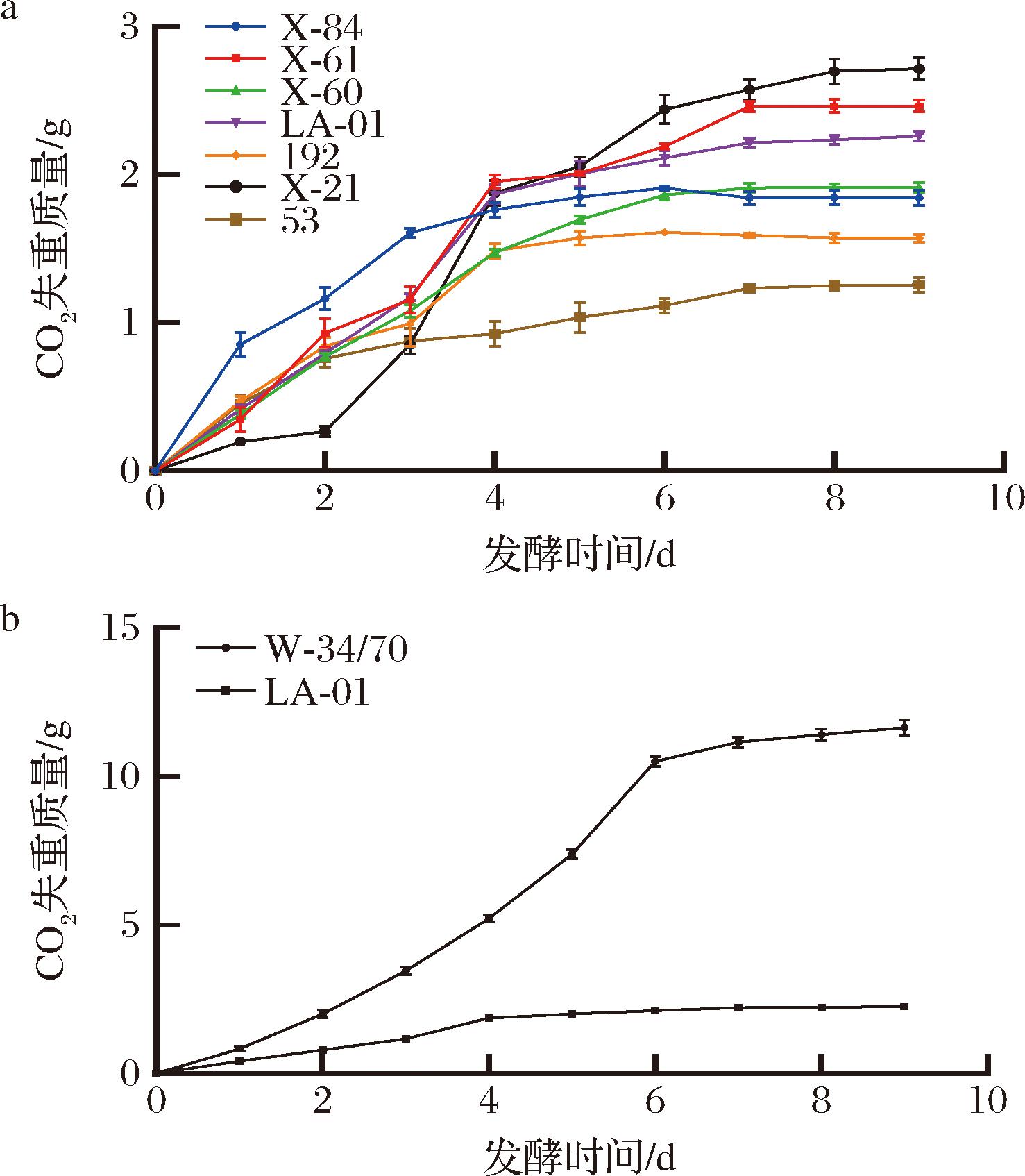
通过每天定时测定发酵液的失重变化,以此推断出菌株的发酵速度、确定菌株发酵的终点以及评估发酵程度。结果如图3所示。
在300 mL麦汁体系中,非酿酒酵母的失重为1.50~2.50 g(图3-a),失重不高,发酵液泡沫不丰富,可能是非酿酒酵母对糖的利用率不高,且非酿酒酵母产乙醇能力较弱,二氧化碳生成量不足,因此发酵液泡沫不丰富。非酿酒酵母在4 d左右会停止失重,而啤酒酵母在6 d左右才会停止失重且失重达到11.00 g左右(图3-b),综上,相较于啤酒酵母,非酿酒酵母的发酵液会出现泡沫不丰富,且口感偏甜的问题;其中X-21菌株失重为2.54 g,发酵速率最快,失重也最高,与残糖量测定的数据吻合。
2.5 发酵液基本理化性质测定
对发酵液基本理化性质进行测定[21],结果如表6所示。以LA-01为对照,筛选出的非酿酒酵母除了X-21发酵度达到20.13%外,其余5株非酿酒酵母发酵度都没有达到10%,发酵度偏低,发酵液口感甜腻,且有麦芽异味,发酵效果较差。LA-01的发酵度仅为11.19%,X-21相较于LA-01发酵度更高,发酵液的甜腻问题有所改善。
表6 不同菌株的发酵液基本理化性质
Table 6 Basic physicochemical properties of fermentation broth from different strains
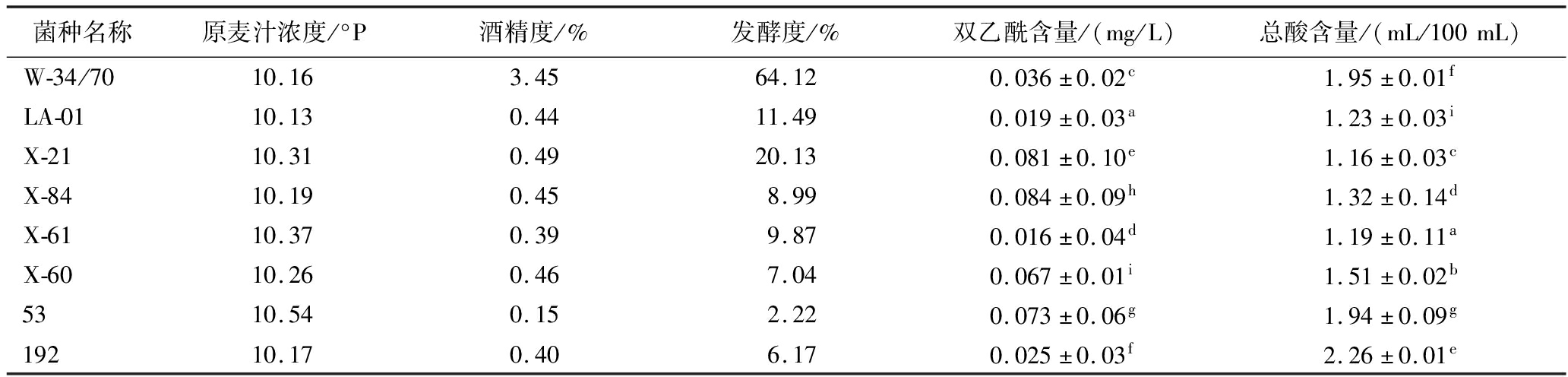
菌种名称原麦汁浓度/°P酒精度/%发酵度/%双乙酰含量/(mg/L)总酸含量/(mL/100mL)W-34/7010.163.4564.120.036±0.02c1.95±0.01fLA-0110.130.4411.490.019±0.03a1.23±0.03iX-2110.310.4920.130.081±0.10e1.16±0.03cX-8410.190.458.990.084±0.09h1.32±0.14dX-6110.370.399.870.016±0.04d1.19±0.11aX-6010.260.467.040.067±0.01i1.51±0.02b5310.540.152.220.073±0.06g1.94±0.09g19210.170.406.170.025±0.03f2.26±0.01e
啤酒中的双乙酰含量是衡量啤酒成熟与否的决定性因素,双乙酰含量过高,啤酒会产生馊饭味[18]。正常淡色啤酒中双乙酰的含量应低于0.1 mg/L,筛选的菌株的发酵液双乙酰含量均低于0.1 mg/L,符合啤酒标准。此外,根据国家标准,10 °P以下麦汁酿造啤酒总酸含量应低于2.2 mL/100 mL,根据测定结果,只有192号菌株总酸含量略高,为2.26 mL/100 mL,其余总酸含量均低于2.2 mL/100 mL,符合国家要求。
2.6 菌株发酵液高级醇和挥发酯检测分析
对发酵液进行风味物质分析,得到初步的感官评价结果。结果如表7所示。相较于LA-01,使用X-21发酵得到的发酵液中乙酸乙酯和乙酸异戊酯含量分别达到21.13 mg/L和5.539 mg/L,而LA-01的发酵液中乙酸乙酯含量为3.54 mg/L以及乙酸异戊酯含量为0.116 mg/L,所以X-21酿造出的无醇啤酒有特殊的香气风味[22]。而其余的非酿酒酵母由于发酵度不高的原因,相关风味物质产生较少,因此麦芽风味较强且有较难以接受的异味;相较于商业啤酒酵母W-34/70酿造的啤酒,X-21酿造的无醇啤酒除乙酸乙酯含量接近外,正丙醇含量为5.71 mg/L、异丁醇含量为6.31 mg/L以及异戊醇含量为14.24 mg/L,高级醇含量偏低,导致无醇啤酒口感的协调性不佳[23],仍需进一步改进。
表7 发酵液基本风味物质测定 单位:mg/L
Table 7 Determination of basic flavor substances in fermentation broth
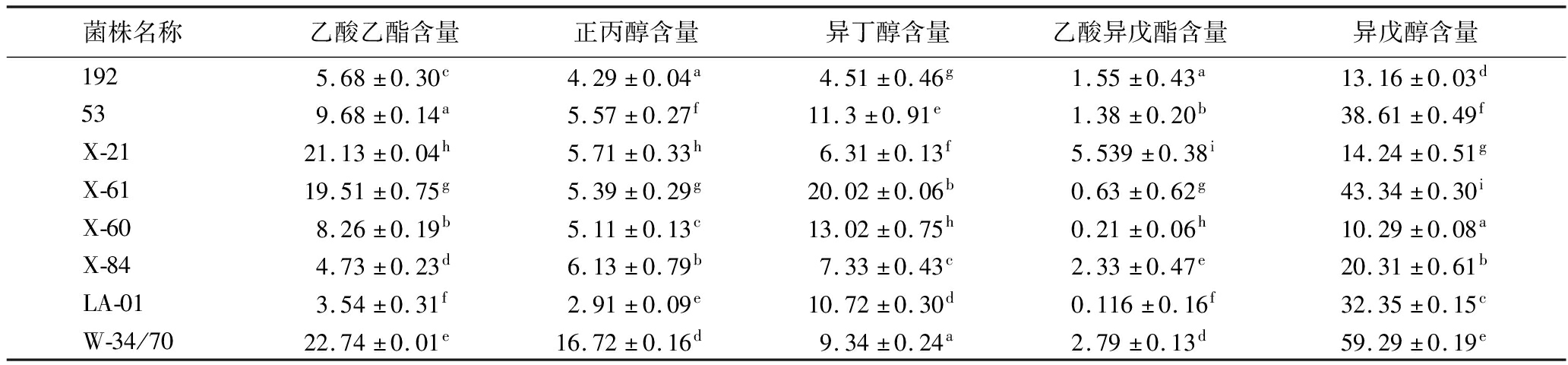
菌株名称乙酸乙酯含量正丙醇含量异丁醇含量乙酸异戊酯含量异戊醇含量1925.68±0.30c4.29±0.04a4.51±0.46g1.55±0.43a13.16±0.03d539.68±0.14a5.57±0.27f11.3±0.91e1.38±0.20b38.61±0.49fX-2121.13±0.04h5.71±0.33h6.31±0.13f5.539±0.38i14.24±0.51gX-6119.51±0.75g5.39±0.29g20.02±0.06b0.63±0.62g43.34±0.30iX-608.26±0.19b5.11±0.13c13.02±0.75h0.21±0.06h10.29±0.08aX-844.73±0.23d6.13±0.79b7.33±0.43c2.33±0.47e20.31±0.61bLA-013.54±0.31f2.91±0.09e10.72±0.30d0.116±0.16f32.35±0.15cW-34/7022.74±0.01e16.72±0.16d9.34±0.24a2.79±0.13d59.29±0.19e
为了对发酵液的风味进行更直观地评价,使用电子舌测定不同菌株发酵液的甜味、酸味、苦味、咸味、鲜味以及后味,并进行对比,结果如图4所示。
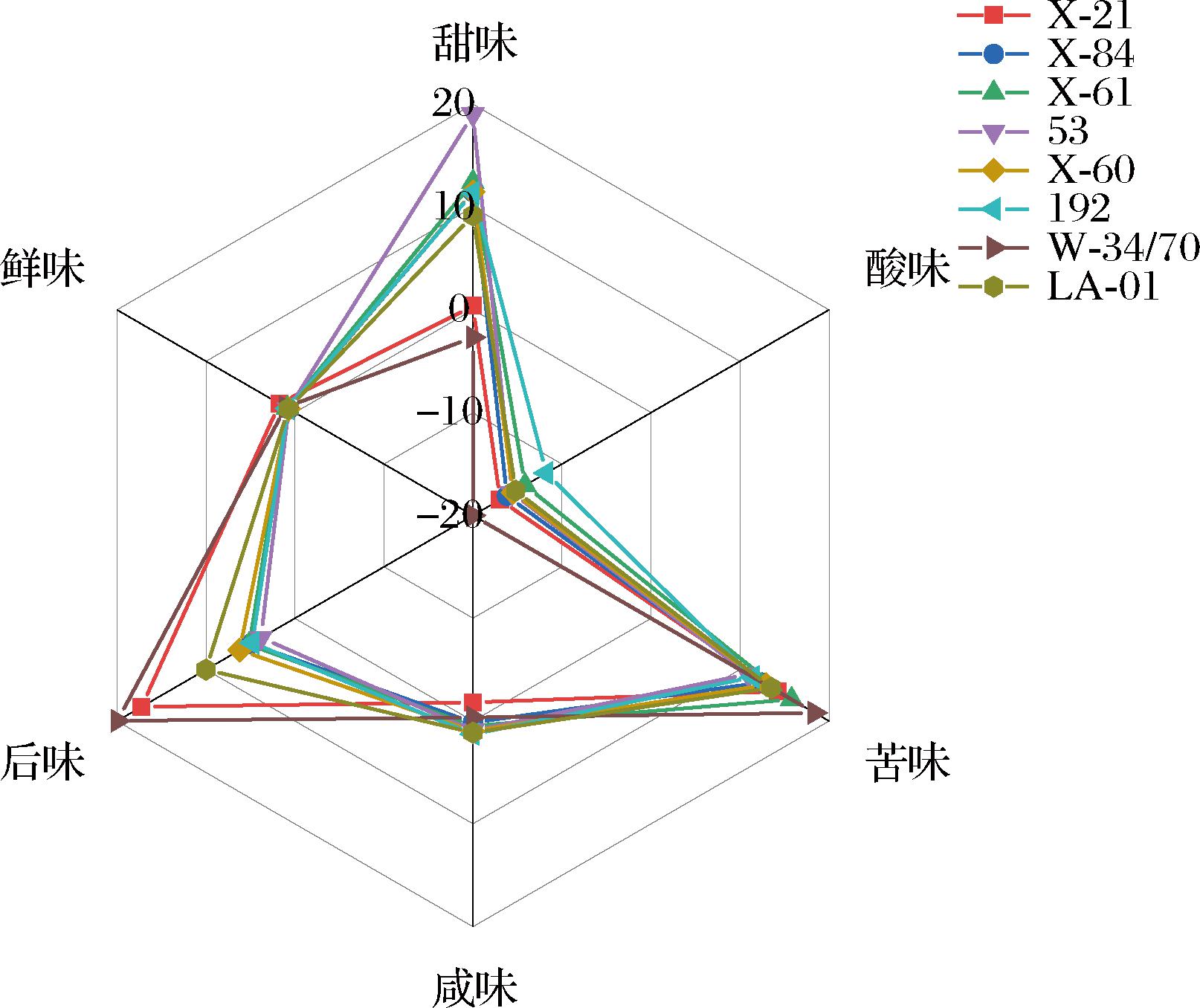
图4 不同菌株发酵液风味雷达图
Fig.4 Radar image of fermentation broth flavor of different bacterial strains
由图4的风味雷达图可以看出,X-21酿造的无醇啤酒的风味集中在后味和苦味,相较于LA-01的酸涩味有较大改善,且X-21酿造的无醇啤酒甜味值较低,与正常啤酒接近,说明发酵液甜腻口感有所改善;与W-34/70相比,甜味值仍较高,其余五味与W-34/70酿造的正常啤酒相近。原因是X-21酿造的无醇啤酒中仍存在部分麦芽糖利用不彻底的现象,因此甜味与正常啤酒相比偏高。而其他5株非酿酒酵母由于发酵度不高,发酵液口感甜腻,风味主要集中于甜味,口感不佳。
为了进一步探究X-21发酵的无醇啤酒中更加详细的风味构成,本文在基础风味分析的基础之上,利用GC-MS测定了X-21发酵液中的各风味成分,以商用LA-01菌株的发酵液以及市售无醇啤酒为对照,结果如附表1所示。除气相测定的5种风味物质之外,发现X-21发酵的无醇啤酒中辛酸甲酯以及丁酸乙酯含量也较高,分别为35.37 mg/L以及25.72 mg/L,两者均为果香风味贡献物质,相较之下,LA-01的发酵液中丁酸乙酯含量较低,仅为1.02 mg/L。其他类物质如吡嗪类在3个样品中含量均不高,含量低于1 mg/L。乙醛对啤酒风味有很大影响,是构成啤酒生青味的主要物质之一,形成啤酒不纯正,不协调的苦味和气味。但是在3个样品中,均未检测到乙醛。但是市售无醇啤酒以及LA-01的总醛含量偏高,分别为72 mg/L 和60 mg/L,X-21的总醛含量仅为28 mg/L。醇酯比是衡量啤酒品质的重要指标,正常啤酒的醇酯比应该在3.0~5.0[18],但是本文测定出X-21以及LA-01的醇酯比均在1左右,市售无醇啤酒也仅有1.2,醇酯比偏低。与正常啤酒中的醇酯比相差较大。
在筛选得到的6株菌株中,X-21的糖利用率更高,因此发酵度更高,发酵液的甜腻口感以及麦芽异味减轻,发酵液有特殊的花果香气,接受度更高,符合市场对无醇啤酒的需求。与啤酒酵母W-34/70相比,风味物质含量更为接近,更加接近传统啤酒的定义。因此,最终选取X-21作为无醇啤酒生产菌株进行下一步的实验。
3 总结与展望
从各种水果来源中筛选产香能力较强,且产乙醇能力较弱的菌株,以期作为生产新型口感风味的无醇啤酒的潜力菌株。经过一系列筛选,从富集到的682株菌株中筛选到10株符合筛选条件的潜力菌株。随后潜力菌株在麦汁中进行发酵性能测试、发酵液基本理化指标和基本风味物质的测定,最终筛选出一株产独特花果香风味,且发酵度更高的非酿酒酵母X-21。该菌株在酒花耐受性测试下可以正常在苦味值为50 IBU的麦汁中生长,该菌株相较于商用无醇啤酒酵母LA-01,发酵度达到20.13%,提高了75.16%且可以利用10%左右的麦芽糖,总糖利用率提高64.25%,有效缓解了限制发酵法生产无醇啤酒最后成品口感甜腻的问题,且发酵液呈现特殊的花果香气具有生产新型风味无醇啤酒的潜力。但是由于单菌发酵,发酵液仍存在一些口感问题,后续考虑接入其他类型的菌株改善风味,同时改进麦汁制备工艺以匹配生产条件。
[1] BELLUT K, ARENDT E K.Chance and Challenge:Non-Saccharomyces yeasts in nonalcoholic and low alcohol beer brewing—A review[J].Journal of the American Society of Brewing Chemists, 2019, 77(2):77-91.
[2] BASSO R F, ALCARDE A R, PORTUGAL C B.Could non-Saccharomyces yeasts contribute on innovative brewing fermentations?[J].Food Research International, 2016, 86:112-120.
[3] 王笑语, 陈晶瑜, 马长伟.非酿酒酵母在多元化啤酒酿造应用中的研究进展[J].食品与发酵工业, 2024, 50(10):362-370.WANG X Y, CHEN J Y, MA C W.Application of non-Saccharomyces in diversified beer brewing:A review[J].Food and Fermentation Industries, 2024, 50(10):362-370.
[4] 周广田, 赵文娟, 白立勇.无醇啤酒生产新工艺的研究[J].酿酒科技, 2007(4):104-106;108.ZHOU G T, ZHAO W J, BAI L Y.Study on the improved brewing-process of alcohol-free beer[J].Liquor-Making Science &Technology, 2007(4):104-106;108.
[5] MICHEL M, MEIER-DÖRNBERG T, JACOB F, et al.Review:Pure non-Saccharomyces starter cultures for beer fermentation with a focus on secondary metabolites and practical applications[J].Journal of the Institute of Brewing, 2016, 122(4):569-587.
[6] ANDERSON H E, SANTOS I C, HILDENBRAND Z L, et al.A review of the analytical methods used for beer ingredient and finished product analysis and quality control[J].Analytica Chimica Acta, 2019, 1085:1-20.
[7] 胡华勇, 方志远, 周阿蕙.纯发酵法酿造无醇啤酒的工艺研究[J].中外酒业·啤酒科技, 2020(7):24-26.HU H Y, FANG Z Y, ZHOU A H.Research on the process of brewing non-alcoholic beer using pure fermentation method[J].Chinese and foreign liquor industry, 2020(7):24-26.
[8] PERP TE P, COLLIN S.Influence of beer ethanol content on the wort flavour perception[J].Food Chemistry, 2000,71(3):379-385.
TE P, COLLIN S.Influence of beer ethanol content on the wort flavour perception[J].Food Chemistry, 2000,71(3):379-385.
[9] MICHEL M, KOPECK J, MEIER-DÖRNBERG T, et al.Screening for new brewing yeasts in the non-Saccharomyces sector with Torulaspora delbrueckii as model[J].Yeast, 2016, 33(4):129-144.
J, MEIER-DÖRNBERG T, et al.Screening for new brewing yeasts in the non-Saccharomyces sector with Torulaspora delbrueckii as model[J].Yeast, 2016, 33(4):129-144.
[10] 李海峰, 李砷, 牟志勇, 等.非酿酒酵母在酒类酿造过程中的微生物相互作用及功能特性研究进展[J].食品与发酵工业, 2024, 50(7):313-323.LI H F, LI S, MOU Z Y, et al.Research progress on microbial interaction and functional characteristics of non-Saccharomyces yeast in wine brewing process[J].Food and Fermentation Industries, 2024, 50(7):313-323.
[11] DURGA PRASAD C G, VIDYALAKSHMI R, BASKARAN N, et al.Influence of Pichia myanmarensis in fermentation to produce quinoa based non-alcoholic beer with enhanced antioxidant activity[J].Journal of Cereal Science, 2022,103:103390.
[12] 李凯, 王金晶, 李永仙, 等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业, 2019,45(5):115-120.LI K K, WANG J J, LI Y X, et al.Screening and identification of yeast strain for red pitaya wine fermentation[J].Food and Fermentation Industries, 2019,45(5):115-120.
[13] 刘杨.特殊酵母发酵生产无醇啤酒的研究[D].泰安:山东农业大学, 2013.LIU Y.Research on the production of alcoholic beer by special yeast fermentation[D].Taian:Shandong Agricultural University, 2013.
[14] ELLIS D J, KERR E D, SCHENK G, et al.Metabolomics of non-Saccharomyces yeasts in fermented beverages[J].Beverages, 2022, 8(3):41.
[15] 胡荣飞, 陈璐瑶, 张小妮, 等.利用研磨仪快速提取基因组DNA用于PCR[J].生物技术通讯, 2019,30(5):668-673.HU R F, CHEN L Y, ZHANG X N, et al.Rapid extraction genomic DNA for PCR by grinding mill[J].Letters in Biotechnology, 2019,30(5):668-673.
[16] PIERMARINI S, VOLPE G, ESTI M, et al.Real time monitoring of alcoholic fermentation with low-cost amperometric biosensors[J].Food Chemistry, 2011, 127(2):749-754.
[17] 徐亚男,李琦,刘秋萍,等.新疆葡萄酒产区非酿酒酵母菌研究进展[J].食品工业.2015,36 (1):266-270.XU Y N,LI Q, LIU Q P, et al.Research progress of non-Saccharomyces yeasts in Xinjiang[J].Food Industry, 2015, 36(1):266-270.
[18] METHNER Y, MAGALH ES F, RAIHOFER L, et al.Raihofer, et al.Beer fermentation performance and sugar uptake of Saccharomycopsis fibuligera-A novel option for low-alcohol beer[J].Frontiers in Microbiology, 2022, 13:1011155.
ES F, RAIHOFER L, et al.Raihofer, et al.Beer fermentation performance and sugar uptake of Saccharomycopsis fibuligera-A novel option for low-alcohol beer[J].Frontiers in Microbiology, 2022, 13:1011155.
[19] MATRAXIA M, ALFONZO A, PRESTIANNI R, et al.Non-conventional yeasts from fermented honey by-products:Focus on Hanseniaspora uvarum strains for craft beer production[J].Food Microbiology, 2021, 99:103806.
[20] BR NYIK T, SILVA D P,
NYIK T, SILVA D P, ![]() M, et al.A review of methods of low alcohol and alcohol-free beer production[J].Journal of Food Engineering, 2012, 108(4):493-506.
M, et al.A review of methods of low alcohol and alcohol-free beer production[J].Journal of Food Engineering, 2012, 108(4):493-506.
[21] SENKARCINOVA B, GRAÇA DIAS I A, NESPOR J, et al.Probiotic alcohol-free beer made with Saccharomyces cerevisiae var.boulardii[J].LWT, 2019, 100:362-367.
[22] 赵剑雷, 邱树毅, 王晓丹, 等.异常威克汉姆酵母与酿酒酵母在混合发酵中的相互作用机制[J].食品科学, 2022, 43(16):201-208.ZHAO J L, QIU S Y, WANG X D, et al.Interaction mechanism of Wickerhamomyces anomalus and Saccharomyces cerevisiae in mixed culture fermentation[J].Food Science, 2022, 43(16):201-208.
[23] GARC A-MART
A-MART N N, PEREZ-MAGARI
N N, PEREZ-MAGARI O S, ORTEGA-HERAS M, et al.Sugar reduction in musts with nanofiltration membranes to obtain low alcohol-content wines[J].Separation and Purification Technology, 2010, 76(2):158-170.
O S, ORTEGA-HERAS M, et al.Sugar reduction in musts with nanofiltration membranes to obtain low alcohol-content wines[J].Separation and Purification Technology, 2010, 76(2):158-170.