常山胡柚(Citrus paradis. cv.changshan huyou)由酸橙与柚自然杂交而成,是原产浙江常山地理标志产品保护范围内的一种杂种柚,因其果色金黄、口感清爽,深受广大消费者的青睐。同时,胡柚的药用历史悠久,含有多种活性成分,例如黄酮类化合物、挥发性化合物、柠檬苦素类化合物等[1-3]。研究发现胡柚具有抗菌、抗氧化和降血脂等多种药理作用[4-6]。
胡柚蜂蜜是蜜蜂采集胡柚植物的花蜜与自身分泌物混合酿造的单花蜂蜜。优质的胡柚蜂蜜呈现浅琥珀色,低温结晶后呈奶白色、且结晶细腻,其口感清甜、具有独特的柚子清香。受胡柚种植规模的影响,高品质的胡柚蜂蜜产量有限,售价也远高于市场上的普通蜂蜜。胡柚蜂蜜作为一种新开发的地方特色蜜种,由于研究较少,其理化性质和特征成分尚不明确。因此,明确优质胡柚蜂蜜的营养品质,开发一种胡柚蜂蜜种类鉴别的方法,可有助于这种地方特色蜂蜜品牌推广和正确引导市场消费。
常见的单花蜂蜜鉴别方法有花粉鉴别和化学物质鉴定。利用花粉形态鉴别蜂蜜种类是一种常见的蜂蜜种类判别手段,蜂蜜中花粉成分能够最直观地反映蜂蜜的植物来源,通常某种蜂蜜中单一花粉率大于45%即可认定是某个品种的单花种蜂蜜[7]。但花粉形态的鉴定需要检测人员具有丰富的经验和良好的判断,且花粉形态容易混淆,易造成不确定的结果[8]。目前,越来越多的研究表明,特征化学物质能够表征蜂蜜的植物来源,常见的特征成分有糖类[9]、酚类物质[10]、挥发性化合物[11]、含氮化合物[12]及其他微量元素[13]等。例如,黄酮类化合物羟基红花黄色素A可用作红花蜜鉴定的可靠特征物[14];9种特征性挥发成分可以用于希腊柑橘蜜、杉树蜜、松树蜜和百里香蜜这4种蜂蜜的花源鉴别[15];而ZHANG等[16]通过1个植物衍生蛋白和2个意蜂衍生蛋白对枣花蜜的花源进行判定。因此,挖掘单花蜜中标志性化合物,通过标志性化合物建立单花蜜的真实性评价方法能够实现单花蜜种类判别。
本研究鉴定了胡柚蜂蜜中的花粉形态,对其各项理化指标(水分、糖分、淀粉酶值、游离氨基酸)进行检测和分析。通过固相萃取技术(solid-phase extraction,SPE)富集胡柚蜂蜜中的化合物成分,运用超高效液相色谱-串联高分辨质谱仪(ultra performance liquid chromatography-tandem high resolution mass spectrometer, UPLC-HRMS)对胡柚蜂蜜中的小分子化合物进行成分分析,并与其他4种中国常见蜂蜜(包括洋槐蜂蜜、椴树蜂蜜、枣花蜂蜜和荆条蜂蜜)进行比较,挖掘胡柚蜂蜜中的标志性化合物,对其在胡柚蜂蜜中的含量进行定量分析,研究结果将为胡柚蜂蜜的品质特征和种类鉴别提供理论依据。
1 材料与方法
1.1 材料与试剂
胡柚蜂蜜于2023年和2024年采集于浙江省衢州市柯城区航埠镇蜂场、衢州市柯城区石梁镇蜂场以及衢州市衢江区云溪乡蜂场,共计9个批次,每个批次2瓶(500 g/瓶);洋槐蜂蜜、椴树蜂蜜、枣花蜂蜜、荆条蜂蜜均采自合作蜂场,各5个批次,每个批次1瓶(500 g/瓶)。样本分析前于2~8 ℃保存。
甲醇(AR),广东光华科技公司;甲酸(AR≥98%),北京百威灵科技公司;果糖、葡萄糖、蔗糖、18种氨基酸混合标准液(2.5 mol/L)、新橙皮苷(CAS:13241-33-3,HPLC≥98%)、柠檬苦素(CAS:1180-71-8,HPLC≥98%),上海源叶生物科技有限公司。
1.2 仪器与设备
SU8010冷场发射扫描电镜,日本日立公司;BX41生物显微镜,奥林巴斯(中国)有限公司;阿贝折光仪,北京万成北增精密仪器有限公司;UV-2550型紫外-可见分光光度计,日本岛津公司;AdvanceBio 氨基酸分析AAA液相色谱柱(4.6 mm×100 mm, 2.7 μm)、1200高效液相色谱仪-荧光检测器(high performance liquid chromatography-fluorescence detector,HPLC-FLD)、ZORBAX Eclipse Plus C18快速分离色谱柱(3.0 mm×150 mm, 1.8 μm),美国Agilent Technologies公司;ACQUITY UPLC BEH Amide色谱柱(150 mm×2.1 mm, 1.7 μm)、2695高效液相色谱仪-示差折光检测器(high performance liquid chromatography-refractive index detector, HPLC-RID)、Waters oasis HLB固相萃取柱,美国waters公司;超高效液相色谱-串联高分辨质谱仪(UPLC-Q-Exactive Orbitrap MS),美国Thermo Fisher公司。
1.3 实验方法
1.3.1 胡柚蜂蜜孢粉学鉴定
通过对胡柚花花粉以及胡柚蜂蜜样品中花粉的电镜图进行对比,确定胡柚蜂蜜的真实性,操作方法如下:称取20 g蜂蜜样品,加20 mL超纯水溶解后,8 000 r/min离心5 min。随后弃去上清液,加入10 mL超纯水充分清洗后再次离心3 min。重复清洗步骤3~4次,将剩余花粉用1 mL清水复溶后置于干燥培养皿中蒸干水分,用导电胶将样品粘结在样品台上,进行镀膜处理后放入扫描电镜中观察花粉形态。
参照GB/T 23194—2008《蜂蜜中植物花粉的测定方法》,按公式(1)对胡柚蜂蜜花粉率进行计算:
花粉率![]()
(1)
1.3.2 理化指标分析
1.3.2.1 水分含量
参照SN/T 0852—2012《进出口蜂蜜检验规程》,使用阿贝折光仪对胡柚蜂蜜的水分含量进行测定。
1.3.2.2 糖类含量
参照GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》对胡柚蜂蜜中糖类含量进行测定。称取2.000 g蜂蜜样品(精确到0.001 g),加纯水定容至50 mL,充分溶解,8 000 r/min离心15 min,取上清液过0.22 μm滤膜,待HPLC-RID检测。
1.3.2.3 淀粉酶活性测定
参照GB/T 18932.16—2003《蜂蜜中淀粉酶值的测定方法 分光光度法》。该方法以10%(质量分数)蜂蜜水溶液中的酶水解1%(质量分数)淀粉的速率进行判定。使用紫外分光度计于660 nm波长处测定反应溶液吸光度值,记录达到特定吸光度所需时间,直至吸光度小于0.235。以时间为横坐标,吸光度为纵坐标做直线,按公式(2)对胡柚蜂蜜的淀粉酶活性进行计算:
(2)
式中:X为淀粉酶活性,mL/(g·h);t为吸光度为0.235时对应的时间,min。
1.3.2.4 游离氨基酸含量
参照SN/T 5223—2019《蜂蜜中18种游离氨基酸的测定 高效液相色谱-荧光检测法》用HPLC-FLD分析测定。称取3.00 g胡柚蜂蜜(精确到0.01 g),加纯水定容至50 mL,混合均匀,离心后,0.22 μm滤膜过滤。液相色谱条件:进样量5.0 μL,柱温40 ℃。色谱柱:AdvanceBio 氨基酸分析 AAA液相色谱柱(4.6 mm×100 mm,2.7 μm)。流动相A:磷酸二氢钠缓冲溶液,流动相B:V(乙腈)∶V(甲醇)∶V(水)=45∶45∶10。荧光检测波长:1~11.4 min:λex=340 nm,λem=450 nm,11.5~18 min:λex=230 nm,λem=305 nm。本方法依据氨基酸标准品的保留时间和蜂面积,对样品中各氨基酸进行定性和定量测定。18种氨基酸的混合标准溶液以流动相A稀释成浓度为25.0 nmol/mL的标准工作液进样检测。
1.3.3 蜂蜜非靶向代谢组鉴定
通过SPE小柱进行蜂蜜样品的前处理,结合超高效液相色谱串联高分辨质谱仪,对胡柚蜂蜜、洋槐蜂蜜、椴树蜂蜜、枣花蜂蜜、荆条蜂蜜几种蜂蜜的小分子化合物进行非靶向代谢组学研究,分析胡柚蜂蜜中标志性成分。
采用ZHAO等[17]的方法并进行一定优化,对蜂蜜样品进行前处理:称取2.50 g(精确到0.01 g)蜂蜜样品,加5.0 mL纯水充分溶解,8 000 r/min离心10 min,保留上清液;按说明书活化固相萃取小柱后,用固相萃取柱对上清液进行成分富集,水洗后充分除去小柱中的水分;最后3 mL甲醇洗脱,氮气吹干;加入1 mL 80%(体积分数)甲醇溶液复溶,0.22 μm滤膜过滤,装至进样瓶中用于分析。质量控制(quality control,QC)样品是5种单花蜜样品上机液的等量混合,用于监测分析系统的稳定性。
液相参数:样品进样量2.0 μL、总流速0.3 mL/min,柱温箱温度40 ℃。色谱柱:ZORBAX Eclipse Plus C18快速分离色谱柱(3.0 mm×150 mm,1.8 μm)。流动相:A为水(含0.1%甲酸,体积分数),B为甲醇。梯度洗脱方法:0~0.5 min,5% B;0.5~4 min,5%~40% B;4.0~12 min,40%~95% B;12~16 min,95% B;16~20 min,5% B。每5个样品进1针QC样品,用于检测系统的稳定性。
质谱参数:采用High Energy Spark-Induced电喷雾离子化方式,喷雾电压大小为正极3.5 kV,负极3.0 kV。毛细管温度为320 ℃,加热器温度为350 ℃,鞘内气体流速为40 arb,在正离子和负离子切换模式下采集数据。采集范围m/z为80~1 200。AGC target自动增益控制目标离子数为1×105;最大离子注入时间为50 ms。扫描分辨率为17 500;离子碰撞能量为20、30、40 eV。一级全扫描(full scan),用于定量分析,二级数据依赖性扫描(full MS/dd-MS2),用于化合物的定性分析。MS数据由Xcablibur软件(Thermo Fisher Scientific)收集并保存为Raw格式文件。
1.3.4 胡柚蜂蜜标志性成分定性分析
利用Compound Discoverer 3.3软件对原始数据进行保留时间校正、峰面积提取、峰归类、填补空缺值、峰面积校正等分析。检索Mzcloud、Chemspider数据库,综合保留时间(retention time,RT)、一级质谱、二级质谱等信息对未知代谢物进行鉴定。使用SIMCA 14.1软件进行多变量统计分析,利用相对峰强度执行主成分分析(orthogonal principal component analysis,PCA)和偏最小二乘判别分析(partial least squares discriminant analysis,OPLS-DA)。对OPLS-DA模型进行置换检验(permutation test)来确保模型的稳定性和可靠性。最后利用变量重要性投影计算(variable importance in projection,VIP)>1、单变量统计分析(P<0.01)和倍性变化(fold change,FC)>2筛选具有统计学意义的胡柚蜂蜜差异代谢物。通过比对蜂蜜样品与标准品的提取离子色谱图及碎片离子信息,最终确定目标化学成分及其分子结构。
1.3.5 胡柚蜂蜜标志性成分定量分析
为了确定胡柚蜂蜜中新橙皮苷与柠檬苦素的含量,针对这2种化合物,建立了一种基于UPLC-HRMS的外标定量方法:称取一定质量的新橙皮苷、柠檬苦素标准品,配制成10 mL标准品混合储备液(10.000 mg/L),逐级稀释成0.125、0.250、0.500、1.000、2.000、4.000 mg/L的溶液备用。
采用全扫描质谱-平行反应监测(full-scan mass spectrometry-parallel reaction monitoring, FullMS-PRM)方法对标准品溶液与经1.3.3节前处理后的胡柚蜂蜜样品进行目标特征物离子的定性和定量,数据采集模式及参数与1.3.3节中全扫模式基本一致,在inclusion信息部分填入新橙皮苷与柠檬苦素准确的m/z值,其中新橙皮苷为负电离模式,扫描时间范围9.00~11.00 min,离子碰撞能量30 eV;柠檬苦素为正电离模式,扫描时间10.30~12.30 min,离子碰撞能量30 eV。质谱部分通过Xcalibur软件收集MS/MS数据并保存为Raw格式文件。使用Xcalibur软件进行目标物含量计算,以标准品上样质量浓度(mg/L)为横坐标x,峰面积为纵坐标y构建校准曲线,根据胡柚蜂蜜样品中特征物离子的峰面积计算胡柚蜂蜜中新橙皮苷与柠檬苦素的含量。
2 结果与分析
2.1 胡柚蜂蜜基本理化性质分析
胡柚是浙江省衢州地区特有的地方良种,种植面积广且分布集中;胡柚每年4月中旬至5月初开花,花期约20 d,其花为白色的总状花序,开花时柚花飘香且大量流蜜,非常适合西方蜜蜂集中采集,因而能够形成量产商品化的胡柚单花蜂蜜。检测蜂蜜中的花粉形态特征和相对含量是鉴别蜂蜜溯源鉴别的可靠手段。通过扫描电镜对胡柚蜂蜜的花粉与胡柚花的花粉进行了比较。结果表明胡柚的花粉孢子与胡柚蜂蜜中代表性花粉的孢子形状相同,都呈长球形和等极形,表面为负网状,有4个萌发孔,其结构具有典型的孢粉学特征,如图1所示。本研究所用胡柚蜂蜜中的单一花粉率均大于60%。根据花粉率和花粉形态特征可以判定实验蜂蜜是单花胡柚蜂蜜。

a-胡柚花粉孢子;b-胡柚蜂蜜花粉孢子
图1 胡柚蜂蜜花粉孢子的SEM(×2 500) 图
Fig.1 The SEM(×2 500) photograph of Huyou honey palynological analysis
蜂蜜的各项理化指标是蜂蜜最基础的品质特征。蜂蜜的基本理化指标包括水分含量、糖类、淀粉酶活性等。胡柚的基本理化指标测定结果见表1。
表1 胡柚蜂蜜理化指标
Table 1 Physical and chemical indexes of honey

理化指标含量葡萄糖/(g/100g)35.66±2.15果糖/(g/100g)40.37±1.22果葡比1.14±0.10蔗糖/(g/100g)ND水分含量/%19.84±0.20淀粉酶活性/[mL/(g·h)]20.32±1.57氨基酸/(mg/kg)脯氨酸456.50±29.07甲硫氨酸75.48±5.23赖氨酸40.19±12.17谷氨酰胺22.54±6.01苯丙氨酸21.65±4.89谷氨酸15.03±3.36天冬氨酸13.95±3.83丝氨酸12.72±1.51缬氨酸9.79±1.36精氨酸9.60±1.41组氨酸9.37±1.18丙氨酸8.45±2.58酪氨酸8.34±1.74甘氨酸7.45±0.65苏氨酸6.10±0.67亮氨酸5.28±0.96异亮氨酸4.75±2.58色氨酸1.42±0.44
注:ND表示未检出。
本研究中所检测的胡柚蜂蜜属于自然成熟蜂蜜,其水分含量为19.58%~20.16%,符合国标对优质蜂蜜的要求。而根据GB 14963—2011《食品安全国家标准 蜂蜜》对蜂蜜品质的要求判断,胡柚蜂蜜是一种品质较高的单花蜂蜜。胡柚蜂蜜的果糖和葡萄糖总含量平均值为75.67 g/100 g,而蔗糖均未检出,符合国家标准规定。果糖与葡萄糖含量的比值称为果葡比(F/G),通常蜂蜜中果葡比一般为1.0~1.7,由于葡萄糖的水溶性小于果糖,因此果糖与葡萄糖比值越低,蜂蜜越易产生结晶,比值高于1.3时结晶变得相对缓慢[18]。本研究中的胡柚蜂蜜的果葡比为1.14,在4 ℃贮藏7 d后呈现出奶白色结晶状态。
淀粉酶是蜂蜜中天然存在的特有成分,其活性常被用作衡量蜂蜜的新鲜度,能够作为蜂蜜贮藏时间的指标,酶值越高一定程度上代表蜂蜜品质越好。根据我国行业标准GH/T 18796—2012《蜂蜜》规定,蜂蜜中淀粉酶活性(1%淀粉溶液,质量分数)≥4 mL/(g·h),本研究中胡柚蜂蜜的淀粉酶活性均值为(20.32±1.57) mL/(g·h),远超行业标准,证明了实验所用样品为新鲜的胡柚蜂蜜。
氨基酸是构成蛋白质的基本组成成分,是蜂蜜中营养物质的主要来源之一[19]。蜂蜜中氨基酸主要来源于花粉和花蜜,其约占蜂蜜的1%。本研究对胡柚蜂蜜中的18种游离氨基酸进行了定量检测,总含量为(723.03±40.60) mg/kg,其中脯氨酸的含量最高,平均值为(456.50±29.07) mg/kg,其次为甲硫氨酸和赖氨酸,含量分别为(75.48±5.23) mg/kg和(30.86±9.27) mg/kg。蜂蜜中脯氨酸的含量不仅被作为衡量蜂蜜中游离氨基酸含量的标准,也是评价蜂蜜成熟度和掺假现象的重要理化指标,一般认为,天然蜂蜜的脯氨酸含量不应低于180 mg/kg[20]。本研究中,胡柚蜂蜜中的脯氨酸含量占游离氨基酸总量的60%以上,与前人研究测定的洋槐蜜[21-22],枣花蜂蜜[22],以及云南5种特色蜂蜜[23]中脯氨酸的含量比例结果一致。
蜜源植物是主要影响蜂蜜中氨基酸种类和含量的因素,不同蜂蜜中氨基酸的种类、含量存在一定差异[22]。甲硫氨酸在云南澳洲坚果蜜、咖啡蜜、米团花蜜、苕子蜜和橡胶蜜中均未检出[23],而在福建省南平地区飞龙掌血蜂蜜中的含量为(36.79±8.45) mg/kg[19]。胡柚蜂蜜中甲硫氨酸的含量稳定,仅次于脯氨酸。甲硫氨酸为苦味氨基酸,胡柚蜂蜜中甲硫氨酸的高含量与胡柚甘中微苦的口感相关。而赖氨酸为鲜味氨基酸,甲硫氨酸和赖氨酸的高含量也是胡柚蜂蜜独特风味形成的因素。
2.2 胡柚蜂蜜中标志性成分鉴定
由于胡柚蜂蜜与其他大众蜜源的蜂蜜具有相似的理化性质以及感官特性,本研究采用UPLC-HRMS方法对4种我国常见蜂蜜(洋槐蜂蜜、椴树蜂蜜、枣花蜂蜜和荆条蜂蜜)与胡柚蜂蜜进行了非靶向小分子化合物的分析。现代的UPLC-HRMS技术能够对蜂蜜中小分子化合物代谢物信息进行全面获取,并结合化学计量学方法探究蜂蜜的标志性成分,是一种宏观非靶向的蜂蜜种类区分方法,表现出准确性更高、灵敏度更好的优点[24]。胡柚蜂蜜样品的总离子色谱图如图2所示。

图2 胡柚蜂蜜总离子色谱图
Fig.2 Total ion chromatogram photograph of Huyou honey
匹配数据库后的初始数据,以保留时间和峰图为标准进行结果去冗余,在胡柚蜂蜜、枣花蜂蜜、洋槐蜂蜜、椴树蜂蜜、荆条蜂蜜这5种蜂蜜的共计29个样品中鉴定到3 392种小分子化合物。通过PCA对数据进行特征降维,降低样本复杂性的同时提高了准确度[25]。通过PCA,所得结果如图3-a所示,主成分1和主成分2的方差贡献率分别为44.9%和13.3%,所有样品点均在95%置信区间内,并呈现良好的聚类,可知胡柚蜂蜜与其他蜂蜜样本完全分离,表明胡柚蜂蜜与其他蜂蜜之间存在明显的差异。为进一步验证胡柚蜂蜜的独特性,将蜂蜜分为胡柚蜂蜜和其他蜂蜜两组,基于T检验的火山图来筛选胡柚蜂蜜的特征组分。通过单因素方差分析(P<0.01)以及差异倍数(FC>2)处理,分析不同品质蜂蜜之间的差异,结果用火山图进行可视化表示图3-b,共筛选出283个上调特征化合物,表示其在胡柚蜂蜜中的表达量相对其他蜂蜜是2倍以上。
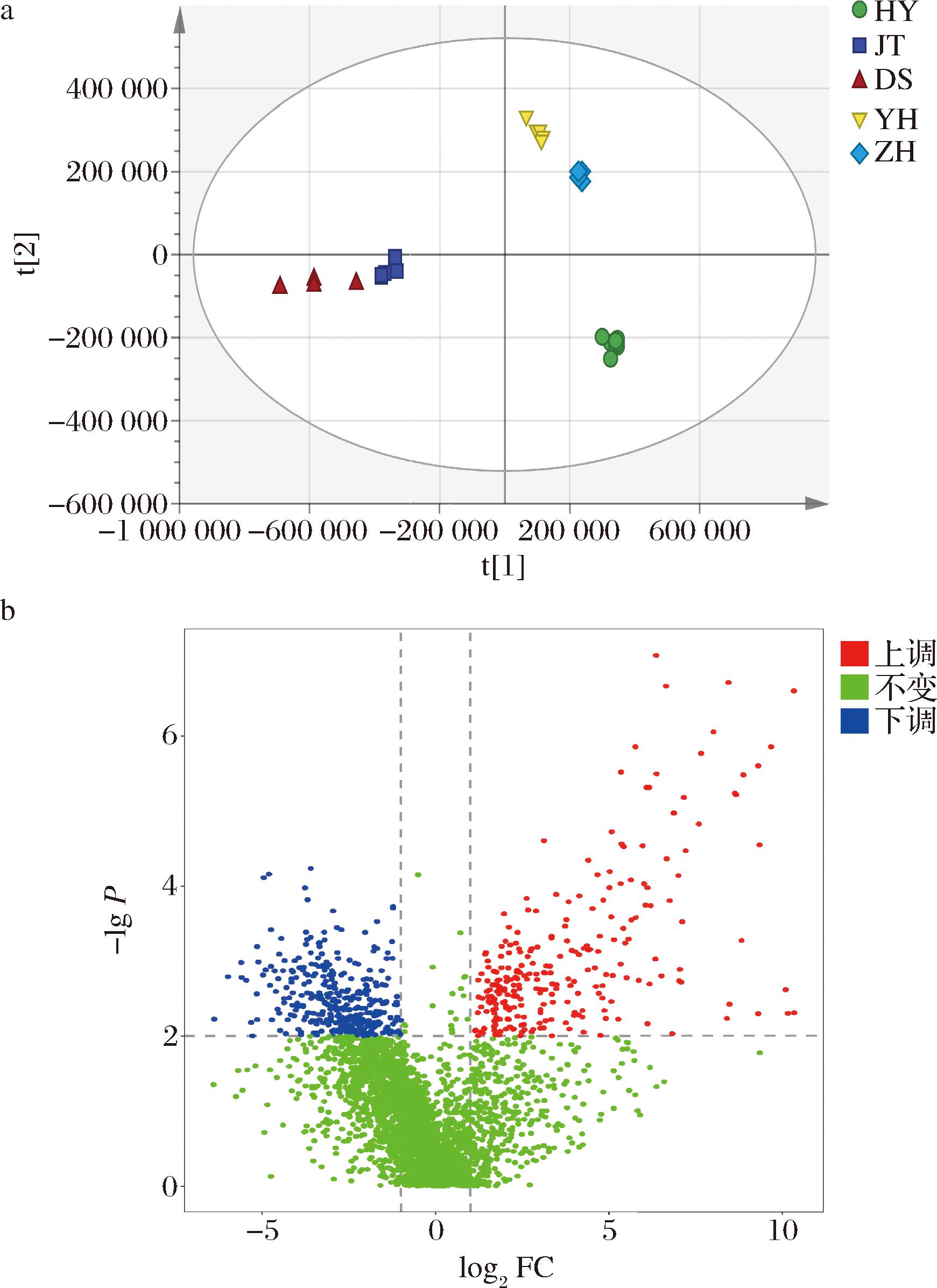
a-5种蜂蜜的主成分分析图(“HY”表示胡柚蜂蜜;“JT” 表示荆条蜂蜜;“DS” 表示椴树蜂蜜;“YH” 表示洋槐蜂蜜;“ZH” 表示枣花蜂蜜);b-胡柚蜂蜜与其他蜂蜜非靶向代谢物分布火山图(P<0.01)
图3 蜂蜜代谢组学多元统计分析
Fig.3 Multivariate statistical analysis of honey metabolomics data
进一步通过OPLS-DA对胡柚蜂蜜进行分析,绘制得分图(图4-a)并对模型进行200次置换检验验证模型准确率(图4-b),其中R2斜率大于0,Q2在y轴上的截距小于0.05(-0.438),说明模型的预测能力较好,且没有过度拟合[26]。
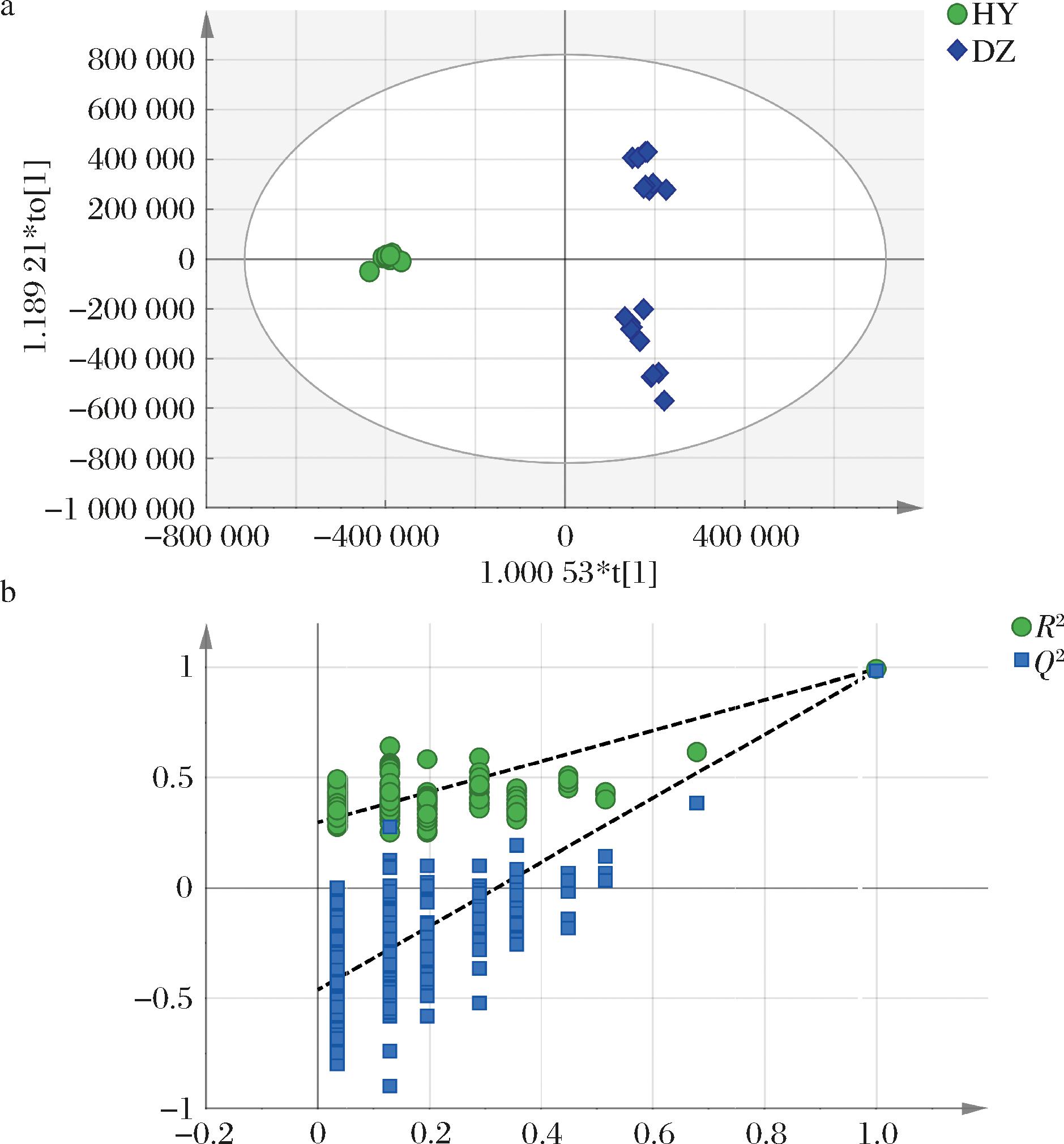
a-OPLS-DA 得分图(“HY”表示胡柚蜂蜜;“DZ”表示其他蜂蜜);b-置换检验图
图4 胡柚蜂蜜与其他蜂蜜样本的OPLS-DA结果及模型200次循环迭代置换检验图
Fig.4 OPLS-DA result for Huyou honey samples vs.other honey samples and permutation test diagram of OPLS-DA model iterated 200 times
注:OPLS-DA中R2X=0.580,R2Y=0.993,Q2=0.986。
进而分析各代谢物的VIP,VIP值越大表明该化合物对于区分2组样品的贡献越大[24]。在此基础上筛选出22个同时满足P<0.01以及FC>2、VIP>1的化合物为差异代谢物。根据通过Compound Discoverer 3.3软件对质谱与数据库进行数据检索和比对的结果初步鉴定,这22个差异代谢物中包括6种生物碱及其衍生物、2种芳香烃类化合物、1种黄酮类化合物、1种三萜类化合物、1种脂肪族化合物以及11种其他类化合物。其中黄酮类化合物新橙皮苷与三萜类化合物柠檬苦素是胡柚蜂蜜所特有且表达量高的,它们的VIP值分别为1.216 97和1.976 14,在提取离子色谱图中的m/z分别为609.18和471.20,因此选择这2个特征作为鉴别胡柚蜂蜜植物源的潜在标志性成分。将标准品进行同一方法测定,根据蜂蜜样品与标准品的保留时间和二级质谱图的离子碎片进行比较,进一步确定2种物质为新橙皮苷与柠檬苦素。胡柚蜂蜜中新橙皮苷与柠檬苦素的提取离子色谱图与二级质谱图如图5所示。
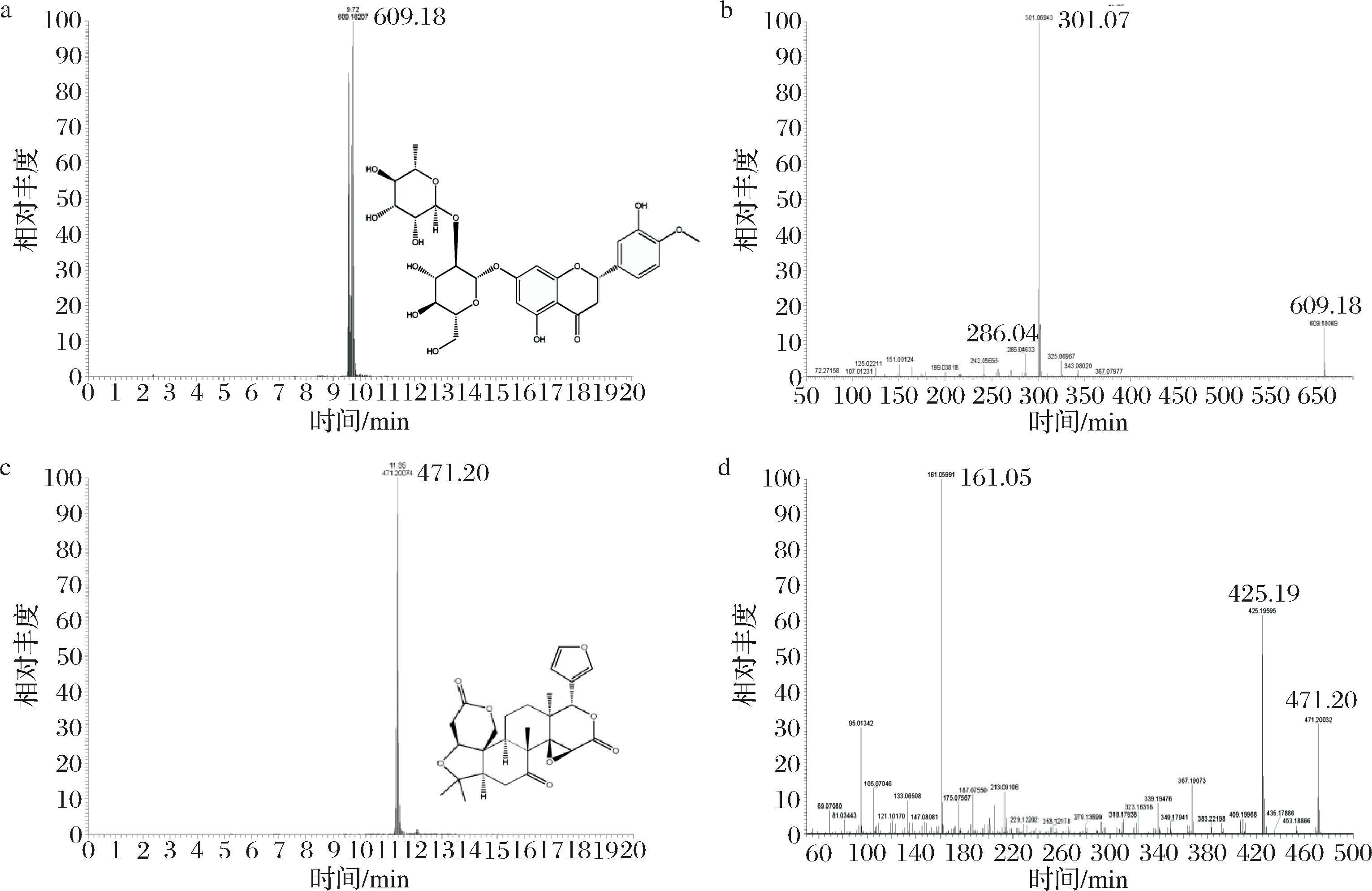
a-新橙皮苷提取离子色谱图;b-新橙皮苷二级质谱图;c-柠檬苦素提取离子色谱图;d-柠檬苦素二级质谱图
图5 胡柚蜂蜜中两种标志性成分的提取离子色谱图与二级质谱图
Fig.5 Extracted ion chromatogram and mass spectrum of two characteristic components in Huyou honey
可见,在胡柚蜂蜜及其相应的标准品中,2种特征成分的出峰时间和二级谱图完全一致。新橙皮苷的保留时间大约在9.7 min,在负离子模式下准分子离子峰为m/z 609.18[M-H]-,分子式为C28H34O15,推测母离子丢失1分子鼠李糖基(Rha,146)与一分子葡萄糖基葡萄糖基(Glc,162)得到碎片离子m/z 301.07,继续丢失1分子CH3得到碎片离子m/z 286.04。柠檬苦素的保留时间大约在11.3 min,在正离子模式下准分子离子峰为m/z 471.20[M+H]+,分子式为C26H30O8,推测母离子丢失1分子CO与1分子H2O得到碎片离子m/z 425.19,二级质谱图中还观察到碎片离子m/z 161.05[M+H-C16H22O6]+可用作柠檬苦素的定性和定量离子(表2)。
表2 胡柚蜂蜜标志性成分分析
Table 2 Huyou honey characteristic components analysis
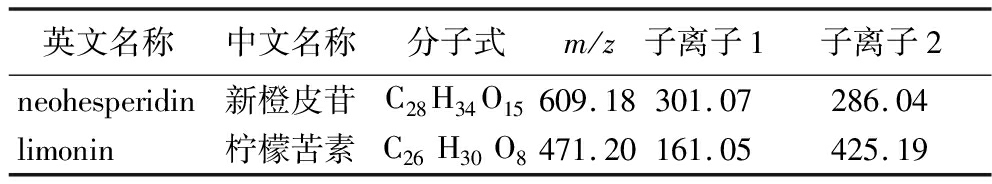
英文名称中文名称分子式m/z子离子1子离子2neohesperidin新橙皮苷C28H34O15609.18301.07286.04limonin柠檬苦素C26H30O8471.20161.05425.19
2.2 胡柚蜂蜜中标志性成分定量分析
2种化合物定量方法的线性范围均0.125~4.000 mg/kg。其中,新橙皮苷的线性回归方程为y=7.697 67×107x-5.875 21×106,相关系数R2=0.999 0;柠檬苦素的线性回归方程为y=1.817 62×108x+1.424 25×107,相关系数R2=0.997 6。
对胡柚蜂蜜以及其他4种蜂蜜样品中的新橙皮苷与柠檬苦素进行定量分析,结果如图6所示。在实验所用的胡柚蜂蜜样品中,新橙皮苷的含量为0.961~1.478 mg/kg,柠檬苦素的含量为0.347~0.659 mg/kg,其他4种对照蜂蜜的新橙皮苷与柠檬苦素含量均低于定量范围(<0.125 mg/kg),进一步验证了新橙皮苷和柠檬苦素可作为胡柚蜂蜜植物源鉴别的特征标记物,并将其应用于胡柚蜂蜜的种类鉴别及品质评价。
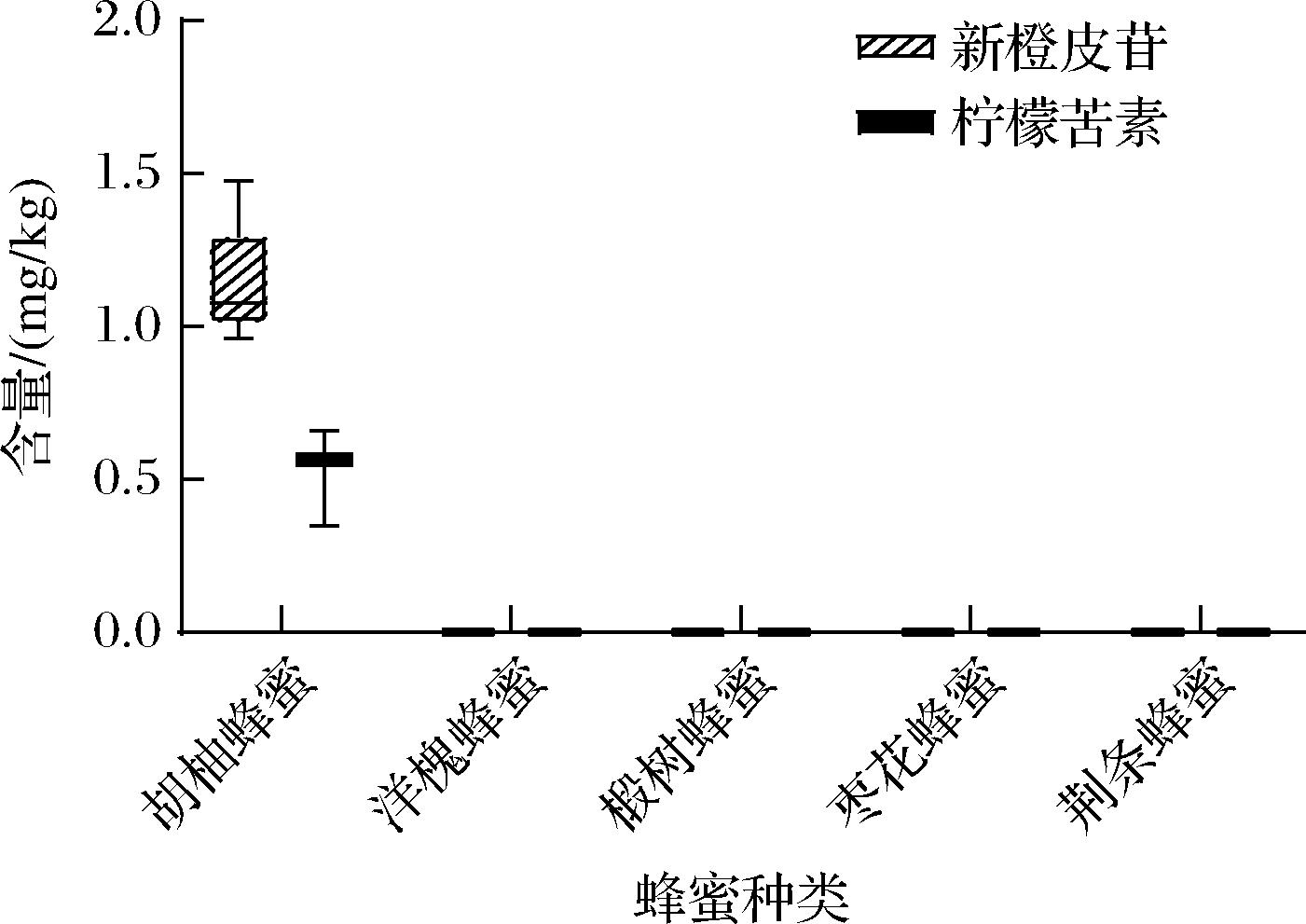
图6 不同蜂蜜样品中新橙皮苷和柠檬苦素的含量
Fig.6 Concentrations of neohesperidin and limonin in different honey samples
新橙皮苷是丰富存在于胡柚果实中的一种重要的二氢黄酮类多酚物质,具有多种生物活性,其在胡柚果皮与果肉中的含量丰富,分别约为3.20 mg/kg与31.31 mg/kg[27]。新橙皮苷是胡柚皮中主要发挥抗氧化活性的有效成分,具有较强的清除自由基能力,因而,新橙皮苷也是评价胡柚制成品衢枳壳品质标准的主要指标[28]。柠檬苦素是存在于芸香科和楝科植物中的三萜类化合物,是具有高度生物活性的植物次生代谢产物[29]。柠檬苦素是导致胡柚果实苦味的重要物质之一,在胡柚果皮的降脂与抗炎作用中起主要作用[30-31]。在本实验所使用的胡柚蜂蜜样品中,新橙皮苷与柠檬苦素的含量分别约为1.160 mg/kg与0.553 mg/kg。鉴于新橙皮苷与柠檬苦素同时富含于胡柚的果实与植物中,研究人员认为新橙皮苷与柠檬苦素可能是鉴别胡柚蜂蜜植物源的标志性成分。此外,新橙皮苷和柠檬苦素不仅对胡柚蜂蜜的植物源鉴别起重要作用,对于其生物活性的评估也具有重要价值,在后续的研究中可对胡柚蜂蜜的抗氧化、抗菌等活性进行进一步研究,为其品质评定提供更加完善的依据。
3 结论
胡柚蜂蜜是浙江省常山县的一种地方特色单花蜜,采用现有标准方法对胡柚蜂蜜理化性质进行分析,检测结果表明胡柚蜂蜜各项基本理化指标均符合蜂蜜国家标准。通过UPLC-HRMS技术结合化学计量学方法,在胡柚蜂蜜中鉴定到新橙皮苷与柠檬苦素为可用于鉴别其种类的2种标志性成分,其中,新橙皮苷还未见在其他蜂蜜中报道。建立了胡柚蜂蜜的种类鉴别评价方法,对蜂蜜样品中新橙皮苷与柠檬苦素的含量进行定量,采集胡柚蜂蜜中新橙皮苷的含量为0.961~1.478 mg/kg,柠檬苦素的含量为0.347~0.659 mg/kg。研究首次对胡柚蜂蜜的品质特征进行了系统研究,为胡柚蜂蜜质量标准的建立,提供了重要的理论依据。
[1] FANG H T, ZHANG H L, WEI X B, et al.Phytochemicals and antioxidant capacities of young citrus fruits cultivated in China[J].Molecules, 2022, 27(16):5185.
[2] CUI Q, JIANG L J, WEN L L, et al.Metabolomic profiles and differential metabolites of volatile components in Citrus aurantium Changshan-Huyou pericarp during different growth and development stages[J].Food Chemistry-X, 2024, 23:101631.
[3] 李锦荣, 陈国玉, 虞立, 等.衢枳壳主要化学成分及药效学作用和机制研究进展[J].中南药学, 2024, 22(2):459-465.LI J R, CHEN G Y, YU L, et al.Pharmacological effects of Quzhou Aurantii Fructus extract and its active components and related mechanism[J].Central South Pharmacy, 2024, 22(2):459-465.
[4] 赵雪梅,叶兴乾,朱大元, 等.胡柚皮挥发油的化学成分和抗菌活性初步研究[J].中国中药杂志, 2003, 28(11):1087-1089.ZHAO X M, YE X Q, ZHU D Y, et al.Preliminary study on chemical constituents and antibacterial activity of volatile oil from Huyou peel[J].China Journal of Chinese Materia Medica, 2003, 28(11):1087-1089.
[5] ZHANG Q X, SONG W Y, TAO G Q, et al.Comparison of chemical compositions and antioxidant activities for the immature fruits of citrus Changshan-Huyou YB Chang and Citrus aurantium L.[J].Molecules, 2023, 28(13):5057.
[6] 杨佩磊, 蒋剑平, 李全清, 等.胡柚皮黄酮对高脂血症大鼠的降血脂作用研究[J].中国中药杂志, 2017, 42(5):936-943.YANG P L, JIANG J P, LI Q Q, et al.Effects of pure total flavonoids from citrus Changshan-Huyou on blood lipid metabolism in hyperlipidemic rats[J].China Journal of Chinese Materia Medica, 2017, 42(5):936-943.
[7] CORVUCCI F, NOBILI L, MELUCCI D, et al.The discrimination of honey origin using melissopalynology and Raman spectroscopy techniques coupled with multivariate analysis[J].Food Chemistry, 2015, 169:297-304.
[8] 梁馨文, 李强强, 王凯, 等.蜂蜜溯源特征标记物研究进展[J].食品科学, 2018, 39(15):343-348.LIANG X W, LI Q Q, WANG K, et al.A review of characteristic markers for honey traceability[J].Food Science, 2018, 39(15):343-348.
[9] SERRA BONVEHI J, VENTURA COLL F, ORANTES BERMEJO J F.Characterization of avocado honey (Persea americana Mill.) produced in Southern Spain[J].Food Chemistry, 2019, 287:214-221.
[10] ![]() U M,
U M, ![]() Ž L.Polyphenols as possible markers of botanical origin of honey[J].Journal of AOAC INTERNATIONAL, 2017, 100(4):852-861.
Ž L.Polyphenols as possible markers of botanical origin of honey[J].Journal of AOAC INTERNATIONAL, 2017, 100(4):852-861.
[11] ESCRICHE I, SOBRINO-GREGORIO L, CONCHADO A, et al.Volatile profile in the accurate labelling of monofloral honey.The case of lavender and thyme honey[J].Food Chemistry, 2017, 226:61-68.
[12] ZHENG Y F, WU M C, CHIEN H J, et al.Honey proteomic signatures for the identification of honey adulterated with syrup, producing country, and nectar source using SWATH-MS approach[J].Food Chemistry, 2021, 354:129590.
[13] 吴招斌, 陈芳, 陈兰珍, 等.基于电感耦合等离子体质谱法和化学计量学鉴别蜂蜜品种研究[J].光谱学与光谱分析, 2015, 35(1):217-222.WU Z B, CHEN F, CHEN L Z, et al.Application of inductively coupled plasma mass spectrometry with chemometric methods in classification of honeys according to their types[J].Spectroscopy and Spectral Analysis, 2015, 35(1):217-222.
[14] ZHAO L W, REN C J, XUE X F, et al.Safflomin A:A novel chemical marker for Carthamus tinctorius L.(Safflower) monofloral honey[J].Food Chemistry, 2022, 366:130584.
[15] KARABAGIAS I K, BADEKA A, KONTOMINAS M G.A decisive strategy for monofloral honey authentication using analysis of volatile compounds and pattern recognition techniques[J].Microchemical Journal, 2020, 152:104263.
[16] ZHANG Y, WANG Y X, ZHAO H A, et al.Characterization of novel protein component as marker for floral origin of Jujube (Ziziphus jujuba Mill.) honey[J].Journal of Agricultural and Food Chemistry, 2019, 67(44):12255-12263.
[17] ZHAO T, ZHAO L W, WANG M, et al.Identification of characteristic markers for monofloral honey of Astragalus membranaceus var.Mongholicus Hsiao:A combined untargeted and targeted MS-based study[J].Food Chemistry, 2023, 404:134312.
[18] 王桃红, 祖铁红, 侯小超, 等.新疆薰衣草蜂蜜品质及挥发性成分分析[J].食品与发酵工业, 2024, 50(6):260-266.WANG T H, ZU T H, HOU X C, et al.Analysis of quality and volatile compounds in lavender honey from Xinjiang[J].Food and Fermentation Industries, 2024, 50(6):260-266.
[19] 姜澳, 黎洪霞, 刘肇龙, 等.飞龙掌血蜂蜜挥发性物质组成及关键香气物质分析[J].食品科学, 2024, 45(11):175-185.JIANG A, LI H X, LIU Z L, et al.Analysis of volatile composition and key aroma compounds in Toddalia asiatica Lam honey[J].Food Science, 2024, 45(11):175-185.
[20] HERMOS N I, CHIC
N I, CHIC N R M, DOLORES CABEZUDO M.Free amino acid composition and botanical origin of honey[J].Food Chemistry, 2003, 83(2):263-268.
N R M, DOLORES CABEZUDO M.Free amino acid composition and botanical origin of honey[J].Food Chemistry, 2003, 83(2):263-268.
[21] YANG J L, LIU Y H, CUI Z Y, et al.Analysis of free amino acid composition and honey plant species in seven honey species in China[J].Foods, 2024, 13(7):1065.
[22] SUN Z, ZHAO L L, CHENG N, et al.Identification of botanical origin of Chinese unifloral honeys by free amino acid profiles and chemometric methods[J].Journal of Pharmaceutical Analysis,2017, 7(5):317-323.
[23] 孙晓杰, 黄学者, 赵玉强, 等.云南5种蜂蜜12种糖组分和20种氨基酸含量的测定与分析[J].食品科学, 2025, 46 (2):148-155.SUN X J, HUANG X Z, ZHAO Y Q, et al.Determination and analysis of 12 saccharides and 20 amino acids in five types of honey from Yunnan province[J].Food Science, 2025, 46 (2):148-155.
[24] 刘钰浩, 张葆春, 申春华, 等.基于广泛代谢组学的白兰地非挥发化合物鉴定及差异分析[J].食品与发酵工业, 2024, 50(16):324-347.LIU Y H, ZHANG B C, SHEN C H, et al.Identification and differences of non-volatile compounds in brandy based on widely targeted metabolomics[J].Food and Fermentation Industries,2024,50(16):324-347.
[25] WU J Z, OUYANG Q, PARK B, et al.Physicochemical indicators coupled with multivariate analysis for comprehensive evaluation of matcha sensory quality[J].Food Chemistry, 2022, 371:131100.
[26] ZHAO H A, CHENG N, WANG Q, et al.Effects of honey-extracted polyphenols on serum antioxidant capacity and metabolic phenotype in rats[J].Food &Function, 2019, 10(5):2347-2358.
[27] 周心悦, 周逸辰, 陈晋, 等.胡柚及其苦味黄烷酮对糖脂代谢相关疾病的调节功能研究进展[J].中国食品添加剂, 2022, 33(12):41-49.ZHOU X Y, ZHOU Y C, CHEN J, et al.Research progress on regulation of Huyou and its bitter flavanone on diseases related to glucose and lipid metabolism[J].China Food Additives, 2022, 33(12):41-49.
[28] 汪丽霞, 郑浩, 徐小忠, 等.常山胡柚小青果干制工艺对制成品“衢枳壳”品质的影响[J].中国南方果树, 2022, 51(4):39-42.WANG L X, ZHENG H, XU X Z, et al.Effects of drying process of young fruits of Changshan Huyou(Citrus aurantium L.) on quality of Qu Fructus aurantii products[J].South China Fruits,2022,51(4):39-42.
[29] 刘晓政, 严晓丽, 胡丹, 等.常山胡柚不同部位中柠檬苦素的含量分析[J].食品工程, 2017(2):54-57.LIU X Z, YAN X L, HU D, et al.Study on content of limonin in different tissues of citrus changshan-Huyou[J].Food Engineering, 2017(2):54-57.
[30] 林敏,任思婕,张真真,等.常山胡柚降血脂成分提取工艺及其功能研究[J].核农学报, 2015, 29(12):2343-2348.LIN M, REN S J, ZHANG Z Z, et al.Study of extraction for hypolipidemic components from the peel and pomace of Citrus paradisi cv.Changshan-Huyou and its application[J].Journal of Nuclear Agricultural Sciences, 2015, 29(12):2343-2348.
[31] HU Y H, LIU J, LI H, et al.Chemical constituents from Citrus Changshan-Huyou and their anti-inflammatory activities[J].Chemistry &Biodiversity, 2020, 17(11):e2000503.