枸杞(Lycium chinense Mill.)隶属茄科(Solanaceae)枸杞属(Lycium),为多年生落叶灌木[1],主要分布于我国西北部的宁夏、青海、甘肃和新疆等地[2],近年来在西藏部分地市也有栽培。西藏栽培枸杞主要品种有宁夏枸杞(Lycium barbarum Linn.)、黑果枸杞(Lycium ruthenicum Murr.)和少量的野生驯化栽培的苦枸杞(Lycium amarum sp.nov.)等[3-4]。枸杞富含枸杞多糖、多种氨基酸、类胡萝卜素、维生素及矿物质,具有提高免疫力、抗癌、降血糖、降血压、降血脂、延缓衰老和养颜美容等多种功效[5]。
西藏地处中国青藏高原西南部,素有“世界屋脊”和“地球第三极”之称,凭借其独特的地理位置和气候条件赋予了藏产枸杞新的代谢特性,同时也造就了同一地区不同品种枸杞的代谢特征和营养成分的差异。西藏主栽的红枸杞品种为宁夏枸杞(Lycium barbarum Linn.),黑枸杞品种为黑果枸杞(Lycium ruthenicum Murr.),同时在山南市、林芝市和拉萨市还生长有野生的苦枸杞(Lycium amarum sp.nov.),也已被人工驯化栽培,苦枸杞其果也为红色,可能更适合作为药用枸杞开发利用。并且有关藏产枸杞代谢组学和营养成分研究尚未见报道,因此,本研究的开展独具地域特色且极为必要。
非靶向代谢组学是一种全面、系统地分析生物体内代谢物的方法[6-7],它可以定性和定量地分析生物体内小于1 kDa的代谢物。通过结合多元统计分析方法,可以更详细地鉴定样品之间的差异,并挖掘出特定的差异代谢物和新的代谢通路[8-9]。非靶向代谢组学与近红外光谱[10]、核磁共振[11]、高效液相色谱[12]等分析方法结合使用,可以更显著地研究植物体内代谢物的表达水平和与外部环境的关系。该技术已被广泛应用于微生物、植物、食品等领域[13-15]。马瑞雪[16]采用超高效液相色谱-电喷雾电离-串联质谱(ultra-performance liquid chromatography-electrospray ionization-tandem mass spectrometry,UPLC-ESI-MS/MS)非靶向代谢组学技术对不同产地(宁夏、青海和甘肃)“宁杞1号”进行枸杞黄酮类化合物生物合成差异研究,发现黄酮类化合物生物合成存在一定差异,总酚含量和总黄酮含量在宁夏产地枸杞果实中的含量均较高,且环境条件对3个产地枸杞中的黄酮、黄酮醇和黄烷酮影响较大。汤丽华等[17]采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法建立非靶向代谢组学研究方法,发现宁杞7号、宁杞9号、宁杞10号3个不同品种的宁夏枸杞代谢物差异较为显著。因此,藏产枸杞之间的代谢差异亟待研究。
本研究对西藏不同地区的不同品种枸杞样品进行基本营养成分和代谢组学分析,以期揭示我区不同品种枸杞的代谢差异,为进一步研究其营养成分和功能活性成分提供基础数据,尤其是为苦枸杞加工利用和功能活性成分挖掘奠定基础,并为我区不同地区枸杞的品质评估和利用提供科学依据。
1 材料与方法
1.1 材料与试剂
2023年9月18日至20日进行日喀则市白朗县和林芝市巴宜区两地3种枸杞(宁夏枸杞、黑果枸杞以及苦枸杞)果实的采集工作,枸杞生长期间采取常规化田间管理,随机选取10株生长一致的枸杞树,分别采集每株枸杞树上、中、下部位的成熟果实,并混合均匀,置于采样袋中并编号,每组3个重复。供试样品为采自于日喀则市白朗县和林芝市巴宜区两地的3种枸杞(宁夏枸杞、黑果枸杞以及苦枸杞)的成熟期鲜果经过采摘、晾晒、脱水、干燥等一系列加工工序后制成枸杞干果,在枸杞制品中,约九成鲜枸杞果实被加工成干制产品,干燥是枸杞保鲜最常见的加工方法之一[18],通过晾晒将枸杞鲜果制成干果不仅可操作性强且节约成本,因此本实验选用枸杞干果作为材料开展相关研究,具体采样信息见表1。
表1 采样地的地理信息
Table 1 Information on geographic locations of sampling sites

样品编号枸杞品种采样地纬度经度海拔/mZH宁夏枸杞(LyciumbarbarumLinn.)日喀则白朗县29°13′33.68″N89°09′27.33″E3862RH黑果枸杞(LyciumruthenicumMurr.)日喀则白朗县29°13′33.68″N89°09′27.33″E3862LH苦枸杞(Lyciumamarumsp.nov.)林芝市巴宜区29°40′14.05″N94°20′19.47″E3003
甲醇(色谱纯)、乙腈(色谱纯)、甲酸(色谱纯),美国Thermo Fisher公司;L-2-氯苯丙氨酸(混合内标),上海恒创生物科技有限公司;琥珀酸-d4(混合内标),美国Sigma公司;L-缬氨酸-d8(混合内标),上海皓元生物医药科技有限公司;胆酸-D4(混合内标),上海源叶生物科技有限公司;植物类黄酮检测试剂盒、维生素C测定试剂盒、植物总酚检测试剂盒,南京建成生物工程研究所;维生素B1试剂盒、总糖含量试剂盒、总多糖含量测定试剂盒、BCA法蛋白含量测定试剂盒,苏州科铭生物技术有限公司。
1.2 仪器与设备
FA2 104B电子天平,上海越平科学仪器有限公司;NanoDrop 2 000微量分光光度计,美国Thermo Fisher公司;Wonbio-E全自动样品快速研磨仪,上海万柏生物科技有限公司;F-060SD超声波清洗机,深圳福洋科技集团有限公司;TYXH-I漩涡振荡器,上海汗诺仪器有限公司;TGL-16MS台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;Waters ACQUITY UPLC I-Class plus/Thermo QE HF液相色谱-质谱联用仪,美国Waters/Thermo Fisher Scientific公司;AdvanceBio MS Spent Media (2.1 mm×50 mm,2.7 μm)色谱柱,美国安捷伦公司;ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)液相色谱柱,美国Waters公司。
1.3 实验方法
1.3.1 营养成分测定
采用植物类黄酮检测试剂盒、维生素C测定试剂盒、维生素B1试剂盒、总糖含量试剂盒、总多糖含量测定试剂盒、BCA法蛋白含量测定试剂盒和植物总酚检测试剂盒分别检测枸杞样品中黄酮、维生素C、维生素B1、总糖、总多糖、蛋白和总酚的含量[19]。
1.3.2 氨基酸含量测定
精确称取经过组织粉碎机粉碎的枸杞干果粉末20 mg,加入141 μL水,100 μL 0.15%脱氧胆酸钠混匀,加入4 μL 100 μg/mL的三内标溶液(Lys-d4/Try-d5/Gln-d4),混匀后超声10 min(5 ℃,40 kHz),加入5 μL 10 mol/L的三氯醋酸(trichloroacetic acid,TCA)混匀,样品冷冻静置沉淀10 min,4 ℃ 14 000 r/min离心10 min,取上清液50 μL,加入350 μL水,涡旋混匀,过Biotage 0.2 μm PTFE滤膜,采用液相色谱-电喷雾电离串联质谱(liquid chromatography-electrospray ionization tandem mass spectrometry, LC-ESI-MS/MS)对样品中的目标物进行定性定量检测[20]。精确称取17种氨基酸的标品适量,加0.1 mol/L HCl水溶解并定容至1 mL,涡旋混匀,得标准品储备溶液。
色谱条件[20]:色谱柱为AdvanceBio MS Spent Media(2.1 mm×50 mm,2.7 μm),柱温40 ℃,进样量为1 μL。流动相A(含体积分数为0.1%的甲酸,10 mmol/L甲酸铵,体积分数为95 %的水溶液),流动相B(含体积分数为0.1%的甲酸,10 mmol/L甲酸铵,体积分数为95 %的乙腈溶液)。流速0.5 mL/min,梯度洗脱程序:0~3 min,10%~40% A,90%~60% B;3~4 min,40% A,60% B,4~4.1 min,40%~10% A,60%~90% B;4.1~6 min,10% A,90% B。
质谱条件[20]:高通量质谱仪SCIEX QTRAP 6500+,采用正/负模式检测,气帘气压力为35 psi,喷雾电压为+5 500/-4 500,离子源温度为550 ℃,雾化气电压为50 psi,辅助气流速为50 L/min。
1.3.3 非靶向代谢组学分析
称取60 mg混样干燥后磨碎的枸杞果实粉末置于1.5 mL离心管中,加入2颗小钢珠和600 μL甲醇-水(V∶V=7∶3,含混合内标,4 μg/mL),-40 ℃冰箱中预冷2 min,用研磨机研磨(60 Hz,2 min),冰水浴超声提取30 min,-40 ℃静置过夜,低温离心10 min(12 000 r/min,4 ℃),用注射器吸取150 μL的上清液,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃下保存,直到进行LC-MS分析[15]。
液相色谱条件[14]:色谱柱(100 mm×2.1 mm,1.8 μm);柱温:45 ℃;流速:0.35 mL/min;进样体积:4 μL;流动相组成A:水(含体积分数为0.1%的甲酸),B:乙腈。梯度洗脱程序:0~2 min,5% B;2~4 min,30% B;4~8 min,50% B;8~10 min,80% B;10~15 min,100% B;15.1~16 min,5% B。
质谱条件[21]:电子喷雾离子源(electrospray ionization, ESI);样品质谱信号采集采用正负离子分开扫描,具体采集模式为数据依赖采集(data dependent acquisition,DDA)。质谱参数如下:正离子喷雾电压为3.8 kV,负离子喷雾电压为-3.0 kV,鞘气35 arb,辅助气8 arb,毛细管温度320 ℃,以分辨率60 000进行一级全扫描,一级全扫描范围m/z 100~1 200,二级分辨率为15 000,归一化碰撞能10、20、40 eV。
1.4 数据处理
将原始数据经Progenesis QI v3.0(Nonlinear Dynamics,Newcastle,UK)软件进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化处理,得到保留时间、质荷比和峰强度等数据,在此基础上根据公共数据库与鹿明生物自建LuMet-Plant数据库对代谢物进行定性分析[14]。对鉴定的代谢产物进行主成分分析(principal component analysis, PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)。根据变量重要性投影(variable importance projection, VIP)初步筛选差异代谢物,结合单变量分析的单维统计P值或者差异倍数值进一步筛选差异代谢物,同时将得到的相应差异代谢物进行KEGG数据库代谢通路分析[15]。
2 结果与分析
2.1 三种枸杞营养成分的比较分析
如表2所示,日喀则产宁夏枸杞中的总糖、总多糖、可溶性蛋白质和总酚含量最高,有研究表明枸杞品种差异和生长环境共同决定了枸杞总糖含量的高低[22]。有学者发现低总糖含量的枸杞果实整体呈果实较小、更高功效成分含量趋势,但是也存在少量品种/品系具有低总糖含量、功效成分含量较高且果实较大情况[23],3种枸杞中林芝苦枸杞总糖含量最低,表明其可能含有较高的功效成分,这一推测也在3种枸杞中氨基酸组成分析中得到了一定的证实,即林芝苦枸杞中药用氨基酸和必需氨基酸含量最高。日喀则黑果枸杞中类黄酮、维生素C和维生素B1的含量最高,研究表明黑果枸杞正常情况比中华枸杞具有更高的黄酮和类黄酮含量[24],与此研究结果相近,同时也有研究发现枸杞子中类黄酮成分具有较强的抗氧化活性[25],表明日喀则黑果枸杞可能具有更强的抗氧化活性。
表2 三种枸杞样品营养成分比较
Table 2 Comparison of the nutrient composition of the three Lycium chinense samples
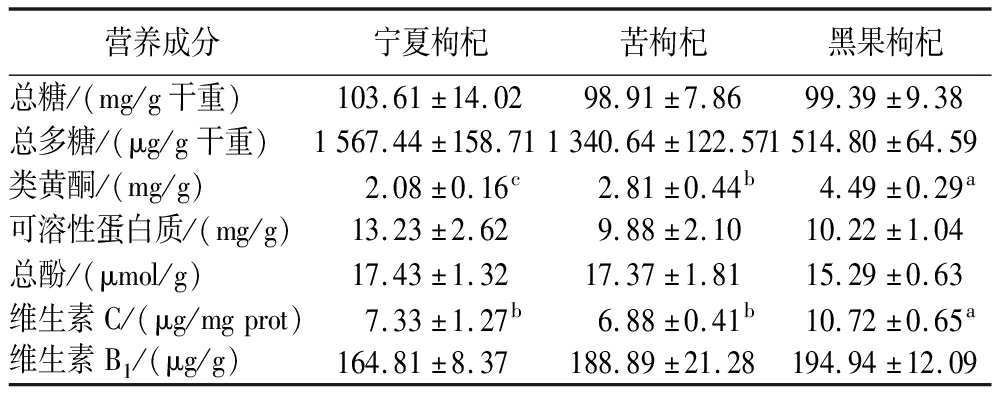
营养成分宁夏枸杞苦枸杞黑果枸杞总糖/(mg/g干重)103.61±14.0298.91±7.8699.39±9.38总多糖/(μg/g干重)1567.44±158.711340.64±122.571514.80±64.59类黄酮/(mg/g)2.08±0.16c2.81±0.44b4.49±0.29a可溶性蛋白质/(mg/g)13.23±2.629.88±2.1010.22±1.04总酚/(μmol/g)17.43±1.3217.37±1.8115.29±0.63维生素C/(μg/mgprot)7.33±1.27b6.88±0.41b10.72±0.65a维生素B1/(μg/g)164.81±8.37188.89±21.28194.94±12.09
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 三种枸杞氨基酸的组成及含量分析
由表3可知,3种枸杞样品中检测到了17种氨基酸,其中必需氨基酸8种(含半必需氨基酸组氨酸),非必需氨基酸9种。日喀则产宁夏枸杞中,必需氨基酸占总氨基酸的19.91%,必需氨基酸与非必需氨基酸的比例为24.86%。日喀则黑果枸杞中,必需氨基酸占总氨基酸的16.47%,必需氨基酸与非必需氨基酸的比例为19.73%。林芝苦枸杞中,必需氨基酸占总氨基酸的42.95%,必需氨基酸与非必需氨基酸的比例为75.29%。FAO/WHO提出理想蛋白质的标准,即必需氨基酸与总氨基酸比例为40%,必需氨基酸与非必需氨基酸比例为60%以上[26],3种枸杞中只有林芝苦枸杞达到了理想蛋白质的标准,而日喀则产宁夏枸杞和黑果枸杞未达到理想蛋白的要求,这也与李强等研究结果较为一致[26-27]。
表3 三种枸杞氨基酸含量
Table 3 Amino acid content of three kinds of Lycium chinense

指标宁夏枸杞黑果枸杞苦枸杞丙氨酸(Ala)2,7/(mg/g)1.91±0.71a1.16±1.15a1.63±0.15a精氨酸(Arg)2,5/(mg/g)2.68±0.12a0.92±0.46b2.90±0.72a天冬氨酸(Asp)2,5,6/(mg/g)0.41±0.22b0.21±0.11b2.82±1.84a谷氨酸(Glu)2,5,6/(mg/g)0.15±0.03a0.19±0.06a0.07±0.01b甘氨酸(Gly)2,7/(mg/g)0.07±0.03b0.06±0.03b0.20±0.06a组氨酸(His)1/(mg/g)0.56±0.13b0.09±0.05b1.82±0.92a异亮氨酸(Ile)1,5/(mg/g)0.05±0.04b0.02±0.01b0.20±0.04a半胱氨酸(Cys)4/(mg/g)0.0009±0.0001a0.0018±0.0008a0.0020±0.0013a亮氨酸(Leu)1,5/(mg/g)0.59±0.22b0.09±0.04c1.18±0.14a赖氨酸(Lys)1,5/(mg/g)0.64±0.48b0.14±0.11b2.38±0.53a甲硫氨酸(Met)1,4/(mg/g)0.04±0.01b0.02±0.01b0.11±0.04a苯丙氨酸(Phe)1,3/(mg/g)0.37±0.3b0.20±0.08b1.17±0.14a脯氨酸(Pro)2,7/(mg/g)5.73±0.41a0.68±0.53b1.29±0.58b丝氨酸(Ser)2,7/(mg/g)1.74±0.51a0.30±0.23b0.74±0.28b苏氨酸(Thr)1/(mg/g)0.74±0.16a0.07±0.05c0.35±0.31b酪氨酸(Tyr)3/(mg/g)0.06±0.04b0.13±0.10b0.55±0.13a缬氨酸(Val)1,5/(mg/g)0.18±0.05b0.09±0.07b0.47±0.03aTAA/(mg/g)15.92094.371817.8820EAA/(mg/g)3.170.727.68NEAA/(mg/g)12.753.6510.20AAA/(mg/g)0.430.331.72SAA/(mg/g)0.04090.02180.1102PAA/(mg/g)4.701.6610.02UAA/(mg/g)0.560.402.89GAA/(mg/g)9.452.203.86BAA/(mg/g)3.541.144.86EAA/NEAA/%24.8619.7375.29EAA/TAA/%19.9116.4742.95NEAA/TAA/%80.0883.4957.04AAA/TAA/%2.707.559.62SAA/TAA/%0.260.500.62PAA/TAA/%29.5237.9756.03UAA/TAA/%3.529.1516.16GAA/TAA/%59.3650.3221.59BAA/TAA/%22.2326.0827.18
注:1,总氨基酸(total amino acid,TAA);2,必需氨基酸( essential amino acid, EAA);3,非必需氨基酸(non essential amino acids, NEAA);4,芳香族氨基酸(aromatic amino acids, AAA);5,含硫氨基酸(sulfur-containing amino acids, SAA);6,药用氨基酸(medicinal amino acids, PAA);7,鲜味氨基酸(umami amino acids, UAA);8,甜味氨基酸(sweet amino acids, GAA),9,苦味氨基酸(bitter amino acids, BAA);TAA总含量=Ala+Arg+Asp+Glu+Gly+His+Ile+Cys+Leu+Lys+Met+Phe+Pro+Ser+Thr+Tyr+Val;EAA总含量=Thr+Val+Met+Ile+Leu+Phe+His+Lys;NEAA总含量=Asp+Ser+Glu+Pro+Gly+Ala+Arg;AAA总含量=Phe+Tyr;SAA总含量=Cys+Met;PAA总含量=Asp+Glu+Val+Leu+Ile+Arg+Lys;UAA总含量=Asp+Glu;GAA总含量=Gly+Ala+Ser+Phe;BAA总含量=Arg+Val+.Met+Ile+Leu。
林芝苦枸杞中药用氨基酸、芳香族氨基酸、含硫氨基酸、鲜味氨基酸占总氨基酸的比例均要高于其他两种枸杞,因此本研究认为苦枸杞可能更适合作为药用枸杞而开发利用。日喀则产宁夏枸杞和黑果枸杞中的甜味氨基酸占总氨基酸的比例远高于苦枸杞中比例,且前两种枸杞中的苦味氨基酸占总氨基酸的比例要低于苦枸杞中的比例,同郭家平等[28]研究结果相近,也与品尝滋味一致(宁夏枸杞和黑果枸杞呈甜味,而苦枸杞呈现一定苦味且苦后回甘)。
2.3 枸杞果实中代谢物总体分析
枸杞果实样品中,共鉴定出7 101个代谢物,其中脂类和类脂分子最多(35.3%),其次是有机酸和衍生物(14.6%)、有机杂环化合物(14.1%)、苯丙烷和聚酮类(11.0%)、有机氧化合物(9.8%)、苯环型化合物(8.6%)、核苷和核苷酸和类似物(1.8%)、生物碱和衍生物(1.4%)、有机氮化合物(1.3%)和其他(2.1%)(图1)。
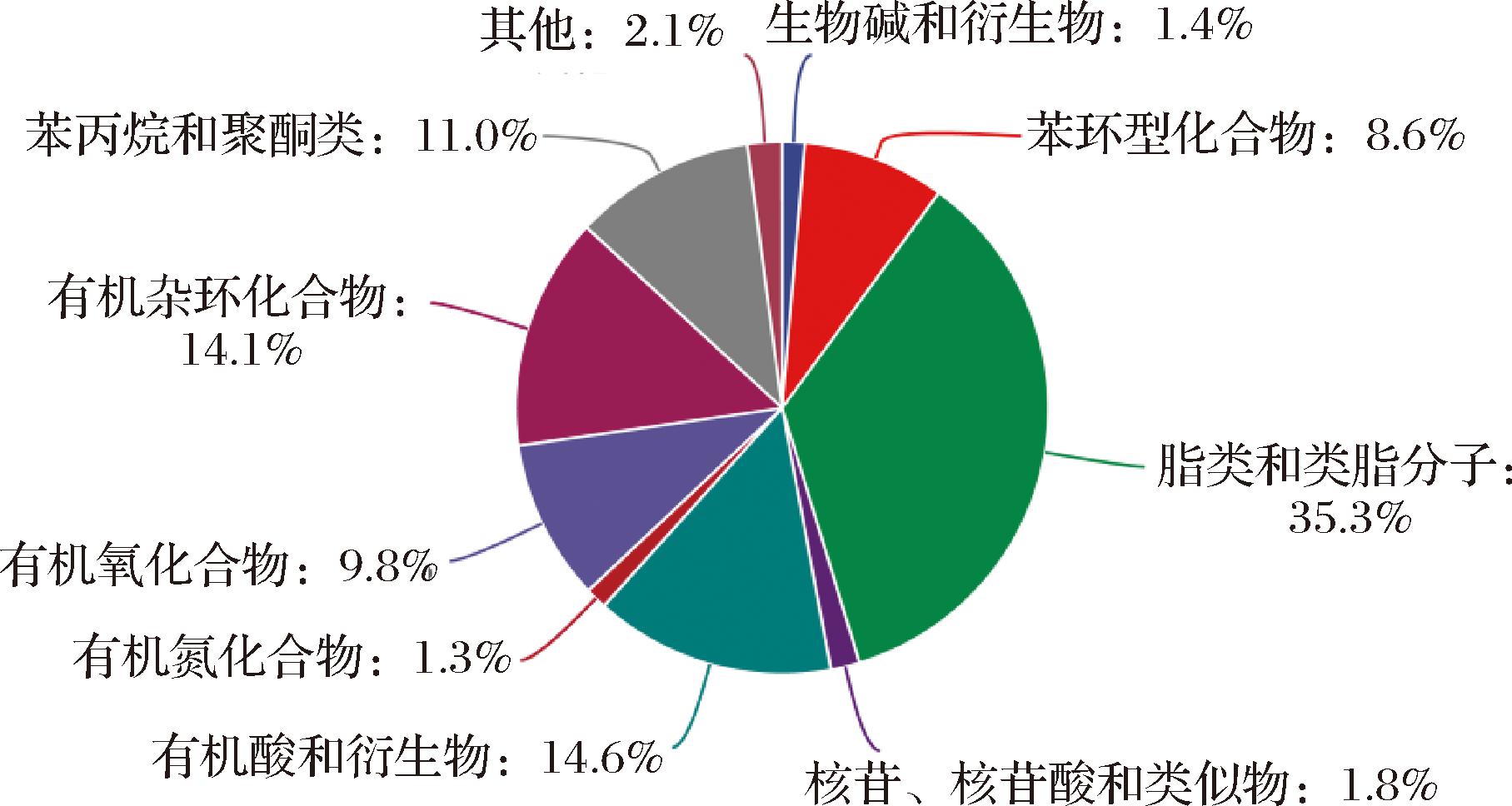
图1 枸杞所有代谢产物的分类
Fig.1 Classification of all metabolites of Lycium chinense
2.4 不同枸杞代谢组学多元统计分析
为明确3种枸杞的总体代谢差异和组内样本之间的变异度大小,对供试样品进行PCA和相关性分析。PCA结果表明(图2-A),PC1可以解释3种枸杞的总方差和分离样本的56.3%,PC2能解释总方差的29.8%,说明3种枸杞组间代谢产物的积累模式存在较大差异,各组的点云分布区域靠近,说明组内代谢物组成结构差异较小。如图2-B~图2-D所示,为了避免过度拟合,进行OPLS-DA模型验证(置换检验n=200),结果R2大于Q2且Q2回归线与Y轴截距小于0,说明模型稳健可靠且不存在过拟合现象。
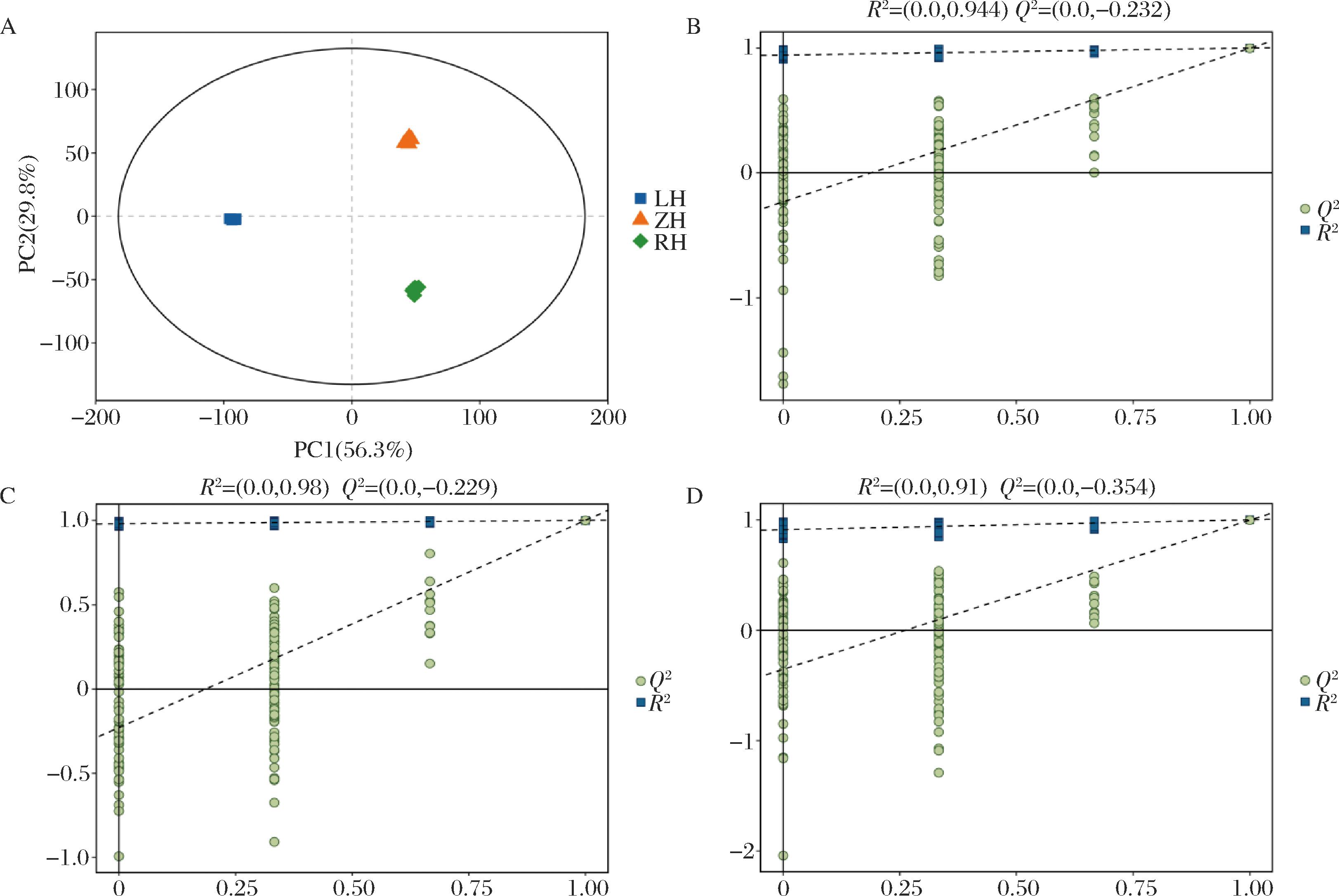
A-PCA得分图;B、C、D分别为LH vs RH、LH vs ZH、ZH vs RH的200次置换检验图
图2 三种枸杞代谢产物PCA得分图和Permutation模型验证图
Fig.2 PCA score chart and Permutation model validation chart of metabolites of three types of Lycium chinense
2.5 差异代谢物分析
在正负离子模式下,3种枸杞中共筛选出1 142种差异代谢物(图3-A)。在LH和RH之间有787个差异代谢物(335个上调物质,452个下调物质),在LH和ZH之间有765个差异代谢物(357个上调物质,408个下调物质),在ZH和RH之间有744个差异代谢物(338个上调物质,406个下调物质)。
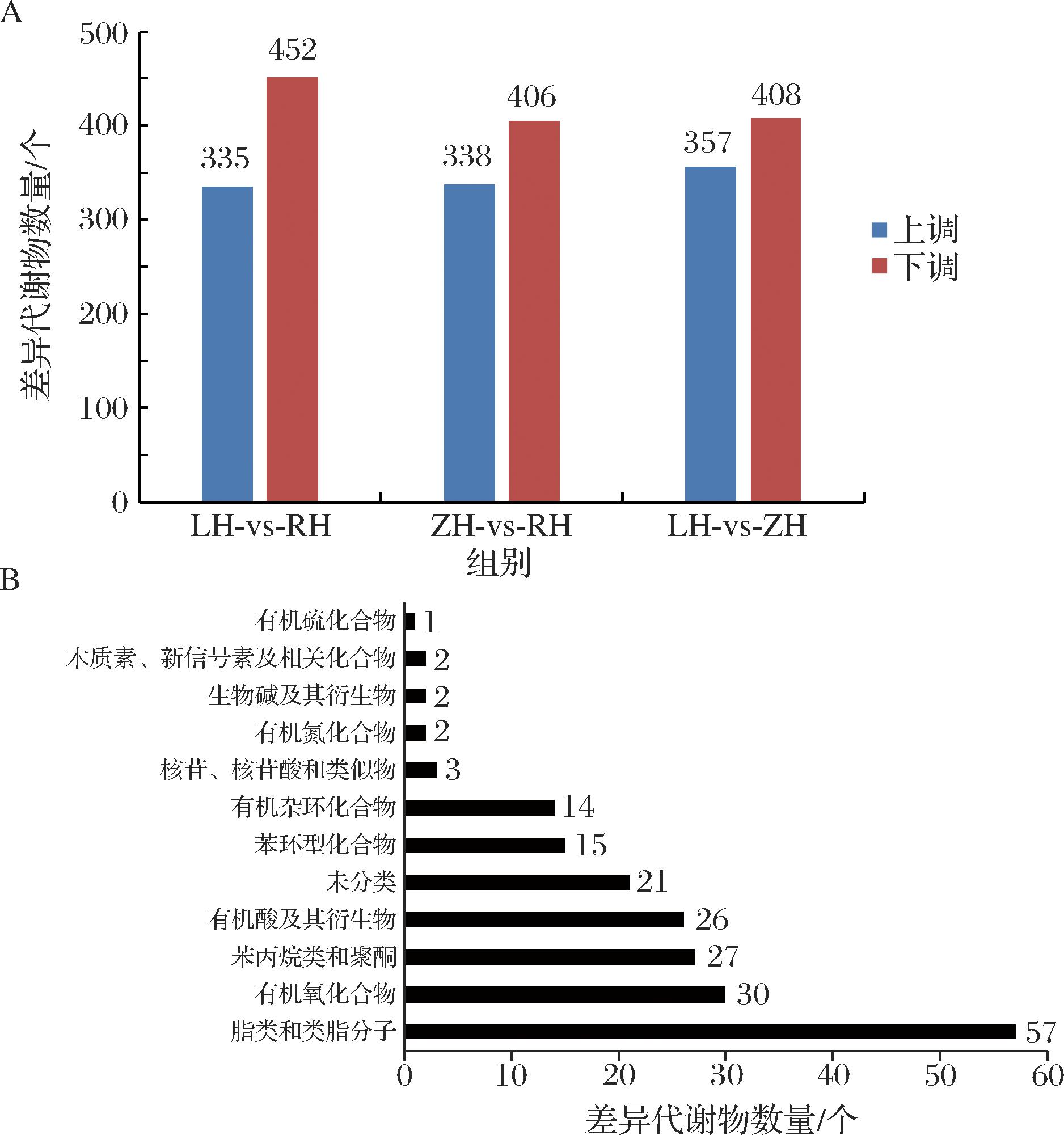
A-不同品种枸杞间差异代谢物柱状图;B-3种枸杞共有差异代谢物柱状图
图3 不同品种枸杞间差异代谢物柱状图和共有差异代谢物柱状图
Fig.3 Bar charts of differential metabolites and common differential metabolites among different varieties of Lycium chinense
3种枸杞有200个共有差异代谢物,分别为有机硫化合物(1种),木质素、新信号素及相关化合物(2种),生物碱及其衍生物(2种),有机氮化合物(2种),核苷、核苷酸和类似物(3种),有机杂环化合物(14种),苯环型化合物(15种),未分类(21种),有机酸及其衍生物(26种),苯丙烷类和聚酮(27种),有机氧化合物(30种),脂类和类脂分子(57种),共200种(图3-B)。
通过VIP≥1,P<0.05标准筛选出显著差异代谢物,其中VIP排序前20的差异代谢物,如表4所示。林芝苦枸杞和日喀则黑果枸杞相比,在苦枸杞中下调的代谢物主要以羧酸及其衍生物类物质为主,同时二氢麦角碱、地骨皮乙素和异黄酮4′-葡萄糖苷下调也较为显著,而除了未分类的化合物,脂肪酰基类物质和龙舌兰皂苷C含量显著上调。林芝苦枸杞和日喀则宁夏枸杞相比,在苦枸杞中下调的代谢物主要为甘油磷脂类和羧酸及其衍生物类化合物,同时黄酮类化合物芦丁含量也下调明显,而除了未分类的化合物,脂肪酰基类物质和龙舌兰皂苷C含量同样显著上调。日喀则产宁夏枸杞与黑果枸杞相比,在宁夏枸杞中地骨皮乙素、异黄酮4′-葡萄糖苷、喹那普利和山奈酚3-(4′-(E)-P-香豆素二糖苷)-7-鼠李糖苷等化合物的含量显著下调,而PC(18∶1(11Z)/0∶0)、芦丁、二氢麦角碱、阿卡比糖醛酸和大脑啡肽的含量显著上调。二氢麦角碱可有效治疗阿尔茨海默病,其可直接作用于阿尔茨海默病患者的中枢神经系统多巴胺,选择性抑制中枢神经系统中乙酰胆碱的降解,增强突触前神经末梢释放递质和突触后受体的刺激作用,改善患者的神经传递功能,从而达到身体恢复正常状态的效果[29],与苦枸杞相比,日喀则产宁夏枸杞和黑果枸杞中二氢麦角碱相对含量较高,且二氢麦角碱成分具有抗阿尔兹海默病的功能,已在其他地区的枸杞上得到了验证[30-31]。地骨皮乙素是枸杞皮中提取的一种酚类化合物,具有多胺骨架和二氢咖啡酸附属物,其具有很强的抗氧化应激活性,并具有抗炎及神经保护作用[32],皂苷是存在于植物界的一类比较复杂的苷类化合物(大多可溶于水),经临床及药理证实皂苷具有较明显的抗菌、抗炎、止血、降血糖和抗衰老的活性[33],喹那普利可抑制血管紧张素转换酶(angiotensin converting enzyme,ACE)活性,阻止血管紧张素I转换为血管紧张素II,从而使血管紧张素II所介导的血管收缩作用明显减弱,降低动脉的血管阻力,具有降压效果。同样推测西藏栽培枸杞可能也具有抗炎、降压降糖和神经保护等作用,仍需要通过后续试验去验证。芦丁具有抗氧化、抗心肌损伤、抗菌、抗炎等药理活性[34],日喀则产宁夏枸杞中芦丁的含量相对最高,表明其具有更强的抗氧化和抗炎等药理活性。
表4 三种枸杞显著差异代谢化合物表(VIP排序前20的差异代谢物)
Table 4 Significantly different metabolic compounds of three types of Lycium chinense (Top 20 differential metabolites in VIP ranking)

组别代谢物类别VIPFC变化类型P值LH-vs-RHPE(0∶0/18∶4(6Z,9Z,12Z,15Z))甘油磷酯23.85730.0071下调2.03×10-7二氢麦角碱麦角碱及其衍生物20.08340.1578下调2.29×10-72-(β-D-吡喃甘露糖基)-L-色氨酸吲哚及其衍生物13.23820.0494下调2.65×10-132e,13z十八碳二烯醛脂肪酰基13.16480.4606下调5.55×10-6地骨皮乙素酚类12.44370.0280下调2.86×10-9N-(1-脱氧-1-果糖基)酪氨酸羧酸及其衍生物11.27890.1120下调3.72×10-11N-(1-脱氧-1-果糖基)缬氨酸羧酸及其衍生物10.51620.0935下调1.42×10-10N-(1-脱氧-1-果糖基)异亮氨酸羧酸及其衍生物10.10040.2754下调2.14×10-8Okooa-Ps甘油磷酯9.76990.1910下调2.67×10-7异黄酮4′-葡萄糖苷黄酮类化合物9.39210.0002下调6.41×10-11PGP(22∶4(7Z,10Z,13Z,16Z)/20∶5(7Z,9Z,11E,13E,17Z)-3OH(5,6,15))未分类11.844711765.9551上调6.89×10-169s,10r,13s-三羟基十八碳-11e-烯酸脂肪酰基11.769119.4303上调5.80×10-129s,10s,11r-三羟基-12z-十八烯酸脂肪酰基10.270914.3500上调1.93×10-9PGP(22∶5(7Z,10Z,13Z,16Z,19Z)/PGE2)未分类9.81731544.7529上调2.46×10-8PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/TXB2)未分类9.25452.9×1012上调4.59×10-135-十八炔酸脂肪酰基9.08718.6157上调8.52×10-8(11e,15z)-9,10,13-三羟基-11,15-十八碳二烯酸脂肪酰基8.99758.8541上调5.52×10-7PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/6keto-PGF1alpha)未分类7.537516662.2532上调2.50×10-9PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/PGE2)未分类7.039564663.7045上调7.90×10-10龙舌兰皂苷C类固醇和类固醇衍生物6.5346514.0777上调7.45×10-6LH-vs-ZH二氢麦角碱麦角碱及其衍生物23.14920.1328下调2.70×10-10N-(1-脱氧-1-果糖基)脯氨酸羧酸及其衍生物20.02160.0067下调1.13×10-10PC(18∶1(11Z)/0∶0)甘油磷酯15.15260.0029下调1.19×10-102e,13z十八碳二烯醛脂肪酰基14.97790.4211下调6.27×10-8N-(1-脱氧-1-果糖基)异亮氨酸羧酸及其衍生物13.46190.1850下调2.56×10-8芦丁黄酮类化合物11.41210.0139下调1.72×10-11Okooa-Ps甘油磷酯10.32950.1834下调1.78×10-7PE(0∶0/18∶4(6Z,9Z,12Z,15Z))甘油磷酯9.20690.0487下调4.51×10-8N-(1-脱氧-1-果糖基)缬氨酸羧酸及其衍生物9.10780.1266下调3.21×10-9PC(18∶2(2E,4E)/0∶0)甘油磷酯8.75360.0203下调4.03×10-99s,10r,13s-三羟基十八碳-11e-烯酸脂肪酰基12.304343.0766上调3.87×10-12PGP(22∶4(7Z,10Z,13Z,16Z)/20∶5(7Z,9Z,11E,13E,17Z)-3OH(5,6,15))未分类12.1899449.5708上调8.38×10-169s,10s,11r-三羟基-12z-十八烯酸脂肪酰基10.799131.8623上调1.21×10-9PGP(22∶5(7Z,10Z,13Z,16Z,19Z)/PGE2)未分类10.0910210.9747上调2.62×10-8(11e,15z)-9,10,13-三羟基-11,15-十八碳二烯酸脂肪酰基9.802964.9595上调1.96×10-7PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/TXB2)未分类9.5157281.0437上调5.09×10-135-十八炔酸脂肪酰基8.52783.9247上调7.32×10-7PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/6keto-PGF1alpha)未分类7.7422181.3467上调2.74×10-9PGP(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/PGE2)未分类7.24902703.0393上调7.93×10-11龙舌兰皂苷C类固醇和类固醇衍生物6.7292588.8434上调7.44×10-6ZH-vs-RHPE(0∶0/18∶4(6Z,9Z,12Z,15Z))甘油磷酯25.96770.1451下调8.81×10-72-(β-D-吡喃甘露糖基)-L-色氨酸吲哚及其衍生物13.37490.2998下调1.92×10-11N-(1-脱氧-1-果糖基)酪氨酸羧酸及其衍生物12.90040.1634下调7.68×10-11地骨皮乙素酚类11.64300.3708下调7.77×10-7异鼠李素3-O-[4-羟基-E-肉桂酰基-(->6)-B-D-吡喃葡萄糖基-(1->2)-A-L-吡喃鼠李糖苷]黄酮类化合物11.02960.0001下调0.000571异黄酮4′-葡萄糖苷黄酮类化合物10.87620.0347下调9.56×10-11喹那普利羧酸及其衍生物9.84040.0156下调6.84×10-75′-((Z)-阿魏基)3-(2′-甲基阿拉伯糖基木糖)肉桂酸及其衍生物9.32330.0023下调8.51×10-11山奈酚3-(4′-(E)-P-香豆素二糖苷)-7-鼠李糖苷黄酮类化合物9.21580.0000下调7.18×10-12吲哚丙烯酸吲哚及其衍生物9.17520.1055下调9.40×10-11N-(1-脱氧-1-果糖基)脯氨酸羧酸及其衍生物20.43774.8543上调1.66×10-9PC(18∶1(11Z)/0∶0)甘油磷酯16.09747.1911上调5.99×10-10芦丁黄酮类化合物11.12963.5578上调8.71×10-101-O-肉桂酰基-(6-阿拉伯糖基葡萄糖)肉桂酸及其衍生物9.663538.7997上调4.50×10-12N-(1-脱氧-1-果糖基)异亮氨酸羧酸及其衍生物9.21251.4889上调0.000274二氢麦角碱麦角碱及其衍生物8.80361.1878上调0.039757PC(18∶2(2E,4E)/0∶0)甘油磷酯8.58953.6745上调8.32×10-8阿卡比糖醛酸有机氧化物8.046967.2482上调2.76×10-12大脑啡肽羧酸及其衍生物7.93318.6201上调7.68×10-11N-(1-脱氧-1-果糖基)亮氨酸羧酸及其衍生物7.10273.0684上调1.66×10-5
2.6 差异代谢物KEGG富集分析
通过对3种枸杞的差异代谢物进行KEGG通路富集分析(图4),发现林芝苦枸杞和日喀则黑果枸杞的差异代谢物显著富集的主要代谢通路为亚油酸代谢途径、α-亚麻酸代谢途径、丙酮酸代谢途径、三羧酸循环途径、抗坏血酸和阿糖二酸代谢途径以及丙氨酸、天冬氨酸和谷氨酸代谢途径(图4-A),其中α-亚麻酸代谢途径中显著富集的差异代谢为胆固醇酯、12-氧-植物二烯酸、(6Z,9Z,11E,13S)-13-氢过氧基-6,9,11-十八碳三烯酸、(9Z,11E,13S,15Z)-13-羟基-9,11,15-十八碳三烯酸、(9S,10E,12Z,15Z)-9-羟基十八碳-10,12,15-三烯酸。林芝苦枸杞和日喀则产宁夏枸杞的差异代谢物显著富集的主要代谢通路为亚油酸代谢途径、三羧酸循环途径、抗坏血酸和阿糖二酸代谢途径、丙酮酸代谢途径、乙醛酸和二羧酸代谢途径、α-亚麻酸代谢以及以及花生四烯酸代谢途径(图4-B),其中亚油酸代谢途径中显著富集的差异代谢为(9Z,11E,13S)-13-羟基十八碳-9,11-二烯酸、γ-亚麻酸、9-氧代油酸酯、(9S,10E,12Z)-9-羟基十八碳-10,12-烯酸、(9S,10E,12Z)-9-羟基十八碳-10,12-二烯酸、9,10-二羟癸酸酯和12,13-二羟基油酸。日喀则产宁夏枸杞与日喀则黑果枸杞的差异代谢物显著富集的主要代谢通路为三羧酸循环途径、抗坏血酸和阿糖二酸代谢途径、类黄酮生物合成、亚油酸代谢途径、糖酵解/糖异生途径、丙酮酸代谢途径以及苯丙烷生物合成途径(图4-C),其中类黄酮生物合成通路中显著富集的差异代谢为槲皮素、柚皮素、绿原酸、根皮苷、柚皮素-7-O-葡萄糖苷。

图4 差异代谢物KEGG富集通路
Fig.4 Differential metabolite KEGG enrichment pathway
2.7 不同枸杞的营养关键代谢物
基于VIP值>1、log2FC绝对值≥1和FDR<0.05的筛选标准,在不同品种枸杞中共鉴定出108种对样品贡献较大的代谢物。这些化合物对枸杞品质特性的影响至关重要,主要属于脂类和类脂分子、有机氧化合物、苯丙烷和聚酮类化合物、有机杂环化合物、有机酸及其衍生物及苯环型化合物这6种类别。
脂类和类脂分子中贡献度较大的有40种,包含17种脂肪酰基类、14种甘油磷脂类、3种甘油糖脂类、3种固醇脂类、2种鞘脂类和1种类固醇和类固醇衍生物类(图5-A)。丰度相对较高的代谢化合物为5-十八炔酸、γ-亚麻酸、磷脂酰胆碱、姜糖脂A、他氟前列素、洋地黄素和磷脂酰乙醇胺。γ-亚麻酸具有抗肿瘤、降血压和降血糖等生物活性[35],林芝苦枸杞中γ-亚麻酸的相对丰度最高。磷脂酰胆碱已被证明具有保护肝脏损伤的作用[36],日喀则产宁夏枸杞中其相对丰度最高。他氟前列素具有增加视神经乳头血流、降低眼压和神经保护的作用[37],同样在日喀则产宁夏枸杞中其相对丰度最高。有机氧化合物类中贡献度最高的化合物有17种,包括碳水化合物和碳水化合物结合物类化合物16种,醇类和多元醇类化合物1种,其中丰度相对较高的化合物为D-葡萄糖醛酸、木麻黄6-α-D-葡萄糖苷、隐绿原酸、阿卡比糖醛酸、海藻酸丙二醇酯和Am-LPE(16∶0/0∶0)(图5-B)。隐绿原酸具有抗氧化、抑菌、降压和降脂等生理活性[38],本研究中日喀则黑果枸杞中其相对丰度高于其他2种枸杞。海藻酸丙二醇酯具有增稠性和酸稳定性,具有很高的商业价值而且得到了广泛的应用[39],日喀则产宁夏枸杞中其相对丰度最高。温度也会影响碳水化合物和有机化合物的含量,且较低的温度会诱导还原糖和有机化合物的积累[40],因此初步推测3种枸杞中有机氧化合物类的物质的积累主要是由品种差异造成的,但有可能和温度也存在一定的关系。由图5-C所示,苯丙烷和聚酮类化合物中贡献度高的化合物有17种,其中黄酮类化合物9种、香豆素及其衍生物类化合物2种、肉桂酸及其衍生物类化合物2种、2-芳基苯并呋喃黄酮类化合物2种、芪类化合物1种和3,4-二氢香豆素类化合物1种,其中丰度相对较高的化合物为克罗酰胺、芦丁、异槲皮苷、槲皮素、虎杖苷B、亚茶碱、棉子素3-芸香糖苷、异黄酮4′-葡萄糖苷和3-羟基香豆素。芦丁、异槲皮苷和槲皮素具有抗炎抑菌、抗病毒、抗氧化、提高免疫力等作用[41-42],且在日喀则产宁夏枸杞中三者的相对丰度均最高,与差异代谢物分析结果一致,同时也表明日喀则产宁夏枸杞更适合用于苯丙烷和聚酮类生物活性物质挖掘与开发。研究表明,芦丁既是黑果枸杞中黄酮类化合物的主要成分,也是红枸杞中主要的黄酮类化学物质[43],与本研究结果一致,表明芦丁可能是影响枸杞果实黄酮含量的代谢标志物,在果实品质方面发挥着重要作用。有机杂环化合物中贡献度较高的化合物有11种(图5-D),其中丰富度相对较高的化合物为L-色氨酸、2-羟基丙咪嗪葡萄糖醛酸、布瑞哌唑、异丙酯,且以上化合物在日喀则2种枸杞中的相对丰度要高于林芝苦枸杞。苯环型化合物中贡献度较高的化合物有8种(图5-E),其中丰富度相对较高的化合物为伐哌前列素、地骨皮乙素、莫匹胺和苯甲酸双环霉素,地骨皮乙素其具有抗炎及神经保护作用[32],其中日喀则黑果枸杞中其相对丰度最高,即枸杞品种不同苯环型化合物的相对丰度同样存在一定的差异。有机酸及其衍生物中贡献度较高的化合物有11种(图5-F),其中丰度相对较高的化合物为赖诺普利、N-(1-脱氧-1-果糖基)亮氨酸、L-2-氨基-5-羟基戊酸和吲哚丙烯酰甘氨酸,赖诺普利具有降压和纠正脂质代谢紊乱的作用[44],并且在林芝苦枸杞中其相对丰度最高,因此林芝苦枸杞在后期的开发过程中有必要关注其有机酸及其衍生物类化合物的活性功能。

A-脂类和类脂分子;B-有机氧化合物;C-苯丙烷和聚酮类化合物;D-有机杂环化合物;E-苯环型化合物;F-有机酸及其衍生物
图5 三种枸杞主要代谢分类差异热图
Fig.5 Heat map of the main metabolic classification differences of the three types of Lycium chinense
总之,3种西藏产枸杞果实主要差异代谢物为脂类和类脂分子、苯丙烷和聚酮类以及有机氧化物类三大类化合物的数量较多,构成了西藏产3种枸杞活性物质含量的差异性,且赋予了西藏产枸杞特殊的品质。例如,日喀则产宁夏枸杞中芦丁、异槲皮苷和槲皮素丰度最高,该品种更适合用于黄酮类活性物质的提取。林芝苦枸杞中赖诺普利的丰度相对较高,后期应适当关注其有机酸及其衍生物类的物质的功能活性。
3 结论
本研究检测分析了西藏栽培的3种枸杞的基本营养成分及代谢物差异。林芝苦枸杞总糖含量最低,药用氨基酸和必需氨基酸等含量最高,达到理想蛋白的要求,表明其可能含有较高的功效成分,同时,甜味氨基酸的占比最低,而苦味氨基酸的占比最高,与其品尝滋味一致。3种枸杞果实样品中,共鉴定出7 101个代谢物,其中脂类和类脂分子最多。3种西藏栽培枸杞因其品种差异,分别具有不同的代谢特征,且差异显著代谢物(前20种)可作为区分3种枸杞的品种的主要代谢物。3种枸杞的差异代谢物主要富集在亚油酸代谢途径、α-亚麻酸代谢途径和三羧酸循环途径等,主要参与的代谢物有胆固醇酯、12-氧-植物二烯酸、γ-亚麻酸和9-氧代油酸酯等。3种枸杞果实中共鉴定出的108种贡献较大的代谢物,主要属于脂类和类脂分子、苯丙烷和聚酮类以及有机氧化物类,同时它们也构成了西藏产3种枸杞活性物质含量的差异性,且赋予了西藏产枸杞特殊的品质。本研究仅分析了西藏栽培的3种枸杞的基本营养成分、氨基酸组成以及主要代谢特征,后期仍需要在此基础上开展更加深入和精准靶向代谢物差异的研究及功能活性的开发研究,尤其是苦枸杞功能活性成分的挖掘和验证。
[1] 蒋锡龙, 孙玉霞, 董兴全, 等.不同酿酒酵母发酵桃果酒香气成分研究[J].食品工业科技, 2013, 34(21):91-96.JIANG X L, SUN Y X, DONG X Q, et al.Study on aromatic components of peach fruit wine fermented with different yeast strains[J].Science and Technology of Food Industry, 2013, 34(21):91-96.
[2] 张克勤, 孙西予, 董赛君, 等.枸杞起泡酒发酵菌株的筛选及其功效研究[J].食品与发酵科技, 2020, 56(2):17-26;68.ZHANG K Q, SUN X Y, DONG S J, et al.Screening of fermentation strains and efficacy studies of wolfberry sparkling wine[J].Food and Fermentation Sciences &Technology, 2020, 56(2):17-26;68.
[3] 钱丹, 纪瑞锋, 郭威, 等.中国枸杞属种间亲缘关系和栽培枸杞起源研究进展[J].中国中药杂志, 2017, 42(17):3282-3285.QIAN D, JI R F, GUO W, et al.Advances in research on relationships among Lycium species and origin of cultivated Lycium in China[J].China Journal of Chinese Materia Medica, 2017, 42(17):3282-3285.
[4] XIE D M, ZHANG X B, QIAN D, et al.Lycium amarum sp.nov.(Solanaceae) from Xizang, supported from morphological characters and phylogenetic analysis[J].Nordic Journal of Botany, 2016, 34(5):538-544.
[5] 万宁.枸杞果实功能成分提取分离技术研究[D].哈尔滨:东北林业大学, 2023.WAN N.Study on extraction and separation technology of functional components from Lycium barbarum fruit[D].Harbin:Northeast Forestry University, 2023.
[6] WANG Y X, LI J M, XU Z Z, et al.The formation process of green substances in Chrysanthemum morifolium tea[J].Food Chemistry, 2020, 326:127028.
[7] LIU P F, WANG L, DU Q X, et al.Chemotype classification and biomarker screening of male Eucommia ulmoides Oliv.flower core collections using UPLC-QTOF/MS-based non-targeted metabolomics[J].PeerJ, 2020, 8:e9786.
[8] TAN J F, DAI W D, LU M L, et al.Study of the dynamic changes in the non-volatile chemical constituents of black tea during fermentation processing by a non-targeted metabolomics approach[J].Food Research International, 2016, 79:106-113.
[9] JOHNSON C H, IVANISEVIC J, SIUZDAK G.Metabolomics:Beyond biomarkers and towards mechanisms[J].Nature Reviews Molecular Cell Biology, 2016, 17(7):451-459.
[10] AN Y L, LI Y, WEI W L, et al.Species discrimination of multiple botanical origins of Fritillaria species based on infrared spectroscopy, thin layer chromatography-image analysis and untargeted metabolomics[J].Phytomedicine, 2024, 123:155228.
[11] NAZ S, VALLEJO M, GARC A A, et al.Method validation strategies involved in non-targeted metabolomics[J].Journal of Chromatography A, 2014, 1353:99-105.
A A, et al.Method validation strategies involved in non-targeted metabolomics[J].Journal of Chromatography A, 2014, 1353:99-105.
[12] QIN D D, WANG Q S, LI H J, et al.Identification of key metabolites based on non-targeted metabolomics and chemometrics analyses provides insights into bitterness in Kucha[Camellia kucha (Chang et Wang) Chang][J].Food Research International, 2020, 138:109789.
[13] 李淑芳, 刘继红, 尹海燕, 等.基于超高效液相色谱-高分辨质谱的非靶向代谢组学技术结合化学计量学对信阳茶树品种差异的研究[J].分析测试学报, 2022, 41(2):149-155.LI S F, LIU J H, YIN H Y, et al.Study on difference of tea cultivars planted in Xinyang by non-targeted metabolomics with chemometrics based on ultrahigh performance liquid chromatography-high resolution mass spectrometry[J].Journal of Instrumental Analysis, 2022, 41(2):149-155.
[14] 唐雪妹, 赵晓丽, 高毓文, 等.基于UPLC-Q-orbitrap-MS的非靶向代谢组学用于不同橄榄品种差异代谢物分析[J].热带作物学报, 2021, 42(12):3416-3423.TANG X M, ZHAO X L, GAO Y W, et al.Untargeted metabolomics analysis of different olive varieties by UPLC-Q-orbitrap-MS mass spectrometry[J].Chinese Journal of Tropical Crops, 2021, 42(12):3416-3423.
[15] WANG Q S, YANG K, WEI X Y, et al.Untargeted metabolomics analysis reveals dynamic changes in co-fermentation with human milk-derived probiotics and Poria cocos[J].Frontiers in Microbiology.2022, 13:1032870.
[16] 马瑞雪.基于多组学技术的不同产地“宁杞1号”枸杞黄酮类化合物生物合成差异研究[D].银川:宁夏大学, 2023.MA R X.Study on the difference of biosynthesis of flavonoids in “Ningqi No.1” Lycium barbarum from different regions based on multiomics technology[D].Yinchuan:Ningxia University, 2023.
[17] 汤丽华, 马雪梅, 张瑶, 等.基于非靶向代谢组学分析不同品种宁夏枸杞差异性代谢物[J].食品安全质量检测学报, 2022, 13(24):8083-8090.TANG L H, MA X M, ZHANG Y, et al.Differential metabolites analysis on different varieties of Lycium barbarum L.based on non-targeted metabolomics[J].Journal of Food Safety and Quality, 2022, 13(24):8083-8090.
[18] 苏庆宇.枸杞原浆感官词典的建立及主要风味物质研究[D].北京:北京林业大学, 2022.SU Q Y.Establishment of sensory dictionary of Lycium barbarum puree and study on main flavor substances[D].Beijing:Beijing Forestry University, 2022.
[19] 牛世蓉, 李敏敏, 崔伟业, 等.高压蒸汽热加工对滇黄精抗氧化及抗炎活性的影响[J].食品工业科技, 2025, 46(10):351-359. NIU S R, LI M M, CUI W Y, et al.Effects of high pressure steam processing on antioxidant and anti-inflammatory activities of Polygonatum kingianum[J].Science and Technology of Food Industry, 2025, 46(10):351-359.
[20] 胡来丽.不同加工工艺中百香果生理活性物质量变规律研究[D].贵阳:贵州大学, 2022.HU L L.Study on quantitative change law of physiological active substances of passion fruit in different processing technologies[D].Guiyang:Guizhou University, 2022.
[21] 潘鑫.香豆素抑制藜麦籽粒及穗发芽的作用研究[D].成都:成都大学, 2024.PAN X.Study on the inhibitory effect of coumarin on quinoa grain and pre-harvest sprouting[D].Chengdu:Chengdu University, 2024.
[22] 郑耀文.基于稳定同位素及营养组分的枸杞产地识别技术研究[D].西宁:青海大学, 2019.ZHENG Y W.Study on origin identification of Lycium barbarum L. stable isotope and nutrient components[D].Xining:Qinghai University, 2019.
[23] 闫亚美, 米佳, 张锋锋, 等.宁夏枸杞干果的表观性状与主要营养成分含量的相关性[J/OL].食品科学技术学报, 2024.https://link.cnki.net/urlid/10.1151.TS.20240918.1043.002.YAN Y M, MI J, ZHANG F F, et al.Study on the correlation between phenotype characters and main nutrient contents of dried fruits of Lycium barbarum L.[J/OL].Journal of Food Science and Technology, 2024.https://link.cnki.net/urlid/10.1151.TS.20240918.1043.002.
[24] QIN X Y, YIN Y, ZHAO J H, et al.Metabolomic and transcriptomic analysis of Lycium chinese and L.ruthenicum under salinity stress[J].BMC Plant Biology, 2022, 22(1):8.
[25] YANG T T, HU Y H, YAN Y M, et al.Characterization and evaluation of antioxidant and anti-inflammatory activities of flavonoids from the fruits of Lycium barbarum[J].Foods, 2022, 11(3):306.
[26] 李强, 何彩, 史星雲, 等.不同种源黑果枸杞果实游离氨基酸的品质评价[J].经济林研究, 2023, 41(1):26-35.LI Q, HE C, SHI X Y, et al.Quality evaluation of free amino acids in fruits for different provenances of Lycium ruthenicum[J].Non-wood Forest Research, 2023, 41(1):26-35.
[27] 周琪乐, 龚凌慧, 纪凤娣, 等.红枸杞、黄枸杞和黑枸杞营养成分比较[J].中国酿造, 2021, 40(10):43-49.ZHOU Q L, GONG L H, JI F D, et al.Comparison of nutritional constituents of red wolfberry, yellow wolfberry and black wolfberry[J].China Brewing, 2021, 40(10):43-49.
[28] 郭家平, 陈怡雪, 王亚盟, 等.不同产地黑果枸杞的蛋白质营养价值评价[J].食品工业, 2020, 41(9):336-340.GUO J P, CHEN Y X, WANG Y M, et al.The evaluation of protein nutritional value of Lycium ruthenicum Murray from different habitats[J].The Food Industry, 2020, 41(9):336-340.
[29] 许雯蔚.二氢麦角碱在阿尔茨海默病治疗中的应用分析[J].北方药学, 2017, 14(1):72-73.XU W W.Application of dihydroergo toxine in the treatment of Alzheimer’s disease[J].Journal of North Pharmacy, 2017, 14(1):72-73.
[30] 何文彬.基于代谢组学的黑枸杞醇提物抗阿尔茨海默病作用机制研究[D].济南:山东第一医科大学, 2019.HE W B.Study on the mechanism of the ethanol extraction of Lycium ruthenium Murr against Alzheimer’s disease based on metabolomics[D].Jinan:Shandong First Medical University, 2019.
[31] 叶红霞, 贺颖西, 齐妍强, 等.枸杞多糖对阿尔茨海默病合并2型糖尿病小鼠学习记忆能力及脑内Tau蛋白磷酸化水平的影响[J].石河子大学学报(自然科学版), 2023, 41(3):360-366.YE H X, HE Y X, QI Y Q, et al.Effect of Lycium barbarum polysaccharides on learning and memory ability and Tau protein phosphorylation level in brain with Alzheimer’s disease and type 2 diabetes mellitus mice[J].Journal of Shihezi University(Natural Science), 2023, 41(3):360-366.
[32] 陈亮, 王谊鹏.地骨皮乙素对创伤性脑损伤继发氧化应激损伤的影响[J].解剖科学进展, 2022, 28(4):421-423;428.CHEN L, WANG Y P.Effect of Kukoamine B on oxidative stress induced by traumatic brain injury in rats[J].Progress of Anatomical Sciences, 2022, 28(4):421-423;428.
[33] 王川.龙舌兰皂苷的提取工艺[J].食品与发酵工业, 2008, 34(11):190-193.WANG C.Extracting technology of total saponin from maguey[J].Food and Fermentation Industries, 2008, 34(11):190-193.
[34] 谷雨薇, 陈思懿, 吴松昊, 等.药食同源草果抗微生物活性研究进展[J].食品与发酵科技, 2024, 60(3):86-91.GU Y W, CHEN S Y, WU S H, et al.Research progress on the anti-microbial activity of amomum tsao-ko in medicinal food homology[J].Food and Fermentation Science &Technology, 2024, 60(3):86-91.
[35] 李依阳.植物源抽提物抑制乳腺癌功能研究[D].郑州:河南农业大学, 2024.LI Y Y.Study on the inhibitory effect of plant-derived extracts on breast cancer[D].Zhengzhou:Henan Agricultural University, 2024.
[36] 李垚然.丙烯酰胺肝脏毒性的干预作用机制及其内外暴露关联和风险评估[D].杭州:浙江大学, 2023.LI Y R.Interventional mechanisms of acrylamide hepatotoxicity and its internal and external exposure associations and risk assessment[D].Hangzhou:Zhejiang University, 2023.
[37] 唐潇.他氟前列腺素在高眼压症治疗的中医寒热证型疗效差异与相关性研究[D].成都:成都中医药大学, 2023.TANG X.Study on the difference and correlation of therapeutic effect of tafluprostaglandin in the treatment of ocular hypertension with traditional Chinese medicine cold and heat syndrome[D].Chengdu:Chengdu University of Traditional Chinese Medicine, 2023.
[38] 李倩, 张洁, 雷凤梅, 等.核桃花中绿原酸、新绿原酸和隐绿原酸的提取工艺优化及其抗氧化活性研究[J].食品安全质量检测学报, 2024, 15(11):284-293.LI Q, ZHANG J, LEI F M, et al.Optimization of extraction technology and antioxidant activity of chlorogenic acid, neochlorogenic acid and cryptochlorogenic acid from walnut flowers[J].Journal of Food Safety and Quality, 2024, 15(11):284-293.
[39] 黄明丽.酪蛋白酸钠与藻酸丙二醇酯相互作用及其对鱼油乳状液稳定性的影响[D].青岛:中国海洋大学, 2014.HUANG M L.Interaction between sodium caseinate and propylene glycol alginate and its effect on the stability of fish oil emulsion[D].Qingdao:Ocean University of China, 2014.
[40] JUNG Y, LEE J, KIM H K, et al.Metabolite profiling of Curcuma species grown in different regions using 1H NMR spectroscopy and multivariate analysis[J].The Analyst, 2012, 137(23):5597-5606.
[41] 梁梓敏.芒果止咳片质量控制方法研究[D].南宁:广西中医药大学, 2020.LIANG Z M.Study on quality control method of mango Zhike Tablets[D].Nanning:Guangxi University of Chinese Medicine, 2020.
[42] 谭丽, 龙江兰, 曾志华, 等.基于网络药理学和代谢组学探讨黄芪四妙汤治疗2型糖尿病的作用机制[J].中国中药杂志, 2024, 49(15):4207-4219.TAN L, LONG J L, ZENG Z H, et al.Mechanism of Huangqi Simiao Decoction in treatment of type 2 diabetes mellitus based on network pharmacology and metabonomics[J].China Journal of Chinese Materia Medica, 2024, 49(15):4207-4219.
[43] 毕冉冉, 赵圆, 孙玉敬.枸杞植物化学成分调节肠道菌群及相关生理功能的研究进展[J].浙江大学学报(农业与生命科学版), 2024, 50(1):25-34.BI R R, ZHAO Y, SUN Y J.Research advances on regulating intestinal flora and their physiological functions by phytochemicals of goji berry[J].Journal of Zhejiang University(Agriculture and Life Sciences), 2024, 50(1):25-34.
[44] 凌伟.肾脏脂质紊乱的病理特征及其与RAS激活的关系[D].长沙:中南大学, 2022.LING W.Pathological characteristics of renal lipid disorder and its relationship with RAS activation[D].Changsha:Central South University, 2022.