粮食、水果、蔬菜等农作物一直是人类食物的重要来源,病虫害的频繁暴发,为农业生产带来了巨大损失。丁烯基多杀菌素是一种新型生物杀虫剂,由须糖多孢菌(Saccharopolyspora pogona)有氧发酵产生,具有高效、半衰期短、低残留、绿色安全、见光易分解等优点[1-2]。不仅有杀虫、杀螨和杀寄生虫活性,同时还可以杀灭其类似物多杀菌素难以控制的苹果蠹蛾、烟青虫、马铃薯甲虫等害虫。在粮食,果蔬农作物的生产、贮藏及环境发展等方面有着极大的应用潜力[3-4]。但须糖多孢菌合成丁烯基多杀菌素的能力低下,尚不能实现工业化生产。挖掘丁烯基多杀菌素合成的限速步骤,进行精准基因工程改造是获得高产工程菌株的有效方法[5-7]。
目前,丁烯基多杀菌素的生物合成途径已被全面研究,其结构中主要包含大环内酯糖苷配基、鼠李糖基团和福乐糖胺基团3个部分,由5个聚酮合成酶基因、4个聚酮桥接基因、12个糖生物合成基因、2个糖基转移酶基因,共23个基因负责催化合成(图1)。其中,busH、busI、busK编码的O-甲基转移酶分别使鼠李糖的2、3、4号位甲基化[8]。鼠李糖甲基化不完全时会获得2′-O-demethyl spinosyn α1或3′-O-demethyl spinosyn α1等低生物活性的丁烯基多杀菌素衍生物[9-10]。因此,鼠李糖甲基化在丁烯基多杀菌素生物合成中至关重要。O-甲基转移酶的甲基供体S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)由L-甲硫氨酸和ATP通过蛋氨酸腺苷转移酶(methionine adenosyltransferase,MAT)即SAM合成酶催化生成[11],是次级代谢产物甲基化修饰的重要前体[12]。OCHI等[13]和HUH等[14]通过发酵优化在发酵培养基中添加SAM,增强了灰黄色链霉菌、天蓝色链霉菌和阿维链霉菌中抗生素的合成,阿维菌素的产量提升6倍[15]。过表达MAT基因metK促进SAM合成也可以增强菌株中次级代谢物的产生,使阿维链霉菌和佩克链霉菌中的阿维菌素及阿霉素的产量分别提高了2倍和3.5倍[16]。大量研究表明,SAM除了能够作为前体,同时还可以作为激活转录调控因子的效应因子[17-18],提高产物合成途径中的其他前体物质[19],影响菌株生长代谢[20],从而促进次级代谢产物的合成。
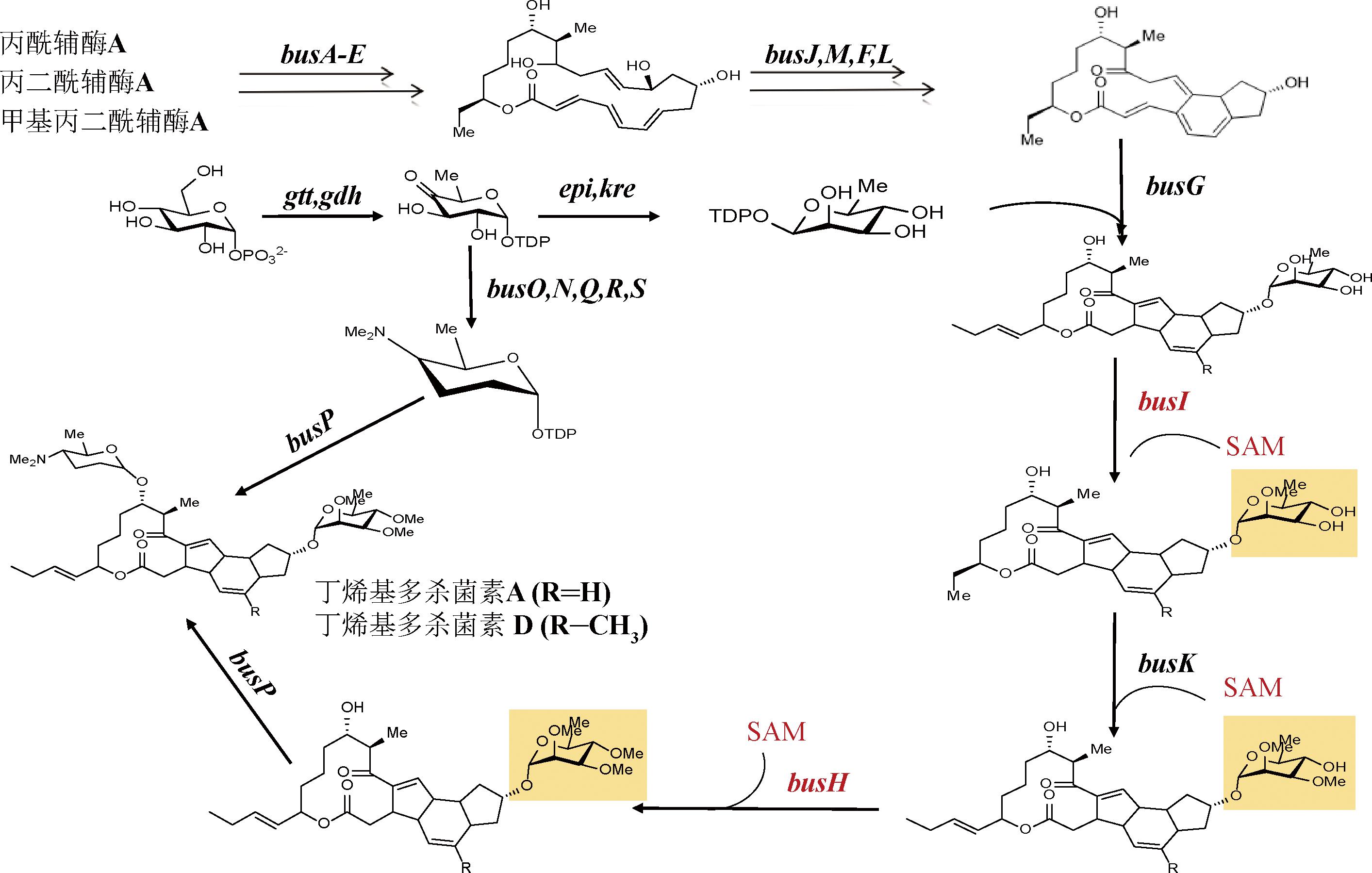
图1 须糖多孢菌中丁烯基多杀菌素的合成途径
Fig.1 Synthetic pathway of butenyl-spinosyn in Saccharopolyspora pogona
基于实验室前期获得的S.pogona ASAGF58[21]蛋白质组学数据[22],发现蛋白质MAT含量具有显著差异。本研究通过在发酵培养基中添加SAM,对内源MAT蛋白进行挖掘及催化能力测定,O-甲基转移酶和MAT基因组合过表达的方式来探究鼠李糖甲基化途径对丁烯基多杀菌素合成的影响。最后对高产工程菌株的生长代谢特性、基因的表达水平进行比较分析,探究了工程菌株的高产机制,为后续高产须糖多孢菌基因工程改造提供依据。
1 材料与方法
1.1 菌株和质粒
本研究用于构建须糖多孢菌基因工程菌株的相关质粒和菌株如表1所示。
表1 质粒和菌株
Table 1 The plasmids and strains

菌种和质粒描述来源Plasmid:pSET159pSET152质粒衍生物aac(3)IV实验室构建pET28a蛋白表达质粒实验室保藏pET28a-MetK1MetK1蛋白表达质粒本研究构建pET28a-MetK2MetK2蛋白表达质粒本研究构建pSET159-busI/busK/busHO-甲基转移酶基因单独过表达质粒本研究构建pSET159-metK1/metK2metK基因单独过表达质粒本研究构建pSET159-metK1/metK2-busI/busK/busHmetK与busI/busK/busH的组合过表达质粒本研究构建E.coli:DH5α大肠杆菌感受态细胞实验室保藏S17-1接合转移制备供体菌所用大肠杆菌实验室保藏BL21(DE3)蛋白表达所用大肠杆菌实验室保藏M-02MetK1蛋白表达菌株本研究构建M-36MetK2蛋白表达菌株本研究构建S.pogona:ASAGF58须糖多孢菌野生菌株实验室保藏M1metK1基因的过表达菌株本研究构建M2metK2基因的过表达菌株本研究构建S1busI基因的过表达菌株本研究构建S2busK基因的过表达菌株本研究构建S3busH基因的过表达菌株本研究构建I-1metK1和busI的组合过表达菌株本研究构建I-2metK2和busI的组合过表达菌株本研究构建H-1metK1和busH的组合过表达菌株本研究构建H-2metK2和busH的组合过表达菌株本研究构建K-1metK1和busK的组合过表达菌株本研究构建K-2metK2和busK的组合过表达菌株本研究构建
1.2 培养条件及主要试剂
大肠杆菌(Escherichia coli)在LB培养基(胰蛋白胨10 g/L、NaCl 10 g/L、酵母提取物5 g/L)中于37 ℃,200 r/min培养;须糖多孢菌在课题组建立的种子培养基及发酵培养基[23]中培养,培养条件为30 ℃,200 r/min。TSB(tryptic soy broth 30 g/L)培养基及固体GYM(glucose yeast malt broth)培养基(葡萄糖4.0 g/L、酵母浸粉4.0 g/L、麦芽提取物10.0 g/L、CaCO3 2.0 g/L、琼脂20.0 g/L)主要用于孢子纯化和扩培,接合转移采用MISP4培养基(可溶性淀粉10.0 g/L、磷酸氢二钾1.0 g/L、氯化钠1.0 g/L、硫酸铵2.0 g/L、CaCO3 2.0 g/L、酵母提取物0.5 g/L、蛋白胨1.0 g/L、无机盐溶液1.0 mL/L、琼脂20.0 g/L)。
Phanta max Super-Fidelity DNA聚合酶、Gibson mix,南京诺唯赞生物科技股份有限公司;质粒小提试剂盒,天根生化科技(北京)有限公司;基因组提取试剂盒、琼脂糖凝胶回收试剂盒,普洛麦格(北京)生物技术有限公司;酵母提取物、胰蛋白胨,英国 Oxoid 公司。各抗生素购自Sigma公司,使用质量浓度分别为:安普霉素50 μg/mL;萘啶酮酸25 μg/mL;卡纳霉素50 μg/mL;氯霉素25 μg/mL。SAM,北京索莱宝科技有限公司;SAM酶联免疫试检测剂盒,酶联生物。本研究所用引物均由生工生物工程(上海)股份有限公司合成。
1.3 SAM的外源添加及胞内/胞外SAM浓度的测定
参考XU等[24]所述方法,在发酵培养基中外源添加SAM并对胞内胞外样品进行制备。配制0.1 mol/L的SAM母液,在接种菌株ASAGF58后的发酵培养基中添加SAM,使培养基中的SAM终浓度分别为0、0.5、1、2 mmol/L。利用SAM酶联免疫检测试剂盒进行胞内和胞外SAM含量的检测,方法参照试剂盒说明书。
1.4 工程菌株的构建
构建MetK1和MetK2蛋白表达质粒及单独或组合过表达鼠李糖甲基化相关基因的质粒,基因表达系统如图2-a所示。MetK1和MetK2蛋白表达质粒的构建以须糖多孢菌ASAGF58为模板,使用pET28a-metK1-F/R和pET8a-metK2-F/R引物扩增1.2 kb左右且带有25 bp同源臂的片段用于Gibson组装,同时以质粒pET28a为模板利用pET28a-F/R引物对PCR扩增得到的片段作为Gibson载体,转化到感受态细胞DH5α中并涂布于LB抗性平板上过夜培养。在pET28a载体T7启动子的上游及目的基因下游设计验证引物T-pET28a-F/R,对LB抗性平板上长出的菌落进行验证,将验证正确的菌落在相应抗性LB液体培养基中培养后提取质粒,通过电转化法将质粒转入大肠杆菌BL21(DE3)中获得MetK1、MetK2的表达菌株M-02和M-36。
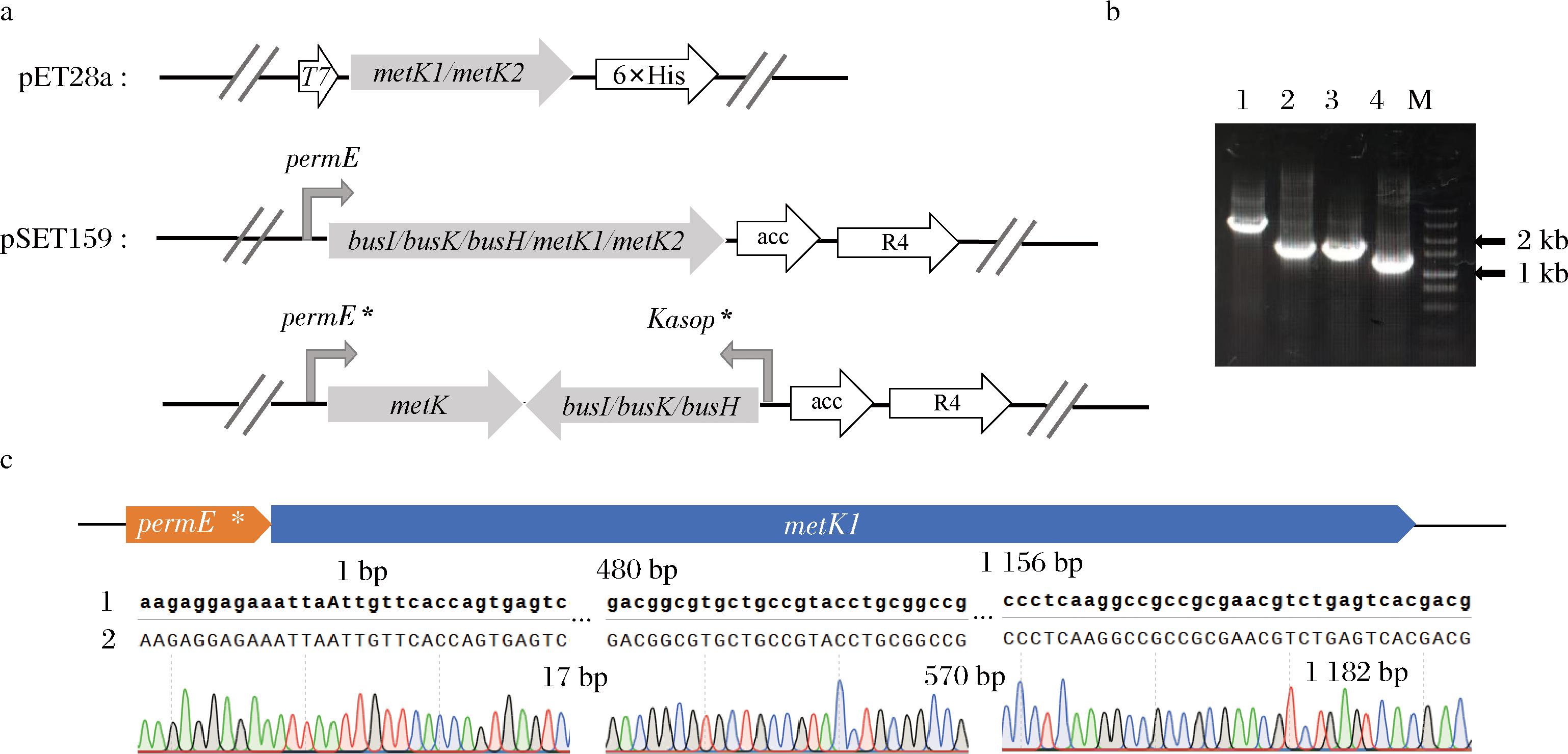
M-5 kb DNA Marker;泳道1~4-携带质粒pSET159-metK-busI、pSET159-busI、pSET159-busK、pSET159-busH的菌落。
a-重组质粒表达系统示意图;b-菌落PCR验证;c-菌株测序结果
图2 重组质粒表达系统示意图及菌落PCR验证
Fig.2 Schematic of recombinant plasmid expression system and colony PCR verification
注:图c测序结果以M1菌株为例,序列1为质粒图谱序列,metK1为GenbanK中对应序列;序列2为菌株测序序列。
过表达工程菌株则是以课题组前期构建的位点特异性重组质粒pSET159-permE为模板,使用159-F/permE-R引物扩增的片段作为Gibson载体;分别以重组质粒pSET159-Kasop*和S.pogona ASAGF58基因组为模板,PCR扩增得到基因片段:强启动子Kasop*、metK1、metK2、busI、busK和busH,Gibson组装后,转化到感受态细胞S17-1涂布于LB抗性平板上过夜培养。对长出的菌落进行验证如图2-b所示。之后将验证正确的菌落送往生工生物公司进行测序结果如图2-c所示,将测序正确的菌株作为供体菌株,通过接合转移[25]将过表达质粒转化到受体须糖多孢菌S.pogona ASAGF58中并整合到其基因组attB位点上。使用引物F/R对平板上长出的接合子进行验证,可扩增出1.5 kb的片段即为成功整合菌株,相关引物如表2所示。
表2 用于菌株构建的引物
Table 2 Primers for strain construction

引物序列(5′-3′)用途pET28a-metK1-FcagcaaatgggtcgcggatccgaattcttgttcaccagtgagtccgtgaccgaaggMetK1蛋白基因pET28a-metK1-RgagtgcggccgcaagcttgtcgactcagacgttcgcggcggccttpET28a-metK2-FacagcaaatgggtcgcggatccgaattcgtgagtgagatcaaccgcaggttgttcaccMetK2蛋白基因pET28a-metK2-RcgagtgcggccgcaagcttgtcgactcagatgccggcggcgctcttpET28a-Fgtcgacaagcttgcggccgcactc扩增pET28apET28a-RgaattcggatccgcgacccatttgctgtT-pET28a-Ftcatcatcacagcagcggcctgg蛋白表达质粒克隆验证T-pET28a-Rcgggctttgttagcagccggatctc159-Fgcgcgatatcgaattcgtaatcat扩增pSET159-permEpermE-RtaatttctcctctttaatgttaaacaaaattatttctagT159-Ftatgttgatcggcactttgc质粒克隆验证T159-RgagttagctcactcattaggKasop∗-Fcccagtcacgacgttgtaaaacgactgttcacattcgaaccgtctctgctttg克隆Kasop∗启动子Kasop∗-RaactcccccagtcctgcacmetK1-FtttaacattaaagaggagaaattattgttcaccagtgagtccgtgacmetK1-RccgtcgttttacaacgtcgtgactcagacgttcgcggcggmetK2-FtgtttaacattaaagaggagaaattagtgagtgagatcaaccgcaggttgttcaccametK2-RccgtcgttttacaacgtcgtgactcagatgccggcggcgctctbusI-Fcatgattacgaattcgatatcgcgctcagccggcgctgcgcag鼠李糖甲基化相关途径基因busI-RgtttaacattaaagaggagaaattatgttcacattcgaaccgtctctgctttgbusK-FgtttaacattaaagaggagaaattaatgtccgcaacgcacgagatcgaaabusK-RggccgtcgttttacaacgtcgtgactcacttgtcctccgcgctgttcacgbusH-FgtttaacattaaagaggagaaattaatgccctcccagaacgcgctgtabusH-RctggccgtcgttttacaacgtcgtgactcaccagctgcggcgccagFccgcttactttcaaccgaggcg接合子验证Rcttctgctcgccctcgtagg
1.5 MetK1和MetK2的诱导表达及酶活性测定
将菌株M-02和M-36在Kana抗性的液体LB中培养至OD600值为0.6~0.8,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)进行诱导,于30 ℃,160 r/min培养10 h。
取诱导后的菌液2 mL,5 000 r/min离心2 min收集菌体,用PBS反复洗涤2次后重悬,并利用紫外分光光度计调整菌液浓度,使OD600值为2。取500 μL 重悬的菌液置于冰水浴中进行超声破碎,4 ℃,12 000 r/min离心10 min收集上清液获取粗酶液。如文献[26]中所述方法设定反应混合物(1 mL,粗酶液500 μL),将MetK1和MetK2进行体外催化反应,使用SAM酶联免疫测试试剂盒检测SAM的生成量来反应MAT的酶活力。
1.6 须糖多孢菌发酵参数的测定
在菌株发酵的第3、5、7天取样发酵液对须糖多孢菌相关发酵参数进行测定,发酵液中丁烯基多杀菌素的含量、菌株生物量、葡萄糖的消耗量均按照文献[27]所述方式进行测定。pH值采用梅特勒托利多仪器有限公司的FE20型pH计测定。
1.7 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)
采用TRIzol法提取总RNA(Thermo Fisher官网),cDNA通过Thermo Fisher逆转录试剂盒获得,方法参见Thermo Fisher公司逆转录试剂盒说明书(货号K1691):基因相对表达量的测定使用TaKaRa公司SYBR荧光定量试剂盒(货号RR42LR),ASAGF58中第3、5、7天的cDNA为对照样品Control(C),其余样品为测试样品Test(T),参照基因Reference(R)为16S rRNA,其余基因为测试基因Sample(S)。以ΔΔCt方法计算测试基因的差异倍数[28],对目标基因的mRNA表达水平进行比较分析,相关引物如表3所示。
表3 用于qRT-PCR的引物
Table 3 Primers for qRT-PCR

引物 序列(5′-3′)qbusI-FaatcggcctggagatcacttqbusI-RgcgtcgaaccggagaacaqmetK-FtaccgcaaccttcgtcaaccqmetK-RcactacctcccgactggctcqbldD-FtcgtcgggtcctatgagcgqbldD-RtcacaactttggtggcaggcqwhiA-FccgacgggctgaggtttcqwhiA-Rgtgcccgaacagctcgtgq16S-Fggggtggttacgggatctgtq16S-Rcatcaaaggcatcagcgaaca
1.8 数据分析
本文章中设置3个平行实验,将所得数据进行标准差计算即所得图示中的误差棒;所有结果的显著性差异分析均采用t检验,*表示P<0.1,**表示P<0.05,***表示P<0.01;相对产量(%)表示目标产物产量与对照菌株产量的比值。
2 结果与分析
2.1 外源添加SAM对丁烯基多杀菌素合成的影响
在野生型菌株ASAGF58的发酵培养基中添加SAM,摇瓶发酵后检测丁烯基多杀菌素含量。结果显示(图3-a),随着培养基中SAM浓度的增加,丁烯基多杀菌素产量没有显著变化。进一步对菌株胞内SAM含量进行检测,以不添加SAM为对照(图3-b),胞内SAM浓度有所增加,SAM可以通过跨膜运输进入胞内。推测外源添加的SAM不被菌株所利用从而使SAM的外源添加对菌株ASAGF58合成丁烯基多杀菌素没有促进作用。
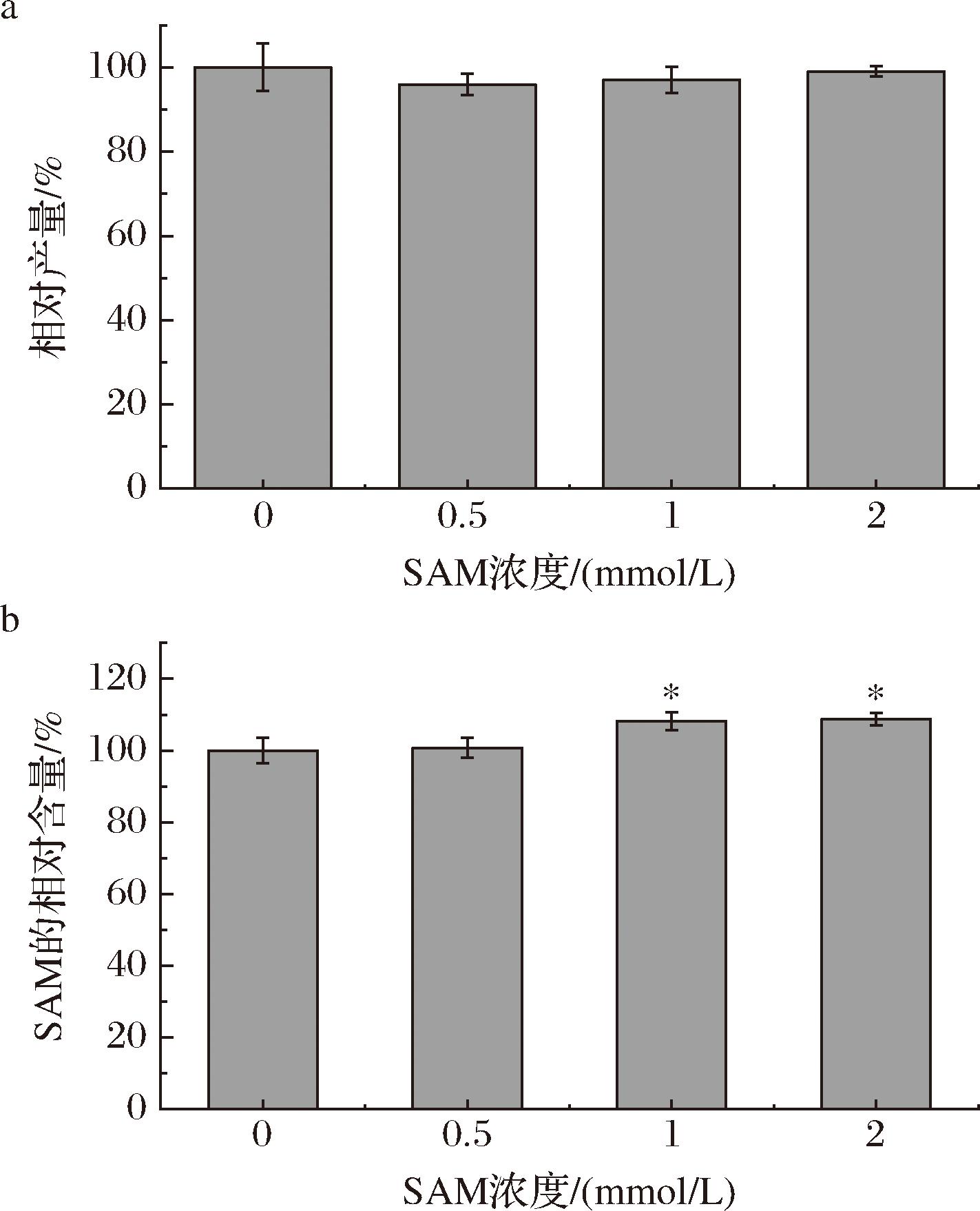
a-外源添加SAM发酵合成丁烯基多杀菌素;b-外源添加SAM发酵后菌株ASAGF58胞内的SAM浓度
图3 外源SAM添加对丁烯基多杀菌素产量的影响及菌株胞内SAM含量变化
Fig.3 Effect of exogenous addition SAM on the yield of butenyl-spinosyn and SAM concentration change
注:*表示P<0.1(下同)。
2.2 MAT蛋白比对及酶活力测定
分别从天蓝色链霉菌[Streptomyces coelicolor A3(2)]、红色糖多孢菌(Saccharopolyspora erythraea NRRL 2338)、刺糖多孢菌(Saccharopolyspora spinosa)中挖掘得到4个MAT蛋白(SCO1476、A8924_4287、ATCC20203_GM004844、ATCC20203_GM006362),与须糖多孢菌ASAGF58的基因组进行比对发现ASAGF58中存在2个MAT蛋白QIZ39212.1(MetK1)和QIZ38945.1(MetK2),如图4-a所示。MetK1和MetK2与外源4个MAT蛋白氨基酸序列具有较高的同源性(79.30%~97.34%)。进一步将MetK1和MetK2在大肠杆菌中诱导表达并进行体外酶促反应比较了二者的催化活性,结果表明(图4-b),MetK1和MetK2均具有MAT活力,在ATP的存在下可将L-蛋氨酸催化分别生成66.36、42.96 pg/mL的SAM。
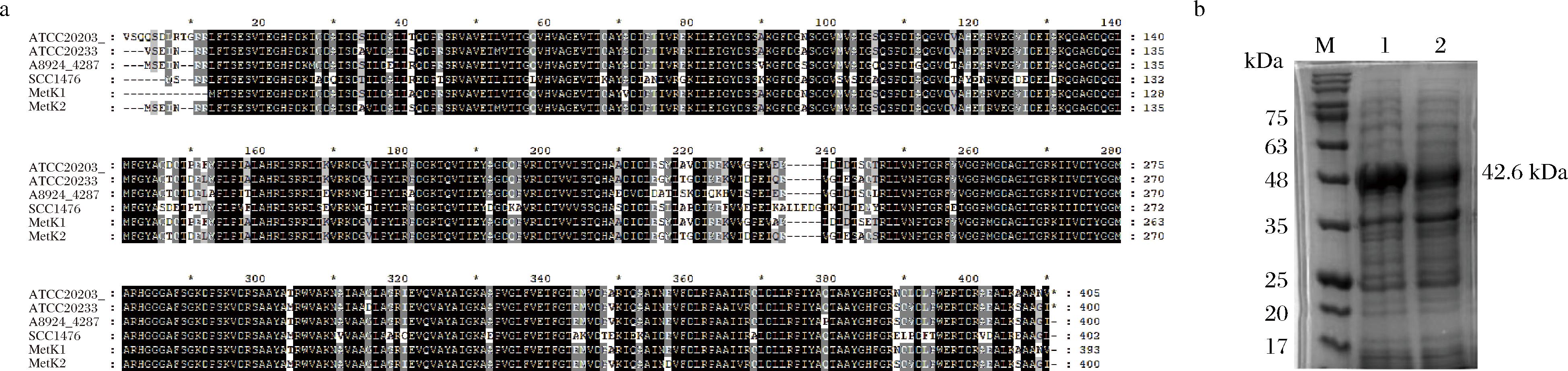
M-蛋白质分子质量标记;泳道1-MetK1蛋白;泳道2-MetK2蛋白。
a-不同来源的MAT蛋白氨基酸序列比对;b-His6标签标记的MetK1和MetK2表达
图4 SAM合酶的挖掘比对
Fig.4 Excavation and comparison of SAM synthase
2.3 SAM合酶基因过表达调控丁烯基多杀菌素的合成
为了进一步验证SAM对丁烯基多杀菌素合成的影响,对MAT基因进行了过表达。以菌株ASAGF58为底盘细胞,分别构建2个MAT基因metK1和metK2的过表达工程菌株M1和M2,并进行摇瓶发酵验证,结果显示(图5),与对照菌株ASAGF58相比,工程菌株M1和M2的丁烯基多杀菌素产量没有显著变化,与外源添加SAM的发酵结果一致。SAM是鼠李糖甲基化途径的甲基供体,甲基转移酶的不足可能会使胞内SAM不被利用,从而导致单独MAT基因过表达对丁烯基多杀菌素的合成无影响。因此对MAT基因和O-甲基转移酶基因进行组合过表达调控。
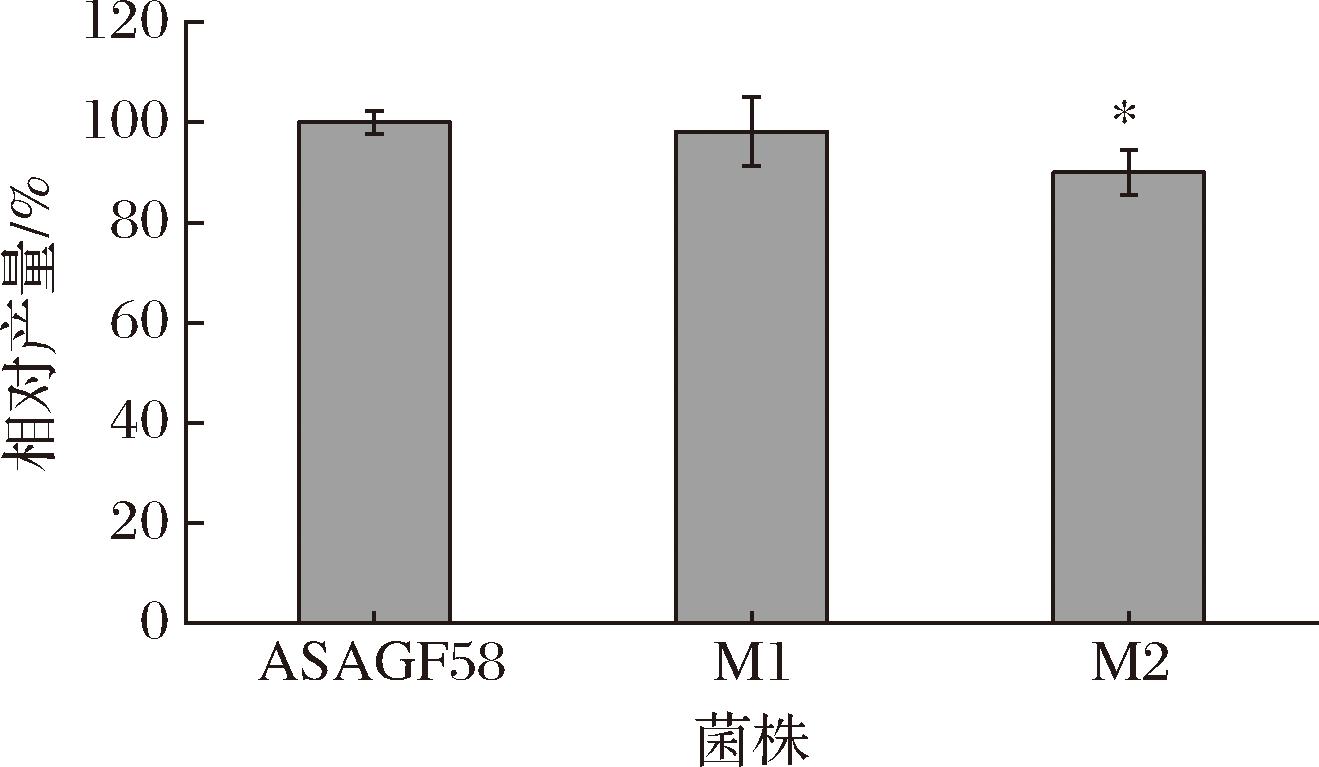
图5 过表达MAT基因工程菌株对丁烯基多杀菌素合成的影响
Fig.5 Effect of overexpressing MAT gene on synthesis of butenyl-spinosyn
2.4 SAM合酶基因和O-甲基转移酶基因组合过表达对丁烯基多杀菌素合成的影响
构建MAT和O-甲基转移酶基因不同组合metK1-busI、metK1-busK、metK1-busH、metK2-busI、metK2-busK和metK2-busH的过表达工程菌株I-1、K-1、H-1、I-2、K-2和H-2,通过摇瓶发酵验证O-甲基转移酶和MAT基因的共同强化对产物合成的影响。将单独过表达O-甲基转移酶基因busI、busK、busH工程菌株S1、S2、S3与野生菌株ASAGF58(CK)作为对照。发酵结果如图6所示,单独过表达O-甲基转移酶对丁烯基多杀菌素的产生无影响,MAT和O-甲基转移酶基因的部分组合过表达促进了丁烯基多杀菌素的合成,其中菌株I-1、H-1和I-2比对照菌株ASAGF58分别提高3.17、1.43、2.21倍,然而其余工程菌株的产物产量均没有提升。
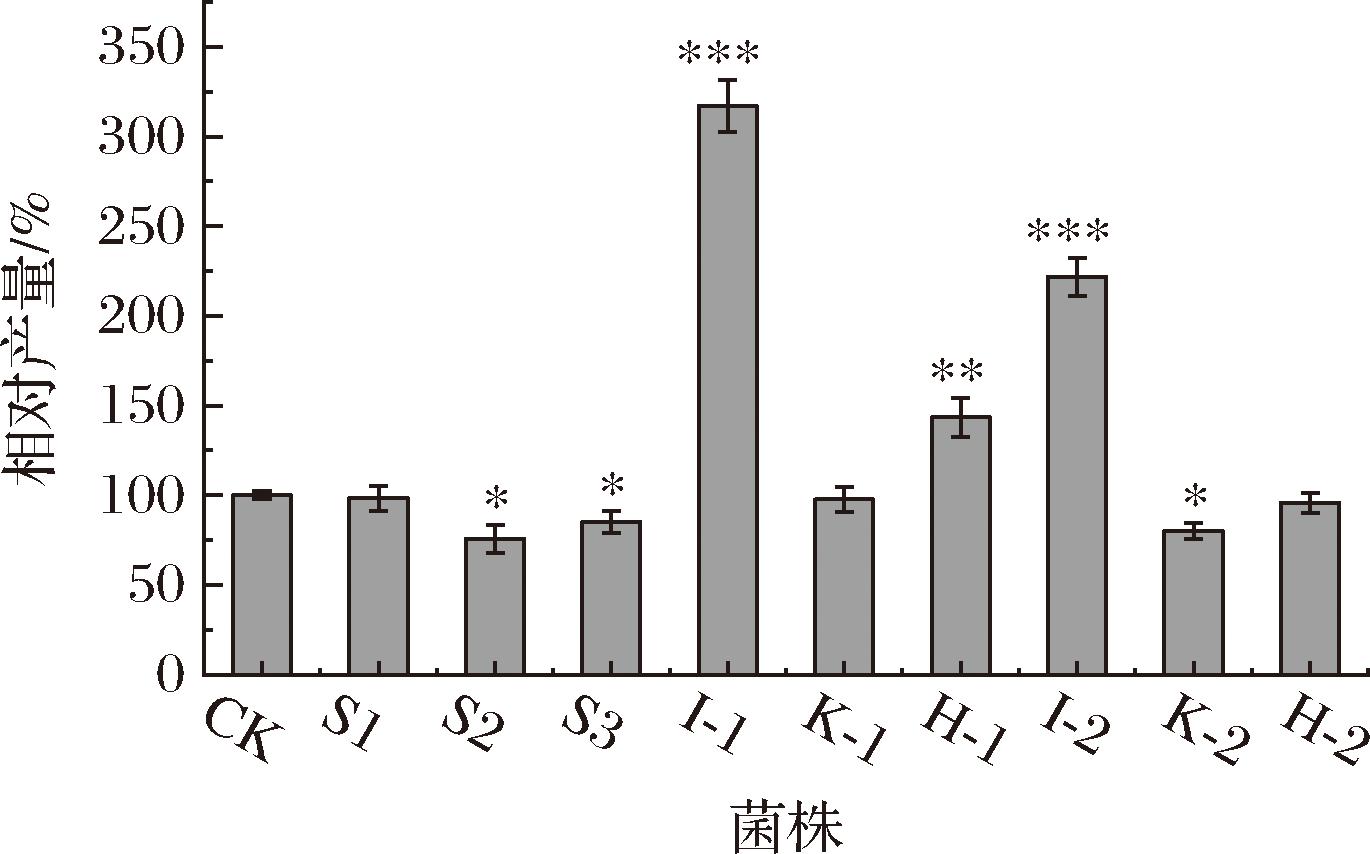
图6 组合过表达SAM合酶基因与O-甲基转移酶基因对丁烯基多杀菌素产量的影响
Fig.6 Effect of combination overexpression of SAM synthase gene and O-methyltransferase gene on the yield of butenyl-spinosyn
注:**表示P<0.05,***表示P<0.01(下同)。
丁烯基多杀菌素与多杀菌素的合成途径相似,O-甲基转移酶基因按照busI、busK和busH的顺序分别使鼠李糖的3、4和2号位甲基化,busI作为甲基化的第一步最先发挥作用且至关重要[29]。同时,MetK1的酶活力大于MetK2,因此busI与metK1基因的组合过表达使产物产量提高最为显著。以上结果表明,甲基供体SAM及O-甲基转移酶在鼠李糖甲基化途径中相辅相成,二者的共同过表达强化了鼠李糖的甲基化途径,促进了丁烯基多杀菌素的合成。
2.5 工程菌株的高产机制探究
为了探究工程菌株的高产机制,以提产效果最好的菌株I-1为研究对象,首先对不同时期菌株的生长代谢特性进行了分析,结果如图7所示。工程菌株I-1与野生型菌株ASAGF58的生物量在发酵初期均快速上升,发酵第3天菌株I-1的生物量较ASAGF58菌株提高了42%,进一步对菌株I-1中的生长相关基因bldD和whiA(bldD基因与菌体形态相关,whiA影响孢子的形成[30])的转录水平进行测定。bldD基因发酵第3天的表达水平较ASAGF58提高了21倍,whiA在第5天发生显著上调,由此可见,SAM及O-甲基转移酶的增加对菌株生长具有较大的促进作用。
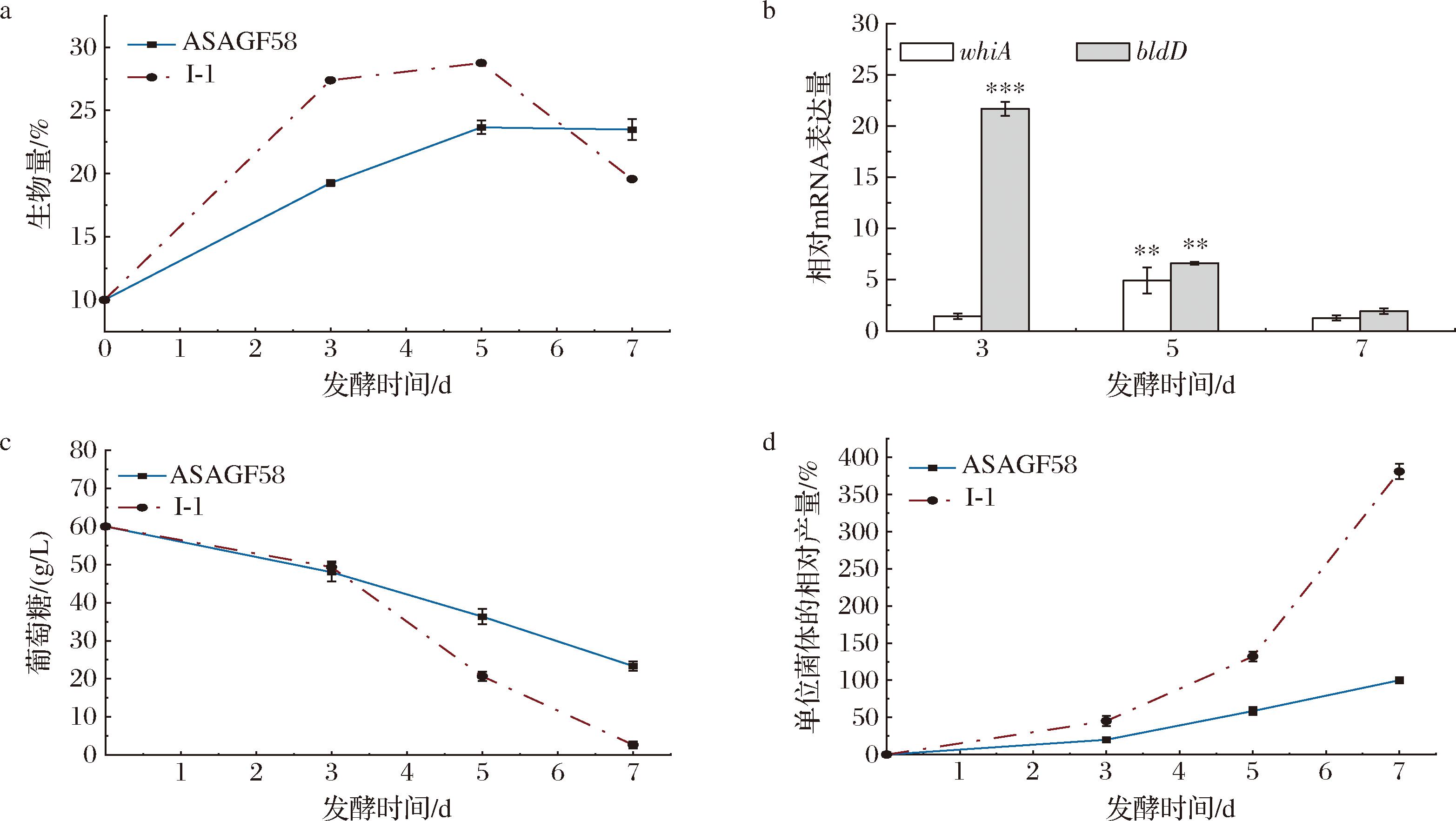
a-生物量变化;b-whiA和bldD基因的转录水平;c-培养基中葡萄糖含量变化;d-单位菌体相对产量变化
图7 菌株ASAGF58和I-1发酵期间的生长代谢特性
Fig.7 Growth metabolic characteristics of strains ASAGF58 and I-1 during fermentation
注:单位菌体相对产量以菌株ASAGF58发酵第7天时的数值为参考计算。
发酵期间2株菌的葡萄糖消耗量在前3 d基本相同,发酵中后期菌株I-1葡萄糖消耗加快,同时丁烯基多杀菌素大量合成。经过计算发现I-1菌株的单位菌体产量远高于ASAGF58,在第7天达到了ASAGF58的3.8倍。这些结果表明菌株I-1的产量提高,并非单由生物量提高所导致,SAM及O-甲基转移酶的增多增强了葡萄糖的摄取率,提高了单位菌体的产物合成效率。同时busI及metK的共同过表达强化了鼠李糖甲基化途径,使丁烯基多杀菌素高效合成。
比较工程菌株I-1中鼠李糖甲基化相关基因busI、metK1的转录水平发现(图8),busI和metK1基因的表达水平在发酵初期均上调,其中busI基因的表达水平在第3天和第5天发生显著上调,其表达量分别是野生菌株的9.11、7.16倍。这些结果表明,metK1基因主要在发酵前期发挥作用,SAM是重要前体物质,当甲基充足时O-甲基转移酶基因busI的大量表达才能够促进丁烯基多杀菌素的合成,busI和metK1是丁烯基多杀菌素合成途径中的关键基因。
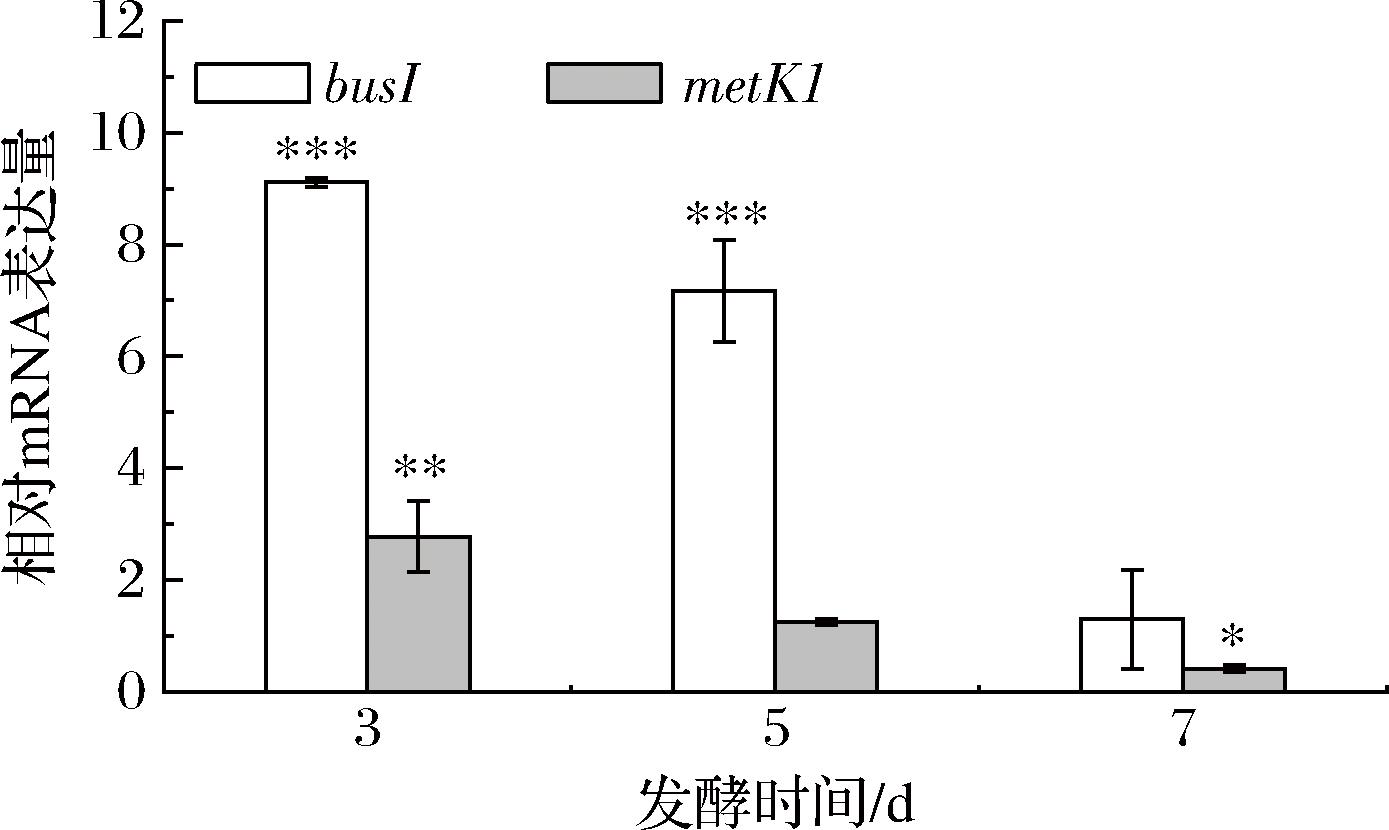
图8 菌株I-1中metK1和busI基因的转录水平
Fig.8 Transcriptional levels of metK1 and busI genes in strain I-1
3 结论与讨论
本研究主要确定了丁烯基多杀菌素合成途径中的关键限速步骤,通过对过表达工程菌株的发酵验证,分析了鼠李糖基甲基化相关基因对丁烯基多杀菌素合成的影响,并对高产工程菌株的高产机制进行探究,主要结论与讨论如下:鼠李糖甲基化途径相关metK和O-甲基转移酶基因的组合过表达促进了丁烯基多杀菌素的合成,筛选获得3株高产工程菌株I-1、H-1和I-2分别使丁烯基多杀菌素的产量提高3.17、1.43、2.21倍。经过多个不同基因组合过表达工程菌株的发酵验证分析,busI与metK1的组合过表达对产物合成的促进最为显著。实验结果表明,busI与metK1基因在产物合成中较为关键,SAM与O-甲基转移酶存在一定的平衡关系,将二者含量维持在适当水平则有利于丁烯基多杀菌素的合成。高产菌株I-1的生长代谢特性分析表明,菌株I-1在发酵期间菌体大量积累,葡萄糖被快速利用,同时单位菌株产物合成效率大幅提高。metK1与busI的组合过表达增强了菌株生长代谢从而实现了丁烯基多杀菌素的高效合成。
后续可通过协同调控MAT与O-甲基转移酶的表达水平或对它们进行酶学改造,来获得更加稳定高效合成丁烯基多杀菌素的工程菌株,为粮食高质量生产、贮藏安全等方面提供支撑。
[1] 寿佳丽, 裘娟萍.新型生物农药-丁烯基多杀菌素[J].农药, 2011, 50(4):239-243;272.SHOU J L, QIU J P.A new type of biological pesticide:Butenyl-spinosyns[J].Agrochemicals, 2011, 50(4):239-243;272.
[2] 唐建立.须糖多孢菌丁烯基多杀菌素生物合成调控的几个关键基因的功能研究[D].长沙:湖南师范大学, 2021.TANG J L.The function study of several key genes regulating butenyl-spinosyn biosynthesis in Saccharopolyspora pogona[D].Changsha:Hunan:Hunan Normal University, 2021.
[3] 田博宇, 高爽, 刘阳星月, 等.微生物源杀虫剂对储粮害虫的防治应用与展望[J].粮食与油脂, 2021, 34(5):7-9;16.TIAN B Y, GAO S, LIU Y X Y, et al.Application and prospect of microbial insecticides in the control of stored grain pests[J].Cereals & Oils, 2021, 34(5):7-9;16.
[4] 孙艳敏, 韩锦峰, 陈小丽, 等.减施化学农药防治植物病害措施的研究进展[J].贵州农业科学, 2021, 49(5):58-66.SUN Y M, HAN J F, CHEN X L, et al.Advances in measures of reduction of chemical pesticides to control plant diseases[J].Guizhou Agricultural Sciences, 2021, 49(5):58-66.
[5] 何昊城.丁烯基多杀菌素合成关键调控基因及代谢网络优化研究[D].长沙:湖南师范大学, 2021.He H C.Optimization of key regulatory genes and metabolic networks of butenyl-spinosyn biosynthesis[D].Changsha:Hunan Normal University, 2021.
[6] RANG J, ZHU Z R, LI Y L, et al.Identification of a TetR family regulator and a polyketide synthase gene cluster involved in growth development and butenyl-spinosyn biosynthesis of Saccharopolyspora pogona[J].Applied Microbiology and Biotechnology, 2021, 105(4):1519-1533.
[7] 彭胜男, 何昊城, 苑爽芹, 等.fcl基因对须糖多孢菌丁烯基多杀菌素生物合成及生长发育的影响[J].生物工程学报, 2019, 35(9):1662-1675.PENG S N, HE H C, YUAN S Q, et al.Effect of fcl gene for butenyl-spinosyn biosynthesis and growth of Saccharopolyspora pogona[J].Chinese Journal of Biotechnology, 2019, 35(9):1662-1675.
[8] 王靖楠, 庞建, 秦磊, 等.丁烯基多杀菌素高产菌株的选育和改造策略[J].化工学报, 2022, 73(2):566-576.WANG J N, PANG J, QIN L, et al.Breeding and modification strategies of butenyl-spinosyn high-yield strains[J].CIESC Journal, 2022, 73(2):566-576.
[9] HUANG K X, XIA L Q, ZHANG Y M, et al.Recent advances in the biochemistry of spinosyns[J].Applied Microbiology and Biotechnology, 2009, 82(1):13-23.
[10] LEWER P, HAHN D R, KARR L L, et al.Discovery of the butenyl-spinosyn insecticides:Novel macrolides from the new bacterial strain Saccharopolyspora pogona[J].Bioorganic &Medicinal Chemistry, 2009, 17(12):4185-4196.
[11] ZHAO X Q, GUST B, HEIDE L.S-Adenosylmethionine (SAM) and antibiotic biosynthesis:Effect of external addition of SAM and of overexpression of SAM biosynthesis genes on novobiocin production in Streptomyces[J].Archives of Microbiology, 2010, 192(4):289-297.
[12] RANG J, HE H C, YUAN S Q, et al.Deciphering the metabolic pathway difference between Saccharopolyspora pogona and Saccharopolyspora spinosa by comparative proteomics and metabonomics[J].Frontiers in Microbiology, 2020, 11:396.
[13] OCHI K, SAITO Y, UMEHARA K, et al.Restoration of aerial Mycelium and antibiotic production in a Streptomyces griseoflavus arginine auxotroph[J].Journal of General Microbiology, 1984, 130(8):2007-2013
[14] HUH J H, KIM D J, ZHAO X Q, et al.Widespread activation of antibiotic biosynthesis by S-adenosylmethionine in Streptomycetes[J].FEMS Microbiology Letters, 2004, 238(2):439-447.
[15] 梁剑光, 黄鹏, 徐正军.阿维菌素生物合成及其代谢途径研究进展[J].常熟理工学院学报, 2007, 21(4):65-70.LIANG J G, HUANG P, XU Z J.New research progress of avermectin biosynthesis pathway and the metabolic engineering[J].Journal of Changshu Institute of Technology, 2007, 21(4):65-70.
[16] YOON G S, KO K H, KANG H W, et al.Characterization of S-adenosylmethionine synthetase from Streptomyces avermitilis NRRL8165 and its effect on antibiotic production[J].Enzyme and Microbial Technology, 2006, 39(3):466-473.
[17] SHIN S K, XU D L, KWON H J, et al.S-adenosylmethionine activates adpA transcription and promotes streptomycin biosynthesis in Streptomyces griseus[J].FEMS Microbiology Letters, 2006, 259(1):53-59.
[18] OKAMOTO S, LEZHAVA A, HOSAKA T, et al.Enhanced expression of S-adenosylmethionine synthetase causes overproduction of actinorhodin in Streptomyces coelicolor A3(2)[J].Journal of Bacteriology, 2003, 185(2):601-609.
[19] ZHANG X C, FEN M Q, SHI X L, et al.Overexpression of yeast S-adenosylmethionine synthetase metK in Streptomyces actuosus leads to increased production of nosiheptide[J].Applied Microbiology and Biotechnology, 2008, 78(6):991-995.
[20] KIM D J, HUH J H,YANG Y Y, et al.Accumulation of S-adenosyl-L-methionine enhances production of actinorhodin but inhibits sporulation in Streptomyces lividans TK23[J].Journal of Bacteriology, 2003, 185(2):592-600.
[21] GUO C, GUO W Q, LIU Y C, et al.Complete genome sequence of butenyl-spinosyn producing Saccharopolyspora strain ASAGF58[J].Annals of Microbiology, 2020, 70(1):46.
[22] PANG J, LI X Y, GUO C, et al.Exploring a high-efficiency genetic transformation system for engineering Saccharopolyspora pogona ASAGF58 to improve butenyl-spinosyn production[J].ACS Agricultural Science &Technology, 2023, 3(2):203-210.
[23] 张逍遥, 郭超, 王靖楠, 等.常压室温等离子体诱变选育丁烯基多杀菌素高产菌株及培养基优化[J].粮油食品科技, 2022, 30(1):174-181.ZHANG X Y, GUO C, WANG J N, et al.Breeding of butenyl-spinosyns producing strain by atmospheric room temperature plasma and optimization of culture medium[J].Science and Technology of Cereals, Oils and Foods, 2022, 30(1):174-181.
[24] XU Y R, TAN G Q, KE M L, et al.Enhanced lincomycin production by co-overexpression of metK1 and metK2 in Streptomyces lincolnensis[J].Journal of Industrial Microbiology &Biotechnology, 2018, 45(5):345-355.
[25] 李晓晨.多杀菌素异源生物合成体系优化研究[D].济南:山东大学, 2023.LI X C.Optimization of spinosad heterologous biosynthesis system[D].Jinan:ShanDong University, 2023.
[26] OH T J, NIRAULA N P, LIOU K, et al.Identification of the duplicated genes for S-adenosyl-l-methionine synthetase (metK1-sp and metK2-sp) in Streptomyces peucetius var.caesius ATCC 27952[J].Journal of Applied Microbiology, 2010, 109(2):398-407.
[27] 徐周钦, 郭超, 李金萍, 等.60Co-NTG复合诱变选育丁烯基多杀菌素高产菌株及其杀虫活性[J].中国生物防治学报, 2024, 40(2):299-309.XU Z Q, GUO C, LI J P, et al.Breeding of butenyl-spinosyns high yielding strain by 60Co-NTG compound mutation and its insecticidal activity[J].Chinese Journal of Biological Control, 2024, 40(2):299-309.
[28] BUSTIN S A, BENES V, GARSON J A, et al.The MIQE guidelines:Minimum information for publication of quantitative real-time PCR experiments[J].Clinical Chemistry, 2009, 55(4):611-622.
[29] KIM H J, WHITE-PHILLIP J A, OGASAWARA Y, et al.Biosynthesis of spinosyn in Saccharopolyspora spinosa:Synthesis of permethylated rhamnose and characterization of the functions of SpnH, SpnI, and SpnK[J].Journal of the American Chemical Society, 2010, 132(9):2901-2903.
[30] 薛正莲, 王珊, 孙俊峰, 等.链霉菌形态分化与次级代谢产物合成的研究进展[J].微生物学报, 2021, 61(12):3870-3886.XUE Z L, WANG S, SUN J F, et al.Research progress on morphological differentiation and secondary metabolite biosynthesis of Streptomyces[J].Acta Microbiologica Sinica, 2021, 61(12):3870-3886.