乳液凝胶是由乳液分散相和凝胶相结合形成的复杂胶体材料,常将乳液的连续相凝胶化而制得,其兼具乳液和凝胶特性[1]。乳液凝胶是一种常见食品体系,如蛋黄酱是水包油(oil in water, O/W)型乳液凝胶体系[2]。另外,乳液凝胶也多用于模拟脂肪、制作低脂食品[3]。在食品体系中,乳液凝胶的常见基质有3种,即蛋白质、多糖、蛋白质-多糖复合物。单一多糖或蛋白质稳定的乳液凝胶力学性能不足,稳定性不高,而利用蛋白和多糖间的相互排斥或吸引可调节食品凝胶的功能特性[4]。因此,以蛋白质-多糖复合物制备乳液凝胶是研究热点之一。
海藻酸钠(sodium alginate, SA)是一种由α-L-葡萄糖醛酸和β-D-甘露糖醛酸形成的天然来源的线性多糖;因其优良的凝胶性而作为成膜基质、微胶囊壁材等,在食品工业和医药领域中被广泛应用[5]。酪蛋白是乳中含量最高的蛋白质,约占牛乳中蛋白质含量的80%,其钠盐称为酪蛋白酸钠(sodium caseinate, SC)。SC营养价值高,表面活性优异,且具有良好凝胶性,常用作乳液凝胶基质[6]。
近年来,乳液凝胶被广泛用作活性因子的递送系统,以保护活性因子,提高其生物利用度。研究表明,经乳清分离蛋白-壳聚糖基乳液凝胶负载后,番茄红素在胃液中的释放量减少,在肠液中可实现快速释放[7-8]。ZHUANG等[9]用聚甘油聚蓖麻油酸酯、乳清分离蛋白和魔芋葡甘露聚糖制备了乳液凝胶,用于负载原花青素,提高了其生物利用度。另外,经乳液凝胶中负载后,槲皮素溶解度提高,稳定性改善,生物利用度显著提高[10]。可见,乳液凝胶具有负载和递送活性因子的性能。
传统蛋白质基乳液凝胶的制备方法包括乳液的形成和凝胶化,工艺复杂,耗时长,如热诱导、酸诱导、盐诱导、超声诱导、酶法交联等[11-13]。本团队前期开发了一步均质法制备酪蛋白胶束基乳液凝胶,发现添加SA可显著提升乳液凝胶稳定性[14]。进一步研究发现,采用葡萄糖酸-δ-内酯(gluconate-δ-lactone, GDL)酸化可显著改善SA-酪蛋白基乳液凝胶流变性,并显著提升负载的原花青素在胃肠环境中的稳定性[15]。另外,以酪蛋白代替酪蛋白胶束,通过一步均质法形成高内相乳液凝胶,且适量添加SA提升了乳液凝胶的稳定性,并实现了姜黄素的高效负载,提高了其生物可及性[16]。由此可见,酪蛋白与SA复合物可作为基质用于开发高稳定性乳液凝胶,以实现活性因子的负载和递送。
与液态乳液比,乳液凝胶具有更加优异的稳定性,常作为可食用3D打印油墨以及动物脂肪代替物,具有较大的开发潜力[17-18]。研究表明,以蚕豆分离蛋白为乳化剂,制备的油相体积分数为50%的乳液凝胶经热处理后3D打印适应性进一步提高[19]。由亚麻籽蛋白-SA复合物稳定的高内相乳液凝胶封装姜黄素,成功用于3D打印,打印的物体表面光滑,具有自支撑性[20]。由此可见,乳液凝胶在3D打印方面具有一定的潜力。然而,随着油相含量的增加,乳液凝胶热力学不稳定性增强,并且其结构强度难以满足3D打印基材的实际需求,所以提升高含油量乳液凝胶的结构强度和自支撑性是研究热点。
本研究在前期研究的基础上,以SC为基质,通过一步均质法制备了含油量为80%的乳液凝胶,通过添加GDL以提升乳液凝胶的结构强度,并将乳液凝胶用于负载原花青素(proanthocyanidins, PC);系统评价了SA添加顺序对乳液凝胶结构及性质的影响规律,评估了乳液凝胶的3D打印性能,并探讨了模拟消化过程中乳液凝胶对PC的释放规律,以期为SA-SC基乳液凝胶在3D打印功能食品中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
SC、SA、PC、GDL,合肥博美生物科技有限责任公司。
1.2 仪器与设备
STA449F5同步热分析仪,德国耐驰仪器制造有限公司;GS-1剪切乳化搅拌机,沧州亿轩试验仪器有限公司;XC-SW40光学显微镜,深圳市星辰光学仪器有限公司;HR-1混合流变仪,沃特世科技有限公司;KH19A高速离心机,湖南凯达科学仪器有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司。
1.3 实验方法
1.3.1 乳液凝胶的制备
将4 g SC分散在pH 6.86、浓度为0.05 mol/L的100 mL磷酸盐缓冲液中,于37 ℃下磁力搅拌2 h,制得SC溶液。将2 g SA溶于pH 6.86、浓度为0.05 mol/L的100 mL磷酸盐缓冲液中,于37 ℃磁力搅拌至溶解,4 ℃下放置过夜至完全水合,制得SA溶液。
乳液凝胶中SA添加过程分为2种,同步添加时,将SC溶液与SA溶液按体积比为8∶2混合,在600 r/min、37 ℃磁力搅拌2 min。取上述混合物6 mL,与24 mL大豆油混合,在14 000 r/min下采用均质机均质3 min,得到总体积30 mL的乳液凝胶,记为M0。分步添加时,将4.8 mL SC溶液先与24 mL油相混合,以14 000 r/min均质3 min,得到初级乳液凝胶;然后将1.2 mL SA溶液加入初级乳液凝胶中,在相同条件下均质制得乳液凝胶,记为S0。在均质之前,向SC溶液中按照15 mg/mL的比例添加GDL,在上述2种方法下制备乳液凝胶,分别记为M15、S15。在SC溶液中加入PC(添加量为4 mg/mL),在上述工艺下制得乳液凝胶,分别记作MP0、MP15、SP0、SP15。
1.3.2 乳液凝胶微观结构分析
参考本团队前期方法,采用光学显微镜于物镜40×、目镜10×下进行观察,并用ImageJ软件对油滴的尺寸进行统计[15]。
1.3.3 乳液凝胶稳定性测定
a)贮藏稳定性
取新制备的乳液凝胶3 mL,装于螺旋盖玻璃瓶中,4 ℃保存,定期拍摄外观。
b)pH稳定性
取新制备的乳液凝胶2 mL,装于螺旋盖玻璃小瓶中,加入3 mL不同pH值(pH 1、3、4、5、7、9)的水溶液,置于25 ℃下放置15 d,然后观察并拍照。
c)热稳定性
取新制备的乳液凝胶3 mL,分别于65、80 ℃加热30 min。加热后的样品于25 ℃下保存24 h,拍照并进行显微镜观察。
d)Ca2+稳定性
取新制备的乳液凝胶2 mL,与3 mL不同质量浓度(0.05、0.075、0.1、0.125、0.15 g/mL)的CaCl2溶液混合;在25 ℃下保存7 d,然后观察并拍照。
e)冻融稳定性
将20 mL新鲜制备的乳液凝胶置于离心管中,在-24 ℃下贮藏22 h,然后在25 ℃下解冻2 h;于4 000×g离心20 min后,收集样品的油相。从乳液凝胶中析出的油相百分比的计算如公式(1)所示:
油相百分比![]()
(1)
式中:V为离心后析出的油相体积,V0为乳液凝胶中油相的原始体积。
f)SC析出程度分析及持水能力(water holding capacity, WHC)测定将新制备的乳液凝胶在8 000×g离心20 min后,取下层水相,用SDS-PAGE分析蛋白质组成[15]。
将离心后的乳液凝胶下层清液移除,测量剩余凝胶的质量,乳液凝胶WHC[16]的计算如公式(2)所示:
(2)
式中:m为离心后乳液凝胶质量,m0为初始乳液凝胶质量。
1.3.4 乳液凝胶热分解性能测定
准确称取8~10 mg乳液凝胶样品置于氧化铝坩埚中,参考本团队前期方法,采用热分析仪对样品的热稳定性进行分析[15]。
1.3.5 乳液凝胶流变性测定
使用混合流变仪测定乳液凝胶的流变性[15]。小振幅振荡剪切试验采用1~100 Hz频率扫描,应变为0.1%;大振幅振荡剪切试验采用0.1%~100%应变扫描,频率为1 Hz[21]。
1.3.6 乳液凝胶3D打印性能评价
乳液凝胶由3D打印机打印,以评价其自支撑性及打印性能。采用1 mm喷嘴挤出,喷嘴移动速度设置为5.2 mm3/s,3D打印形状为心形,高度5 mm,填充率100%[17]。
1.3.7 乳液凝胶中PC的体外模拟释放测定
将1 g乳液凝胶放入截留分子质量为1 kDa的透析袋中,按照本团队前期方法进行模拟消化[15]。取透析液3 mL,测定278 nm下的吸光度,PC释放量通过同介质下绘制的标准曲线(y=0.006 42x+0.015 63)计算。
1.4 统计分析
所有实验重复3次,采用Excel 2010处理数据,用Origin Pro 9.0软件绘图,采用Duncan法进行差异显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 乳液凝胶的微观结构
乳液凝胶的光学显微照片和粒径分布如图1所示。由图1可以看出,相同条件下,SA添加顺序对乳液凝胶中油滴平均粒径具有一定的影响。其中,SA分步添加的样品中的油滴粒径略小于同步添加样品。这是因为同步添加时,SC与SA先形成静电斥力,然后乳化油滴;而分步添加过程中,第一次均质使SC在油水界面形成乳化层,之后添加的SA与乳化层SC间形成静电斥力,直接作用于乳化油滴,使其粒径减小[22]。相同制备方式下,添加GDL明显降低了乳液凝胶的油滴粒径。这是因为GDL在放置过程中会发生水解,酸化诱导SC和SA凝胶化并形成更致密的凝胶网络结构;另外,SA在酸的作用下由负电荷变为正电荷,并与SC发生静电吸引,迫使油滴收缩,粒径减小[23]。负载PC后,乳液凝胶中的油滴粒径略有减小,这是由于PC可以在同一SC链上的不同氨基酸残基间,或不同SC上的氨基酸残基间形成非共价交联,使SC结构变得紧凑和致密[15]。另外,PC带有负电荷,与SC结合后使其负电量增加,进而增大了SC与SA间的静电斥力,致使油滴粒径减小。相同油相体积分数下,油滴粒径越小,其数量越多,拥堵效应越明显,乳液凝胶的机械性能可能越强。由此推测,SP15乳液凝胶具有较强的机械性能。

a-M0;b-S0;c-M15;d-S15;e-MP0;f-SP0;g-MP15;h-SP15
图1 乳液凝胶的粒径分布和光学显微照片(标尺:600 μm)
Fig.1 Size distribution of oil droplets and optical microscopy images in emulsion gels (scale:600 μm)
2.2 乳液凝胶的稳定性
2.2.1 贮藏稳定性
图2为乳液凝胶在4 ℃下贮藏150 d的外观。由图2可以看出,乳液凝胶在贮藏期间均保持稳定,没有发生相分离现象。SC与SA之间可形成较强的静电斥力,从而提高了乳液凝胶的稳定性。此外,SA作为增稠剂,在水相中形成致密的网络,从而阻止了油滴的合并与聚集[24]。可见,SA-SC基乳液凝胶贮藏稳定性较高,且其不受SA添加顺序影响。

a-新鲜乳液凝胶正置和倒置的外观;b-贮藏30 d后乳液凝胶正置和倒置的外观;c-贮藏150 d后乳液凝胶正置和倒置的外观
图2 4 ℃下不同贮藏期乳液凝胶外观
Fig.2 Appearance of emulsion gels during storage at 4 ℃
2.2.2 pH稳定性
所有乳液凝胶在不同pH水溶液稀释并静置15 d后均未发生相分离(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.040499),表明其具有较高的pH稳定性。SA和SC之间的相互作用受pH值影响。当pH大于SC的等电点pI(4.6)时,SA与SC均带负电荷,两者之间形成较强的静电斥力,起到有效稳定乳液凝胶结构的作用。因此,未添加GDL的乳液凝胶在pH为5、7、9的水溶液稀释后保持结构稳定。当水溶液pH低于pI时,SC因乳化油滴而吸附于油滴表面,SA填充于油滴间隙,酸化过程中SA先接触到酸,表面负电荷降低,甚至变为正值,进而与油滴表面的SC产生静电引力而包裹在油滴表面,因此乳液凝胶在pH为1、3、4的水溶液稀释下仍保持稳定。另外,SA能有效增加水相黏度,从而降低油滴的流动性,有效提升了乳液凝胶的稳定性[24]。添加GDL后,乳液凝胶体系pH为酸性,且SC在酸化作用下凝胶,与SA结合,使乳液凝胶网络结构更加致密,在低浓度酸、碱的作用下可保持稳定。除pH=1外,未添加GDL的乳液凝胶均在不同pH值水溶液稀释下发生漂浮现象。GDL酸化使得油滴粒径减小,油滴间隙增大,网络结构较为松散,因此出现飘浮现象。
为了进一步评价乳液凝胶的pH稳定性,对不同pH水溶液稀释后乳液凝胶的油滴粒径进行了统计分析,结果见表1。由表1可知,同一乳液凝胶中油滴粒径随pH值的降低而减小,这主要是由于pH越小,SC与SA之间的静电斥力越小,且可能转变为引力而附着于油滴上,因此迫使油滴收缩。添加PC后,油滴粒径随pH变化的幅度降低,而添加GDL后乳液凝胶中油滴粒径变化幅度更小,这是因为添加PC和GDL迫使样品中乳液凝胶油滴收缩,粒径减小,使其随体系pH的改变而变化不大。另外,同一pH下,分步添加SA的样品中油滴粒径均小于同步添加SA的样品。
表1 不同pH水溶液稀释下乳液凝胶中油滴的平均粒径 单位:μm
Table 1 Average size of oil droplets in emulsion gels after diluting at different pH
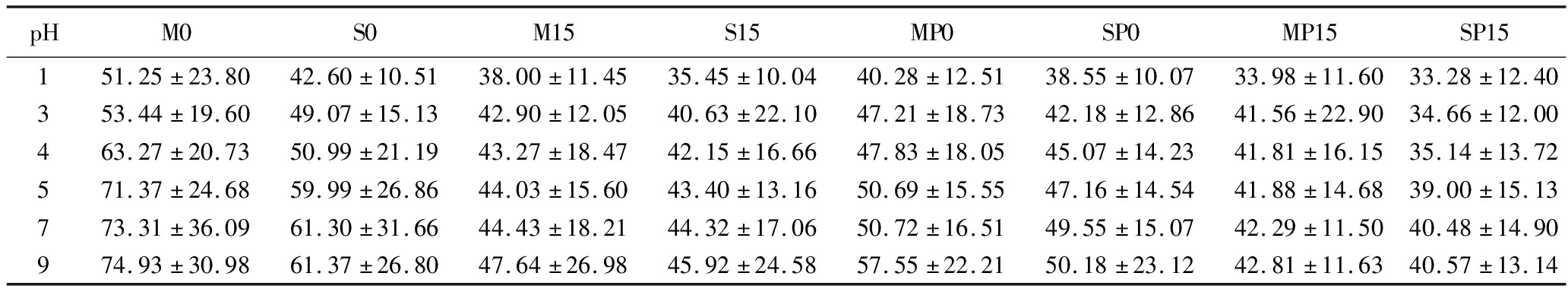
pHM0S0M15S15MP0SP0MP15SP15151.25±23.8042.60±10.5138.00±11.4535.45±10.0440.28±12.5138.55±10.0733.98±11.6033.28±12.40353.44±19.6049.07±15.1342.90±12.0540.63±22.1047.21±18.7342.18±12.8641.56±22.9034.66±12.00463.27±20.7350.99±21.1943.27±18.4742.15±16.6647.83±18.0545.07±14.2341.81±16.1535.14±13.72571.37±24.6859.99±26.8644.03±15.6043.40±13.1650.69±15.5547.16±14.5441.88±14.6839.00±15.13773.31±36.0961.30±31.6644.43±18.2144.32±17.0650.72±16.5149.55±15.0742.29±11.5040.48±14.90974.93±30.9861.37±26.8047.64±26.9845.92±24.5857.55±22.2150.18±23.1242.81±11.6340.57±13.14
2.2.3 热稳定性
不同温度(65 ℃和80 ℃)加热30 min后乳液凝胶的表观状态、光学显微照片及粒径分布如图3所示。热处理后,乳液凝胶倒置均未见流动,并且没有出现相分离现象,表明其具有较高的热稳定性。与未加热的油滴粒径相比,热处理后油滴的平均粒径变化不大(附图2,https://doi.org/10.13995/j.cnki.11-1802/ts.040499),这是由于油相体积分数高达80%,形成的拥堵效应较强,而油滴间填充了一定量的SA,其流动性极大程度受限,在热处理下难以流动、聚集合并,因而加热不会显著改变乳液凝胶中油滴粒径。

a-65 ℃热处理后乳液凝胶正置和倒置的外观;b-80 ℃热处理后乳液凝胶正置和倒置的外观
图3 不同温度热处理后乳液凝胶的外观
Fig.3 Appearance of emulsion gels after heat treatment at different temperatures
另外,添加GDL后乳液凝胶粒径随热处理温度变化很小,这是因为GDL酸化进一步强化了凝胶网络结构,且起到固定SC、SA的作用,使油滴更加难以流动。研究表明,SC可吸附于油滴表面,提高乳液凝胶的热稳定性[25]。相同条件下,分步添加SA的样品油滴粒径变化小于同步添加样品,与前文油滴粒径变化趋势一致。可见,分步添加SA有利于减小油滴粒径,提升乳液凝胶稳定性。
2.2.4 Ca2+稳定性
将乳液凝胶置于不同质量浓度(0.05~0.15 g/mL)的CaCl2溶液中并放置7 d后的外观如附图3(https://doi.org/10.13995/j.cnki.11-1802/ts.040499)。第1天时,所有样品清液均不透明,这是因为未用于乳化的SC溶出且在Ca2+作用下发生絮凝。有研究表明,添加一定量Ca2+后,乳液凝胶表面粗糙,结构松散,蛋白质出现絮凝[26]。静置7 d后,絮凝的SC沉降,所有样品的清液变为澄清透明;乳液凝胶未分层,也没有出现油相析出。Ca2+通过与SA物理交联诱导SA进一步凝胶,加固了乳液凝胶网络,并防止了SC絮凝析出,因此乳液凝胶在Ca2+中具有较高的稳定性。
2.2.5 冻融稳定性
乳液凝胶经过3次冻融循环后析出的油相百分数如图4所示。结果表明,SA添加顺序对乳液凝胶的冻融稳定性没有显著影响(P<0.05)。不含GDL和PC的乳液凝胶经过3次冻融循环后,90%以上的油相析出,这主要是由于冰晶的形成和未冻水的不足使SC覆盖的界面层破裂,导致油滴聚集[27]。添加PC后,析出的油相百分数减小,主要是因为PC的加入导致油滴表面SC之间及SC与SA交联,且PC的负电荷使油滴表面净电荷增加,静电斥力增加,从而提高了乳液凝胶的抗聚集性。添加GDL后,乳液凝胶经3次冻融后析出的油相百分数小于5%,这归因于GDL为酸化剂,在酸化作用下SC与SA凝胶,形成更加致密的网络结构,限制了冰晶的大小,降低了冰晶对乳液凝胶结构的破坏,因此乳液凝胶冻融稳定性显著提升(P<0.05)。综上所述,GDL和PC可以协同提高乳液凝胶冻融稳定性,赋予乳液凝胶优异的冷冻加工性能。
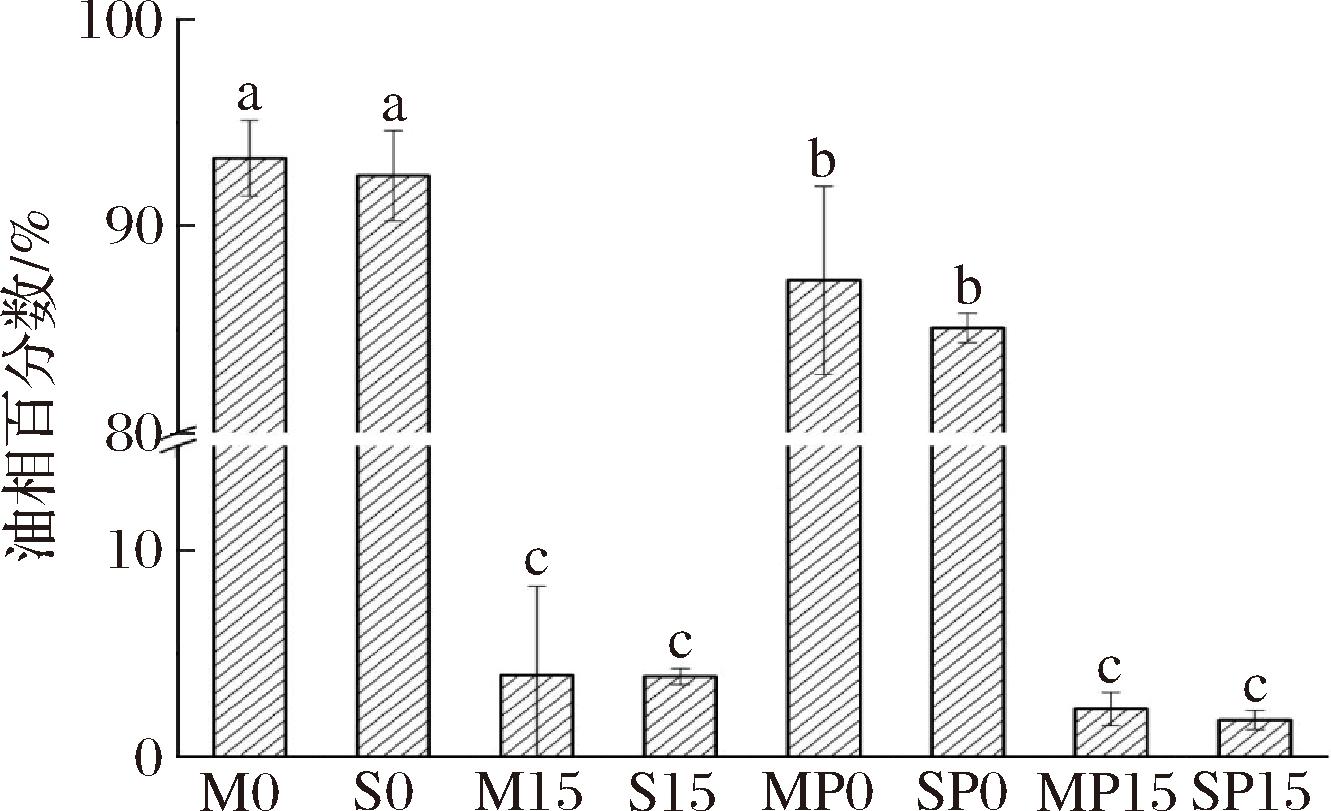
图4 冻融3次后乳液凝胶析出油相百分比
Fig.4 Separated oil phase percentage from emulsion gels after three freeze-thaw cycles
注:不同小写字母表示样品间差异显著(P<0.05)(下同)。
2.2.6 SC析出程度分析
放置72 h后,对乳液凝胶离心清液进行SDS-PAGE分析,结果如图5所示。由图5可以看出,未添加GDL的乳液凝胶上清液中出现酪蛋白条带,为未参与乳化的SC。添加PC后,酪蛋白条带变化不明显。然而,添加GDL后,酪蛋白条带消失。由于GDL的酸化作用,使SC形成了酸凝胶,因此游离酪蛋白减少。SA添加顺序对游离酪蛋白含量不产生影响。也就是说,GDL添加提高了乳液凝胶的结构稳定性。

图5 乳液凝胶离心清液的SDS-PAGE图
Fig.5 SDS-PAGE images of serum from emulsion gels
2.3 乳液凝胶的持水性(WHC)
乳液凝胶的WHC如图6所示,所有样品均具有较高的持水能力,其WHC在90%以上。PC的加入对乳液凝胶WHC没有显著性影响(P>0.05),而GDL显著提高了样品的WHC(P<0.05),这主要是因为GDL的添加致使凝胶内部pH值降低,形成了均匀致密的凝胶网络结构,水分子通过毛细管力更紧密地固定在网络结构中,且难以在离心力作用下析出[28]。
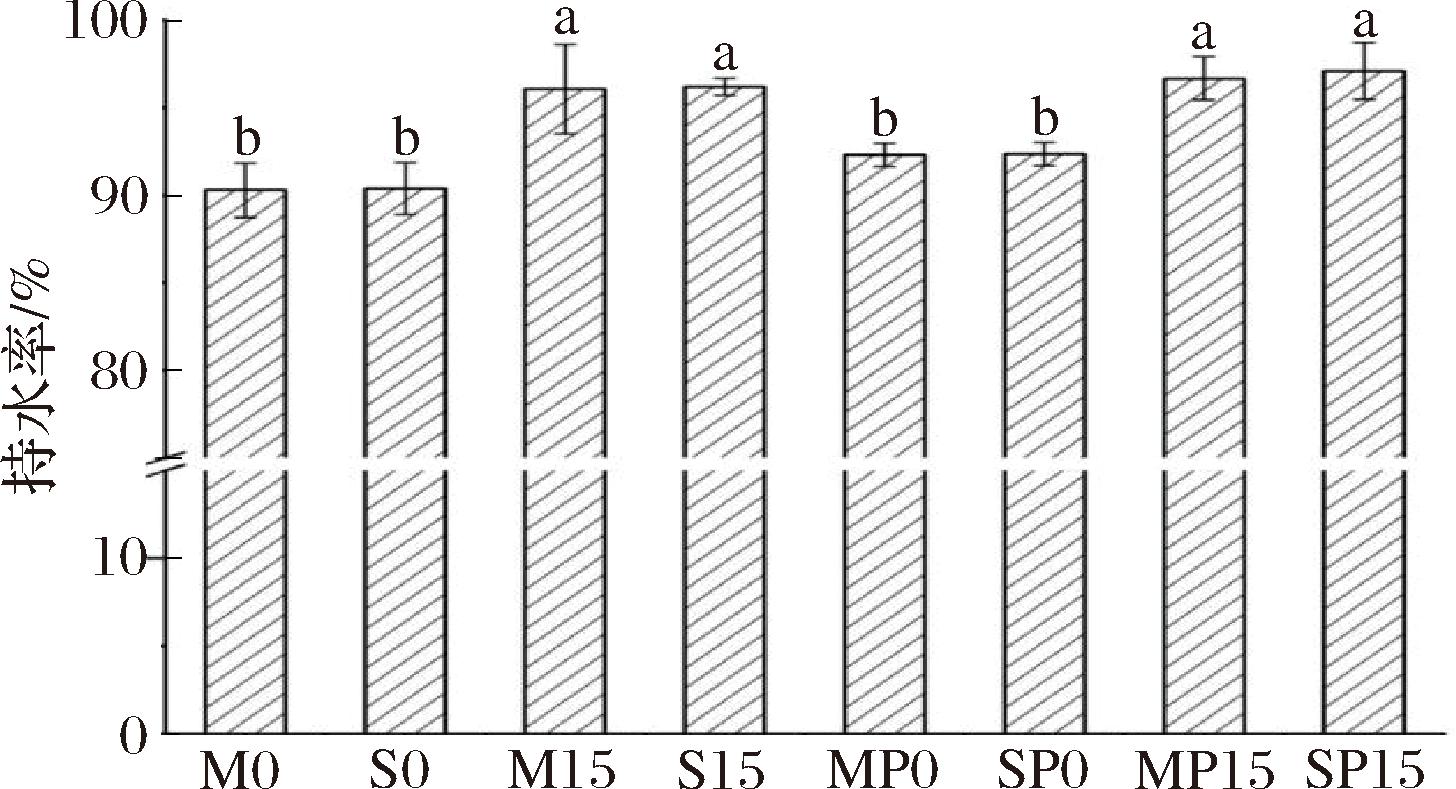
图6 乳液凝胶的持水能力
Fig.6 Water holding capacity of emulsion gels
2.4 乳液凝胶的热分解特性
乳液凝胶的热重(thermogravimetric analysis, TG)和微商热重(derivative thermogravimetry, DTG)曲线如附图4(https://doi.org/10.13995/j.cnki.11-1802/ts.040499)。由图4可知,乳液凝胶的TG曲线与油的TG曲线相似,因为其含油量高达80%。乳液凝胶的失重可分为2个阶段:第一个失重阶段(80~150 ℃)为水分蒸发;第二失重阶段为360~460 ℃,主要是油的热分解所致。由DTG曲线可以看出,油的分解温度为406 ℃。乳液凝胶中,油的分解温度升高。添加GDL和PC的乳液凝胶热分解曲线与未添加样品相似,这是由于PC添加量较少,而GDL酸化并未形成共价作用,因此对乳液凝胶的热分解特性没有明显影响。此外,SA添加顺序对样品的热分解特性无明显影响,因为不同制备工艺下凝胶微观结构和基质间作用力相同。
2.5 乳液凝胶的流变性
乳液凝胶的流变性、稳定性和3D打印性密切相关。图7-a为乳液凝胶在不同剪切速率下的黏度变化。适合3D打印的材料黏度不宜太高,黏度过高会导致材料与注射器的摩擦力增大,挤出速度会慢于设定值,致使3D打印物表面不光滑,挤压不均匀,甚至打印失败[29]。
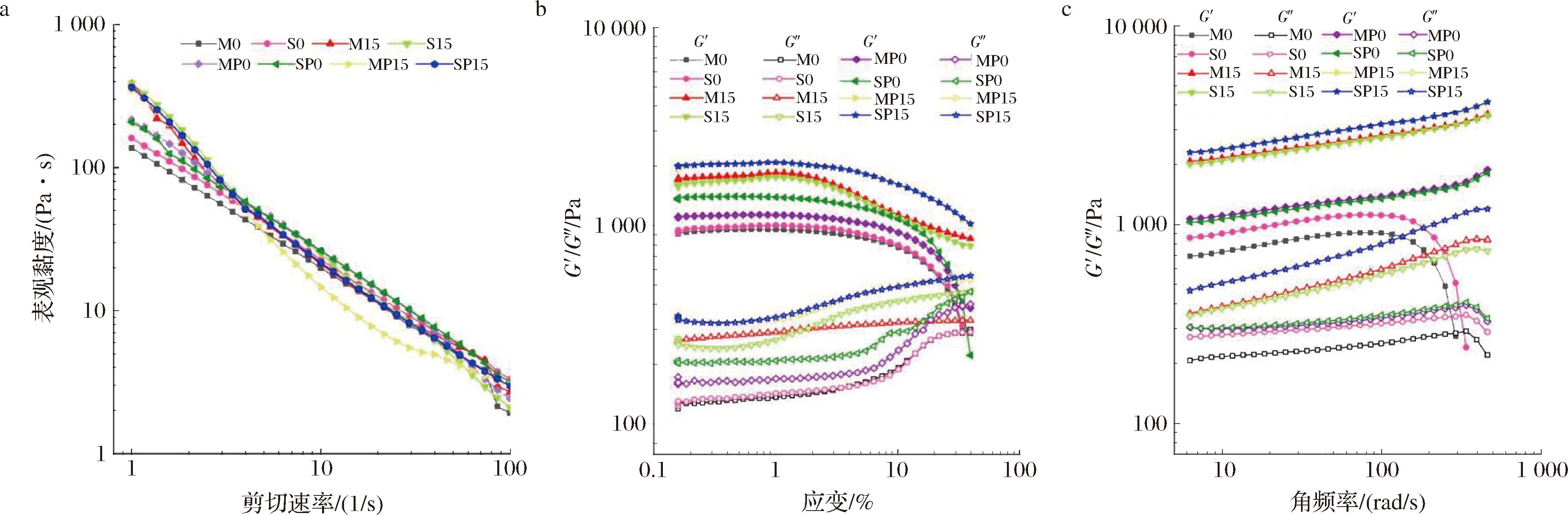
a-黏度;b-弹性模量随应变的变化曲线;c-弹性模量随角频率的变化曲线
图7 乳液凝胶的黏度、弹性模量随应变的变化曲线以及弹性模量随角频率的变化曲线
Fig.7 Curves of viscosity, elastic modulus with strain and elastic modulus with angular frequency of emulsion gels
由图7可知,随着剪切速率的增加,乳液凝胶的黏度降低,表现出剪切稀化行为,适合在3D打印过程中通过喷嘴挤出。添加GDL后,乳液凝胶的初始黏度增大,是因为GDL的添加促使SC和SA凝胶,且油滴粒径变小,从而增大了黏度;随着剪切速率的增加,其稀化行为更为明显,更有利于3D打印中的挤压和提高打印精度。此外,与未添加组相比,添加PC后乳液凝胶的初始黏度增大,这归因于PC与SC之间产生的交联作用。
乳液凝胶的储能模量(G′)代表弹性固体行为,损耗模量(G″)与黏性和类液体行为相关[30]。如图7-b所示,当应变较低时,乳液凝胶G′和G″不随应变增大而变化,即线性变化区域;该区域内,所有样品的G′>G″,表明乳液凝胶为弹性材料。G′和G″交叉点为γco,表示凝胶结构破裂,为样品由黏弹性固体行为向黏弹性液体行为转变的开始[31]。当应变值进一步增大时,G′和G″交叉,之后G″大于G′,表明乳液凝胶的结构被破坏。GDL和PC的添加增大了乳液凝胶的G′和G″,延长了线性变化区域范围,推迟了γco的出现,表明PC和GDL使得乳液凝胶的结构变得致密,抗变形能力增强。
乳液凝胶的黏弹性响应与角频率的函数关系如图7-c所示,所有乳液凝胶的G′均大于G″,表明其可以应用于3D打印[32]。在角频率低于200 rad/s时,G′和G″随着角频率的增加而增大,表明弹性行为占主导地位,有利于3D打印物体的形状稳定性。当乳液凝胶的G′>2 000 Pa时,可形成稳定的打印产品[33]。G′和G″随着GDL的添加而增大,表明GDL的酸诱导凝胶化改善了凝胶内部结构,从而形成了更强的网络结构,表现出更强的类固体行为,与乳液凝胶微观结构分析结果一致。加入PC后,乳液凝胶的G′和G″也增大,更有利于3D打印。添加GDL和PC后,SA添加顺序对乳液凝胶强度不产生影响,说明GDL和PC对乳液凝胶黏弹性的影响大于SA添加顺序。综上所述,GDL和PC的添加改善了乳液凝胶的流变性,其中S15、M15、SP15、MP15均可满足3D打印食品对基材的强度要求。
2.6 乳液凝胶的3D打印性能
乳液凝胶的3D打印图形如图8所示,所有乳液凝胶均成功打印成型,且具有良好的自支撑性。添加GDL后的打印产品边缘更加清晰,打印精度显著提高;负载PC后,打印产品的表面更加光滑。同时添加GDL和PC的乳液凝胶3D打印精度最高。另外,SA添加顺序对乳液凝胶的3D打印性能没有明显影响,与流变性分析结果一致。乳液凝胶的3D打印性能主要与其流变性有关,乳液凝胶的剪切稀化行为可以支持其在3D打印中的连续挤出,较高的弹性模量赋予其一定的自支撑性能和良好的打印精度,且G′值越大,打印精度越高[33]。因此,MP15、SP15具有最佳的3D打印性。
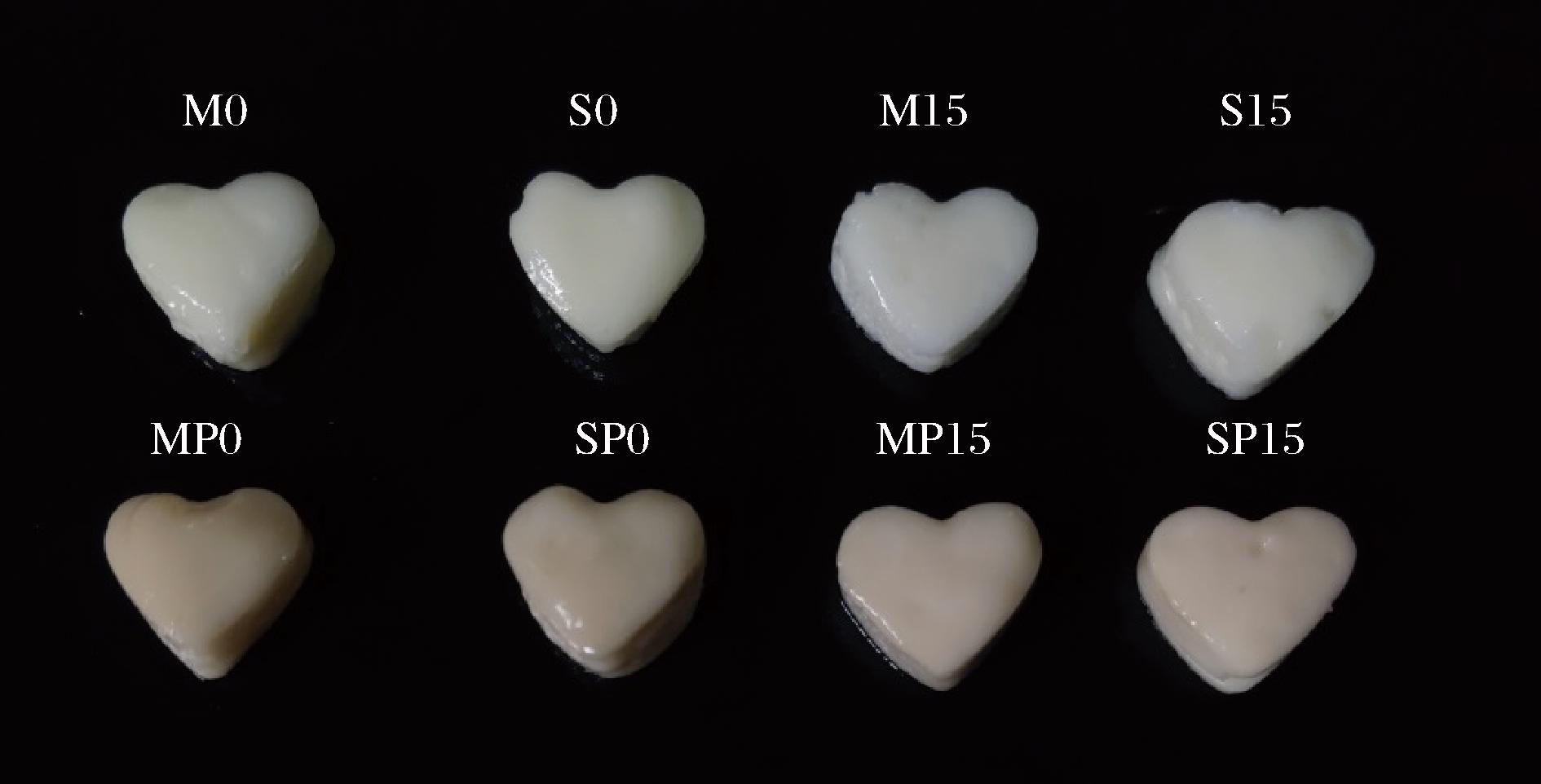
图8 乳液凝胶的3D打印图形
Fig.8 3D printing of emulsion gels
2.7 乳液凝胶对PC的体外模拟释放性能
体外模拟胃肠消化过程中PC从乳液凝胶中的累积释放曲线如图9所示。模拟胃液消化2 h后,经乳液凝胶负载后PC的释放率低于游离PC(19.18±1.67)%,这是由于乳液凝胶中PC被结合和包覆,难以扩散到胃液中,而游离PC更易溶出。添加GDL后,PC的释放率进一步降低,其中SP15的释放率最小,为(7.64±3.42)%。可见,GDL添加增强了乳液凝胶网络结构和黏弹性,从而降低了PC的扩散和溶出。
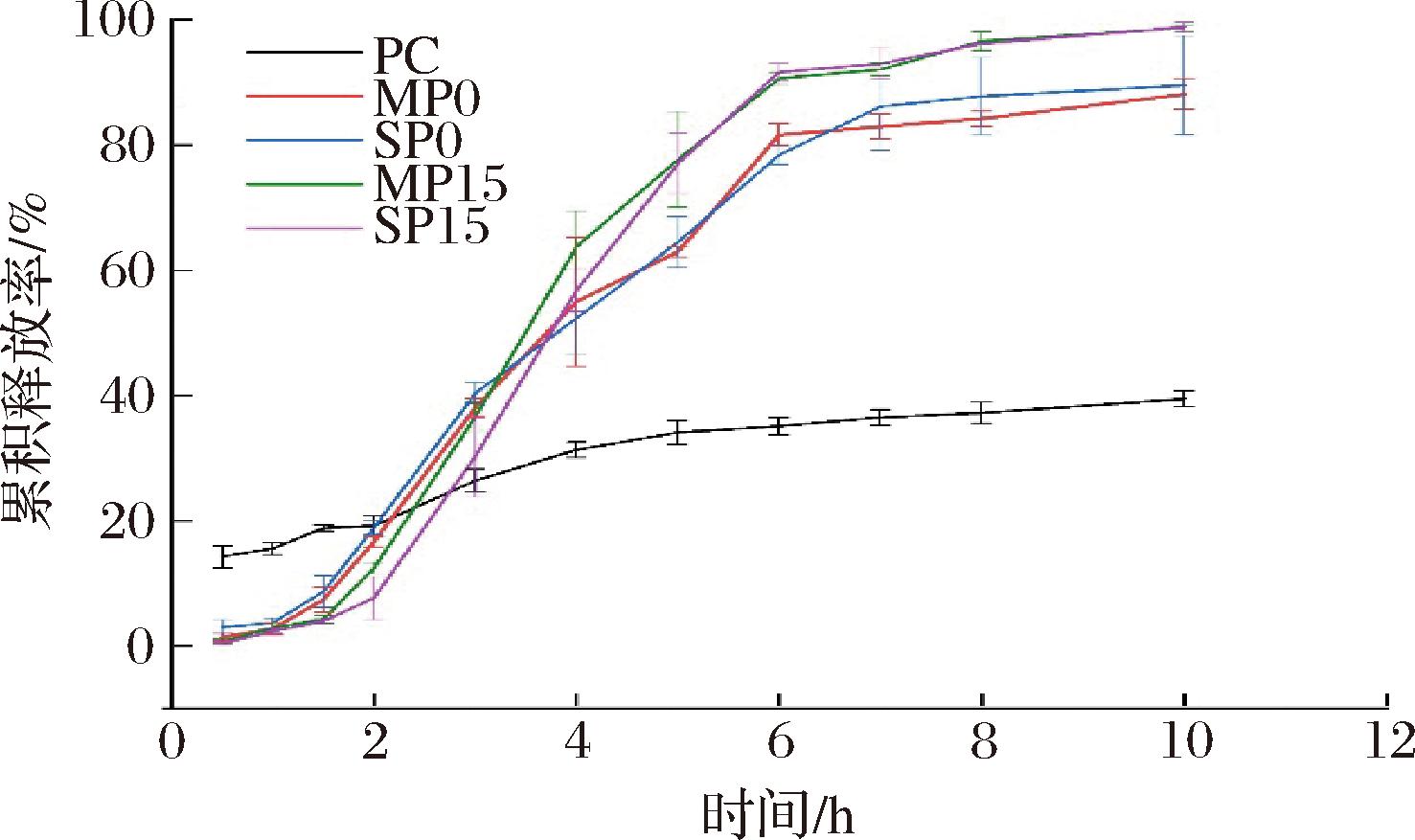
图9 乳液凝胶中的PC在模拟胃肠消化过程中的释放曲线
Fig.9 Release profile of PC during simulated gastrointestinal digestion from emulsion gels
在模拟肠液中,乳液凝胶中PC的释放速率显著高于游离PC,且在消化初期快速释放。PC在酸性条件下稳定,而在中性和碱性条件下稳定性降低,易降解[34]。因此,游离PC在模拟肠液中发生降解,累积释放率低于40%。乳液凝胶负载避免了PC与肠液直接接触,从而保护了其结构稳定,因此释放率较高。就乳液凝胶组而言,模拟消化6 h后,GDL酸化的乳液凝胶中PC释放率大于90%,其在消化8 h时的释放率高达98%以上,未添加GDL的乳液凝胶中PC释放率大于80%。GDL酸化诱导凝胶化,赋予凝胶内部酸性环境,有效降低了消化液的pH,保护了PC的结构稳定。然而,SA添加方式对PC的10 h累积释放率没有明显影响。由此可见,GDL的添加有效保护了PC的稳定性,实现了肠道的靶向释放。
3 结论
以SC和SA为基质,制备了油相体积分数为80%的乳液凝胶。SA与SC分步添加时,乳液凝胶中油滴粒径减小;采用GDL酸化后,油滴粒径进一步减小。SA添加顺序对乳液凝胶的稳定性影响不大,所有乳液凝胶贮藏150 d后结构仍然保持稳定,未见油相析出。在GDL的酸化作用下,乳液凝胶的黏弹性和冻融稳定性显著提高,其3D打印性能显著改善。另外,PC的添加提高了乳液凝胶的黏弹性。乳液凝胶负载有效保护了PC不在胃液环境中释放,使其到达肠道;经GDL诱导酸化后,乳液凝胶中PC在肠液中的累积释放率进一步提升,有利于改善其生物利用度。然而,SA添加顺序对乳液凝胶的3D打印性能及PC的10 h模拟消化累积释放率影响不大。
综上所述,PC经GDL酸化的SA-SC基乳液凝胶负载后,稳定性显著改善,并实现了肠道靶向输送。该体系具有极高的稳定性,可作为3D打印食品基材,开发3D打印功能食品。
[1] 丁玲, 唐艺华, 张丽芬, 等.花生蛋白-果胶复合乳液凝胶的流变学特性和微观结构[J].食品科学, 2022, 43(16):46-52.DING L, TANG Y H, ZHANG L F, et al.Rheological properties and microstructure of peanut protein-pectin emulsion gel[J].Food Science, 2022, 43(16):46-52.
[2] 尹文俊, 朱蒙蒙, 陈小威, 等.天然皂皮皂苷与大豆分离蛋白协同构建高蛋白减脂植物基蛋黄酱及其特性[J].食品科学, 2024, 45(9):22-28.YIN W J, ZHU M M, CHEN X W, et al.Preparation and characteristics of high-protein and fat-reduced Vegetarian Mayonnaise Co-stabilized by natural Quillaja saponin and soybean protein isolate[J].Food science, 2024, 45(9):22-28.
[3] ZHAO X, LI D, WANG L J, et al.Role of gelation temperature in rheological behavior and microstructure of high elastic starch-based emulsion-filled gel[J].Food Hydrocolloids, 2023, 135:108208.
[4] 韦湘滢, 姚晓琳, 岳健雄, 等.沙蒿多糖-明胶双水相乳液凝胶构建及特性[J].食品科学, 2024, 45(16):61-67.WEI X Y, YAO X L, YUE J X, et al.Construction and properties of aqueous two-phase emulsion gels based on Artemisia sphaerocephala Krasch.polysaccharide and gelatin[J].Food Science, 2024, 45(16):61-67.
[5] 张勉羚, 肖建辉, 孙超, 等.甘薯蛋白水解物对钙离子诱导下海藻酸钠凝胶形成的影响[J].食品科学技术学报, 2023, 41(4):67-81.ZHANG M L, XIAO J H, SUN C, et al.Effects of sweet potato protein hydrolysates on formation of calcium ion-induced sodium alginate gel[J].Journal of Food Science and Technology, 2023, 41(4):67-81.
[6] LI X F, GUO C, YANG X, et al.Acid-induced mixed methylcellulose and casein gels:Structures, physical properties and formation mechanism[J].Food Chemistry, 2021, 366(2):130561.
[7] LI P Y, GUO C, LI X F, et al.Preparation and structural characteristics of composite alginate/casein emulsion gels:A microscopy and rheology study[J].Food Hydrocolloids, 2021, 118:106792.
[8] LYU P F, WANG D, CHEN Y L, et al.Pickering emulsion gels stabilized by novel complex particles of high-pressure-induced WPI gel and chitosan:Fabrication, characterization and encapsulation[J].Food Hydrocolloids, 2020, 108:105992.
[9] ZHUANG H, LI X Q, WU S J, et al.Fabrication of grape seed proanthocyanidin-loaded W/O/W emulsion gels stabilized by polyglycerol polyricinoleate and whey protein isolate with konjac glucomannan:Structure, stability, and in vitro digestion[J].Food Chemistry, 2023, 418:135975.
[10] CHEN X, MCCLEMENTS D J, WANG J, et al.Coencapsulation of (-)-epigallocatechin-3-gallate and quercetin in particle-stabilized W/O/W emulsion gels:Controlled release and bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2018, 66(14):3691-3699.
[11] LIU F G, LIANG X P, YAN J, et al.Tailoring the properties of double-crosslinked emulsion gels using structural design principles:Physical characteristics, stability, and delivery of lycopene[J].Biomaterials, 2022, 280:121265.
[12] YU J, WANG Y, LI D, et al.Freeze-thaw stability and rheological properties of soy protein isolate emulsion gels induced by NaCl[J].Food Hydrocolloids, 2022, 123:107113.
[13] BALAKRISHNAN G, NGUYEN B T, SCHMITT C, et al.Heat-set emulsion gels of casein micelles in mixtures with whey protein isolate[J].Food Hydrocolloids, 2017, 73:213-221.
[14] QIN J J, YUAN Z W, AN J, et al.Highly stable emulsion gels with micellar casein based on the jamming transition, for bioactive molecule delivery[J].Food Hydrocolloids, 2023, 143:108874.
[15] 乔蕾蕾, 杨敏, 秦娟娟, 等.酸诱导酪蛋白胶束-海藻酸钠乳液凝胶性质及其对原花青素的负载性能[J].食品科学, 2023, 44(16):50-60.QIAO L L, YANG M, QIN J J, et al.Properties and proanthocyanidin-loading capacity of acid-induced micellar casein-sodium alginate emulsion gels[J].Food Science, 2023, 44(16):50-60.
[16] 刘玫君, 乔蕾蕾, 杨敏.酪蛋白-海藻酸钠基乳液凝胶性质及其在姜黄素负载中的应用[J].食品科学技术学报, 2024, 42(2):58-74.LIU M J, QIAO L L, YANG M.Properties of emulsion gels based on casein-sodium alginate and their application on curcumin delivery[J].Journal of Food Science and Technology, 2024, 42(2):58-74.
[17] BI A Q, XU X B, GUO Y, et al.Fabrication of flavour oil high internal phase emulsions by casein/pectin hybrid particles:3D printing performance[J].Food Chemistry, 2022, 371:131349.
[18] 石冬雪, 李悦欣, 陈倩, 等.壳聚糖自组装颗粒与明胶-大豆分离蛋白微胶束协同构建高内相乳液体系[J].食品科学, 2024, 45(20):82-91.SHI D X, LI Y X, CHEN Q, et al.Synergistic construction of high internal phase emulsion system with self-assembled chitosan nanoparticles and gelatin-soybean protein isolate micromicelles[J].Food Science, 2024, 45(20):82-91.
[19] HU Y X, CHENG L R, LEE S J, et al.Formation and characterisation of concentrated emulsion gels stabilised by faba bean protein isolate and its applications for 3D food printing[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2023, 671:131622.
[20] CHEN Y, WANG Y S, LI Y H, et al.Extrusion-based 3 d printing of pickering high internal phase emulsions stabilized by flaxseed protein-sodium alginate complexes for encapsulating curcumin[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2023, 673:131863.
[21] 王然.直链淀粉含量对玉米淀粉-茶多酚乳液凝胶稳定性质的影响[J].食品科学, 2024, 45(6):41-47.WANG R.Effect of amylose content on stability of maize starch-tea polyphenol emulsion gels[J].Food Science, 2024, 45(6):41-47.
[22] GUO Q, YE A Q, LAD M, et al.The breakdown properties of heat-set whey protein emulsion gels in the human mouth[J].Food Hydrocolloids, 2013, 33:215-224.
[23] LI Y H, WANG C, LUAN Y H, et al.Preparation of pH-responsive cellulose nanofibril/sodium alginate based hydrogels for drug release[J].Journal of Applied Polymer Science, 2021, 139(7):51647.
[24] ZHANG H, TAN S M, GAN H M, et al.Investigation of the formation mechanism and β-carotene encapsulation stability of emulsion gels based on egg yolk granules and sodium alginate[J].Food Chemistry, 2022, 400(2):134032.
[25] CHEVALLIER M, RIAUBLANC A, CAUTY C, et al.The repartition of whey protein microgels and caseins between fat droplet surface and the continuous phase governs the heat stability of emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2019, 563:217-225.
[26] TOMCZYNSK-MLEKO M, HANDA A, WESOLOWSKA-TROJANOWSKA M.et al.New controlled release material:Aerated egg white gels induced by calcium ions[J].European Food Research &technology, 2016, 242:1235-1243.
[27] MUNOZ-GONZALEZ I, RUIZ-CAPOLLAS C, SALVADOR M, et al.Emulsion gels as delivery systems for phenolic compounds:Nutritional, technological and structural properties[J].Food Chemistry, 2021, 339(8):128049.
[28] CHENG Y, FU Y, MA L, et al.Rheology of edible food inks from 2D/3D/4D printing, and its role in future 5D/6D printing[J].Food Hydrocolloids, 2022, 132:107855.
[29] GODOI F C, PRAKASH S, BHANDARI B R.3D printing technologies applied for food design:Status and prospects[J].Journal of Food Engineering, 2016, 179:44-54.
[30] GENG M J, HU T, ZHOU Q, et al.Effects of different nut oils on the structures and properties of gel-like emulsions induced by ultrasound using soy protein as an emulsifier[J].International Journal of Food Science and Technology, 2020, 56(4):1649-1660.
[31] FOUDAZI R, QAVI S, MASALOVA I, et al.Physical chemistry of highly concentrated emulsions[J].Advances in Colloid and Interface Science, 2015, 220:78-91.
[32] WHITE D A, FISK I D, MITCHELL J R, et al.Sunflower-seed oil body emulsions:Rheology and stability assessment of a natural emulsion[J].Food Hydrocolloids, 2008, 22:1224-1232.
[33] ZHANG J Y, PANDYA J K, MCCLEMENTS D J, et al.Advancements in 3D food printing:A comprehensive overview of properties and opportunities[J].Critical Reviews in Food Science and Nutrition, 2022, 62(17):4752-4768.
[34] ZHAO Y, JIANG C Q, LU J Y, et al.Research progress of proanthocyanidins and panthocyanidins[J].Phytotherapy Research, 2023, 37(6):2552-2577.