二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)是人体必需的ω-3长链多不饱和脂肪酸,在防治心脑血管疾病、增进视觉功能和降血脂等方面起着重要作用[1-3]。其中,DHA 有健脑益智、改善视力等作用,被称为“脑黄金”,而EPA 主要清理血管垃圾,被称为“血管清道夫”[4]。2023年,有关部门制定并发布了《允许保健食品声称的保健功能目录 营养素补充剂(2023 年版)》和《保健食品原料目录 营养素补充剂(2023年版)》,前者增加了补充ω-3长链多不饱和脂肪酸的保健功能及其释义,后者新增了DHA,对于推动保健食品新功能及产品研发具有重要意义。
随着多不饱和脂肪酸营养价值的研究深入以及人们生活水平的提高,鱼油和藻油受到广泛关注,消费市场逐年扩大。高品质产品越来越受欢迎,但随之而来的掺伪问题也日益突出。优质鱼油资源匮乏,价格普遍较高,不法商家为一己私欲,在高品质产品中掺兑一定比例的廉价油脂,以次充好,也有部分商家虚假标识欺骗消费者,严重损害了消费者的利益。
现有鱼油和藻油保健品真实性的鉴别主要是基于色谱法对声称功能性标志成分(DHA和EPA)进行定量分析[5-6]。单一物质的定量对原料及产品的真实性鉴别存在局限性,难以进行有效监督和管理。脂肪酸组成是油脂的特征指标,当一种油脂掺入另一种油脂后,必然会改变其脂肪酸组成和含量,可以用于油脂的掺伪检验和真实性鉴别[7-9]。
目前鱼油和藻油保健品脂肪酸特征对比研究及真实性鉴别鲜见报道。本研究采用气相色谱法结合化学计量学对多种不同来源的鱼油和藻油中富含的11种主要脂肪酸进行分析,评价以脂肪酸组成鉴别鱼油和藻油的可行性,并筛选差异代谢物对其准确定量,以期为鱼油和藻油保健品的质量标准建立和真实性鉴别提供科学依据。
1 材料与方法
1.1 材料与试剂
沙丁鱼、小黄鱼、鲣鱼、金枪鱼,均购于电商平台;鱼油和藻油(液态油脂样品),分别来自陕西帕尼尔生物科技有限公司和汤臣倍健股份有限公司;裂壶藻粉,分别购自陕西冠晨生物科技有限公司和西安威斯博生物科技有限公司;国产鱼油软胶囊和藻油软胶囊样品,均来自市售或网购;不同品牌植物油(菜籽油、大豆油和玉米油),均为大型超市所售知名品牌产品;37种脂肪酸甲酯混标(溶于异辛烷,总计10 mg/mL,1 mL)、十一烷酸甘油三酯、二十二碳六烯酸甲酯、二十碳五烯酸甲酯,纯度均≥99.0%,上海安谱璀世标准技术服务有限公司;14%三氟化硼-甲醇溶液、无水硫酸钠,甲醇(色谱纯)、正己烷(色谱纯),上海麦克林生化科技有限公司;氢氧化钠、氯化钠,国药化学试剂有限公司。
1.2 仪器与设备
Trace1600 Series气相色谱仪,配备AI/AS 1610自动进样器、FID检测器,美国Thermo Fisher Scientific公司;HA-300氢空一体机,北京科普生分析科技有限公司;HH-600电热恒温水槽,常州中捷实验仪器制造有限公司;EDAA-2300TH超声波清洗器,上海安谱实验科技股份有限公司;旋转蒸发器,上海贤德实验仪器有限公司;ME55/02电子天平,瑞士METTLER TOLEDO公司;超纯水机,美国MILLI-Q公司。
1.3 实验方法
1.3.1 鱼油及藻油的制备
新鲜鱼原料洗净沥干,取鱼腹、内脏和鱼头搅碎混匀,置于-20 ℃冰箱冷藏备用。裂壶藻粉不做处理,直接称量。取30 g原料置于锥形瓶中,按照料液比1∶5(g∶mL)加入150 mL正己烷,于50 ℃、300 W条件下超声浸提1 h,重复提取2~3次后,8 000 r/min离心10 min,上清液经过旋转蒸发器除去有机溶剂得到对应油脂样品。
1.3.2 标准溶液的配制
十一烷酸甘油三酯内标溶液的配制:准确称取十一烷酸甘油三酯标准品189.91 mg,置于25.00 mg棕色容量瓶中,加入甲醇溶解并定容至刻度,得到3.798 2 mg/mL的十一烷酸甘油三酯内标溶液。
二十二碳六烯酸甲酯、二十碳五烯酸甲酯溶液的配制:分别称取90.66 mg DHA甲酯和93.28 mg EPA甲酯,用正己烷溶解并定容至10 mL,分别得到9.066和9.328 mg/mL的标准溶液。
1.3.3 样品前处理
脂肪酸组成的测定参照汪学荣等[10]报道的方法。精确称取油脂样品60.0 mg,准确加入2 mL内标溶液,后加入0.2 mol/L NaOH-CH3OH 溶液 5 mL,60 ℃皂化30 min;待冷却后加质量分数为14% BF3-CH3OH溶液5 mL,60 ℃甲酯化30 min;冷却后加正己烷与饱和氯化钠各4 mL,涡旋混匀,静置分层。吸取上层有机相加过量无水硫酸钠除水,待气相色谱分析。
1.3.4 色谱条件
色谱柱:TR-FAME(100 m×0.25 mm×0.2 μm,Thermo Fisher Scientific);进样口温度:260 ℃;升温程序:100 ℃保持9.15 min,以13.5 ℃/min升温至180 ℃,保持4.95 min,再以1.2 ℃/min升温至200 ℃,保持17.15 min,最后以4.4 ℃/min升温至230 ℃,保持9.55 min;载气:99.999%氮气,1 mL/min;分流比:100∶1;进样体积:1 μL。
1.3.5 方法学验证
1.3.5.1 相对校正因子
取37种混合脂肪酸甲酯混标,按1.3.4节中的色谱条件连续进样6 针,记录峰面积并计算相对校正因子。
1.3.5.2 重复性实验
取同一油脂样品平行称定6份,按照1.3.3节前处理后在上述色谱条件下测定,计算DHA和EPA的含量及相对标准偏差(relative standard deviation,RSD)以判断方法的重复性。
1.3.5.3 精密度实验
取同一份经过前处理后的样品溶液,连续进样6次,计算EPA和DHA含量的RSD以评价仪器的精密度。
1.3.5.4 加标回收率实验
将DHA、EPA含量已知的样品9份分成3组,每组3个样品按照80%、100%、120%(质量分数)加入标准溶液,计算加标回收率和RSD。
1.3.5.5 稳定性实验
取同一份油脂样品,按照1.3.3节的方法前处理后,分别在0、2、4、8、12、24 h时测定DHA和EPA的含量以判断待测样品溶液和设备在1 d内的稳定性。
1.4 数据处理及统计
按照面积归一化法计算各脂肪酸的相对含量,内标法计算单个脂肪酸的含量[6]。所有数据平行测定3次,结果以“平均值±标准差”的形式表示。采用SPSS统计软件进行数据差异显著性分析,用SIMCA软件对数据进行主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)。
2 结果与分析
2.1 脂肪酸甲酯色谱测定结果
本实验选用Trace TR-FAME色谱柱,是专为分离脂肪酸甲酯而设计的氰丙基苯基相,适用于分离不同饱和度的顺式/反式异构体和脂肪酸甲酯,性能可靠且重现性好。由图1可以看出,37种脂肪酸甲酯在色谱柱上能实现完全分离,峰型平滑尖锐且可独立辨别,说明该色谱条件能够实现鱼油和藻油中脂肪酸组成的分析。
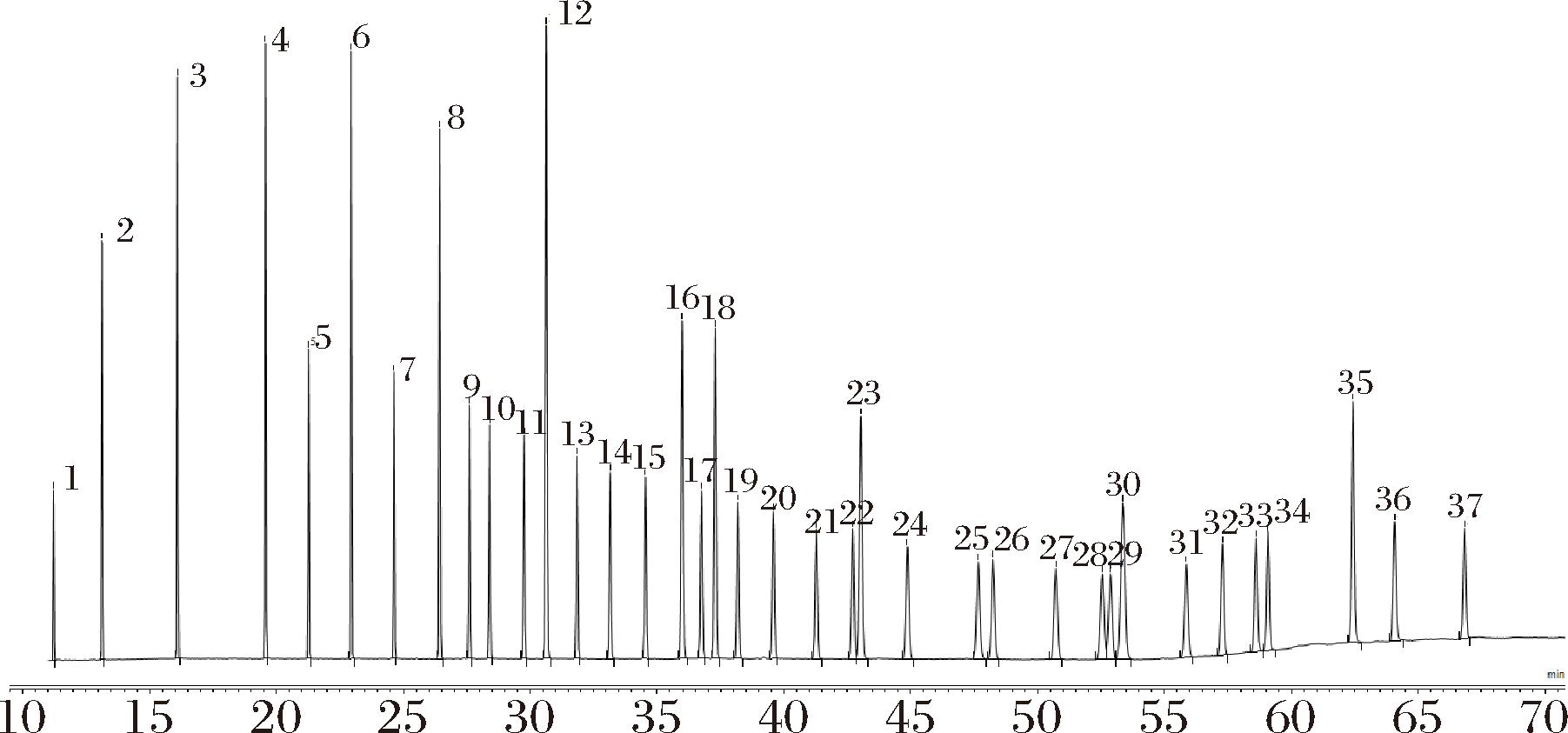
1-C4:0;2-C6:0;3-C8:0;4-C10:0;5-C11:0;6-C12:0;7-C13:0;8-C14:0;9-C14:1;10-C15:0;11-C15:1;12-C16:0;13-C16:1;14-C17:0;15-C17:1;16-C18:0;17-C18:1n9t;18-C18:1n9c;19-C18:2n6t;20-C18:2n6c;21-C18:3n6;22-C18:3n3;23-C20:0;24-C20:1;25-C21:0;26-C20:2;27-C20:3n6;28-C20:4n6;29-C20:3n3;30-C22:0;31-C22:1n9;32-C20:5n3;33-C23:0;34-C22:2;35-C24:0;36-C24:1;37-C22:6n3。
图1 37种脂肪酸甲酯色谱图
Fig.1 Chromatogram of 37 fatty acid methyl esters
2.2 代表性油脂脂肪酸指纹特征及真实性判别分析
常见的鱼油造假方式有用劣质鱼油冒充高品质鱼油,或在鱼油中掺入廉价动植物油脂,如大豆油、菜籽油等。因此选择3种日常食用较多的植物油脂,利用1.3.3节中方法测定脂肪酸组成。鱼油和藻油及3种植物油样品中共检测出11种主要脂肪酸,结果见表1。5种油脂均含超过68%的不饱和脂肪酸,饱和脂肪酸占比较少。鱼油和藻油中饱和脂肪酸分别为31.40%和30.77%,而其他3种植物油中饱和脂肪酸最高仅为15.38%。鱼油脂肪酸组成中棕榈酸(C16:0)和DHA含量最高,其次为油酸(C18:1n9c)和EPA。藻油中DHA含量高达60%,而EPA含量仅1.42%,其次棕榈酸含量较高(25.17%)。其他3种植物油中,菜籽油油酸(57.89%)含量最高,玉米油和大豆油中亚油酸(C18:2n6c)含量较高,分别为57.14%和54.12%,这与前人研究相似[11-12],并且所测植物油脂均符合对应油脂的国家标准,品质良好。相较于其他4种油脂,鱼油各脂肪酸相对含量波动范围更广,说明不同品种鱼油的脂肪酸组成差异较大[13-14],且油脂脂肪酸组成还会受到鱼的产地、季节、加工部位和油脂提取工艺等因素的影响[15-16]。在植物油中能检测到微量的DHA和EPA,但植物油和鱼油的DHA/EPA均小于4,相反,藻油中DHA/EPA高达42.31。王琼芬等[17]曾用DHA、EPA相对含量比(DHA/EPA)作为特征指标鉴别鳕鱼肝油和鱼油,认为若DHA/EPA超过1.40~1.68则判定鳕鱼肝油中掺杂了鱼油。因此DHA/EPA也可以作为鉴别藻油和其他油脂的指标之一。
表1 5种油脂脂肪酸组成比较
Table 1 Comparison of fatty acid composition of five kinds of oil
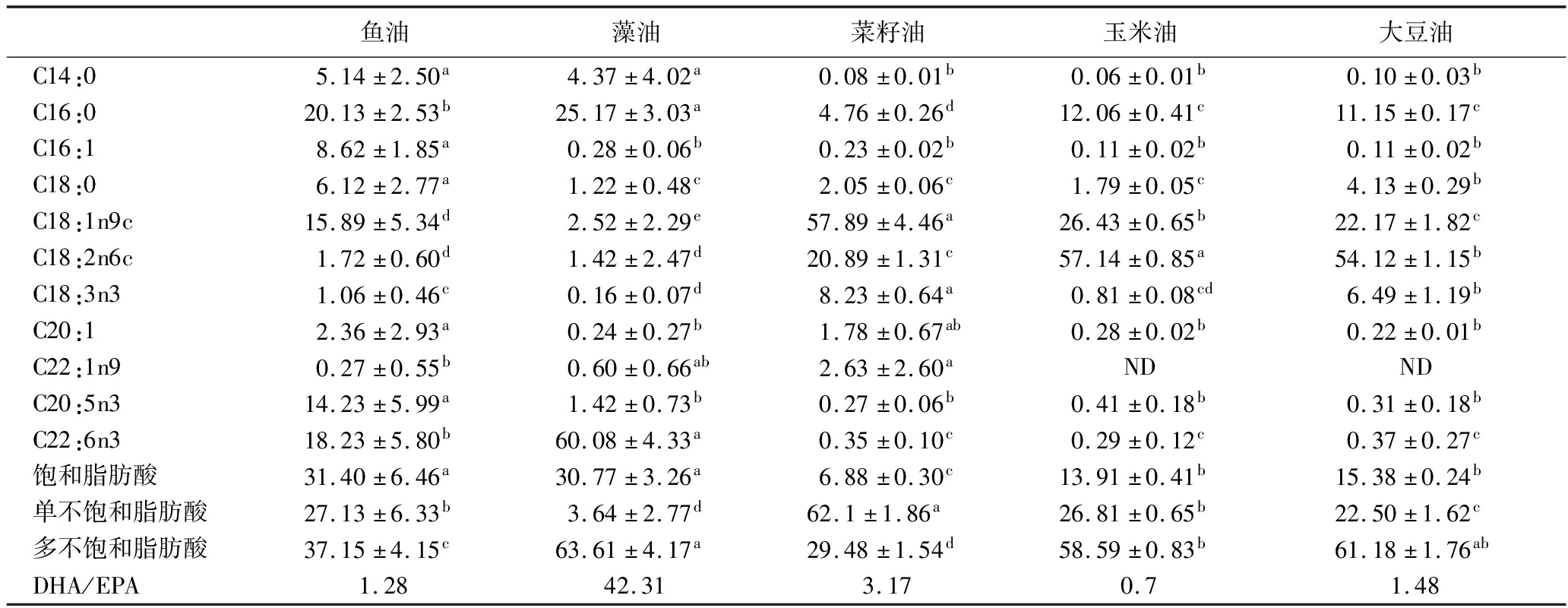
鱼油藻油菜籽油玉米油大豆油C14:05.14±2.50a4.37±4.02a0.08±0.01b0.06±0.01b0.10±0.03bC16:020.13±2.53b25.17±3.03a4.76±0.26d12.06±0.41c11.15±0.17cC16:18.62±1.85a0.28±0.06b0.23±0.02b0.11±0.02b0.11±0.02bC18:06.12±2.77a1.22±0.48c2.05±0.06c1.79±0.05c4.13±0.29bC18:1n9c15.89±5.34d2.52±2.29e57.89±4.46a26.43±0.65b22.17±1.82cC18:2n6c1.72±0.60d1.42±2.47d20.89±1.31c57.14±0.85a54.12±1.15bC18:3n31.06±0.46c0.16±0.07d8.23±0.64a0.81±0.08cd6.49±1.19bC20:12.36±2.93a0.24±0.27b1.78±0.67ab0.28±0.02b0.22±0.01bC22:1n90.27±0.55b0.60±0.66ab2.63±2.60aNDNDC20:5n314.23±5.99a1.42±0.73b0.27±0.06b0.41±0.18b0.31±0.18bC22:6n318.23±5.80b60.08±4.33a0.35±0.10c0.29±0.12c0.37±0.27c饱和脂肪酸31.40±6.46a30.77±3.26a6.88±0.30c13.91±0.41b15.38±0.24b单不饱和脂肪酸27.13±6.33b3.64±2.77d62.1±1.86a26.81±0.65b22.50±1.62c多不饱和脂肪酸37.15±4.15c63.61±4.17a29.48±1.54d58.59±0.83b61.18±1.76abDHA/EPA1.2842.313.170.71.48
注:ND表示未检测到;不同字母表示同行数据差异显著(P<0.05)(下同)。
PCA是非监督模式的数据分析方法,能够对数据进行降维处理,结果可以图形的形式更加直观地展现出来。利用SIMCA软件对五类油脂样品中11种脂肪酸进行PCA。基于特征值>1选取3个主成分,第一主成分和第二主成分的贡献率分别为43.8%和23.8%,累计贡献度大于70%,利用主成分1和主成分2做二维散点图,得到如图2-a所示的主成分分析得分图和荷载图。鱼油、藻油和其他3种植物油在主成分分析得分图上得到有效区分,且鱼油、藻油与其他3种植物油差异显著,但鱼油较为分散,鱼油和藻油较为接近。
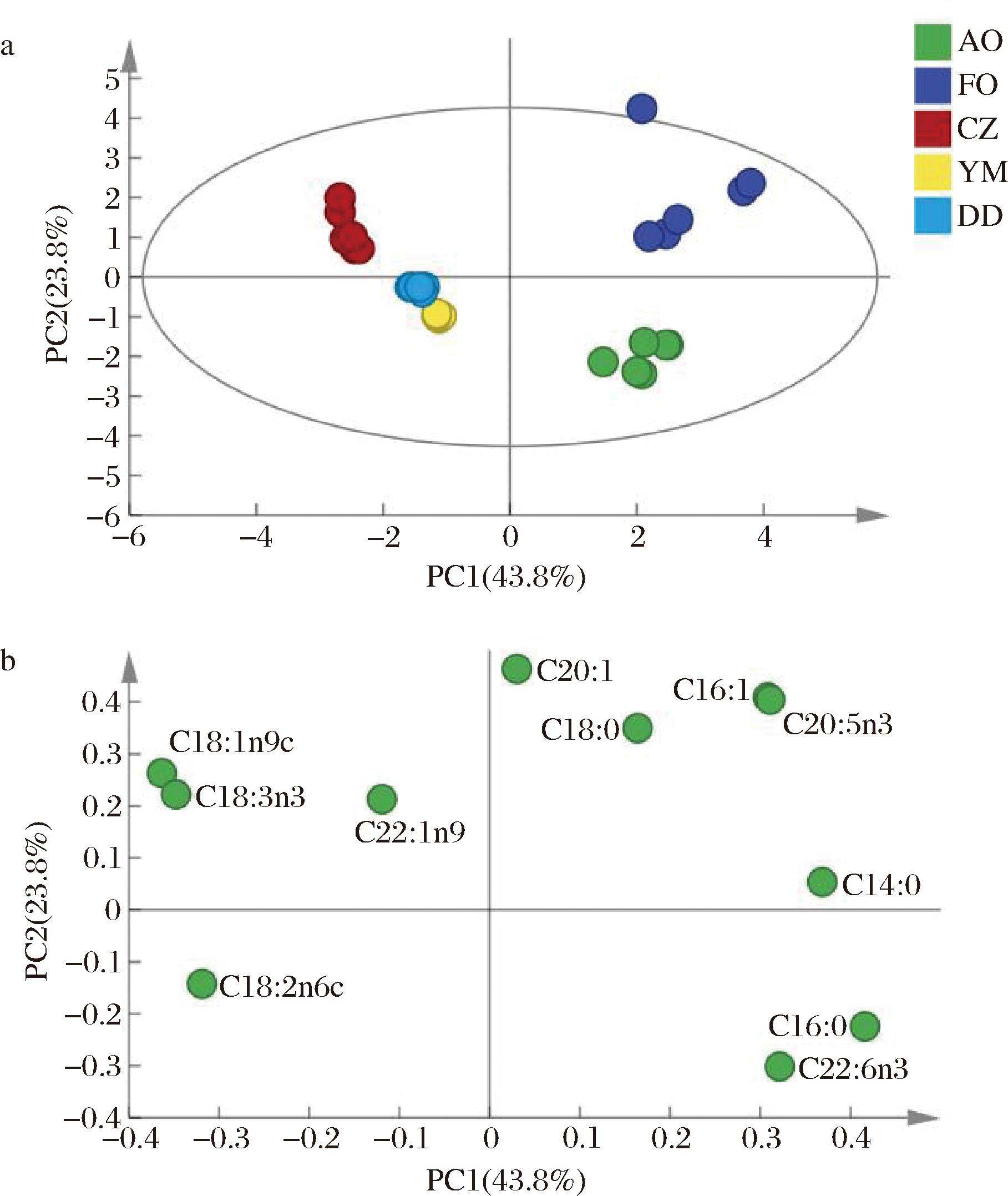
a-PCA得分;b-PCA载荷图
图2 5种油脂脂肪酸PCA结果
Fig.2 PCA result for fatty acids of five kinds of oil
注:“algal oil(AO)”表示藻油;“fish oil(FO)”表示鱼油;“CZ”表示菜籽油;“YM”表示玉米油;“DD”表示大豆油(下同)。
由于PCA是一种无监督学习,只能观察到样本之间的分类趋势,不具备对未知样本的分类预测能力,无法对鱼油和藻油保健品中存在的假冒伪劣产品进行判别归类,因此利用PLS-DA这种有监督的统计方法实现分类预测[18]。结果见图3-a,鱼油和藻油在二维散点图上与其他3种植物油区分明显,并且同一类油脂样品与PCA结果相比更加聚集。模型的参数为R2X=0.954,R2Y=0.937,Q2=0.932。R2表示模型对训练数据的的拟合优度,Q2表示对未知数据的预测能力,R2和Q2的值越接近1,表明模型的解释能力和预测能力越好,结果稳定可靠[19]。
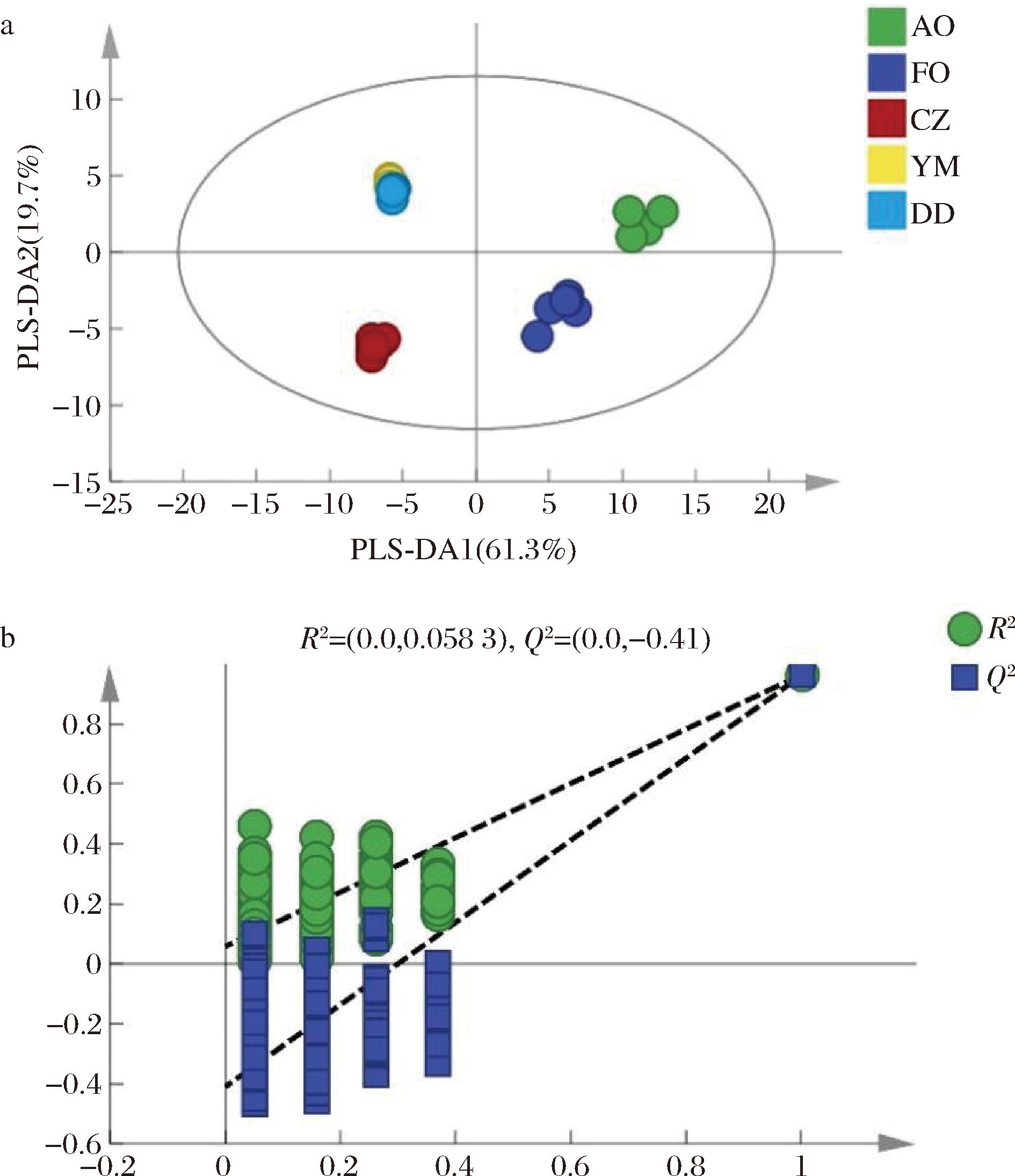
a-PLS-DA得分图;b-置换检验图
图3 5种油脂脂肪酸PLS-DA结果及模型200次循环迭代置换检验图
Fig.3 PLS-DA result for fatty acids of five kinds of oil and permutation test diagram of PLS-DA model iterated 200 times
为了防止模型出现过度拟合现象,对PLS-DA得分图进行200次循环迭代置换检验,结果如图3-b所示。PLS-DA模型数值为R2(0.0,0.058 3),Q2(0.0,-0.41),R2和Q2均小于保留度为1.0的值,且Q2回归线与Y轴交于负半轴,表明可以使用该模型对鱼油和藻油进行准确鉴别,未出现过度拟合,具有真实性和有效性。
ω-3补充剂早期的主要原料来源为深海鱼油,但容易受到品质和捕捞季节的影响,难以满足人们日益增长的营养需求。后来研究发现,DHA的原始生产者是海洋中的浮游生物和藻类,通过食物链传递给海洋鱼类并在其脂肪中积累,因此微藻成为DHA的新兴来源[20]。随着科学技术的发展,通过生物发酵技术,已经能够利用海洋微藻高效生产DHA,过程洁净可控、可追溯,更加环保、安全,加上藻油DHA的成分含量更加适合婴幼儿,在婴配粉领域应用较为广泛,近年来藻油代替鱼油的趋势逐步显现[21]。然而这也带来了新的挑战,可能出现在高价值深海鱼油中掺杂藻油的现象,造成产品营养成分和质量的改变,因此有必要进一步研究鱼油和藻油保健品原料的真实性问题。
2.3 鱼油及藻油保健品原料真实性判别分析
鱼油和藻油保健品的脂肪酸组成如表2所示,可知鱼油和藻油保健品总不饱和脂肪酸的含量超过60%,其中EPA和DHA含量最高,并且有些保健鱼油产品的EPA和DHA总量占比超过98%,这是因为天然鱼油和微藻中DHA都是以甘油三酯型(TG型)存在, DHA含量偏低,为提高DHA含量往往需要对鱼油进行乙酯化处理得到乙酯型鱼油(EE型)。乙酯型鱼油因为不能被有效水解释放游离脂肪酸,因而消化吸收率远低于甘油三酯型[22-24]。且乙酯型鱼油极易氧化,其氧化产物对人体有害[25]。为了克服以上缺点,对乙酯型鱼油经过甘油酯化处理后得到再酯化型(rTG型)鱼油,该类鱼油在DHA含量、产品稳定性和生物利用率上都优于其他两类[26-27]。
表2 鱼油及藻油保健品脂肪酸组成 单位:%
Table 2 Fatty acid composition of fish oil and algae oil health foods
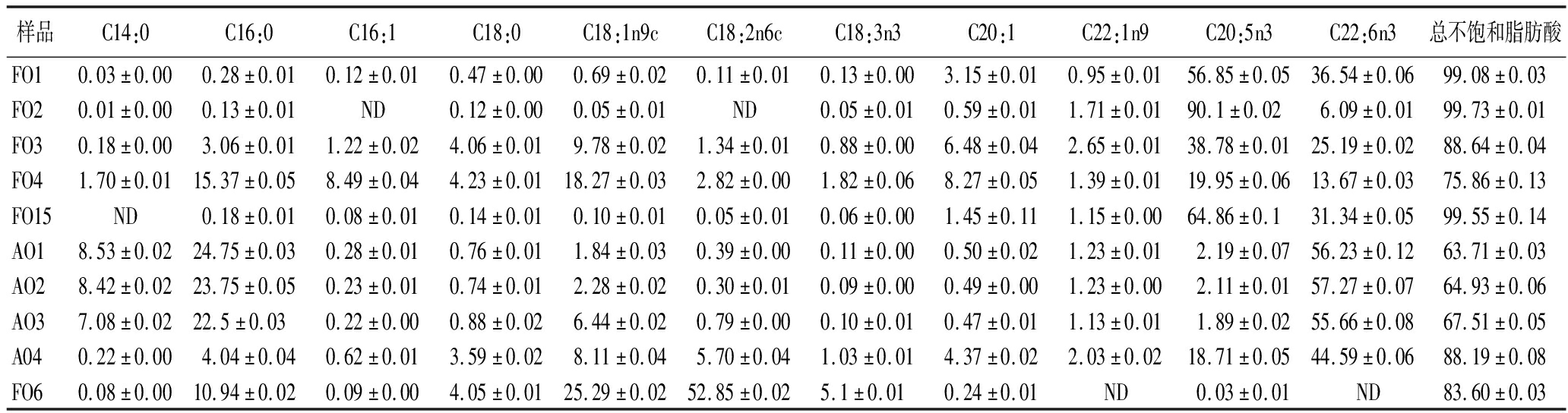
样品C14:0C16:0C16:1C18:0C18:1n9cC18:2n6cC18:3n3C20:1C22:1n9C20:5n3C22:6n3总不饱和脂肪酸FO10.03±0.000.28±0.010.12±0.010.47±0.000.69±0.020.11±0.010.13±0.003.15±0.010.95±0.0156.85±0.0536.54±0.0699.08±0.03FO20.01±0.000.13±0.01ND0.12±0.000.05±0.01ND0.05±0.010.59±0.011.71±0.0190.1±0.026.09±0.0199.73±0.01FO30.18±0.003.06±0.011.22±0.024.06±0.019.78±0.021.34±0.010.88±0.006.48±0.042.65±0.0138.78±0.0125.19±0.0288.64±0.04FO41.70±0.0115.37±0.058.49±0.044.23±0.0118.27±0.032.82±0.001.82±0.068.27±0.051.39±0.0119.95±0.0613.67±0.0375.86±0.13FO15ND0.18±0.010.08±0.010.14±0.010.10±0.010.05±0.010.06±0.001.45±0.111.15±0.0064.86±0.131.34±0.0599.55±0.14AO18.53±0.0224.75±0.030.28±0.010.76±0.011.84±0.030.39±0.000.11±0.000.50±0.021.23±0.012.19±0.0756.23±0.1263.71±0.03AO28.42±0.0223.75±0.050.23±0.010.74±0.012.28±0.020.30±0.010.09±0.000.49±0.001.23±0.002.11±0.0157.27±0.0764.93±0.06AO37.08±0.0222.5±0.030.22±0.000.88±0.026.44±0.020.79±0.000.10±0.010.47±0.011.13±0.011.89±0.0255.66±0.0867.51±0.05A040.22±0.004.04±0.040.62±0.013.59±0.028.11±0.045.70±0.041.03±0.014.37±0.022.03±0.0218.71±0.0544.59±0.0688.19±0.08FO60.08±0.0010.94±0.020.09±0.004.05±0.0125.29±0.0252.85±0.025.1±0.010.24±0.01ND0.03±0.01ND83.60±0.03
对鱼油和藻油进行无监督式主成分分析,结果见图4-a和4-b。主成分分析二维图表明通过PCA没有办法实现鱼油和藻油的有效区分。OPLS-DA是一种有监督的判别方法,可排除无关因素、放大组间差异、反应模型的检测及预测效果,分离效果优于PCA[19]。由图4-c和4-d可知,鱼油样品主要分布在置信区间左侧,藻油主要分布在置信区间右侧,鱼油和藻油样品通过OPLS-DA可以实现完全分离。藻油差异较小,聚集在一起,而鱼油组内差异较大。从载荷图中可以看出变量C20:5n3(EPA)和C22:6n3(DHA)对鱼油和藻油的分类最重要。模型的参数R2X=0.870,R2Y=0.931,Q2=0.833,模型的解释能力和预测能力良好。200次循环迭代置换检验结果(图5)显示,OPLS-DA模型数值为R2(0.0,0.277),Q2(0.0,-0.51),Q2为负值,表明未出现过度拟合,结果真实有效。
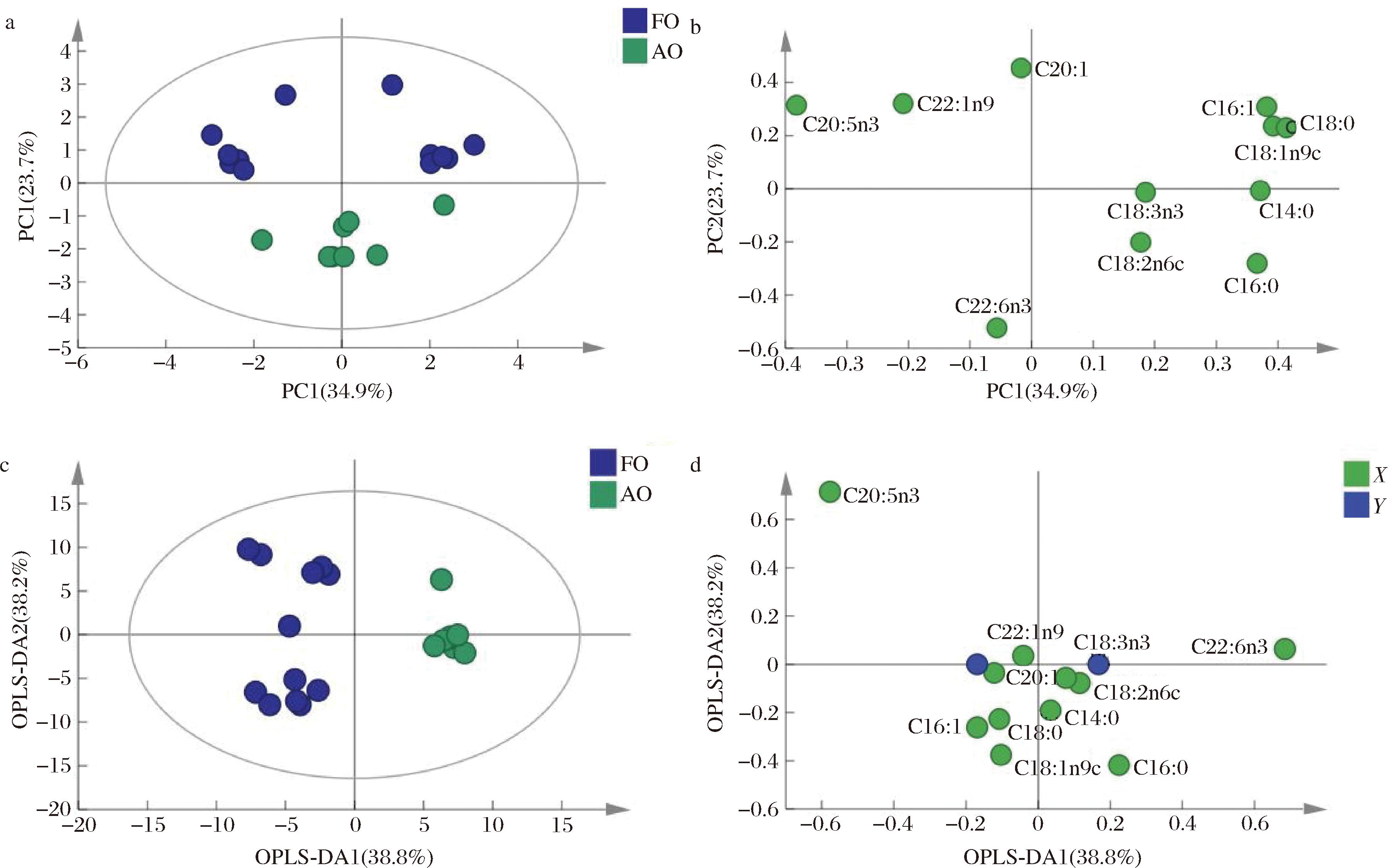
a-PCA得分图;b-PCA载荷图;c-OPLS-DA得分图;d-OPLS-DA载荷图
图4 鱼油和藻油脂肪酸PCA和OPLS-DA结果
Fig.4 PCA and OPLS-DA results for fish oil and algae oil
注:“X”表示特征变量;“Y” 表示目标变量。
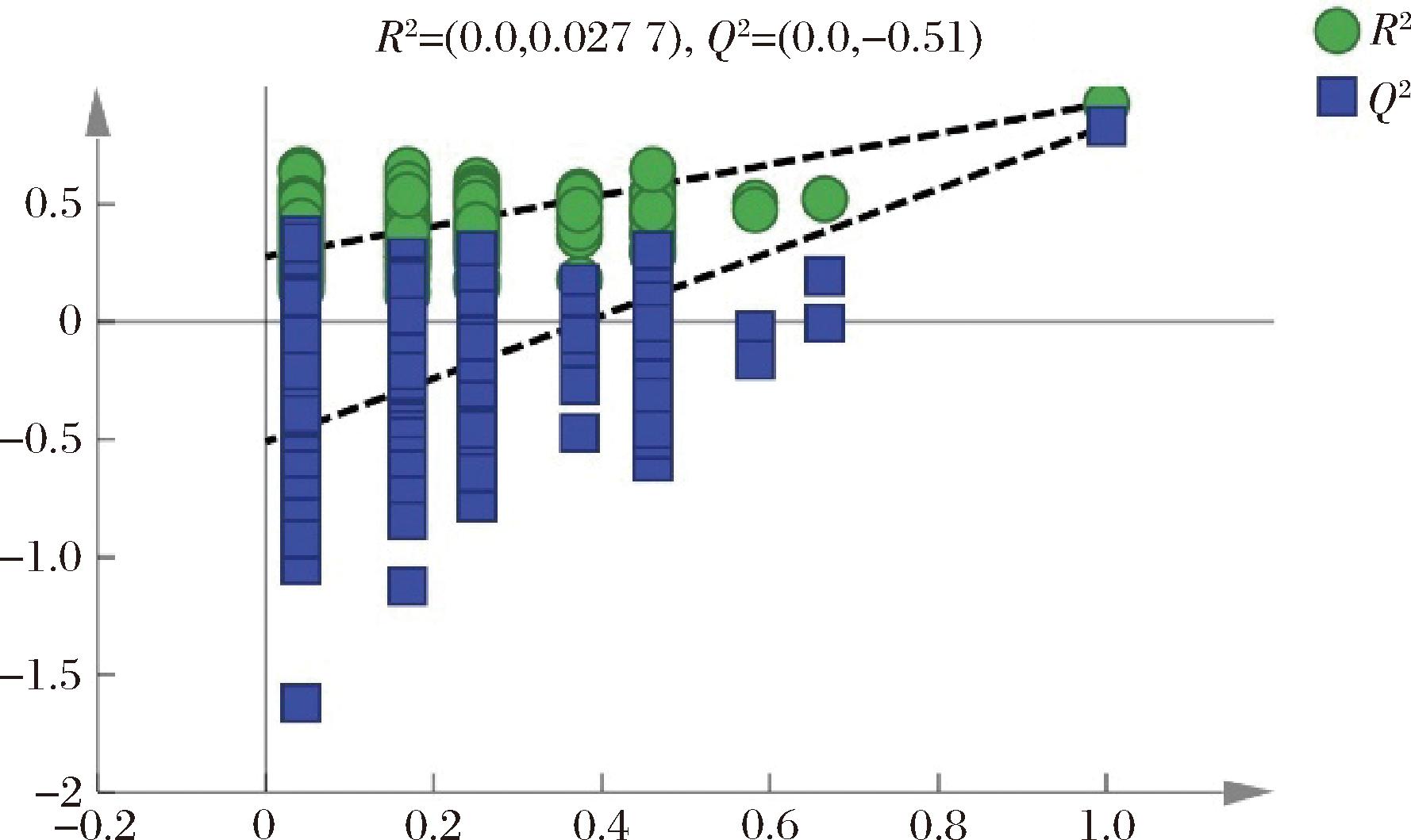
图5 OPLS-DA模型200次循环迭代置换检验图
Fig.5 Permutation test diagram of OPLS-DA model iterated 200 times
提取OPLS-DA模型中11个变量的贡献度(VIP值),如图6所示,结果显示VIP值大于1且P<0.05的物质为DHA和EPA,表明这2种成分对于鱼油和藻油的区分具有显著的影响,是主要标志性成分,且这2个成分也是鱼油和藻油保健品的功能性声称成分,有必要对其进行进一步分析,明确不同类型产品中两者的含量分布范围与虚假宣称等问题。
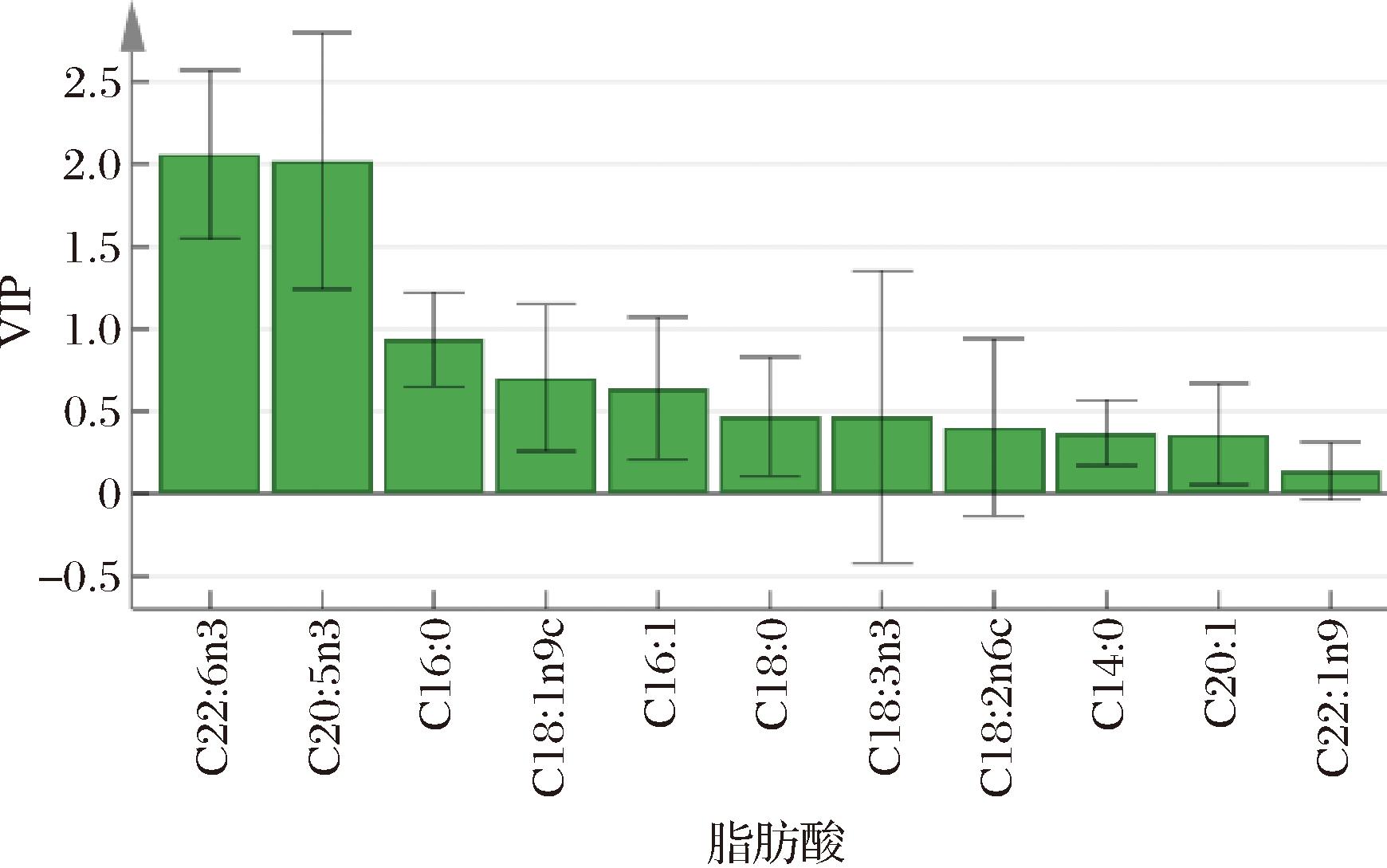
图6 OPLS-DA自变量投影重要性指标VIP图
Fig.6 OPLS-DA independent variable projected importance index VIP chart
2.4 鱼油及藻油保健品DHA和EPA含量的测定
2.4.1 方法学验证
2.4.1.1 相对校正因子
由表3可知,采用内标法测得DHA甲酯和EPA甲酯对内标C11:0的相对校正因子的平均值分别为1.023 7和1.004 8,RSD分别为0.37%和0.84%。
表3 DHA甲酯和EPA甲酯对内标C11:0的相对校正因子
Table 3 Relative correction factor of DHA and EPA methyl ester based on C11:0

序号123456平均值RSD/%DHA甲酯1.02201.02841.01921.02541.02031.02691.02370.37EPA甲酯1.00611.01070.99051.00241.01531.00381.00480.84
2.4.1.2 重复性实验
重复性实验结果如表4所示,该样品DHA的平均含量为35.04 g/100 g,RSD为1.40%;EPA的平均含量为53.05 g/100 g,RSD为1.49%,表明重复性较好。
表4 重复性试验结果
Table 4 Repeatability test results

序号称样量/mgDHAEPA含量/(g/100g)平均含量/(g/100g)RSD/%含量/(g/100g)平均含量/(g/100g)RSD/%160.2234.47260.1135.04360.0234.42460.1635.50560.1935.48660.1935.3335.041.4052.0352.9552.1953.7053.8053.6553.051.49
2.4.1.3 精密度实验
精密度实验结果如表5所示,DHA的RSD为0.34%,EPA的RSD为0.14%,表明实验精密度较好。
表5 精密度实验结果
Table 5 Precision test results
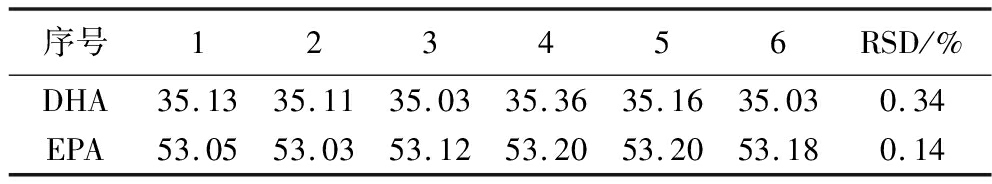
序号123456RSD/%DHA35.1335.1135.0335.3635.1635.030.34EPA53.0553.0353.1253.2053.2053.180.14
2.4.1.4 加标回收实验
加标回收实验结果如表6所示,DHA和EPA的平均回收率分别为98.79%和99.91%,RSD均小于3%,说明该方法能够准确测定样品中DHA和EPA的含量。
表6 DHA和EPA的加标回收结果(n=3)
Table 6 Recovery results of DHA and EPA(n=3)
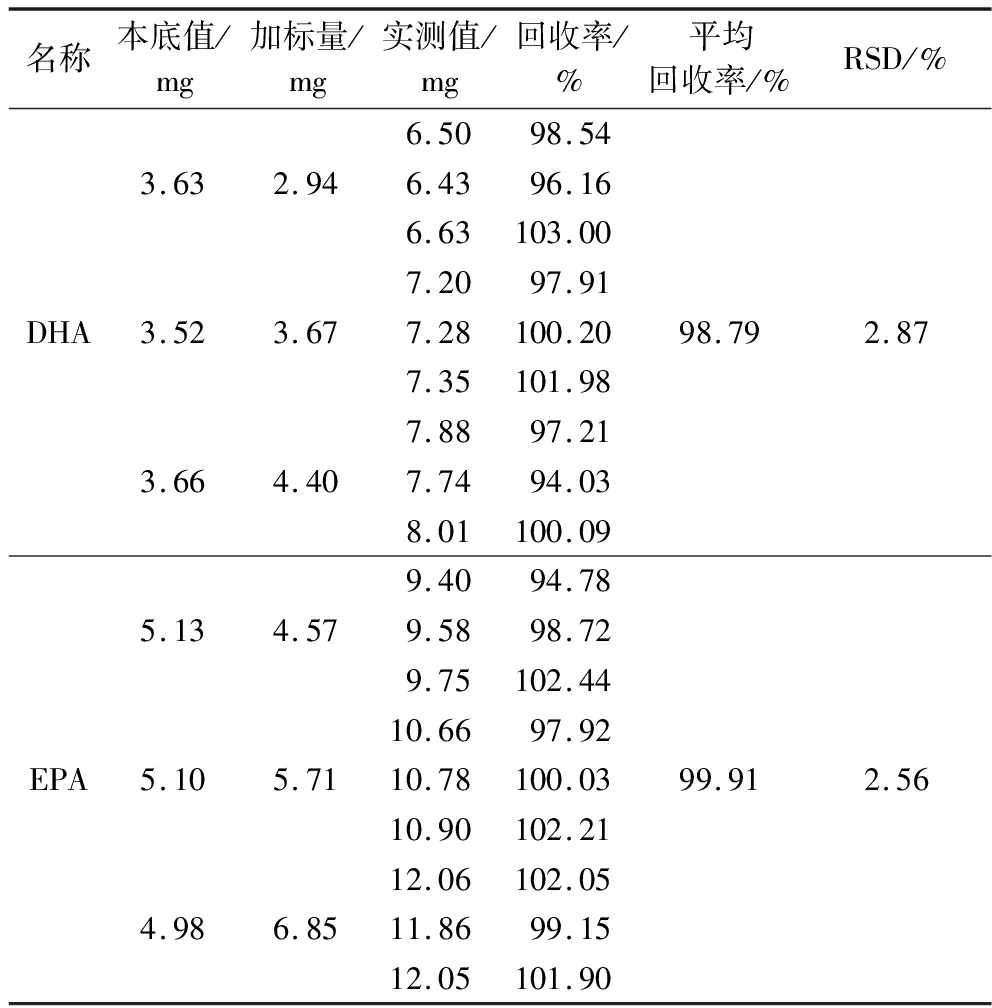
名称本底值/mg加标量/mg实测值/mg回收率/%平均回收率/%RSD/%DHA3.632.943.523.673.664.406.5098.546.4396.166.63103.007.2097.917.28100.207.35101.987.8897.217.7494.038.01100.0998.792.87EPA5.134.575.105.714.986.859.4094.789.5898.729.75102.4410.6697.9210.78100.0310.90102.2112.06102.0511.8699.1512.05101.9099.912.56
2.4.1.5 稳定性实验
在同一天内多次测定DHA和EPA的含量,RSD分别是1.58%和1.51%,表明样品溶液及仪器在24 h稳定性良好。
2.4.2 市售样品测定
10款市售鱼油及藻油保健品中DHA和EPA含量如表7所示。由结果可知,产品质量参差不齐,9款产品的实测值都达到或高于声称值,均未虚标,但也不乏有产品以次充好。其中鱼油样品FO6中EPA和DHA几乎未检出,但声称值却很高,可初步判断该样品为假鱼油样品。经过2.2节中PLS-DA模型预测为大豆油。由于大豆油和玉米油脂肪酸组成接近,区别在于大豆油中含有更高含量的亚麻酸,结合表2中FO6的脂肪酸组成,发现假鱼油样品符合GB/T 1535—2017《大豆油(含第1号修改单)》,因此可以确认该鱼油为大豆油假冒。我国大豆资源丰富,大豆油价格低廉,存在冒充鱼油销售的可能性。
表7 市售样品DHA和EPA的实测值与声称值对比 单位:g/100 g
Table 7 Comparison of actual and claimed values of DHA and EPA in samples
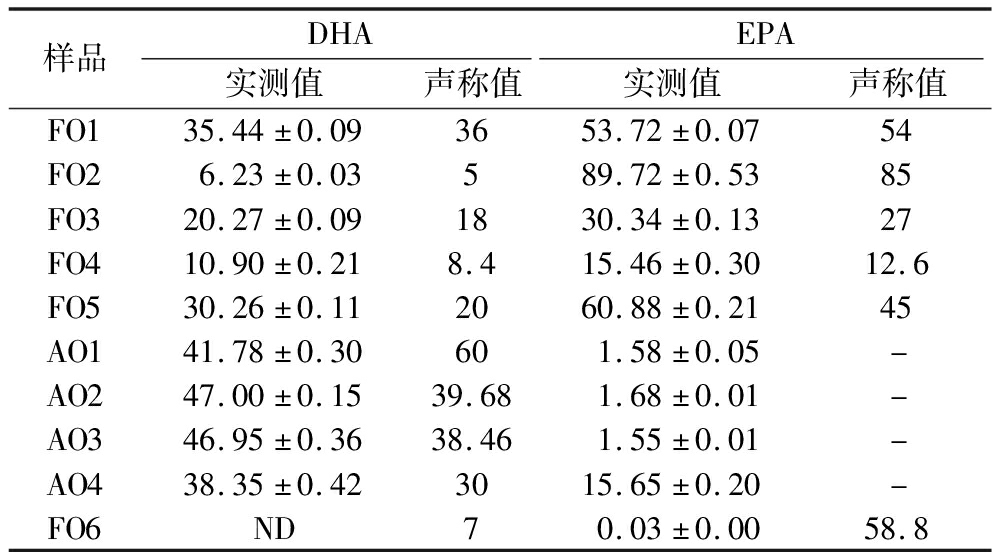
样品DHAEPA实测值声称值实测值声称值FO135.44±0.093653.72±0.0754FO26.23±0.03589.72±0.5385FO320.27±0.091830.34±0.1327FO410.90±0.218.415.46±0.3012.6FO530.26±0.112060.88±0.2145AO141.78±0.30601.58±0.05-AO247.00±0.1539.681.68±0.01-AO346.95±0.3638.461.55±0.01-AO438.35±0.423015.65±0.20-FO6ND70.03±0.0058.8
注:“-”表示未标明声称值。
3 结论
本研究采用气相色谱法结合多元统计分析系统地对鱼油、藻油和3种常见植物油脂中11种脂肪酸组成进行探究,结果表明PCA模型整体上可以将鱼油和藻油与其他植物油脂分开,但两者之间距离较近。OPLS-DA能够实现鱼油和藻油保健品的有效区分,模型可行且不存在过度拟合,能够实现鱼油和藻油保健品的真实性鉴别。经化学计量学分析获得了鱼油和藻油的关键特征组分DHA和EPA,对产品中的关键组分开展含量普查,测定结果稳定性好,重复性佳,发现市售保健品中存在用大豆油冒充鱼油的现象且对DHA和EPA含量存在标签虚假标注。本研究的相关内容为后期鱼油和藻油相关标准的建立提供技术手段和数据支撑,以期规范鱼油和藻油保健品市场,保障消费者的权益。
[1] LEAF A, ALBERT C M, JOSEPHSON M, et al.Prevention of fatal arrhythmias in high-risk subjects by fish oil n-3 fatty acid intake[J].Circulation.2005, 112(18):2762-2768.
[2] RAYMOND J, MORIN A, POITRAS M, et al.Short-term fish oil supplementation during adolescence supports sex-specific impact on adulthood visuospatial memory and cognitive flexibility[J].Nutrients, 2022, 14(17):3513.
[3] SANDERS T A B, HINDS A, PEREIRA C C.Influence of n-3 fatty acids on blood lipids in normal subjects[J].Journal of Internal Medicine, 1989, 731:99-104.
[4] RUBIO-RODR GUEZ N, BELTR
GUEZ N, BELTR N S, JAIME I, et al.Production of omega-3 polyunsaturated fatty acid concentrates:A review[J].Innovative Food Science &Emerging Technologies, 2010, 11(1):1-12.
N S, JAIME I, et al.Production of omega-3 polyunsaturated fatty acid concentrates:A review[J].Innovative Food Science &Emerging Technologies, 2010, 11(1):1-12.
[5] 鲁辉, 周璇, 钱叶飞, 等.保健食品中EPA和DHA含量测定方法研究[J].中国食品添加剂, 2015,26(4):190-194.LU H, ZHOU X, QIAN Y F, et al.Study on determination of EPA and DHA in health food[J].China Food Additives, 2015,26(4):190-194.
[6] 朱丽君, 王鲁霞, 武玲, 等.气相色谱内标法测定鱼油保健品中的EPA和DHA含量[J].中国油脂, 2019, 44(8):130-133.ZHU L J, WANG L X, WU L, et al.Determination of EPA and DHA contents in fish oil health products by gas chromatography internal standard method[J].China Oils and Fats,2019, 44(8):130-133.
[7] XING C R, YUAN X Y, WU X Y, et al.Chemometric classification and quantification of sesame oil adulterated with other vegetable oils based on fatty acids composition by gas chromatography[J].LWT, 2019, 108:437-445.
[8] WANG X R, HAN Y Z, LI Y X, et al.Detection of Qinghai-Tibet Plateau flaxseed oil adulteration based on fatty acid profiles and chemometrics[J].Food Control, 2021, 130:108332.
[9] 王琼芬, 刘婷, 张梦奇, 等.天然鱼肝油脂肪酸指纹图谱研究及掺假鉴定[J].食品安全质量检测学报, 2018, 9(22):5968-5974. WANG Q F, LIU T, ZHANG M Q, et al.Fatty acids fingerprint of natural cod-liver oil and its adulteration identification[J].Journal of Food Safety and Quality, 2018, 9(22):5968-5974.
[10] 汪学荣, 周玲, 吴青.三文鱼油超声波辅助提取工艺及脂肪酸组成分析[J].中国油脂, 2019, 44(2):23-26.WANG X R, ZHOU L, WU Q.Ultrasound-assisted extraction of Salmon oil and its fatty acid composition[J].China Oils and Fats, 2019, 44(2):23-26.
[11] 杨春英, 刘学铭, 陈智毅.15种食用植物油脂肪酸的气相色谱-质谱分析[J].食品科学, 2013, 34(6):211-214.YANG C Y, LIU X M, CHEN Z Y.Determination of fatty acid profiles in fifteen kinds of edible vegetable oil by gas chromatography-mass spectrometry[J].Food Science, 2013, 34(6):211-214.
[12] LI X H, KONG W, SHI W M, et al.A combination of chemometrics methods and GC-MS for the classification of edible vegetable oils[J].Chemometrics and Intelligent Laboratory Systems, 2016, 155:145-150.
[13] 曹蓉露, 陈小娥, 宋诗军, 等.基于脂肪酸组成特征的沙丁鱼油掺伪检测[J].核农学报, 2023, 37(2):338-345.CAO R L, CHEN X E, SONG S J, et al.Adulteration detection of sardine oil based on fatty acid composition characteristics[J].Journal of Nuclear Agricultural Sciences, 2023, 37(2):338-345.
[14] LINHARTOV Z, KREJSA J, ZAJ
Z, KREJSA J, ZAJ C T, et al.Proximate and fatty acid composition of 13 important freshwater fish species in central Europe[J].Aquaculture International, 2018, 26(2):695-711.
C T, et al.Proximate and fatty acid composition of 13 important freshwater fish species in central Europe[J].Aquaculture International, 2018, 26(2):695-711.
[15] SHIRAI N, TERAYAMA M, TAKEDA H.Effect of season on the fatty acid composition and free amino acid content of the sardine Sardinops melanostictus[J].Comparative Biochemistry and Physiology Part B:Biochemistry &Molecular Biology, 2002, 131(3):387-393.
[16] HAO S X, WEI Y, LI L H, et al.The effects of different extraction methods on composition and storage stability of sturgeon oil[J].Food Chemistry, 2015, 173:274-282.
[17] 王琼芬, 郑平安, 刘婷, 等.基于脂肪酸特征指标的鳕鱼肝油掺假鉴定[J].食品科学, 2019, 40(8):326-330.WANG Q F, ZHENG P A, LIU T, et al.Adulteration identification of cod liver oils based on characteristic fatty acids[J].Food Science, 2019, 40(8):326-330.
[18] 周欣, 张琳, 毛婵, 等.基于化学计量学方法结合正交偏最小二乘判别分析的陈皮饮片HPLC指纹图谱研究[J].中草药, 2019, 50(9):2194-2200.ZHOU X, ZHANG L, MAO C, et al.HPLC fingerprints research on decoction pieces of Citri Reticulatae Pericarpium based on chemometrics methods combined with orthogonal partial least square discriminate analysis[J].Chinese Traditional and Herbal Drugs, 2019, 50(9):2194-2200.
[19] 张九凯, 徐冰冰, 韩建勋, 等.基于脂质组学的沙棘油及其掺假油的甘油酯组成比较分析[J].中国食品学报, 2021, 21(11):144-158.ZHANG J K, XU B B, HAN J X, et al.Comparative analysis of the glyceride composition of sea buckthorn oil and its adulterated oil based on lipidomics[J].Journal of Chinese Institute of Food Science and Technology, 2021,21(11):144-158.
[20] SAINI R K, PRASAD P, SREEDHAR R V, et al.Omega-3 polyunsaturated fatty acids (PUFAs):Emerging plant and microbial sources, oxidative stability, bioavailability, and health benefits—A review[J].Antioxidants, 2021, 10(10):1627.
[21] LENIHAN-GEELS G, BISHOP K S, FERGUSON L R.Alternative sources of omega-3 fats:Can we find a sustainable substitute for fish?[J].Nutrients, 2013, 5(4):1301-1315.
[22] SHAHIDI F, AMBIGAIPALAN P.Omega-3 polyunsaturated fatty acids and their health benefits[J].Annual Review of Food Science and Technology, 2018, 9(1):345-381.
[23] YANG L, KUKSIS A, MYHER J.Lipolysis of menhaden oil triacylglycerols and the corresponding fatty acid alkyl esters by pancreatic lipase in vitro:A reexamination[J].Journal of Lipid Research, 1990, 31(1):137-147.
[24] IKEDA I, SASAKI E, YASUNAMI H, et al.Digestion and lymphatic transport of eicosapentaenoic and docosahexaenoic acids given in the form of triacylglycerol, free acid and ethyl ester in rats[J].Biochimica Et Biophysica Acta, 1995, 1259(3):297-304.
[25] YOSHII H, FURUTA T, SIGA H, et al.Autoxidation kinetic analysis of docosahexaenoic acid ethyl ester and docosahexaenoic triglyceride with oxygen sensor[J].Bioscience, Biotechnology, and Biochemistry, 2002, 66(4):749-753.
[26] 刘美娟, 苏昭仑, 何健, 等.再酯化甘油三酯型鱼油中不同结构油脂的含量研究[J].中国油脂:1-9.LIU M J, SU Z L, HE J, et al.Study on the contents of different structure oils in re-esterified triglyceride type fish oil[J].China Oils and Fats:1-9
[27] 刘美娟, 苏昭仑, 何健, 等.再酯化甘油三酯型鱼油中不同结构酯的含量及稳定性分析[J].中国油脂, 2024, 49(3):78-81.LIU M J, SU Z L, HE J, et al.Contents of different structure esters in re-esterified triglyceride type fish oil and its stability[J].China Oils and Fats, 2024, 49(3):78-81.