黑小麦是一类籽粒颜色呈紫色、蓝色、蓝紫色和紫黑色的特色麦类作物[1]。与普通小麦相比,黑小麦含有丰富的蛋白质、膳食纤维、不饱和脂肪酸和酚类化合物等营养物质和生物活性成分[2]。戊聚糖又称阿拉伯木聚糖,是黑小麦麸皮膳食纤维的主要组成成分[3],具有改善肠道菌群、降血糖、降血脂及增强免疫等生物活性[4-6]。根据溶解性的不同,可将戊聚糖分为水溶性戊聚糖(water extractable arabinoxylan, WEAX)和水不溶性戊聚糖(water unextractable arabinoxylan, WUAX),其中WUAX含量占70%~75%[7]。WUAX具有较强的吸水性和膨胀力,能够促进肠道蠕动、减少肥胖、防止便秘[8]。但其难以融合到食品中,在结肠中发酵能力较差,生物利用率低[9]。WEAX结构疏松,易于被肠道菌群利用,具有更优的降糖、降脂和抗氧化性等生理功能[10]。采用有效的改性方法处理麦麸,使WUAX溶解,改善其品质及生理功能,是黑小麦麸皮实现功能化的重要途径。
常见的膳食纤维物理改性方法如微波和挤压处理,已被证实可促进不溶性膳食纤维溶解,改善膳食纤维的理化性质和生理功能。吴丽萍等[11]探究了微波处理对燕麦麸皮膳食纤维结构和功能特性的影响,结果显示改性后膳食纤维呈现出复杂的网状结构,比表面积增大,其亚硝酸盐吸附能力和持油力和膨胀力均显著优于未改性膳食纤维。袁志宁等[12]研究发现,挤压处理后,柚皮可溶性膳食纤维的提取率提高,葡萄糖吸附能力和阳离子交换能力分别提高180.3%和70.5%,自由基清除能力显著增强,这可能与改性后膳食纤维的比表面积、微观结构和粒径大小等有关。通过物理方法破坏膳食纤维天然结构,结合酶处理,可帮助分子链展开,使功能基团暴露,提高酶对目标活性基团的水解效率。目前,采用物理-生物方法协同改性黑小麦麸皮膳食纤维以改善其生理功能的研究还少有报道。本研究采用微波、挤压结合木聚糖酶解,采用水法和碱法提取,促进WUAX溶解,分析改性方法对戊聚糖理化性质和功能活性的影响,以期为改善黑小麦戊聚糖的功能特性,推动黑小麦资源的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
黑小麦:运黑14207。
主要试剂:1,1-二苯基-2-三硝基苯肼、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐、木聚糖酶(EC 3.2.1.8酶活力≥50 000 U/mg),合肥博美生物科技有限责任公司;α-葡萄糖苷酶(100 U/mg)、耐高温α-淀粉酶(30 U/mg)、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside,PNPG)、邻苯二甲醛,美国Sigma公司;牛磺胆酸钠、甘氨胆酸钠、胆固醇,上海源叶生物科技有限公司;三氟乙酸,上海阿拉丁生化科技股份有限公司;氢氧化钡,天津市大茂化学试剂厂;三氯乙酸,南京化学试剂股份有限公司。
1.2 仪器与设备
DS32-II双螺杆挤压机,济南赛信机械有限公司;LW-20HMV-4X隧道式微波干燥杀菌设备,山东立威微波设备有限公司;ICS 1100离子色谱仪,美国DIONEX 公司;Waters 2690高效液相色谱仪,美国Waters公司;BIOTEK多功能酶标仪,美国BIOTEK公司;Hitachi S-4800扫描电镜,日本日立有限公司。
1.3 实验方法
1.3.1 原料预处理工艺
a)微波处理:取黑小麦麸皮,以输出功率40 kW,加热温度85 ℃,传送速度2 m/min对其进行热处理。
b)挤压膨化处理:采用双螺杆挤压膨化机,一区温度常温、二区温度60 ℃、三区温度130 ℃,主机频率26.40 Hz,喂料频率10.80 Hz,旋切频率60 Hz对原料进行处理。
c)酶解:向麸皮中加入5%(质量分数)木聚糖酶,加蒸馏水进行活化。
1.3.2 戊聚糖提取工艺
取未处理和经微波-挤压处理的黑小麦麸皮,按料液比1∶7(g∶mL),加入70%(体积分数)的乙醇,70 ℃下处理2 h,抽滤并晾干。参照田玉荣[10]的方法,提取戊聚糖。
a)水法提取戊聚糖:取上述黑小麦麸皮,按照料液比1∶10(g∶mL),加入蒸馏水,40 ℃下搅拌1 h,离心(5 000 r/min,15 min),收集上清液(沉淀用于后续碱提),浓缩后加4倍体积95%(体积分数)乙醇沉淀,沉淀物加水复溶,透析48 h,冷冻干燥,即得水溶性戊聚糖(WEAX)、微波-挤压水溶性戊聚糖(ME-WEAX)。
b)碱法提取戊聚糖:取a)中水提后沉淀,1∶10(g∶mL)加入饱和Ba(OH)2溶液,常温浸提2 h,离心(沉淀再次加碱浸提),调节上清液pH值至5.5,适度浓缩后醇沉,沉淀物加水复溶,透析,冷冻干燥,得碱溶性戊聚糖(WUAX)、微波-挤压碱溶性戊聚糖(ME-WUAX)。
c)酶解水提制备戊聚糖:取经微波-挤压处理后的麸皮,以1∶10(g∶mL)料液比加水混匀,加入木聚糖酶,40 ℃水浴1 h,反应结束后100 ℃加热5 min灭酶,离心取上清液(沉淀用于后续碱提),浓缩,乙醇沉淀,透析,冷冻干燥得微波-挤压-酶解水提戊聚糖(MEE-WEAX)。
d)酶解碱提制备戊聚糖:取c)中水提后沉淀,同2)中碱提法制备得到微波-挤压-酶解碱溶性戊聚糖(MEE-WUAX)。
1.3.3 单糖组成分析
称取戊聚糖样品3 mg,加入2 mL 2 mol/L 三氟乙酸,121 ℃水解1 h,除去过量的三氟乙酸,进样ICS 1100 型离子色谱仪,分析其单糖组成。检测条件:Carbopac PA 20色谱柱,检测器为电化学检测器,柱温30 ℃,流速为0.4 mL/min,10 mmol/L KOH进行横梯度洗脱,进样体积25 μL。
1.3.4 相对分子质量分析
采用Waters 2690 型高效色谱仪检测戊聚糖的相对分子质量。检测条件:检测器为示差折光检测器,色谱柱为Ultrahydrogel TMLinear(7.8 mm×300 mm,5 μm),流动相为0.1 mol/L NaNO3,流速0.9 mL/min,柱温45 ℃,进样量20 μL[10]。
1.3.5 扫描电镜(scanning electron microscope,SEM)分析
取少量干燥的戊聚糖样品,固定在导电胶上,真空条件下镀金,设置扫描电压为1.0 kV,对样品放大2 000倍下的表面形态进行观察。
1.3.6 黑小麦麸皮戊聚糖理化性质的测定
1.3.6.1 溶解度测定
称取0.1 g戊聚糖样品,加入10 mL蒸馏水,75 ℃ 水浴1 h,离心,将沉淀烘干至恒重[13],溶解度按公式(1)计算:
溶解性![]()
(1)
式中:m0,样品干重,g;m1,干燥后沉淀物的质量,g。
1.3.6.2 持水力和持油力测定
取0.1 g样品与2.5 mL蒸馏水或食用油混合,37 ℃下水浴30 min,离心,除去未吸附的水或油,记录残留物质量,持水力和持油力计算如公式(2)所示:
持水力、持油力![]()
(2)
式中:m1,样品质量,g;m2,残留物质量,g。
1.3.6.3 亚硝酸根离子吸附能力
参照吴丽萍等[11]的方法绘制亚硝酸钠含量标准曲线。取2份0.5 g戊聚糖样品,加入50 mL 100 μmol/L亚硝酸钠溶液,分别调节pH值至2.0和7.0,37 ℃下水浴振荡2 h,离心,测定上清液中亚硝酸盐含量,亚硝酸根离子吸附能力计算如公式(3)所示:
亚硝酸根离子吸附能力![]()
(3)
式中:m,戊聚糖样品质量,g;m0,吸附前亚硝酸钠质量,μg;m1,吸附后亚硝酸钠质量,μg。
1.3.7 黑小麦麸皮戊聚糖体外抗氧化活性测定
参照温启华等[14]的方法测定戊聚糖组分的DPPH自由基清除率。取2.0 mL样品溶液于试管中,加入2.0 mL 0.2 mmol/L DPPH-无水乙醇溶液,避光反应30 min后测定OD517nm值,计算如公式(4)所示:
DPPH自由基清除率![]()
(4)
式中:A1,样品组吸光度值;A2,无水乙醇代替DPPH-无水乙醇溶液的背景吸收值;A0,无水乙醇代替样品溶液的空白对照组吸光度值。
参照谢佳函等[15]的方法测定ABTS阳离子自由基清除率。参照LEE等[16]的方法测定羟自由基清除率。参照陈薛[17]的方法测定戊聚糖的总还原能力。
1.3.8 体外降血糖活性测定
1.3.8.1 α-葡萄糖苷酶抑制率测定
参照ZHENG等[18]的方法,取样品溶液,加入1 U/mL α-葡萄糖苷酶,37 ℃孵育5 min,加入10 mmol/L PNPG,37 ℃下孵育30 min,加入0.2 mol/L Na2CO3溶液。以阿卡波糖作阳性对照,在405 nm处测定吸光度值,计算如公式(5)所示:
α-葡萄糖苷酶抑制率![]()
(5)
式中:A1,样品和酶反应后的吸光度值;A2,只加样品反应后的吸光度值;A3,只加酶和底物反应后的吸光度值;A4,只加入底物反应后的吸光度值。
1.3.8.2 α-淀粉酶抑制率测定
参照SUN等[19]的方法,将1 U/mL α-淀粉酶溶液在37 ℃下与样品溶液预混合10 min,加入10 mg/mL可溶性淀粉溶液,37 ℃反应10 min,加入二硝基水杨酸试剂,沸水浴5 min,冷却后,用蒸馏水稀释,以阿卡波糖为阳性对照,于540 nm处测量吸光度,计算如公式(6)所示:
α-淀粉酶抑制率![]()
(6)
式中:A1,样品和酶反应后的吸光度值;A2,只加样品反应后的吸光度值;A3,只加酶和底物反应后的吸光度值;A4,只加入底物反应后的吸光度值。
1.3.8.3 葡萄糖吸附能力测定
参照WANG等[20]的方法,配制不同浓度葡萄糖溶液,取0.05 g样品,加入1 mL葡萄糖溶液,37 ℃下振荡2 h后,离心,按照DNS法测定上清液葡萄糖浓度。
1.3.9 体外降血脂活性测定
1.3.9.1 胆酸盐吸附能力测定
参考于美汇等[21]的方法,绘制胆酸盐含量标准曲线。参照段振[22]的方法测定戊聚糖的胆酸盐吸附能力。
1.3.9.2 胆固醇吸附能力测定
参照王大为等[23]的方法,测定戊聚糖的胆固醇吸附能力。
1.4 数据处理
所有实验重复3次,结果表示为“平均值±标准差”,运用SPSS 25.0软件进行显著性分析,采用Origin 8.6软件绘图。
2 结果与分析
2.1 单糖组成分析
各戊聚糖组分单糖组成结果如图1所示。由图1可以看出,不同戊聚糖组分均主要由阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、葡萄糖(glucose,Glc)和半乳糖(galactose,Gal)组成,碱提戊聚糖组分的Ara和Xyl含量总体高于水提组分。改性后戊聚糖的Glc质量分数升高,Ara和Xyl质量分数有所降低。
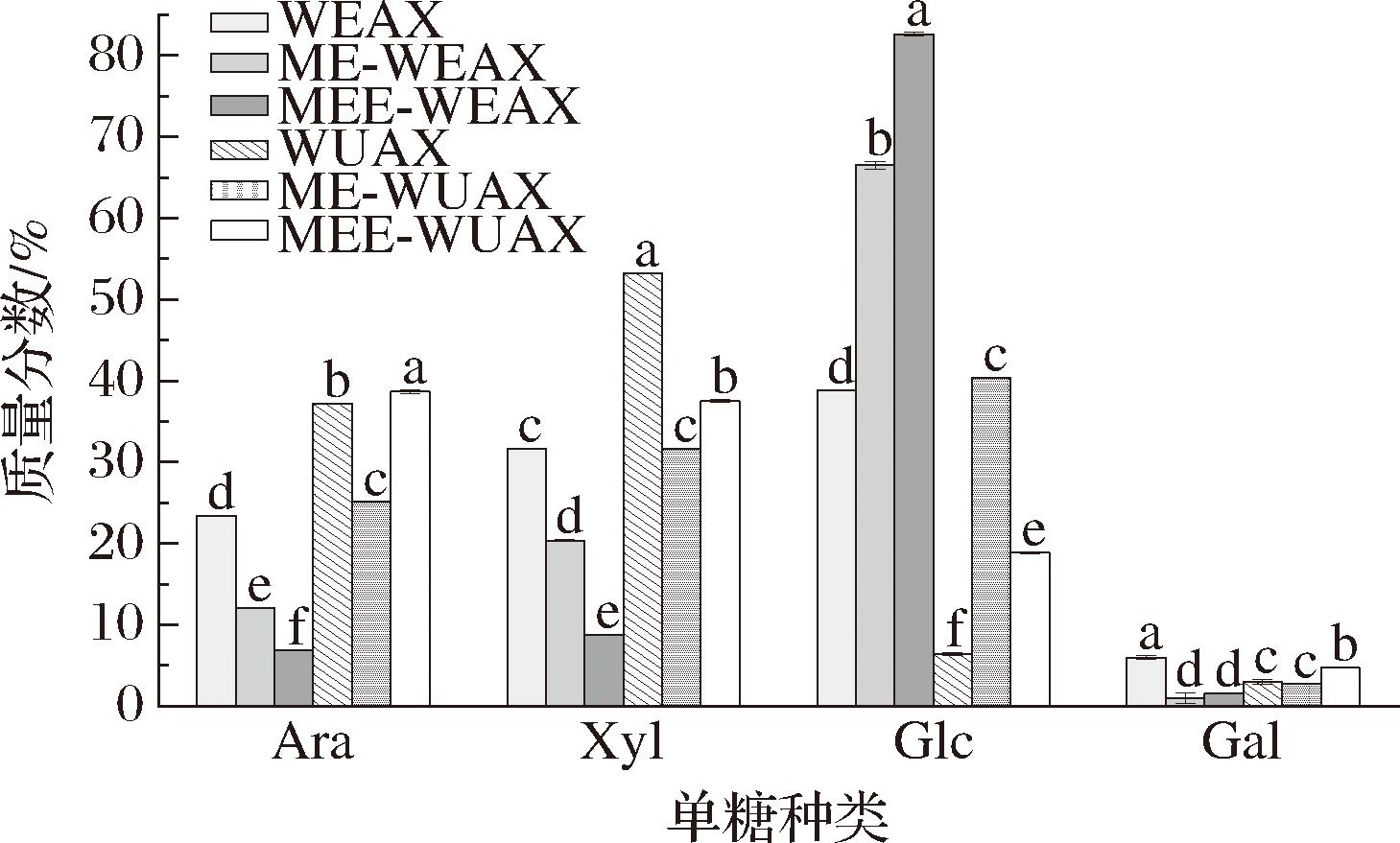
图1 不同戊聚糖组分的单糖组成
Fig.1 Monosaccharide composition of different pentosan fractions
注:图中组内不同字母表示显著性差异(P<0.05)(下同)。
2.2 相对分子质量分析
戊聚糖组分的相对分子质量分布如图2所示。WEAX相对分子质量由6.72×105和2.93×103两部分组成,所占比例分别为70.53%和29.47%;WUAX由相对分子质量为8.80×105和2.41×103两部分组成,分别占77.72%和22.28%。与WEAX相比,ME-WEAX和MEE-WEAX的Mw分布较均一,相对分子质量大幅下降,分别为3.17×105和2.50×105。MEE-WUAX由Mw为2.62×105和4.82×103两部分组成,分别占比81.08%和18.92%;ME-WUAX的相对分子质量主要集中在3.15×105。结果表明,改性处理促使高Mw戊聚糖组分中部分糖苷键发生断裂,降解为低Mw组分,且经微波-挤压-酶解后,戊聚糖相对分子质量下降程度更高。
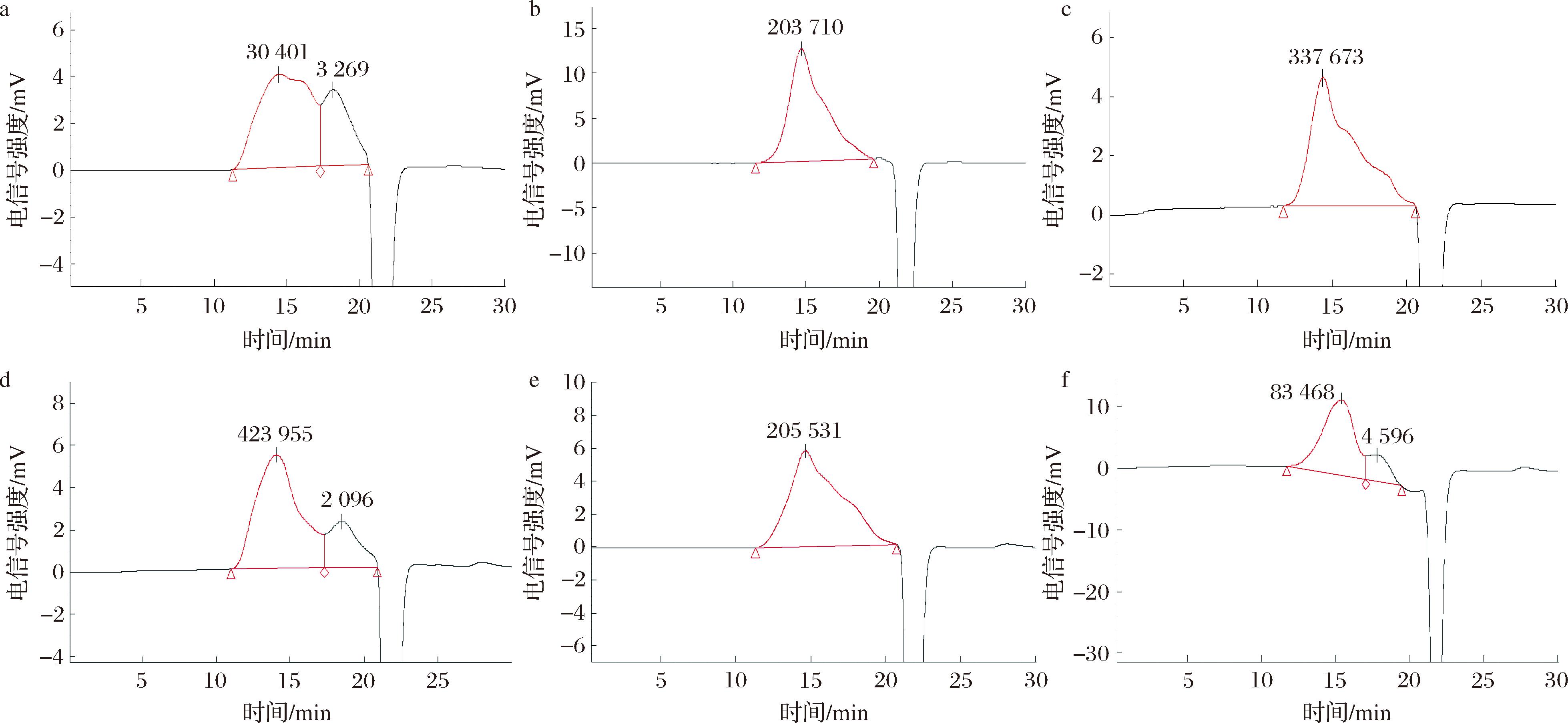
a-WEAX;b-ME-WEAX;c-MEE-WEAX;d-WUAX;e-ME-WUAX;f-MEE-WUAX
图2 不同改性方法下黑小麦麸皮戊聚糖的相对分子质量分布
Fig.2 Relative molecular mass of pentosan from black wheat bran under different modification methods
2.3 扫描电镜分析
改性前后戊聚糖组分的微观结构如图3所示。图3-a和图3-b显示,WEAX和WUAX组分呈现为形状不规整的片状结构,表面光滑平整,结构较为致密。经微波-挤压处理后,戊聚糖表面粗糙,有孔洞产生,出现颗粒状或碎片化改变。酶解后戊聚糖表面更加松散、粗糙。

a-WEAX;b-ME-WEAX;c-MEE-WEAX;d-WUAX;e-ME-WUAX;f-MEE-WUAX
图3 改性前后黑小麦麸皮戊聚糖SEM图(2 000×)
Fig.3 SEM image of pentosan in black wheat bran before and after modification (2 000×)
MEE-WEAX表面颗粒化明显,出现大量的孔洞,呈蜂窝状。MEE-WUAX表现为更细碎的片状,表面凹凸不平,有裂痕和沟壑出现。
2.4 不同改性方法下黑小麦麸皮戊聚糖的理化性质
2.4.1 溶解性、持水力和持油力分析
各戊聚糖组分的溶解性、持水力和持油力如表1所示。在微波和挤压处理的高压和高剪切力作用下,戊聚糖分子中糖苷键断裂,大分子物质降解为小分子,同时增加亲水基团的暴露,促进戊聚糖的溶解。结果显示,水提戊聚糖组分的持水力优于碱提组分,碱提戊聚糖组分表现出更强的持油效果,这与张慧娟等[3]的研究结果相符。改性后,戊聚糖组分的持水力和持油力显著增强(P<0.05)。经微波-挤压-酶解后,水提戊聚糖组分的持水力由(4.04±0.10) g/g提高为(4.51±0.12) g/g,持油力达到(12.37±0.26) g/g;碱提组分的持水力由(2.32±0.17) g/g提高到(3.35±0.11) g/g,持油力为(16.40±0.13) g/g。这可能是因为,微波-挤压处理使戊聚糖表面更加疏松,毛细孔数量更多,有利于水分和油的渗入。此外,酶解处理可以降低分子中半纤维素的聚合度,暴露出更多活性基团,增强戊聚糖对水分和油的截留作用[24]。
表1 改性前后黑小麦麸皮戊聚糖的溶解性、持水力和持油力
Table 1 Solubility, water holding capacity and oil holding capacity of pentosan before and after modification of black wheat bran
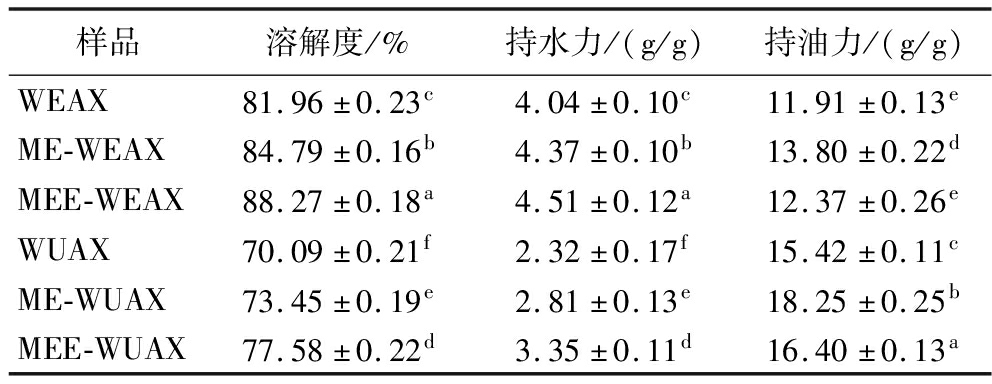
样品溶解度/%持水力/(g/g)持油力/(g/g)WEAX81.96±0.23c4.04±0.10c11.91±0.13eME-WEAX84.79±0.16b4.37±0.10b13.80±0.22dMEE-WEAX88.27±0.18a4.51±0.12a12.37±0.26eWUAX70.09±0.21f2.32±0.17f15.42±0.11cME-WUAX73.45±0.19e2.81±0.13e18.25±0.25bMEE-WUAX77.58±0.22d3.35±0.11d16.40±0.13a
注:同列数据不同字母代表差异显著(P<0.05)。
2.4.2 亚硝酸根离子吸附能力
膳食纤维对亚硝酸根离子的吸附作用分为物理吸附和化学吸附,分别通过其疏松的表面结构和分子中的酚酸基团实现[25]。由图4可知,改性后,戊聚糖组分的吸附能力显著提升(P<0.05)。SEM结果显示,改性后戊聚糖的结构更加疏松,比表面积增大,孔隙率更高,这有利于其对亚硝酸根离子的物理吸附。吸附能力还受到体系pH值的影响,pH值为2时,吸附效果更优,此时MEE-WEAX和MEE-WUAX组分的吸附量最高,达到(267.26±1.44)、(320.70±0.95) μg/g。这可能是因为戊聚糖分子中阿魏酸的酚酸基团在酸性条件下与![]() 结合,从而发挥吸附作用[11]。中性环境下,阿魏酸的羧基发生降解,导致对亚硝酸根离子的吸附能力减弱[26]。
结合,从而发挥吸附作用[11]。中性环境下,阿魏酸的羧基发生降解,导致对亚硝酸根离子的吸附能力减弱[26]。
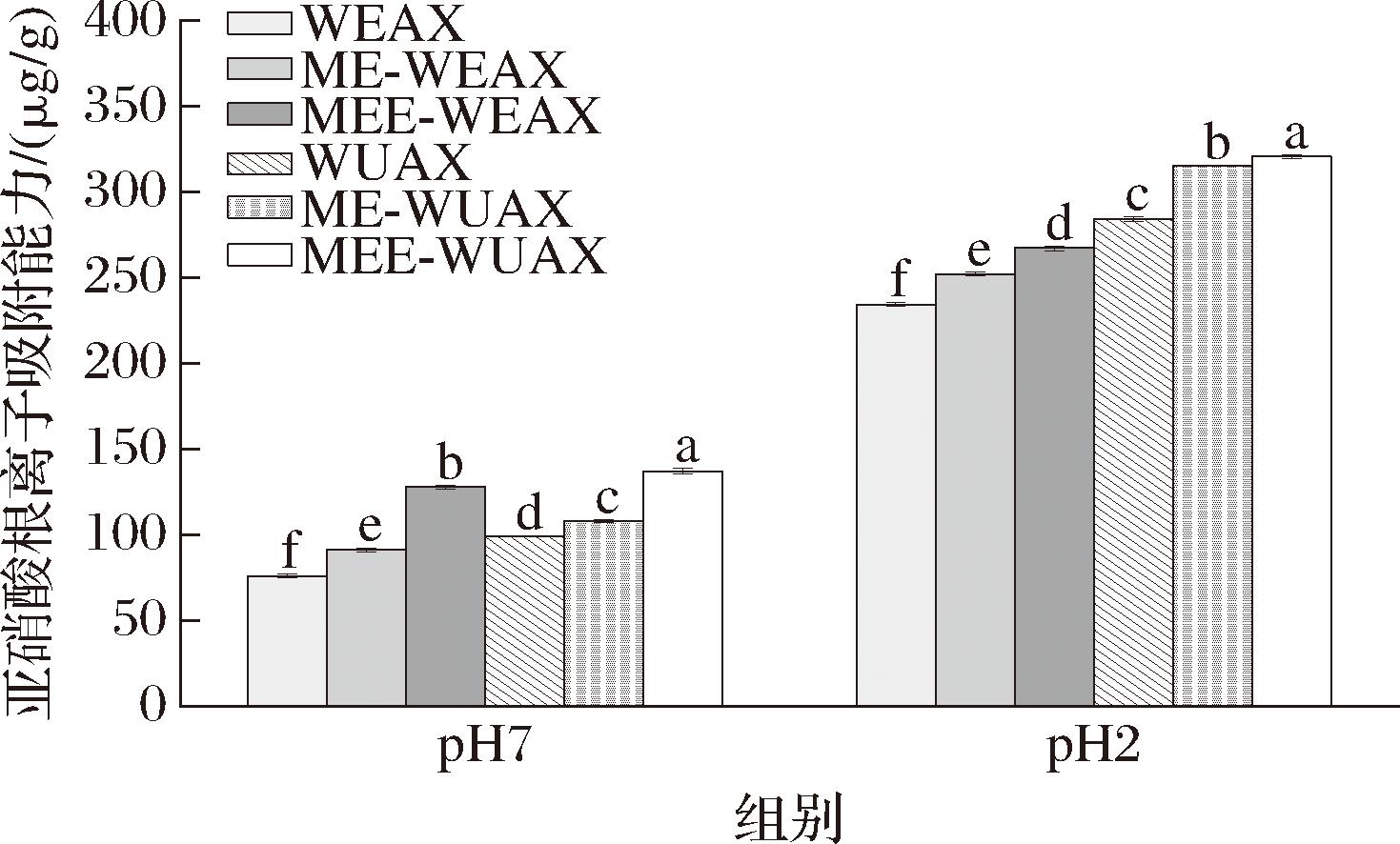
图4 不同改性方法下黑小麦麸皮戊聚糖的亚硝酸根离子吸附能力
Fig.4 Nitrite ion adsorption capacity of pentosan from black wheat bran under different modification methods
2.5 不同改性方法下黑小麦麸皮戊聚糖的体外抗氧化活性
各戊聚糖组分的抗氧化结果如图5所示。在质量浓度为0.5~3 mg/mL,戊聚糖的ABTS阳离子自由基和DPPH自由基清除能力随着浓度增加而显著增强(P<0.05)。当质量浓度为3 mg/mL时,ME-WEAX和MEE-WUAX的ABTS阳离子自由基清除率最高,为(82.69±1.53)%和(98.91±0.42)%;MEE-WEAX和MEE-WUAX的DPPH自由基清除率分别为(81.34±0.55)%和(88.55±0.54)%。结果显示,同一质量浓度下碱提组分的自由基清除效果显著优于水提组分(P<0.05)。改性后戊聚糖的抗氧化能力显著增强,这可能是因为微波和挤压协同处理使戊聚糖的结构变得疏松多孔,比表面积增大,对物理处理后的麸皮进行酶解,戊聚糖粒径减小,暴露出更多供氢体或电子供体,其抗氧化能力进一步增强[24]。
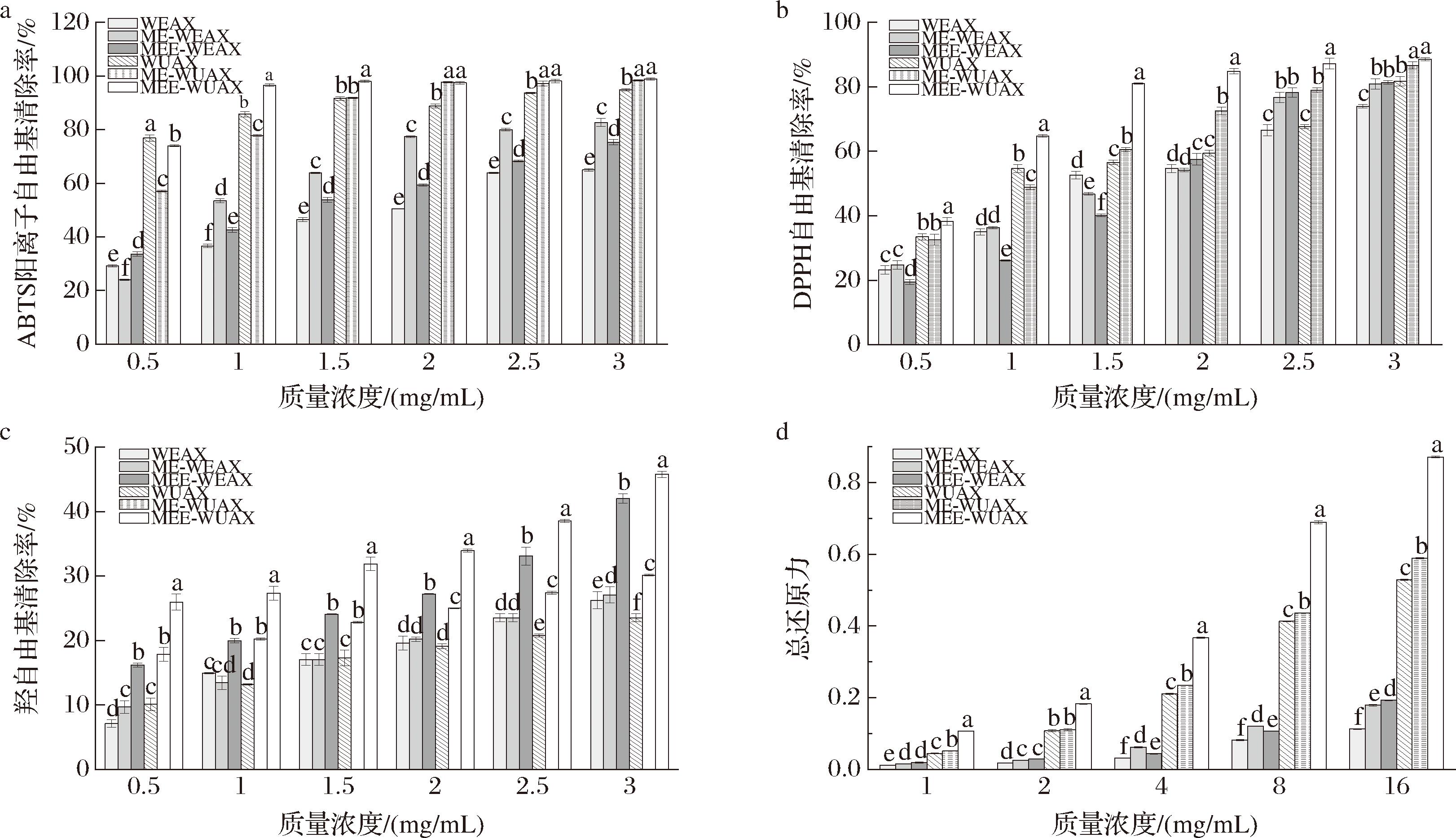
a-ABTS阳离子自由基清除率;b-DPPH自由基清除率;c-羟自由基清除率;d-总还原能力
图5 不同改性方法下黑小麦麸皮戊聚糖的抗氧化活性
Fig.5 Antioxidant activity of pentosan from black wheat bran under different modification methods
当质量浓度为3 mg/mL时,MEE-WEAX、ME-WUAX和MEE-WUAX的羟自由基清除率达到(42.01±0.75)%、(30.12±0.14)%和(45.78±0.49)%,分别较未处理组分提高了60%、28%和95%,而ME-WEAX的清除率只略高于WEAX,这表明微波-挤压-酶解对羟自由基清除能力的提升效果更好。
总还原能力整体上MEE-WUAX>ME-WUAX>WUAX>MEE-WEAX>ME-WEAX>WEAX。当样品质量浓度为16 mg/mL时,经微波-挤压-酶解后,水提戊聚糖组分的总还原能力由0.113±0.001提高为0.193±0.001;碱提组分的总还原能力由0.529±0.002提高到0.871±0.002。总还原力的强弱与还原糖含量高低有关,还原糖含量越高,则总还原能力越强,这与上述单糖组成的结果相符。
2.6 不同改性方法下黑小麦麸皮戊聚糖的体外降血糖活性
不同戊聚糖组分的体外降血糖活性如图6所示。α-葡萄糖苷酶抑制作用与膳食纤维的相对分子质量有关,低分子质量的样品会增加与酶活性位点的接触,从而提高抑制率[27]。改性处理使戊聚糖的α-葡萄糖苷酶抑制率有所增强,且微波-挤压酶解处理提升效果更优,这可能与改性后戊聚糖相对分子质量的降低有关。当质量浓度为16 mg/mL时,MEE-WEAX和MEE-WUAX的α-葡萄糖苷酶抑制率最高,分别为(46.01±1.37)%和(62.16±1.60)%,较未处理组分提高了26%和69%。
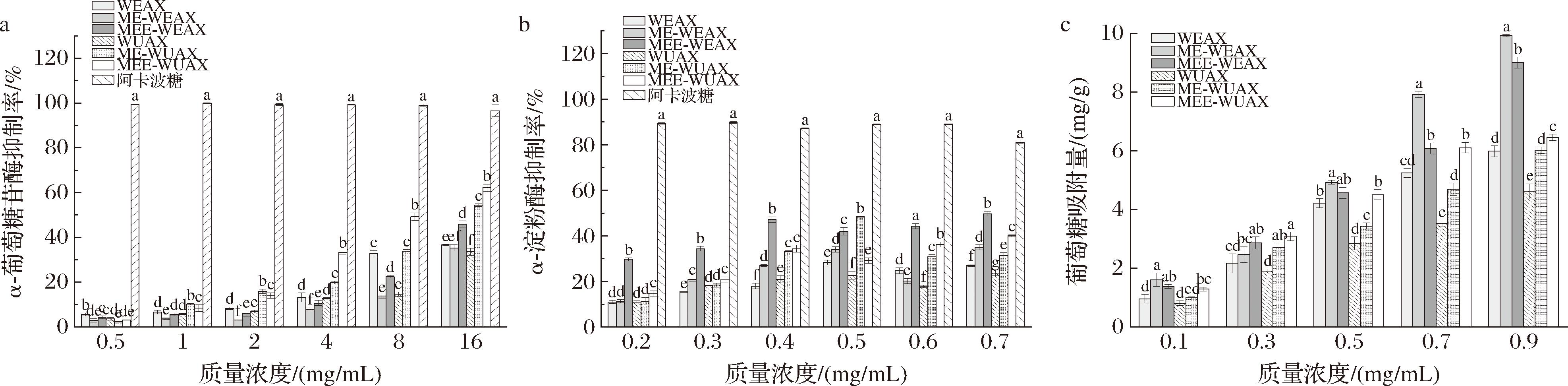
a-α-葡萄糖苷酶抑制率;b-α-淀粉酶抑制率;c-葡萄糖吸附量
图6 不同改性方法下黑小麦麸皮戊聚糖的体外降血糖活性
Fig.6 Hypoglycemic activity in vitro of pentosan from black wheat bran under different modification methods
膳食纤维对α-淀粉酶活性的抑制作用,主要通过其对淀粉和酶的包裹作用和对酶的直接吸附作用,从而减少酶和底物的结合,抑制酶的活性[25]。由图6-b可以看出,戊聚糖对α-淀粉酶的抑制率随质量浓度的增加呈现起伏的变化趋势,均显著低于阿卡波糖(P<0.05),与未处理组分相比,2种改性方法均能显著增强戊聚糖的α-淀粉酶的抑制能力。改性后的戊聚糖表面结构更粗糙,疏松多孔的结构能够吸附并固定更多的酶和淀粉,使对酶的抑制作用增强。当质量浓度为0.7 mg/mL时,MEE-WEAX的抑制率最高为(49.77±1.06)%;质量浓度为0.5 mg/mL时,ME-WUAX的抑制率最高,为(48.43±0.18)%。
如图6-c所示,戊聚糖组分的葡萄糖吸附能力随葡萄糖浓度的增加而增强,且水提戊聚糖组分的吸附能力更强(P<0.05)。葡萄糖质量浓度为0.9 mg/mL时,ME-WEAX和MEE-WUAX的吸附量最高达到(9.93±0.04) mg/g和(6.46±0.11) mg/g,均显著高于相应未处理组分。吸附能力的增强可能是由于改性后戊聚糖的粒度减小,功能基团暴露,从而增加了与葡萄糖的接触面积,且改性后样品疏松多孔的结构也有利于葡萄糖分子的嵌入[28]。
2.7 不同改性方法下黑小麦麸皮戊聚糖的体外降血脂活性
2.7.1 胆酸盐吸附能力分析
各戊聚糖组分对胆酸盐的结合能力如图7所示。戊聚糖对牛磺胆酸钠的吸附作用更为显著,这可能是因为牛磺胆酸钠磺酸基的酸性强于甘氨胆酸钠中的羧基,更易离子化,增强了与膳食纤维之间的结合力[29]。戊聚糖对2种胆酸盐的吸附能力均随着样品质量的增加而增强,改性处理使戊聚糖的吸附能力得到不同程度的提升。微波-挤压改性后戊聚糖分子中的糖苷键断裂,小分子化学物质急剧挥发,促使微孔隙形成,戊聚糖比表面积增大,增加了戊聚糖与胆酸盐的结合位点,从而增强了对胆酸盐的吸附作用[30]。经过酶解后,碱提戊聚糖组分的吸附能力降低,可能是由于酶解后戊聚糖组分的粒径进一步减小,削弱了戊聚糖对胆酸盐的束缚。当样品质量为60 mg时,MEE-WEAX和ME-WUAX的牛磺胆酸钠吸附率分别为(65.62±0.23)%和(45.81±0.50)%,是相应未处理组分的2.08倍和1.01倍;相同条件下,其对甘氨胆酸钠吸附率分别为(49.73±0.64)%和(43.69±0.45)%,是未处理组分的1.84倍和1.05倍。
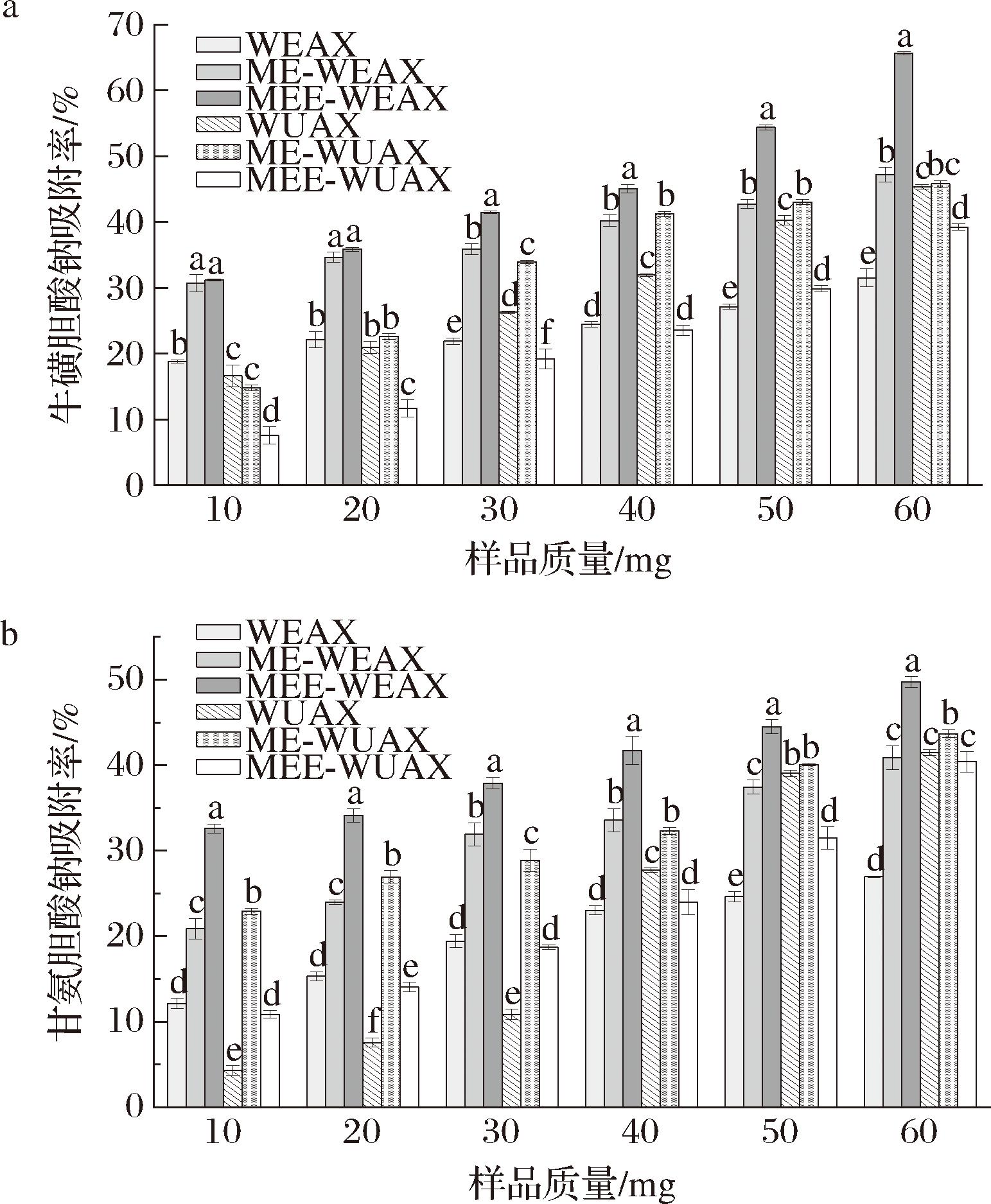
a-牛磺胆酸钠吸附率;b-甘氨胆酸钠吸附率
图7 不同改性方法下黑小麦麸皮戊聚糖的胆酸盐结合能力
Fig.7 Cholate binding capacity of pentosan from black wheat bran under different modification methods
2.7.2 胆固醇结合能力分析
由图8可知,pH值为7时,戊聚糖组分的胆固醇结合效果更好,这可能是因为酸性环境中戊聚糖与胆固醇分子均携带部分正电荷,两者产生排斥作用力,导致胆固醇结合能力降低[31]。与未处理组分相比,经微波-挤压后,戊聚糖组分的胆固醇吸附能力显著增强(P<0.05),pH值为7时,ME-WEAX的胆固醇结合能力达到(25.51±0.30) mg/g,是相应pH下未处理组分的1.53倍;ME-WUAX的吸附能力为(13.61±0.10) mg/g。经物理改性后戊聚糖结构更加疏松多孔,暴露出更多与胆汁酸中羟基结合的活性位点,胆固醇吸附能力增强[32],对经物理方法处理后的戊聚糖进一步酶解,其对胆固醇的吸附率有所降低,这可能是因为过量的酶会破坏膳食纤维的三维网络结构,导致胆固醇结合能力下降[24]。
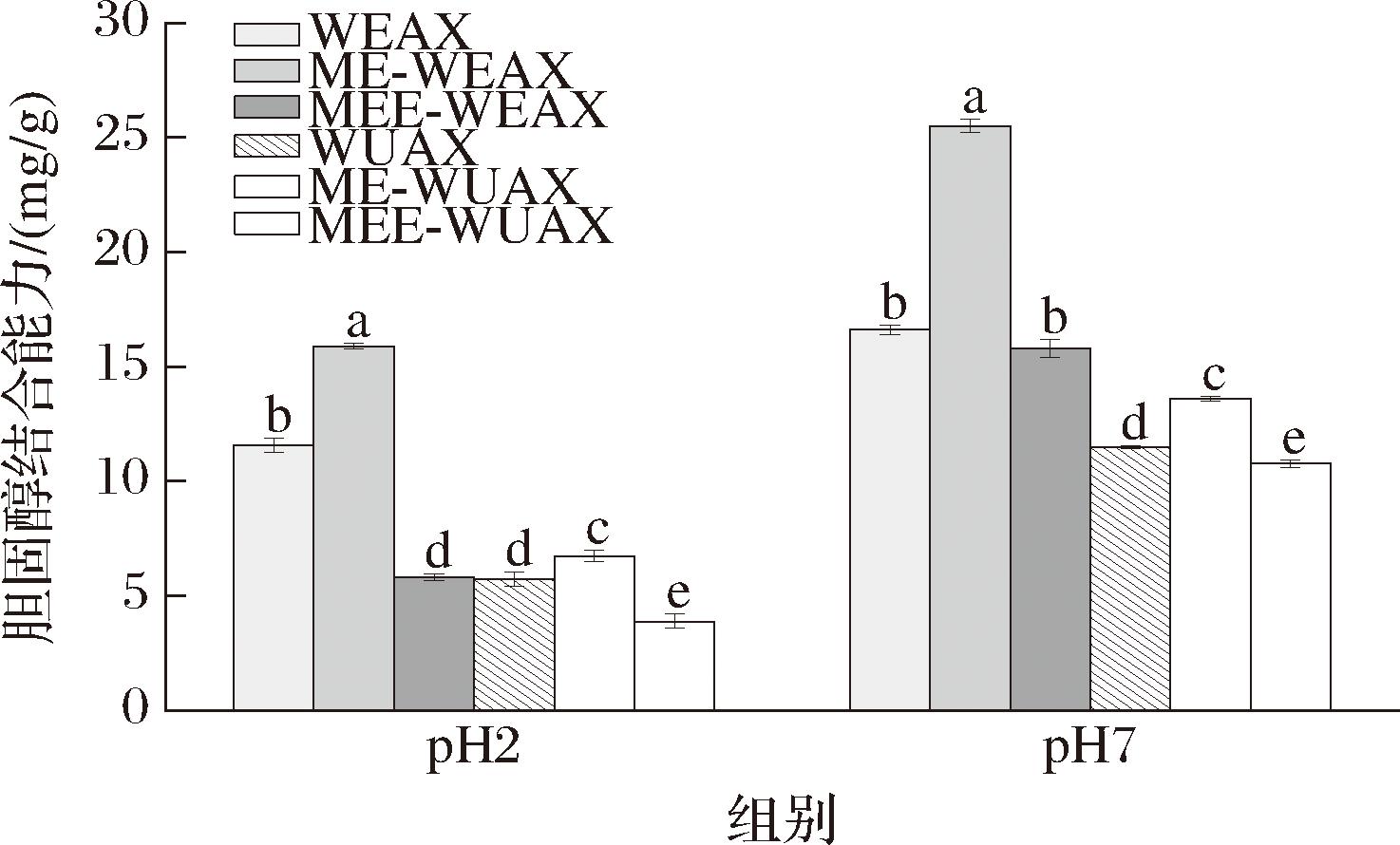
图8 不同改性方法下黑小麦麸皮戊聚糖的胆固醇结合能力
Fig.8 Cholesterol binding ability of pentosan from black wheat bran under different modification methods
3 结论
单糖组成结果显示,戊聚糖组分均主要由Ara、Xyl、Glc以及微量Gal组成。改性后戊聚糖组分相对分子质量降低,微观结构发生变化,结构疏松多孔,表面粗糙,其理化性质和功能特性也随之改变。改性后戊聚糖的持水力、持油力和亚硝酸根离子吸附能力显著增强,体外功能活性得到显著改善。MEE-WUAX的抗氧化能力最强,其总还原力高达0.871±0.002,是未处理组分的1.65倍;ABTS阳离子自由基清除率最高为(98.91±0.42)%;羟自由基清除率为(45.78±0.49)%,较未处理组分提高了95%。体外降血糖结果显示,MEE-WUAX的α-葡萄糖苷酶抑制率最高为(62.16±1.60)%,MEE-WEAX的α-淀粉酶抑制能力最强为(49.77±1.06)%。此外,MEE-WEAX对2种胆酸盐的吸附能力最强。改性后,戊聚糖的理化性质和功能活性得到不同程度改善,微波-挤压-酶解处理对戊聚糖性质的影响更为显著。本文探究了改性方法对戊聚糖理化性质和体外功能活性的影响,未来将进一步探索不同戊聚糖组分的体内益生活性,以期为黑小麦功能性食品研发提供参考,推动麸皮资源的利用。
[1] 裴自友, 孙玉, 孙善澄, 等.中国黑小麦研究利用现状[J].种子, 2002, 21(4):42-44.PEI Z Y, SUN Y, SUN S C, et al.Besearch progress of Chinese black wheat[J].Seed, 2002, 21(4):42-44.
[2] 李帮秀, 宗学凤, 张建奎.黑粒小麦的营养特性研究[J].西南农业大学学报(自然科学版), 2004, 26(6):753-755.LI B X, ZONG X F, ZHANG J K, et al.Study on nutritional characters of whent genotypes with different grain color[J].Journal of Southwest Agricultural University (Natural Science Edition), 2004, 26(6):753-755.
[3] 张慧娟, 靳程茗, 吕世豪, 等.黑麦麸膳食纤维的结构和功能特性研究[J].中国食品学报, 2023, 23(8):84-93.ZHANG H J, JIN C M, LYU S H, et al.Studies on structure and functional characteristics of dietary fiber from rye bran[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(8):84-93.
[4] 张茜, 赵鑫, 成锦华, 等.基于核磁共振氢谱代谢组学研究阿拉伯木聚糖及其复合多糖对高脂饮食诱导肥胖小鼠粪便代谢物的影响[J].食品科学, 2023, 44(19):140-147.ZHANG Q, ZHAO X, CHENG J H, et al.Proton nuclear magnetic resonance spectroscopy (1H-NMR)-based metabolomic analysis effects of arabinoxylan and its mixture with β-glucan on fecal metabolites in high-fat diet-induced obese mice[J].Food Science, 2023, 44(19):140-147.
[5] NIE Q X, HU J L, CHEN H H,et al.Arabinoxylan ameliorates type 2 diabetes by regulating the gut microbiota and metabolites[J].Food Chemistry, 2022, 371:131106.
[6] CAO L, LIU X Z, QIAN T X, et al.Antitumor and immunomodulatory activity of arabinoxylans:A major constituent of wheat bran[J].International Journal of Biological Macromolecules, 2011, 48(1):160-164.
[7] 李凡, 李言, 钱海峰, 等.阿拉伯木聚糖提取及其对面团性质影响研究进展[J].中国粮油学报, 2022, 37(6):194-202.LI F, LI Y, QIAN H F, et al.Research progress on extraction of arabinoxylan and its effects on dough[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(6):194-202.
[8] ELLEUCH M, BEDIGIAN D, ROISEUX O, et al.Dietary fibre and fibre-rich by-products of food processing:Characterisation, technological functionality and commercial applications:A review[J].Food Chemistry, 2011, 124(2):411-421.
[9] DAMEN B, VERSPREET J, POLLET A, et al.Prebiotic effects and intestinal fermentation of cereal arabinoxylans and arabinoxylan oligosaccharides in rats depend strongly on their structural properties and joint presence[J].Molecular Nutrition &Food Research, 2011, 55(12):1862-1874.
[10] 田玉荣.不同加工工艺条件下黑小麦麸皮戊聚糖的理化性质及益生活性研究[D].太原:山西大学, 2021.TIAN Y R.Study on the physicochemical properties and prebiotic activity of black wheat bran pentosan under different processing conditions[D].Taiyuan:Shanxi University, 2021.
[11] 吴丽萍, 董康珍, 楚文靖, 等.微波改性对燕麦麸膳食纤维结构及功能性质的影响[J].中国食品学报, 2021, 21(9):30-37.WU L P, DONG K Z, CHU W J, et al.Effects of microwave modification on the structure and functional properties of oat bran dietary fiber[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):30-37.
[12] 袁志宁, 霍栓, 严嘉恬, 等.挤压对柚皮可溶性膳食纤维理化、功能及结构特性的影响[J].天津科技大学学报, 2024, 39(3):21-27;71.YUAN Z N, HUO S, YAN J T, et al.Effect of extrusion on physicochemical, functional and structural properties of dietary fiber from pomelo peel[J].Journal of Tianjin University of Science &Technology, 2024, 39(3):21-27;71.
[13] 魏旭瑶, 姜彩霞, 曾祥瑞, 等.复合酶改性玉米皮可溶性膳食纤维的工艺优化及理化特性分析[J].食品工业科技, 2024, 45(6):202-209.WEI X Y, JIANG C X, ZENG X R, et al.Process optimization and physicochemical characteristics analysis of soluble dietary fiber from corn bran modified by composite enzymes[J].Science and Technology of Food Industry, 2024, 45(6):202-209.
[14] 温启华, 陆逸昊, 杨露芳, 等.硒化天麻多糖的制备、结构表征及其抗氧化活性评价[J].食品工业科技, 2024, 45(3):18-30.WEN Q H, LU Y H, YANG L F, et al.Preparation, structure characterization and antioxidant activity evaluation of selenized Gastrodia elata polysaccharides[J].Science and Technology of Food Industry, 2024, 45(3):18-30.
[15] 谢佳函, 刘回民, 刘美宏, 等.红豆皮多酚提取工艺优化及抗氧化活性分析[J].中国食品学报, 2020, 20(1):147-157.XIE J H, LIU H M, LIU M H, et al.Extraction process optimization and antioxidant activity analysis of polyphenols from azuki bean coats (Vigna angularis)[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1):147-157.
[16] LEE J H, HWANG C E, SON K S, et al.Comparisons of nutritional constituents in soybeans during solid state fermentation times and screening for their glucosidase enzymes and antioxidant properties[J].Food Chemistry, 2019,272:362-371.
[17] 陈薛.不同茶树品种鲜叶多糖的理化性质和抗氧化活性比较研究[D].杭州:浙江大学, 2022.CHEN X.Comparative study on physicochemical properties and antioxidant activity of polysaccharides from fresh leaves of different tea varieties[D].Hangzhou:Zhejiang University, 2022.
[18] ZHENG Q W, JIA R B, LUO D H, et al.The effect of extraction solution pH level on the physicochemical properties and α-glucosidase inhibitory potential of Fucus vesiculosus polysaccharide[J].LWT, 2022, 169:114028.
[19] SUN L J, CHEN W Q, MENG Y H, et al.Interactions between polyphenols in thinned young apples and porcine pancreatic α-amylase:Inhibition, detailed kinetics and fluorescence quenching[J].Food Chemistry, 2016, 208:51-60.
[20] WANG C H, MA Y L, ZHU D Y, et al.Physicochemical and functional properties of dietary fiber from bamboo shoots (Phyllostachys praecox)[J].Emirates Journal of Food and Agriculture, 2017, 29(7):509-517.
[21] 于美汇, 赵鑫, 尹红力, 等.碱提醇沉黑木耳多糖体外和体内降血脂功能[J].食品科学, 2017, 38(1):232-237.YU M H, ZHAO X, YIN H L, et al.In vitro and in vivo hypolipidemic effect of Auricularia auricular polysaccharides[J].Food Science, 2017, 38(1):232-237.
[22] 段振.石榴皮不溶性膳食纤维的提取、体外降血脂活性研究及咀嚼片制备[D].西安:陕西师范大学, 2018.DUAN Z.Extraction of insoluble dietary fiber from pomegranate peel, study on its hypolipidemic activity in vitro and preparation of chewable tablets[D].Xi’an:Shaanxi Normal University, 2018.
[23] 王大为, 宋云禹, 刘阳, 等.毛葱膳食纤维性质及结构分析[J].食品科学, 2018, 39(2):53-57.WANG D W, SONG Y Y, LIU Y, et al.Properties and structure of dietary fiber from tillering onion[J].Food Science, 2018, 39(2):53-57.
[24] 张帅, 郭晓雪, 任丽琨, 等.酶法改性影响膳食纤维的构成及生物作用效果的研究进展[J].食品安全质量检测学报, 2022, 13(4):1089-1098.ZHANG S, GUO X X, REN L K, et al.Research progress of enzymatic modification on the composition and biological effects of dietary fiber[J].Journal of Food Safety &Quality, 2022, 13(4):1089-1098.
[25] 郑佳欣.刺梨渣膳食纤维蒸汽爆破改性及结构、功能性质研究[D].北京:北京林业大学, 2020.ZHENG J X.Study on steam explosion modification, structure and functional properties of dietary fiber from Rosa roxburghii Tratt residue[D].Beijing:Beijing Forestry University, 2020.
[26] 杨开, 杨振寰, 吴伟杰, 等.雷笋膳食纤维酶法改性及其理化性能和结构变化[J].食品与发酵工业, 2019, 45(4):36-41.YANG K, YANG Z H, WU W J, et al.Physicochemical properties and structural changes of bamboo shoots dietary fiber with enzymatic modification[J].Food and Fermentation Industries, 2019, 45(4):36-41.
[27] WU D T, HE Y, FU M X, et al.Structural characteristics and biological activities of a pectic-polysaccharide from okra affected by ultrasound assisted metal-free Fenton reaction[J].Food Hydrocolloids, 2022, 122:107085.
[28] 王俊杰, 罗钰湲, 黄越, 等.球磨-酶法联合工艺制备菠萝皮渣不溶性膳食纤维:结构与理化特性的研究[J].食品与发酵工业, 2025,51(4):162-169.WANG J J, LUO Y Y, HUANG Y, et al.Preparation of insoluble dietary fiber from pineapple peel by ball milling enzymatic combined method:Study on structure and physicochemical properties[J].Food and Fermentation Industries, 2025,51(4):162-169.
[29] 吴鸿亿, 黄玲冬, 刘奇, 等.制备方法对高节竹笋头可溶性膳食纤维的理化与功能特性影响[J].食品与发酵工业, 2025,51(2):258-266.WU H Y, HUANG L D, LIU Q, et al.Effects of preparation methods on physicochemical and functional properties of soluble dietary fiber from Phyllostachys prominens bamboo shoot head[J].Food and Fermentation Industries, 2025,51(2):258-266.
[30] 任雨离, 刘玉凌, 何翠, 等.微波和微粉碎改性对方竹笋膳食纤维性能和结构的影响[J].食品与发酵工业, 2017, 43(8):145-150.REN Y L, LIU Y L, HE C, et al.Changes of fresh chimonobambusa dietary fiber in properties and structure modified by microwave and fine grinding[J].Food and Fermentation Industries, 2017, 43(8):145-150.
[31] EOM T, KIM Y S, CHOI C H, et al.Current understanding of microbiota-and dietary-therapies for treating inflammatory bowel disease[J].Journal of Microbiology, 2018, 56(3):189-198.
[32] WEN Y, NIU M, ZHANG B J, et al.Structural characteristics and functional properties of rice bran dietary fiber modified by enzymatic and enzyme-micronization treatments[J].LWT-Food Science and Technology, 2017, 75:344-351.