鲊广椒(Zha-chili)是中国湖北、贵州、四川和重庆等地区一种典型的传统发酵食品,其因酸、辣和鲜等独特的口感特征而深受消费者的青睐[1]。鲊广椒的制作时间大概在10月份,通常将新鲜的辣椒碎、碾碎的米粉和食盐按照一定的比例进行混合后转移至陶罐中并压实,继而在室温下自发厌氧发酵15~30 d制作而成[2]。由于独特的固态厌氧发酵方式和相对自然的发酵环境,鲊广椒中蕴藏了丰富的乳酸菌。李悦琦等[3]使用MiSeq测序技术和纯培养技术相结合的方法对巴东地区鲊广椒中细菌多样性进行了解析,发现乳杆菌属(Lactobacillus)为绝对优势细菌属,同时分离鉴定到6个菌种隶属于Lactobacillus,其中植物乳植杆菌(Lactiplantibacillus plantarum)和消化乳杆菌(L.alimentarius)为可培养优势乳杆菌。张振东等[4]使用MiSeq测序技术和纯培养技术相结合的方法对重庆地区鲊广椒微生物菌群进行了解析,发现Lactobacillus、促生乳杆菌属(Levilactobacillus)、迟缓乳杆菌属(Lentilactobacillus)和伴生乳杆菌属(Companilactobacillus)等为主要优势细菌属,同时将Levilactobacillus和Lentilactobacillus分别鉴定为短促生乳杆菌(L.brevis)和布氏迟缓乳杆菌(L.buchneri)。除此之外,ZHANG等[5-7]从鲊广椒中分离出了4株乳酸菌新物种,分别为鲊广椒伴生乳杆菌(C.zhachilii HBUAS52074T)[5]、恩施促生乳杆菌(L.enshiensis HBUAS57009T)[6]、土家促生乳杆菌(L.tujiae HBUAS51241T)[7]和安琪嗜戊糖乳杆菌(Secundilactobacillus angelii HBUAS51383T)[7]。DONG等[8]亦从鲊广椒中分离出了1株乳酸菌新物种,为宜都发酵剂乳杆菌(L.yiduensis HBUAS62285T),这亦证明了鲊广椒中蕴含着独特的乳酸菌资源。近年来,多数学者在研究鲊广椒细菌菌群结构的同时,还将其分离鉴定到的乳酸菌菌株再次投入于鲊广椒的纯种发酵中,结果发现鲊广椒的品质能够得到改善[9]。另外,兰沁洁等[10]通过菌株复配发酵对羊肉香肠品质影响的研究发现,菌株间的协同作用可有效提升羊肉香肠的可接受度和食用品质。基于此,积极探讨乳酸菌新物种的纯种和复配发酵对鲊广椒品质的影响,对于解析鲊广椒品质和菌群共生关系具有积极意义。
复杂的微生物菌群是影响发酵食品物理性质和感官品质的重要因素[11]。Illumina MiSeq高通量测序是一种用于探索微生物群落结构的新一代测序技术,该技术克服了传统培养方法的缺点,并因其通量高和检测速度等特点而被广泛应用于各种食品的微生物群落多样性分析中[12]。此外,作为新型仿生设备的电子鼻(E-nose)和电子舌(E-tongue)可分别模拟人类的嗅觉和味觉,两者的结合应用可快速准确地数字化评价发酵食品的感官品质[13]。例如,WANG等[14]在使用电子鼻和电子舌对发酵食品豆豉的品质进行评价的基础上,采用MiSeq技术对其蕴含的真菌群落结构进行了解析,并建立了真菌菌群与品质间的关联性。可见,MiSeq技术与仿生技术相结合来解析发酵食品的品质形成具有一定可行性。
本研究以鲊广椒源不同乳酸菌新物种发酵的鲊广椒为研究对象,在采用电子鼻和电子舌技术对其风味和滋味品质进行评价的基础上,使用纯培养技术和MiSeq测序技术对其微生物群落结构进行解析,同时基于直系同源蛋白数据库对不同菌种发酵鲊广椒细菌潜在的功能差异进行分析,最后探究新物种菌属与其滋味品质间和菌属间的关联性,以期为鲊广椒品质的改善提供数据支撑。
1 材料与方法
1.1 材料与试剂
新物种恩施促生乳杆菌(L.enshiensis HBUAS57009T)和鲊广椒伴生乳杆菌(C. zhachilii HBUAS52074T),由传统发酵食品团队从鲊广椒样品中分离鉴定获得。
二荆条辣椒、大米、白酒、食盐、花椒和白胡椒粉,市售;平板计数琼脂(plate count agar,PCA)培养基、MRS培养基和马铃薯葡萄糖琼脂(PDA)培养基,北京奥博星生物技术有限责任公司;QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒,德国QIAGEN公司;引物338F/806R和ITS1F/ITS2R,由上海桑尼生物科技有限公司合成;5×TransStartTM FastPfu Buffer、dNTPs Mix和FastPfu Fly DNA Polymerase,北京全式金生物技术有限公司;MiSeq高通量测序配套试剂,美国Illumina公司;参比溶液、阴阳离子溶液和内部溶液,日本INSENT公司。
1.2 仪器与设备
DG250厌氧工作站(80%N2、10%H2和10%CO2,均为体积分数),英国Don Whitley公司;Veriti FAST PCR仪,美国ABI公司;DYY-12电泳仪,北京六一仪器厂;UVPCDS8000凝胶成像分析系统,美国ProteinSimple公司;ND-2000C微量紫外分光光度计,美国Nano Drop公司;PE300 MiSeq高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司;PEN3电子鼻、SA402B电子舌,德国Airsense公司。
1.3 实验方法
1.3.1 菌株的活化与制备
新物种L.enshiensis和C.zhachilii的培养条件为30 ℃静置培养24 h,将其分别活化3次后于灭过菌的50 mL离心管中3 000 r/min,4 ℃离心10 min,弃上清液,再加入无菌0.85%(质量分数)生理盐水冲洗菌体沉淀2次,最后使用无菌水将菌体稀释成2.0×107 CFU/mL浓度的菌悬液,置于4 ℃条件下备用。实验分为4组,即:自然发酵组、L.enshiensis单菌发酵组、C.zhachilii单菌发酵组、L.enshiensis和C.zhachilii的1∶1体积比复配发酵组,每组样品制备3份。
1.3.2 鲊广椒样品的制备
参照向秀连等[15]制备鲊广椒样品的各食材配比,称取相应质量的辣椒碎、大米粉、食盐、花椒和白胡椒粉于发酵罐中,在无菌条件下按照5%(体积分数)接种量分别添加菌种,搅拌均匀后盖上碗盖,并在罐口喷洒5 mL白酒以帮助封口,于30 ℃条件下密封发酵28 d。
1.3.3 风味和滋味品质的测定
挥发性风味品质的测定:准确称取15.0 g样品于电子鼻专用样品瓶中,参照张苗苗等[16]对五峰泡菜水风味品质评价的样品处理步骤和测定方法,使用电子鼻对鲊广椒的风味特征进行数字化测定。
滋味品质的测定:准确称取30 g样品于120 mL蒸馏水中,搅拌均匀后用保鲜膜封口并放置于室温下平衡30 min,12 000 r/min离心10 min并抽滤,参照董蕴等[17]对市售甜面酱滋味品质评价的测定方法和步骤,使用电子舌对鲊广椒滤液的酸、苦、涩、咸、鲜及苦、涩和鲜味回味等滋味特征进行数字化测定。
1.3.4 活菌计数与pH值的测定
分别参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》、GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》和GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》对鲊广椒样品中细菌总数、乳酸菌数、酵母菌和霉菌数进行计数。使用数显pH计对鲊广椒样品的pH值进行测定。
1.3.5 Illumina MiSeq高通量测序
鲊广椒样品宏基因组DNA的提取参照DNA试剂盒中提供的操作方法进行,参照SUN等[18]的方法使用338F/806R(338F:5′-ACTCCTACGGGAGGCAGCAG-3′/806R:5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA的V3~V4高变区进行PCR扩增,同时参照CAO等[19]的方法使用引物ITS1F/ITS2R(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′/ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS2区进行PCR扩增。将纯化后的PCR产物通过分光光度计进行定量后寄送至上海美吉生物医药科技有限公司进行配对末端测序(2×300 bp)。
1.3.6 生物信息学分析
本研究基于QIIME(v 1.9.0)平台对高通量测序生成的对端原始序列数据进行物种分析和多样性评估。首先使用PyNAST软件将原始序列数据进行拆分并将其分配给相应的样品,继而参照MAO等[20]的方法对原始序列进行质控,并使用trim_galore(v 0.6.6)修剪低质量序列,使用基于重叠序列的FLASH(v 1.2.11)对得到的高质量对端序列进行合并[21],同时使用Chimera Slayer从合并序列中检查并过滤嵌合体序列[22],基于97%相似性的阈值下使用UCLUST对获得的无嵌合体序列进行聚类以获得操作分类单元(operational taxonomic units,OTU)[23],分别使用RDP(Ribosomal Database Project,v 11.5)[24]数据库和UNITE(v 7.2)[25]数据库对具有代表性的细菌和真菌OTU序列进行鉴定以分析微生物群落的组成。
1.3.7 基因功能预测
使用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)软件对12份鲊广椒样品的细菌序列功能进行分析[26],继而根据直系同源蛋白数据库(clusters of orthologous groups of proteins,COG)注释其细菌基因功能[27]。
1.4 数据处理
每组样品的各项指标均平行测定3次,数据处理在Excel 2016中进行。使用多元方差分析(multivariate analysis of variance,MANOVA)方法和SPSS方差分析软件分析各测定指标的差异显著性,可视化分析集中在Origin 2017、R(v 4.1.3)和Cytoscape中进行。
2 结果与分析
2.1 不同菌种发酵鲊广椒感官特性分析
本研究首先通过电子鼻和电子舌等仿生技术对不同菌种发酵鲊广椒的风味和滋味指标进行了数字化分析,结果如表1所示。
表1 不同菌种发酵鲊广椒风味和滋味指标分析
Table 1 Flavor and taste indexes analysis of fermented Zha-chili with different strains
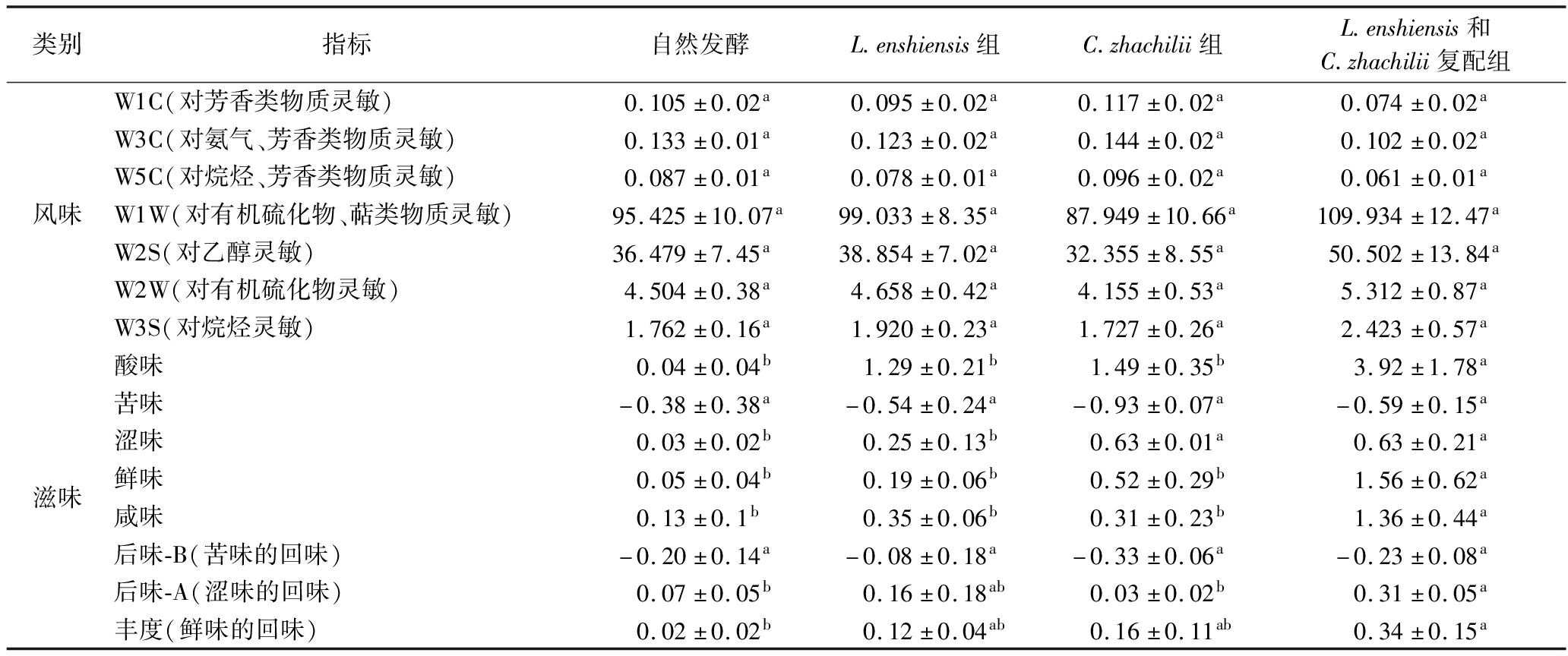
类别指标自然发酵L.enshiensis组C.zhachilii组L.enshiensis和C.zhachilii复配组风味W1C(对芳香类物质灵敏)0.105±0.02a0.095±0.02a0.117±0.02a0.074±0.02aW3C(对氨气、芳香类物质灵敏)0.133±0.01a0.123±0.02a0.144±0.02a0.102±0.02aW5C(对烷烃、芳香类物质灵敏)0.087±0.01a0.078±0.01a0.096±0.02a0.061±0.01aW1W(对有机硫化物、萜类物质灵敏)95.425±10.07a99.033±8.35a87.949±10.66a109.934±12.47aW2S(对乙醇灵敏)36.479±7.45a38.854±7.02a32.355±8.55a50.502±13.84aW2W(对有机硫化物灵敏)4.504±0.38a4.658±0.42a4.155±0.53a5.312±0.87aW3S(对烷烃灵敏)1.762±0.16a1.920±0.23a1.727±0.26a2.423±0.57a滋味酸味 0.04±0.04b 1.29±0.21b 1.49±0.35b 3.92±1.78a苦味-0.38±0.38a-0.54±0.24a-0.93±0.07a-0.59±0.15a涩味0.03±0.02b0.25±0.13b0.63±0.01a0.63±0.21a鲜味0.05±0.04b0.19±0.06b0.52±0.29b1.56±0.62a咸味0.13±0.1b0.35±0.06b0.31±0.23b1.36±0.44a后味-B(苦味的回味)-0.20±0.14a-0.08±0.18a-0.33±0.06a-0.23±0.08a后味-A(涩味的回味)0.07±0.05b0.16±0.18ab0.03±0.02b0.31±0.05a丰度(鲜味的回味)0.02±0.02b0.12±0.04ab0.16±0.11ab0.34±0.15a
注:同一行肩标字母不同表示差异显著(P<0.05)(下同)。
由表1可知,在风味指标上,W1C、W3C、W5C、W1W、W2S、W2W和W3S这7个传感器对不同菌种发酵鲊广椒的响应值无明显差异(P>0.05)。究其原因可能在于鲊广椒其内部菌群的代谢和外部辅料的调香。一方面,鲊广椒中含有丰富的乳酸菌资源,其在发酵过程中产生的代谢产物主要为乳酸、柠檬酸和乙酸等酸类物质[28],对鲊广椒风味品质影响较弱,另一方面,鲊广椒在制作过程中添加了大量的辣椒碎、白酒和香辛料等增味物质,这些辅料其自身的风味超过并掩盖了乳酸菌在发酵过程中产生的风味物质。此外,从整体上看,W1W传感器对不同菌种发酵鲊广椒的响应强度较大,均大于80。由此可见,不同菌种发酵鲊广椒样品中其挥发性风味物质主要为有机硫化物和萜烯类物质。GUO等[29]使用电子鼻对不同地区鲊广椒的风味指标进行了测定,发现其挥发性风味物质亦以有机硫化物和萜烯类物质为主,这与本研究结果一致。
在滋味指标上,不同菌种发酵鲊广椒在酸味、涩味、鲜味、咸味、后味-A和丰度指标上均存在显著差异(P<0.05)。有研究指出,在使用电子舌评价食品的滋味品质时,只有2个样品在同一指标上的响应差值大于1.0,其滋味的差异才可通过感官鉴评得以区分[30]。因此,不同菌种发酵鲊广椒的滋味品质差异主要体现在酸味、鲜味和咸味指标上,其中,L.enshiensis纯种发酵组和C.zhachilii纯种发酵组鲊广椒的酸味、鲜味和咸味指标强度高于自然发酵组,但其差异不显著(P>0.05),而L.enshiensis和C.zhachilii复配发酵组鲊广椒的酸味、鲜味和咸味指标强度均显著高于其他组(P<0.05)。有研究指出,酸味和鲜味是鲊广椒的理想滋味特征[29]。由此可见,相较于自然发酵,富集乳酸菌发酵可提高鲊广椒的滋味特征品质,且尤以复配发酵组鲊广椒的滋味品质最佳。
2.2 不同菌种发酵鲊广椒微生物群落结构分析
本研究使用纯培养技术对不同菌种发酵鲊广椒中的菌落总数、乳酸菌、酵母菌和霉菌进行了活菌计数,同时使用常规检测方法对其pH值进行了测定,初步对鲊广椒中微生物丰度及其发酵效果进行估量,结果如表2所示。
表2 不同菌种发酵鲊广椒活菌计数和pH值分析
Table 2 Viable bacteria count and pH value analysis of fermented Zha-chili with different strains
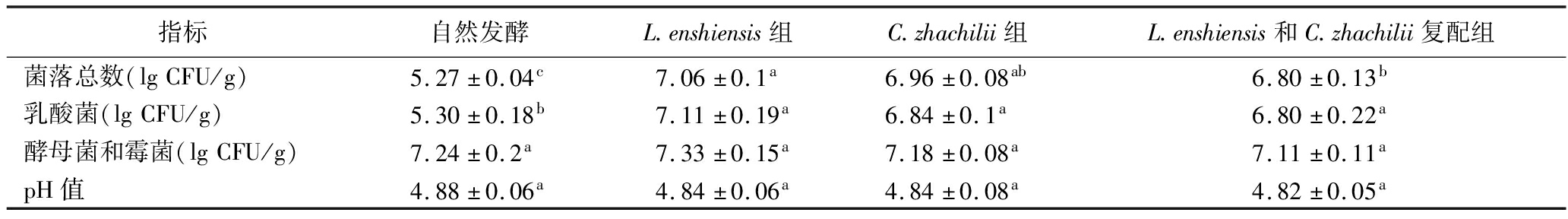
指标自然发酵L.enshiensis组C.zhachilii组L.enshiensis和C.zhachilii复配组菌落总数(lgCFU/g)5.27±0.04c7.06±0.1a6.96±0.08ab6.80±0.13b乳酸菌(lgCFU/g)5.30±0.18b7.11±0.19a6.84±0.1a6.80±0.22a酵母菌和霉菌(lgCFU/g)7.24±0.2a7.33±0.15a7.18±0.08a7.11±0.11apH值4.88±0.06a4.84±0.06a4.84±0.08a4.82±0.05a
由表2可知,在自然发酵、Lev.enshiensis纯种发酵、Com.zhachilii纯种发酵及复配发酵这4个组中,菌落总数分别为5.27、7.06、6.96、6.80 lg CFU/g,乳酸菌数分别为5.30、7.11、6.84、6.80 lg CFU/g,酵母菌和霉菌数分别为7.24、7.33、7.18、7.11 lg CFU/g,pH值分别为4.88、4.84、4.84和4.82。此外,纯种发酵组和复配发酵组鲊广椒的菌落总数和乳酸菌总数均显著高于自然发酵组(P<0.05),而不同菌种发酵鲊广椒中的酵母菌和霉菌数及pH值差异均不显著(P>0.05)。基于此,本研究进一步使用MiSeq高通量测序技术对不同菌种发酵鲊广椒的微生物群落结构进行了解析,基于门水平结果如图1所示。
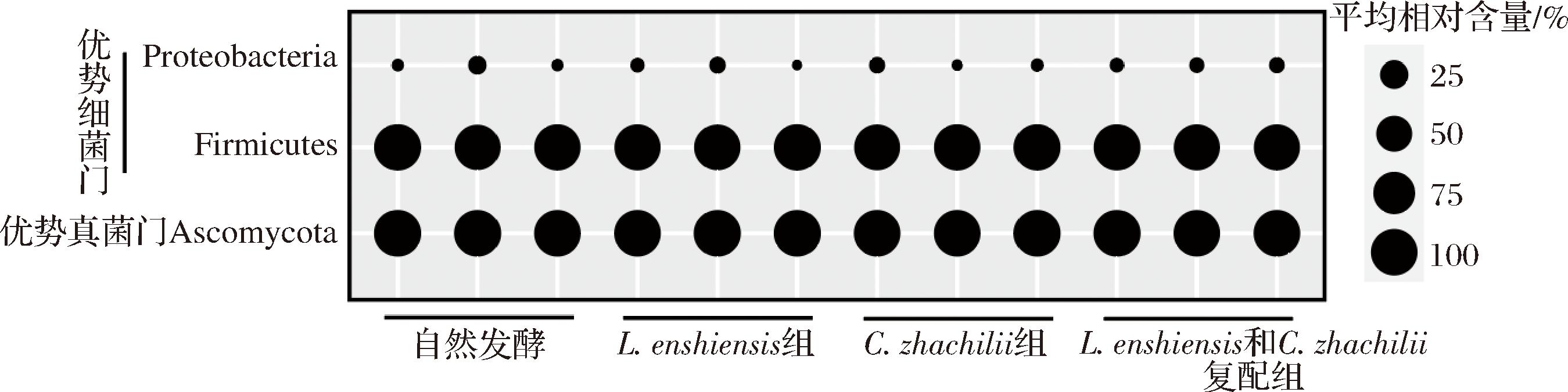
图1 基于门水平不同菌种发酵鲊广椒中微生物群落结构分析
Fig.1 Analysis of microbial community structure in fermented Zha-chili with different strains based on phylum levels
由图1可知,不同菌种发酵鲊广椒中优势细菌门(平均相对含量>1.0%)有2个,分别为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为97.31%和1.75%,可见Firmicutes为绝对优势细菌门。有研究指出,隶属于Firmicutes的多数菌属可通过代谢过程影响发酵食品的成熟和风味品质,例如Lactobacillus、明串珠菌属(Leuconostoc)和乳球菌属(Lactococcus)等[31]。由图1亦可知,不同菌种发酵鲊广椒中优势真菌门有1个,为子囊菌门(Ascomycota),其平均相对含量为99.86%。经kruskal-wallis检验发现,优势菌门在不同类型菌种发酵鲊广椒中差异不显著(P>0.05)。
本研究进一步基于属水平对不同菌种发酵鲊广椒的微生物群落结构进行了解析,结果如图2所示。
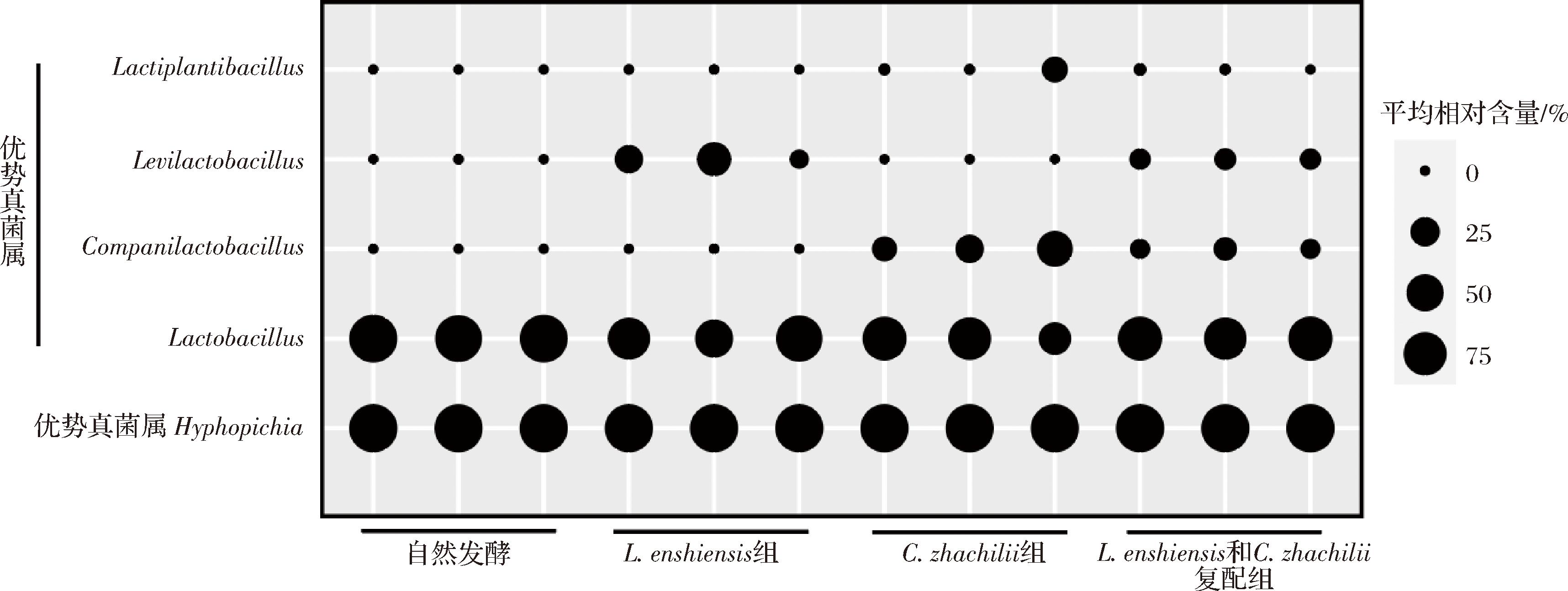
图2 基于属水平不同菌种发酵鲊广椒中微生物群落结构分析
Fig.2 Analysis of microbial community structure in fermented Zha-chili with different strains based on genus levels
由图2可知,不同菌种发酵鲊广椒中优势细菌属(平均相对含量>1.0%)有4个,分别为Lactobacillus、Companilactobacillus、Levilactobacillus和乳植物杆菌属(Lactiplantibacillus),其平均相对含量分别为76.85%、9.05%、7.81%和1.49%,可见Lactobacillus为绝对优势细菌属。以往多数研究发现,植物性发酵食品中优势细菌属均以Lactobacillus为主[32],这与本研究结果一致。有研究指出,Lactobacillus在发酵过程中代谢产生的有机酸不仅可以降低环境中的pH,从而抑制周围腐败微生物的生长,其代谢产生的乳酸还可与环境中的醇、醛和酮类物质发生反应,生成大量挥发性风味物质从而提高发酵风味[28]。ZHENG等[33]在2020年将Lactobacillus重新划分为23个新属,其中包括Companilactobacillus、Levilactobacillus和Lactiplantibacillus。随着富集乳酸菌的接种,鲊广椒的细菌群落结构发生了较大改变。与自然发酵组相比,L.enshiensis纯种发酵组鲊广椒中Levilactobacillus的平均相对含量显著偏高(P<0.05),为22.52%;C.zhachilii纯种发酵组鲊广椒中Companilactobacillus的平均相对含量亦显著偏高(P<0.05),为27.71%。此外,L.enshiensis和C.zhachilii复配发酵组鲊广椒中Companilactobacillus和Levilactobacillus的平均相对含量亦显著高于自然发酵组(P<0.05),分别为8.73%和8.74%。Companilactobacillus和Levilactobacillus亦属于乳酸菌,两者在发酵过程中可将原料分解转化为增味物质,进而增强发酵食品的口感和营养[34]。接种富集乳酸菌的鲊广椒在发酵过程中伴随有少量Lactiplantibacillus的产生与代谢,YU等[35]的研究指出,Lactiplantibacillus主要存在于发酵蔬菜或植物产品中,具有潜在的益生菌特性,可调节宿主免疫反应和降低血清胆固醇等以促进人体健康。由图2亦可知,不同菌种发酵鲊广椒中优势真菌属仅有1个,为生丝毕赤酵母属(Hyphopichia),其平均相对含量为99.81%,且其在不同类型菌种发酵鲊广椒中差异不显著(P>0.05),这与表2中对不同菌种发酵鲊广椒的酵母菌和霉菌活数计数结果进行分析,发现其差异不显著的结论相对应。有研究指出,Hyphopichia为发酵食品中的产香酵母,其具有较强的发酵能力和产乙醇能力,不仅能够增强发酵食品的营养价值还可赋予其独特的口感风味[36]。
2.3 不同菌种发酵鲊广椒菌群功能差异分析
本研究在比较了不同菌种发酵鲊广椒中微生物菌群结构的差异后,进一步对其细菌的基因功能进行了差异分析,将菌群序列上传至PICRUSt软件进行比对后发现其注释到的COG隶属于23个功能类别,分别归类为信息存储和处理、代谢、未知以及细胞过程和信号这4种,其中具有差异的功能类群如图3所示。

a-信息储存和处理;b-代谢;c-细胞过程和信号
图3 不同菌种发酵鲊广椒中细菌基因功能差异分析
Fig.3 Analysis of differences in bacterial gene function in fermented Zha-chili with different strains
注:图中同一功能上标不同小写字母表示差异显著(P<0.05)。
由图3可知,与自然发酵组相比,在信息存储和处理方面,纯种发酵组和复配发酵组鲊广椒的菌群基因功能在复制、重组与修复,翻译、核糖体结构与生物发生功能上表达均显著偏高(P<0.05);在代谢方面,核苷转运与代谢和氨基酸转运代谢功能上表达亦均显著偏高(P<0.05);在细胞过程和信号方面,细胞壁/膜/被膜的生物合成功能上表达亦显著偏高(P<0.05),而胞内转运、分泌和小泡运输,信号转导机制,细胞运动和抵御机制功能上表达呈现显著不规律变化。由此可见,相较于自然发酵,富集乳酸菌发酵在整体上可明显提高鲊广椒中细菌菌群的基因功能表达。
2.4 细菌属与滋味品质的相关性分析
有研究指出,微生物代谢对发酵食品的品质具有重要影响[37]。为此,本研究通过计算Spearman等级相关系数进一步对细菌属与滋味品质间的相关性进行了解析,结果如图4所示。
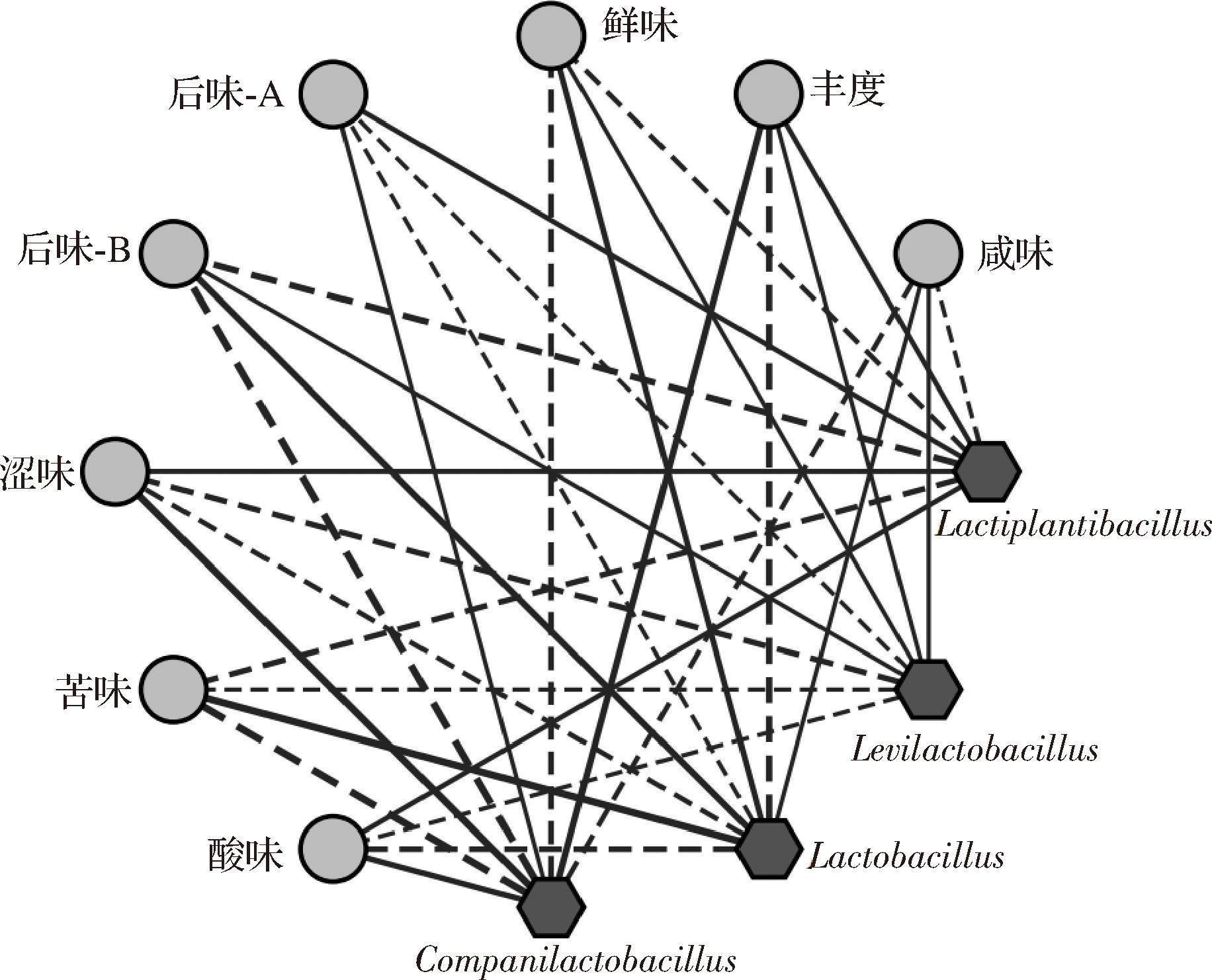
图4 不同菌种发酵鲊广椒中细菌属与滋味指标的相关性网络图
Fig.4 Correlation network between bacterial genera and taste indexes in fermented Zha-chili with different strains
注:实线代表正相关关系,虚线代表负相关关系,线越粗代表相关性越大。
由图4可知,细菌属与滋味指标间存在着复杂的构效关系,经鉴定共得到32对正负相关关系。其中,Levilactobacillus和Lactobacillus均与咸味和鲜味物质的生成呈现正相关关系,而两者与酸味物质的生成均呈现负相关关系。Companilactobacillus与酸味物质的生成呈现正相关性,与咸味和鲜味物质的生成呈现负相关关系。Lactiplantibacillus与酸味和鲜味物质的生成呈现正相关关系,与咸味物质的生成呈现负相关关系。由此可见,富集乳酸菌发酵对鲊广椒的滋味品质具有一定的积极作用。
同时,本研究进一步对L.enshiensis和C.zhachilii复配发酵组鲊广椒中Levilactobacillus和Companilactobacillus的相关性进行了分析,结果如图5所示。
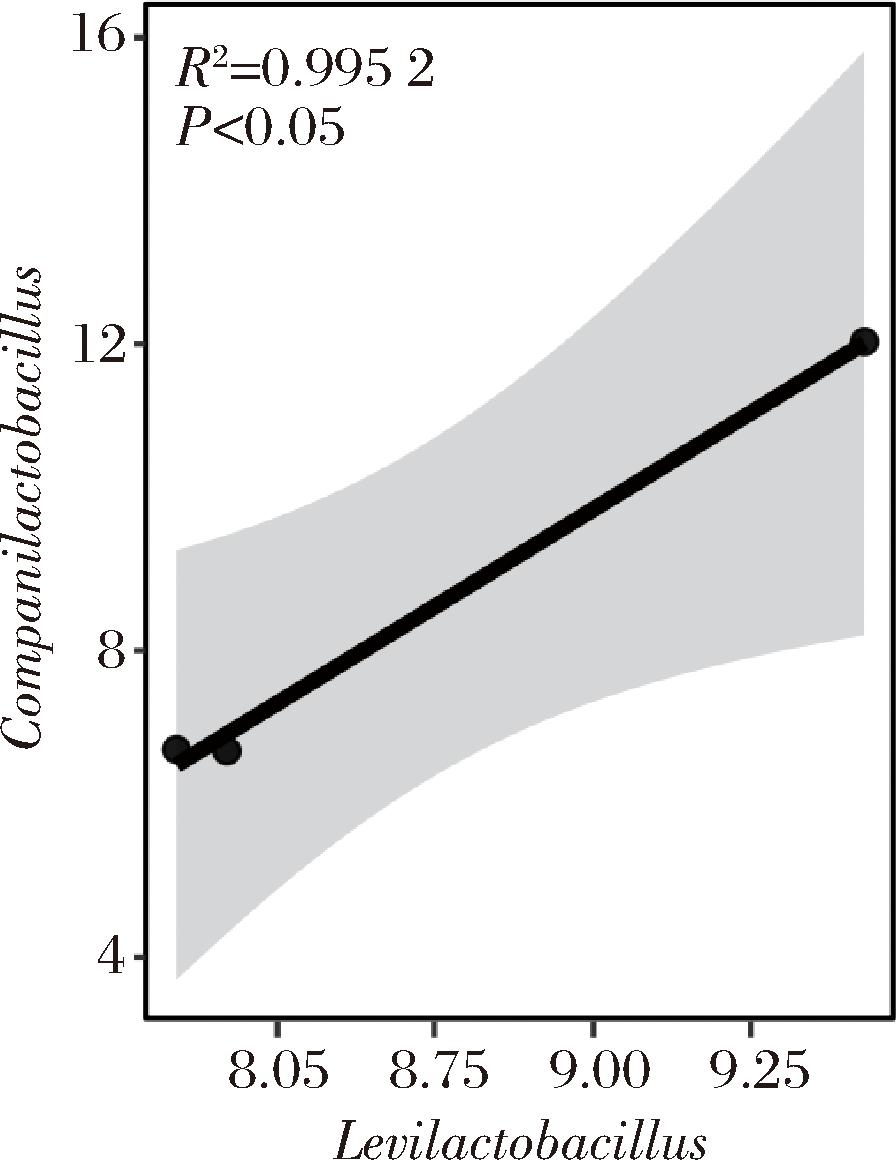
图5 Levilactobacillus和Companilactobacillus的相关性拟合曲线图
Fig.5 Correlation fitting curves of Levilactobacillus and Companilactobacillus
由图5可知,Levilactobacillus和Companilactobacillus间相对含量呈现显著正相关性(P<0.05)。由此可见,L.enshiensis和C.zhachilii这2个乳酸菌新物种在复配发酵过程中存在共生关系,两者间的共生作用可进一步促进鲊广椒滋味品质的形成。
3 结论
相较于自然发酵组,富集乳酸菌发酵的鲊广椒在风味品质上差异不明显,而其在滋味品质上有明显提升,且尤以L.enshiensis和C.zhachilii复配发酵组鲊广椒的滋味品质最佳。同时,Lactobacillus在鲊广椒中占绝对优势,随着鲊广椒源新物种L.enshiensis和C.zhachilii的接种,Companilactobacillus和Levilactobacillus的丰度显著增加,并伴随着细菌菌群基因功能表达的显著提高,经相关性分析发现,两者与滋味特征指标间呈现多种正负相关性,对鲊广椒滋味品质的形成具有一定的积极作用,且两者在复配发酵过程中存在共生关系,进一步提升了鲊广椒的滋味品质。
[1] CAI W C, TANG F X, WANG Y R, et al.Bacterial diversity and flavor profile of Zha-Chili, a traditional fermented food in China[J].Food Research International, 2021, 141:110112.
[2] CAI W C, WANG Y R, HOU Q C, et al.PacBio sequencing combined with metagenomic shotgun sequencing provides insight into the microbial diversity of Zha-chili[J].Food Bioscience, 2021, 40:100884.
[3] 李悦琦, 熊英梅, 向秀连, 等.巴东地区鲊广椒细菌多样性分析及乳酸菌分离鉴定[J].中国酿造, 2023, 42(3):109-114.LI Y Q, XIONG Y M, XIANG X L, et al.Bacterial diversity analysis, isolation and identification of lactic acid bacteria of Zha-Chili in Badong region[J].China Brewing, 2023, 42(3):109-114.
[4] 张振东, 李学富, 肖秋杨, 等.基于高通量测序与分离鉴定方法解析奉节和巫山鲊广椒微生物多样性[J].食品与发酵工业, 2023, 49(24):178-185.ZHANG Z D, LI X F, XIAO Q Y, et al.Microbial diversity of Zha-chili from Fengjie and Wushan County using high-throughput sequencing and isolation and identification-based methods[J].Food and Fermentation Industries, 2023, 49(24):178-185.
[5] ZHANG Z D, HOU Q C, WANG Y R, et al.Lactobacillus zhachilii sp.nov., a lactic acid bacterium isolated from Zha-Chili[J].International Journal of Systematic and Evolutionary Microbiology, 2019, 69(8):2196-2201.
[6] ZHANG Z D, WANG Y R, HOU Q C, et al.Lactobacillus enshiensis sp.nov., a novel arsenic-resistant bacterium[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(4):2580-2587.
[7] ZHANG Z D, WANG Y R, DONG Y, et al.Characterization of two novel pentose-fermenting and GABA-producing species:Levilactobacillus tujiorum sp.nov.and Secundilactobacillus angelensis sp.nov.isolated from a solid-state fermented Zha-chili[J].Systematic and Applied Microbiology, 2022, 45(5):126344.
[8] DONG Y, WANG Y R, ZHAO H J, et al.Levilactobacillus yiduensis sp.nov., isolated from Zha-chili in Yidu County, Hubei Province, China[J].Current Microbiology, 2023, 80(4):112.
[9] 雷炎, 马佳佳, 雷敏, 等.恩施鲊广椒乳酸菌的分离鉴定及其对挥发性风味物质的影响[J].中国酿造, 2019, 38(7):126-130.LEI Y, MA J J, LEI M, et al.Isolation and identification of lactic acid bacteria from Zhaguangjiao of Enshi and its effect on volatile flavor substances[J].China Brewing, 2019, 38(7):126-130.
[10] 兰沁洁, 宋杰, 陈沫, 等.乳酸菌和酵母菌复配发酵对羊肉香肠食用品质的影响[J].食品与发酵工业, 2024, 50(6):24-33.LAN Q J, SONG J, CHEN M, et al.Effect of compound fermentation of lactic acid bacteria and yeast on eating quality of mutton sausages[J].Food and Fermentation Industries, 2024, 50(6):24-33.
[11] AMMOR M S, MAYO B.Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:An update[J].Meat Science, 2007, 76(1):138-146.
[12] EZEKIEL C N, AYENI K I, EZEOKOLI O T, et al.High-throughput sequence analyses of bacterial communities and multi-mycotoxin profiling during processing of different formulations of kunu, a traditional fermented beverage[J].Frontiers in Microbiology, 2018, 9:3282.
[13] PERIS M, ESCUDER-GILABERT L.Electronic noses and tongues to assess food authenticity and adulteration[J].Trends in Food Science &Technology, 2016, 58:40-54.
[14] WANG Y R, XIANG F S, ZHANG Z D, et al.Characterization of bacterial community and flavor differences of different types of Douchi[J].Food Science &Nutrition, 2021, 9(7):3460-3469.
[15] 向秀连, 赵慧君, 王玉荣, 等.食盐添加对鲊广椒感官品质及细菌类群的影响[J].食品工业科技, 2023, 44(17):108-114.XIANG X L, ZHAO H J, WANG Y R, et al.The effect of salt addition on sensory quality and bacterial structure of Zhaguangjiao[J].Science and Technology of Food Industry, 2023, 44(17):108-114.
[16] 张苗苗, 解云, 王玉荣, 等.五峰土家族自治县泡菜水品质评价及其乳酸菌多样性解析[J].食品与发酵工业, 2022, 48(22):187-193.ZHANG M M, XIE Y, WANG Y R, et al.Quality evaluation and analysis of lactic acid bacterial diversity of Wufeng Tujia autonomous county Paocai brine[J].Food and Fermentation Industries, 2022, 48(22):187-193.
[17] 董蕴, 张一涵, 杨小丽, 等.基于电子舌技术对甜面酱滋味品质的评价[J].保鲜与加工, 2019, 19(1):121-126.DONG Y, ZHANG Y H, YANG X L, et al.Taste profile evaluation of wheat paste by electronic tongue analysis[J].Storage and Process, 2019, 19(1):121-126.
[18] SUN W N, XIAO H Z, PENG Q, et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Annals of Microbiology, 2016, 66(3):1293-1301.
[19] CAO J H, ZHENG Y L, ZHAO T, et al.Changes in the microbial community structure during the digitally managed fermentation of medium-temperature Daqu[J].Food Science and Technology, 2022, 42:e87122.
[20] MAO J J, LIU X L, GAO T, et al.Unraveling the correlations between bacterial diversity, physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT, 2022, 154:112764.
[21] ![]() T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
[22] POLLOCK J, GLENDINNING L, WISEDCHANWET T, et al.The madness of microbiome:Attempting to find consensus “best practice” for 16S microbiome studies[J].Applied and Environmental Microbiology, 2018, 84(7):e02627-17.
[23] WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Frontiers in Microbiology, 2021, 12:644012.
[24] COLE J R, CHAI B, FARRIS R J, et al.The ribosomal database project (RDP-II):Introducing myRDP space and quality controlled public data[J].Nucleic Acids Research, 2007, 35(Database issue):D169-D172.
[25] K LJALG U, NILSSON R H, ABARENKOV K, et al.Towards a unified paradigm for sequence-based identification of fungi[J].Molecular Ecology, 2013, 22(21):5271-5277.
LJALG U, NILSSON R H, ABARENKOV K, et al.Towards a unified paradigm for sequence-based identification of fungi[J].Molecular Ecology, 2013, 22(21):5271-5277.
[26] CHEN Y, TIAN W, SHAO Y, et al.Miscanthus cultivation shapes rhizosphere microbial community structure and function as assessed by Illumina MiSeq sequencing combined with PICRUSt and FUNGUIld analyses[J].Archives of Microbiology, 2020, 202(5):1157-1171.
[27] HUERTA-CEPAS J, SZKLARCZYK D, HELLER D, et al.eggNOG 5.0:A hierarchical, functionally and phylogenetically annotated orthology resource based on 5090 organisms and 2502 viruses[J].Nucleic Acids Research, 2019, 47(D1):D309-D314.
[28] 郝卓莉.酸菜发酵期间细菌群落结构动态变化分析[J].中国酿造, 2020, 39(7):56-61.HAO Z L.Dynamic changes analysis of bacterial community structure during sauerkraut fermentation[J].China Brewing, 2020, 39(7):56-61.
[29] GUO Z, WANG Y R, XIANG F S, et al.Evaluating the flavor and divergent bacterial communities in corn-based Zha-chili[J].Food Bioscience, 2022, 46:101563.
[30] 郭壮, 汤尚文, 王玉荣, 等.基于电子舌技术的襄阳市售米酒滋味品质评价[J].食品工业科技, 2015, 36(15):289-293.GUO Z, TANG S W, WANG Y R, et al.Taste profile characterization of commercial rice wine in Xiangyang by electronic tongue analysis[J].Science and Technology of Food Industry, 2015, 36(15):289-293.
[31] LIU W J, ZHENG Y, KWOK L Y, et al.High-throughput sequencing for the detection of the bacterial and fungal diversity in Mongolian naturally fermented cow’s milk in Russia[J].BMC Microbiology, 2015, 15:45.
[32] HE Z, CHEN H Y, WANG X Y, et al.Effects of different temperatures on bacterial diversity and volatile flavor compounds during the fermentation of Suancai, a traditional fermented vegetable food from northeastern China[J].LWT, 2020, 118:108773.
[33] ZHENG J S, WITTOUCK S, SALVETTI E, et al.A taxonomic note on the genus Lactobacillus:Description of 23 novel Genera, emended description of the genus Lactobacillus beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(4):2782-2858.
[34] CHEN C, LIU Y, TIAN H X, et al.Metagenomic analysis reveals the impact of JIUYAO microbial diversity on fermentation and the volatile profile of Shaoxing-Jiu[J].Food Microbiology, 2020, 86(4):103326.
[35] YU Z H, ZHANG X, LI S Y, et al.Evaluation of probiotic properties of Lactobacillus plantarum strains isolated from Chinese sauerkraut[J].World Journal of Microbiology &Biotechnology, 2013, 29(3):489-498.
[36] CHEN S, XU Y.Adaptive evolution of Saccharomyces cerevisiae with enhanced ethanol tolerance for Chinese rice wine fermentation[J].Applied Biochemistry and Biotechnology, 2014, 173(7):1940-1954.
[37] TRAN T, GRANDVALET C, VERDIER F, et al.Microbiological and technological parameters impacting the chemical composition and sensory quality of kombucha[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):2050-2070.