便秘是一种常见的消化系统疾病,影响着全球数以亿计的人群。便秘不仅对个体的生理健康造成影响,还显著降低了患者的生活质量[1]。根据罗马Ⅳ标准,便秘的定义包括排便频率减少、粪便硬度增加及排便困难等症状[2]。便秘的病因是多方面的,包括纤维摄入不足、身体活动不足、脱水和某些潜在的疾病等因素。然而,越来越多的研究显示,肠道菌群失调可能是导致便秘的关键原因[3-5]。因此,了解肠道菌群与便秘之间的关系已成为开发新的治疗策略的重点。
人体肠道栖息着数万亿微生物,包括细菌、病毒和真菌,它们共同构成肠道菌群。这些微生物发挥着许多功能,例如发酵膳食纤维、合成维生素和维持肠道上皮的完整性[6]。研究表明,便秘患者常表现出肠道菌群失调,特别是有益细菌的多样性减少[4]。便秘患者的肠道微生物群中,拟杆菌门显著增加,变形菌门显著减少,而厚壁菌门未发生显著变化[7]。一项关于功能性便秘的研究表明,与健康人群相比,便秘患者的肠道微生物发生显著变化,并通过改变微生物代谢途径加剧便秘[8]。肠道微生物失调可导致肠道的蠕动减慢、通透性改变以及炎症的发生,这些都会加剧便秘症状[5]。
传统的便秘治疗方法通常依赖化学药物,如泻药和促动力药物,这些药物可以直接作用于肠道来刺激排便,短期内可以有效缓解便秘症状。然而,长期使用这些药物可能导致一系列副作用,如药物依赖、肠道功能减弱、电解质失衡和腹泻等[9]。尤其是一些泻药在长期使用过程中可能改变肠道的自然蠕动能力,进一步加重症状。
与之相比,益生菌作为一种天然、温和的干预方式,并且对肠道健康的益处往往更持久。益生菌是指对宿主有益的活微生物,能够通过调节肠道微生物来改善消化系统的功能[10]。具体机制包括通过促进有益菌群的繁殖、抑制有害菌的生长、增加短链脂肪酸的生成等途径,改善肠道蠕动、增加排便频率并优化粪便的性质[11]。相比于化学药物,益生菌的使用不仅能避免药物依赖,还能在改善便秘症状的同时促进肠道的整体健康,减轻长期用药可能带来的副作用[12]。一项随机对照试验表明,便秘患者摄入短双歧杆菌和植物乳植杆菌能有效缓解排便障碍及改善粪便性状[13]。植物乳植杆菌能够增加肠道中短链脂肪酸的产生,从而促进肠道蠕动,降低粪便硬度,促进排便[14]。因此,通过益生菌调节肠道微生物并恢复其平衡,已成为改善便秘的可行策略,越来越受到关注。
鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)是一种广泛研究的益生菌,在调节肠道菌群和改善消化道健康方面表现出显著潜力[15]。已有研究显示,鼠李糖乳酪杆菌能够通过多种机制改善肠道功能。例如,鼠李糖乳酪杆菌通过竞争抑制病原菌繁殖、提高肠道屏障功能及免疫反应的调控等机制促进肠道健康[16]。然而,其对便秘患者的具体疗效仍未得到充分探索。
在本研究中,针对在动物实验中对便秘具有较好缓解作用的鼠李糖乳酪杆菌CCFM1068,在人群实验中验证其对便秘的缓解作用及对患者肠道健康的益处,特别是在调节肠道菌群相关物种丰度、改善粪便硬度、排便频率和生活质量方面的效果。为改善便秘提供一种新的治疗策略,也为便秘的管理提供新的思路和依据。
1 实验材料与方法
1.1 研究对象
以在无锡市第二人民医院确诊的25名慢性便秘患者作为实验对象。本研究经无锡市第二人民医院药物临床试验伦理委员会批准(伦理委员会批件编号:2020001),并已在中国临床试验注册中心完成注册(http://www.chictr.org.cn),注册号是ChiCTR2100045497。
纳入标准:年龄在18~65岁、符合罗马Ⅳ诊断标准的中国成年人;近1周未使用任何影响胃肠动力的药物;受试者或监护人已签署知情同意书;患者填写书面知情同意书、基本情况调查表、生活状况调查表,并在整个试验期间承诺配合研究。
排除标准:药物或其他疾病引起的继发性便秘;确诊为肠道器质性疾病;患有任何代谢疾病;干预前2周内服用过含有抗生素或益生菌的食品和药物;需要长期服用改善便秘的药物;不配合研究的参与者。
1.2 实验设计
入组前访问时间为1周,进行基线评估。主要评估了纳入和排除标准,符合条件的参与者被纳入研究,并签署知情同意书,完成病例报告表。病例报告表主要记录以下指标:参与者身体基本信息(包括联系方式、年龄、性别、身高和体重)、每周排便次数(spontaneous bowel movements,SBM)、布里斯托大便分类法(Bristol stool form scale,BSFS)、便秘患者症状自评问卷(patient assessment of constipation-symptoms,PAC-SYM)和便秘患者生存质量量表(patient assessment of constipation quality of life,PAC-QOL)。
BSFS将人类粪便分成7种类型,第一型至第三型为便秘,第四型是理想的便形[17]。PAC-SYM是用来评估便秘患者严重程度的量表,分值越高越严重[18]。PAC-QOL可以通过身体功能、心理状态和社交互动等方面对患者的生活质量进行评估,同样分值越高表示生活质量越差[19]。
访问结束后,第一次收集每位参与者的粪便样本,进行4周的益生菌菌粉干预。干预期间,参与者每日2次,每次食用1包菌粉,并记录每天的排便情况。干预4周结束后,再次采集每位参与者的粪便样本,并完成第2次病例报告表。粪便样本在采集后迅速被运送到实验室,并储存在-80 ℃冰箱。
本研究中使用的益生菌为鼠李糖乳酪杆菌CCFM1068。试验过程中以菌条的形式发放给志愿者,每条菌粉2 g,活菌数为1×1010 CFU/条。该菌粉由扬州江大食生一生食品有限公司生产。
1.3 肠道菌群检测
使用FastDNA旋转试剂盒提取粪便DNA,然后进行Illumina MiSeq测序。通用引物对用于16S rRNA基因扩增子测序。从凝胶中收集所有纯化的PCR产物,并使用Qubit dsDNA检测试剂盒进行定量。然后将PCR产物以相等浓度汇集,并在MiSeq PE300平台上进行双端测序。
1.4 数据分析
实验数据均以“平均数±标准差”来表示,并使用R 4.3.3和Gephi 0.10.1软件进行绘图。组间采用非参数Wilcoxon秩和检验进行差异的计算,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 人群临床指标
在访问期间,25名志愿者中有6人不符合纳入标准,2人拒绝签署知情同意书,共纳入17人进行益生菌干预。在干预期间,6人由于依从性差而脱落,最终完成整个实验的志愿者共11人。将干预前(B1)与干预1周(W1)、干预2周(W2)、干预3周(W3)和干预4周(B2)4个时间点的便秘患者临床指标均进行差异分析(表1)。结果显示,B1与B2两组之间的BSFS、SBM和PAC-QOL评分之间具有显著差异(图1)(P<0.05)。此外,B1与W3的BSFS和SBM也出现显著差异(图1-a、图1-b)。PAC-SYM评分虽无显著差异,但在干预后的4周内PAC-SYM具有下降的趋势。这些结果表明,随着服用CCFM1068时间的增加,逐渐改善了便秘患者的便秘症状和生活质量。
表1 临床指标
Table 1 Clinical indicators
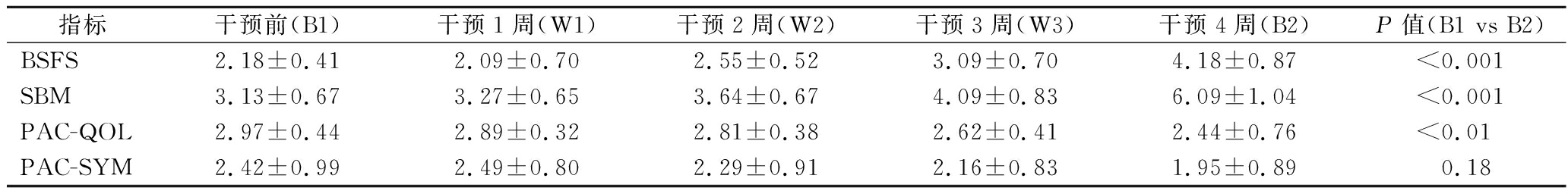
指标干预前(B1)干预1周(W1)干预2周(W2)干预3周(W3)干预4周(B2)P值(B1 vs B2)BSFS2.18±0.412.09±0.702.55±0.523.09±0.704.18±0.87<0.001SBM3.13±0.673.27±0.653.64±0.674.09±0.836.09±1.04<0.001PAC-QOL2.97±0.442.89±0.322.81±0.382.62±0.412.44±0.76<0.01PAC-SYM2.42±0.992.49±0.802.29±0.912.16±0.831.95±0.890.18
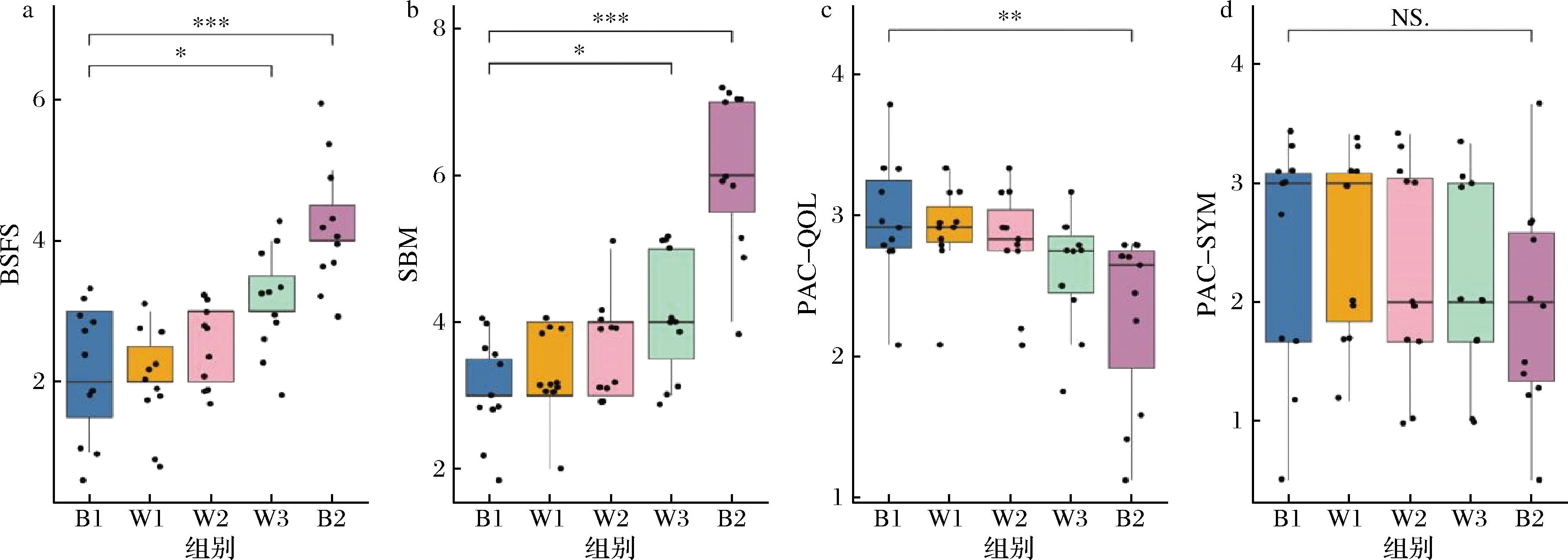
a-BSFS;b-SBM;c-PAC-QOL;d-PAC-SYM
图1 便秘患者的临床指标
Fig.1 Clinical indicators of constipation patients
注:NS.表示无显著差异,P>0.05;*表示P<0.05;**表示P<0.01;***表示P<0.001(下同)。
2.2 CCFM1068对肠道菌群总体结构的影响
使用4个指数(Chao1、ACE、Shannon和Simpson指数)来比较B1组和B2组的α多样性。B2组的Chao1和ACE指数较高,与B1组相比具有显著差异(P<0.05)。但Shannon指数和Simpson指数B1和B2组没有显著差异(图2)。结果表明,鼠李糖乳酪杆菌CCFM1068干预后便秘患者肠道菌群的丰富度升高。
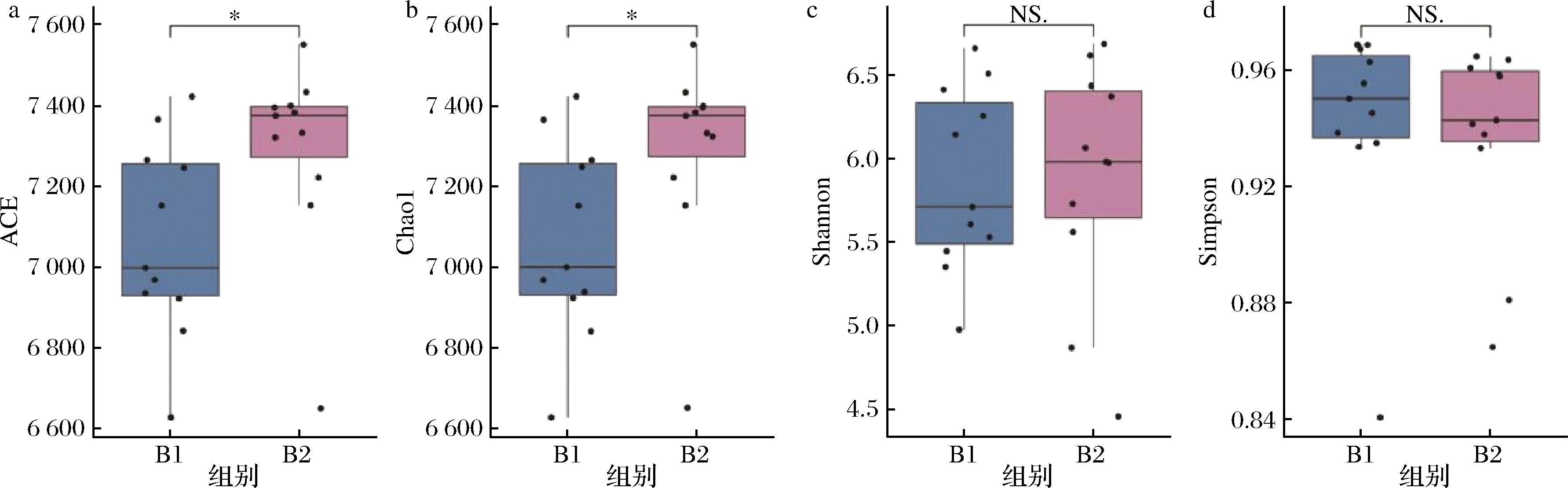
a-ACE;b-Chao1;c-Shannon;d-Simpson
图2 便秘患者肠道菌群的α多样性
Fig.2 The α-diversity of gut microbiota in constipation patients
如图3所示,主坐标分析(principal coordinates analysis,PCoA)表明,干预前B1和干预后B2患者肠道微生物的群落结构不同。进行PERMANOVA差异性检验分析比较2组肠道菌群的整体结构,结果显示2组肠道菌群的组成存在显著差异(P<0.05)。堆积柱状图(图3-b)展示了门水平丰度占比前10的门,相比于干预前B1,CCFM1068干预后,B2组中Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)和Actinobacteria(放线菌门)的丰度显著上升,Bacteroidetes(拟杆菌门)的丰度显著下降。通过计算Firmicutes/Bacteroidetes(F/B),图3-c表明干预后显著提升了F/B的比值(P<0.001)。选取相对丰度前100的科进行可视化作图,并通过Wilcoxon秩和检验计算P值。在科水平上,相比于干预前,干预后便秘患者肠道菌群中Bacteroidaceae(拟杆菌科)、Tannerellaceae(坦纳氏菌科)和Rikenellaceae(理研菌科)的丰度显著下降,Lachnospiraceae(毛螺菌科)和Streptococcaceae(链球菌科)的丰度显著上升(图3-d)。可知,CCFM1068干预显著改变了肠道菌群的结构。

a-肠道菌群PCoA图;b-门水平堆叠柱状图;c-F/B;d-Wilcoxon秩和检验比较科水平差异;e-干预前属水平互作网络图;f-干预后属水平互作网络图
图3 便秘患者肠道菌群的总体组成
Fig.3 Structural composition of the gut microbiota in constipation patients
肠道菌群之间的相互作用影响着人体肠道系统的平衡。因此,根据相对丰度选取前50个最丰富的属,通过Spearman相关性分析来确定干预前B1和干预后B2的核心属(P<0.05和r>|0.3|)。图中点越大,表示与该属相关的菌属就越多。线条的粗细表示相关性的强弱。研究发现,干预前B1的核心属是Clostridioides(拟梭菌属)、Odoribacter、Lachnoclostridium和Ruthenibacterium(图3-e),干预后B2的核心属是Raoultella(拉乌尔菌属)、Erysipelatoclostridium、Citrobacter(柠檬酸杆菌属)和Paraprevotella(图3-f)。可知,鼠李糖乳酪杆菌CCFM1068干预改变了便秘患者的核心菌属。
2.3 CCFM1068干预后差异菌群的筛选
使用LEfSe分析确定了干预前后的差异微生物。系统发育树显示,这些差异微生物主要聚集在Firmicutes和Bacteroidetes的分支上(图4-a)。以线性判别分析(linear discriminant analysis,LDA)得分>2.5为筛选标准,共得到15个显著差异属(图4-b)。结果显示,CCFM1068干预后Bacteroides(拟杆菌属)、Phocaeicola、Alistipes(另枝菌属)、Parabacteroides(副拟杆菌属)、Odoribacter和Butyricimonas(丁酸单胞菌属)的丰度在便秘人群中显著下降,Dorea、Adlercreutzia(安德克氏菌属)、Megamonas(巨单胞菌属)、Mediterraneibacter、Clostridium(梭菌属)、Anaerobutyricum、Streptococcus(链球菌属)、Raoultella和Escherichia(埃希氏菌属)的丰度显著上升。
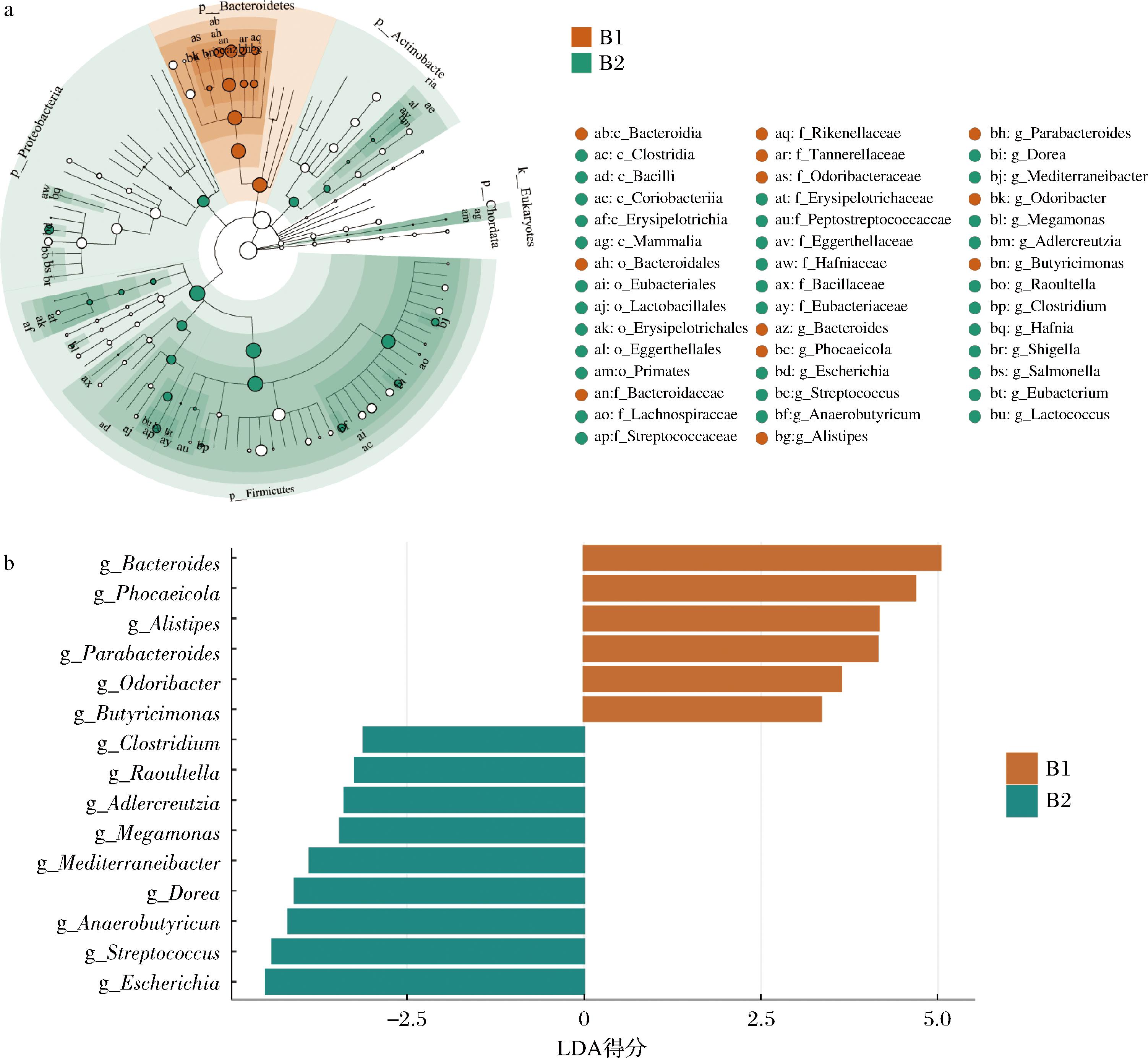
a-肠道菌群LEfSe图;b-LDA得分
图4 便秘患者肠道菌群的总体组成
Fig.4 Structural composition of the gut microbiota in constipation patients
2.4 相关性分析
将上述15个差异属与BSFS、SBM、PAC-QOL和PAC-SYM进行Spearman相关性分析(图5)。结果显示,CCFM1068干预后下调的6个属(Bacteroides、Phocaeicola、Alistipes、Parabacteroides、Odoribacter和Butyricimonas)均与BSFS分值呈显著负相关;上调的9个属均与BSFS呈显著正相关。已知BSFS的分值越小,便秘越严重。与其呈现负相关的菌,理论上则是造成便秘的关键菌。而鼠李糖乳酪杆菌CCFM1068则显著下调了这些菌的相对丰度(Bacteroides、Phocaeicola、Alistipes、Parabacteroides、Odoribacter和Butyricimonas)。同理,与BSFS分值呈显著正相关的菌,则是缓解便秘的特征菌群。而鼠李糖乳酪杆菌CCFM1068则显著上调了这些菌的相对丰度(Dorea、Raoultella、Adlercreutzia、Megamonas、Mediterraneibacter、Clostridium、Anaerobutyricum、Streptococcus和Escherichia)。
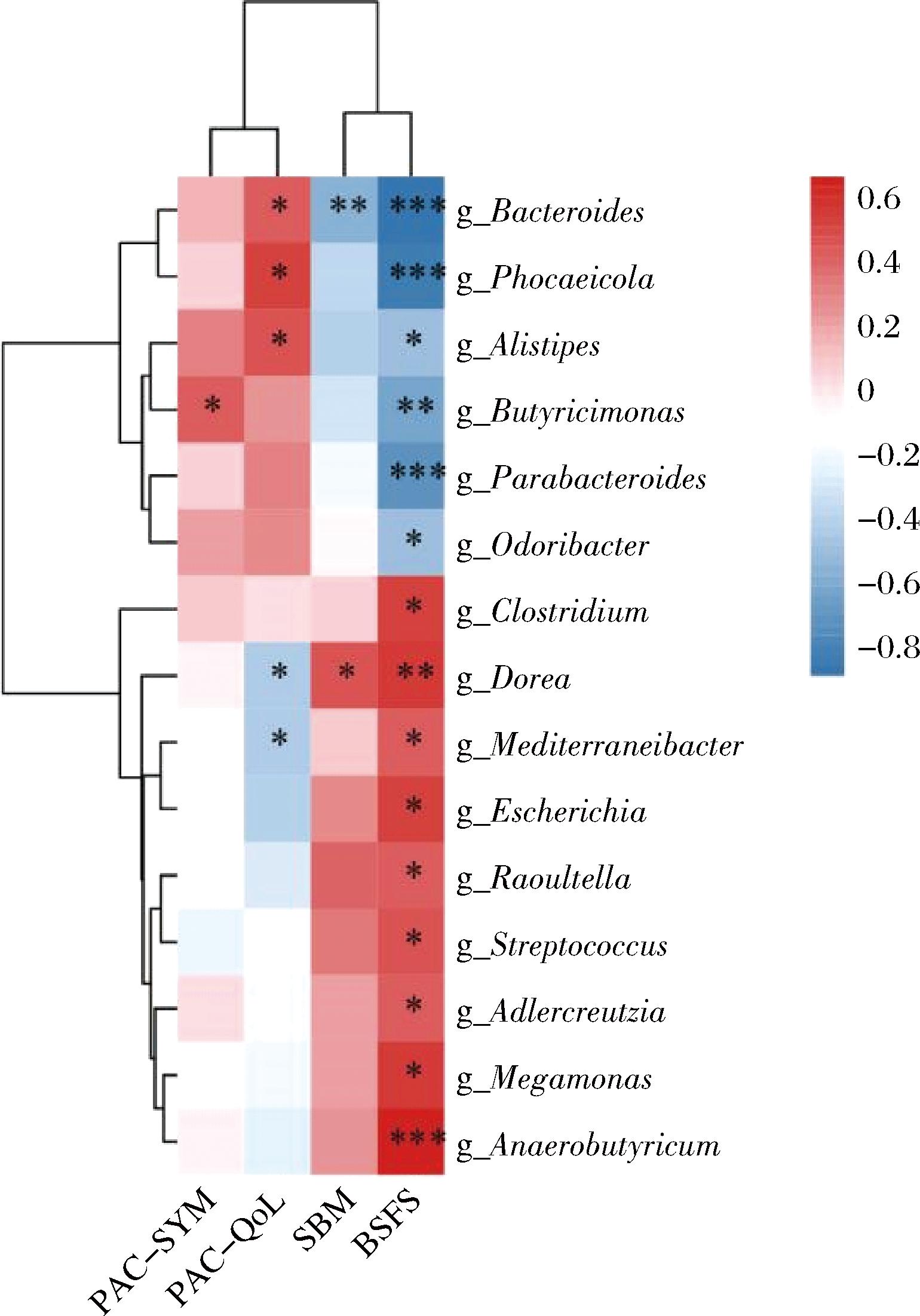
图5 相关性分析
Fig.5 Correlation analysis
由此可知,鼠李糖乳酪杆菌CCFM1068可通过下调Bacteroides、Phocaeicola、Alistipes、Parabacteroides、Odoribacter和Butyricimonas的丰度,上调Dorea、Raoultella、Adlercreutzia、Megamonas、Mediterraneibacter、Clostridium、Anaerobutyricum、Streptococcus和Escherichia的丰度,改变了粪便的性状,降低粪便硬度,从而达到缓解便秘的目的。
3 讨论
本实验中探究了服用4周鼠李糖乳酪杆菌CCFM1068对便秘患者的益处。尤其关注其对肠道微生物群落结构、粪便性状、排便频率和患者生活质量的影响。
研究结果表明,便秘患者服用鼠李糖乳酪杆菌CCFM1068后显著改善了BSFS、SBM和PAC-QOL,这与MA等[10]的研究一致。支持了鼠李糖乳酪杆菌CCFM1068在便秘治疗中的潜在益处。
肠道菌群分析表明,CCFM1068干预显著影响了便秘患者的肠道菌群组成。干预后,肠道菌群的Chao1指数和ACE指数显著增加,表明CCFM1068能提高菌群的多样性,可能有助于恢复其生态平衡。此外,PCoA(基于Bray-Curtis距离指数)显示,CCFM1068干预后,肠道菌群的整体组成发生了显著变化。
研究还发现,CCFM1068干预后,Firmicutes的丰度显著上调,而Bacteroidetes的丰度显著下降,这一结果与多项研究相一致。已有文献表明,与健康人相比,便秘患者的Bacteroidetes丰度往往较高,且Firmicutes丰度通常较低[20-21]。通过调节F/B比值,CCFM1068可能恢复了便秘患者肠道菌群的平衡。
在相关性分析中,Bacteroides与BSFS和SBM呈显著负相关,与PAC-QOL显著正相关。Bacteroides的过度生长与肠道润滑功能的丧失和肠道屏障的破坏密切相关[22]。已有研究表明,Bacteroides的增殖可能会降低肠道转运速度,导致便秘症状的加重[23-24]。在本研究中,CCFM1068通过下调Bacteroides的丰度,进而改善了便秘症状。下一步拟通过设计Bacteroides的种特异性引物,进一步观察鼠李糖乳酪杆菌CCFM1068主要下调的是哪一个种的相对丰度,确定引起便秘的特征种。相反,CCFM1068显著上调了Dorea、Clostridium、Anaerobutyricum、Raoultella、Adlercreutzia、Megamonas、Mediterraneibacter、Streptococcus和Escherichia的丰度。这些菌种的上调可能进一步促进了肠道微生物平衡和正常功能。其中,Dorea已被证实在肠道菌群平衡中发挥关键作用。Dorea通过促进短链脂肪酸的产生,从而加快肠道蠕动和排便,同时增加肠道内液体分泌,改善肠道免疫反应[25-26]。短链脂肪酸通过作用于肠嗜铬细胞,促进血清素的合成[27]。血清素是肠道运动和分泌的关键调节因子,能够促进结肠的运动[28]。在我们的研究中,Dorea与BSFS和SBM呈显著正相关,进一步支持了其在便秘缓解中的潜在作用。此外,Clostridium和Anaerobutyricum已被证明具有产短链脂肪酸和调节肠道屏障的潜力,从而有助于改善便秘症状[29-30]。
综上所述,鼠李糖乳酪杆菌CCFM1068通过显著调节肠道微生物的组成,恢复了肠道菌群的平衡,进而改善了便秘患者的临床症状,包括增加排便次数、改善粪便硬度,并显著提高了患者的生活质量。这些发现不仅进一步验证了益生菌在便秘治疗中的作用,也为将益生菌作为一种有效的干预手段提供了有力的证据。
4 结论
本研究探讨了鼠李糖乳酪杆菌CCFM1068在便秘人群干预实验中的作用,重点评估其对肠道微生物群落结构、粪便性状、排便次数及患者生活质量的影响。结果显示,CCFM1068通过下调Bacteroides、Phocaeicola、Alistipes、Parabacteroides、Odoribacter和Butyricimonas的丰度,上调Dorea、Clostridium、Anaerobutyricum、Raoultella、Adlercreutzia、Megamonas、Mediterraneibacter、Streptococcus和Escherichia的丰度,从而改善粪便硬度,增加排便次数,提高便秘患者的生活质量。
研究为益生菌在改善肠道健康和生活质量方面的潜在应用提供了新的证据。未来的研究应进一步探讨这一机制,并评估在不同人群中的应用潜力,为便秘及相关肠道疾病的干预提供新的策略和理论依据。
[1] 张升彦, 张磊, 朱良如, 等.基于肠道菌群的慢性便秘治疗进展[J].临床消化病杂志, 2022, 34(2):149-152.ZHANG S Y, ZHANG L, ZHU L R, et al.Progress in treatment of chronic constipation based on intestinal flora[J].Chinese Journal of Clinical Gastroenterology, 2022, 34(2):149-152.
[2] LAI H, LI Y F, HE Y F, et al.Effects of dietary fibers or probiotics on functional constipation symptoms and roles of gut microbiota:A double-blinded randomized placebo trial[J].Gut Microbes, 2023, 15(1):2197837.
[3] WANG J K, YAO S K.Roles of gut microbiota and metabolites in pathogenesis of functional constipation[J].Evidence-Based Complementary and Alternative Medicine, 2021, 2021(1):5560310.
[4] ZHANG S S, WANG R X, LI D Y, et al.Role of gut microbiota in functional constipation[J].Gastroenterology Report, 2021, 9(5):392-401.
[5] PAN R L, WANG L L, XU X P, et al.Crosstalk between the gut microbiome and colonic motility in chronic constipation:Potential mechanisms and microbiota modulation[J].Nutrients, 2022, 14(18):3704.
[6] CLEMENTE J C, URSELL L K, PARFREY L W, et al.The impact of the gut microbiota on human health:An integrative view[J].Cell, 2012, 148(6):1258-1270.
[7] WANG J L, WANG L L, YU Q Q, et al.Characteristics of the gut microbiome and serum metabolome in patients with functional constipation[J].Nutrients, 2023, 15(7):1779.
[8] MANCABELLI L, MILANI C, LUGLI G A, et al.Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses[J].Scientific Reports, 2017, 7:9879.
[9] 王玥, 蒋葵.阿片类药物引起的便秘病理机制及治疗进展[J].中国肿瘤临床, 2021, 48(16):852-857.WANG Y, JIANG K.Progress in pathological mechanism and therapy of opioid-induced constipation[J].Chinese Journal of Clinical Oncology, 2021, 48(16):852-857.
[10] MA T, YANG N, XIE Y, et al.Effect of the probiotic strain, Lactiplantibacillus plantarum P9, on chronic constipation:A randomized, double-blind, placebo-controlled study[J].Pharmacological Research, 2023, 191:106755.
[11] MARTIN F P, COMINETTI O, BERGER B, et al.Metabolome-associated psychological comorbidities improvement in irritable bowel syndrome patients receiving a probiotic[J].Gut Microbes, 2024.16(1):2347715.
[12] MITELM O F C R, BERGAMASCHI C C, GERENUTTI M, et al.The effect of probiotics on functional constipation in adults:Double-blind, randomized, placebo-controlled study[J].Medicine, 2021, 100(10):e24938.
O F C R, BERGAMASCHI C C, GERENUTTI M, et al.The effect of probiotics on functional constipation in adults:Double-blind, randomized, placebo-controlled study[J].Medicine, 2021, 100(10):e24938.
[13] DEL PIANO M, CARMAGNOLA S, ANDERLONI A, et al.The use of probiotics in healthy volunteers with evacuation disorders and hard stools:A double-blind, randomized, placebo-controlled study[J].Journal of Clinical Gastroenterology, 2010, 44(Suppl 1):S30-S34.
[14] SAAD R J, RAO S S C, KOCH K L, et al.Do stool form and frequency correlate with whole-gut and colonic transit? Results from a multicenter study in constipated individuals and healthy controls[J].The American Journal of Gastroenterology, 2010, 105(2):403-411.
[15] PETROF E O.Probiotics and gastrointestinal disease:Clinical evidence and basic science[J].Anti-Inflammatory &Anti-Allergy Agents in Medicinal Chemistry, 2009, 8(3):260-269.
[16] LEE E S, SONG E J, NAM Y D, et al.Probiotics in human health and disease:From nutribiotics to pharmabiotics[J].Journal of Microbiology, 2018, 56(11):773-782.
[17] KOH H, LEE M J, KIM M J, et al.Simple diagnostic approach to childhood fecal retention using the Leech score and Bristol stool form scale in medical practice[J].Journal of Gastroenterology and Hepatology, 2010, 25(2):334-338.
[18] DU Y T, LI Y, XU X J, et al.Probiotics for constipation and gut microbiota in Parkinson’s disease[J].Parkinsonism &Related Disorders, 2022, 103:92-97.
[19] JANSSENDUIJGHUIJSEN L, VAN DEN BELT M, RIJNAARTS I, et al.Acacia fiber or probiotic supplements to relieve gastrointestinal complaints in patients with constipation-predominant IBS:A 4-week randomized double-blinded placebo-controlled intervention trial[J].European Journal of Nutrition, 2024, 63(5):1983-1994.
[20] LI H X, CHEN J W, REN X J, et al.Gut microbiota composition changes in constipated women of reproductive age[J].Frontiers in Cellular and Infection Microbiology, 2021, 10:557515.
[21] GUO M Q, YAO J F, YANG F, et al.The composition of intestinal microbiota and its association with functional constipation of the elderly patients[J].Future Microbiology, 2020, 15(3):163-175.
[22] ZAFAR H, SAIER JR M H.Gut Bacteroides species in health and disease[J].Gut Microbes, 2021, 13(1):1-20.
[23] PARTHASARATHY G, CHEN J, CHEN X F, et al.Relationship between microbiota of the colonic mucosa vs feces and symptoms, colonic transit, and methane production in female patients with chronic constipation[J].Gastroenterology, 2016, 150(2):367-379.
[24] WOLF P G, PARTHASARATHY G, CHEN J, et al.Assessing the colonic microbiome, hydrogenogenic and hydrogenotrophic genes, transit and breath methane in constipation[J].Neurogastroenterology &Motility, 2017, 29(10):e13056.
[25] SAN-JUAN-VERGARA H, ZUREK E, AJAMI N J, et al.A Lachnospiraceae-dominated bacterial signature in the fecal microbiota of HIV-infected individuals from Colombia, South America[J].Scientific Reports, 2018, 8:4479.
[26] BIENENSTOCK J, KUNZE W, FORSYTHE P.Microbiota and the gut-brain axis[J].Nutrition Reviews, 2015, 73(suppl 1):28-31.
[27] ZHANG T, LIU W X, LU H M, et al.Lactic acid bacteria in relieving constipation:Mechanism, clinical application, challenge, and opportunity[J].Critical Reviews in Food Science and Nutrition, 2025, 65(3):551-574.
[28] REIGSTAD C S, SALMONSON C E, RAINEY J F, et al.Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells[J].The FASEB Journal, 2015, 29(4):1395-1403.
[29] DI VINCENZO F, DEL GAUDIO A, PETITO V, et al.Gut microbiota, intestinal permeability, and systemic inflammation:A narrative review[J].Internal and Emergency Medicine, 2024, 19(2):275-293.
[30] WHITE M T, SEARS C L.The microbial landscape of colorectal cancer[J].Nature Reviews Microbiology, 2023, 22(4):240-254.