大足冬菜属于叶芥菜[Brassica juncea(L.)Czern.],是十字花科芸薹属(Brassica)植物,最常作为食品原材料进行煎炸或腌制[1],也常作为直接食用的佐餐小菜。大足冬菜采用传统手工腌制,以叶芥菜中的乌叶菜这一品种为原料,通过原料采收、精选、上架风干脱水(剩余新鲜芥菜25%的质量)、下架,与风干叶用芥菜质量比20∶1的食盐揉搓腌制,密封装坛,次日开坛重复腌制,前后反复7 d,之后再入坛压紧密封,露天发酵3~4年,包装成品。
作为大足冬菜原材料的叶芥菜价格低廉,营养价值高,它具有一些生物活性成分,如硫代葡萄糖苷及其降解产物和多酚(类黄酮和花青素),大量的膳食纤维、叶绿素、β-胡萝卜素和抗坏血酸、矿物质和挥发性成分[2],新鲜叶芥菜和发酵叶芥菜均已被证实有抗氧化活性、抗炎作用[3]、抗癌[4-5]和预防疾病的作用[6]。截止2023年,全国芥菜需求量日益增加,年栽培面积近100 hm2,产量4 500万t,产值达到2 000亿元,已经成为了新兴发酵行业的重要原材料。像大多数芸薹属植物一样,叶芥菜有特殊香气和口味,这取决于其中含有的香气成分和非挥发性化合物。目前对大足冬菜中的香气成分有不少研究,如异硫氰酸酯类[7],这是新鲜叶芥菜中含量最多的物质[8],也是其辛辣和苦味的主要来源[9]。
代谢组学是一种对生物体内所有代谢物进行定量分析的研究方法[10]。代谢组学的研究分为靶向代谢和非靶向代谢分析[11]。由于非靶向代谢具有不针对某一类特定的代谢物,将样本中所有检测到的小分子代谢物进行比较分析进而研究代谢过程这一特点[12],常常用来大规模筛选参与样品代谢过程的关键化合物。本实验研究不同发酵年份大足冬菜非挥发性化合物变化和代谢情况,适合使用LC-MS非靶向代谢检测方法[13]。LC-MS具有高分辨率,检测动态范围宽等优点。同时添加的质控样品也可以提高实验的可信度,尤其是监测渐进和突然性的变化[14]。
1 材料与方法
1.1 材料与试剂
0~4年发酵年份大足冬菜,重庆市大足区重庆鑫轩冬菜股份合作社;甲醇、乙腈、甲酸、纯水、丙醇,色谱纯,美国Fisher公司。
1.2 仪器与设备
超高效液相色谱串联傅里叶变换质谱,美国赛默飞世尔公司;JXDC-20型氮气吹扫仪,上海净信实业发展有限公司;LNG-T88型台式快速离心浓缩干燥器,太仓市华美生化仪器厂。
1.3 实验方法
1.3.1 叶芥菜选用
实验使用大足冬菜由重庆市大足区重庆鑫轩冬菜股份合作社提供。以当地新鲜叶芥菜中的乌叶菜为原料。
1.3.2 采样及样品前处理
根据厂家装罐记录挑选不同发酵年份的大足冬菜,每个发酵年份大足冬菜随机选择3个发酵罐,分别从发酵罐上中下部采集200 g样品,将样品使用液氮快速冷冻处理后切成小块,将每一年大足冬菜混匀,发酵大足冬菜采样年份为0、1、2、3、4年,每年采集3个样品。将样本送至上海美吉生物有限公司进行测试。
1.3.3 色谱条件
色谱柱:HSS T3色谱柱(100 mm×2.1 mm i.d., 1.8 μm);流动相A为95%水+5%乙腈,流动相B为47.5%乙腈+47.5%异丙醇+5%水。流动相A、B都含0.1%甲酸(以上均为体积分数)。
1.3.4 质谱条件
采用正负离子扫描模式。辅助气加热温度为425 ℃,毛细管温度为325 ℃,正模式离子喷雾电压为3 500 V,负模式离子喷雾电压为-3 500 V[15]。
1.4 数据分析
利用软件 Progenesis QI进行基线过滤、峰识别、积分、保留时间校正和峰对齐等处理步骤,生成包含保留时间、质荷比和峰强度数据的矩阵。然后对预处理后的数据矩阵进行主成分分析(principal component analysis,PCA)和偏最小二乘判别方法(partial least squares discriminant analysis,PLS-DA)。同时参考公共数据库[人类代谢组数据库(Human Metabolome Database,HMDB)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)]分析代谢物组成及参与代谢通路。
2 结果与分析
2.1 样本预处理及统计
共分为5组样品,每组3个重复,a0~c0为z组(发酵0年),a1~c1为o组(发酵1年),a2~c2为t组(发酵2年),a3~c3为h组(发酵3年),a4~c4为f组(发酵4年),同时添加质控组核查数据稳定性,质控组分为3个重复。
检测到的有效峰和鉴定出的代谢物如表1所示,共鉴定出代谢物2 218种,有效峰9 847,其中正离子模式下鉴定出1 194种代谢化合物,负离子模式下鉴定出1 024种代谢化合物。
表1 LC-MS结果汇总及鉴定
Table 1 Summary and identification of LC-MS results

离子模式有效峰(原始)鉴定的代谢物(原始)正离子5 2061 194负离子4 6411 024混合模式9 8472 218
2.2 PCA
通过PCA可将可视化数据集中信息,初步掌握各样本间的总体代谢差异水平及变异度大小。如图1所示。PC1贡献率为34.90%,PC2贡献率为20.20%,各样本均分布在95%置信区间范围且互不交叠,表明不同发酵年份大足冬菜代谢物具有显著差异;质控样本聚集在PCA图中心,表明PCA模型稳定可靠,可以为后续分析提供支撑。
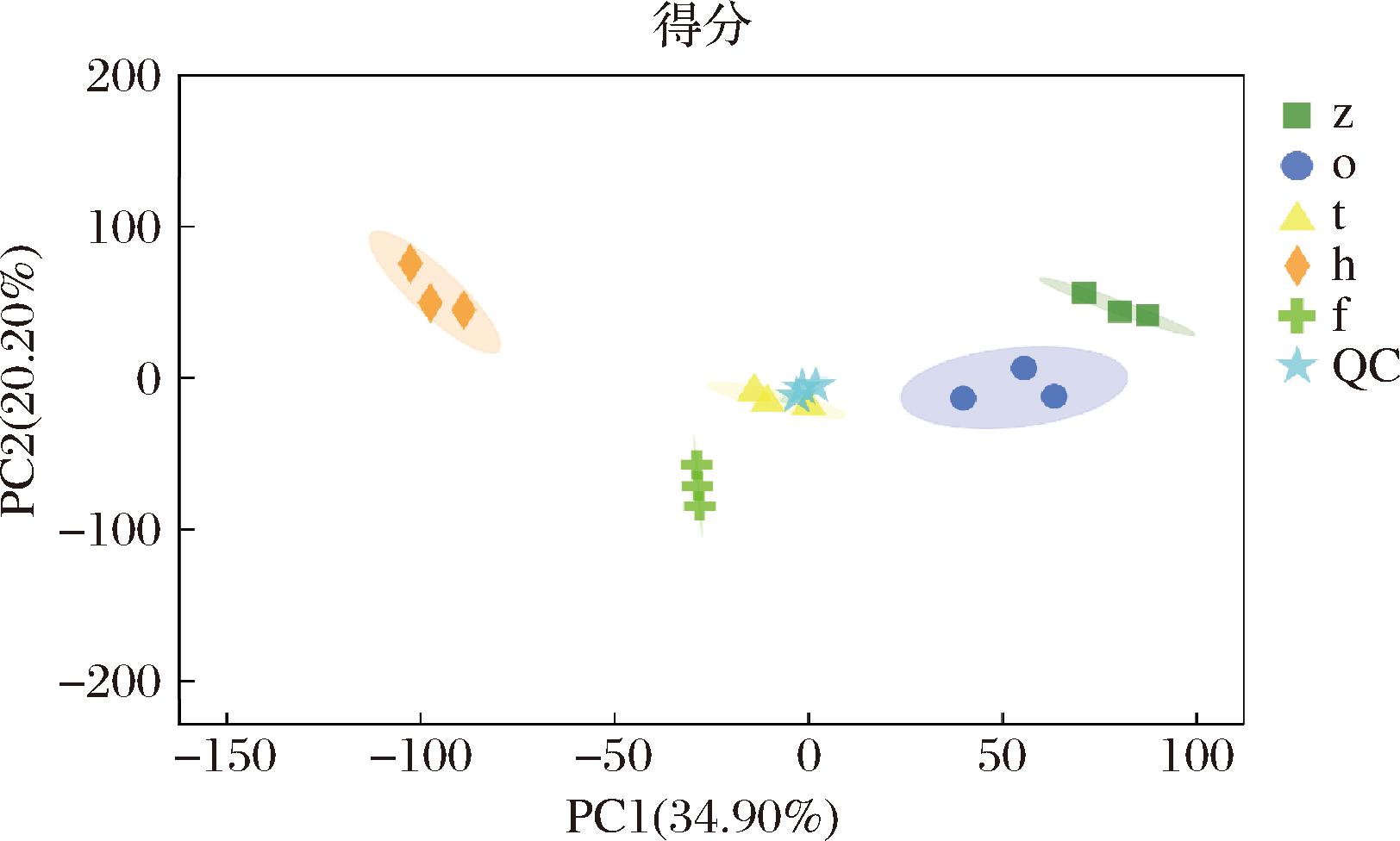
图1 大足冬菜不同发酵年份代谢组学PCA结果
Fig.1 Metabolomic PCA result of Dazu dongcai in different fermentation years
2.3 PLS-DA
二维PLS-DA 得分图常用来直观地展示模型的分类效果,PLS-DA模型概览可对PLS-DA模型的解释能力和预测能力进行评价,如图2、图3所示,各样本均位于置信区内,并且R2Y和Q2累计值不断增加,说明PLS-DA模型稳定可靠。
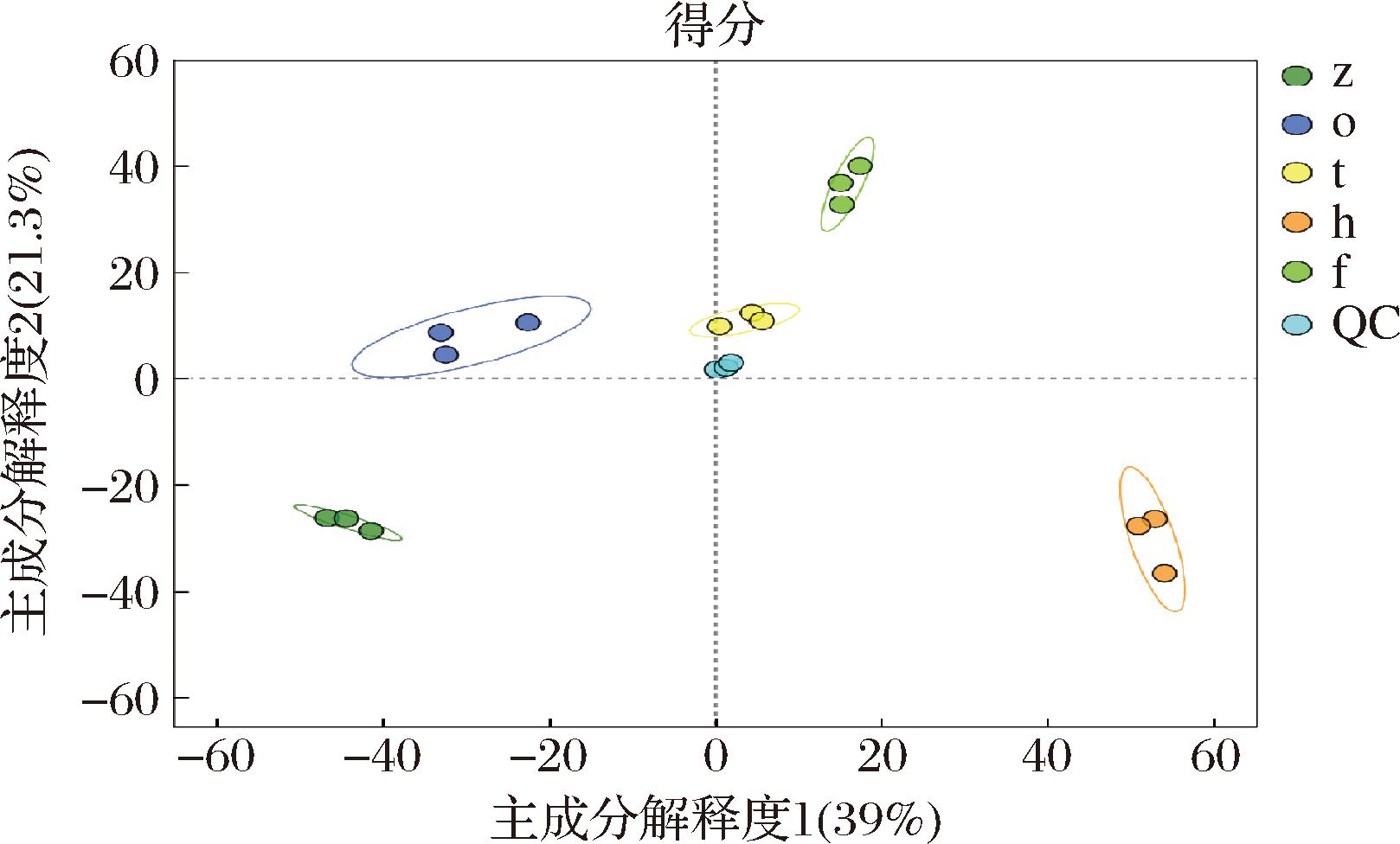
图2 大足冬菜不同发酵年份代谢物PLS-DA得分图
Fig.2 PLS-DA scores of metabolites in different fermentation years of Dazu dongcai
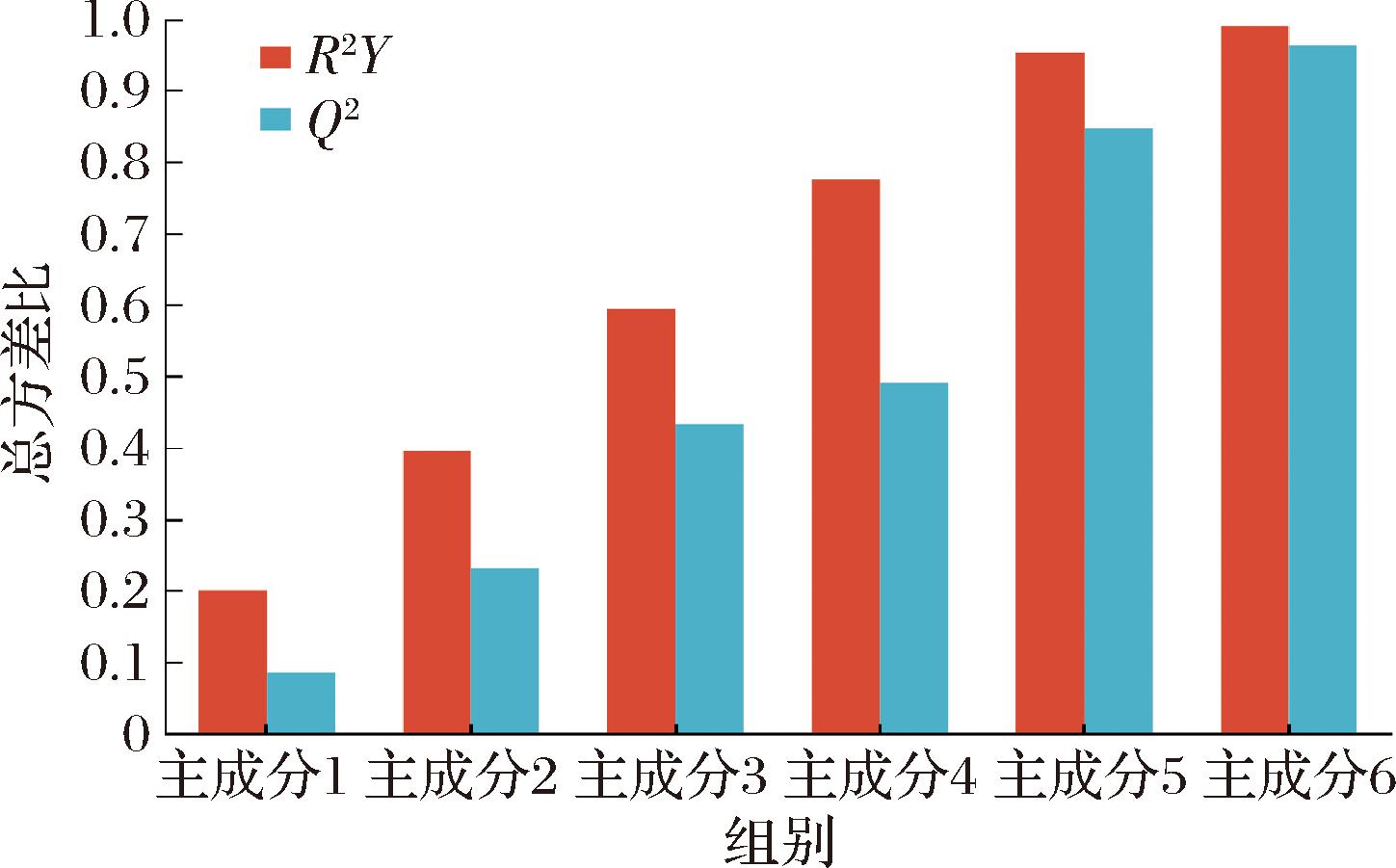
图3 大足冬菜不同发酵年份代谢物PLS-DA模型概览
Fig.3 Overview of PLS-DA models of metabolites in different fermentation years of Dazu dongcai
2.4 差异代谢物HMDB化合物分类
HMDB(https://hmdb.ca)包含了人体内发现的小分子代谢物的详细信息,该数据库包含 220 945 个代谢物条目,8 610 个蛋白质序列(酶和转运蛋白)与这些代谢物条目有关。通过比对HMDB,共鉴定出15类共1 527种代谢物质,如图4所示,其中有机酸及其衍生物占比28.88%、脂质和脂质样分子占比18.66%、有机杂环化合物占比18.60%,位于鉴定出HMDB的化合物种类前三。
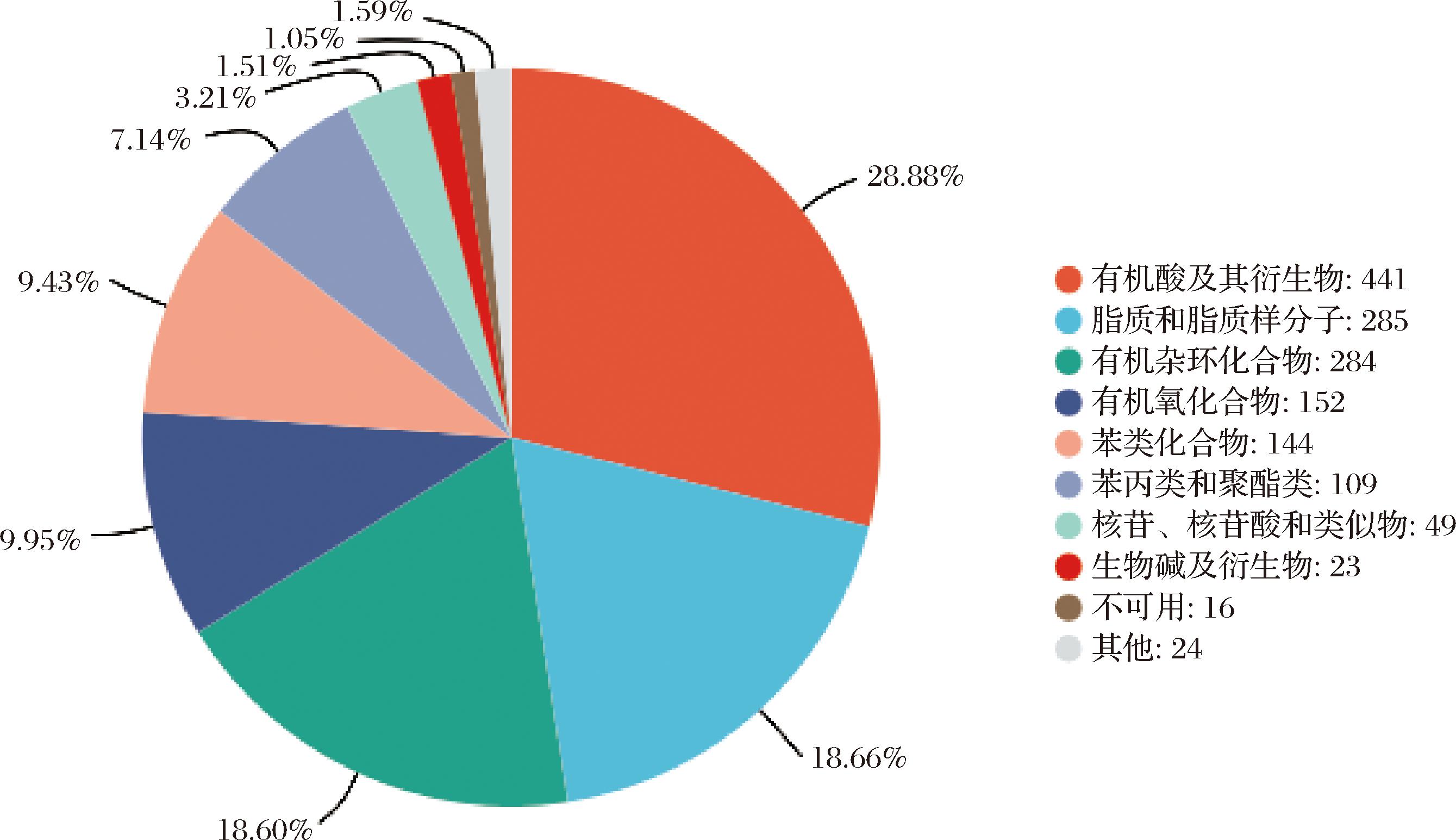
图4 大足冬菜HMDB代谢物分类统计
Fig.4 Classification statistics of HMDB metabolites in Dazu dongcai
2.5 KEGG通路富集分析
如图5所示,对大足冬菜不同发酵年份差异代谢物进行KEGG通路富集分析,有21条通路具有显著差异,分别为:缬氨酸、亮氨酸和异亮氨酸生物合成,黄酮和黄酮醇生物合成,辅因子的生物合成,精氨酸和脯氨酸代谢,角质、软脂和蜡生物合成,β-丙氨酸代谢,硫辛酸代谢,甜菜碱生物合成,苯丙氨酸代谢,赖氨酸生物合成,组氨酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙烷生物合成,核苷酸代谢,叶酸生物合成,D-氨基酸代谢,烟酸和烟酰胺代谢,莨菪烷、哌啶和吡啶生物碱的生物合成,赖氨酸降解,酪氨酸代谢,色氨酸代谢。这些代谢途径中共有276种代谢物,其中山柰酚3-麦冬皂苷、4-胍基丁酸、4-氨基-4-脱氧分支酸、酵母氨酸、2-氨基己二酸、N-阿魏酰基-1,4-丁二胺、寻霉素A、咪唑丙酸、N6-乙酰-L-赖氨酸、L-胱硫醚、哌可酸、芸香苷、紫云英苷、L-4-羟基谷氨酸半醛、阿福豆苷、莰非醇-3-O-葡糖苷、2-异丙基苹果酸、山奈酚3-O-槐糖苷、槲皮素等差异代谢物改变较大。
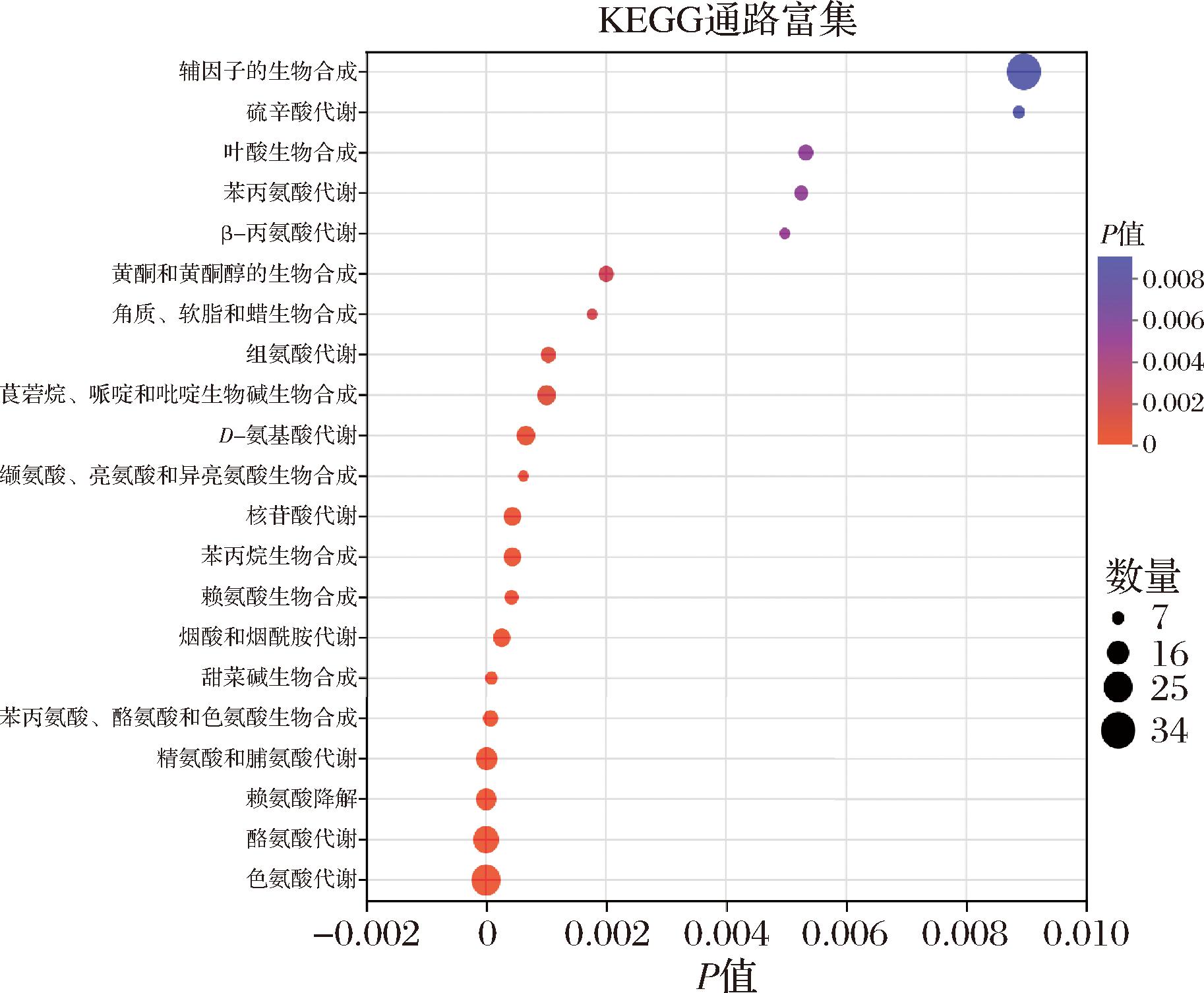
图5 大足冬菜不同发酵年份差异代谢物KEGG分析
Fig.5 KEGG analysis of differential metabolites in different fermentation years of Dazu dongcai
在上述具有显著差异的代谢通路中,氨基酸代谢活动活跃,仅呈味氨基酸就有L-谷氨酸和L-苯丙氨酸,还存在许多呈味氨基酸前体物质和代谢物质,如前酪氨酸、L-天冬氨酸半醛等,这些化合物的活跃代谢成就了发酵大足冬菜的特殊风味[16]。参与苯丙烷生物合成的芥子酸有抗菌、抗癌、抗炎[17-19]等作用。另外,发酵大足冬菜中酸类物质代谢也十分活跃,如:抗坏血酸、琥珀酸、棕榈酸、延胡索酸、异丙基苹果酸等,这些酸类物质相互作用,影响使用者对酸甜苦辣咸的感知程度[20]。参与甜菜碱生物合成的差异代谢物有多巴胺、多巴胺醌、左旋多巴、苋菜红苷、亮氨酸氨基色素、甜菜醛氨酸、白细胞色素、3-甲氧酪氨,在酪氨酸代谢过程中,酪氨酸通过酪氨酸羟基化反应转化为左旋多巴,进入甜菜碱生物合成,如图6所示,红点代表上述检测出的差异代谢物,且相对丰度均上调,参与甜菜碱生物合成的部分物质可以作为安全无毒的食用色素。左旋多巴可以转化成多巴胺又进一步氧化为多巴胺醌[21]。多巴胺是人类生存不可缺少的一种物质,可以调节对其他神经递质的敏感性[22]。
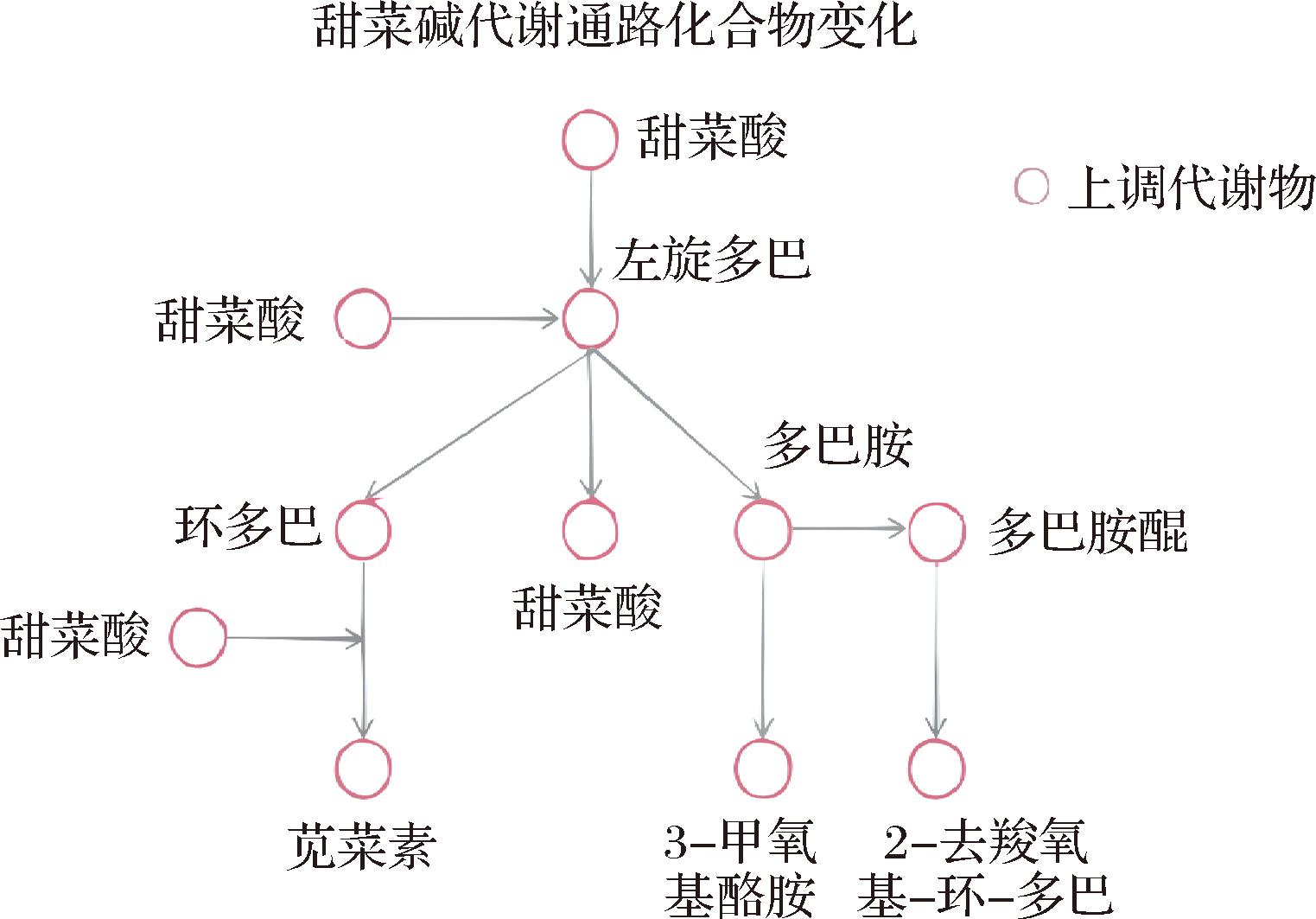
图6 甜菜碱生物合成通路
Fig.6 Betalain biosynthesis pathway
2.6 差异代谢物Venn分析
Venn图可展示代谢集间代谢物数量的改变,表明实验各阶段诱导了哪些代谢物发生变化。如图7所示,柱状图显示了比较组总代谢物数目,其中f_vs_z代谢物数目为840、h_vs_t代谢物数目为649、o_vs_z代谢物数目为755、f_vs_h代谢物数目为669、t_vs_o代谢物数目为771。其中有48种代谢物为各比较组共同差异代谢物,不同年份比较组独有代谢物数目呈现先上升后下降的趋势。
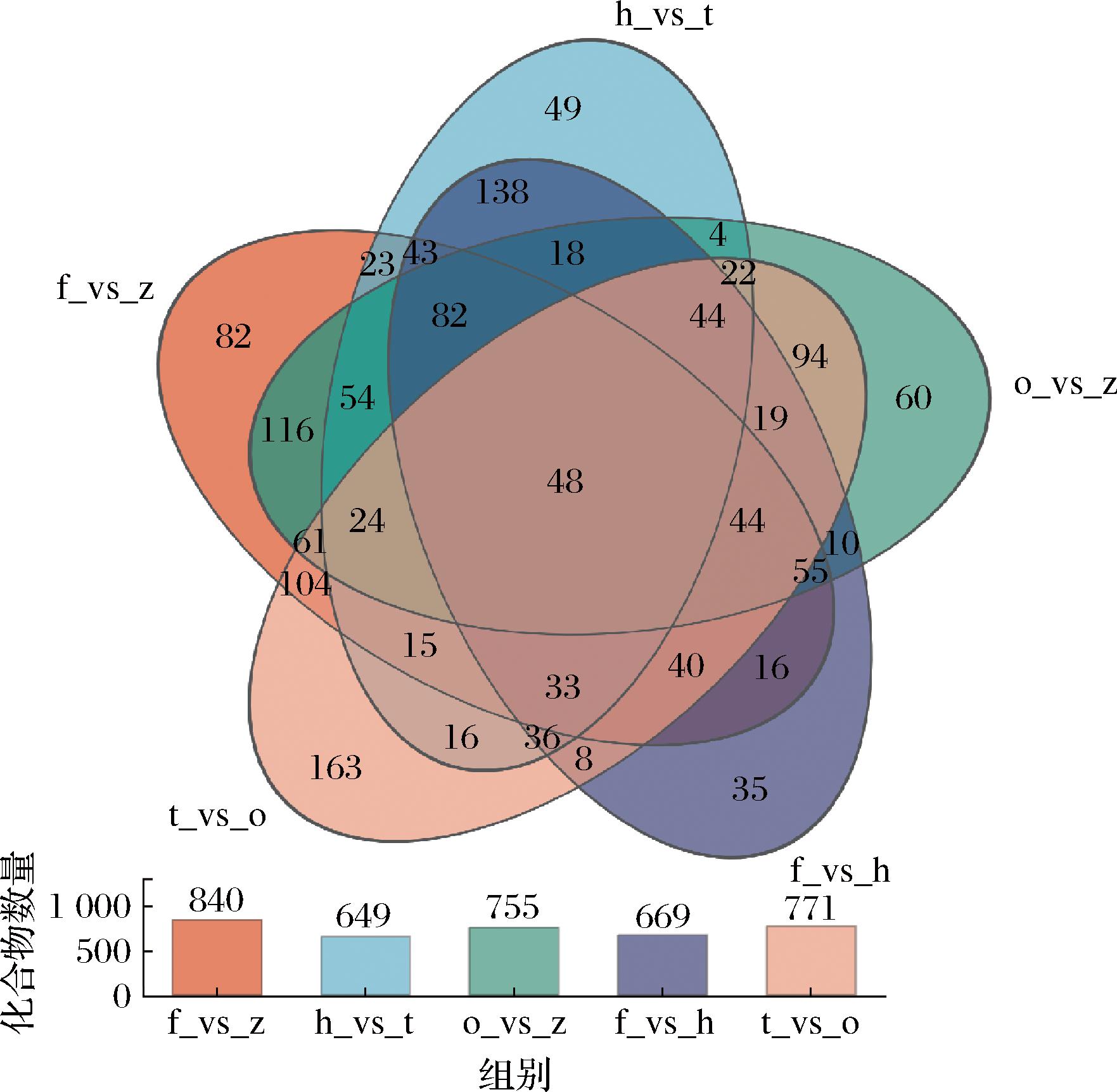
图7 大足冬菜差异代谢化合物Venn图
Fig.7 Venn diagram of differentially metabolic compound in Dazu dongcai
2.7 差异代谢物聚类分析
对大足冬菜不同发酵年份的差异代谢物进行聚类分析,如图8所示,将样本和代谢物都进行聚类,根据颜色的深浅不同可判断代谢物相对表达量的大小,同一组的重复样品之间代谢物差异较小,同一化合物在不同组间相对表达量改变较大。
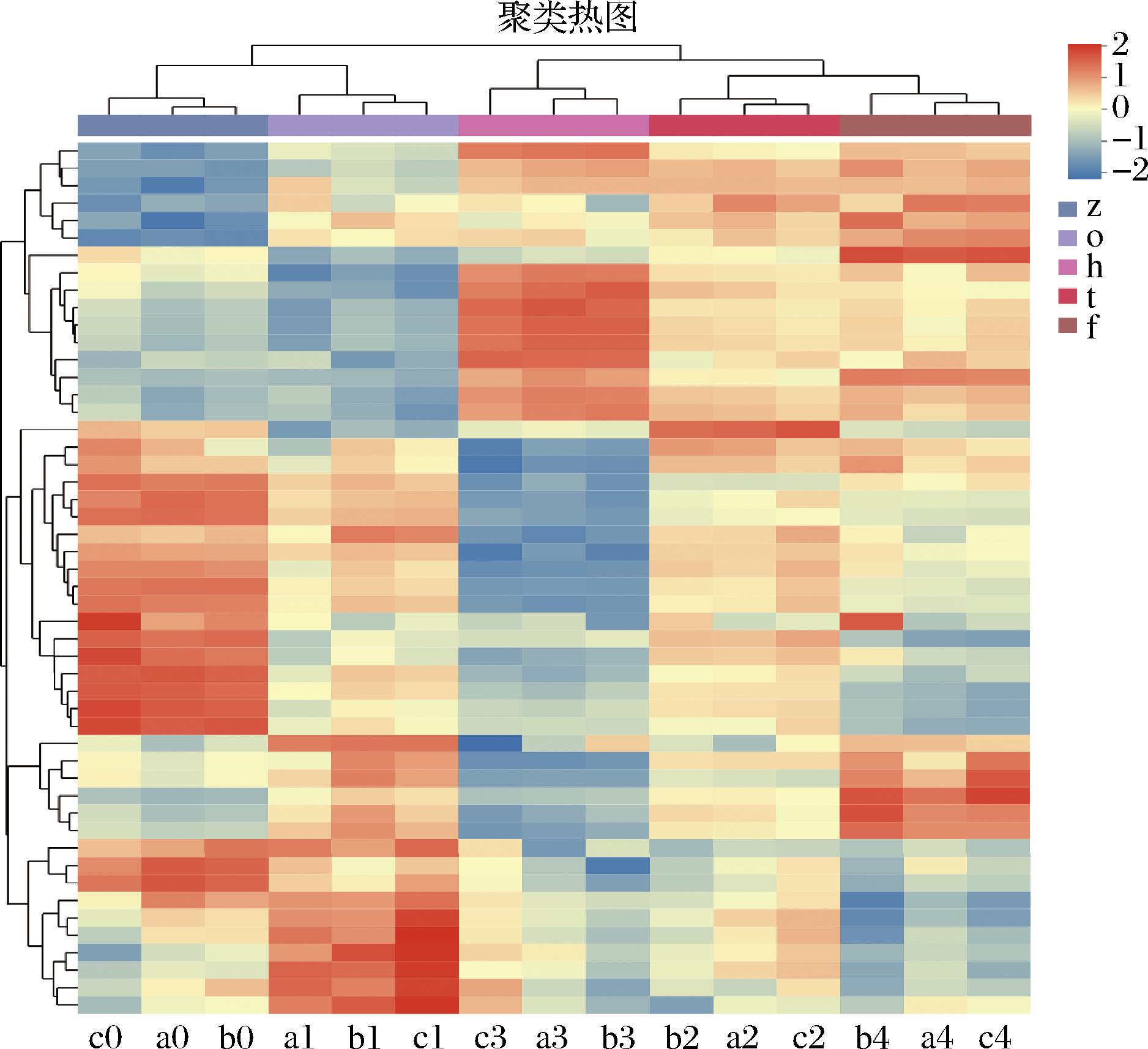
图8 不同发酵年份大足冬菜差异化合物聚类热图
Fig.8 Heat map for clustering of differential compounds in Dazu dongcai in different fermentation years
2.8 显著差异代谢物的筛选
在正负离子模式下,大足冬菜不同发酵年份共筛选出1 668种差异代谢物,如图9所示,从o_vs_z、O_vs_t、h_vs_t、f_vs_h各比较组中筛选出差异代谢化合物数目,分别为755、771、649、669种。结果表明,大足冬菜发酵期间差异代谢物数量呈波动趋势,发酵0年到2年的上调差异代谢物呈上升趋势,发酵2年上调差异代谢物数量最多,发酵3年时上调差异代谢物下降,在发酵4年时上调差异代谢物上升。下调差异代谢物数量也呈现波动趋势,在2年和4年时下调差异代谢物减少,1年和3年时下调差异代谢物增加。
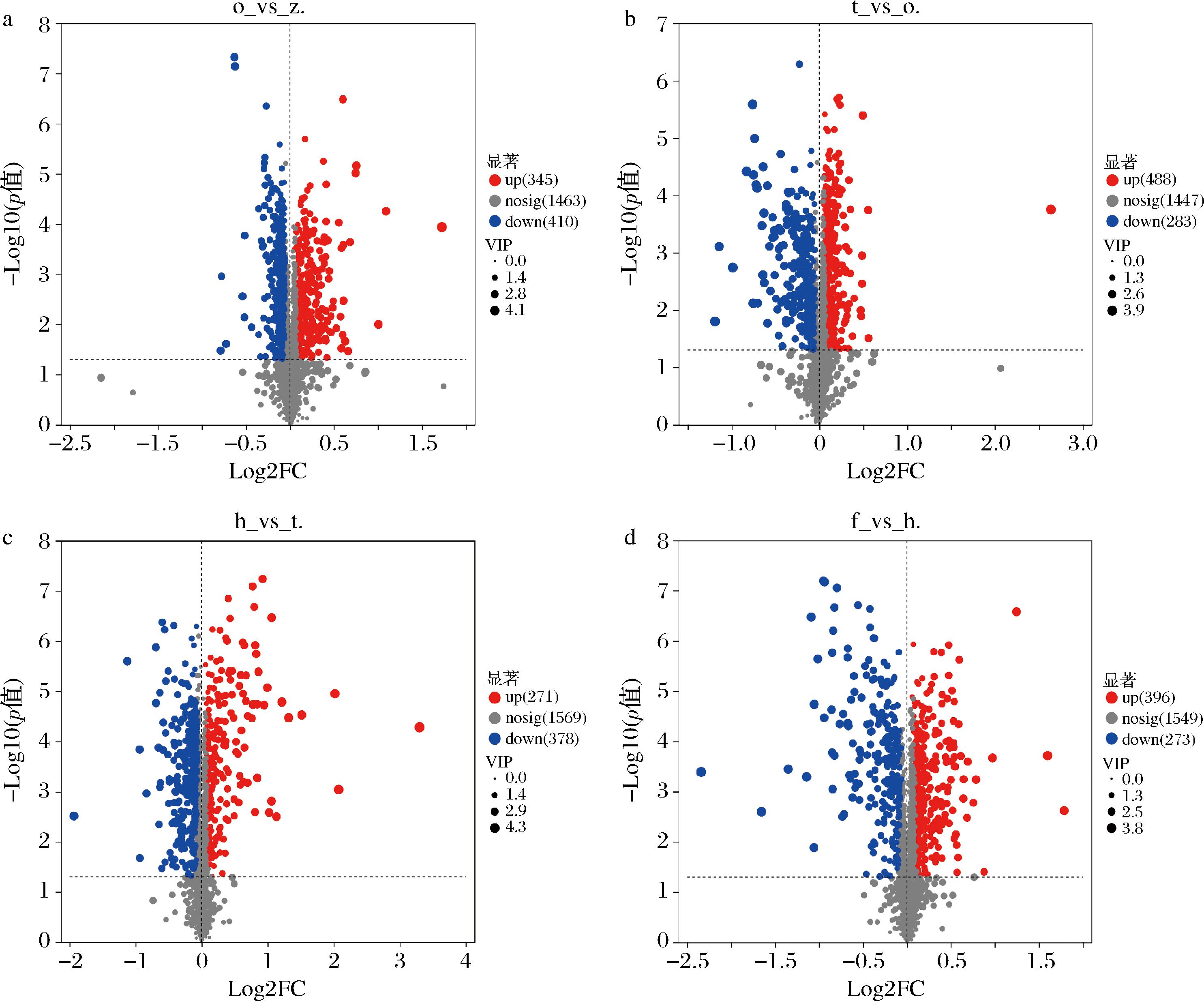
a-o_vs_z;b-t_vs_o;c-h_vs_t;d-f_vs_h
图9 大足冬菜代谢组间差异代谢物火山图
Fig.9 Metabolite volcano plots of intermetabolomic differences in Dazu dongcai
根据PLS-DA模型VIP≥1、P值<0.05、FC>2和FC<1/2的标准筛选显著差异代谢物[23],如表2所示,共筛选出2种上调差异代谢物和8种下调差异代谢物。羧酸及其衍生物多为下调,如布瓦西坦、羟脯氨酰基-天冬酰胺、色氨酰-半胱氨酸、谷氨酸γ-甲酯、羟丙酰亮氨酸;核苷、核苷酸和类似物多为下调化合物,如N-[(5-羟基-2-吡啶基)甲基]腺苷;脂质和脂质分子是上调物质,如盐霉素。在大足冬菜整体发酵过程有机酸及其衍生物,脂质和脂质分子,核苷、核苷酸和类似物代谢途径比较活跃。发酵后期有机酸及其衍生物氨基酸、肽和类似物途径活跃。其中甲脲参与了咖啡因代谢,在咖啡因代谢通路中还检测到了黄嘌呤、7-甲基黄嘌呤、5-乙酰氨基-6-氨基-3-甲基尿嘧啶等化合物的存在,这些化合物使得发酵大足冬菜的鲜味提升,并减弱苦辣味[24]。盐霉素具有抗菌作用,它的相对丰度从0年的1.736经过大足冬菜4年的发酵提升到了5.263,为大足冬菜长达4年的发酵环境提供了条件。盐霉素还具有抗肿瘤活性,给大足冬菜产业在医药中的发展提供了可能。
表2 大足冬菜显著差异代谢化合物表
Table 2 Table of metabolic compounds with significant differences in Dazu dongcai
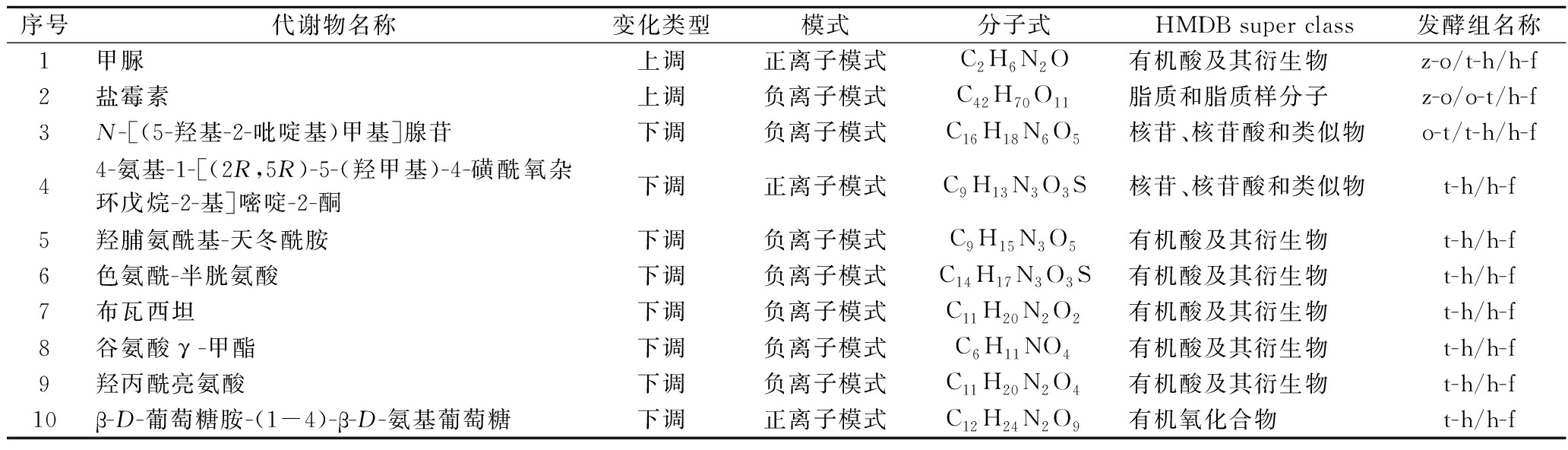
序号代谢物名称变化类型模式分子式HMDB super class发酵组名称1甲脲上调正离子模式C2H6N2O有机酸及其衍生物z-o/t-h/h-f2盐霉素上调负离子模式C42H70O11脂质和脂质样分子z-o/o-t/h-f3N-[(5-羟基-2-吡啶基)甲基]腺苷下调负离子模式C16H18N6O5核苷、核苷酸和类似物o-t/t-h/h-f44-氨基-1-[(2R,5R)-5-(羟甲基)-4-磺酰氧杂环戊烷-2-基]嘧啶-2-酮下调正离子模式C9H13N3O3S核苷、核苷酸和类似物t-h/h-f5羟脯氨酰基-天冬酰胺下调负离子模式C9H15N3O5有机酸及其衍生物t-h/h-f6色氨酰-半胱氨酸下调负离子模式C14H17N3O3S有机酸及其衍生物t-h/h-f7布瓦西坦下调负离子模式C11H20N2O2有机酸及其衍生物t-h/h-f8谷氨酸γ -甲酯下调负离子模式C6H11NO4有机酸及其衍生物t-h/h-f9羟丙酰亮氨酸下调负离子模式C11H20N2O4有机酸及其衍生物t-h/h-f10β-D-葡萄糖胺-(1-4)-β-D-氨基葡萄糖下调正离子模式C12H24N2O9有机氧化合物t-h/h-f
检测出的显著差异代谢物有6种都属于有机酸及其衍生物,有机酸在发酵过程中不仅可以抑制微生物活性,延长大足冬菜的保藏期,还可以调节发酵大足冬菜的酸度,改善咸味。核苷类化合物可以影响免疫调节,促进肠道铁的吸收,N-[(5-羟基-2-吡啶基)甲基]腺苷和4-氨基-1-[(2R,5R)-5-(羟甲基)-4-磺酰氧杂环戊烷-2-基]嘧啶-2-酮多出现在蘑菇类非挥发性化合物的检测中,但几乎没有文献详细描述,还需进一步研究阐明其化合物结构和功能。
3 结论与讨论
本研究旨在研究不同发酵年份大足冬菜非挥发性代谢物质,通过LC-MS非靶向代谢组学技术,鉴定出代谢物共2 218种。通过PCA及聚类热图表明实验准确性,同时发现不同发酵年份大足冬菜代谢物差异显著;通过对差异代谢物进行HMDB化合物分类,共鉴定出13种699种代谢物质。通过KEGG通路富集,发现21条差异代谢通路,共有276种差异代谢物参与大足冬菜发酵。
利用Venn图分析大足冬菜差异代谢物,发现各比较组共同差异代谢物数量为48,其中f_vs_h比较组差异较小,独有的差异代谢物数量为35,而t_vs_o比较组差异较大,独有的差异代谢物数量为163。火山图结果显示大足冬菜发酵期间差异代谢物数量呈波动趋势,发酵0年到2年的上调差异代谢物呈上升趋势,发酵2年上调差异代谢物数量最多,发酵3年时上调差异代谢物下降,在发酵4年时上调差异代谢物上升。下调差异代谢物数量也呈现波动趋势,在2年和4年时下调差异代谢物减少,发酵1年和3年时下调差异代谢物数量增加。根据PLS-DA得分图和模型概览确保PLS-DA模型稳定可靠,通过VIP≥1、P值<0.05、FC>2和FC<1/2标准筛选出显著差异代谢物,共筛选出10种显著差异代谢物,包括2种差异代谢物上调和8种差异代谢物下调。对这些显著差异代谢物所在代谢通路进行归纳,发现羧酸及其衍生物、有机氧化合物及核苷多为下调化合物,有机碳酸类化合物和脂质多为上调化合物。
大足冬菜发酵过程中检测到盐霉素含量显著提升,甜菜素合成途径活跃,对发酵4年期的大足冬菜进行盐霉素、多巴胺和食用色素的分离提纯,可以帮助大足冬菜产业开发提供新方向。同时,发酵大足冬菜和蘑菇部分代谢产物相似且都属于核苷酸类,如N-[(5-羟基-2-吡啶基)甲基]腺苷和4-氨基-1-[(2R,5R)-5-(羟甲基)-4-磺酰氧杂环戊烷-2-基]嘧啶-2-酮,可以对其结构和PCA功能进行检测,开发新型核苷酸作用。发酵大足冬菜中咖啡因代谢途径也十分活跃,咖啡因代谢途径常与茶类、咖啡类等提神物质相关,可以考虑开发发酵大足冬菜作为提神类饮品添加物。大足冬菜发酵产业可以根据代谢产物变化锚定最终代谢产物探索温度、湿度及盐含量对其变化速度的影响调整生产工艺。
本研究采用非靶向代谢组学技术对大足冬菜不同发酵年份代谢物进行差异分析,筛选出显著差异代谢物。结果表明,有机酸、核苷、有机氧、脂质物质在大足冬菜发酵过程中表现出不同程度的差异。大足冬菜发酵工艺改进,提取关键酶,提升药用价值等分析可能是未来关注热点。同时,在研究中发现发酵大足冬菜过程中,有机酸等影响风味成分的物质变化较大,今后将对不同发酵年份大足冬菜的有机酸进行测定,为大足冬菜后续成分研究及代谢网络制作提供科学依据。
[1] TIAN Y, DENG F M.Phytochemistry and biological activity of mustard (Brassica juncea):A review[J].CyTA - Journal of Food, 2020, 18(1):704-718.
[2] 田艳. 华容大叶芥菜主要化学成分及其乙醇提取物抗结肠炎机理研究[D].长沙:湖南农业大学, 2020.TIAN Y.Study on the main chemical components of Huarong large-leaf mustard and the anti-colitis mechanism of its ethanol extract[D].Changsha:Hunan Agricultural University, 2020.
[3] TIAN Y, DENG F M, ZHAO L Y, et al.Characterization of extractable components of fresh and fermented Huarong large-leaf mustard and their inhibitory effects on human colon cancer cells[J].Food Bioscience, 2021, 43:101280.
[4] RAIOLA A, ERRICO A, PETRUK G, et al.Bioactive compounds in Brassicaceae vegetables with a role in the prevention of chronic diseases[J].Molecules, 2018, 23(1):15.
[5] JAHANGIR M, KIM H K, CHOI Y H, et al.Health-affecting compounds in Brassicaceae[J].Comprehensive Reviews in Food Science and Food Safety, 2009, 8(2):31-43.
[6] OH S, TSUKAMOTO C, KIM K, et al.Investigation of glucosinolates, and the antioxidant activity of Dolsan leaf mustard kimchi extract using HPLC and LC-PDA-MS/MS[J].Journal of Food Biochemistry, 2017, 41(3):e12366.
[7] YU Y Y, XU Y J, LI L, et al.Dynamic evolution of flavor substances and bacterial communities during fermentation of leaf mustard (Brassica juncea var.multiceps) and their correlation[J].LWT, 2022, 167:113796.
[8] LIU D Q, ZHANG C C, ZHANG J M, et al.Metagenomics reveals the formation mechanism of flavor metabolites during the spontaneous fermentation of potherb mustard (Brassica juncea var.multiceps)[J].Food Research International, 2021, 148:110622.
[9] ZHAO D Y, TANG J, DING X L.Analysis of volatile components during potherb mustard (Brassica juncea, Coss.) pickle fermentation using SPME-GC-MS[J].LWT - Food Science and Technology, 2007, 40(3):439-447.
[10] GARCIA-PEREZ I, POSMA J M, SERRANO-CONTRERAS J I, et al.Identifying unknown metabolites using NMR-based metabolic profiling techniques[J].Nature Protocols, 2020, 15(8):2538-2567.
[11] MUNJAL Y, TONK R K, SHARMA R.Analytical techniques used in metabolomics:A review[J].Systematic Reviews in Pharmacy, 2022, 13(5):550-556.
[12] 张子洁, 唐鳗秋, 夏玙, 等.基于代谢组学分析四川黄酒麦曲制曲发酵过程中黄酮类物质的代谢[J].食品科技, 2022, 47(7):250-255.ZHANG Z J, TANG M Q, XIA Y, et al.Metabolic analysis of flavonoids during koji making and fermentation of Sichuan yellow wine wheat koji based on metabonomics[J].Food Science and Technology, 2022, 47(7):250-255.
[13] THEODORIDIS G, GIKA H G, WILSON I D.LC-MS-based methodology for global metabolite profiling in metabonomics/metabolomics[J].TrAC Trends in Analytical Chemistry, 2008, 27(3):251-260.
[14] SANGSTER T, MAJOR H, PLUMB R, et al.A pragmatic and readily implemented quality control strategy for HPLC-MS and GC-MS-based metabonomic analysis[J].Analyst, 2006, 131(10):1075-1078.
[15] 楚京嬴, 吕嘉枥, 高捷, 等.芹菜IDF与多菌群益生菌连续共培养的培养物特性[J].食品研究与开发, 2024, 45(9):183-192.CHU J Y, LYU J L, GAO J, et al.Characteristics of the cultures from continuous co-cultures of celery IDF with multi-probiotics[J].Food Research and Development, 2024, 45(9):183-192.
[16] 耿瑞蝶, 王金水.呈味氨基酸和肽对发酵食品中风味的作用[J].中国调味品, 2019, 44(7):176-178;183.GENG R D, WANG J S.Effect of flavored amino acids and peptides on the flavor of fermented foods[J].China Condiment, 2019, 44(7):176-178;183.
[17] ENGELS C, SCHIEBER A, G NZLE M G.Sinapic acid derivatives in defatted Oriental mustard (Brassica juncea L.) seed meal extracts using UHPLC-DAD-ESI-MSnand identification of compounds with antibacterial activity[J].European Food Research and Technology, 2012, 234(3):535-542.
NZLE M G.Sinapic acid derivatives in defatted Oriental mustard (Brassica juncea L.) seed meal extracts using UHPLC-DAD-ESI-MSnand identification of compounds with antibacterial activity[J].European Food Research and Technology, 2012, 234(3):535-542.
[18] YUN K J, KOH D J, KIM S H, et al.Anti-inflammatory effects of sinapic acid through the suppression of inducible nitric oxide synthase, cyclooxygase-2, and proinflammatory cytokines expressions via nuclear factor-kappaB inactivation[J].Journal of Agricultural and Food Chemistry, 2008, 56(21):10265-10272.
[19] PANDI A, KALAPPAN V M.Pharmacological and therapeutic applications of Sinapic acid-an updated review[J].Molecular Biology Reports, 2021, 48(4):3733-3745.
[20] SHI Y G, PU D D, ZHOU X W, et al.Recent progress in the study of taste characteristics and the nutrition and health properties of organic acids in foods[J].Foods, 2022, 11(21):3408.
[21] TIMONEDA A, FENG T, SHEEHAN H, et al.The evolution of betalain biosynthesis in Caryophyllales[J].New Phytologist, 2019, 224(1):71-85.
[22] WISE R A, ROBBLE M A.Dopamine and addiction[J].Annual Review of Psychology, 2020, 71:79-106.
[23] 范蕊,王文文,王腾斌,等.基于非靶向代谢组学分析不同发酵时期新疆沙棘酵素代谢产物的差异[J].食品与发酵工业, 2024, 11:1802.FAN R, WANG W W, WANG T B, et al.Based on non-targeted metabolomics, the differences in metabolites of Xinjiang sea buckthorn enzyme in different fermentation stages were analyzed[J].Food and Fermentation Industries, 2024, 11:1802.
[24] BI X F, YU H H, HU F G, et al.A systematic analysis of the correlation between flavor active differential metabolites and multiple bean ripening stages of Coffea arabica L[J].Molecules, 2024, 29(1):180.