共微囊化技术作为一种新兴技术,可将多个生物活性化合物共微囊化,比单一组分的生物活性和功能性的协同效应更好。本技术在制药工业中得到了广泛的推广,例如食品中的益生菌菌株和生物活性物质的共微囊化,具有潜在的发展价值。将益生菌与菊粉、聚葡萄糖等益生元共微囊化,可以有效地保持益生菌在胃肠道转运过程中的活力[1],并且可以防止在加工和储存过程中受到低pH和氧化应激等有害条件的影响[2]。
共微囊化技术包括静电纤维法、乳化法、挤压法、复合凝聚法、冷冻干燥法、喷雾干燥法等[3],其中喷雾干燥技术发展较成熟,1950年后期开始应用于食品工业,可将液体样品转化为粉末来防止氧化降解。喷雾干燥技术通常采用麦芽糊精、海藻酸盐、羧甲基纤维素、乳清蛋白(whey protein concentrate,WPC)和酪蛋白酸钠等水性材料用作壁材来包覆不同的益生菌[4]。喷雾干燥技术既经济又常用,灵活性高,可以生产出质量好的产品。研究发现在碳水化合物中,海藻糖可高效稳定膜和蛋白质,蛋白质、多糖及其组合是最流行的微囊化材料[5]。
槲皮素可通过抑制黄嘌呤氧化酶活性[6]和促进尿酸排泄[7]降低血尿酸浓度;但是槲皮素是一种疏水性分子,在水(0.17~7 μg/mL)、胃液(5.5 μg/mL)和小肠液中的溶解度相对较低,导致其生物利用度低[8]。WPC是牛奶的加工产品,具有两亲性,不仅具有多种疏水性氨基酸,又含有亲水基团,且疏水基团和亲水基团高度不对称[9]。故它具有优秀的乳化、自组装、凝胶、水结合能力、pH反应凝胶肿胀行为[10]和与其他大分子形成复合物或共轭的能力。益生菌NCU001464是从发酵桑葚中分离鉴定出的一株发酵乳杆菌(Lactobacillus fermentum),具有高β-葡萄糖苷酶活性、降解尿酸前体物质肌苷和鸟苷的作用,能有效降低血尿酸水平[11]。
本研究旨在以WPC和海藻糖为壁材,将该益生菌与槲皮素共微囊化。利用WPC的两亲性,采用pH诱导法提高疏水性物质槲皮素的溶解性,复合壁材包埋发酵乳杆菌与槲皮素,优化了微胶囊化工艺,并研究了该微胶囊在模拟消化道中的稳定性。以期为工业化生产生物活性物质与活菌共微囊化制剂提供理论依据和现实指导。
1 试验材料与设备
1.1 实验材料
槲皮素,麦克林试剂公司;L. fermentum NCU001464,南昌大学食品科学与资源挖掘全国重点实验室提供。WPC、海藻糖、MRS培养基、胃蛋白酶、胰蛋白酶、猪胆盐,北京索莱宝有限公司;Na2HPO4、KH2PO4,天津市大茂化学试剂厂;其他试剂皆为国产分析级试剂。
1.2 实验设备
FE30型pH计,梅特勒-托利多仪器有限公司;TU-1901紫外分光光度计,北京普析通用仪器有限责任公司;B290小型喷雾干燥仪,BUCHI实验室设备贸易有限公司;LabSwift水分活度(water activity,Aw)仪,瑞士novasina公司;ZSD-A1160A全自动新型生化培养箱,上海精宏试验设备有限公司;ST16R高速低温离心机,赛默飞世尔科技有限公司;MLS-3751L-PC高压蒸汽灭菌锅,松下健康医疗器械株式会社;DHG-9246A电热恒温鼓风干燥箱,上海精宏试验设备有限公司。
2 实验方法
2.1 益生菌的培养与制备
参考文献[12]的方法并稍作修改,将保存在甘油管中的L. fermentum NCU001464在MRS固体培养基上划线,置于37 ℃培养箱厌氧培养24 h,然后挑取单菌落接种在MRS肉汤中,于37 ℃厌氧培养16 h使菌株达到生长稳定期。之后按1%的接种量将菌液接种至新的MRS肉汤中厌氧16 h。培养好的菌液4 ℃、6 000×g离心5 min,收集菌泥并用质量分数为0.85%的无菌生理盐水洗涤2次。
2.2 保护剂配方优化
2.2.1 共微囊化配方单因素试验
分别考察WPC、海藻糖、L.fermentum NCU001464与保护剂的比例、槲皮素的添加量对微胶囊中L.fermentum NCU001464活菌数的影响。
2.2.2 正交试验设计
在单因素试验的基础上,确定了WPC质量浓度和海藻糖质量浓度、菌悬液与保护剂的比例、槲皮素添加量的最优条件范围。设计3水平4因素正交试验,以益生菌存活率、槲皮素包埋率、得率为指标,确定最佳工艺条件。正交试验设计如表1所示。
表1 正交试验因素水平
Table 1 Factor level of orthogonal experiment
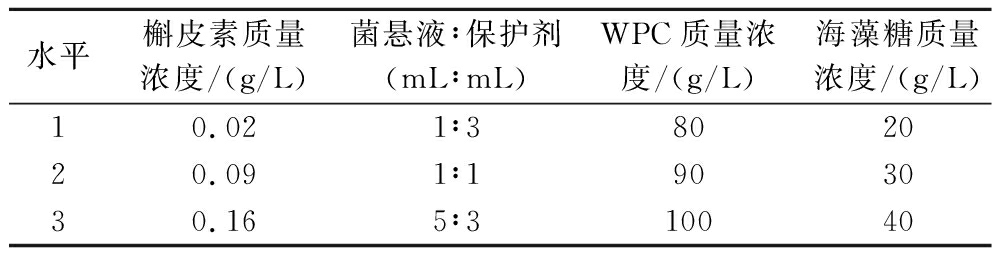
水平槲皮素质量浓度/(g/L)菌悬液∶保护剂(mL∶mL)WPC质量浓度/(g/L)海藻糖质量浓度/(g/L)10.021∶3802020.091∶1903030.165∶310040
2.3 微胶囊的制备
2.3.1 壁材溶液的制备
WPC溶液的制备,称取一定量的WPC溶于100 mL灭菌的蒸馏水中,600 r/min搅拌,80 ℃水浴5 min巴氏灭菌。
海藻糖溶液的制备:称取一定量的海藻糖溶于100 mL无菌蒸馏水中,在600 r/min搅拌,80 ℃水浴5 min灭菌。
2.3.2 pH 诱导的WPC-Q复合物
本实验采用pH诱导促进槲皮素与WPC共价结合,促进槲皮素溶解,主要是因为蛋白质在碱性条件下发生解体,同时槲皮素发生脱质子化溶解,当逐渐被酸中和时,蛋白质重新聚合,槲皮素则会发生质子化进入蛋白质的疏水空腔中[13]。
首先在WPC溶液中添加一定量的槲皮素,在400 r/min磁力搅拌下,往混合液中滴加4 mol/L NaOH,将其pH值调至12,溶解槲皮素;然后采用1 mol/L的HCl溶液将pH值调回7,制得WPC-Q复合液。
2.3.3 喷雾干燥制备微胶囊
参考文献[14]方法并进行修改,将75 mL WPC-Q复合液、75 mL海藻糖溶液与150 mL菌悬液离心下来的菌泥充分混合。采用实验室规模喷雾干燥机进行微胶囊的制备,干燥条件为:空气流速350 L/h,进料流速0.48 L/h,进风温度120 ℃,出风温度65~70 ℃,载气压力0.1 MPa。干燥粉末用不透明的铝箔袋进行真空封装,置于干燥器中备用。
2.4 共微囊化益生菌存活率
参考文献[15]并稍作修改,取0.1 g粉末溶解于0.9 mL pH=7的PBS然后用生理盐水进行梯度稀释至合适浓度,MRS琼脂平板涂布,37 ℃培养箱培养48 h,计算活菌数。每个样品重复3次。L.fermentum NCU001464存活率按公式(1)计算:
存活率![]()
(1)
式中:N,微胶囊中释放的活细胞数,CFU/g;N0,微胶囊化前存在于进料溶液中的活细胞数,CFU/g。
2.5 共微囊化槲皮素包埋率、得率
2.5.1 标准曲线的制定
参考文献[16]的方法并进行修改,准确称取0.50 mg槲皮素粉末用乙醇溶解并定容到50 mL棕色容量瓶中,摇匀备用。然后从容量瓶中分别取1、2、3、4、5 mL液体置于5个10 mL离心管中,并补加乙醇溶液使体积达到5 mL,摇匀即得。最终每个管中槲皮素质量浓度为2、4、6、8、10 μg/mL。测定372.5 nm处吸光度值记为x,建立与槲皮素浓度y(μg/mL)的标准曲线:y=10.746x-0.249 8,R2=0.997 8。
2.5.2 微胶囊中总槲皮素含量测定
参考文献[17]的方法并稍作修改。由于壁材溶于水,而芯材易溶于乙醇,所以利用体积分数为50%的乙醇水溶液作为溶剂,将芯材和壁材溶解[18]。称取粉末1 g,溶于9 mL体积分数为50%乙醇中,超声波溶解30 min,离心(8 000 r/min,10 min)然后取1 mL于10 mL离心管中,用体积分数为50%乙醇稀释至5 mL,以体积分数为50%乙醇作空白,分别在372.5 nm波长处测定吸光度值并记录。用回归曲线计算得到未被包埋的槲皮素含量,槲皮素的得率计算如公式(2)所示:
槲皮素得率![]()
(2)
式中:A0,槲皮素初始添加量,μg/g;A1,微胶囊中总槲皮素含量,μg/g。
2.5.3 微胶囊表面游离槲皮素含量测定
称取粉末1 g溶于9 mL无水乙醇中,超声波溶解30 min,离心(8 000 r/min,10 min)然后取1 mL于10 mL离心管中,用无水乙醇稀释至5 mL,以无水乙醇作空白,分别在372.5 nm处测定吸光度值并记录。根据标准曲线计算得到未被包埋的槲皮素含量[17],槲皮素的包埋率计算如公式(3)所示:
槲皮素包埋率![]()
(3)
式中:A0,槲皮素初始添加量,μg/g;A2,未被包埋的槲皮素含量,μg/g。
2.6 水分含量的测定
根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,通过重量分析法测定水分含量,将称量瓶烘干至恒重,然后称取0.3 g粉末于称量瓶中,置于102 ℃烘箱中烘干4 h,取出置于干燥器内,冷却称重,再烘0.5 h,取出冷却称重,重复至减重不超过2 mg,平行测定3次。
2.7 Aw的测定
使用Aw分析仪测量微胶囊粉末在25 ℃下的Aw值。每个样品重复测量3次。
2.8 模拟胃肠道存活实验
参考 MINEKUS等[19]的方法并稍加改进,实验器材高温灭菌后烘干待用。
模拟胃消化液:含有3 g/L胃蛋白酶的PBS(pH 2.5,10 mmol/L);模拟消化肠液:含有胰蛋白酶(1 g/L)、胆盐(3 g/L)和PBS(pH 8.0,10 mmol/L)。
胃消化阶段:分别称取1.0 g微胶囊样品,加入9 mL 经0.22 μm滤膜过滤后的胃消化液,置于37 ℃振荡温育2 h,加入胃蛋白酶则表示胃消化过程开始,于2.0 h处计算活菌数。
肠消化阶段:将10 mL胃消化后样品(消化2 h后)6 000 r/min离心5 min,去上清液,加入经0.22 μm滤膜过滤后的肠消化液,37 ℃避光振荡温育2 h,分别取1 mL的消化液于2 mL离心管中,计算活菌数,重复3次。
2.9 数据分析
试验结果表示为“平均值±标准差”。分别采用SPSS 19.0软件与Origin Pro 9.0软件进行统计分析,不同字母代表显著性差异(P<0.05)。
3 结果与分析
3.1 海藻糖质量浓度对共微囊化效果的影响
在WPC质量浓度80 g/L,菌悬液与保护剂体积比1∶1,槲皮素添加量2 mg/150 mL,300 r/min转速下搅拌30 min后,喷雾干燥制备微胶囊粉末,海藻糖质量浓度对共微囊化效果的影响如图1所示。
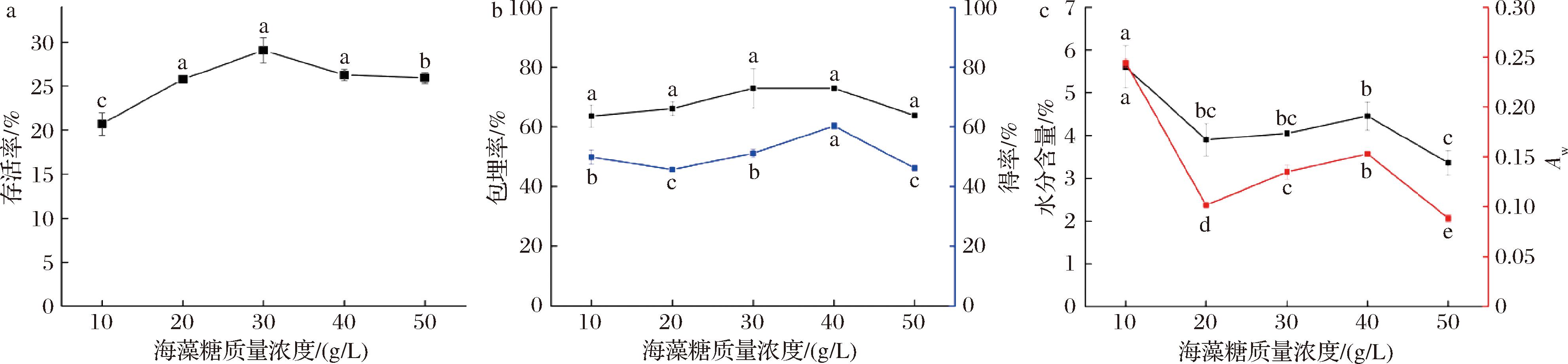
a-益生菌存活率;b-槲皮素包埋率、得率;c-水分含量、Aw
图1 海藻糖质量浓度对共微囊化效果的影响
Fig.1 Effect of trehalose concentration on the effect of co-microencapsulation
注:不同字母表示差异显著(P<0.05)(下同)。
由图1可知,海藻糖质量浓度对微囊化益生菌存活率具有显著影响(P<0.05),随着海藻糖质量浓度的增加,益生菌存活率表现为先上升后下降的变化趋势,当海藻糖质量浓度为30 g/L 时益生菌存活率最高[(29.07±1.42)%],BARAJAS- LVAREZ等[20]的研究采用50 g/L的海藻糖浓度获得较高的益生菌存活率;同时具有最高的槲皮素包埋率[(72.90±6.68)%];而40 g/L海藻糖组微胶囊粉末的槲皮素得率最高[(60.25±1.02)%],其次是30 g/L的海藻糖组;随着微胶囊中海藻糖添加量的增加,水分含量显著降低(P<0.05),整体低于 6%,这是因为海藻糖具有低吸湿特性。且微胶囊的Aw变化趋势和水分含量的变化趋势一致,Aw均低于0.60,降低了微生物生长速率的安全值,低Aw可以避免微生物生长和脂质氧化等不良的化学反应[21]。因此采用海藻糖质量浓度为20、30、40 g/L作为正交试验水平。
LVAREZ等[20]的研究采用50 g/L的海藻糖浓度获得较高的益生菌存活率;同时具有最高的槲皮素包埋率[(72.90±6.68)%];而40 g/L海藻糖组微胶囊粉末的槲皮素得率最高[(60.25±1.02)%],其次是30 g/L的海藻糖组;随着微胶囊中海藻糖添加量的增加,水分含量显著降低(P<0.05),整体低于 6%,这是因为海藻糖具有低吸湿特性。且微胶囊的Aw变化趋势和水分含量的变化趋势一致,Aw均低于0.60,降低了微生物生长速率的安全值,低Aw可以避免微生物生长和脂质氧化等不良的化学反应[21]。因此采用海藻糖质量浓度为20、30、40 g/L作为正交试验水平。
3.2 WPC质量浓度对共微囊化效果的影响
在菌悬液与保护剂比例1∶1,槲皮素添加量2 mg/150 mL,海藻糖30 g/L、300 r/min搅拌30 min。由图2可知,WPC质量浓度对存活率具有显著影响(P<0.05),存活率随着WPC质量浓度表现为先上升后下降的趋势,且WPC质量浓度为90 g/L 时益生菌存活率最高,为(23.13±0.78)%;而70 g/L WPC壁材组合所制得的粉末具有最高的槲皮素包埋率[(76.05±0.20)%],可能是因为WPC具有结合疏水性小分子的能力和能通过各种交联机制形成凝胶[22]的自组装能力,对一些敏感物质具有的保护作用。同时具有最高的槲皮素得率为(63.78±0.84)%,但是槲皮素包埋率和得率受槲皮素浓度的影响更大,后期可以通过调整槲皮素浓度进行优化;喷雾干燥微胶囊粉末的水分含量随着WPC的质量浓度增加越来越低,根据以往的研究,喷雾干燥嗜酸乳杆菌的储存性取决于水分活性,范围为(0.303±0.037)~(0.441±0.021)[20],本研究粉末Aw值为(0.089±0.003)~(0.224±0.004),整体偏低,因此足以在储存时保持嗜酸乳杆菌的稳定性。所以选择乳清蛋白质量浓度为80、90、100 g/L作为后续正交试验水平。
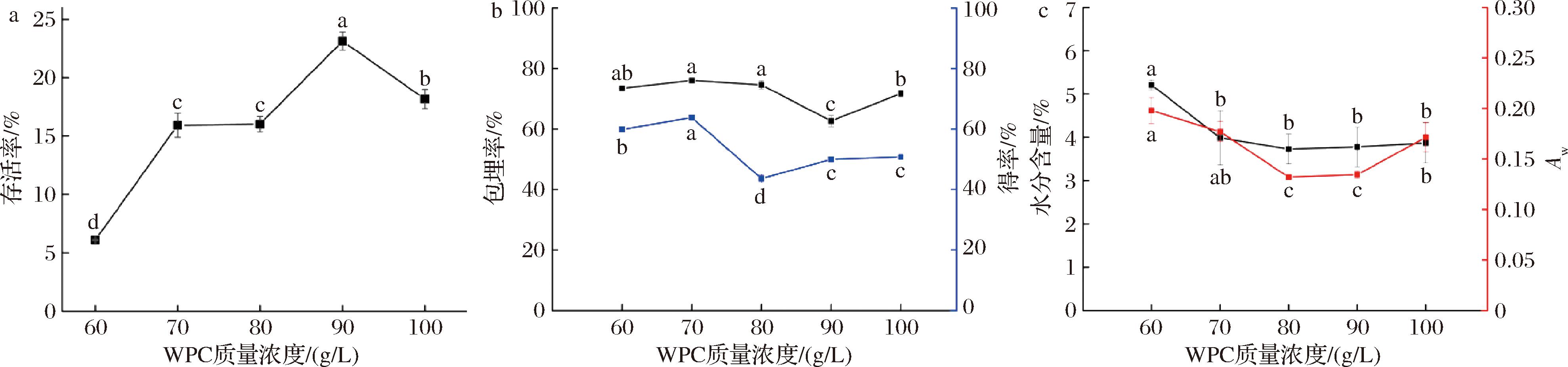
a-益生菌存活率;b-槲皮素包埋率、得率;c-水分含量、Aw
图2 WPC质量浓度对共微囊化效果的影响
Fig.2 Effect of whey protein concentration on the effect of co-microencapsulation
3.3 菌悬液与保护剂比例对共微囊化效果的影响
在海藻糖30 g/L、WPC 90 g/L,槲皮素添加量2 mg/150 mL,300 r/min搅拌30 min。由图3可知,菌悬液的添加量对益生菌存活率具有显著影响(P<0.05),表现为先上升后下降的趋势,其中1∶1 体积比所制得的粉末具有最高益生菌存活率(26.42±2.33)%;这可能是因为过高的浓度导致渗透压过高,超过了细胞膜承受的压力范围,和加重了相互之间的摩擦损伤,细胞膜造成破损[23]。不同益生菌添加量对喷雾干燥粉末的槲皮素包埋率和得率没有显著影响(P>0.05),1∶1体积比喷雾干燥后的粉末具有最高的槲皮素包埋率[(73.63±3.65)%]。同时具有最高的槲皮素得率(65.96±5.53)%。所添加的菌悬液与保护剂比例为1∶1的喷雾干燥粉末水分含量最低,为(3.04±0.24)%,且该因素对微胶囊粉末水分含量(P<0.05)和Aw(P<0.05)具有显著影响,Aw也处于安全水平。因此选择菌悬液与保护剂的比例为1∶3、1∶1、5∶3进行后续优化。
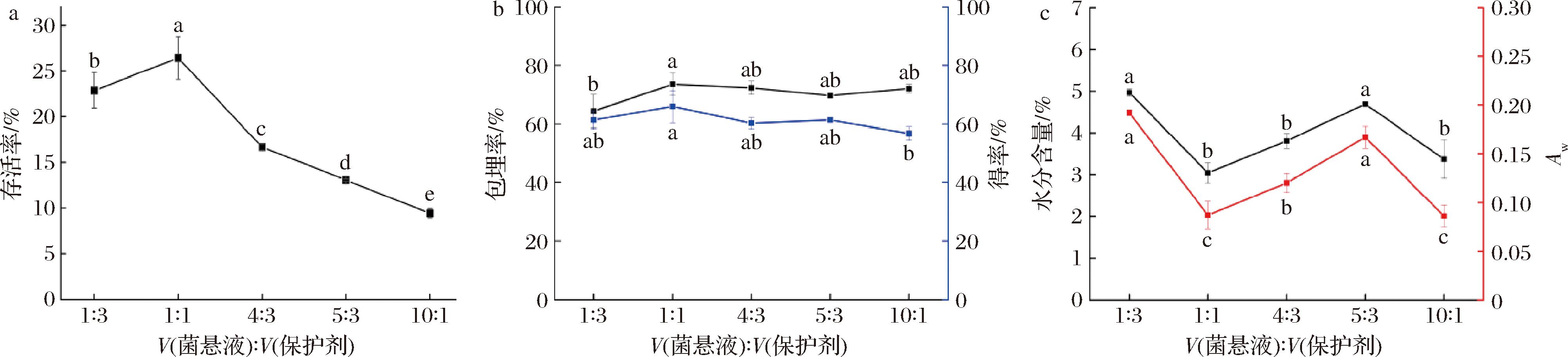
a-益生菌存活率;b-槲皮素包埋率、得率;c-水分含量、Aw
图3 不同菌悬液与保护剂比例对共微囊化效果的影响
Fig.3 Effects of different ratios of bacterial sludge to protective agent on the effect of co-microencapsulation
3.4 槲皮素添加量对共微囊化效果的影响
在海藻糖30 g/L、WPC 90 g/L、菌悬液与保护剂比例1∶1,300 r/min转速下搅拌30 min,槲皮素添加量对共微囊化效果的影响结果如图4所示。
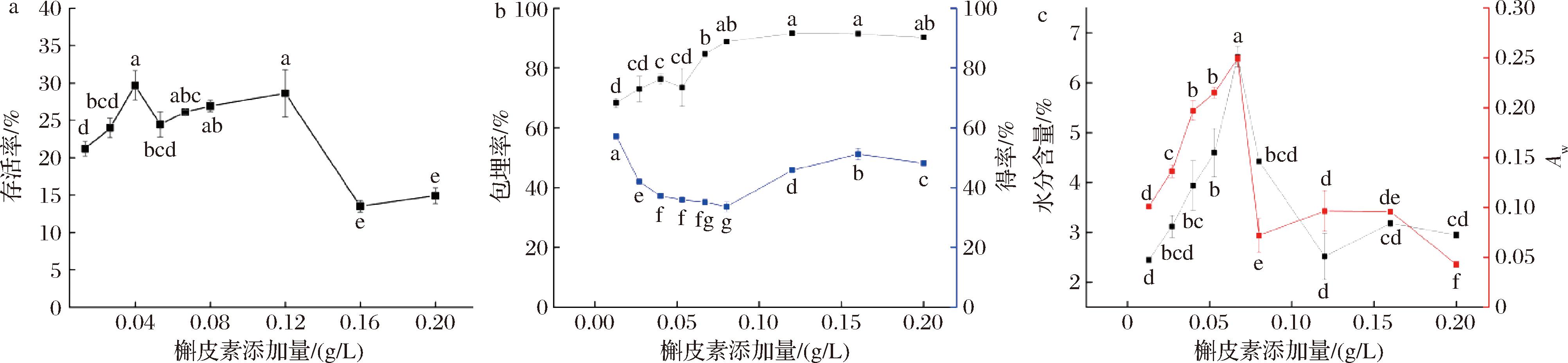
a-益生菌存活率;b-槲皮素包埋率、得率;c-水分含量、Aw
图4 槲皮素添加量对共微囊化效果的影响
Fig.4 Effect of quercetin addition on the effect of co-microencapsulation
由图4可知,槲皮素添加量为0.16 g/L所制得的粉末槲皮素包埋率最高为(91.47±0.05)%,而同时槲皮素得率也相对较高;槲皮素添加量对益生菌存活率具有显著影响(P<0.05),槲皮素添加量为0.04 g/L时益生菌存活率最高,所制得的粉末具有最高益生菌存活率(29.67±1.97)%。而0.04 g/mL与0.12 g/L之间没有显著差异,这可能是因为WPC和槲皮素的共价结合增强了蛋白质网络结构的致密性[24],加强了对益生菌的保护效果,然而当浓度过高时,蛋白质分子会不稳定[25]。槲皮素含量对喷雾干燥粉末的水分含量、Aw具有显著影响(P<0.05),且槲皮素添加量为0.12 g/L所制得的粉末水分含量最低(2.52±0.46)%,可能是因为添加槲皮素后蛋白质结构的部分展开,暴露了掩埋在其中的亲水基团,改善了 WPC 与水结合的能力。微胶囊粉末的水分含量与Aw值均处于维持良好稳定性的水平值,综上考虑,设计0.02、0.09、0.16 g/L为后续槲皮素添加量优化水平。
3.5 正交试验结果
由单因素试验结果得出正交试验水平(表1),单因素试验结果显示微胶囊粉末的水分含量和Aw值均处于安全值水平,有利于微胶囊的稳定,故正交试验仅需从益生菌存活率、槲皮素包埋率和得率3个指标考察共微囊化效果。
由正交试验结果和极差分析(表2)可知,4个因素对微囊化益生菌存活率、微胶囊槲皮素包埋率和得率大小的影响的主次关系分别为:B(菌悬液与保护剂比例)>A(槲皮素添加量)>C(乳清蛋白浓度)>D(海藻糖浓度)、A(槲皮素添加量)>B(菌悬液与保护剂比例)>D(海藻糖浓度)>C(乳清蛋白浓度)和A(槲皮素添加量)>D(海藻糖浓度)>B(菌悬液与保护剂比例)>C(乳清蛋白浓度)。最佳组合为:A1B1C2D2、A2B1C1D3、A2B1C3D3,再对最佳组合进行验证。
表2 正交试验结果
Table 2 Results of othogonal experiment
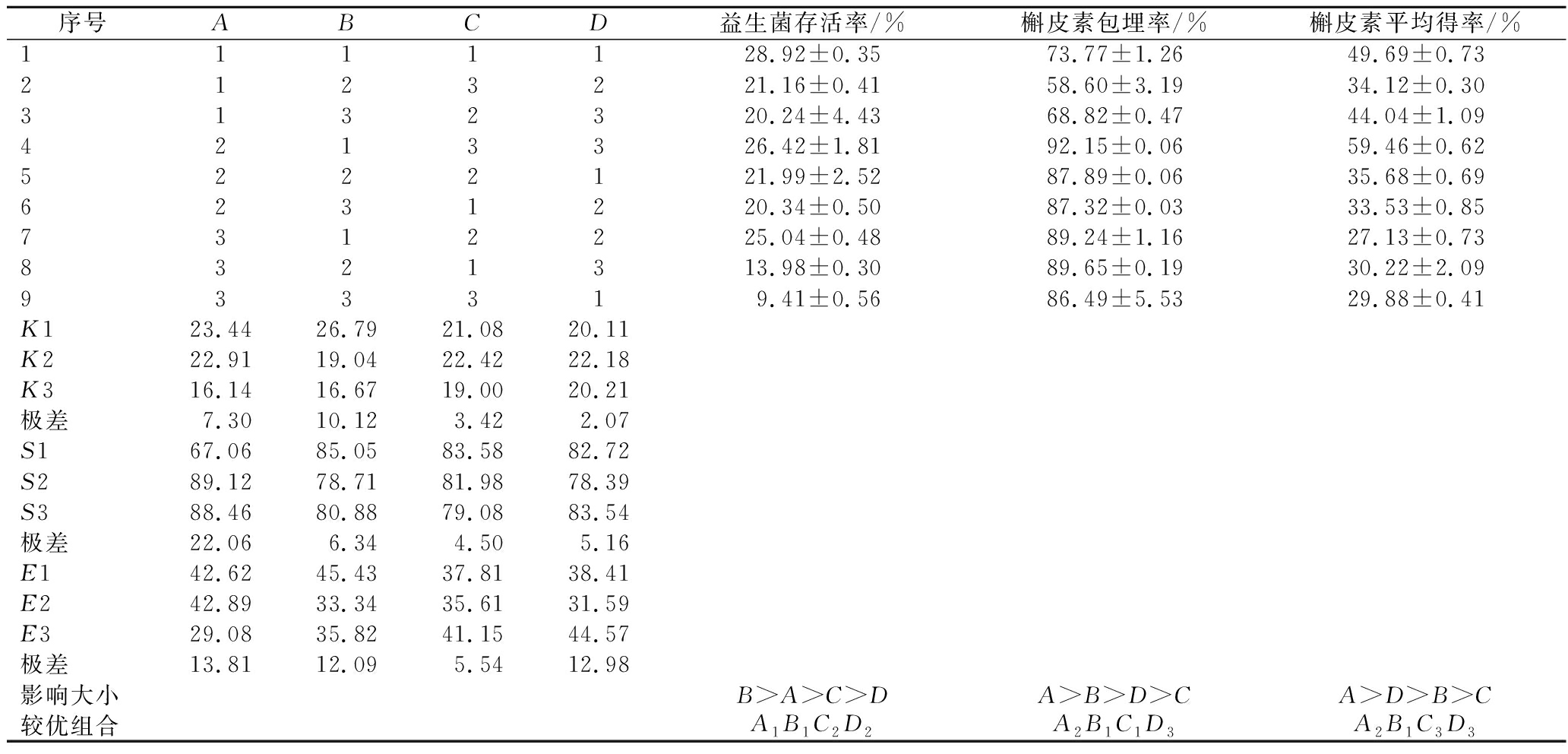
序号ABCD益生菌存活率/%槲皮素包埋率/%槲皮素平均得率/%1111128.92±0.3573.77±1.2649.69±0.732123221.16±0.4158.60±3.1934.12±0.303132320.24±4.4368.82±0.4744.04±1.094213326.42±1.8192.15±0.0659.46±0.625222121.99±2.5287.89±0.0635.68±0.696231220.34±0.5087.32±0.0333.53±0.857312225.04±0.4889.24±1.1627.13±0.738321313.98±0.3089.65±0.1930.22±2.09933319.41±0.5686.49±5.5329.88±0.41K123.4426.7921.0820.11K222.9119.0422.4222.18K316.1416.6719.0020.21极差7.3010.123.422.07S167.0685.0583.5882.72S289.1278.7181.9878.39S388.4680.8879.0883.54极差22.066.344.505.16E142.6245.4337.8138.41E242.8933.3435.6131.59E329.0835.8241.1544.57极差13.8112.095.5412.98影响大小B>A>C>DA>B>D>CA>D>B>C较优组合A1B1C2D2A2B1C1D3A2B1C3D3
由正交试验验证结果可知(表3),A1B1C2D2组具有最高的益生菌存活率(26.19±0.81)%,高于LI等[26]微囊化益生菌存活率结果(14.28±0.78)%,和最高的槲皮素得率(72.16±0.52)%,组合A2B1C1D3与A2B1C3D3的槲皮素包埋率较高。
表3 正交试验验证结果
Table 3 Results of orthogonal test verification
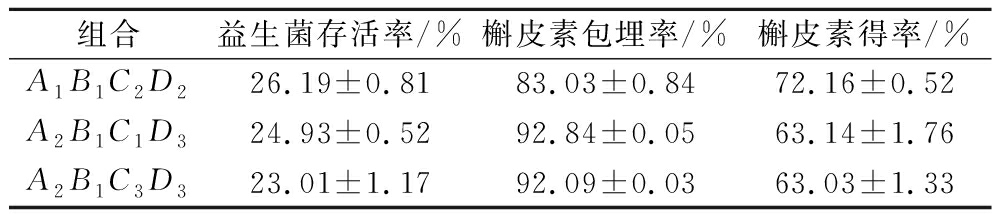
组合益生菌存活率/%槲皮素包埋率/%槲皮素得率/%A1B1C2D226.19±0.8183.03±0.8472.16±0.52A2B1C1D324.93±0.5292.84±0.0563.14±1.76A2B1C3D323.01±1.1792.09±0.0363.03±1.33
综合试验结果,选择组合A1B1C2D2作为最优条件开展后续实验,即微胶囊配方为槲皮素质量浓度0.02 g/L、菌悬液与保护剂比例1∶3、WPC质量浓度90 g/L 、海藻糖质量浓度30 g/L。
3.6 体外模拟胃肠道消化试验
由图5可知,游离发酵乳杆菌与微囊化发酵乳杆菌经过模拟胃液消化2 h后活细胞数没有显著变化,表明L. fermentum耐胃液消化;再经过2 h模拟肠液消化后,游离的发酵L. fermentum活细胞数从(9.32±0.04)lg CFU/mL降至(1.75±0.22)lg CFU/mL,而微囊化发酵乳杆菌的活细胞数从(9.65±0.02)lg CFU/mL降至(8.12±0.06)lg CFU/mL,与LI等[26]的研究结果接近,由此可见,经过WPC和海藻糖微囊化的L. fermentum具有显著的耐胃、肠液消化能力。
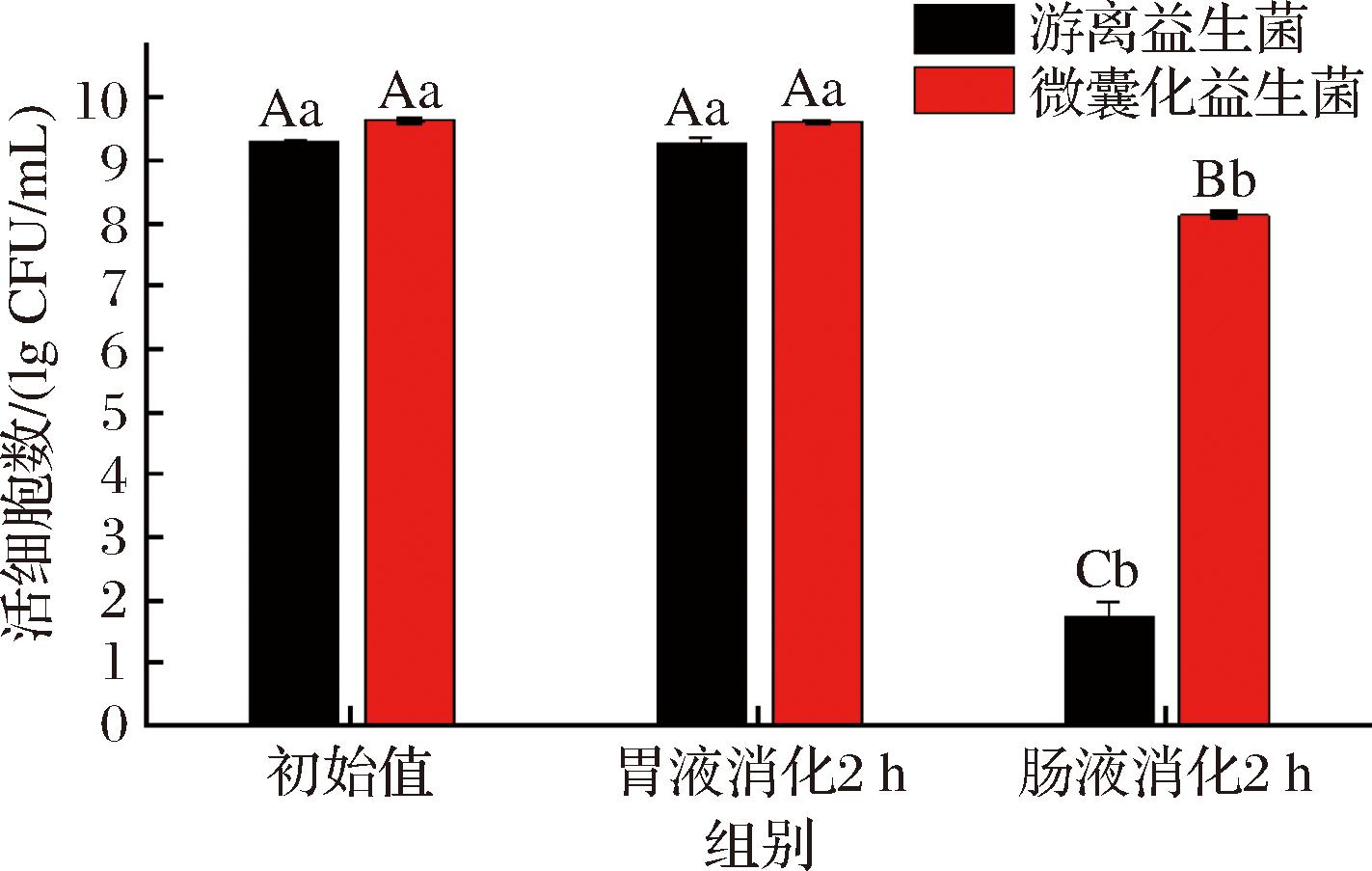
图5 微胶囊耐受性试验结果
Fig.5 Results of co-microencapsule tolerance experiment
注:不同的大写字母表示组间差异显著(P<0.05),不同小写字母表示组内差异显著(P<0.05)。
4 结语
本研究以WPC和海藻糖为壁材,通过pH诱导法,将槲皮素与WPC共价结合,提高疏水性槲皮素的溶解性,以实现槲皮素与益生菌的共微囊化,制备具有优良特性的微胶囊粉末。通过单因素试验和正交试验工艺优化,得出L. fermentum和槲皮素共微囊化的最佳配方组合:槲皮素浓度0.02 g/L、菌悬液与保护剂的比例1∶3、WPC 90 g/L、海藻糖30 g/L,所得粉末中益生菌存活率和槲皮素得率最高;此时存活率为26.19%、槲皮素包埋率为83.03%、槲皮素得率为72.16%,微胶囊的Aw与水分含量都处于安全水平。通过体外模拟消化实验结果可知,壁材显著提高了益生菌在胃肠道消化过程中的耐受力;本研究为疏水性生物活性物质与益生菌的共微囊化提供了理论指导,本试验制备的微胶囊具有良好的耐消化能力,而该微胶囊的其他特征还需进一步研究。
[1] ATIA A, GOMMA A I, FLISS I, et al.Molecular and biopharmaceutical investigation of alginate-inulin synbiotic coencapsulation of probiotic to target the colon[J].Journal of Microencapsulation, 2017, 34(2):171-184.
[2] CHEN L, YANG T, SONG Y J, et al.Effect of xanthan-chitosan-xanthan double layer encapsulation on survival of Bifidobacterium BB01 in simulated gastrointestinal conditions, bile salt solution and yogurt[J].LWT-Food Science and Technology, 2017, 81:274-280.
[3] MISRA S, PANDEY P, MISHRA H N.Novel approaches for co-encapsulation of probiotic bacteria with bioactive compounds, their health benefits and functional food product development:A review[J].Trends in Food Science &Technology, 2021, 109:340-351.
[4] JACKSON L S, LEE K.Microencapsulation and the food industry[J].LWT, 1991, 24(4):289-297.
[5] MORGAN C A, HERMAN N, WHITE P A, et al.Preservation of micro-organisms by drying;A review[J].Journal of Microbiological Methods, 2006, 66(2):183-193.
[6] IRONDI E A, AGBOOLA S O, OBOH G, et al.Guava leaves polyphenolics-rich extract inhibits vital enzymes implicated in gout and hypertension in vitro[J].Journal of Intercultural Ethnopharmacology, 2016, 5(2):122-130.
[7] HU Q H, ZHANG X, WANG X, et al.Quercetin regulates organic ion transporter and uromodulin expression and improves renal function in hyperuricemic mice[J].European Journal of Nutrition, 2012, 51(5):593-606.
[8] FENG S M, WU S J, XIE F, et al.Natural compounds lower uric acid levels and hyperuricemia:Molecular mechanisms and prospective[J].Trends in Food Science &Technology, 2022, 123:87-102.
[9] LI J L, HWANG I C, CHEN X G, et al.Effects of chitosan coating on curcumin loaded nano-emulsion:Study on stability and in vitro digestibility[J].Food Hydrocolloids, 2016, 60:138-147.
[10] LESJAK M, BEARA I, SIMIN N, et al.Antioxidant and anti-inflammatory activities of quercetin and its derivatives[J].Journal of Functional Foods, 2018, 40:68-75.
[11] LIN J X, XIONG T, PENG Z, et al.Novel lactic acid bacteria with anti-hyperuricemia ability:Screening and in vitro probiotic characteristics[J].Food Bioscience, 2022, 49:101840.
[12] HAN C L, XIAO Y J, LIU E C, et al.Preparation of Ca-alginate-whey protein isolate microcapsules for protection and delivery of L.bulgaricus and L.paracasei[J].International Journal of Biological Macromolecules, 2020, 163:1361-1368.
[13] 陈超. 影响燕麦生物碱生物利用率的因素探究与纳米共包埋粒子的构建[D].无锡:江南大学,2020.CHEN C.Study on the factors affecting the bioavailability of oat alkaloids and the construction of nano-co-embedded particles[D].Wuxi:Jiangnan University, 2020.
[14] ANANTA E, VOLKERT M, KNORR D.Cellular injuries and storage stability of spray-dried Lactobacillus rhamnosus GG[J].International Dairy Journal, 2005, 15(4):399-409.
[15] NEUENFELDT N H, ALMEIDA FARIAS C A, DE OLIVEIRA MELLO R, et al.Effects of blueberry extract co-microencapsulation on the survival of Lactobacillus rhamnosus[J].LWT, 2022, 155:112886.
[16] XAVIER-JR F H, GUEUTIN C, CHACUN H, et al.Mucoadhesive paclitaxel-loaded chitosan-poly (isobutyl cyanoacrylate) core-shell nanocapsules containing copaiba oil designed for oral drug delivery[J].Journal of Drug Delivery Science and Technology, 2019, 53:101194.
[17] VALENCIA M S, FRANCO DA SILVA M Jr, XAVIER F H Jr, et al.Bioactivity and cytotoxicity of quercetin-loaded, lecithin-chitosan nanoparticles[J].Biocatalysis and Agricultural Biotechnology, 2021, 31:101879.
[18] 吴超. 黄酮苷元的制备及其微胶囊化[D].无锡:江南大学,2006.WU C.Preparation and microencapsulation of flavonoid aglycones[D].Wuxi:Jiangnan University, 2006.
[19] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food - an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[20] BARAJAS- LVAREZ P, GONZ
LVAREZ P, GONZ LEZ-
LEZ- VILA M, ESPINOSA-ANDREWS H.Microencapsulation of Lactobacillus rhamnosus HN001 by spray drying and its evaluation under gastrointestinal and storage conditions[J].LWT, 2022, 153:112485.
VILA M, ESPINOSA-ANDREWS H.Microencapsulation of Lactobacillus rhamnosus HN001 by spray drying and its evaluation under gastrointestinal and storage conditions[J].LWT, 2022, 153:112485.
[21] REYES V, CHOTIKO A, CHOULJENKO A, et al.Viability of Lactobacillus acidophilus NRRL B-4495 encapsulated with high maize starch, maltodextrin, and gum Arabic[J].LWT, 2018, 96:642-647.
[22] RAZAVI S, JANFAZA S, TASNIM N, et al.Microencapsulating polymers for probiotics delivery systems:Preparation, characterization, and applications[J].Food Hydrocolloids, 2021, 120:106882.
[23] SANTIVARANGKNA C, KULOZIK U, FOERST P.Alternative drying processes for the industrial preservation of lactic acid starter cultures[J].Biotechnology Progress, 2007, 23(2):302-315.
[24] 王东. 乳清蛋白和槲皮素的复合作用及其对乳液稳定性的影响[D].哈尔滨:东北农业大学,2021.WANG D.Complex action of whey protein and quercetin and its effect on emulsion stability[D].Harbin:Northeast Agricultural University, 2021.
[25] CHEN X, MCCLEMENTS D J, ZHU Y Q, et al.Enhancement of the solubility, stability and bioaccessibility of quercetin using protein-based excipient emulsions[J].Food Research International, 2018, 114:30-37.
[26] LI H Y, PENG F, LIN J X, et al.Preparation of probiotic microcapsules using gelatin-xylooligosaccharides conjugates by spray drying:Physicochemical properties, survival, digestion resistance and colonization[J].Food Bioscience, 2023, 52:102462.