任何有氧呼吸的生物都会产生自由基,而过量的自由基会引发氧化应激,导致DNA、RNA和膜脂等生物分子发生氧化损伤,进而引起各种疾病,如过早衰老、癌症、动脉粥样硬化、糖尿病和心血管病等[1]。为了避免氧化应激的影响,抗氧化剂已被广泛用于食品、医药和化妆品等行业中[2]。然而,一些研究发现化学合成抗氧化剂会对人体造成一定的损害[3]。因此,寻找安全有效的天然抗氧化剂逐渐成为人们关注的焦点。抗氧化肽作为一种天然抗氧化剂,因其结构相对简单、易吸收、稳定性好、无免疫反应性,渐渐成为研究人员、消费者和食品行业高度关注的关键功能成分[4]。近年来,各种食物来源的蛋白质已被用于生产天然抗氧化肽,例如大豆、火腿和鲑鱼等[5-7]。此外,在实际生产加工及应用过程中,肽类物质可能会因为氧化、水解、螯合等作用而降解,不同的加工环境 (pH、金属离子、加热) 也可能会导致多肽的结构发生变化,进而影响其抗氧化活性及功能[8]。因此,研究不同加工条件对肽活性的影响,对肽在功能性食品中的应用具有重要的参考价值。
我国是世界上拥有牦牛最多的国家,牦牛屠宰后大量牦牛骨(约占其体重约20%)的深层次利用和高附加值加工很少,这不仅浪费了宝贵的骨骼资源,还对高原的生态环境造成了较大的压力。牦牛骨富含胶原蛋白,被认为是生物活性肽的有效来源。最近,许多研究报道了牦牛骨胶原衍生肽 (yak bone collagen peptides,YBCPs) 的制备及其生物活性,例如改善骨骼健康、抗衰老和抗糖尿病等[9-11]。在之前的研究中,YBCPs已被证明不仅可以改变小鼠肠道菌群的组成并提高短链脂肪酸的产生,还可以通过调节NF-κB信号通路和NO的产生来有效抑制炎症[12-13]。这表明YBCPs具有一系列生物活性,可以作为改善人类健康的功能成分。此外,还发现牦牛骨胶原蛋白的水解物在体外抗氧化活性验证中展现出良好的抗氧化活性,并从中鉴定出了几种低分子质量肽[14-15]。然而,这些低分子质量肽的稳定性和抗氧化活性尚未得到广泛的研究。
因此,本研究从先前鉴定的牦牛骨胶原蛋白肽中筛选出4条具有生物活性的肽。这些肽在生物信息学在线预测平台上的结果显示,它们无毒性和过敏性,并且具有很好的水溶性。此外,它们还获得了较高的自由基清除(free radical scavenging,FRS)评分和螯合离子(chelate,CHEL)评分,表现出优秀的抗氧化潜力[13-14]。它们的氨基酸序列分别为:GPPGPAGPAG(P1)、GPAGPAGPIGPVG(P2)、GPAGPSGPAGK(P2)和GPAGPQGPR(P4)。首先,通过DPPH自由基清除能力、Fe2+螯合能力、羟自由基(·OH)清除能力和ABTS阳离子自由基清除能力验证了它们的抗氧化活性。接着,评估了4条肽在不同pH、温度、食品辅料、金属离子、光照和模拟体外胃肠道消化下的稳定性,并通过分子对接技术对4条肽与Keap1蛋白进行对接模拟,对其生物学性质进行评价并确定了其分子机制。本研究为牦牛骨胶原蛋白肽在各个行业和领域的研究及开发应用提供了依据。
1 材料与方法
1.1 材料与试剂
牦牛骨胶原蛋白肽(GPPGPAGPAG、GPAGPAGPIGPVG、GPAGPSGPAGK和GPAGPQGPR)(纯度>95%),上海诺优生物科技公司;DPPH、ABTS,上海麦克林生化科技有限公司;本实验所用其他试剂均为国产分析纯。
1.2 仪器与设备
FiveEasy plus pH仪,梅特勒托利多科(中国)有限公司;酶标仪,南京科麟得仪器有限公司;电热恒温水槽,上海精宏实验设备有限公司;高速离心机,安徽中科中佳科学仪器有限公司;电子分析天平,奥豪斯仪器(上海)有限公司;恒温金属浴,杭州博日科技股份有限公司。
1.3 牦牛骨胶原蛋白肽的抗氧化能力测定
通过DPPH自由基清除能力、Fe2+螯合能力、·OH清除能力和ABTS阳离子自由基清除能力来验证4条牦牛骨肽的抗氧化活性[6,15]。其中肽样品溶液用纯净水制备使其质量浓度为 0.01、0.05、0.1、0.5、1.0 g/L。
1.4 牦牛骨胶原蛋白肽的抗氧化稳定性研究
为更直观的表达肽的活性稳定性,参考姬中伟[16]的方法,以DPPH自由基清除能力维持率为指标,评估4条牦牛骨胶原蛋白肽在不同pH、温度、食品辅料、金属离子的抗氧化稳定性。
参考梁雪等[17]的方法并稍作修改,配制1 g/L的肽样品溶液,分别置于黑暗、室内自然光以及阳光直射条件下6 h,并以黑暗条件下样品的DPPH自由基清除能力为对照,计算DPPH自由基清除能力维持率来评估4条肽的光稳定性。
参考郑昌亮等[18]的方法并稍作修改,以DPPH自由基清除能力为指标,配制1 g/L的肽样品溶液,评估体外模拟胃肠消化对4条牦牛骨胶原蛋白肽抗氧化活性的影响。
1.5 肽与受体Keap1的分子对接
参考SUN等[19]的方法并稍作修改,通过Discovery Studio (DS) 软件 (2019版,美国Dassault Systems Biovia) 构建肽的三维结构,然后通过Prepare Ligands对肽进行了结构优化。从PDB数据库下载Keap1/Nrf2 复合物 (PDB ID:6QMK) 作为受体。在DS软件中去除了Keap1/Nrf2复合物的Nrf2配体和水,接着执行了清洁蛋白方案和制备蛋白方案,对Keap1受体进行了预处理,并定义了蛋白结合位点。优化后的肽添加了CHARMm力场,使用CDOCKER方案Keap1受体对接并将Pose Cluster Radius参数设置为0.5。
1.6 数据处理
采用Excel 2021软件进行数据处理、统计与分析,采用OriginPro 2024b和GraphPad Prism 9.5.0软件制图。数据以“平均数±标准差”表示,用SPASS 26将实验数据进行正态分布检验,对符合正态分布的数据进行单因素ANOVO检验后进行LSD多重比较检验以评估平均值之间的显著性,P<0.05为差异有统计学意义。
2 结果与分析
2.1 牦牛骨胶原蛋白肽抗氧化活性验证
自由基是高反应性物质,通常会诱发影响食品质量和营养的有害反应。此外,超负荷的自由基诱导的氧化应激也被认为是各种疾病的原因[20]。抗氧化剂可以通过3种主要机制抵消活性物质对细胞的有害影响:氢原子转移(hydrogen atom transfer,HAT)、单电子-质子转移(single electron-proton transfer,SET) 和顺序质子损失电子转移(sequential proton loss by electron transfer,SPLET),以及螯合过渡金属的能力[21]。DPPH自由基清除能力和ABTS阳离子自由基清除能力主要与SET有关,·OH清除能力与HAT作用机制有关。
4条肽的DPPH自由基清除能力、Fe2+ 螯合能力、·OH清除能力和ABTS阳离子自由基清除能力结果如图1所示。随着肽质量浓度的增加,4条肽的抗氧化能力也不断增强。当质量浓度为1 g/L时,P1和P4的DPPH自由基清除能力最强,分别达到了(50.36±0.33)%和(42.93±0.96)%(图1-a)。P3和P4的Fe2+螯合能力最强,分别达到(42.83±0.68)%和(45.99±0.32)%(图1-b)。4条肽还表现出一定的·OH清除能力和ABTS阳离子自由基清除能力。在质量浓度为1 g/L时,P1的·OH清除能力最佳,为(35.33±0.24)% (图1-c),P2的ABTS阳离子自由基清除能力最强,为(18.44±1.24)% (图1-d)。此外,4条肽的DPPH自由基清除能力和Fe2+螯合能力随着质量浓度增加仍有良好的上升趋势。据报道,生物活性肽中的疏水性氨基酸尤为重要,它们可促进与脂质的相互作用,从而表现出强大的自由基清除活性[22]。本研究中4条肽都含有高比例的疏水性氨基酸,P1、P2、P3和P4含有的疏水性氨基酸比例分别为60.00%、61.50%、45.45%和44.44%。有研究表明,低分子质量的肽往往表现出更好的抗氧化活性[23]。FAN等[24]发现由枯草芽孢杆菌发酵鸭肝制备得到的低分子质量肽相较于高分子质量的肽,展现出了更强的抗氧化能力。此外,碱性氨基酸有助于抗氧化肽更好的与金属离子螯合,因为它们能够利用其侧链的带电基团与金属离子形成金属螯合物[25]。在本研究中,P3和P4的Fe2+螯合能力较强,这可能是因为它们在N端都含有碱性氨基酸。P1和P4的总抗氧化活性相对较强,这可能是由于P1和P4的肽链最短,分子质量最小。总体来说,这4条肽具有良好的抗氧化活性,在食品工业中具有作为抗氧化添加剂的潜力。
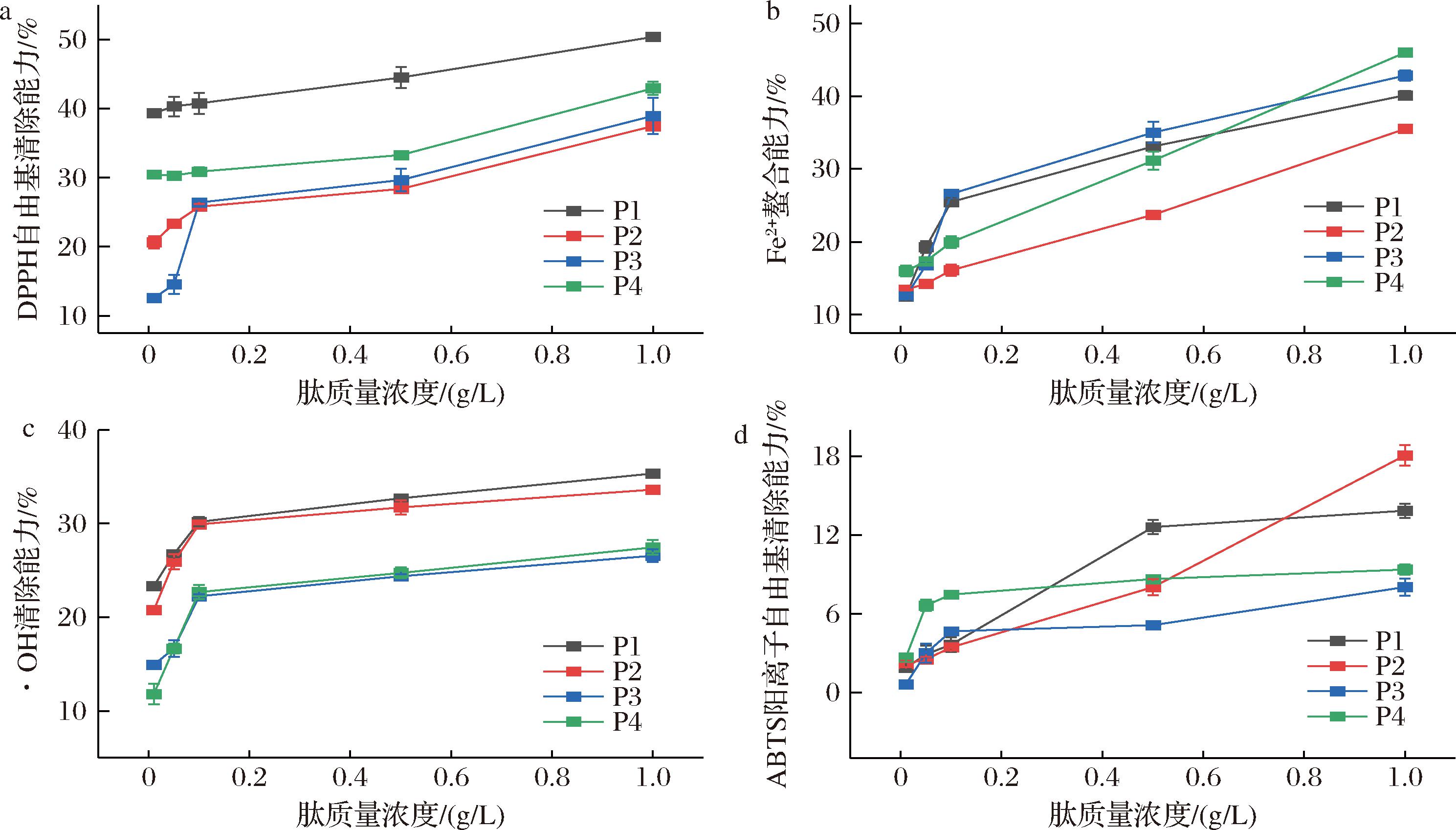
a-DPPH自由基清除能力;b-Fe2+螯合能力;c-·OH清除能力;d-ABTS阳离子自由基清除能力
图1 四条肽的抗氧化活性验证
Fig.1 The antioxidant activity of the four peptides
2.2 牦牛骨胶原蛋白肽的抗氧化稳定性研究
2.2.1 不同温度对牦牛骨胶原蛋白肽抗氧化活性的影响
食品加工过程中通常会涉及到温度的变化,不同温度对牦牛骨胶原蛋肽抗氧化活性的影响如图2-a所示。当温度从25 ℃升至75 ℃时,P1和P3的DPPH自由基清除能力维持率均有所下降,但都能维持在90%以上。当温度从75 ℃进一步升至100 ℃时,4条肽的抗氧化能力均有所提升,其中P4的提升最为显著,提升了28.16%。这可能归因于4条肽中高比例的疏水氨基酸,有研究表明蛋白质中负责清除自由基的氨基酸残基主要是疏水性氨基酸,它们通常被隔离在分子核心内,而高温会导致肽的构象变化,将蛋白质分子内部的疏水性氨基酸残基暴露于水相中,从而暴露出更多活性位点,进而增强它们的自由基清除能力[6,26]。总体而言,传统的热处理对这4种肽的活性影响较小,它们在各种热处理技术中具有广泛的潜在应用。
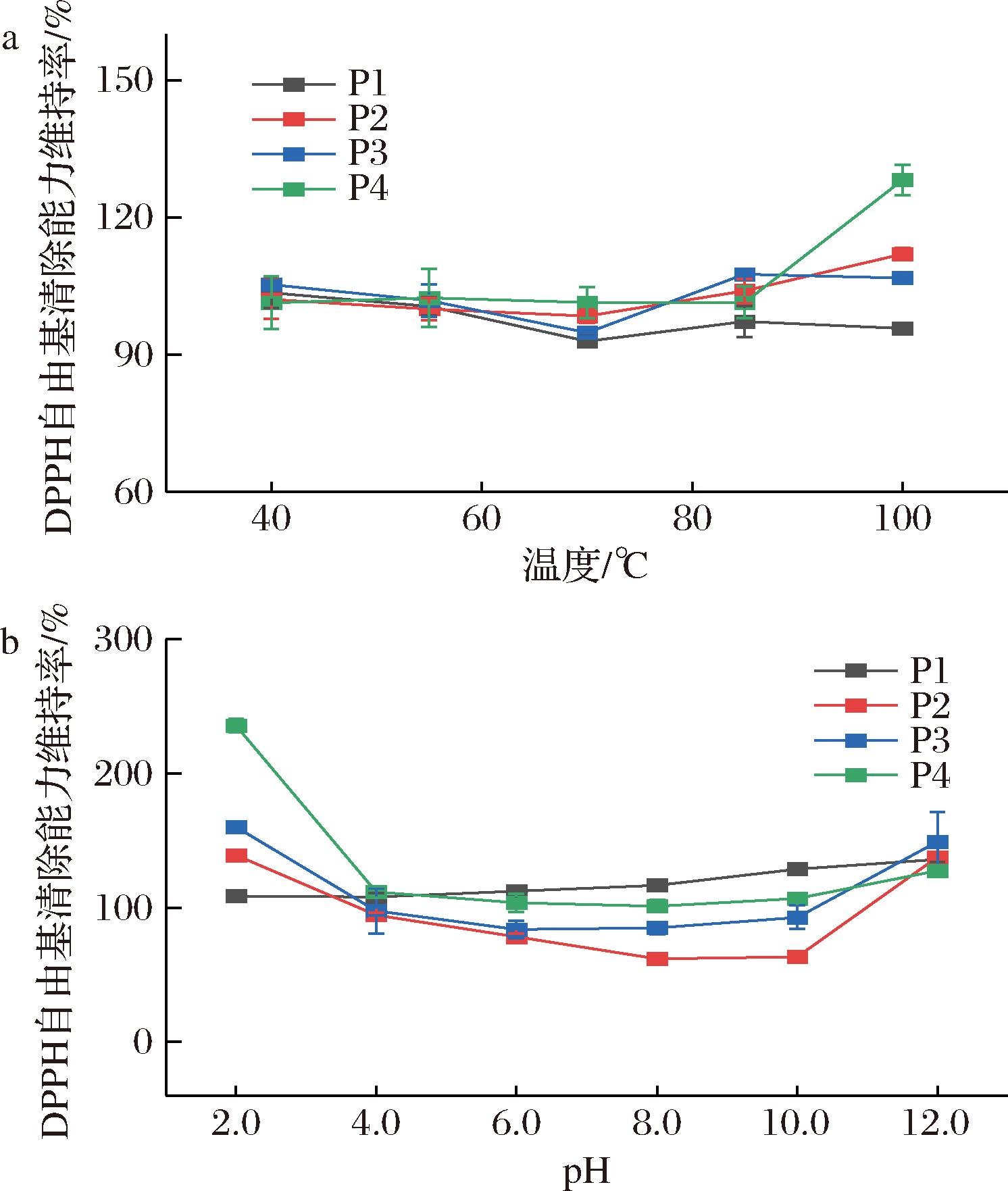
a-温度;b-pH
图2 不同温度和pH对4条肽抗氧化活性的的影响
Fig.2 Effect of different temperatures and pH on the antioxidant activity of four peptides
2.2.2 不同pH对牦牛骨胶原蛋白肽抗氧化活性的影响
环境的pH值会影响电离特性和电子转移,从而影响肽的抗氧化能力[27]。不同pH对牦牛骨胶原蛋肽抗氧化活性的影响如图2-b所示,当pH值为2.0时,4条肽的DPPH自由基清除能力都有所提高,其中P4提升的最多,提高了135.60%。当pH值从4.0提高至10.0时,P2和P3的DPPH自由基清除能力有所下降,分别下降了31.07%和4.76%。当pH值大于10.0时,P2和P3的DPPH自由基清除能力有所回升,分别提高了74.37%和56.48%。据一些报道,酸性条件可能会影响肽分子上羟基的可用性,并提高肽的氢供氢能力[28]。此外,在特定的pH值下,抗氧化肽中的氨基酸残基可能达到最佳的离子化状态,从而提高其与自由基的反应活性。在4条肽中,P4在pH值为2时抗氧化能力提升最为显著,这可能是因为它的C端含有碱性氨基酸,酸性条件可能会影响其氢键的生成和断裂,从而增强其抗氧化能力。然而,在碱性条件下,一些肽可能会发生外消旋化和脱酰胺反应,导致其抗氧化活性降低[29]。此外,计算了P1、P2、P3和P4的等电点 (https://www.novopro.cn/tools/calc_peptide_prop-erty.html,访问日期:2024年11月20日),分别为7.00、7.00、10.09和11.05。在等电点时,由于缺乏电荷,肽最不稳定,这可能会阻碍肽与自由基之间的反应,从而导致其抗氧化活性变化。本研究表明P1和P4在不同pH下仍能保持良好的抗氧化活性,而P2和P3适合在弱酸性条件下加工和贮存。
2.2.3 不同食品辅料对牦牛骨胶原蛋白肽抗氧化活性的影响
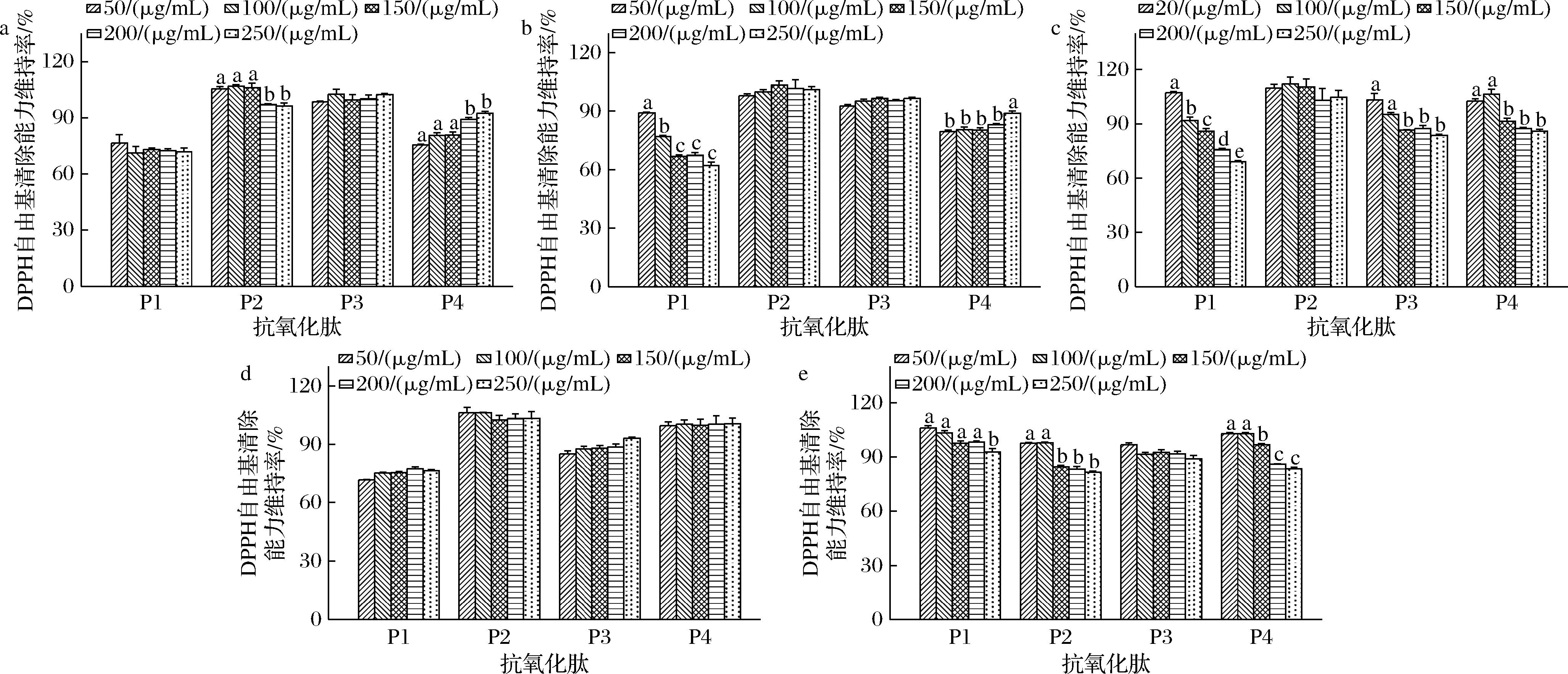
NaCl、蔗糖和柠檬酸是食品中常见的调味剂,苯甲酸钠和柠檬酸钾则是常见的防腐剂,它们对4条肽抗氧化活性的影响如图3所示。其中,P1受NaCl的影响最大,且随着NaCl质量浓度增高,其DPPH自由基清除能力最多下降了14.25% (图3-a)。P2相对稳定,其DPPH自由基清除活性始终维持在90%以上。P3和P4受山梨酸钾的影响最大,当山梨酸钾存在时,其活性维持率分别下降了16.46%和35.53% (图3-d)。这一点与XIE等[30]的结果相似,他们发现在较高盐浓度下,大豆肽的DPPH自由基清除能力最多下降了40%,这可能是因为在较高的盐浓度下,盐离子中和了肽中的静电排斥力,导致肽聚集并降低了抗氧化能力。此外,一些研究表明,山梨酸钾本身具有一定的抗氧化性,它可能与肽竞争性地清除自由基,从而影响肽的抗氧化能力。总的来说,不同的食品辅料对于4条肽的抗氧化活性影响不大,大多数情况下,它们都能维持85%以上的抗氧化活性。需要注意的是,P3和P4在加工和贮存过程中应避开山梨酸钾,以防止其抗氧化活性过度降低。

a-NaCl;b-蔗糖;c-柠檬酸;d-山梨酸钾;e-苯甲酸钠
图3 不同食品原辅料对4条肽抗氧化活性的影响
Fig.3 Effect of different food adjuvants on the antioxidant activity of four peptides
注:不同小写字母表示组间存在显著性差异(P<0.05)(下同)。
2.2.4 不同金属离子对牦牛骨胶原蛋白肽抗氧化活性的影响
抗氧化肽在食品药物的加工生产中会不可避免会与金属器具接触,不同金属离子对不同肽的影响如图4所示。其中P1受金属离子的影响最大,在K+、Ca2+、Mg2+和Zn2+存在时,P1的DPPH自由基清除活性都有所下降。此外,随着Ca2+和Mg2+质量浓度增加,P1的DPPH自由基清除活性最多下降了37.85%和31.02%。P2和P4受Cu2+影响最大,随着Cu2+质量浓度增高,其DPPH自由基清除能力最多下降了18.62%和16.63% (图4-e)。P3相对稳定,其DPPH自由基清除活性始终维持在90%以上。总的来说,Zn2+和Cu2+对肽的抗氧化活性影响更大,这与陈琪等[31]和姚轶俊等[32]发现的结果一致。这可能是由于像Cu2+这样的过渡金属具有未填充的分层d轨道。这些轨道更有可能形成复合物,从而触发自由基和非自由基活性氧的产生[33]。此外,另一些研究表明添加金属离子会破坏肽之间的化学相互作用,降低其溶解度并暴露疏水基团,从而抑制抗氧化活性[8]。因此。在肽的加工过程中,应避免与相应的金属离子接触,以防止其抗氧化活性降低。
a-K+;b-Ca2+;c-Mg2+;d-Zn2+;e-Cu2+
图4 不同金属离子对4条肽抗氧化活性的影响
Fig.4 Effect of different metal ions on the antioxidant activity of four peptides
2.2.5 光照对牦牛骨胶原蛋白肽抗氧化活性的影响
长时间暴露在阳光下会对皮肤造成不可逆的损伤,天然抗氧化剂的开发已成为皮肤光损伤保护研究的重要方向[34]。不同光照条件对不同肽的影响如图5所示,P1、P2、和P3展现出良好的光稳定性,在不同光照条件下的DPPH自由基清除能力无显著差异。此外,P4在阳光直射条件下的DPPH自由基清除能力虽然有所下降,但也能维持在90%以上。本实验结果表明,4条肽具有良好的光稳定性,有应用于防晒化妆品的潜力。
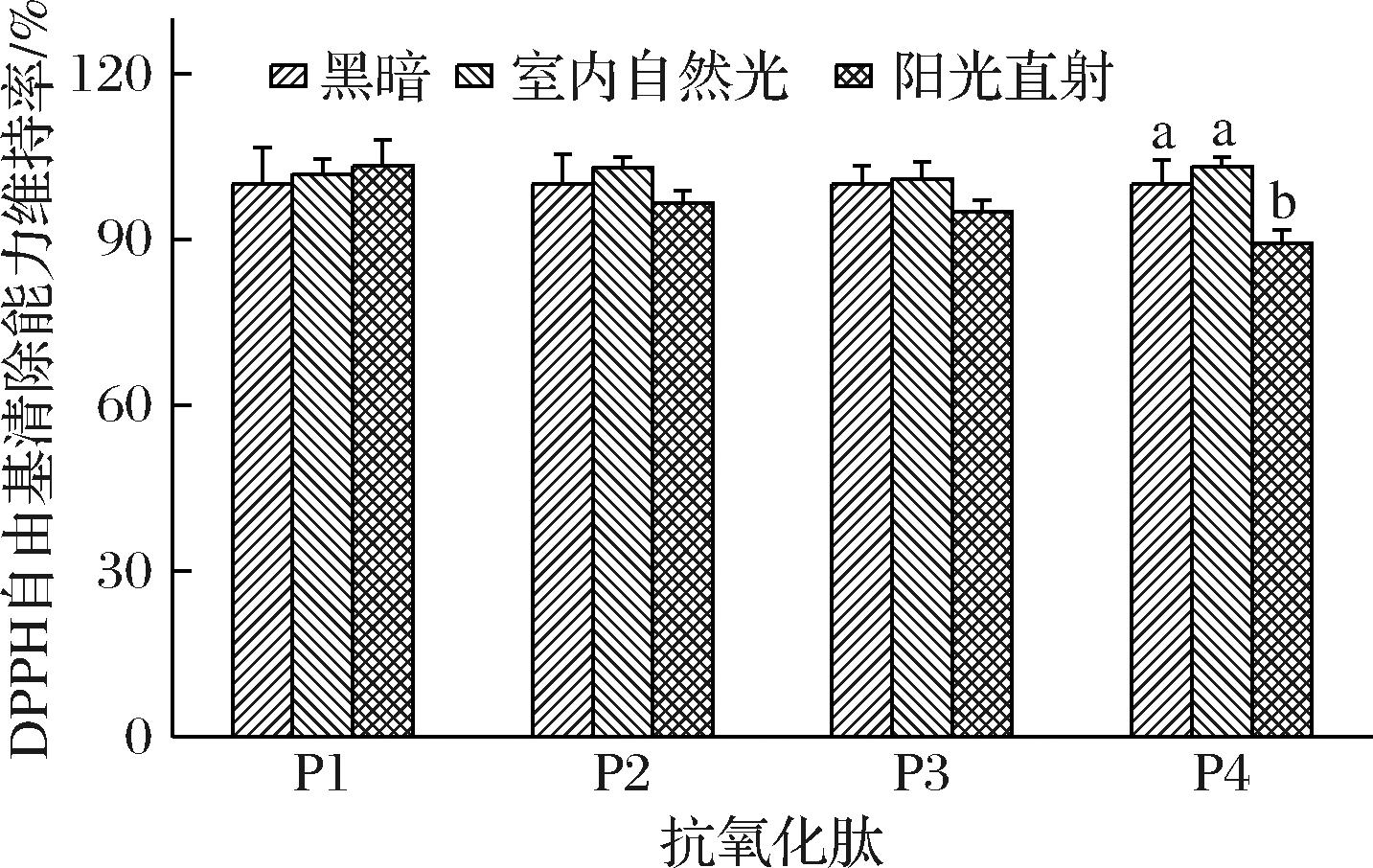
图5 光照对4条肽抗氧化活性的影响
Fig.5 Effect of sunlight on the antioxidant activity of four peptides
2.2.6 体外模拟胃肠消化对牦牛骨胶原蛋白肽抗氧化活性的影响
营养物质的吸收和利用需要经胃消化道吸收,再经肠消化道吸收。因此,有必要研究4条抗氧化肽在体外模拟胃肠道消化过程中的抗氧化活性的变化。如图6所示,4条肽在经过胃消化阶段后,DPPH自由基清除能力都有不同程度的增加,其中抗氧化能力较弱的P2、P3和P4提升较多,分别提高了64.41%、47.80%和77.37%。此外,4条肽再经过肠消化阶段后的DPPH自由基清除能力有着进一步增强,其中P1提升最多,提高了31.60%,P2、P3和P4也提高了20%左右。这与ZHU等[29]的研究结果类似,这可能是因为胃蛋白酶和胰蛋白酶将肽水解成更小的片段,从而将大量的疏水基团暴露在环境中,进而增强了肽的抗氧化活性。本研究为4条肽作为功能活性成分在食品领域中的应用奠定了基础。
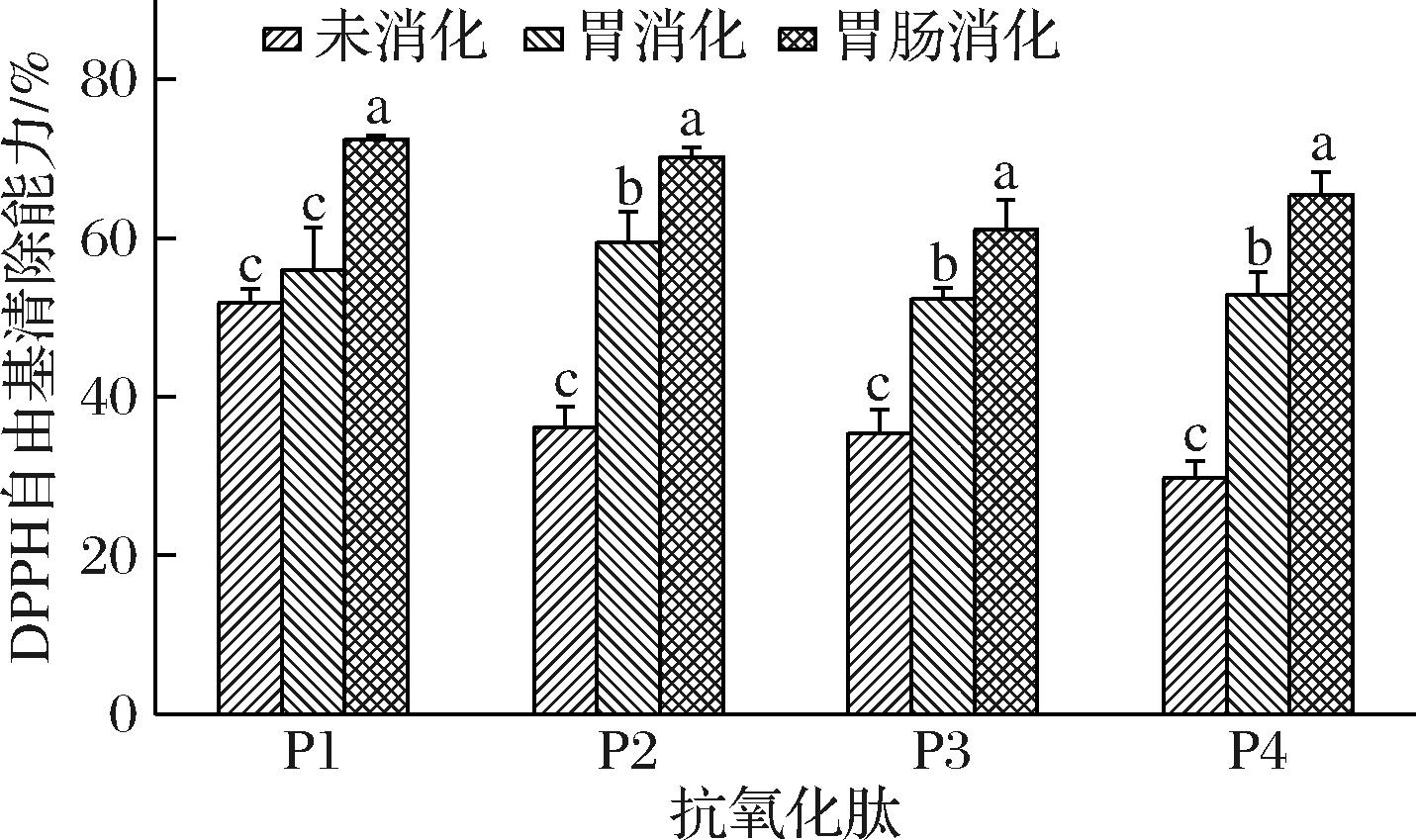
图6 模拟体外胃肠道消化对4条肽抗氧化活性的影响
Fig.6 Effect of digestion stages on the antioxidant activity of four peptides
2.3 分子对接
Keap1/Nrf2通路是调节细胞抗氧化反应的主要信号通路,激活Keap1/Nrf2通路可以减少外源性不良刺激引起的氧化损伤[35]。因此,选择Keap1/Nrf2复合物作为研究对象。正常情况下,Keap1与Cuulln3 (CUL3)形成泛素E3连接酶复合物,Nrf2会被Keap1复合体泛素化修饰并在细胞质中降解。如果多肽与Keap1的Nrf2结合位点结合,则可以增加游离Nrf2,促进Nrf2的核转移,从而激活抗氧化反应元件 (ARE),进而激活抗氧化基因,促进抗氧化酶的表达[2]。分子对接结果见表1,P1、P2和P3与Keap1/Nrf2成功对接,其中,P3的CDOCKER能量最低 (-102.18 kcal/mol),P1的CDOCKER能量最高(-63.24 kcal/mol)。相比之下,P3较容易与Keap1蛋白结合。P4未对接成功,这可能是因为相比于其他3条肽,其氨基酸序列中含有体积较大的精氨酸 (Arg) 和谷氨酰胺 (Gln)。这些氨基酸都连接在刚性较大的脯氨酸 (Pro) 的N端,导致多肽分子空间位阻增大,难以进入对接口袋和Keap1蛋白的活性位点有效结合。
表1 四条肽与 Keap1受体的对接结合能
Table 1 Docking binding energy of three peptides and Keap1

名称对接结合能/(kcal/mol)GPPGPAGPAG (P1)-63.24GPAGPAGPIGPVG (P2)-91.02GPAGPSGPAGK (P3)-102.18GPAGPQGPR (P4)无
注:P4与 Keap1受体对接未成功。
Keap1肽蛋白氢键分布的3D和2D图如图7所示。紫色区域表示Keap1提供氢供体,绿色区域表示Keap1提供氢受体。图8说明了抗氧化肽和Keap1受体之间结合位点数量的热图。结果表明,这些肽与Keap1的氨基酸 GLY367、VAL606、ARG415、TYR525、ARG483和GLY509具有多个结合位点。其中,ARG415和GLY367与肽的结合力最大,P1有2个力,P2有4个力,P3有8个力。其中,ARG415和GLY367都与P1形成1个氢键,与P2形成1个氢键和3个疏水作用力,与P3形成3个氢键和一个疏水作用力。因此,ARG415和GLY367是最关键的结合位点。此外,Keap1蛋白上的VAL606和GLY462也与肽具有多个结合位点。P1、P2和P3分别通过1个、2个和3个力连接到VAL606,它们都是氢键。P1和P2和GLY462都有2个力,它们也都是氢键。此外,Keap1和肽之间存在多个范德华力。一般来说,蛋白质和肽通过多种作用力键合,例如氢键、疏水相互作用、范德华力、π键、碳氢键和电荷,其中氢键和疏水相互作用是小分子与蛋白质结合之间的关键作用力。本研究结果表明,P1、P2和P3都能通过氢键和范德华力和Keap1蛋白结合,展现出良好的抗氧化潜力。

a1-P1 3D图;b1-P1 2D图;a2-P2 3D图;b2-P2 2D图;a3-P3 3D图;b3-P3 2D图
图7 三条肽与Keap1受体对接氢键分布的3D和2D图
Fig.7 3D and 2D map of hydrogen bond distribution of three peptides docking with Keap1 receptor
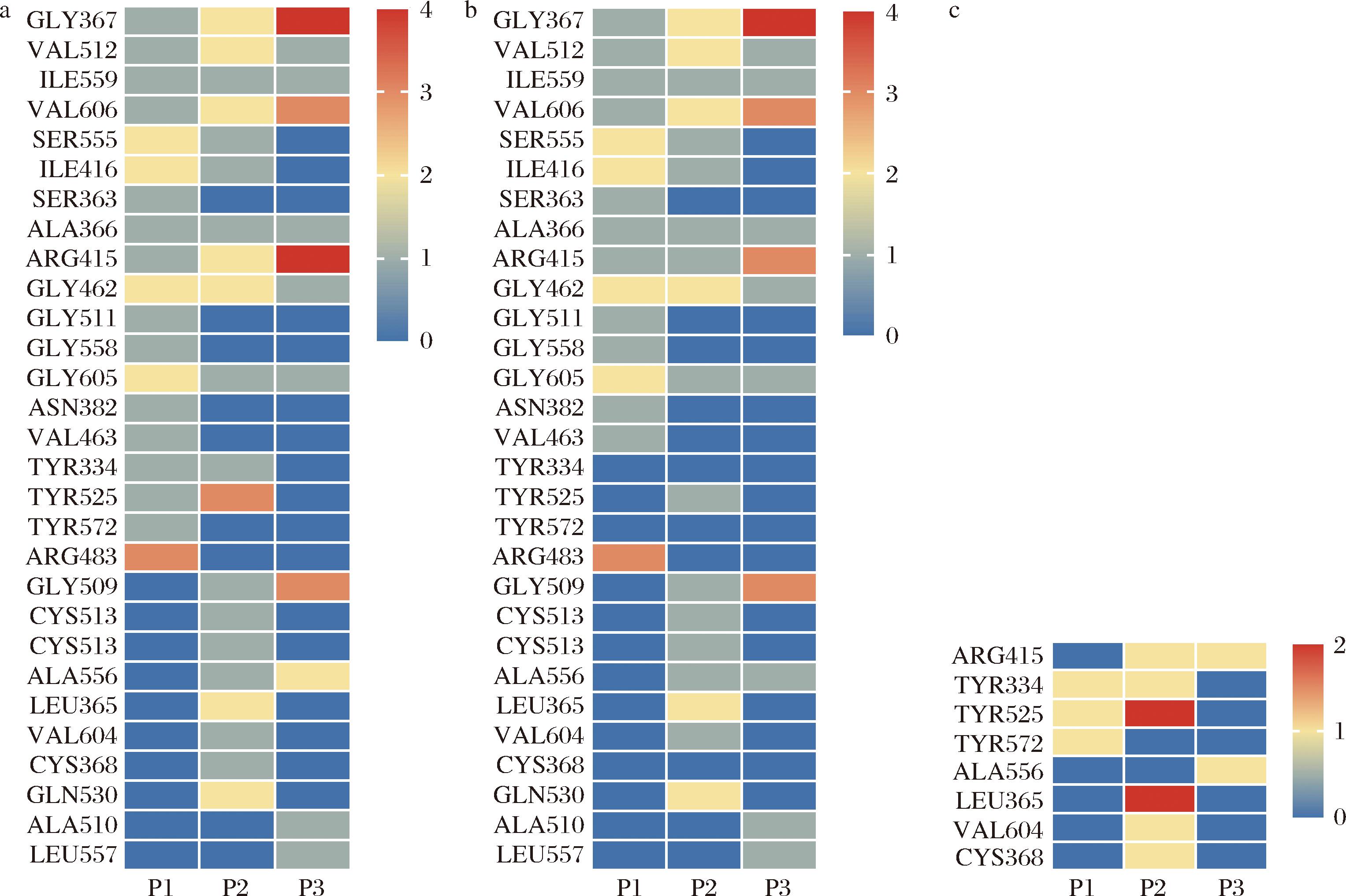
a-总结合位点;b-氢键位点;c-疏水相互作用结合位点
图8 三条肽与Keap1受体的结合位点和结合位点数量
Fig.8 Three peptides binding site and number of binding sites to Keap1 receptor
3 结论与讨论
本研究验证了4条牦牛骨胶原蛋白的抗氧化活性,并探究了不同条件对其抗氧化稳定性的影响。体外抗氧化活性验证和稳定性评估结果表明,4条肽拥有良好的抗氧化活性和稳定性,其中P1和P4的抗氧化能力较强,当质量浓度为1 g/L时,P1展现出最好的DPPH自由基清除能力[(50.36±0.33)%]和·OH清除能力[(35.35±0.24)%],P4展现出最好Fe2+螯合能力[(45.99±0.32)%]。在模拟胃肠道消化阶段,4条肽的抗氧化活性有显著提升 (P>0.05)。此外,在其他条件下,4条肽的抗氧化活性都能维持在85%以上,但不同的肽在少许不同的特定条件下活性有明显降低,其中Cu2+、Zn2+和山梨酸钾对4条肽的抗氧化活性影响较大。分子对接结果显示,P1、P2和P3成功与Keap1蛋白进行了对接,其中ARG415和GLY367被确认为关键的结合位点,而这种结合的主要作用力是氢键和范德华力。本研究表明,牦牛骨胶原蛋白肽有较好的抗氧化活性和应用潜力,可作为天然食物资源应用于功能性食品。此外,未来可在细胞实验和动物实验方面开展更广泛的研究,以更好地探索4条肽的抗氧化活性和机制。
[1] HUANG P T, MIAO J Y, LI J L, et al.Novel antioxidant peptides from pearl shell meat hydrolysate and their antioxidant activity mechanism[J].Molecules, 2023, 28(2):864.
[2] ZHU Z Q, XU Z W, LI Y H, et al.Antioxidant function and application of plant-derived peptides[J].Antioxidants, 2024, 13(10):1203.
[3] SUN Z D, TANG Z, YANG X X, et al.3- tert-butyl-4-hydroxyanisole impairs hepatic lipid metabolism in male mice fed with a high-fat diet[J].Environmental Science &Technology, 2022, 56(5):3204-3213.
[4] 张强, 李伟华.抗氧化肽的研究现状[J].食品与发酵工业, 2021, 47(2):298-304.ZHANG Q, LI W H.Research progress of antioxidant peptides[J].Food and Fermentation Industries, 2021, 47(2):298-304.
[5] CHOURASIA R, CHIRING PHUKON L, MINHAJUL ABEDIN M, et al.Production and characterization of bioactive peptides in novel functional soybean chhurpi produced using Lactobacillus delbrueckii WS4[J].Food Chemistry, 2022, 387:132889.
[6] NAN Y D, MU B D, GE C X, et al.Exploring the novel antioxidant peptides in low-salt dry-cured ham:Preparation, purification, identification and molecular docking[J].Food Chemistry, 2024, 446:138697.
[7] DE LA FUENTE B, PALLARÉS N, BERRADA H, et al.Salmon (Salmo salar) side streams as a bioresource to obtain potential antioxidant peptides after applying pressurized liquid extraction (PLE)[J].Marine Drugs, 2021, 19(6):323.
[8] 郭其洪, 李兴丽, 范江平, 等.辣木籽抗氧化肽的分离鉴定及其稳定性分析[J].食品工业科技, 2022, 43(5):41-47.GUO Q H, LI X L, FAN J P, et al.Isolation, identification and stability analysis of antioxidant peptides from Moringa oleifera seeds[J].Science and Technology of Food Industry, 2022, 43(5):41-47.
[9] LIU C Y, GUO Z T, YANG Y L, et al.Identification of dipeptidyl peptidase-IV inhibitory peptides from yak bone collagen by in silico and in vitro analysis[J].European Food Research and Technology, 2022, 248(12):3059-3069.
[10] WANG Y L, SUN Y D, WANG X G, et al.Novel antioxidant peptides from yak bones collagen enhanced the capacities of antiaging and antioxidant in Caenorhabditis elegans[J].Journal of Functional Foods, 2022, 89:104933.
[11] YE M L, AN C J, LIU H, et al.Synergistic effects and mechanisms of ultrasound-assisted pretreatments on the release of yak (Bos grunniens) bone collagen-derived osteogenic peptides in enzymatic hydrolysis[J].Food and Bioprocess Technology, 2022, 15(7):1658-1675.
[12] GUO Z T, LIU C Y, HU B, et al.Simulated gastrointestinal digestion of yak bone collagen hydrolysates and insights into its effects on gut microbiota composition in mice[J].Food Bioscience, 2021, 44:101463.
[13] YANG Y L, ZHU L Y, GUO Z T, et al.Yak bone collagen-derived anti-inflammatory bioactive peptides alleviate lipopolysaccharide-induced inflammatory by inhibiting the NF-κB signaling pathway and nitric oxide production[J].Food Bioscience, 2023, 52:102423.
[14] GUO Z T, YANG Y L, HU B, et al.The bioaccessibility of yak bone collagen hydrolysates:Focus on analyzing the variation regular of peptides and free amino acids[J].Foods, 2023, 12(5):1003.
[15] 杨玉亮, 衣大龙, 刘春雨, 等.体外模拟消化对牦牛骨胶原蛋白肽抗氧化活性的影响[J].食品与发酵工业, 2021, 47(13):79-84.YANG Y L, YI D L, LIU C Y, et al.Effects of in vitro simulated digestion on the antioxidant activity of yak bone collagen peptides[J].Food and Fermentation Industries, 2021, 47(13):79-84.
[16] 姬中伟. 小米醇溶蛋白肽的制备及其抗氧化与抗炎活性研究[D].无锡:江南大学, 2020.JI Z W.Study on the preparation of foxtail millet prolamins peptide and its antioxidant and anti-inflammatory activities[D].Wuxi:Jiangnan University, 2020.
[17] 梁雪, 孟宇寰, 刘晓亚, 等.γ-聚谷氨酸防晒纳米粒子的制备及性能[J].精细化工, 2022, 39(1):143-149;211.LIANG X, MENG Y H, LIU X Y, et al.Preparation and properties of γ-polyglutamic acid-based sunscreen nanoparticles[J].Fine Chemicals, 2022, 39(1):143-149;211.
[18] 郑昌亮, 陈梦婷, 汪兰, 等.鳙鱼肌原纤维蛋白源抗氧化肽的稳定性研究[J].食品与发酵工业, 2023, 49(8):43-50.ZHENG C L, CHEN M T, WANG L, et al.Stability of antioxidant peptides from bighead carp (Aristichthys nobilis) myofibrillar protein[J].Food and Fermentation Industries, 2023, 49(8):43-50.
[19] SUN C N, LIU Y N, LIU S Y, et al.Identification and molecular mechanism of novel antioxidant peptide from fish sauce:A combined quantum chemistry and molecular simulation[J].Food Chemistry, 2025, 463:141108.
[20] WEI W L, WANG W J, CHEN H, et al.A promising Artemisia capillaris Thunb.Leaf proteins with high nutrition, applicable function and excellent antioxidant activity[J].Food Chemistry, 2024, 21:101153.
[21] MOHAMMADI N, DOS SANTOS LIMA A, AZEVEDO L, et al.Bridging the gap in antioxidant activity of flavonoids:Correlating the oxidation of human plasma with chemical and cellular assays[J].Current Research in Food Science, 2024, 8:100714.
[22] THAHA A, WANG B S, CHANG Y W, et al.Food-derived bioactive peptides with antioxidative capacity, xanthine oxidase and tyrosinase inhibitory activity[J].Processes, 2021, 9(5):747.
[23] XU B T, DONG Q, YU C X, et al.Advances in research on the activity evaluation, mechanism and structure-activity relationships of natural antioxidant peptides[J].Antioxidants, 2024, 13(4):479.
[24] FAN X K, HAN Y, SUN Y Y, et al.Preparation and characterization of duck liver-derived antioxidant peptides based on LC-MS/MS, molecular docking, and machine learning[J].LWT, 2023, 175:114479.
[25] ZHENG Z J, LI J X, CHEN Y, et al.Preparation and characterization of lipophilic antioxidative peptides derived from mung bean protein[J].Food Chemistry, 2022, 395:133535.
[26] YE L, LIAO Y, SUN W Z, et al.Effect of protein oxidation on the stability of peanut beverage[J].CyTA-Journal of Food, 2015, 13(1):49-55.
[27] PEI J Y, GAO X C, PAN D D, et al.Advances in the stability challenges of bioactive peptides and improvement strategies[J].Current Research in Food Science, 2022, 5:2162-2170.
[28] LEMA SKA K, SZYMUSIAK H, TYRAKOWSKA B, et al.The influence of pH on antioxidant properties and the mechanism of antioxidant action of hydroxyflavones[J].Free Radical Biology and Medicine, 2001, 31(7):869-881.
SKA K, SZYMUSIAK H, TYRAKOWSKA B, et al.The influence of pH on antioxidant properties and the mechanism of antioxidant action of hydroxyflavones[J].Free Radical Biology and Medicine, 2001, 31(7):869-881.
[29] ZHU C Z, ZHANG W G, KANG Z L, et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science, 2014, 96(2):783-789.
[30] XIE M X, MA Y Y, AN F Y, et al.Ultrasound-assisted fermentation for antioxidant peptides preparation from okara:Optimization, stability, and functional analyses[J].Food Chemistry, 2024, 439:138078.
[31] 陈琪, 何静, 吉日木图.骆驼胎盘抗氧化肽的制备及其稳定性研究[J].食品与发酵工业, 2024, 50(12):234-242.CHEN Q, HE J, JI R M T.Preparation and stability of antioxidant peptide from camel placenta[J].Food and Fermentation Industries, 2024, 50(12):234-242.
[32] 姚轶俊, 张晶, 鞠兴荣, 等.菜籽抗氧化肽WDHHAPQLR的环境稳定性研究[J].中国粮油学报, 2019, 34(8):54-60.YAO Y J, ZHANG J, JU X R, et al.Environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):54-60.
[33] WONG F C, XIAO J B, ONG M G, et al.Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal, pH and simulated gastrointestinal digestion treatments[J].Food Chemistry, 2019, 271:614-622.
[34] XIE C, FAN Y, YIN S G, et al.Novel amphibian-derived antioxidant peptide protects skin against ultraviolet irradiation damage[J].Journal of Photochemistry and Photobiology B:Biology, 2021, 224:112327.
[35] TONOLO F, MORETTO L, GRINZATO A, et al.Fermented soy-derived bioactive peptides selected by a molecular docking approach show antioxidant properties involving the Keap1/Nrf2 pathway[J].Antioxidants, 2020, 9(12):1306.