淀粉基薄膜作为替代石油基塑料食品包装的理想候选材料,机械强度不足、耐水性差、功能活性单一等始终是制约其规模化应用的固有瓶颈[1]。传统增强策略如添加合成纳米填料或化学交联剂虽能提升其性能,但往往伴随生物降解性下降、环境毒性风险及加工能耗高等问题。一些天然生物聚合物因其独特的天然属性与结构优势成为更加绿色环保的替代方案。纤维素纳米纤维(cellulose nanofiber,CNF)作为一种天然增强填料,凭借其来源丰富、环境友好、成本低廉及表面富含羟基的特性,尤其适用于增强淀粉基薄膜。研究发现,在与淀粉、壳聚糖等聚合物基质共混时,CNF高纵横比和良好分散性的特点使它具备良好的网络纠缠能力[2],能够与基质羟基之间形成刚性氢键网络,导致从基质到纳米纤维的良好应力传递[3],提升薄膜的机械性能。此外,茶多酚(tea polyphenol,TP)作为一种从茶叶中提取的最常见的天然植物多酚[4],其分子结构中的儿茶素单元和苯环结构分别赋予TP良好的抗菌、抗氧化及抗紫外线能力[5]。同时,由于其丰富的酚羟基结构,TP还可以作为天然交联剂进一步改善薄膜的机械性能。
流延法仍然是目前应用于淀粉基薄膜最常见的方法,然而该方法在精确控制薄膜厚度并实现大规模连续生产方面具有挑战性[6-7]。刮刀涂布法是一种成本低、维护简单且能够灵活调控厚度的薄膜制备工艺,利用刮刀与基板的相对运动将溶液刮涂成厚度均一的薄膜[8],目前广泛应用在钙钛矿薄膜(太阳能电池)等化学材料领域[9-10]。淀粉浓度的增加可能有助于提高淀粉膜的机械强度[11],然而由于流动性的限制,高淀粉浓度在传统的重力流延法中并不适用。相反,刮刀涂布法非重力依赖的成膜机制为高固含量淀粉基薄膜的制备提供了新途径,这对于高强度淀粉基薄膜的开发更具优势。最重要的是,这种工艺展现出大规模连续生产的潜力[12]:通过一些热加工设备对成膜液进行加热糊化后倾倒在传送带上,传送带以一定的速度移动,在刮刀涂膜器和基材之间产生剪切力,剪切力将成膜液刮涂成厚度均一的薄膜,然后薄膜在40 ℃的热风中进入干燥器干燥。干燥后,将薄膜从基材上进行剥离收集,以实现薄膜的大规模生产。目前,刮刀涂布法在生物聚合物薄膜的加工制备及性能调控方面的研究仍较为匮乏,相关研究主要集中于仿生珍珠层砖泥结构的设计[13-15],刮刀涂布法制膜示意图如图1所示。
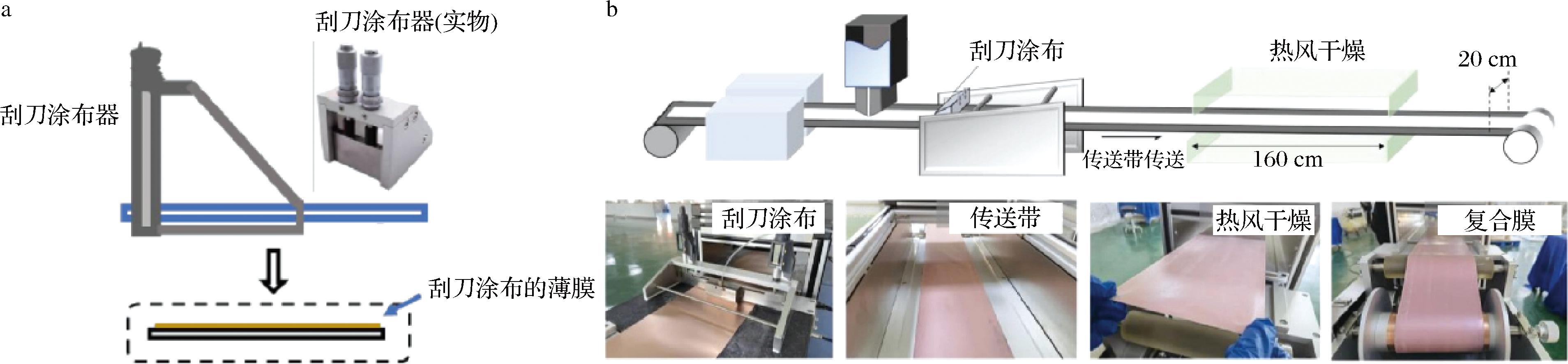
a-刮刀涂布器制膜示意图[16];b-刮刀涂布连续化加工工艺[12]
图1 刮刀涂布法
Fig.1 Scheme of blade coating
之前的研究已经证实CNF以及TP在改善淀粉基薄膜理化性质方面的重要作用[17-19],但两者协同增强淀粉基薄膜的研究仍属空白。因此,本研究采用刮刀涂布法,结合羧基化纤维素纳米纤维(carboxylated cellulose nanofiber,CNF-C)和TP制备了TP/CNF-C/淀粉复合膜(SF-CNF-TP),探讨了CNF-C和TP的含量对复合膜机械性能的影响规律,并对SF-CNF-TP的化学结构、光学特性、热稳定性、功能活性、生物降解性以及生物安全性进行评价,为可持续包装材料的大规模生产和实际应用提供理论依据和技术支持。
1 材料与方法
1.1 材料
玉米淀粉(corn starch,CS),诸城市兴茂玉米开发有限公司;直径4~10 nm、长度1~3 μm、质量分数1%的羧基化纤维素纳米纤维分散液,桂林奇宏科技有限公司;多酚质量分数≥98%的茶多酚、ABTS,阿拉丁生化科技有限公司;DPPH,索莱宝科技有限公司;金黄色葡萄球菌(ATCC 6538)、大肠埃希氏菌(ATCC 25922)、鼠伤寒沙门氏菌(ATCC 14028)和单核增生李斯特氏菌(ATCC 19115)由江南大学食品组分与物性中心提供。其余试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
150 mm KTQ-III型可调制备器(刮刀涂布器),上海祈工仪器设备有限公司;230 mm×340 mm钢化玻璃涂膜平台,上海祈色贸易有限公司;2 mm食品级耐高温硅胶板,上海凌灿橡塑制品有限公司;DHG-9123A型电热恒温鼓风干燥箱,上海柏欣仪器设备厂;HWS-24型电热恒温水浴锅,上海一恒科学仪器有限公司;SHB-Ⅲ型循环水式多用真空泵,长沙明杰仪器有限公司;Thermo SCIENTIFIC K-Alpha X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)系统,美国赛默飞世尔科技公司;D8 PHASER X射线衍射仪,德国布鲁克有限公司;Nexus傅里叶变换红外光谱仪,美国尼高力仪器公司;SU8100冷场发射扫描电子显微镜,日本日立公司;OCA15EC型视频光学接触角测量仪,德国德菲仪器股份有限公司;UV-1800紫外可见分光光度计,岛津企业管理(中国)有限公司;TGA2热重分析仪,梅特勒-托利多集团;TA.XT PlusC质构分析仪,英国稳定微系统公司。
1.3 羧基化纤维素纳米纤维/淀粉复合膜的制备
采用刮刀涂布法制备SF-CNF。按表1的配比分别称取CS、甘油和1%(质量分数,下同)CNF-C分散液于去离子水中,室温下搅拌使其溶解,得到CS/CNF-C复合悬浊液。悬浊液在90 ℃下加热同时磁力搅拌30 min,真空脱泡后,将均匀的成膜溶液倒在15 cm×30 cm的耐高温硅胶板上,硅胶板置于玻璃涂膜平台上,使用刮刀涂布器以15 cm/s的速度进行刮刀涂布,涂布后于室温中静置10 min,将硅胶板转移至40 ℃烘箱中干燥4 h。干燥后将薄膜从硅胶板上剥离,并在室温条件下在含有饱和K2CO3溶液(相对湿度43%)的干燥器中平衡24 h。含有不同量1%CNF-C分散液的薄膜(1%CNF-C分散液与CS的质量比分别为0、1∶1、2∶1、3∶1、4∶1和5∶1,此时CNF-C与CS的质量比分别为0、1∶100、1∶50、3∶100、1∶25和1∶20分别标记为SF、SF-CNF1、SF-CNF2、SF-CNF3、SF-CNF4和SF-CNF5。
表1 SF-CNF成膜溶液配方表
Table 1 Formulation of SF-CNF film-forming solutions
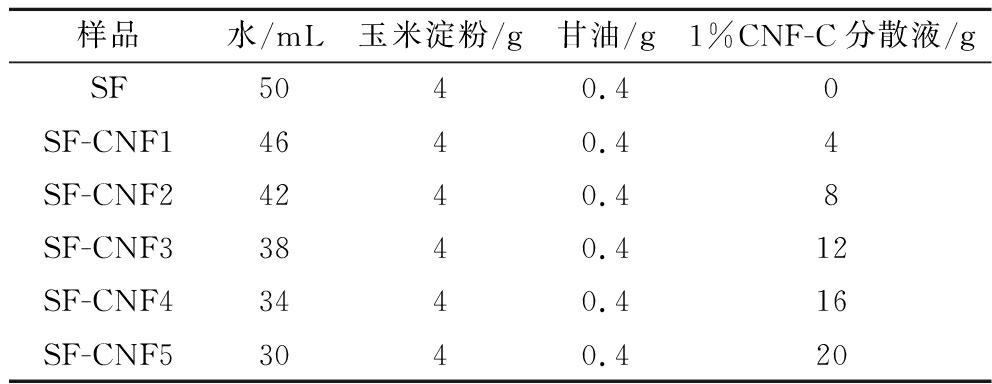
样品水/mL玉米淀粉/g甘油/g1%CNF-C分散液/gSF5040.40SF-CNF14640.44SF-CNF24240.48SF-CNF33840.412SF-CNF43440.416SF-CNF53040.420
1.4 茶多酚/羧基化纤维素纳米纤维/淀粉复合膜的制备
采用刮刀涂布法制备SF-CNF4-TP。首先,在去离子水(50 mL)中加入CS(4 g)、甘油(0.4 g)和1%CNF-C分散液(16 g),随后,分别加入不同量的TP(TP与CS的质量比分别为0、1∶20、1∶10、3∶20、1∶5和1∶4),在室温下搅拌使其溶解,得到CS/CNF-C/TP复合悬浊液。悬浊液在90 ℃下加热同时磁力搅拌30 min,真空脱泡后,将均匀的成膜溶液倒在15 cm×30 cm的耐高温硅胶板上,硅胶板置于玻璃涂膜平台上,使用刮刀涂布器以15 cm/s的速度进行刮刀涂布,涂布后于室温中静置10 min,将硅胶板转移至40 ℃烘箱中干燥4 h。干燥后将薄膜从硅胶板上剥离,并在室温条件下在含有饱和碳酸钾溶液(相对湿度为43%)的干燥器中平衡24 h。含有不同量TP的茶多酚/羧基化纤维素纳米纤维/淀粉复合膜(TP与CS的质量比分别为0、1∶20、1∶10、3∶20、1∶5和1∶4)分别标记为SF-CNF4、SF-CNF4-TP5、SF-CNF4-TP10、SF-CNF4-TP15、SF-CNF4-TP20和SF-CNF4-TP25。
1.5 XPS测定
使用XPS系统分析薄膜表面化学成分和化学基团。具体测试参数:激发源类型为单色化Al靶(E=1 486.68 eV),电压12 000.00 V,工作功率100 W,全谱的通能150 eV,精细谱的通能50 eV,功函数4.20 eV。使用Advantage软件进行分峰处理。
1.6 机械性能测定
使用质构分析仪测量薄膜的拉伸强度,该分析仪配备了A/TG拉伸夹具。将薄膜裁剪成1 cm ×7 cm的矩形条并夹紧在夹具上,在室温下以0.1 mm/s的速率进行拉伸,直至薄膜破裂。
1.7 光学特性测定
薄膜的光学特性包括透光率和紫外线屏蔽性能,使用紫外可见分光光度计测量薄膜在200~800 nm波长范围内的透光率。将薄膜样品裁剪成长方形(1.2 cm×5 cm)贴在石英比色皿一侧,以0.5 nm的采样间隔进行扫描。参考MA等[20]的方法评估薄膜的紫外线屏蔽性能,将薄膜放置在紫外线指示卡上,在波长365 nm的紫外线下照射指示卡1 min,记录照射前后指示卡颜色的变化。
1.8 抗氧化活性测定
1.8.1 DPPH 自由基清除活性
参考YANG等[21]的方法并稍做修改。将不同当量(0.625~12.5 mg/mL)的薄膜样品分别与4 mL DPPH溶液(0.1 mmol/L)混合,在黑暗环境中静置30 min后,用紫外可见分光光度计在517 nm波长条件下测定溶液的吸光度。DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
式中:A0,DPPH溶液的吸光度值;A1,加入薄膜后溶液的吸光度值。
1.8.2 ABTS阳离子自由基清除活性
参考GAO等[22]的方法并稍做修改。配制含7 mmol/L ABTS和2.45 mmol/L过硫酸钾的混合溶液,在黑暗条件下放置16 h,得到ABTS溶液。将不同当量(0.625~12.5 mg/mL)的薄膜样品分别与4 mL ABTS溶液混合,在室温下反应10 min,用紫外可见分光光度计在734 nm波长条件下测量溶液的吸光度值,ABTS阳离子自由基清除率按公式(2)计算:
ABTS阳离子自由基清除率![]()
(2)
式中:A2,ABTS溶液的吸光度值;A3,加入薄膜后溶液的吸光度值。
1.9 抑菌活性测定
采用琼脂平板扩散法(抑菌圈法)评估薄膜对革兰氏阳性菌(金黄色葡萄球菌和李斯特菌)和革兰氏阴性菌(大肠杆菌和沙门氏菌)的抑菌活性[23]。用打孔器将薄膜打孔为直径6 mm的圆片并在紫外灯下进行灭菌处理,将薄膜贴在涂布有0.1 mL细菌悬浮液(105~106 CFU/mL)的固体培养基上。在37 ℃培养箱中培养24 h后,用游标卡尺测量抑菌圈直径。
1.10 热稳定性测定
使用热重分析仪评估薄膜的热稳定性,称量约2 mg样品于陶瓷坩埚中,具体测试参数:在50 mL/min的N2环境下以10 ℃/min的升温速率从30 ℃加热至600 ℃。此外,还评估了薄膜在空气中的热稳定性;将薄膜样品和商用聚乙烯(polyethylene,PE)保鲜膜在150 ℃烘箱中加热15 min,拍摄加热处理前后的照片。
1.11 土壤降解试验
参考MA等[24]的方法并稍做修改。进行土壤埋藏降解实验以评估薄膜的生物降解性。用聚丙烯窗纱(20目)将边长为3 cm正方形薄膜包裹并埋入约9 cm深的土壤中。每隔1 d在固定时间取出薄膜,记录薄膜的外观变化。
1.12 生物安全性评价
参考QIN等[25]的方法,采用豆芽生长实验评估薄膜的生物安全性。绿豆泡种12 h后,移入育苗盆中网格上进行培养。将薄膜切割分散制备成1 mg/mL的溶液置于育苗盆中,对绿豆进行培养,同时以绿豆植株在水中的生长情况为对照。每隔1 d在固定时间测量豆芽的植株高度和根的长度,并拍摄记录豆芽的生长情况。
1.13 统计分析
所有数据均为3次平行,结果表示为“平均值±标准偏差”。通过SPSS 22.0软件进行方差分析,使用邓肯检验确定各组间的统计差异(P<0.05为显著水平)。
2 结果与分析
2.1 SF-CNF的机械性能分析
足够的机械性能对于包装应用至关重要。随着CNF-C含量从0%增加到5%,薄膜的拉伸强度持续上升,然后下降(图2-a)。SF-CNF4的拉伸强度最高(18.58 MPa),比SF的拉伸强度(13.19 MPa)显著提高了40.86%(P<0.05)。羧基化纤维素纳米纤维-淀粉复合膜机械性能的改善可能归因于CNF-C具备良好的分散性,同时,CNF-C高纵横比和高比面积的特点使它具备良好的网络纠缠能力[2],能够与淀粉的羟基之间形成刚性氢键网络,导致了从基质到纳米纤维的良好应力传递[3]。而过高的CNF浓度导致的拉伸强度的下降可能是因为过多的CNF-C会发生团聚,影响了其在淀粉基质中的分散性。CNF-C在基体中的分散性降低会导致应力传递不均匀,从而导致拉伸强度的下降[26]。随着CNF-C的增加,薄膜的断裂伸长率持续显著上升,SF-CNF5的断裂伸长率(7.11%)比SF的断裂伸长率(3.32%)显著增加了1.14倍。这说明CNF-C的添加有效提升了薄膜的柔韧性和延展性。XIA等[27]指出芳纶纳米纤维可以诱导分子沿拉伸方向排列从而增强薄膜的延展性即断裂伸长率,推测CNF-C也是类似的原因。韧性是一个综合指标,是通过应力-应变曲线下方面积的积分计算得出的[28],能够综合评价薄膜的拉伸强度和断裂伸长率。SF-CNF4更高的断裂伸长率与更高的拉伸强度相结合,导致与纯淀粉薄膜相比(0.296 5 MJ/m3),韧性值提升了2.47倍(1.027 7 MJ/m3)。在SF-CNF5出现了下降趋势,从1.027 7 MJ/m3降至0.942 1 MJ/m3,这表明当添加过量CNF-C时,薄膜的机械性能下降(图2-d)。过量CNF-C的团聚削弱了CNF-C和淀粉基质的连贯性,因此当CNF-C含量超过4%(质量分数)时机械性能发生下降,这一趋势与之前的研究一致[29]。如图2-e所示,SF-CNF的杨氏模量也随着CNF-C添加量的增加而增大,CNF-C的高刚度及其与基体的良好相互作用是复合膜杨氏模量增加的原因[30]。更重要的是,SF-CNF复合膜具备热封性能(图2-f),能够加工成为包装袋,在包装工业上具备一定的实用价值和加工适应性。这些结果表明,分散良好的羧基化纤维素纳米纤维和聚合物基体之间发生了适当的界面结合,能够通过聚合物-羧基化纤维素纳米纤维层有效地传递应力,增强薄膜的机械强度。

a-应力-应变曲线;b-拉伸强度;c-断裂伸长率;d-韧性;e-杨氏模量;f-SF-CNF4热封过程的数码照片
图2 SF-CNF的机械性能
Fig.2 Mechanical properties of SF-CNF
注:图中不同小写字母表示差异显著,P<0.05,下同。
2.2 SF-CNF-TP的机械性能分析
CNF-C/淀粉复合膜的机械强度在4%CNF-C添加量下(质量分数)达到最大。因此,在此基础上,添加不同含量的TP(TP与CS的质量比为0、1∶20、1∶10、3∶20、1∶5和1∶4),挑选出机械强度最好的SF-CNF4-TP使其能够更好地降低运输过程中食物因外力暴露在空气中的风险。如图3所示,随着TP的增加,薄膜的拉伸强度最初呈上升趋势,相较于SF-CNF4(18.58 MPa),当TP添加量为10%时,SF-CNF4-TP10的拉伸强度提升至27.31 MPa,在SF-CNF4-TP15达到最大(28.61 MPa),这归因于TP和基质成分之间的相互作用以及更密集的网络结构的形成。这表明适量的TP有助于聚合物网络的巩固和加强[31]。然而,当TP添加量超过15%时,拉伸强度降低。这可能归因于过量TP的分散和聚集,抑制复合膜中TP、CNF-C和淀粉基体之间的相互作用,导致基质中网状结构的削弱和破坏[32]。由于TP分子中存在多个酚羟基的交联网络效应,随着TP含量的增加,淀粉分子链的流动性逐渐降低。正如预期的那样,随着TP含量的增加,SF-CNF的断裂伸长率从6.94%持续下降到1.91%,其中,SF-CNF4-TP10的断裂伸长率为4.37%(图3-c)。韧性为应力-应变曲线下的面积,表示为断裂功[33]。由于TP的添加导致横坐标断裂伸长率的下降,虽然在纵坐标拉伸强度上有一定的提升(图3-b),但仍导致SF-CNF4-TP韧性的下降,此外,添加了TP的SF-CNF4-TP复合膜的韧性值呈现先增大后减小的趋势,当TP添加量为10%时,SF-CNF4-TP10的韧性值达到最大值0.834 0 GPa。CNF-C的添加能够大幅度提高淀粉膜的断裂伸长率,在拉伸强度的提升上作用较小;而TP的增加相较于CNF-C,能够较大程度地增加薄膜的拉伸强度,弥补SF-CNF拉伸强度的不足,同时能够赋予薄膜功能活性。因此,综合考虑薄膜的强度、柔韧性以及功能活性,确定TP的最佳添加量为10%。此时SF-CNF4-TP10的拉伸强度、断裂伸长率和韧性值较SF均有较大的提升,具备相对较高的拉伸强度、断裂伸长率、韧性和功能活性。如图3-f所示,SF-CNF4-TP10的拉伸强度和杨氏模量均优于或相当于常用的石油基塑料PE[34],表明其作为食品包装生物塑料替代品的巨大潜力。
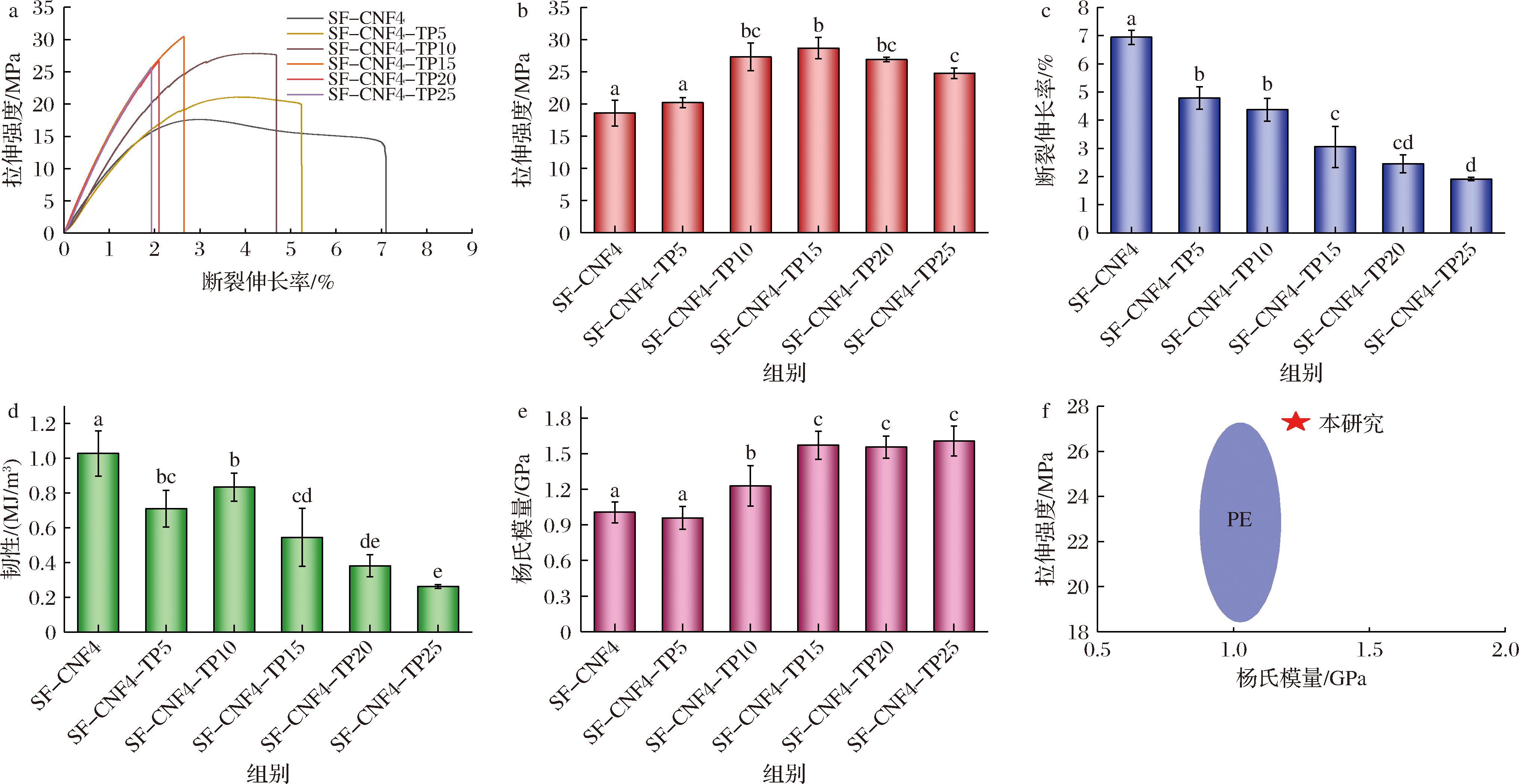
a-应力-应变曲线;b-拉伸强度;c-断裂伸长率;d-韧性;e-杨氏模量;f-SF-CNF4-TP10与PE膜机械性能的比较
图3 SF-CNF4-TP的机械性能
Fig.3 Mechanical properties of SF-CNF4-TP
2.3 SF-CNF-TP的化学结构分析
使用XPS系统测定SF、SF-CNF4、SF-CNF4-TP10的元素组成和化学基团变化,样品的XPS全谱如图4-a所示,所有复合膜在约285 eV和约530 eV处的峰分别对应于C元素和O元素的存在。归因于CNF-C丰富的羟基,SF-CNF4的O1s的峰强度最大,这可能有助于薄膜氢键网络的形成并更好地提高柔韧性,机械性能的结果也验证了这一点。C1s精细谱通常能够被解卷积为4个拟合峰(图4-b~图4-d):284.5 eV(C1:C—C/C—H),286.2 eV(C2:C—O),287.7 eV(C3:O—C—O/C![]() O)和288.8 eV(C4:O—C
O)和288.8 eV(C4:O—C![]() O)[35]。在C1s精细谱中,观察到添加了CNF-C后,C2峰的增大和C4峰的出现;羟基和羧基为羧基化纤维素纳米纤维主要的表面官能团,这表明CNF-C被成功引入到薄膜上[36-37]。SF-CNF4和SF-CNF4-TP10的羧基含量分别为2.6%和1.3%(图4-e);CNF-C在SF-CNF4占据的比例高于SF-CNF4-TP10,因此相较于SF-CNF4-TP10、SF-CNF4的O—C
O)[35]。在C1s精细谱中,观察到添加了CNF-C后,C2峰的增大和C4峰的出现;羟基和羧基为羧基化纤维素纳米纤维主要的表面官能团,这表明CNF-C被成功引入到薄膜上[36-37]。SF-CNF4和SF-CNF4-TP10的羧基含量分别为2.6%和1.3%(图4-e);CNF-C在SF-CNF4占据的比例高于SF-CNF4-TP10,因此相较于SF-CNF4-TP10、SF-CNF4的O—C![]() O官能团含量较高。此外,相较于SF-CNF4,在添加了TP的SF-CNF4-TP10的C1s光谱中,观察到C1峰的显著升高,SF-CNF4和SF-CNF4-TP10的C—C键含量分别为16.45%和32.5%,表明添加了TP后,薄膜表面富含烃类化合物,这可能有助于疏水性能的提高。由于CNF-C的添加,SF-CNF4和SF-CNF4-TP10表现出Na物质的存在(图4-f),这在XPS光谱中显示在 1 071~1 071.5 eV的区域。该XPS全谱和精细谱得出结论,CNF-C和TP在淀粉基体表面形成并掺杂,证实了TP/CNF-C/淀粉复合膜的成功形成。
O官能团含量较高。此外,相较于SF-CNF4,在添加了TP的SF-CNF4-TP10的C1s光谱中,观察到C1峰的显著升高,SF-CNF4和SF-CNF4-TP10的C—C键含量分别为16.45%和32.5%,表明添加了TP后,薄膜表面富含烃类化合物,这可能有助于疏水性能的提高。由于CNF-C的添加,SF-CNF4和SF-CNF4-TP10表现出Na物质的存在(图4-f),这在XPS光谱中显示在 1 071~1 071.5 eV的区域。该XPS全谱和精细谱得出结论,CNF-C和TP在淀粉基体表面形成并掺杂,证实了TP/CNF-C/淀粉复合膜的成功形成。
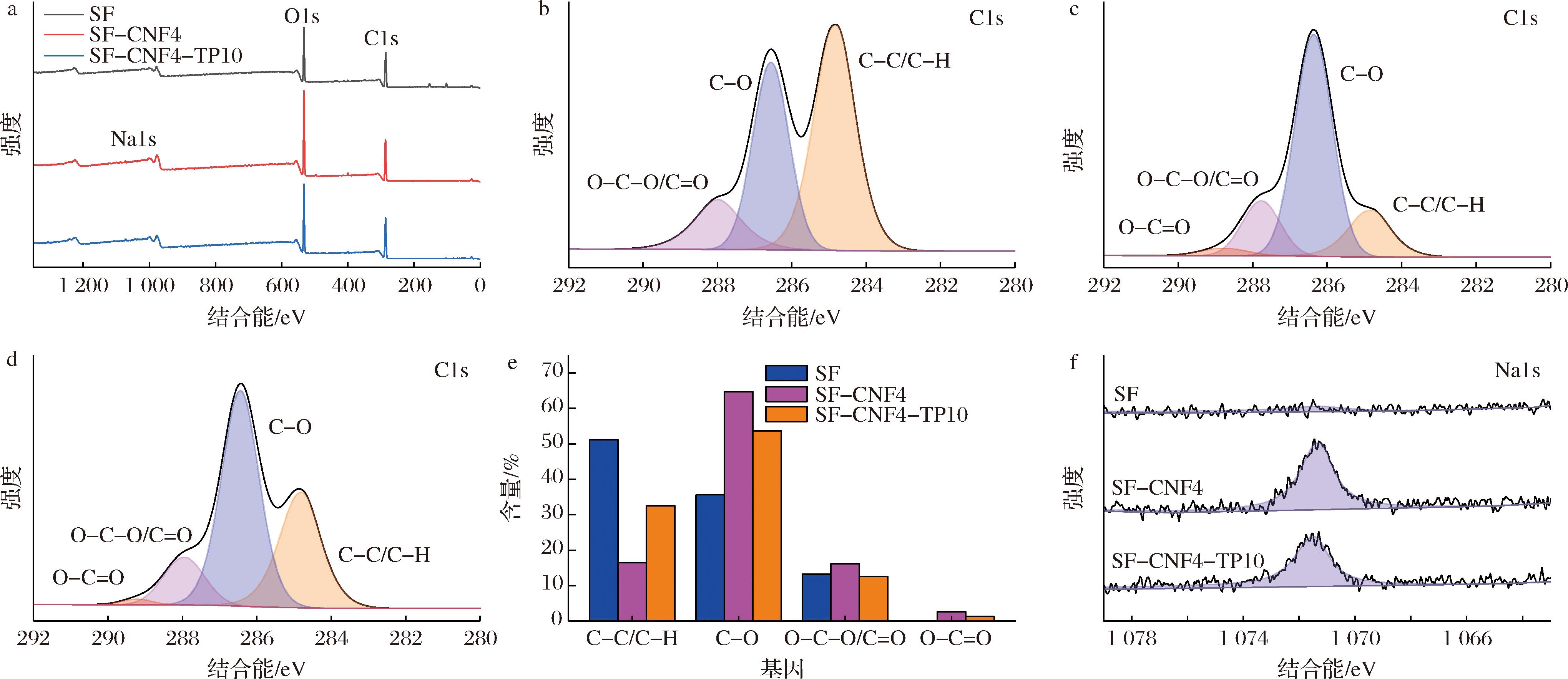
a-XPS 全谱;b-SF的C1s精细谱;c-SF-CNF4的C1s精细谱;d-SF-CNF4-TP10的C1s精细谱;e-相应的基团含量;f-Na1s精细谱
图4 薄膜样品的XPS图谱
Fig.4 XPS spectra of film samples
2.4 SF-CNF-TP的光学特性分析
透明度和紫外线防护是食品包装薄膜保护食品质量的重要特性。在280 nm和660 nm处测定薄膜的透光率,以评估薄膜的紫外线阻隔能力和透明度[38]。SF-CNF4-TP10薄膜显示出优异的透射率水平,在280 nm处的紫外区域和660 nm处的可见光区域透射率分别为80.51%和0.16%。CNF-C的均匀分散和纳米级尺寸,使纤维能够相互缠绕形成均匀致密的薄膜,减少光线的散射和反射现象,使薄膜具有较高的透明度[39]。如图5-c所示,添加了CNF-C的SF-CNF4和SF-CNF4-TP10,透明度T660均高于SF(78.88%)。虽然添加TP导致T600的轻微下降,但仍高于80%,透明度令人满意可用于透明食品包装。此外,TP中所含的芳香环和酚羟基等不饱和基团赋予其优异的紫外屏蔽能力[40]。如图5-a所示,添加TP后,在200~400 nm的紫外区,SF-CNF4-TP10的透射率较低。在280 nm波长处的透过率下降至0.16%,这表明SF-CNF4-TP10具备优异的紫外线阻隔性能(图5-b)。紫外线灯照射实验可以直观地反映紫外线屏蔽能力。用不同的薄膜覆盖紫外线指示卡,然后用365 nm的紫外线照射1 min。去除薄膜后,覆盖区域的颜色变化越小,紫外线屏蔽能力越强。如图5-b(插图)所示,被SF-CNF4覆盖的区域出现了明显的颜色变化,而SF-CNF4-TP10几乎没有颜色变化。这一现象进一步证实了TP可赋予薄膜出色的紫外线阻隔能力。总之,CS/CNF/TP复合膜具备一定的透明度和紫外线阻隔性能,能够一定程度上保护包装食品免受紫外线辐射引发的光氧化和光降解反应。
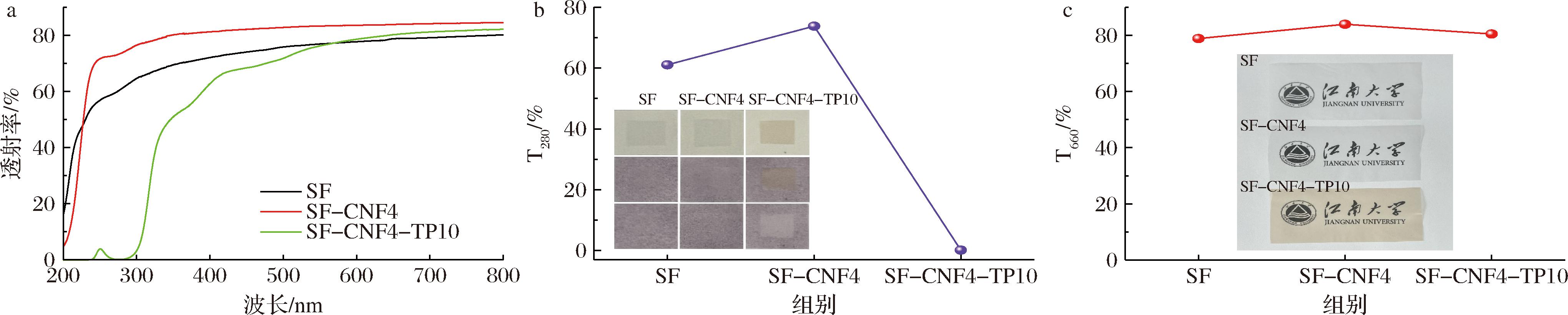
a-紫外-可见透射光谱;b-280 nm波长下的透射率和紫外线指示卡的光学照片(插图);c-660 nm波长下的透射率和薄膜样品的光学照片(插图)
图5 薄膜样品的光学特性
Fig.5 Optical properties of film samples
2.5 SF-CNF-TP的热稳定性分析
热稳定性是评估包装膜材料的一项关键性能。图6-a和图6-b显示了原料和薄膜的TG和DTG曲线。原料和薄膜样品均有相似的热分解过程,包括3个阶段:a)30~200 ℃,失重与样品游离水和结合水的蒸发有关;b)200~400 ℃,质量损失与淀粉分子链、甘油、羧基化纤维素纳米纤维和茶多酚的降解有关。甘油在这个阶段挥发,TP与CNF-C发生分解,淀粉中的碳链发生解聚[31];c)350~600 ℃,样品质量损失主要源于碳质残留物的热分解及其向灰分的最终转化。根据DTG结果,淀粉薄膜的热分解温度略低于淀粉原料的热分解温度,这可能与淀粉的晶体结构受损有关。SF、SF-CNF4和SF-CNF4-TP10的热分解温度分别为312.17、298.17 ℃和298.17 ℃,添加CNF-C和TP后,薄膜的热分解温度下降,表明SF-CNF4和SF-CNF4-TP10的热稳定性相较于SF有所降低。尽管如此,SF-CNF4-TP10在200 ℃以下仍具有出色的热稳定性,符合包装薄膜的实际温度需求。图6-c观察到SF-CNF4-TP10在200 ℃以下的高热稳定性:SF-CNF4-TP10在150 ℃环境下加热15 min后仍能保持原有形状,而商用PE保鲜膜已经变形,边缘卷曲。上述结果表明,SF-CNF4-TP10具备满足实际应用条件所需的热稳定性。
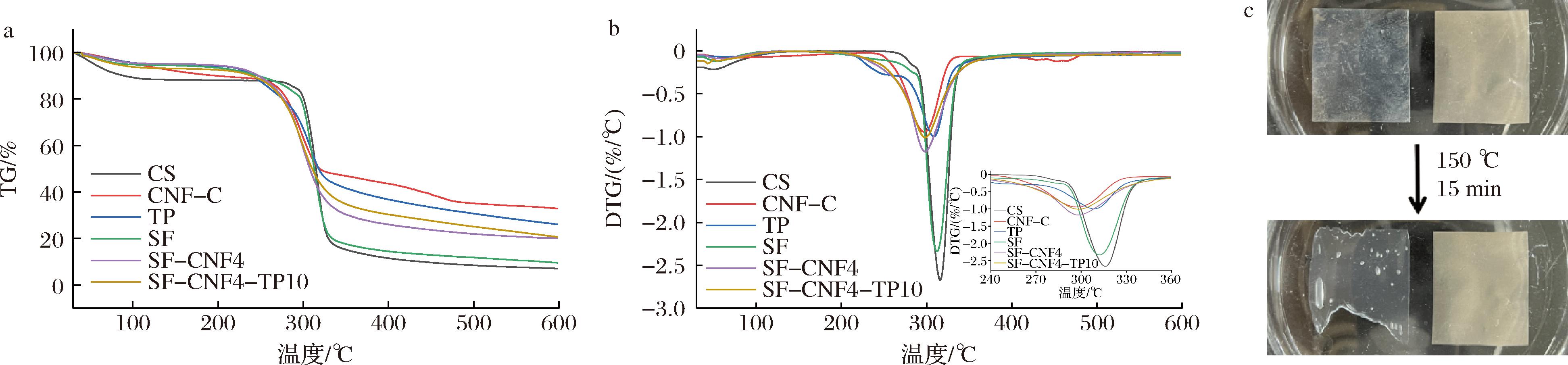
a-TG曲线;b-DTG曲线;c-PE和SF-CNF4-TP10在空气中加热前后的图片
图6 原料和薄膜样品的热稳定性
Fig.6 Thermal stability of ingredients and film samples
2.6 SF-CNF-TP的抗氧化活性和抑菌活性分析
TP分子中的酚羟基结构赋予其显著的抗氧化活性,能够有效提升食品包装材料的功能特性。通过DPPH自由基清除活性评价不同复合膜的抗氧化活性(图7-a)。以10 mg/mL的膜当量为例,SF和SF-CNF4的DPPH自由基清除率仅为3.87%和4.06%,表明其自由基清除能力几乎可以忽略不计。相比之下,含有10%TP(质量分数)的SF-CNF4-TP10的DPPH自由基清除率为71.96%,具备抗氧化特性。同时,SF-CNF4-TP10(50.15%)的ABTS阳离子自由基清除能力也显著高于未添加TP的SF(3.50%)和SF-CNF4(5.23%),当膜当量进一步增加至12.5 mg/mL时,SF-CNF4-TP10薄膜的ABTS阳离子自由基清除率超过60%。这些结果表明,添加TP增强了薄膜的抗氧化活性,并且这种增强表现出剂量依赖性。这种抗氧化活性的增强归因于TP中的酚羟基提供电子和氢原子以稳定自由基,从而能够通过中断链氧化反应起到抗氧化剂的作用[41]。该结果表明,SF-CNF4-TP10薄膜具有作为抗氧化功能包装的潜力。
赋予包装材料抑菌活性能够更好地维持食品的品质与感官特性,延长其保质期。采用抑菌圈法评估了SF、SF-CNF4和SF-CNF4-TP10对2种革兰氏阴性菌(大肠杆菌和沙门氏菌)和2种革兰氏阳性菌(金黄色葡萄球菌和李斯特菌)的抗菌活性(图7-c),图7-d显示了相应的抑菌圈直径。SF和SF-CNF4对4种菌都没有观察到明显的抑制区。表明淀粉和CNF 2种组分的抑菌效果并不理想。相反,SF-CNF4-TP10显示出了对4种菌明显的抑菌活性,对大肠杆菌、沙门氏菌、金黄色葡萄球菌和李斯特菌的抑菌圈直径分别为10.95、10.56、11.05 mm和11.36 mm。可以看出,SF-CNF4-TP10薄膜对革兰氏阳性菌的抑菌活性高于革兰氏阴性菌。这可归因于细胞结构的差异,类黄酮和抗氧化剂能够降解细菌肽聚糖并破坏细胞壁或膜结构,使蛋白质失活并破坏细菌代谢。革兰氏阳性菌(如金黄色葡萄球菌)的细胞壁由较厚的肽聚糖层构成,而革兰氏阴性菌(如大肠杆菌)则在较薄的肽聚糖层之外拥有一层额外的外膜,这层外膜为革兰氏阴性菌提供了更强的抵抗力[42]。这些结果表明,TP可以有效抑制微生物的繁殖和代谢,并在CNF-C/淀粉复合膜中发挥重要的抗菌作用。
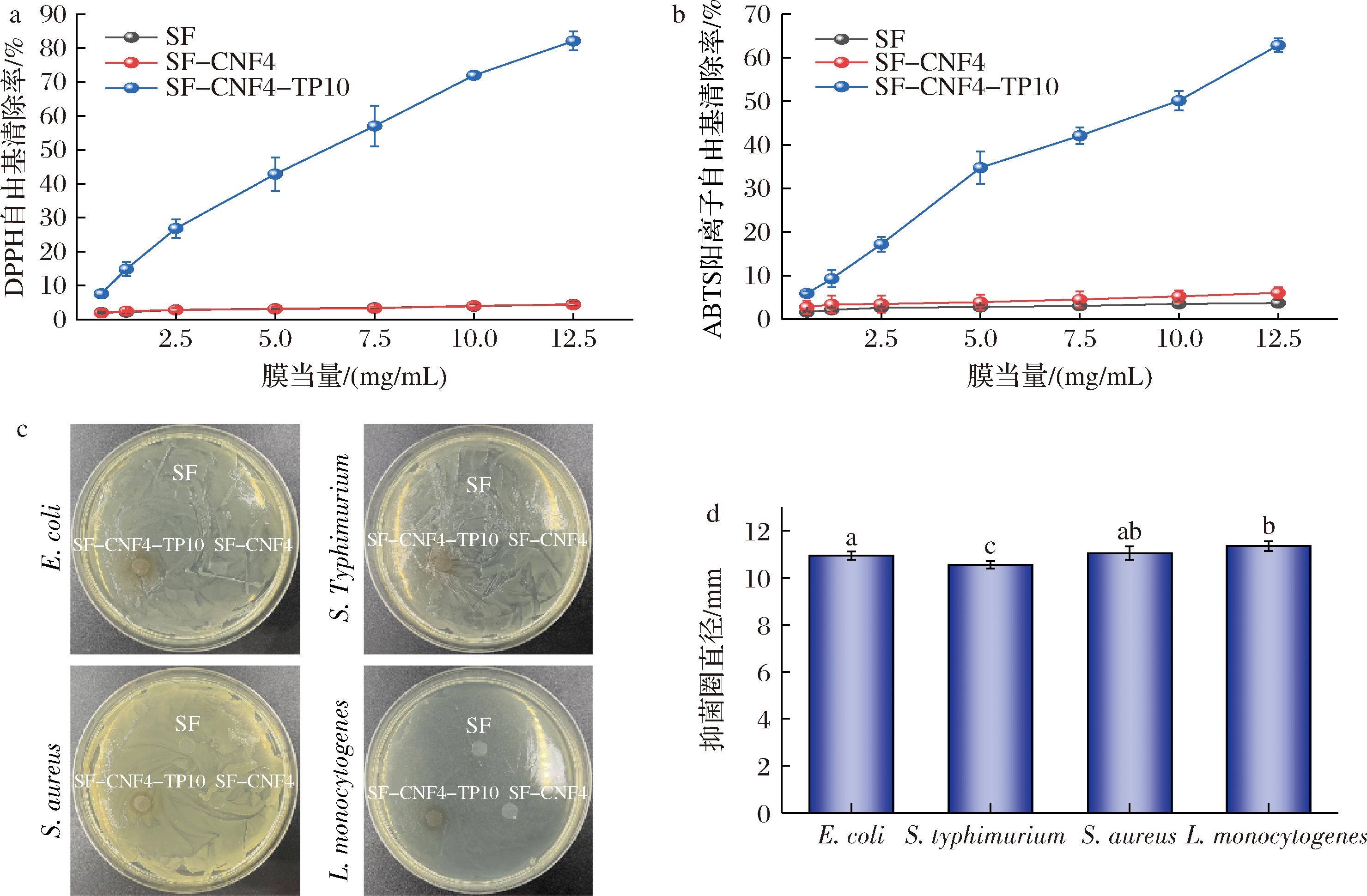
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-抑菌活性;d-SF-CNF4-TP10的抑菌圈直径
图7 薄膜样品的DPPH和ABTS阳离子自由基清除率和抑菌活性
Fig.7 DPPH and ABTS radical scavenging activity and antibacterial activity of film samples
2.7 SF-CNF-TP的生物降解性和生物安全性分析
作为传统塑料的替代品,薄膜在天然土壤中的生物降解性能至关重要。图8-a显示了薄膜在室温下埋入天然土壤不同时期的宏观形态。随着埋入土壤时间的增加,SF、SF-CNF4和SF-CNF4-TP10的表面都逐渐被侵蚀,裂成小碎片。该结果表明,土壤中的微生物可以直接降解淀粉基薄膜,淀粉基薄膜优异的生物降解性显示出取代传统塑料的巨大潜力。
使用豆芽生长试验评估SF-CNF4和SF-CNF4-TP10的生物安全性。图8-b显示了在SF、SF-CNF4和SF-CNF4-TP10分散液中培养的豆芽的生长情况,以纯水培养的豆芽作为对照。结果显示所有豆芽都生长旺盛,不同分散液对豆芽的生长状态和颜色没有明显影响。此外,在用水、SF、SF-CNF4和SF-CNF4-TP10处理的组别之间,平均株高(图8-c)和平均根长(图8-d)没有观察到明显差异(P>0.05)。该结果表明SF、SF-CNF4和SF-CNF4-TP10对植物生长安全无害,具备作为食品包装所需的生物安全性。

a-不同时期薄膜降解的照片;b-用清水、SF、SF-CNF4和SF-CNF4-TP10分散液处理豆芽幼苗的照片;c-平均株高;d-平均根长
图8 薄膜样品的生物降解性和生物安全性评价
Fig.8 Biodegradation and biosafety evaluation of film samples
3 结论
本研究采用刮刀涂布法,结合羧基化纤维素纳米纤维和茶多酚的氢键组装成功制备了多功能茶多酚/羧基化纤维素纳米纤维/淀粉复合膜,并表征了复合膜的化学结构和各项性能。结果表明,羧基化纤维素纳米纤维和茶多酚协同增强了淀粉基薄膜的机械性能。此外,该复合膜展现出良好的透明度,茶多酚提升了薄膜的紫外屏蔽、抑菌和抗氧化能力,且其抗氧化活性呈现出剂量依赖的特点。复合膜在土壤中可被降解,且对植物无毒性,兼具生物安全性。后续将针对淀粉基薄膜疏水特性的缺陷进一步进行改善提升,为可持续食品包装材料的工业化生产与应用提供坚实的理论支撑。
[1] MATHEUS J R V, DALSASSO R R, REBELATTO E A, et al.Biopolymers as green-based food packaging materials:A focus on modified and unmodified starch-based films[J].Comprehensive Reviews in Food Science and Food Safety, 2023, 22(2):1148-1183.
[2] LUO J J, ZHANG M Y, YANG B, et al.A promising transparent and UV-shielding composite film prepared by aramid nanofibers and nanofibrillated cellulose[J].Carbohydrate Polymers, 2019, 203:110-118.
[3] NASRI-NASRABADI B, MEHRASA M, RAFIENIA M, et al.Porous starch/cellulose nanofibers composite prepared by salt leaching technique for tissue engineering[J].Carbohydrate Polymers, 2014, 108:232-238.
[4] ZHANG W L, JIANG H T, RHIM J W, et al.Tea polyphenols (TP):A promising natural additive for the manufacture of multifunctional active food packaging films[J].Critical Reviews in Food Science and Nutrition, 2023, 63(2):288-301.
[5] XU C, ZHOU S, SONG H Z, et al.Green tea polyphenols-derived hybrid materials in manufacturing, environment, food and healthcare[J].Nano Today, 2023, 52:101990.
[6] DO VAL SIQUEIRA L, LA FUENTE ARIAS C I, MANIGLIA B C, et al.Starch-based biodegradable plastics:Methods of production, challenges and future perspectives[J].Current Opinion in Food Science, 2021, 38:122-130.
[7] WANG Y H, JU J, DIAO Y D, et al.The application of starch-based edible film in food preservation:A comprehensive review[J].Critical Reviews in Food Science and Nutrition, 2025, 65(14):2731-2764.
[8] 任福梦. 大面积高效稳定的钙钛矿太阳能模组研究[D].武汉:华中科技大学, 2024.REN F M.Study on large-area, efficient and stable perovskite solar modules[D].Wuhan:Huazhong University of Science and Technology, 2024.
[9] PARK N G, ZHU K.Scalable fabrication and coating methods for perovskite solar cells and solar modules[J].Nature Reviews Materials, 2020, 5(5):333-350.
[10] BUTT M A.Thin-film coating methods:A successful marriage of high-quality and cost-effectiveness:A brief exploration[J].Coatings, 2022, 12(8):1115.
[11] LUCHESE C L, SPADA J C, TESSARO I C.Starch content affects physicochemical properties of corn and cassava starch-based films[J].Industrial Crops and Products, 2017, 109:619-626.
[12] HAN Z M, LI D H, YANG H B, et al.Nacre-inspired nanocomposite films with enhanced mechanical and barrier properties by self-assembly of poly(lactic acid) coated Mica nanosheets[J].Advanced Functional Materials, 2022, 32(32):2202221.
[13] CHEN S M, ZHANG Z B, GAO H L, et al.Bottom-up film-to-bulk assembly toward bioinspired bulk structural nanocomposites[J].Advanced Materials, 2024, 36(23):2313443.
[14] WALTHER A, BJURHAGER I, MALHO J M, et al.Large-area, lightweight and thick biomimetic composites with superior material properties via fast, economic, and green pathways[J].Nano Letters, 2010, 10(8):2742-2748.
[15] YANG H B, LIU Z X, CHEN H, et al.An all-natural fire-resistant bioinspired cellulose-based structural material by external force-induced assembly[J].Materials Today Nano, 2023, 23:100342.
[16] 朱陈杰. 静电纺技术制备电致变色薄膜及其性能研究[D].上海:东华大学, 2021.ZHU C J.Preparation and performance research of electrochromic films prepared by electrospinning technology[D].Shanghai:Donghua University, 2021.
[17] ZHANG D, CHEN L, CAI J, et al.Starch/tea polyphenols nanofibrous films for food packaging application:From facile construction to enhance mechanical, antioxidant and hydrophobic properties[J].Food Chemistry, 2021, 360:129922.
[18] MIAO Z K, LV R F, TENG S L, et al.Development of antioxidant active packaging films with slow release properties incorporated with tea polyphenols-loaded porous starch microcapsules[J].International Journal of Biological Macromolecules, 2022, 222:403-412.
[19] CHEN S L, WU M, LU P, et al.Development of pH indicator and antimicrobial cellulose nanofibre packaging film based on purple sweet potato anthocyanin and oregano essential oil[J].International Journal of Biological Macromolecules, 2020, 149:271-280.
[20] MA Z X, XING Z Y, ZHAO Y, et al.Lotus leaf inspired sustainable and multifunctional Janus film for food packaging[J].Chemical Engineering Journal, 2023, 457:141279.
[21] YANG Z X, ZHANG D, CAI J.Robust design of starch composite nanofibrous films for active food packaging:Towards improved mechanical, antioxidant, and antibacterial properties[J].International Journal of Biological Macromolecules, 2024, 260:129329.
[22] GAO S, LI M, ZHAI X S, et al.Starch as a smart, cheap, and green gatekeeper for the controlled release of propyl gallate from antioxidant biodegradable packaging films[J].Food Chemistry, 2024, 453:139627.
[23] CAO Y J, SONG Z Y, NI W J, et al.Composite nanoparticle-filled oxidized hydroxypropyl starch/carrageenan films:Robust, water-resistant, antibacterial, antioxidant and biodegradable properties[J].Food Hydrocolloids, 2024, 155:110224.
[24] MA X, LIN X H, CHANG C Y, et al.Chitinous bioplastic enabled by noncovalent assembly[J].ACS Nano, 2024, 18(12):8906-8918.
[25] QIN C C, ABDALKARIM S Y H, YANG M C, et al.All-naturally structured tough, ultrathin, and washable dual-use composite for fruits preservation with high biosafety evaluation[J].International Journal of Biological Macromolecules, 2023, 247:125828.
[26] DE VILHENA M B, DA SILVA PAULA M V, DE OLIVEIRA R C, et al.Effect of glycerol and sisal nanofiber content on the tensile properties of corn starch/sisal nanofiber films[J].Polymers, 2024, 16(13):1947.
[27] XIA G M, ZHOU Q W, XU Z, et al.Transparent cellulose/aramid nanofibers films with improved mechanical and ultraviolet shielding performance from waste cotton textiles by in situ fabrication[J].Carbohydrate Polymers, 2021, 273:118569.
[28] FAROOQ M, ZOU T, RIVIERE G, et al.Strong, ductile, and waterproof cellulose nanofibril composite films with colloidal lignin particles[J].Biomacromolecules, 2019, 20(2):693-704.
[29] FAZELI M, KELEY M, BIAZAR E.Preparation and characterization of starch-based composite films reinforced by cellulose nanofibers[J].International Journal of Biological Macromolecules, 2018, 116:272-280.
[30] DOMINIC C D M, DOS SANTOS ROSA D, CAMANI P H, et al.Thermoplastic starch nanocomposites using cellulose-rich Chrysopogon zizanioides nanofibers[J].International Journal of Biological Macromolecules, 2021, 191:572-583.
[31] LI X, LIU Y, LUO B P, et al.Effect of apple polyphenols on physicochemical properties of pea starch/pulp cellulose nanofiber composite biodegradable films[J].International Journal of Biological Macromolecules, 2024, 257:128480.
[32] WAN YAHAYA W A, MOHD AZMAN N A, M KRISHNNAN P, et al.Thermo-mechanical and antioxidant properties of eugenol-loaded carrageenan-cellulose nanofiber films for sustainable packaging applications[J].Journal of Applied Polymer Science, 2024, 141(7):e54943.
[33] XIA G M, JI X Q, XU Z, et al.Transparent cellulose-based bio-hybrid films with enhanced anti-ultraviolet, antioxidant and antibacterial performance[J].Carbohydrate Polymers, 2022, 298:120118.
[34] BAZAN P, MIERZWI SKI D, BOGUCKI R, et al.Bio-based polyethylene composites with natural fiber:Mechanical, thermal, and ageing properties[J].Materials, 2020, 13(11):2595.
SKI D, BOGUCKI R, et al.Bio-based polyethylene composites with natural fiber:Mechanical, thermal, and ageing properties[J].Materials, 2020, 13(11):2595.
[35] KANG N W, KIM M H, SOHN S Y, et al.Curcumin-loaded lipid-hybridized cellulose nanofiber film ameliorates imiquimod-induced psoriasis-like dermatitis in mice[J].Biomaterials, 2018, 182:245-258.
[36] BASHAR M M, OHARA H, ZHU H E, et al.Cellulose nanofiber nanosheet multilayers by the Langmuir-blodgett technique[J].Langmuir, 2019, 35(24):8052-8059.
[37] LI K N, WANG J N, LIU X Q, et al.Biomimetic growth of hydroxyapatite on phosphorylated electrospun cellulose nanofibers[J].Carbohydrate Polymers, 2012, 90(4):1573-1581.
[38] PRIYADARSHI R, KHAN A, RHIM J W.Carrageenan-based washable coatings integrated with sulfur quantum dots for extending banana shelf life[J].Food Packaging and Shelf Life, 2025, 47:101425.
[39] ALMEIDA R, RAMOS A, HÅKONSEN V, et al.Functionalized cellulose nanofiber films as potential substitutes for Japanese paper[J].Carbohydrate Polymer Technologies and Applications, 2024, 8:100573.
[40] BIAN H Y, LUO D, SHI J Y, et al.Cellulose nanofibrils-based packaging films synergistically reinforced by lignin and tea polyphenols for strawberry preservation[J].Chemical Engineering Journal, 2024, 502:157843.
[41] ZHU C Q, YANG Q F, TIAN M, et al.Sustainable nanofiber films based on polylactic acid/modified cellulose nanocrystals containing various types of polyphenols, exhibiting antioxidant activity and high stability[J].Food Chemistry, 2025, 477:143514.
[42] GÜNAL-KÖRO LU D, KARABULUT G, CATALKAYA G, et al.The effect of polyphenol-loaded electrospun fibers in food systems[J].Food and Bioprocess Technology, 2025, 18(6):5094-5116.
LU D, KARABULUT G, CATALKAYA G, et al.The effect of polyphenol-loaded electrospun fibers in food systems[J].Food and Bioprocess Technology, 2025, 18(6):5094-5116.