在现代食品工业中,包装材料对食品保鲜、安全及运输至关重要。传统石油基塑料包装引发严重环境问题,促使新型包装材料研发[1]。食品包装膜的膜基质种类多样,多糖类有淀粉[2]、改性纤维素[3]、壳聚糖[4]等可食性包装膜;蛋白质类包含大豆分离蛋白[5]、玉米醇溶蛋白[6]等可食性包装膜。其中,抗菌包装[7]凭借其能主动抑制微生物滋生的特性,为食品保鲜带来革新,备受关注。
κ-卡拉胶(κ-carrageenan, KC),是一种从红藻中提取的硫酸化多糖,它的pKa为4.9[8],是一种阴离子多糖,由每2个单元带有1个硫酸基团的D-半乳糖链组成[9]。作为载体材料,KC可以为生物活性成分的输送提供稳定的环境[8,10-11]。此外,由于其良好的成膜性能,KC在功能薄膜的设计方面表现出了潜力[12-14]。丁香酚(eugenol,EUG),是一种存在于多种植物中的天然有机化合物,属于酚类化合物。它是丁香等植物挥发油的主要成分[15]。EUG具有浓郁的丁香香气,为透明到淡黄色的液体,具有抗炎、抗氧化和抗菌等活性[16]。将其负载于KC基质中,能改善薄膜的机械性能、阻隔性能,有望制备出抗菌抗氧化功能的智能薄膜。
本研究以KC为膜基质,负载EUG,采用流延法制备出KC-EUG薄膜,研究了其形貌和结构以及基础性能(即机械性能、阻隔性能和表面润湿性能)。在负载EUG后,评估了KC-EUG薄膜的抗氧化活性和抗菌性,测试了EUG在目标膜中的封装率,并评估其在牛奶保鲜中的实际效果。期望通过本研究,开发出一种绿色、高效、具有良好应用前景的活性包装膜,为食品保鲜领域提供新的技术思路与解决方案,助力食品工业朝着绿色、可持续方向发展。
1 材料与方法
1.1 原材料
DPPH、KC(纯度≥99%),上海阿拉丁试剂有限公司;EUG(纯度≥99%),上海麦克林生化技术有限公司;2种典型的食源性致病菌:金黄色葡萄球菌(Staphylococcus aureus)BNCC 186335、大肠杆菌(Escherichia coli)BNCC 133264,北京北纳菌种保藏中心;二甲基亚砜(dimethyl sulfoxide,DMSO),上海国药集团;新鲜牛奶购自合肥当地市场,实验用水为去离子水。
1.2 设备及仪器
HJ-3温控磁力搅拌器,河南英峪领科仪器有限公司;BIC-250人工气候箱,上海博迅实业有限公司;Gemini 500热场发射扫描电子显微镜,德国卡尔蔡司集团;Nicolet 6700 FTIR红外光谱仪,美国Thermo Fisher公司;TA_XT Plus质构仪,英国SMS公司;N500气体透过率仪,广州标记包装设备有限公司;JC2000C1水接触角仪,上海艾菲斯精密仪器有限公司;754PC紫外-可见分光光度计,上海菁华科技仪器有限公司;SHZ-82恒温振荡箱,迅特尔(南通)科学仪器有限公司;SPX-250生化培养箱,上海跃进医疗器械厂;PHS-3C数显pH计,上海仪电科学仪器制造公司。
1.3 KC-EUG薄膜的制备
称取1 g KC粉末,溶解于50 mL水中,90 ℃搅拌1 h,得到透明均质溶液。当KC溶液冷却至60 ℃时,分别加入0%、5%、10%、15%和20%的EUG(基于KC质量),继续搅拌0.5 h。随后,将均质的混合溶液均匀铺展在直径为15 cm的皮氏培养皿中,置于烘箱中30 ℃干燥24 h,获得的薄膜依次记为KC、KC-EUG5、KC-EUG10、KC-EUG15和KC-EUG20。
1.4 测试、表征及应用
1.4.1 薄膜的形貌测试及结构表征
将薄膜裁剪成边长为1.5 cm的正方形小块,用导电胶粘贴在载物台上,对样品进行喷金处理,使用热场发射扫描电子显微镜观察其表面形貌。借助FTIR仪分析样品的分子间作用力,测试范围4 000~525 cm-1,分辨率4 cm-1。
1.4.2 薄膜的机械性能研究
将测试薄膜裁剪成1 cm×10 cm的条状,在每个测试膜的表面不同地点选取10个点进行厚度测量,然后取其平均值作为膜的厚度。根据之前的工作[17],使用质构仪对薄膜力学性能进行了研究。通过计算薄膜的拉伸强度、断裂伸长率和杨氏模量分析其机械性能。
1.4.3 薄膜的阻隔性能研究
薄膜的阻隔性能以氧气透过性与水汽透过率评估。利用气体透过率仪测定薄膜的氧气透过率。实验设定的关键参数为:氧气进气压强0.1 MPa,测试环境温度23 ℃,相对湿度(relative humidity,RH)0%。依据公式(1)计算氧气透过性:
氧气透过性/[cm3/(m·d·atm)]=OTR×d
(1)
式中:OTR,气体透过率仪器检测的氧气透过率,cm3/(m2·d·atm);d,薄膜的厚度,m。
在人工气候培养箱(25 ℃,75%RH)中测量水汽透过率。具体操作如下:在50 mL小烧杯中装入一定量的无水硅胶,用测试膜封装好;然后用电子天平记录首重,将其置于人工气候培养箱(25 ℃,75%RH)中,每隔12 h使用天平测量烧杯的重量,直到烧杯的重量变化值稳定。水汽透过率则按公式(2)计算[18]:
水汽透过率/[g/(m·s·atm)]=(m×x)/(A×t×ΔP)
(2)
式中:m,烧杯的质量增加,g;x,薄膜厚度,m;A,暴露的薄膜面积,m2;ΔP,薄膜上的水蒸气分压差,atm;t,时间,s。
1.4.4 薄膜的水接触角测试
运用接触角测量仪测量薄膜在25 ℃的环境条件下的水接触角,以评价薄膜的润湿性能。为保证数据精确可靠,在薄膜表面随机选取3个不同位点作为测量点,最终测量值为这3个位点数据的平均值。
1.4.5 薄膜的抗氧化性能研究
采用DPPH法评价KC-EUG薄膜的抗氧化活性。先将300 mg的薄膜溶解在100 mL中性缓冲溶液中。然后,取2 mL膜溶液与2 mL DPPH乙醇溶液(0.2 mmol/L)在25 ℃下黑暗条件下振荡30 min(200 r/min),在517 nm处进行分光光度检测(2 mL缓冲溶液和2 mL DPPH酒精溶液的混合物作为对照)。薄膜对自由基清除率按公式(3)计算:
DPPH自由基清除率![]()
(3)
式中:![]() 对照组的吸光度;
对照组的吸光度;![]() 样品的吸光度。
样品的吸光度。
1.4.6 薄膜的抗菌性能研究
金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)被用作模型细菌,用来评估KC-EUG薄膜的抗菌活性。将每片薄膜(300 mg)放入100 mL培养基(106 CFU/mL)中,然后在37 ℃、200 r/min振荡培养(KC薄膜作为对照)。每隔4 h检测600 nm处的吸光度(OD600),以监测细菌生长。抗菌效率按公式(4)计算:
抗菌效率![]()
(4)
式中:![]() 对照的吸光度;
对照的吸光度;![]() 样品的吸光度。
样品的吸光度。
1.4.7 EUG在薄膜中的封装率测试
EUG是易挥发的物质,在制备薄膜的过程中,EUG会因挥发而出现一定的损耗。因此,对EUG在目标膜KC-EUG15中的封装效率进行相关测试。
实验初期,利用紫外可见分光光度仪,针对EUG在250~450 nm波长范围展开数据收集。经测定,确定其最大吸收波长为284 nm。这一数值为后续有关EUG的检测提供了关键依据。采用分光光度计来建立EUG在DMSO溶液里的标准曲线。操作流程如下:依次精确配制质量浓度为5、10、15、20、25、30 μg/mL的EUG的DMSO溶液,把检测波长设为284 nm,对各浓度溶液的吸光度依次测定。之后,以EUG溶液浓度作横坐标,吸光度为纵坐标,利用Origin软件处理数据,绘制出标准曲线。随即,称取一定质量的测试膜,将其溶解在DMSO溶液中,配成质量浓度为0.5 mg/mL的样品膜溶液。在284 nm波长下,检测该样品膜溶液的吸光度,以此确定EUG的实际浓度。再结合理论浓度,根据公式(5)计算封装效率:
封装效率![]()
(5)
式中:ρa,实际质量浓度,μg/mL;ρt,理论质量浓度,μg/mL。
1.4.8 薄膜在牛奶保鲜中的应用
实验方法一:根据ZHAO等[19]的工作稍作改动,对目标膜(KC-EUG15)在牛奶保鲜方面的实际应用进行评估。具体操作方法为:将每种薄膜(1 cm×10 cm)粘在每个瓶子的内壁上,每个瓶子里加入20 mL巴氏杀菌牛奶并在25 ℃下储存,其中一半的薄膜被浸入牛奶中,没有测试薄膜的组被用作对照。每组由3个样品组成,用于测量牛奶的酸度和pH值并拍照。牛奶酸度根据GB 5009.239—2016《食品安全国家标准 食品酸度的测定》测量。
实验方法二:将装有20 mL巴氏消毒牛奶的瓶子用测试薄膜密封后,置于25 ℃环境下储存,没有测试薄膜的组被用作对照。每组由3个样品组成,用于测量牛奶的酸度和pH值并拍照。牛奶酸度根据GB 5009.239—2016《食品安全国家标准 食品酸度的测定》测量。
1.5 统计分析
实验进行3次重复。对3次的实验结果进行了数据分析。差异为P<0.05,则认为具有显著性。
2 结果与分析
2.1 薄膜的形貌与结构分析
如图1所示,纯KC膜表面光滑(图1-a)。在KC基质中掺入EUG后,KC-EUG5-15的膜表面保持均匀光滑(图1-b~图1-d),这说明,在一定含量范围内,EUG可以均匀地分散在KC基质中。然而,如图1-e所示,当EUG含量达到20%时,KC-EUG20膜表面不再光滑,出现许多突起的小颗粒。说明EUG含量过高时会产生团聚现象,KC-EUG20已经不适合实际应用,因此,后续仅对KC及KC-EUG5-15膜进行表征和性能评价。

a-KC;b-KC-EUG5;c-KC-EUG10;d-KC-EUG15;e-KC-EUG20
图1 KC薄膜及KC-EUG系列薄膜的扫描电镜图
Fig.1 SEM images of KC film and KC-EUG series films
红外结果显示(图2),EUG在3 593、1 715、1 680、727和632 cm-1处呈现特征振动峰,分别对应O—H、C—O、C—C、C—H和C![]() C伸缩振动[20]。KC的特征振动峰出现在3 409、1 228[12]、920和835 cm-1[21]。分别对应O—H、O
C伸缩振动[20]。KC的特征振动峰出现在3 409、1 228[12]、920和835 cm-1[21]。分别对应O—H、O![]() S
S![]() O、C—O和C—O—SO3伸缩振动。此外,1 631 cm-1处的振动峰是由于吸收水的振动引起的。在膜KC-EUG15的光谱中,KC和EUG各自的特征振动峰清晰可辨,说明EUG已成功负载于KC基质中。值得注意的是,相较于KC(3 409 cm-1),KC-EUG15的O—H伸缩振动峰向低波数位移至3 400 cm-1,证实KC与EUG间形成了氢键。
O、C—O和C—O—SO3伸缩振动。此外,1 631 cm-1处的振动峰是由于吸收水的振动引起的。在膜KC-EUG15的光谱中,KC和EUG各自的特征振动峰清晰可辨,说明EUG已成功负载于KC基质中。值得注意的是,相较于KC(3 409 cm-1),KC-EUG15的O—H伸缩振动峰向低波数位移至3 400 cm-1,证实KC与EUG间形成了氢键。
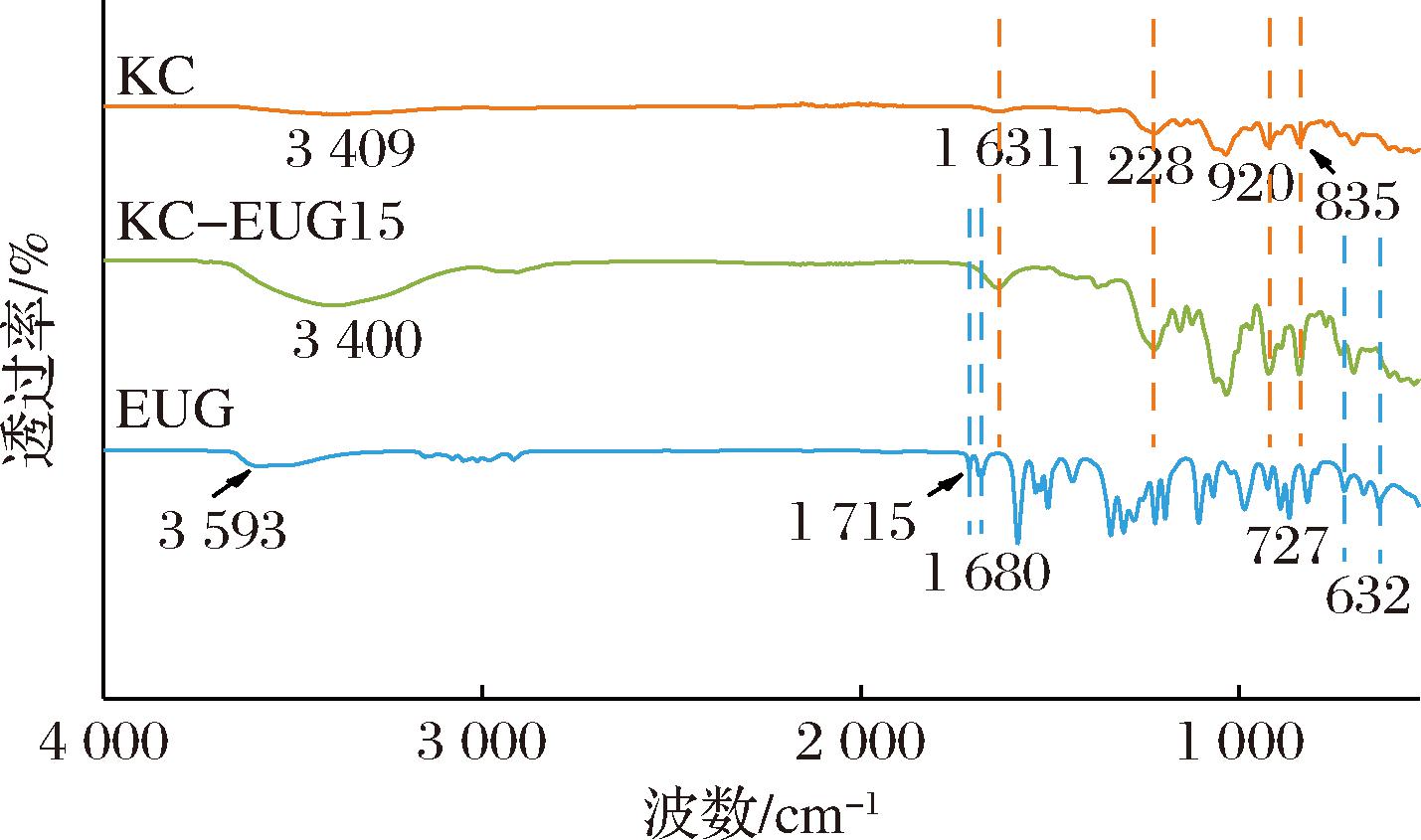
图2 KC、EUG及KC-EUG15薄膜的FTIR图谱
Fig.2 FTIR spectrum of KC, EUG, and KC-EUG15 film
2.2 薄膜的机械性能分析
图3为不同薄膜应力-应变曲线。表1所示,纯KC膜拉伸强度为(27.65±0.37) MPa,断裂伸长率为(23.37±0.37)%,杨氏模量为(4.82±0.08) GPa。加入EUG后,由于其塑化作用,KC-EUG5的拉伸强度和杨氏模量分别降至(26.27±0.43) MPa和(4.61±0.09) GPa,断裂伸长率升至(25.45±0.65)%。此外,还发现随着EUG含量增加,薄膜的拉伸强度和杨氏模量持续下降,断裂伸长率不断增长,这是由于EUG的增塑作用,显著提升薄膜柔韧性。
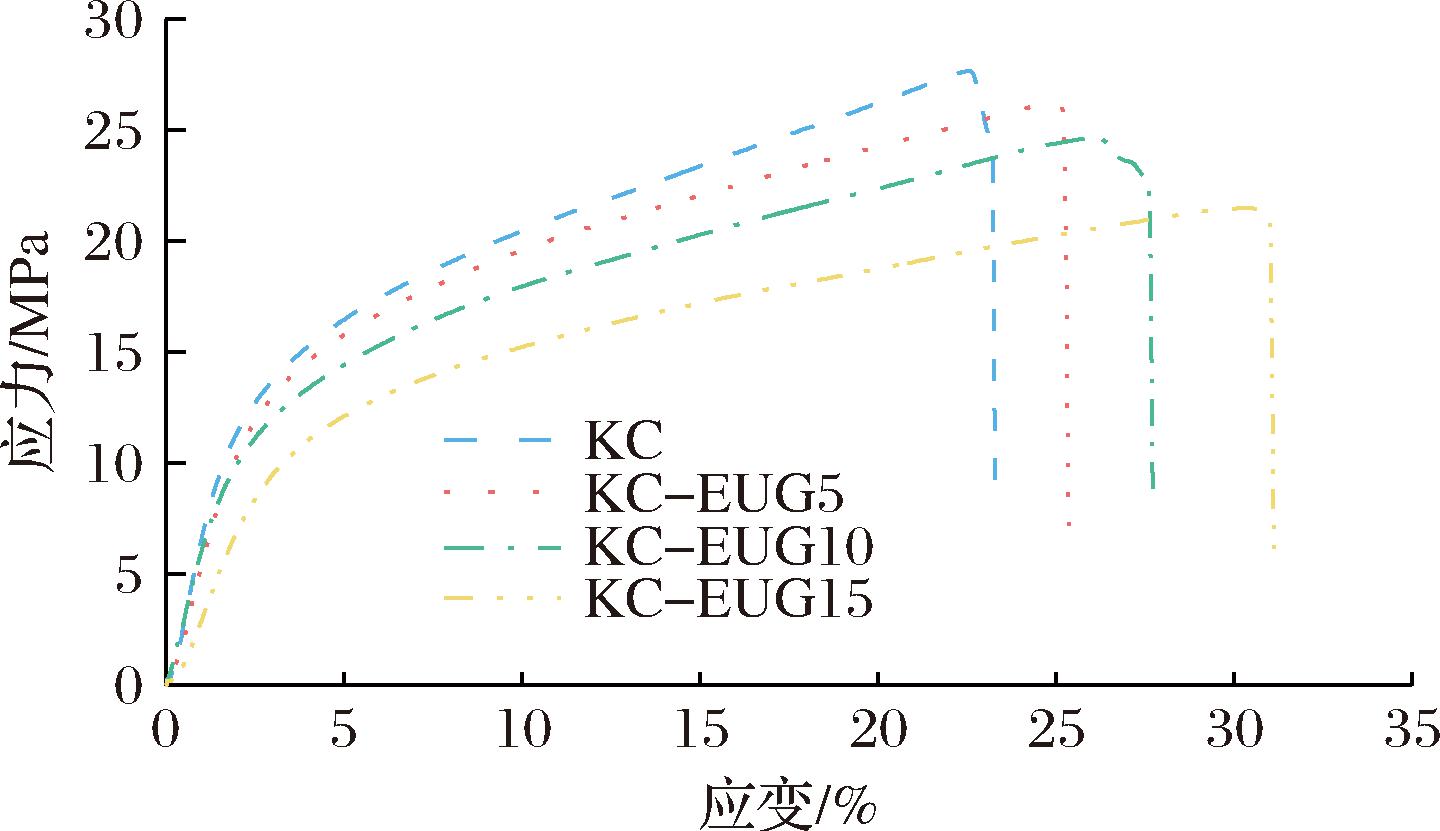
图3 KC薄膜及KC-EUG系列薄膜的应力-应变曲线
Fig.3 Strain-stress curve of KC film and KC-EUG series films
表1 KC薄膜及KC-EUG系列薄膜的机械性能
Table 1 Mechanical properties of KC film and KC-EUG series films
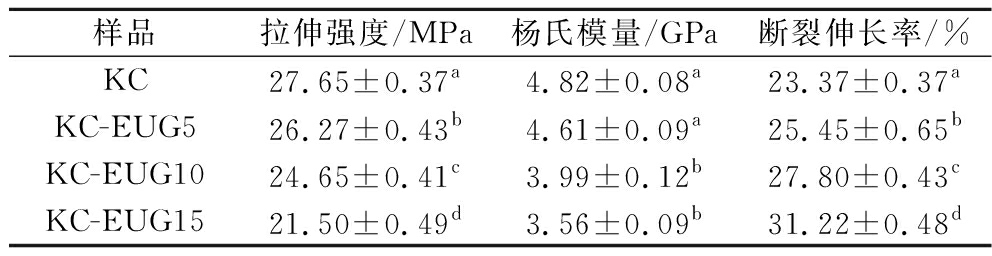
样品拉伸强度/MPa杨氏模量/GPa断裂伸长率/%KC27.65±0.37a4.82±0.08a23.37±0.37aKC-EUG526.27±0.43b4.61±0.09a25.45±0.65bKC-EUG1024.65±0.41c3.99±0.12b27.80±0.43cKC-EUG1521.50±0.49d3.56±0.09b31.22±0.48d
注:不同小写字母表示差异有统计学意义(P<0.05)(下同)。
2.3 薄膜的阻隔性能分析
借助氧气透过性以及水汽透过率评价薄膜的阻隔性能。表2数据表明,纯KC膜的氧气透过性为(0.94±0.03)×10-5 cm3/(m·d·atm),水汽透过率为(2.46±0.04)×10-6 g/(m·s·atm)。当向KC基质中掺入EUG后,薄膜的阻隔性能显著增强。以KC-EUG5为例,其氧气透过性降至(0.72±0.02)×10-5 cm3/(m·d·atm),水汽透过率降至(1.75±0.04)×10-6 g/(m·s·atm)。分析认为,这一现象的产生可能是因为EUG与KC之间形成了氢键结构,该结构有效阻碍了H2O和O2分子的扩散路径。
表2 KC薄膜及KC-EUG系列薄膜的阻隔性能
Table 2 Barrier properties of KC film and KC-EUG series films

样品薄膜厚度/mm氧气透过性×10-5/[cm3/(m·d·atm)]水汽透过率×10-6/[g/(m·s·atm)]KC0.074±0.01d0.94±0.03a2.46±0.04aKC-EUG50.076±0.02c0.72±0.02b1.75±0.04bKC-EUG100.077±0.01b0.53±0.02c1.63±0.03cKC-EUG150.082±0.02a0.51±0.02c1.43±0.03d
进一步观察发现,随着EUG含量逐步递增,膜KC-EUG的阻隔性能进一步提升。氧气透过性从(0.72±0.02)×10-5 cm3/(m·d·atm)持续降低至(0.51±0.02)×10-5 cm3/(m·d·atm),水汽透过率也从(1.75±0.04)×10-6 g/(m·s·atm)降至(1.43±0.03)×10-6 g/(m·s·atm)。推测其原因在于,EUG含量的增加促使膜内各组分之间的连接愈发紧密,分子排列更加有序,从而全方位提升了薄膜整体的阻隔效果。
2.4 薄膜的水接触角分析
EUG含量对膜的润湿性能以水接触角评估,结果如图4所示。纯KC膜的水接触角为(44.73±1.52)°,说明KC具有一定亲水性。当KC膜基质负载EUG后,膜的疏水性发生显著变化。随着EUG负载量上升,KC-EUG膜的疏水性明显增强,水接触角从(65.41±1.53)°逐步增大到(77.91±1.48)°。这是由于EUG具有很强的疏水性,掺入KC膜基质后,有效改变了膜的表面性质,从而提升了薄膜整体的疏水能力。
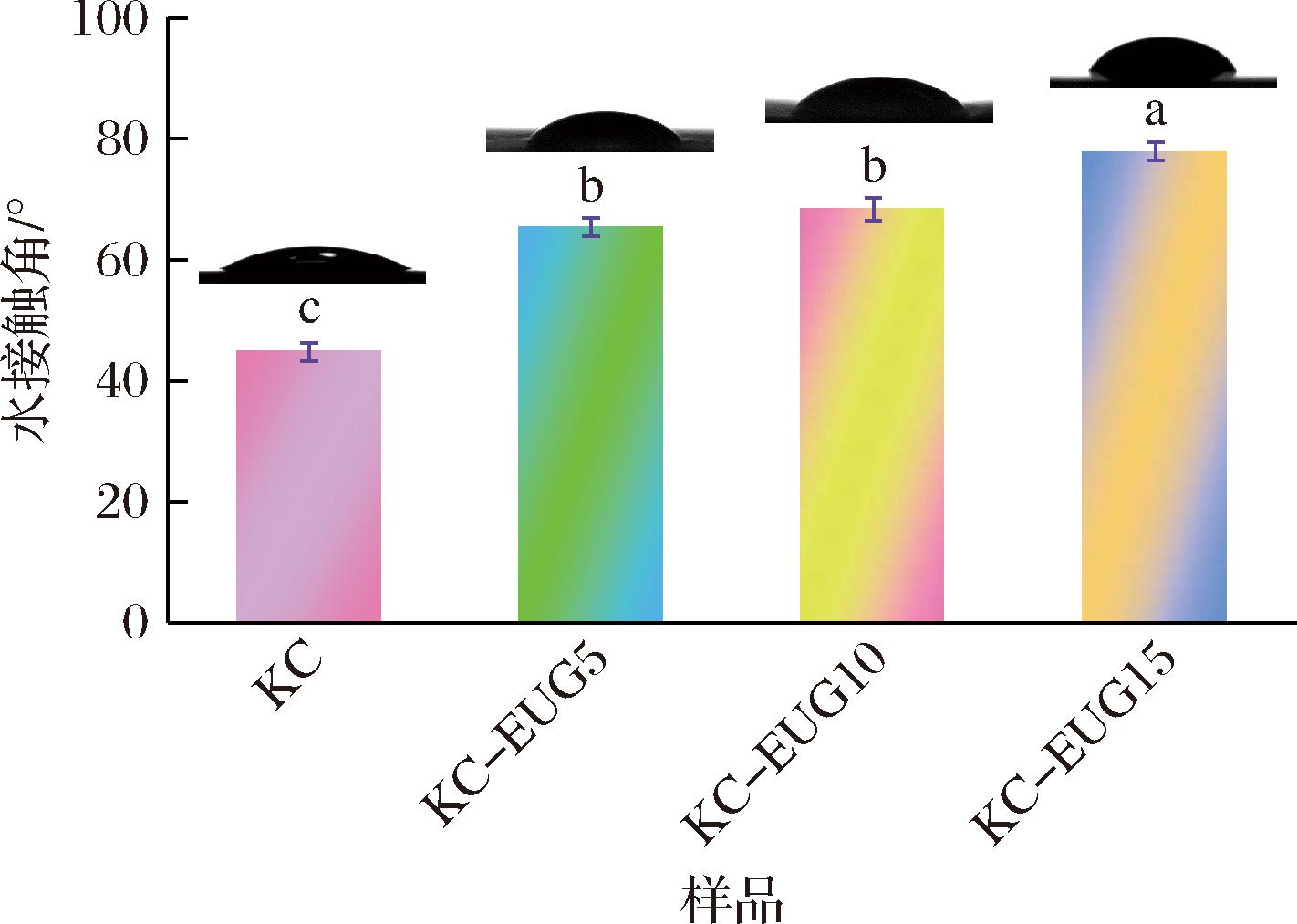
图4 KC薄膜及KC-EUG系列薄膜的水接触角
Fig.4 Water contact angle of KC film and KC-EUG series films
2.5 薄膜的抗氧化性能分析
由表3可知,纯KC膜对DPPH的清除活性几乎为零,这一现象证明KC本身基本不具备抗氧化活性。然而,将EUG掺入KC后,情况发生了显著变化。随着EUG含量在KC-EUG薄膜中逐步提升,薄膜的抗氧化活性也随之增强。KC-EUG5的自由基清除活性达到(30.46±1.21)%,KC-EUG10提升至(46.66±1.35)%,KC-EUG15增加至(62.59±1.42)%。综合上述实验数据可以明确得出,薄膜所展现出的抗氧化性主要来源于EUG。深入分析其原因,主要是由于EUG分子中含有的酚类结构赋予了其抗氧化活性,从而使得薄膜具备了良好的抗氧化性能。
表3 KC薄膜及KC-EUG系列薄膜的抗氧化活性
Table 3 Antioxidant activity of KC film and KC-EUG series films

样品DPPH自由基清除效率/%KC1.37±0.57dKC-EUG530.46±1.21cKC-EUG1046.66±1.35bKC-EUG1562.59±1.42a
2.6 薄膜的抗菌性能分析
为探究膜的抗菌活性,研究选取了具有代表性的细菌S.aureus与E.coli作为实验对象。从细菌生长曲线的变化情况来看(图5-a、图5-b),对照组细菌的生长呈现出较为清晰的3个阶段。在0~4 h的滞后阶段,尽管实验初期提供了优良的生长条件与充足的营养物质,但细菌仍需花费一定时间来适应全新的外界环境,其生长速率极为缓慢,细菌数量仅呈现出极其微弱的上升态势。4~16 h期间,细菌进入指数生长期,此时丰富的营养供给、相对较少的代谢产物堆积以及适宜的外部环境,共同促使细菌数量呈现爆发式增长。到了16~24 h,细菌生长步入稳定期,由于生存空间逐渐受限,营养物质持续减少,细菌的生长速度大幅放缓,数量也逐步趋于稳定状态。
在菌液里分别放入含EUG的薄膜后,实验数据出现了明显差异。如图5-a、图5-c所示,对比对照组,各实验组的细菌生长曲线显著更低。深入分析图5-b、图5-d后发现,薄膜的抗菌活性和EUG含量紧密相关,呈现出正相关趋势。这一结果表明,薄膜的抗菌效果主要得益于EUG,也进一步证明了EUG本身就有抗菌性。随着薄膜中EUG含量逐步增多,薄膜的抗菌效率也稳步上升。具体的抑菌效率数据:KC-EUG5、KC-EUG10、KC-EUG15对S.aureus的抑菌率分别为(26.67±2.91)%、(46.25±2.31)%、(56.29±2.83)%;而对E.coli的抑菌率分别达到(44.94±2.36)%、(52.99±2.98)%、(61.35±2.34)%,凸显出该薄膜对不同菌种抑制上的效果差异。KC-EUG薄膜对E.coli的抑制效果更为显著。深入剖析其中原因,极有可能是因为S.aureus的细胞壁中存在较厚的肽聚糖层,这一结构在一定程度上形成了物理屏障,阻碍了EUG的顺利进入;与此同时,肽聚糖具有亲水性,而疏水性的EUG在渗透特性上更易于作用于E.coli[22],综合多种因素,最终导致了薄膜对2种细菌抑菌效果的差异。
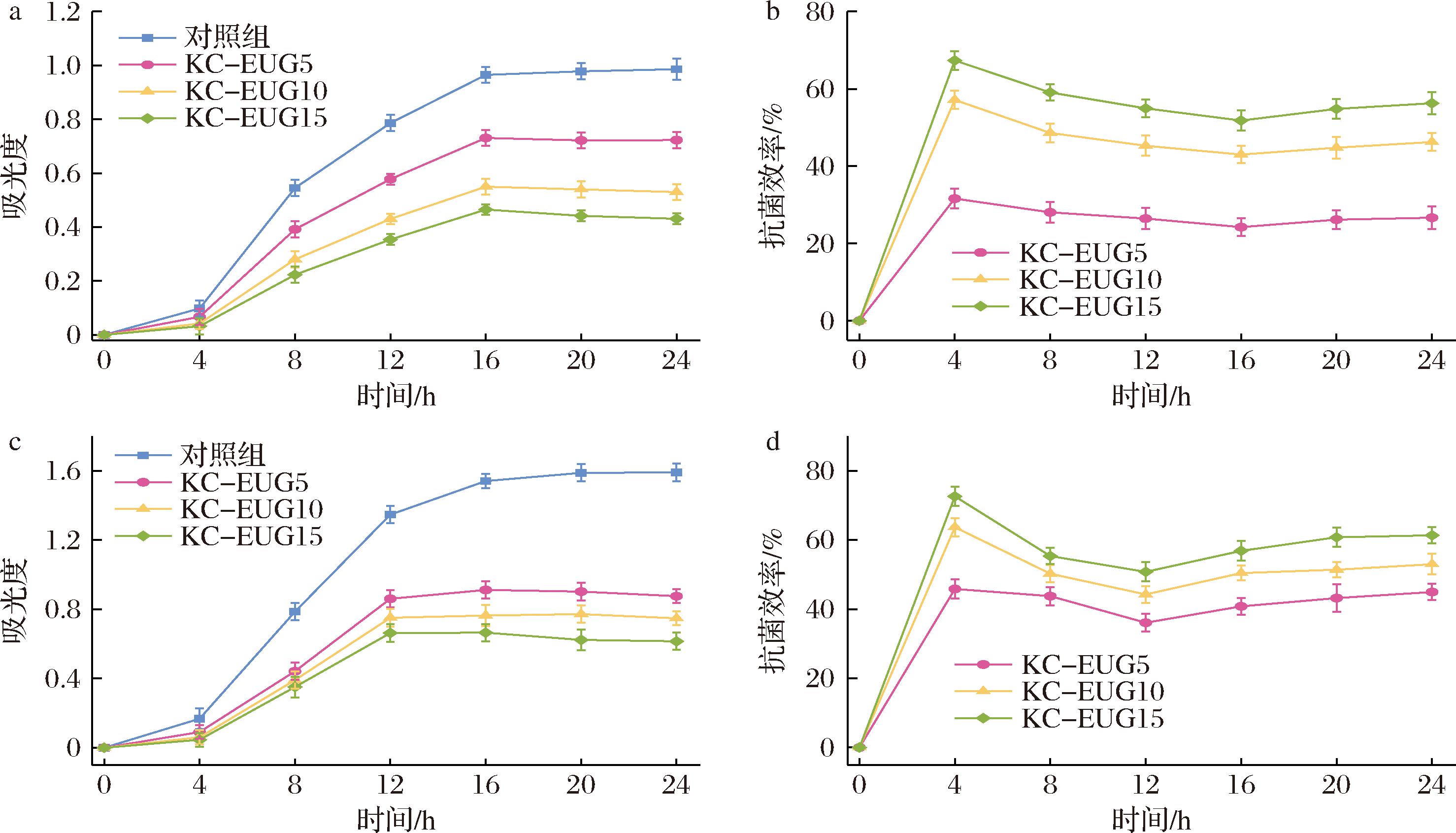
a-暴露于KC-EUG后的S.aureus生长曲线;b-KC-EUG对S.aureus的抗菌效率;c-暴露于KC-EUG后的E.coli生长曲线;d-KC-EUG对E.coli的抗菌效率
图5 暴露于KC-EUG后的细菌生长曲线及抗菌效率
Fig.5 Bacterial growth curves and antimicrobial efficiency after exposure to KC-EUG
2.7 EUG在薄膜中的封装率
从图6可知,EUG的DMSO溶液的最大吸收波长为284 nm。使用紫外分光光度计,分别测量了含5、10、15、20、25、30 μg/mL EUG的DMSO溶液在284 nm波长下的吸光度。以EUG溶液浓度作为横坐标,吸光度作为纵坐标,绘制出了标准曲线。其方程为:y=0.027 0+0.028 4x,R2=0.994 8。经测试,EUG实际在膜KC-EUG15中的封装效率达到了(68.2±1.1)%。这表明尽管存在部分挥发,但大部分EUG通过基质相互作用被有效保留。
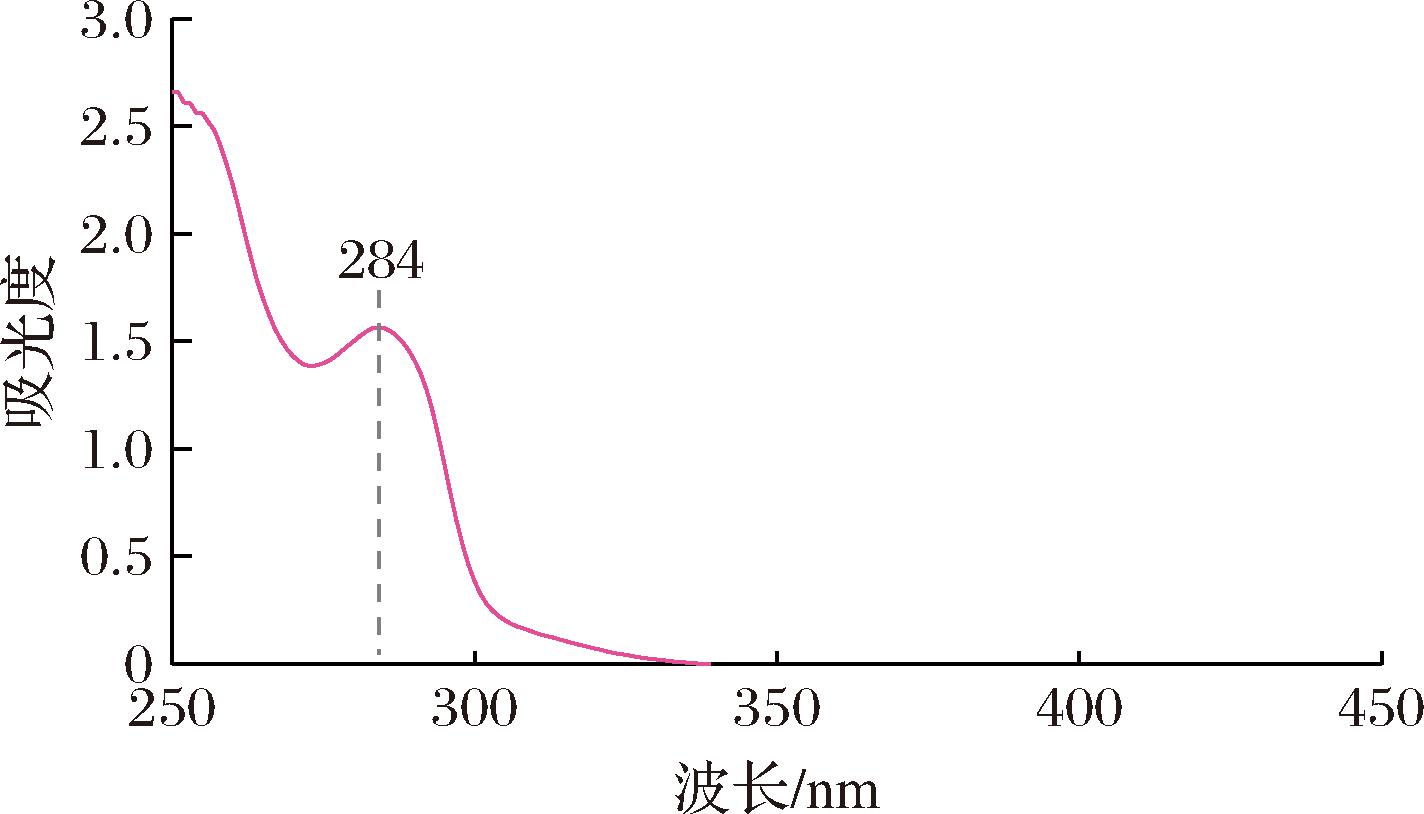
图6 EUG的最大吸收波长
Fig.6 Maximum absorption wavelength of EUG
2.8 薄膜的牛奶保鲜应用
在牛奶变质过程中,微生物代谢总是导致乳酸积累,从而降低牛奶的pH值。因此,酸度是评价牛奶新鲜度的重要指标[23]。一般来说,酸度<18°T的牛奶被认为是新鲜的[24-25]。
实验方法一中,薄膜在牛奶保鲜中的应用示意图如图7-a所示,从图7-c可以看出,对照组和KC组在24 h时变质(酸度>18 °T)。此外,KC组的pH值和酸度与对照组相似(图7-b),表明KC没有抗菌活性。得益于EUG的抗菌活性,KC-EUG15组在24 h时新鲜,在48 h时仍未变质(酸度为17.92 °T)。也就是说,KC-EUG15能够在25 ℃下将牛奶的保质期延长100%。
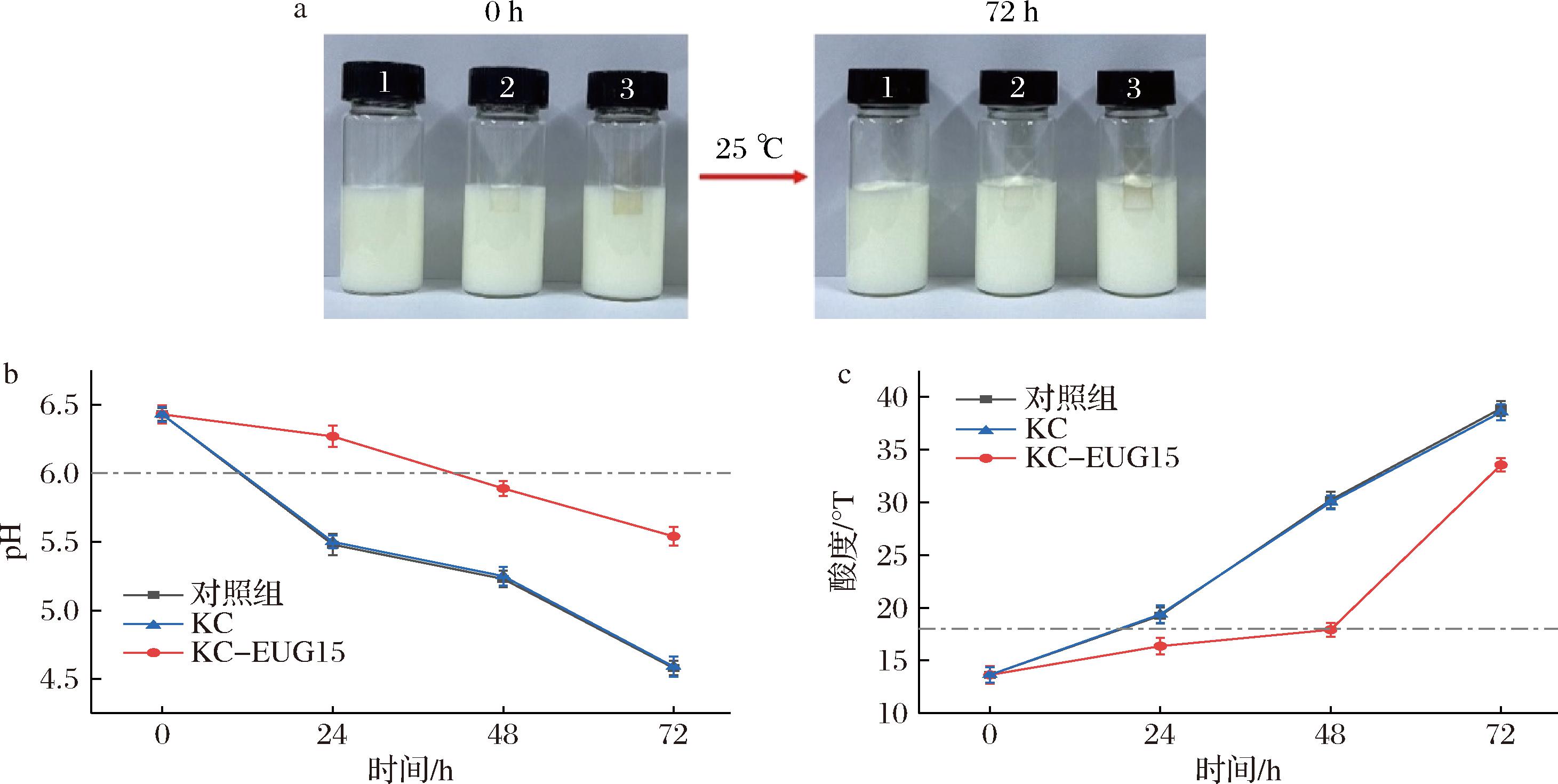
1-对照组;2-KC;3-KC-EUG15。
a-牛奶保鲜示意图;b-牛奶pH值;c-牛奶酸度
图7 KC-EUG15在牛奶保鲜中的应用评估
Fig.7 Evaluation of the application of KC-EUG15 in milk preservation
在实验方法二的探究中,采用EUG的挥发抗菌模式开展牛奶保鲜实验,其应用示意图见图8-a。通过对实验数据的系统分析可知,对照组和KC组在25 ℃环境下储存24 h后,牛奶酸度均超过18°T(图8-c),已经变质;同时,KC组的pH值(图8-b)及酸度变化曲线与对照组高度吻合,这一结果充分表明KC本身不具备抗菌活性。相较之下,KC-EUG15实验组展现出显著优势,该组牛奶在24 h储存期内仍保持新鲜(酸度<18 °T),直至48 h才出现轻微变质(酸度为18.23 °T)。由此可见,在25 ℃的储存条件下,KC-EUG15薄膜能够使牛奶的保质期延长接近100%。
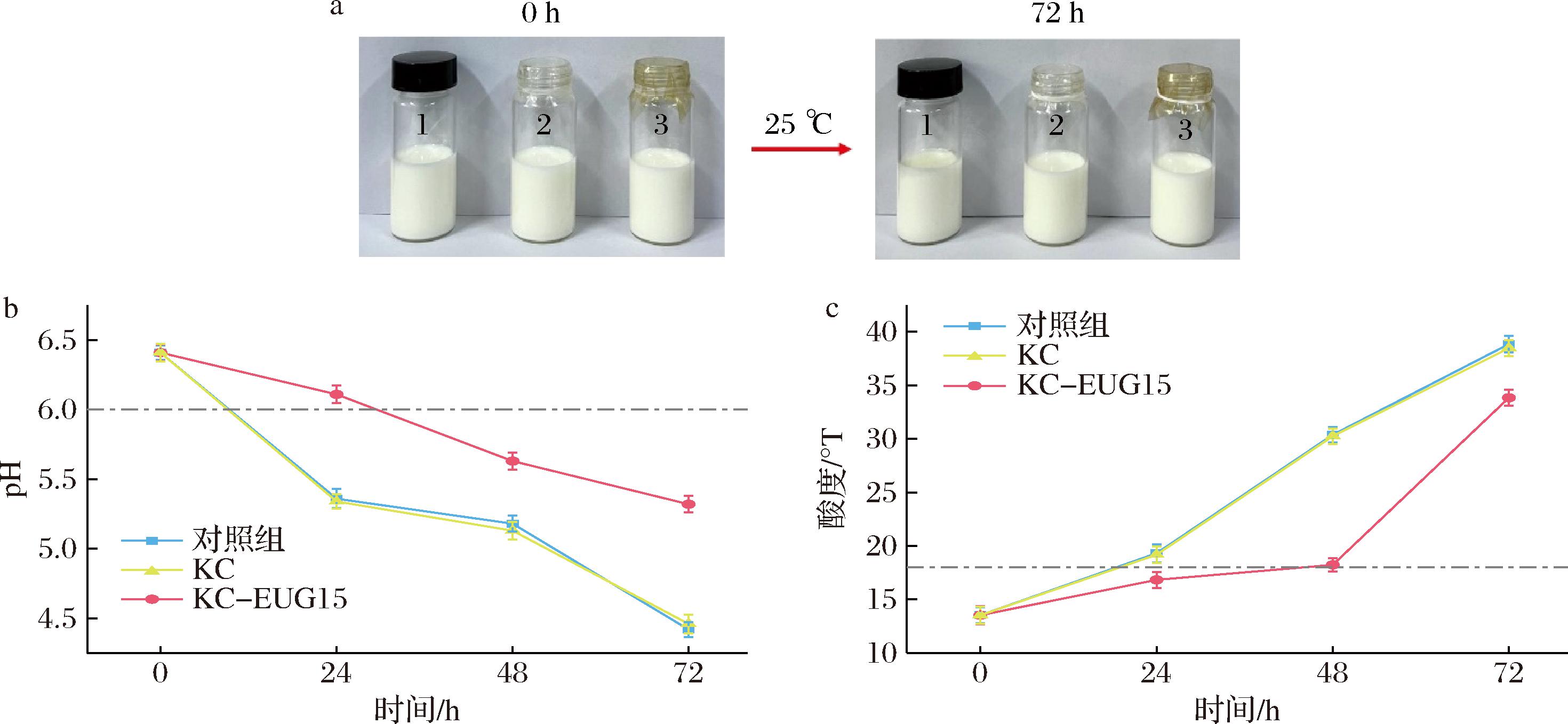
1-对照组;2-KC;3-KC-EUG15。
a-牛奶保鲜示意图;b-牛奶pH值;c-牛奶酸度
图8 KC-EUG15在牛奶保鲜中的应用评估
Fig.8 Evaluation of the application of KC-EUG15 in milk preservation
在两项关于KC-EUG15薄膜应用于牛奶保鲜的实验中,实验方法一采用直接接触法,实验方法二则基于EUG的挥发作用,二者呈现出不同的保鲜效果。实验数据显示,方法一中,KC-EUG15组在48 h时牛奶仍未变质(酸度17.92 °T),而方法二中,该组在48 h时出现略微变质(酸度18.23 °T)。这种差异源于方法的不同:直接接触法可使EUG与牛奶中的微生物充分接触,快速抑制微生物生长繁殖;而挥发作用下,EUG需经空间扩散才能作用于微生物,其抗菌效率受扩散速率的限制,导致抑菌效果相对较弱。
尽管存在效果差异,但两项实验均有力验证了KC-EUG15薄膜的抗菌性能,证实其能显著延长牛奶保质期。这一结论为开发新型食品包装材料提供了可靠的实验依据,表明KC-EUG15薄膜在食品保鲜领域具有广阔的应用前景。在实际食品包装应用中,可根据不同食品特性和包装需求,灵活选择直接接触或挥发抗菌的包装方式,充分发挥KC-EUG15薄膜的抗菌优势,有效延长食品货架期,减少食品腐败损失,对保障食品安全、提升食品品质具有重要意义。
3 结论与讨论
本研究以KC为基质,采用流延法,将EUG均匀分散于KC基质中,成功制备出KC-EUG薄膜。通过FTIR证实,EUG与KC间形成氢键,EUG的引入,使KC-EUG薄膜韧性和阻隔性能增强。此外,由于EUG的疏水性,KC-EUG薄膜的水接触角增大。抗氧化性能测试显示,KC-EUG薄膜对DPPH自由基清除率最高达62.59%,且在抗菌实验中,对大肠杆菌的抑菌效率最高达61.35%,对金黄色葡萄球菌的抑菌效率最高达56.29%,KC-EUG薄膜对大肠杆菌的抑制效果更为显著。针对EUG挥发性特点,测定其封装效率,结果表明,EUG在KC-EUG15膜中的封装效率达到了68.2%。而在实际应用中,KC-EUG15薄膜在25 ℃条件下可使牛奶保质期延长近100%,其抗菌性通过直接接触与挥发两种作用模式均得到有效验证。本研究为新型抗菌食品包装材料的开发提供了理论依据与数据支撑,该成果在食品工业领域具有重要应用价值。通过灵活选择包装作用模式,可针对性提升不同食品的货架期稳定性,对降低食品损耗、保障食品安全及推动绿色包装技术革新具有积极意义。
[1] LI Z X, RAWDKUEN S, FEI T, et al.Recent advances in gellan gum-based films and its application in sustainable food packaging:A review[J].Critical Reviews in Food Science and Nutrition, 2025:1-22.
[2] ROMAINOR A N, CHIN S F, LIHAN S.Antimicrobial starch-based film for food packaging application[J].Starch-Stärke, 2022, 74(3-4):2100207.
[3] GOPALAKRISHNAN K, CHANDEL M, GUPTA V, et al.Valorisation of fruit peel bioactive into green synthesized silver nanoparticles to modify cellulose wrapper for shelf-life extension of packaged bread[J].Food Research International, 2023, 164:112321.
[4] PRIYADARSHI R, RHIM J W.Chitosan-based biodegradable functional films for food packaging applications[J].Innovative Food Science &Emerging Technologies, 2020, 62:102346.
[5] HAN Y Y, YU M, WANG L J.Preparation and characterization of antioxidant soy protein isolate films incorporating licorice residue extract[J].Food Hydrocolloids, 2018, 75:13-21.
[6] WU X, LIU Z, HE S, et al.Development of an edible food packaging gelatin/zein based nanofiber film for the shelf-life extension of strawberries[J].Food Chemistry, 2023, 426:136652.
[7] SHANKAR S, BANG Y J, RHIM J W.Antibacterial LDPE/GSE/Mel/ZnONP composite film-coated wrapping paper for convenience food packaging application[J].Food Packaging and Shelf Life, 2019, 22:100421.
[8] SANTINON C, BEPPU M M, VIEIRA M G A.Optimization of kappa-carrageenan cationization using experimental design for model-drug release and investigation of biological properties[J].Carbohydrate Polymers, 2023, 308:120645.
[9] LOMOLINO G, VINCENZI S, ZANNONI S, et al.Emulsifying activity of potato proteins in the presence of κ-carrageenan at different pH conditions[J].Food Chemistry:X, 2022, 13:100232.
[10] XIE H J, XIANG C Y, LI Y, et al.Fabrication of ovalbumin/κ-carrageenan complex nanoparticles as a novel carrier for curcumin delivery[J].Food Hydrocolloids, 2019, 89:111-121.
[11] ZHENG H X, MAO L K, CUI M N, et al.Development of food-grade bigels based on κ-carrageenan hydrogel and monoglyceride oleogels as carriers for β-carotene:Roles of oleogel fraction[J].Food Hydrocolloids, 2020, 105:105855.
[12] SAEDI S, SHOKRI M, RHIM J W.Preparation of carrageenan-based nanocomposite films incorporated with functionalized halloysite using AgNP and sodium dodecyl sulfate[J].Food Hydrocolloids, 2020, 106:105934.
[13] KHAN A, RIAHI Z, KIM J T, et al.Gelatin/carrageenan-based smart packaging film integrated with Cu-metal organic framework for freshness monitoring and shelf-life extension of shrimp[J].Food Hydrocolloids, 2023, 145:109180.
[14] LIU J R, WANG H L, GUO M, et al.Extract from Lycium ruthenicum Murr.Incorporating κ-carrageenan colorimetric film with a wide pH-sensing range for food freshness monitoring[J].Food Hydrocolloids, 2019, 94:1-10.
[15] OVERLY K R.Microwave-assisted isolation of eugenol from cloves[J].Journal of Chemical Education, 2019, 96(11):2665-2667.
[16] FU X, GAO Y, YAN W Y, et al.Preparation of eugenol nanoemulsions for antibacterial activities[J].RSC Advances, 2022, 12(6):3180-3190.
[17] LIU J R, WANG H L, WANG P F, et al.Films based on κ-carrageenan incorporated with curcumin for freshness monitoring[J].Food Hydrocolloids, 2018, 83:134-142.
[18] LI L L, XIA L, XIAO F, et al.Colorimetric active carboxymethyl chitosan/oxidized sodium alginate-Oxalis triangularis ssp.papilionacea anthocyanins film@gelatin/zein-linalool membrane for milk freshness monitoring and preservation[J].Food Chemistry, 2023, 405(Pt B):134994.
[19] ZHAO R N, CHEN J, YU S F, et al.Active chitosan/gum arabic-based emulsion films reinforced with thyme oil encapsulating blood orange anthocyanins:Improving multi-functionality[J].Food Hydrocolloids, 2023, 134:108094.
[20] WANG H, YUAN D, MENG Q R, et al.Pickering nanoemulsion loaded with eugenol contributed to the improvement of konjac glucomannan film performance[J].International Journal of Biological Macromolecules, 2024, 267:131495.
[21] ROY S, SHANKAR S, RHIM J W.Melanin-mediated synthesis of silver nanoparticle and its use for the preparation of carrageenan-based antibacterial films[J].Food Hydrocolloids, 2019, 88:237-246.
[22] CHENG J F, WANG H L, KANG S L, et al.An active packaging film based on yam starch with eugenol and its application for pork preservation[J].Food Hydrocolloids, 2019, 96:546-554.
[23] MOAZAMI GOODARZI M, MORADI M, TAJIK H, et al.Development of an easy-to-use colorimetric pH label with starch and carrot anthocyanins for milk shelf life assessment[J].International Journal of Biological Macromolecules, 2020, 153:240-247.
[24] GAO R C, HU H L, SHI T, et al.Incorporation of gelatin and Fe2+ increases the pH-sensitivity of zein-anthocyanin complex films used for milk spoilage detection[J].Current Research in Food Science, 2022, 5:677-686.
[25] ZHENG Y W, LI X M, HUANG Y, et al.Two colorimetric films based on chitin whiskers and sodium alginate/gelatin incorporated with anthocyanins for monitoring food freshness[J].Food Hydrocolloids, 2022, 127:107517.