近年来,随着环境可持续性意识的提升,开发高性能、环保的新型生物材料已成为研究热点。细菌纤维素(bacterial cellulose, BC),作为一种由好氧微生物产生的胞外不可溶性多糖,以其高纯度、强韧性和广泛的应用潜力而备受关注[1-3]。然而,纯BC在抗菌性能上的不足限制了其在医疗器械等关键领域的应用。为此,众多学者致力于通过改性和复合手段提升BC的抗菌性能。例如,王金海等[4]通过溶液浸泡法制备的聚赖氨酸/细菌纤维素抗菌敷料体外无明显细胞毒性,体内不引起溶血反应,无急性全身毒性反应,具有良好的生物相容性及抗菌性能。杨惠仪等[5]利用氧化细菌纤维素纳米晶体,通过化学反应接枝双胍化合物和医用聚氨酯涂层复合制备了具有稳定抗菌效果的医用抗菌涂层。尽管已有研究通过不同方法改善了BC的抗菌性能,但探索新型、高效的抗菌添加剂及其与BC的复合机制仍具有重要意义。
微生物溶菌酶(lysozyme, LZ),与常见的蛋清溶菌酶相区别,是一种由微生物分泌产生的代谢产物,具体表现为化学性质稳定的碱性葡萄糖苷酶。它广泛存在于多种生物组织、细胞和体液中。LZ通过催化水解细菌细胞壁肽聚糖上的N-乙酰胞壁酸与N-乙酸葡萄糖胺之间的β-1,4糖苷键[6],从而破坏肽聚糖的骨架结构,实现抑菌功效,然而鉴于不同细菌细胞壁结构的差异性,LZ的抑菌谱受到一定的限制。此外,LZ因其独特的电荷分布和表面疏水性等相关因素,表现出阳离子抗菌肽活性,能够与带负电荷的表面结合,并且独立于胞壁质酶活性而存在,LZ的这种非酶的杀菌活性相较于其酶活性,对微生物的杀伤作用更为显著[7]。作为一种天然无毒害的抗菌蛋白,以其独特的抑菌消炎作用在抗菌领域展现出巨大潜力。孙玥[8]通过制备改性山药淀粉负载LZ获得抑菌剂,将其应用于草莓表面形成了可食性抑菌膜,有效延长了新鲜草莓的保质期。DE FRANCE等[9]研究了纤维素纳米晶体-溶菌酶复合膜的制备方法,复合膜呈现出优异的机械性能及抗菌活性。
植酸钠(sodium phytate, SP),也被称为肌醇六磷酸钠,是一种存在于植物种子、谷物和胚芽等富含纤维的天然原料中。美国食品和药物管理局(Food and Drug Administration, FDA)已将其列为公认安全(generally recognized as safe, GRAS)的物质,并正式批准作为新型食品添加剂使用[10]。SP凭借其丰富的磷含量和与游离金属离子的强螯合作用,展现出卓越的抗氧化和抑菌活性。近年来,SP作为一种多功能的食品添加剂,包括作为抗氧化剂、抑菌剂、护色剂和保水剂,在食品和医药科学领域引起了研究人员的广泛关注。LIU等[11]利用植酸钠与壳聚糖复合涂层保鲜南极磷虾,有效抑制了磷虾的腐败变质,延长其货架期。LZ和SP均已被我国批准作为新型食品添加剂,应用于肉制品、烘焙食品以及乳制品等的防腐[12-14]。然而,二者在抑菌型生物基复合材料中的应用研究尚不充分,特别是在生物医疗器械领域的应用前景亟待探索。
基于此,本研究以BC为基材,创新性地通过培养基中添加LZ原位生成BC-LZ复合膜,并进一步地与不同比例的SP复合,制备出BC-LZ-SP复合膜。本研究旨在深入探究该复合膜的结构组成、物理特性、抗菌性能及生物相容性,为医疗器械中BC基抗菌敷料的开发提供科学依据和参考。
1 材料与方法
1.1 材料与试剂
微生物溶菌酶(酶活力>1 000 U/mg),浙江艾杰斯生物科技有限公司;植酸钠(纯度>99%),桐乡鑫锐生物科技有限公司;小鼠成纤维细胞L929,上海中科院细胞库;2%豚鼠红细胞(SPF级),广州鸿泉生物有限公司;MgSO4、NaOH、K2HPO4、葡萄糖、酵母浸粉,均为分析纯,国药集团化学试剂有限公司;PBS(pH 7.4,10 mmol/L),北京兰杰柯科技有限公司;Triton X-100(纯度>99.5%),德国BioFroxx公司;木糖驹形氏杆菌(Komagataeibacter xylinus),浙江省农产品化学与生物加工技术重点实验室于红茶菌中筛选所得[15];白色念珠菌(Candida albicans)HZB140715,武汉灰藻生物技术有限公司;沙门氏菌(Salmonella)ATCC13311,上海宝藏生物技术中心;枯草芽孢杆菌(Bacillus subtilis)CMCC 63501,北京百欧博伟生物技术有限公司。
1.2 仪器与设备
HSX-250恒温恒湿培养箱,上海一恒科学仪器有限公司;MLS-3751-PC高压灭菌锅,苏州瑞诺德生物科技有限公司;Allegra X-12R冷冻离心机,美国贝克曼库尔特有限公司;TS-600DC恒温摇床,上海天呈实验仪器制造有限公司;Vertex 70傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)仪,德国布鲁克仪器公司;D8 Advance X射线衍射(X-ray powder diffractometer, XRD)仪,日本岛津公司;EM-1011扫描电子显微镜(scanning electron microscope, SEM),日本电子公司;WH-5000电子拉力试验机,宁波伟恒检测仪器有限公司;DCAT21表面接触角测量仪,德国DataPhysics公司。
1.3 细菌纤维素复合膜的制备
1.3.1 培养基的配制
种子培养基配制:分别称取葡萄糖1 g和酵母浸粉1 g,加入去离子水100 mL,固体培养基需加入琼脂2 g,调节pH值为6.0,置于121 ℃灭菌15 min后,在无菌条件下加入3 mL无水乙醇。
发酵培养基配制:分别称取葡萄糖2 g,酵母浸粉1 g,MgSO4 1 g和K2HPO4 0.1 g,加入去离子水100 mL,调节pH值为6.0,置于121 ℃灭菌15 min后,在无菌条件下加入3 mL无水乙醇。
1.3.2 BC-LZ复合膜的制备
取4 ℃保存的K.xylinus接种于固体培养基中,于30 ℃恒温培养箱中培养24 h长出新菌落。挑取单个K.xylinus菌落置于100 mL种子培养基中活化,于30 ℃,150 r/min摇床中培养48 h后,观察到液体浑浊并伴有絮状物产生,停止培养,得到种子液,备用。
在无菌工作台中,将种子液以6%(体积分数)的接种量接入已灭菌的发酵培养基中,一组用培养基发酵,另一组同时加入1 mg/mL的LZ,与发酵培养基充分混合后,2组均置于30 ℃培养箱中静置发酵7~8 d。发酵结束后分别得到一层较厚的水凝胶膜,将膜取出后,用大量去离子水反复清洗,以去除表面残留的培养基。随后将膜置于0.1 mol/L NaOH溶液中,浸泡24 h,以进一步除去残余的培养基和残留菌体。接着,用去离子水反复洗涤膜,直至膜表面呈白色,pH值为中性,即可得到最终产品纯BC膜和BC-LZ复合膜。
1.3.3 BC-LZ-SP复合膜的制备
分别配制体积分数为0.005%、0.01%、0.02%、0.05%的SP溶液,将BC-LZ复合膜置于不同SP溶液中浸泡24 h,以充分吸收液体。反应结束后用去离子水反复冲洗膜表面,即可得到不同浓度的BC-LZ-SP复合膜,放置4 ℃冰箱以备后续实验使用。
1.4 细菌纤维素复合膜的结构与性能表征
1.4.1 FTIR
取适量复合膜样品粉末,与干燥的KBr粉末以质量比1∶100混合并研磨,压片后用FTIR进行测量,设置扫描范围为4 000~400 cm-1,分辨率为4 cm-1,以观察复合膜的化学结构。
1.4.2 SEM
将复合膜样品冷冻干燥48 h后,用液氮沿其截面脆断,使用SEM对样品进行测试。将复合膜样品放置于导电胶上进行喷金处理,在40 kV的加速电压下观察其断面的形貌特征。
1.4.3 X-射线衍射
将复合膜样品裁剪成10 cm×10 cm的矩形,利用XRD仪对样品晶体结构进行分析。设置测定范围为5°~60°,射线源为CuKα,管电压40 kV,管电流40 mA。根据非晶区和结晶区强度的比值可以计算复合膜的结晶度指数(crystallinity index, CrI)值[13]。CrI的计算如公式(1)所示:
结晶度指数![]()
(1)
式中:I200,2θ=22.7°结晶区的衍射强度;Iam,2θ=18°非结晶区的衍射强度。
1.4.4 溶胀性能
模拟体液的配制。称取适量完全干燥的复合膜样品,记录其初始质量m1,在常温条件下将薄膜样品浸润在恒温37 ℃的模拟体液中,分别在0、2、4、8、16、20、24、48 h将样品取出,用滤纸吸干表面水分后,称重记为m2,根据复合膜干湿条件下的质量差来衡量其溶胀性能。溶胀率的计算如公式(2)所示:
溶胀率![]()
(2)
式中:m1,干燥薄膜初始质量,g;m2,吸水溶胀至恒重的薄膜质量,g。
1.4.5 水接触角
将复合膜样品置于表面接触角测量仪下方,设置5 μL蒸馏水滴于薄膜表面,迅速拍照记录,在相应软件中计算其接触角大小。
1.4.6 机械性能
将复合膜样品裁剪成2 cm×7 cm的矩形样条,在万能拉力试验机上进行力学性能测试。依据GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》标准操作,设置仪器拉伸速率为5 mm/min,上下标距为25 mm,重复测试3次,取平均值。
1.4.7 抑菌性能
选用C.albicans、Salmonella和B.subtilis用于评价复合膜样品的抗菌能力。采用国标法,取浓度为106CFU/mL的菌悬液,使用无菌PBS将其进行100 000倍梯度稀释。将复合膜样品裁剪成直径为1 cm的圆片,紫外灭菌2 h。取2 mL菌悬液加入到24孔板中,对照组为纯BC膜,样品处理组分别加入复合膜样品,37 ℃,150 r/min下振荡培养4 h。取100 μL菌悬液涂布到琼脂培养皿上,37 ℃下培养24 h,计数菌落数,按公式(3)计算抑菌率:
抑菌率![]()
(3)
式中:N0,对照组菌落数;N1,样品处理组菌落数。
1.4.8 细胞相容性
准备复苏状态的L929细胞进行细胞传代,弃掉细胞上清液后用PBS清洗2次,用1 mL胰蛋白酶37 ℃下消化1 min,电子显微镜下观察细胞,当细胞的形态发生改变细胞间距增大时,加入5 mL完全培养基终止酶解过程。吹打细胞使其从瓶底脱落,收集含有细胞的DMEM培养基于15 mL离心管中,1 000 r/min,5 min后取出离心管,弃掉上清液,向离心管中加入少量新鲜培养基,传代3次至细胞状态稳定后进行实验。
将复合膜经过去离子水充分洗涤后,经过3 h紫外灭菌,按照0.1∶1(g∶mL)比例将膜用DMEM高糖培养基(不添加胎牛血清和双抗)在37 ℃、5%(体积分数)CO2加湿恒温培养箱中浸泡24 h,去除复合膜后加入10%胎牛血清和1%双抗,制备含复合膜浸提液的DMEM培养基,将该培养基用0.22 μm的滤膜过滤去除杂质。将细胞消化离心重悬,使用血球计数板计数,将细胞浓度调整至1×106 cell/mL。在96孔板中每孔加入100 μL细胞悬液,放入CO2细胞培养箱中培养。培养12 h待细胞贴壁后,吸出旧培养基,加入100 μL复合膜浸出液。继续培养至24、48、72 h。结束后,向每孔各加入20 μL 5 mg/mL噻唑蓝溶液,继续培养3 h。取出96孔板,去除孔内溶液,每孔加入200 μL DMSO,37 ℃摇床上低速振荡15 min,使用酶标仪检测在490 nm处的吸光值。细胞存活率的计算如公式(4)所示:
细胞存活率![]()
(4)
式中:A0,含DMEM培养基的空白组吸光度;A1,含DMEM培养基和细胞的对照组吸光度;A2,含复合膜浸提液和细胞的实验组吸光度。
1.4.9 血液相容性
将复合膜制备成1 cm×1 cm的样品,加入含有2%(体积分数)大鼠红细胞(red blood cell survival,RBCs)悬浮液1 mL的离心管中,其中阴性对照为PBS,阳性对照为0.1%(体积分数)Triton X-100溶液。37 ℃培养1 h后,1 000 r/min离心15 min,收集上清液。用酶标仪检测上清液在540 nm处的吸光值,计算其溶血率。其计算如公式(5)所示:
溶血率![]()
(5)
式中:A0,阴性对照组的吸光度;A1,阳性对照组的吸光度;A2,实验组膜的吸光度。
2 结果与分析
2.1 FTIR分析
如图1所示,BC膜在3 350 cm-1的宽峰为—OH的伸缩振动峰,2 919 cm-1处为C—H的对称和不对称伸缩振动峰。LZ的特征峰为3 600~3 000 cm-1的宽峰,主要表现为N—H和O—H的伸缩振动,因此BC-LZ复合膜在3 450 cm-1附近的宽峰面积明显增大。1 656 cm-1处为C![]() O吸收峰,相较于BC膜的红外光谱图,复合膜的吸收峰强度逐渐减弱,这是由于复合膜中LZ和SP的存在,使得纤维素极性增强,水分子吸附倾向导致。BC膜中1 060 cm-1处的吸收峰为细菌纤维素中的C—O—C的弯曲振动,而复合膜在此处的吸收峰表现出轻微的红移且强度增加,这是因为SP中P
O吸收峰,相较于BC膜的红外光谱图,复合膜的吸收峰强度逐渐减弱,这是由于复合膜中LZ和SP的存在,使得纤维素极性增强,水分子吸附倾向导致。BC膜中1 060 cm-1处的吸收峰为细菌纤维素中的C—O—C的弯曲振动,而复合膜在此处的吸收峰表现出轻微的红移且强度增加,这是因为SP中P![]() O不对称拉伸振动峰与BC中C—O—C叠加而致[16]。红外光谱结果表明,LZ和SP已成功与BC交联。
O不对称拉伸振动峰与BC中C—O—C叠加而致[16]。红外光谱结果表明,LZ和SP已成功与BC交联。
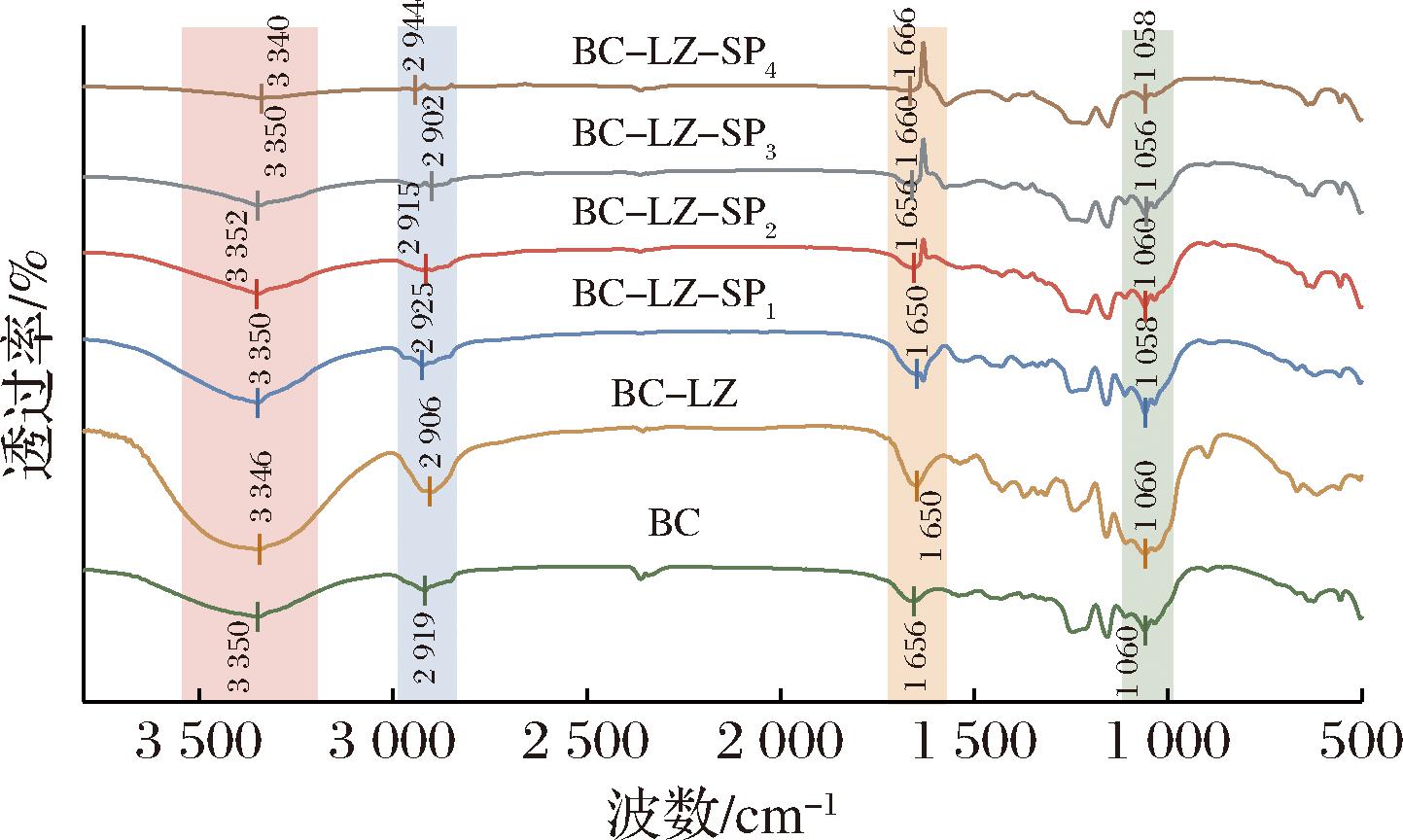
图1 复合膜红外光谱
Fig.1 Infrared spectrum of composite membranes
2.2 SEM分析
用SEM观察复合膜的截面,结果如图2所示。所有膜样品均具备三维孔状结构,该结构与细胞外基质类似,有利于细胞增殖和迁移[17]。其中,图2-a显示,纯BC表现出独特的纤维交织的网状结构,错落有致。随着SP浓度的增加,复合膜虽具备三维孔状结构,但也存在一定的片层和封闭孔结构,影响了原本纤维素间的相互作用。此外,从图2-e和图2-f可以看出,当SP浓度过高时,磷酸基团可能与纤维素分子发生过度交联,这种过度交联限制了纤维之间的自由运动,导致纤维网络变得更加致密,并形成明显的片层结构[18]。这一现象揭示了SP浓度对复合膜微观结构的重要影响,为进一步优化复合膜的性能提供了重要依据。
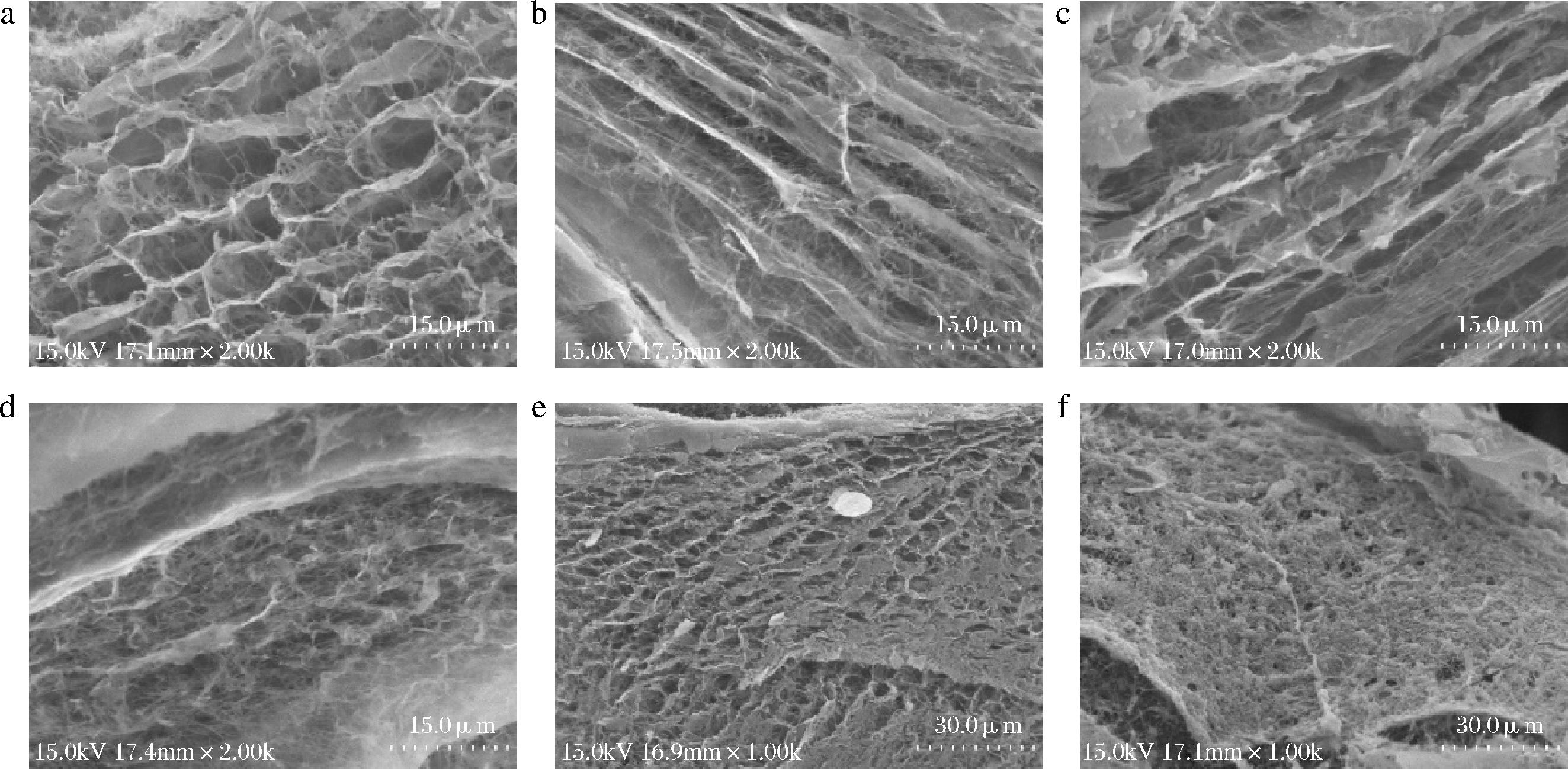
a-BC (2 000×);b-BC-LZ复合膜(2 000×);c-BC-LZ-SP1复合膜(2 000×);d-BC-LZ-SP2复合膜(2 000×);e-BC-LZ-SP3复合膜(1 000×);f-BC-LZ-SP4复合膜(1 000×)
图2 复合膜SEM图
Fig.2 SEM image of composite membranes
2.3 XRD分析
如图3所示,BC在2θ=14.5°、16.5°和22.7°处的衍射峰为纤维素I型的典型结构,分别对应了纤维素的101、111和200晶面[19]。BC-LZ、BC-LZ-SP1、BC-LZ-SP2、BC-LZ-SP3、BC-LZ-SP4在101和200晶面的衍射峰强度随着LZ和SP的引入明显降低,且BC-LZ-SP4在101和200晶面的衍射角分别为14.9°和23.5°,发生了小幅度的偏移。XRD衍射峰的宽度和强度与晶粒大小有关,而衍射峰的位置则与晶型有关[20]。通过公式计算得到复合膜样品的结晶度。从图3可以看出,BC膜的结晶度为86.82%,原位添加LZ提高了复合膜的结晶度,这是由于BC结晶峰主要源于内部结构中存在分子内或分子间氢键,而LZ的引入增强了与BC间的相互作用,纤维的有序排列促使复合膜的结晶度增加。然而,随着SP浓度的增加,磷酸基团与纤维素中的羟基发生相互作用,可能会破坏了原有的氢键网络。这种相互作用使无定型结构的占比增加,导致复合膜结晶度呈下降趋势。因此,过量的SP对纤维素I型的形成具有轻微的负面影响,这从结晶度的降低中得到了验证。这些发现为理解复合膜的结构与性能关系提供了重要依据。
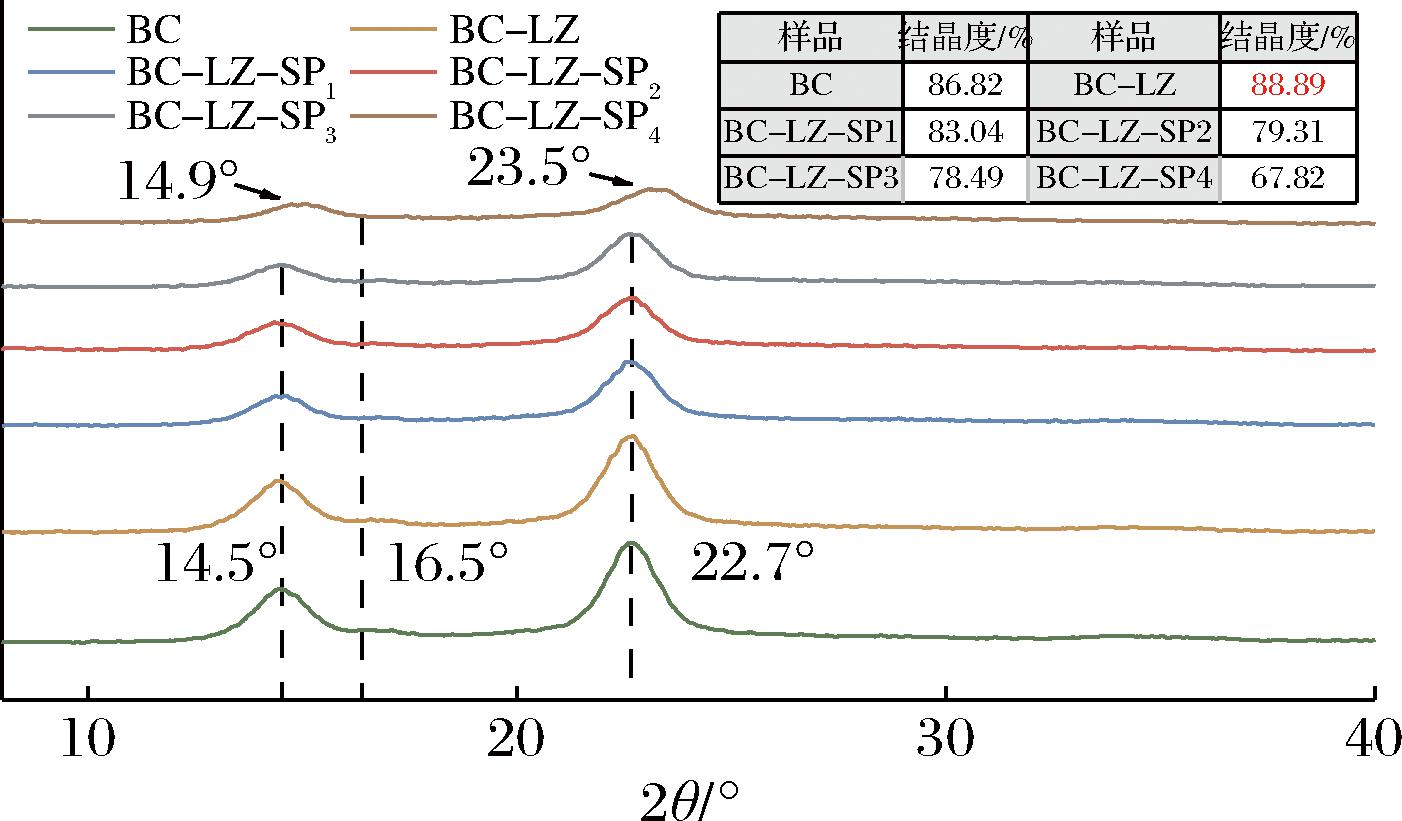
图3 复合膜XRD图
Fig.3 XRD diagram of composite membranes
2.4 溶胀性能分析
经冷冻干燥处理后的复合膜在恒温37 ℃的模拟体液中的溶胀性能曲线如图4所示。由于BC的亲水性,所有复合膜均表现出优异的快速吸水性能,在24 h后可达到最大水溶胀平衡率。随着SP浓度的增加,复合膜溶胀率呈现先上升后下降的趋势。其中,BC-LZ-SP2表现出最高水溶胀平衡率(6 313%),这主要归因于SP与BC的交联作用。在SP浓度较低时,SP的磷酸基团与BC膜中的羟基通过氢键或离子键形成了适度的交联结构,这种交联使得BC膜的纤维网状多孔结构变得更加松散,同时增加了复合膜内部的羟基数量,从而便于水分子的渗透与扩散,提升了溶胀性能。然而,当SP的浓度持续上升时,其磷酸基团与细菌纤维素链上的羟基发生更为强烈的反应,形成更为紧密的交联网络结构,这种致密化的膜结构限制了水分的进入,导致溶胀性能反而下降[21]。因此,SP浓度的合理调控对于优化复合膜的溶胀性能至关重要。
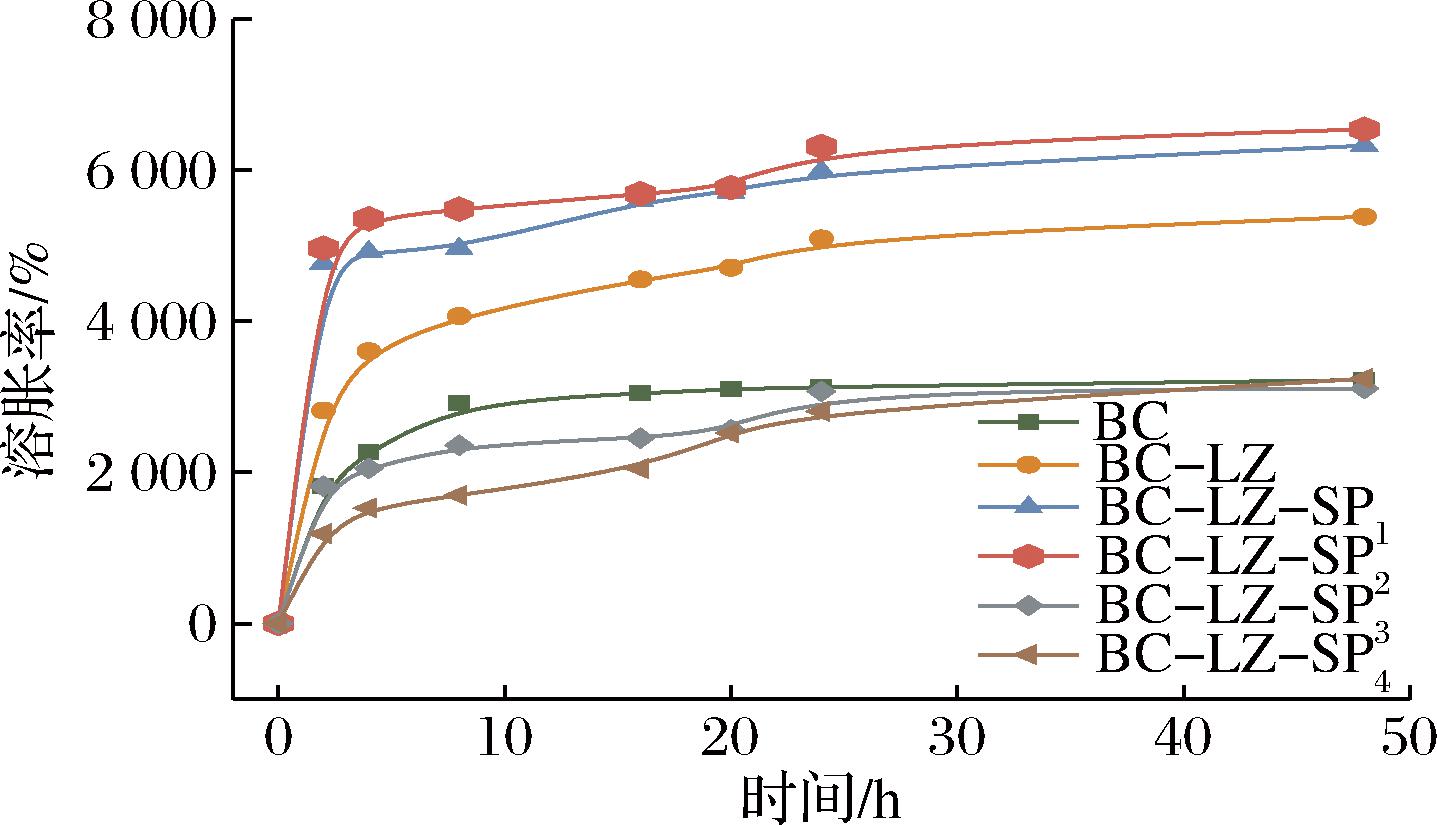
图4 复合膜溶胀性能曲线
Fig.4 Swelling performance curve of composite membranes
2.5 水接触角分析
水接触角测试是衡量复合膜亲疏水性的重要指标。如图5所示,除了BC-LZ-SP3和BC-LZ-SP4复合膜的水接触角大于95°,表现为疏水性质外,其他复合膜均呈现出亲水特性。其中,纯BC膜的水接触角仅为28.3°,随着LZ加入以及SP浓度的增高,复合膜水接触角呈现增大的趋势,亲水性逐渐降低。BC-LZ-SP3和BC-LZ-SP4复合膜表现为明显的疏水特性,这可能是由于SP中多个磷酸基团和烷基基团之间的相互作用,导致膜表面的极性降低,这种极性的降低减少了水分的渗透性和吸水性,进而使得复合膜的溶胀性能减弱,疏水性增加[22]。因此,SP浓度的变化对复合膜的亲疏水性具有显著影响,为调控复合膜的表面性质提供了可能。
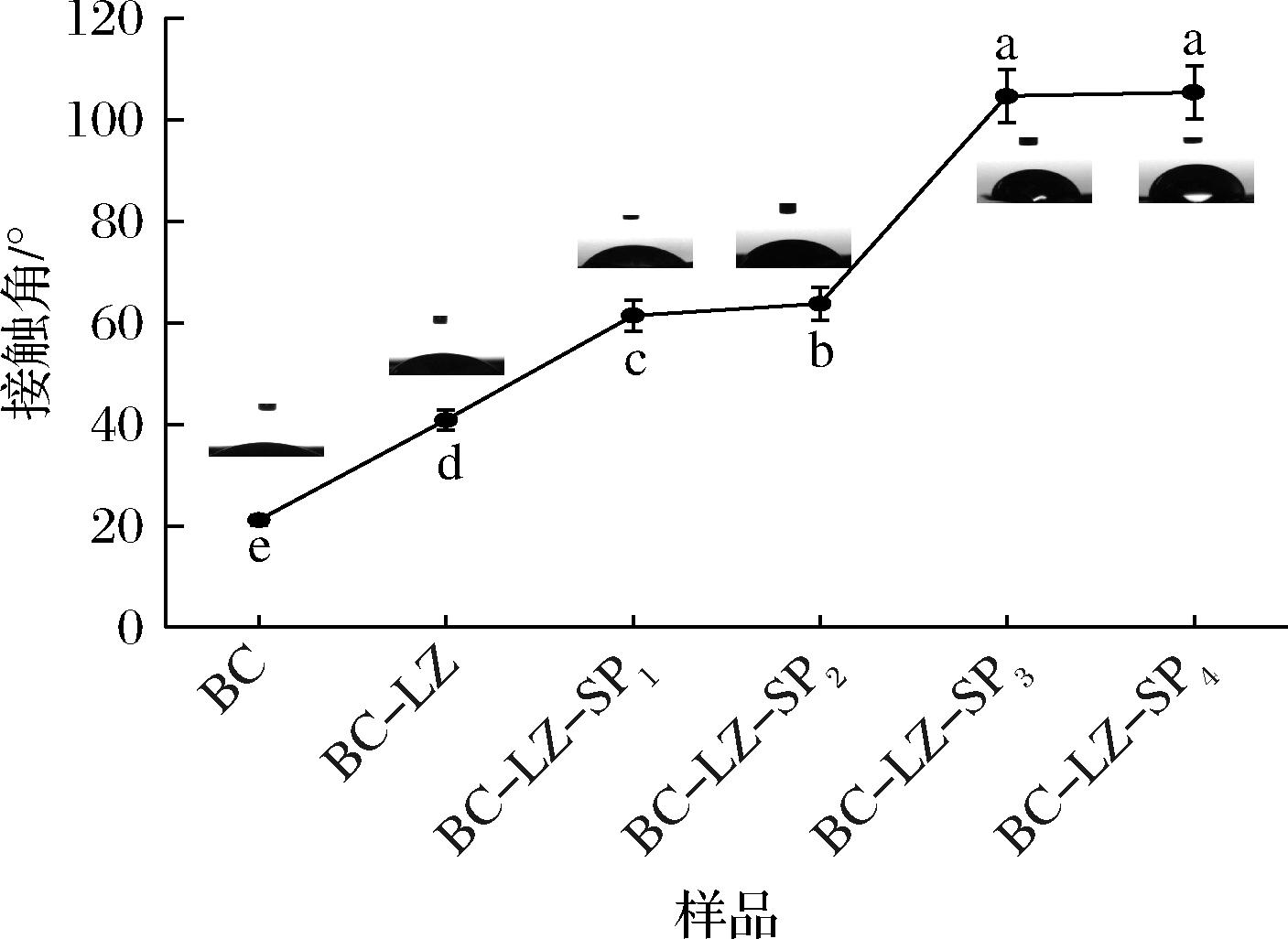
图5 复合膜水接触角
Fig.5 Water contact angle of composite membrane
注:不同小写字母表示差异显著(P<0.05)。
2.6 机械性能分析
利用电子万能拉力机测试抗拉强度和断裂伸长率来表征复合膜的机械性能。如图6所示,BC的拉伸强度为22 MPa,断裂伸长率为3.76%。随着LZ和SP的加入,复合膜的拉伸强度呈增加趋势,BC-LZ-SP4的拉伸强度提高至74 MPa,较BC提升了2.36倍,BC和SP间氢键相互作用使得复合膜的机械性能增加。对于断裂伸长率而言,BC-LZ-SP2的断裂伸长率达6.97%,较BC增加了85.37%,BC和SP间的相互作用同样使复合膜获得了更高的断裂伸长率,随着大量SP负电荷的引入,破坏了与BC间的相互作用,观察到复合膜断裂伸长率呈现下降的趋势,使得复合膜在延伸过程中可能更容易发生断裂。因此,低浓度的SP通过与BC发生相互作用,能够改善BC膜的交联结构,从而增强其拉伸强度和延展性,然而,当SP浓度过高时,可能导致膜结构的过度交联、表面脆化以及水合作用不良,进而使得复合膜的断裂伸长率下降[23]。这一发现为优化复合膜的机械性能提供了重要的指导。
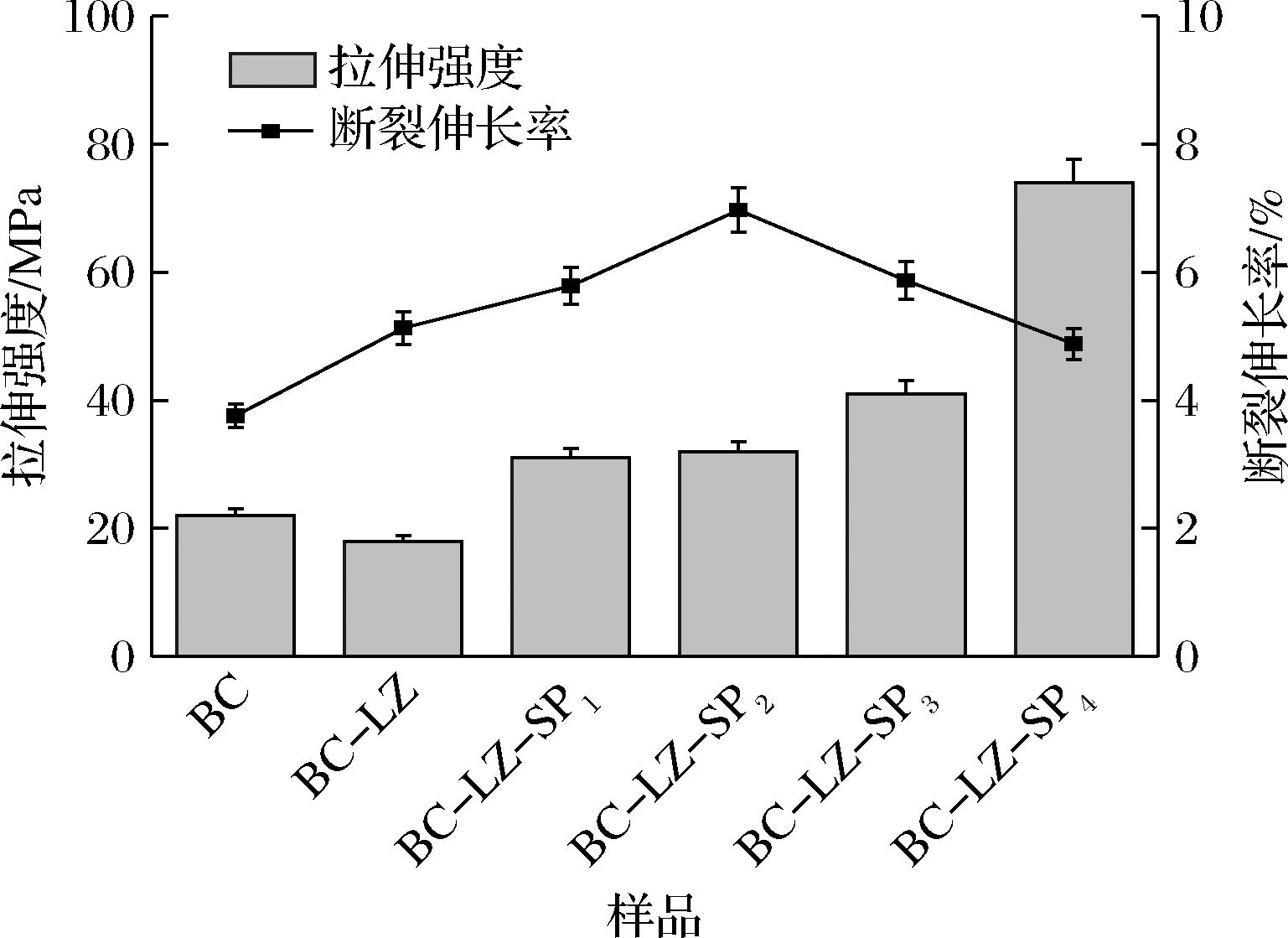
图6 复合膜机械性能
Fig.6 Mechanical properties of composite membranes
2.7 抑菌性能分析
为深入研究复合膜的抑菌特性,以C.albicans、Salmonella和B.subtilis 3种代表性的菌种为研究对象,通过振荡涂板法检测了复合膜的抑菌性能。图7-a显示对照组的纯BC膜中,各组菌落生长状态良好,没有显示出抗菌性。然而,当在BC膜中引入了LZ和SP,形成复合膜分别与细菌共培养后,C.albicans、Salmonella和B.subtilis的菌落数均大幅度降低,这表明复合膜对这3种菌均表现出了良好的抑菌效果。通过控制SP的添加量,可有效调节复合膜的抑菌效果。通过Imagine J软件测试各菌落数量,进行统计分析。如图7-b所示,复合膜抑菌率普遍达到70%以上,且抑菌效果与复合膜中SP含量呈正相关关系。这一现象进一步证实了LZ和SP的协同作用在抑菌过程中起到了关键作用。LZ作为一种正电荷抗菌肽,其独特的电荷特性使其能够与细菌的电负性细胞膜发生静电相互作用,从而破坏细菌细胞膜的完整性,导致细菌内部物质的泄漏和细菌的死亡。而SP中的Na+同样带有正电荷,也能够与细菌细胞膜发生相互作用,进一步增强复合膜的抑菌效果。此外,SP的引入还可能改变了复合膜的表面性质,使其更易与细菌接触并发挥抑菌作用[24]。由此可见,复合膜均具备一定的抑菌性能。
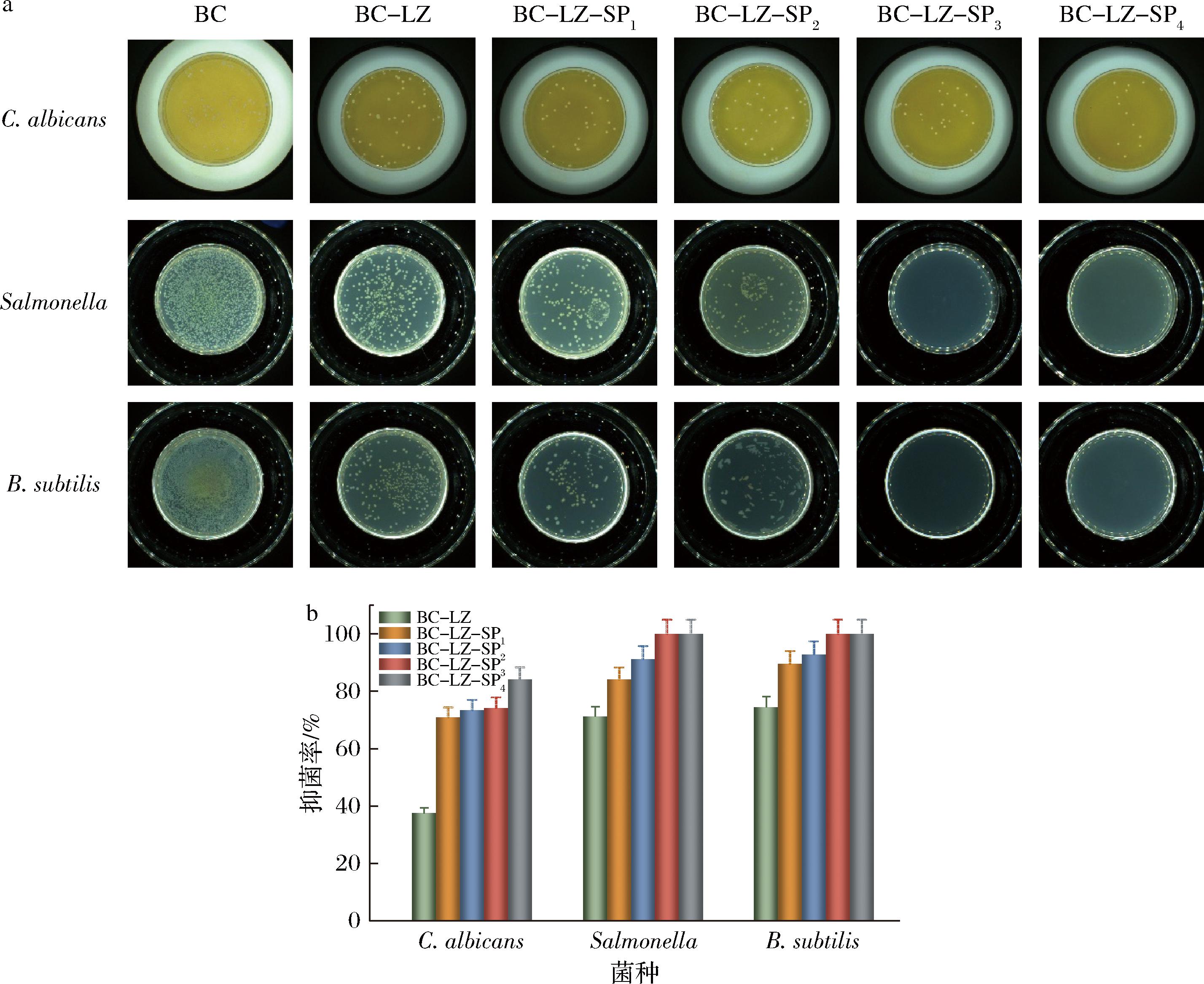
a-复合膜抑菌试验菌落数;b-复合膜抑菌率
图7 复合膜对C.albicans、Salmonella和B.subtilis的抑菌效果
Fig.7 Bacterial inhibition effect of composite membranes on C.albicans, Salmonella, and B.subtilis
2.8 细胞相容性分析
为全面评估复合膜的生物相容性,选用小鼠成纤维细胞L929对复合膜的细胞毒性进行分析,结果如图8所示。在用不同成分复合膜浸提液的培养基培养细胞至24、48、72 h后,尽管在细胞包浆内观察到一些离散颗粒,但并未发现细胞溶解的情况,保持着正常的增殖状态,且细胞活力均高于80%。根据GB/T 16886.5—2017《医疗器械生物学评价 第5部分:体外细胞毒性试验》中细胞活性必须高于70%,复合膜细胞毒性符合国家标准,表明复合膜对细胞无害,具有良好的生物相容性。BC作为一种纯纤维材料,本身就具有易于降解和生物相容性高等特点[25]。本研究中LZ和SP的复合并未对BC基体材料的优良性能产生负面影响,这为理解复合膜的生物学性能提供了新的视角,也为其在制备生物抗菌材料方面的应用提供了更多可能性。
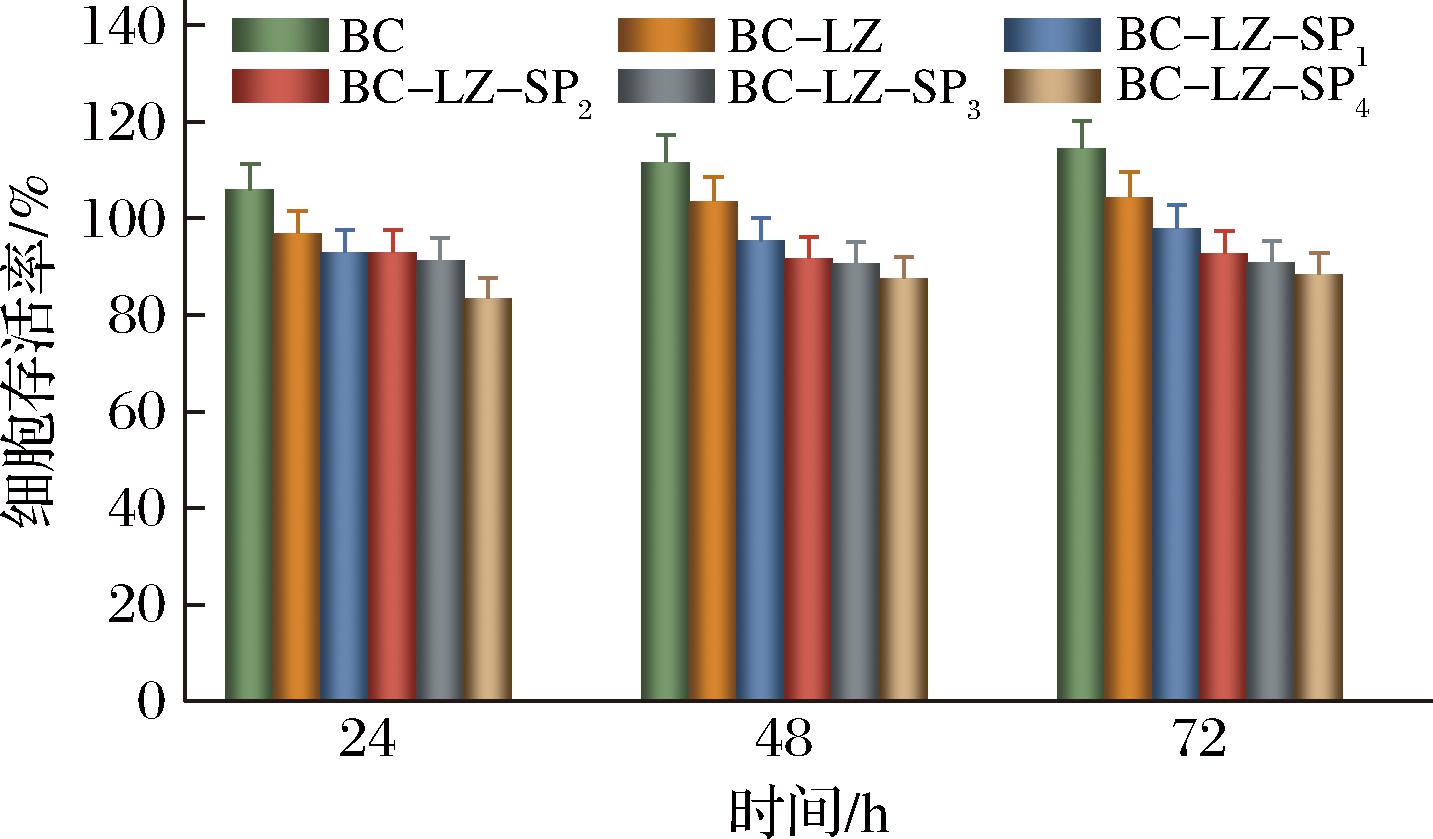
图8 复合膜细胞毒性
Fig.8 Composite membranes cytotoxicity
2.9 血液相容性分析
在评估复合膜的生物体内适用性时,血液相容性是一个至关重要的考量因素。使用RBCs测试,系统探究不同复合膜的血液相容性,旨在为其在生物医学领域的潜在应用提供科学依据。阳性对照采用Triton X-100与RBCs共培养,Triton X-100作为一种非离子型表面活性剂,可破坏红细胞膜。如图9所示,0.1% Triton X-100与RBCs共培养后,几乎所有的红细胞发生破裂,上清液呈红色,其溶血率约为100%[26]。阴性对照PBS、BC、BC-LZ-SP1 和BC-LZ-SP2复合膜与RBCs共孵育后,红细胞在形态上保持完整,上清液呈淡黄色,红细胞裂解率低于国际标准(溶血率<5%[27]),表明其未对RBCs造成明显损伤。而BC-LZ-SP3和BC-LZ-SP4复合膜与RBCs共孵育1 h后,随着SP添加量的增加,复合膜对红细胞的破坏作用逐渐增强。可能是因为高浓度的SP可能会干扰复合膜的表面电荷平衡,导致其对红细胞细胞膜的破坏作用增强[28-29]。虽然BC-LZ-SP3和BC-LZ-SP4复合膜在高浓度下表现出一定的溶血性,但这并不意味着它们在所有应用场景下都不适用。在实际应用中,可以根据具体需求和条件,通过调整复合膜的配方和成分,来优化其血液相容性。例如,可以通过降低SP的添加量或引入其他具有血液相容性的成分来改善复合膜的性能。
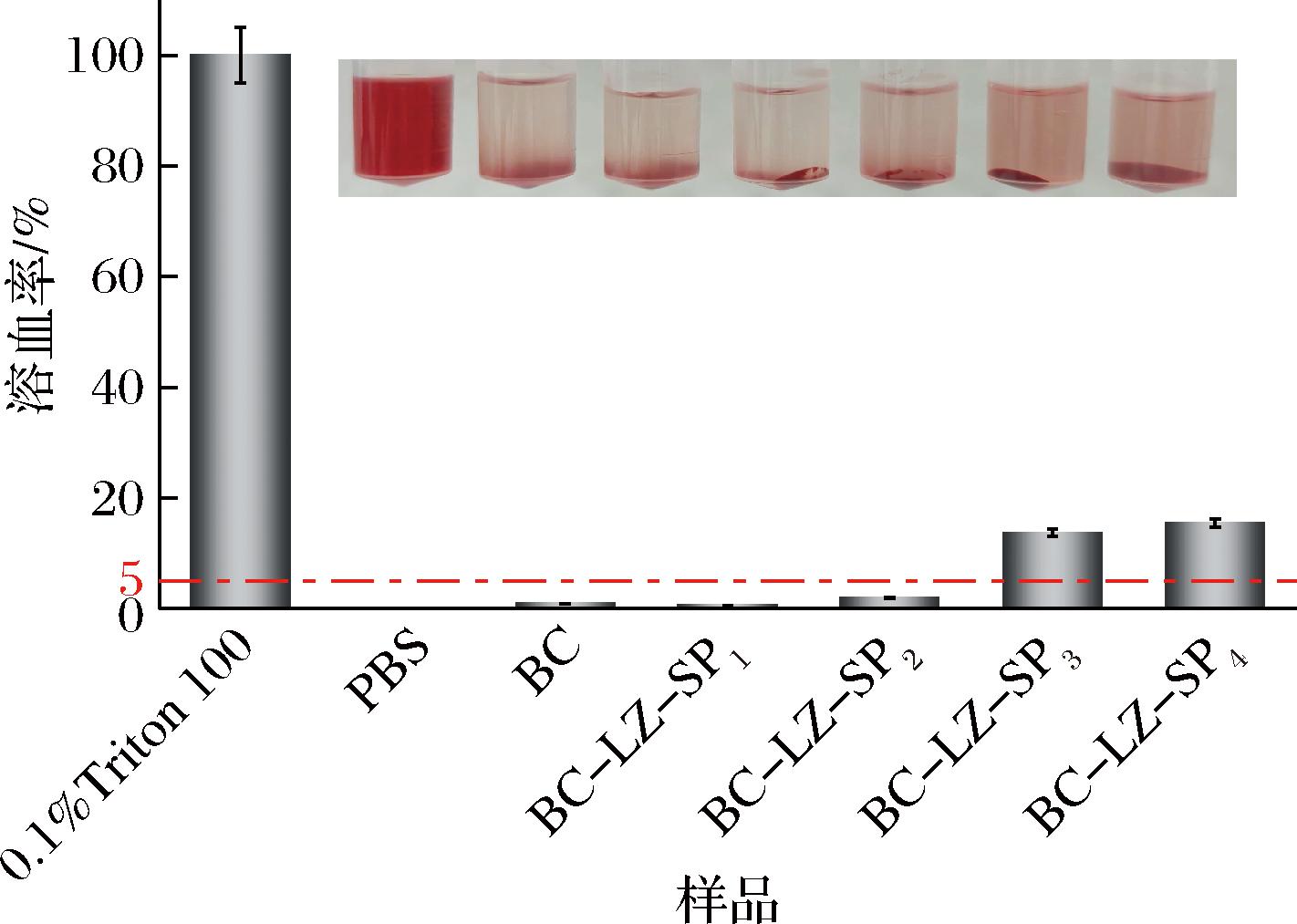
图9 复合膜溶血率
Fig.9 Composite membranes hemolysis rate
3 结论
以细菌纤维素/微生物溶菌酶复合膜为基体,通过溶液浸泡,成功制备了细菌纤维素/微生物溶菌酶/植酸钠复合膜。该复合膜旨在结合BC的生物相容性、LZ的抑菌特性以及SP的潜在抗菌与生物活性,以期获得一种具有广谱抑菌效果、优良物理特性和良好生物相容性的新型生物材料。结果表明,微生物溶菌酶和植酸钠赋予了复合膜良好的抑菌活性和生物相容性,填补了微生物溶菌酶在对革兰氏阴性菌抑制方面受限的空白,二者的协同效应有望提供更广谱的抑菌效果。此外,添加适量植酸钠的复合膜表现出优良的溶胀性能和机械性能,并且具有良好的血液相容性,拓宽了植酸钠作为新型抑菌剂在其他领域的应用,后续可探究细菌纤维素/微生物溶菌酶/植酸钠复合膜在生物医学领域抗菌敷料方面的应用,为未来开发新型功能性生物材料提供了新的思路。
[1] JU S Y, ZHANG F L, DUAN J F, et al.Characterization of bacterial cellulose composite films incorporated with bulk chitosan and chitosan nanoparticles:A comparative study[J].Carbohydrate Polymers, 2020, 237:116167.
[2] ![]() P, GO
P, GO CINIAK G, FIJA
CINIAK G, FIJA KOWSKI K, et al.Potential of bacterial cellulose chemisorbed with anti-metabolites, 3-bromopyruvate or sertraline, to fight against Helicobacter pylori lawn biofilm[J].International Journal of Molecular Sciences, 2020, 21(24):9507.
KOWSKI K, et al.Potential of bacterial cellulose chemisorbed with anti-metabolites, 3-bromopyruvate or sertraline, to fight against Helicobacter pylori lawn biofilm[J].International Journal of Molecular Sciences, 2020, 21(24):9507.
[3] YANG Y N, LU K Y, WANG P, et al.Development of bacterial cellulose/chitin multi-nanofibers based smart films containing natural active microspheres and nanoparticles formed in situ[J].Carbohydrate Polymers, 2020, 228:115370.
[4] 王金海, 朱宏阳, 李泳宁.聚赖氨酸/细菌纤维素抗菌敷料毒性及抗菌性能的检测[J].海峡科学, 2020(10):68-72.WANG J H, ZHU H Y, LI Y N.Determination of toxicity and antimicrobial properties of polylysine/bacterial cellulose antimicrobial dressings[J].Straits Science, 2020(10):68-72.
[5] 杨惠仪, 张栗杨, 丁蒙, 等.功能化细菌纤维素纳米晶复合聚氨酯医用抗菌涂层的制备及性能研究[J].纤维素科学与技术, 2024, 32(1):28-38.YANG H Y, ZHANG L Y, DING M, et al.Preparation and properties of functional bacterial cellulose nanocrystalline polyurethane composite antibacterial coating for medical purposes[J].Journal of Cellulose Science and Technology, 2024, 32(1):28-38.
[6] TOMCZYK  , LE
, LE NIEROWSKI G, CEGIELSKA-RADZIEJEWSKA R.Lysozyme modification using proteolytic enzymes[J].Molecules, 2023, 28(17):6260.
NIEROWSKI G, CEGIELSKA-RADZIEJEWSKA R.Lysozyme modification using proteolytic enzymes[J].Molecules, 2023, 28(17):6260.
[7] CUI Z H, HE F L, LI X X, et al.Molecular insights into the binding model and response mechanisms of triclosan with lysozyme[J].Journal of Molecular Liquids, 2022, 357:119080.
[8] 孙玥. 改性淀粉固载溶菌酶抑菌膜的制备、性能及应用研究[D].长春:吉林大学, 2020.SUN Y.Study in preparation, performance and application of lysozyme modified starch antibacerial film[D].Changchun:Jilin University, 2020.
[9] DE FRANCE K J, KUMMER N, REN Q, et al.Assembly of cellulose nanocrystal-lysozyme composite films with varied lysozyme morphology[J].Biomacromolecules, 2020, 21(12):5139-5147.
[10] YANG S F, LIU L, CHEN H Q, et al.Impact of different crosslinking agents on functional properties of curcumin-loaded gliadin-chitosan composite nanoparticles[J].Food Hydrocolloids, 2021, 112:106258.
[11] LIU B, PAN S K.Effect of chitosan coatings incorporated sodium phytate on the shelf-life of Antarctic krill (Euphausia superba)[J].International Journal of Biological Macromolecules, 2020, 151:62-65.
[12] 彭雯婧, 吕小丽, 韩颖, 等.食品添加剂植酸钠中无机磷含量测定研究[J].中国食品添加剂, 2019, 30(2):148-151.PENG W J, LYU X L, HAN Y, et al.Determination of inorganic phosphorus in food additive sodium phytate[J].China Food Additives, 2019, 30(2):148-151.
[13] 程静然, 宋荣荣, 戴蕴平, 等.转人溶菌酶奶牛牛乳蛋白理化性质的研究[J].黑龙江畜牧兽医, 2021(11):12-16;149-150.CHENG J R, SONG R R, DAI Y P, et al.Study on the physicochemical property of transferred human lysozyme cow milk protein[J].Heilongjiang Animal Science and Veterinary Medicine, 2021(11):12-16;149-150.
[14] WU J, TIAN S J, LUO K, et al.Dietary recombinant human lysozyme improves the growth, intestinal health, immunity and disease resistance of Pacific white shrimp Litopenaeus vannamei[J].Fish &Shellfish Immunology, 2022, 121:39-52.
[15] 余瞻, 赵福权, 徐成龙, 等.红茶菌中细菌纤维素产生菌的筛选、鉴定及其发酵动力学模型构建[J].食品与发酵工业, 2021, 47(6):92-98.YU Z, ZHAO F Q, XU C L, et al.Screening, identification of bacterial cellulose producing bacteria and establishment of fermentation kinetics[J].Food and Fermentation Industries, 2021, 47(6):92-98.
[16] ZHENG K W, LI W, WANG W, et al.Preparation and characterisation of carboxymethyl-chitosan/sodium phytate composite membranes for adsorption in transformer oil[J].International Journal of Biological Macromolecules, 2019, 132:658-665.
[17] 陈李. 载茶多酚丝素蛋白/纤维素/聚丙烯酸复合水凝胶敷料的制备及性能研究[D].重庆:西南大学, 2021.CHEN L.Preparation and properties of tea polyphenol-loaded Silk Fibroin/Cellulose/Poly-acrylic Acid composite hydrogel dressing[D].Chongqing:Southwest University, 2021.
[18] LI H Z, LIU X H, CHI E Y, et al.Enhancing nickel-ion adsorption:Insights into phytate sodium salt modification of styrene-butadiene-styrene triblock copolymer electrospun fiber membranes[J].Science of Advanced Materials, 2023, 15(11):1462-1468.
[19] GEA S, REYNOLDS C T, ROOHPOUR N, et al.Investigation into the structural, morphological, mechanical and thermal behaviour of bacterial cellulose after a two-step purification process[J].Bioresource Technology, 2011, 102(19):9105-9110.
[20] 许艺馨. 壳聚糖接枝细菌纤维素活性复合膜的制备及应用[D].无锡:江南大学, 2022.XU Y X.Preparation and application of chitosan grafted bacterial cellulose active composite film[D].Wuxi:Jiangnan University, 2022.
[21] QIU H Y, GUO P P, GUAN Y T, et al.Deep eutectic solvent-assisted self-healing and anti-freezing composite hydrogels regulated by sodium phytate for wearable sensors[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2024, 686:133346.
[22] YANG J, XIONG L, LI M, et al.Chitosan-sodium phytate films with a strong water barrier and antimicrobial properties produced via one-step-consecutive-stripping and layer-by-layer-casting technologies[J].Journal of Agricultural and Food Chemistry, 2018, 66(24):6104-6115.
[23] ZOLFAGHARI P, KHALEDIAN H R, ALIASGHARLOU N, et al.Facile surface modification of immobilized rutile nanoparticles by non-thermal glow discharge plasma:Effect of treatment gases on photocatalytic process[J].Applied Surface Science, 2019, 490:266-277.
[24] JIANG W B, PENG J, JIANG N, et al.Chitosan phytate nanoparticles:A synergistic strategy for effective dental caries prevention[J].ACS Nano, 2024, 18(21):13528-13537.
[25] LIN J X, TONG X, SUN Q X, et al.Biodegradable ternary Zn-3Ge-0.5X (X=Cu, Mg, and Fe) alloys for orthopedic applications[J].Acta Biomaterialia, 2020, 115:432-446.
[26] 王凤萍. 多尺度细菌纤维素基材料的构筑及其在油水分离和伤口敷料的应用[D].天津:天津科技大学, 2022.WANG F P.Construction of multiscale bacterial cellulose-based materials and their applications in oil-water separation and wound dressing[D].Tianjin:Tianjin University of Science and Technology, 2022.
[27] XIE Y Y, ZHANG Y W, LIU X Z, et al.Aggregation-induced emission-active amino acid/berberine hydrogels with enhanced photodynamic antibacterial and anti-biofilm activity[J].Chemical Engineering Journal, 2021, 413:127542.
[28] 孙美艳. NIR响应的细菌纤维素基功能敷料的制备及性能研究[D].天津:天津科技大学, 2023.SUN M Y.Fabrication of functional bacterial cellulose dressing with NIRStimulus-responsiveness and its study for performance[D].Tianjin:Tianjin University of Science and Technology, 2023.
[29] ZEHTABI F, MONTAZERIAN H, HAGHNIAZ R, et al.Sodium phytate-incorporated gelatin-silicate nanoplatelet composites for enhanced cohesion and hemostatic function of shear-thinning biomaterials[J].Macromolecular Bioscience, 2023, 23(1):2200333.