大黄鱼是我国重要的经济海水养殖鱼种,凭借其口感鲜美、营养丰富、肌间刺较少、价格实惠等特点而深受消费者喜欢,近年来产量一直位居前位[1]。不过,和其他鱼类类似,捕捞后的大黄鱼在运输、贮藏、销售等冷链物流环节极易因环境因素改变而导致品质特性劣变,食用价值大幅度降低,造成较大的经济损失[2]。腐败菌的繁殖被认为是造成大黄鱼品质劣变的重要原因,尤其在贮藏后期,优势腐败菌占据数量优势且具有强致腐潜能,对大黄鱼品质特性的消极作用更为突出[3]。研究发现,优势腐败菌对水产品的强致腐潜能与肌肉蛋白质降解密切相关[4]。具体而言,水产品在贮藏期间极易在腐败菌的作用下逐渐降解成为小分子肽、游离氨基酸,并进一步经脱氨脱羧作用释放各类异味成分,进而加速其腐败变质进程[5-6]。因此,选取有效的抑菌方式对保持大黄鱼冷藏期间品质特性具有重要的作用。同时,水产品本身是一个复杂的体系,贮藏期间会经历特定的微生物演替规律,腐败菌间会存在一定的互作关系[7]。因此,有必要考察特定抑菌方式对其优势腐败菌(单独/混合存在状态)的作用效果,并探析其抑菌机理。
单甘油月桂酸酯(glycerol monolaurate, GML)是一种安全、高效、广谱的抑菌剂,现已被美国食品药品管理局(Food and Drug Administration, FDA)批准为一般公认安全(generally recognized as safe, GRAS)的食品成分[8-9],也因此有潜能作为一种保鲜剂用于食品保鲜,目前已有相关的研究报道。宋飞等[10]将GML与乳酸复配用于冷鲜肉的保鲜,结果发现GML表现出良好的抑菌性与保水效果。YU等[8]通过研究添加有不同浓度GML的壳聚糖涂膜处理对冷藏草鱼品质的影响,发现含0.3% GML的2%壳聚糖可很好地抑制微生物生长、核苷酸分解、碱性成分积累、质构和感官特性劣变。值得注意的是,GML水溶性相对较差,这在一定程度上会限制其使用范围,可考虑将其制成微乳液或者其他的形式以解决这一问题。
因此,本研究将GML制备成微乳液,一方面将GML微乳液与冷藏大黄鱼的优势腐败菌菌悬液进行体外孵育,通过抑菌活性、细胞膜渗透性、细胞形态变化、胞外蛋白酶抑制率等指标,研究不同浓度GML对大黄鱼优势腐败菌的抑菌特性,以初探其抑菌机理,并优化得到抑菌效果最佳的GML浓度。另一方面,利用上述抑菌效果最佳的GML微乳液处理经不同优势腐败菌(单一或混合)接种模式下的大黄鱼块,通过大黄鱼贮藏期间品质特性变化,以考察GML微乳液对不同优势腐败菌接种模式下的冷藏大黄鱼品质影响。
1 材料与方法
1.1 材料与试剂
鲜活大黄鱼,上海市浦东新区芦潮港海鲜市场,采用一层碎冰一层大黄鱼的方式置于泡沫箱中,30 min内运回实验室,使用物理方法打击头部使其眩晕,宰杀后去除内脏并清洗,备用。
Shewanella baltica、Pseudomonas brenneri为冷藏大黄鱼的优势腐败菌,在前期实验中从腐败的冷藏大黄鱼中分离纯化得到,并通过16S rRNA基因测序协同EzTaxon-e系统进行鉴定,采用-80 ℃冰箱冻结法保存菌种,备用。
GML,杭州康源食品科技有限公司;吐温20、Na2S2O3、2.5%(质量分数)戊二醛、PBS(pH 7.5)、水杨酸、柠檬酸钠、NaClO等(分析纯),上海生工化学试剂有限公司;碱性磷酸酶(alkaline phosphatase,AKP)试剂盒、氨基酸脱羧酶酶联免疫分析试剂盒,上海科艾博生物技术有限公司。
1.2 仪器和设备
H-2050R-1高速冷冻离心机,湖南湘仪离心机仪器有限公司;FA25高速匀浆机,上海FLUKO弗鲁克仪器有限公司;HX-200B台式恒温摇床,上海海向仪器设备厂;Cmax Plus酶标仪,美国分子仪器有限公司;1810APC紫外分光光度计,北京普析通用仪器有限责任公司;L-8800氨基酸全自动分析仪,日本Hitachi公司;Waters e2695高效液相色谱仪,美国Waters公司。
1.3 实验方法
1.3.1 体外抑菌特性
GML微乳液的配制:将等体积的GML、无水乙醇混合均匀作为油相,并加入4倍体积的表面活性剂吐温20,25 ℃、600 r/min磁力搅拌2 h后,置于超声波清洗器中,并逐滴加入去离子水稀释,观察体系的状态变化,直至体系始终保持澄清透明状态,并在25 ℃水浴中静置平衡,即得到均匀透明的水相微乳液。记录用水量,计算GML浓度。在此基础上,进一步用去离子水稀释,以配制不同浓度的GML微乳液。
优势腐败菌菌悬液的制备:保存的S.baltica、P.brenneri菌株均置于37 ℃水浴中快速复苏后,分别移取菌液于胰酪大豆胨液体培养基中活化18 h,然后将活化的菌液再次接种至胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基中,28 ℃、160 r/min摇床过夜培养至菌落总数达9 lg CFU/mL,分别选取S.baltica菌悬液、P.brenneri菌悬液、混合菌悬液(等体积的S.baltica菌悬液与P.brenneri菌悬液)分别用无菌生理盐水稀释至6 lg CFU/mL,分别记为SB、PB和SPB,作为接种液备用。
将上述制备的不同形式菌悬液与不同浓度GML微乳液进行体外孵育(摇床孵育24 h),其中GML微乳液在使用前进行灭菌处理,具体分组见表1。
表1 体外孵育处理的组别信息
Table 1 Group information of in vitro incubation treatment
组别配方CK11 mL SB菌悬液+9 mL无菌生理盐水CK21 mL PB菌悬液+9 mL无菌生理盐水CK31 mL SPB菌悬液+9 mL无菌生理盐水C11 mL SB菌悬液+9 mL 3%(体积分数)无菌GML微乳液C21 mL PB菌悬液+9 mL 3%(体积分数)无菌GML微乳液C31 mL SPB菌悬液+9 mL 3%(体积分数)无菌GML微乳液C41 mL SB菌悬液+9 mL 5%(体积分数)无菌GML微乳液C51 mL PB菌悬液+9 mL 5%(体积分数)无菌GML微乳液C61 mL SPB菌悬液+9 mL 5%(体积分数)无菌GML微乳液C71 mL SB菌悬液+9 mL 7%(体积分数)无菌GML微乳液C81 mL PB菌悬液+9 mL 7%(体积分数)无菌GML微乳液C91 mL SPB菌悬液+9 mL 7%(体积分数)无菌GML微乳液
经不同处理的菌悬液达到预设时间后,加入1 mL 0.5 g/L Na2S2O3以终止反应,检测GML微乳液抑菌活性及菌悬液的细胞膜通透性、细胞膜完整性、形态变化、细菌活力及三羧酸循环中相关酶活性和代谢物的含量。
1.3.2 体内抑菌效果
无菌大黄鱼块的制备:大黄鱼外表面首先用75%(体积分数)乙醇溶液轻轻擦拭,然后使用无菌砧板和刀切除鱼头、尾、骨头及鱼皮,切块(约3 cm×3 cm×2 cm),并以1∶10(g∶mL)的比例将大黄鱼块浸入0.5%(质量分数)的福尔马林溶液处理20 s,用无菌水冲洗3次后,再次将大黄鱼块以1∶10(g∶mL)的比例浸没于1 mmol/L碘乙酸溶液以去除鱼样中含有的内源性蛋白酶,在4 ℃环境中浸泡4 h后沥干水,置于超净台紫外杀菌15 min,得到无菌大黄鱼块。
制备的S.baltica菌悬液、P.brenneri菌悬液及混合菌悬液(等体积的S.baltica菌悬液与P.brenneri菌悬液均添加等量的GML微乳液,以实现含特定浓度GML的微乳液(该浓度下对S.baltica、P.brenneri的抑菌活性最佳,以体外抑菌效果的实验结果为依据),作为接种液。
在此基础上,以3 L接种液:15个无菌大黄鱼片的比例,将上述制备好的无菌大黄鱼块浸没于不同的接种液中处理10 min。其中,接种S.baltica菌悬液的处理组记为SB组,接种P.brenneri菌悬液的处理组记为PB组,接种混合菌菌悬液的处理组记为SB+PB组。同时,以无菌去离子水浸渍相同时间的大黄鱼块作为对照,记为CK组。浸渍处理后的样品沥干水分,放入无菌聚乙烯袋贮藏于4 ℃下。定期取样,进行品质指标检测。
1.4 测定方法
1.4.1 体外抑菌特性
1.4.1.1 GML微乳液抑菌活性
取100 μL经不同处理后的菌悬液涂布于TSB培养基,随后置于37 ℃培养箱中培养48 h后,采用平板计数法进行计数。以SB菌悬液的各实验组(C1、C4、C7)与CK1组的细菌菌落数比值的对数值C表示SB优势腐败菌的减菌效果,以PB菌悬液的各实验组(C2、C5、C8)与CK2组的细菌菌落数比值的对数值C表示PB优势腐败菌的减菌效果,以混合菌悬液的各实验组(C3、C6、C9)与CK3组的细菌菌落数比值的对数值C表示混合优势腐败菌的减菌效果。C绝对值越大,表明减菌作用越强。每组进行3次平行实验,取平均值作为最终结果。其计算如公式(1)所示:
C=lg(Ni/N0)
(1)
式中:N0,CK组(CK1、CK2、CK3)的细菌菌落数,CFU/mL;Ni,表示各实验组(C1、C4、C7;C2、C5、C8;C3、C6、C9)的细菌菌落数,CFU/mL,i=1,2,3,4。
1.4.1.2 细胞膜渗透性
参考ZHANG等[11]的方法,并稍作修改。经不同处理后的菌悬液10 000 r/min、4 ℃离心15 min。收集上清液,紫外-可见分光光度计测其在260 nm处的吸光度。利用Bradford蛋白质量浓度测定试剂盒测其上清液中蛋白质含量以评估蛋白质的泄漏量。
1.4.1.3 形态变化
将不同处理组的菌悬液静置过夜,4 000 r/min离心5 min,弃上清液,菌体用pH 7.4的PBS洗涤3次,并用质量分数2.5%戊二醛溶液于4 ℃冰箱中固定4 h,将样品分别用不同体积分数(30%、50%、70%、90%、100%)乙醇梯度脱水后,置于-80 ℃冰箱冷冻保存4~8 h,冷冻干燥24 h后涂至金属箔片并固定喷金,置于扫描电子显微镜下观察菌体形态结构。
1.4.1.4 胞外蛋白酶活性抑制率
参考ZHU等[12]的方法,并稍作修改。取孵育后的不同处理组菌悬液,在4 ℃、10 000 r/min条件下离心10 min,上清液使用0.22 μm无菌滤膜过滤除菌,获得无菌胞外溶液。所得滤液加入9倍体积的三氯乙酸(trichloroacetic acid,TCA)溶液,冰孵5 h后,在4 ℃、12 000×g条件下离心30 min,所得沉淀用预冷的丙酮洗涤3次,重新溶解于100 mmol/L Tris-HCl缓冲液中,即为胞外蛋白酶成分,用Bradford蛋白质检测试剂盒测量其蛋白浓度,胞外蛋白酶活性抑制率表示为不同处理组孵育后的胞外蛋白酶与未孵育前胞外蛋白酶浓度的降低百分比。
1.4.1.5 胞外碱性磷酸酶活性测定
定期取孵育的菌悬液,10 000 r/min离心10 min,取上清液,使用碱性磷酸酶AKP试剂盒测定碱性磷酸酶活性。AKP定义:以1 mL培养液在37 ℃条件下与基质作用15 min产生1 mg酚为1个酶活性单位(U),测定并计算胞外溶液的碱性磷酸酶活性(U/mL)随时间的变化情况。
1.4.2 体内抑菌效果
1.4.2.1 微生物数量
菌落总数测定参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》。
1.4.2.2 感官特性
由训练有素的感官评定员采用9分制评分法对大黄鱼感官特性进行评价,评价内容从外观(20%)、黏液(20%)、组织(25%)、气味(35%)4个角度出发,计算加权平均分。
1.4.2.3 氨含量
参考ZHUANG等[6]的方法:准确称取绞碎均匀的2 g鱼样,加入20 mL去离子水均质,然后4 ℃、6 687 r/min条件下离心10 min,收集上清液,制备得到肌肉组织匀浆液,取40 μL匀浆液与1.96 mL 0.005 mol/L硫酸在离心管中充分混合。然后,加入100 μL 5%(质量分数)水杨酸、5%(质量分数)柠檬酸钠的混合溶液并充分混合。然后,依次加入20 μL 1%(质量分数)硝普钠溶液和20 μL 0.05 mol/L NaClO溶液。在25 ℃下孵育60 min后,使用酶标仪在697 nm处测量OD值。使用0.05~4 μg/mL的标准NH4Cl溶液建立校准曲线。
1.4.2.4 氨基酸脱羧酶含量
按照氨基酸脱羧酶酶联免疫分析试剂盒的说明书进行,此试剂盒利用双抗体夹心法原理,通过检测450 nm处的OD值确定氨基酸脱羧酶含量。
1.4.2.5 TCA-可溶性肽含量
TCA-可溶性肽含量的检测参考SAENGSUK等[13]的方法:移取3 mL样品溶液,加入27 mL 50 g/L 的TCA溶液进行匀浆以提取TCA-可溶性多肽,在冰浴中平衡30 min后,4 ℃、9 450 r/min离心10 min,用Lowry法测定上清液中溶解的TCA-可溶性多肽含量。
1.4.2.6 SDS-PAGE
参考TAN等[14]的方法提取肌原纤维蛋白,然后以1∶4(g∶mL)的比例加入5倍蛋白上样缓冲液(2.0 mL 0.5 mol/L Tris-HCl,并在100 ℃加热5 min。然后取10 μL样品、标准蛋白maker上样到SDS-PAGE预制胶中,在室温下以150 V电泳40~50 min。电泳后,用0.125 g/100 mL考马斯亮蓝R-250染色,并在含30%(体积分数)甲醇、40%(体积分数)乙酸的溶液中快速脱色,使用Gel Image Specialized Analysis软件分析肌原纤维蛋白降解情况。
1.5 统计方法
使用SPSS 24.0中的方差分析进行数据分析,所有实验结果均以“平均值±标准差”表示,采用Tukey检验以P<0.05表示有显著性差异。线图由Origin软件绘制。
2 结果与分析
2.1 体外抑菌特性
2.1.1 GML微乳液抑菌活性
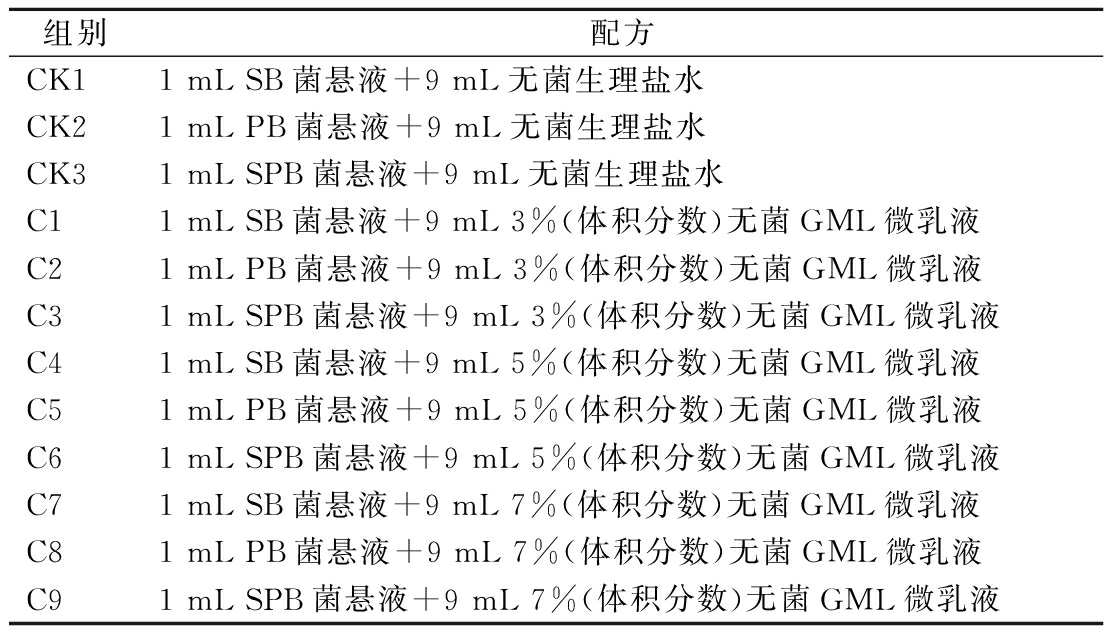
不同质量浓度(0、0.375、0.75、1.5 mg/mL)的GML微乳液对S.baltica、P.brenneri及混合菌(等体积的S.baltica和P.brenneri)的抑菌效果见图1,可明显看出:GML微乳液对S.baltica、P.brenneri及混合菌的减菌效应均具有浓度依赖性与时间依赖性,GML浓度越高,孵育时间越长,减菌效果越好。换句话讲,高浓度的GML微乳液对优势腐败菌表现出良好的抑菌效果,特别是1.5 mg/mL GML微乳液对混合菌的抑菌效果最为突出,这也反映了GML微乳液的广谱抑菌性[15]。不过,在研究中发现:对于相同孵育时间的不同优势腐败菌,GML微乳液对P.brenneri的抑菌效果要逊色于S.baltica,而当2种优势腐败菌共存时,GML微乳液对混合菌的抑菌效果要强于S.baltica。这可能是因为这2种优势腐败菌的代谢存在一定的互作关系[16]。当GML微乳液与混合菌悬液孵育时,会干扰这两者间存在的互作关系,从而达到更好的抑菌效果。李妍萍等[17]研究表明GML微乳液对优势腐败菌生物被膜形成的抑制作用也是其发挥抑菌特性的重要缘由。从这个角度看,GML微乳液对2种优势腐败菌共混状态下的生物被膜形成的影响更为明显。因此,从减菌效果来看,可将GML微乳液用于抑制S.baltica、P.brenneri的繁殖。对于抑菌机理,之前有研究发现,GML可通过非特异性地经细菌表面信号转导系统实现与质膜的相互作用,从而实现抑菌的效果[18];也有研究发现,GML抑菌特性与影响微生物生物膜的形成密切相关[19]。
a-S.baltica菌悬液;b-P.brenneri菌悬液;c-混合菌悬液
图1 不同浓度GML微乳液对单一/混合优势腐败菌的抑菌活性
Fig.1 Bacteriostatic activity of different concentrations of GML microemulsion against single/mixed SSOs
2.1.2 细胞膜渗透性
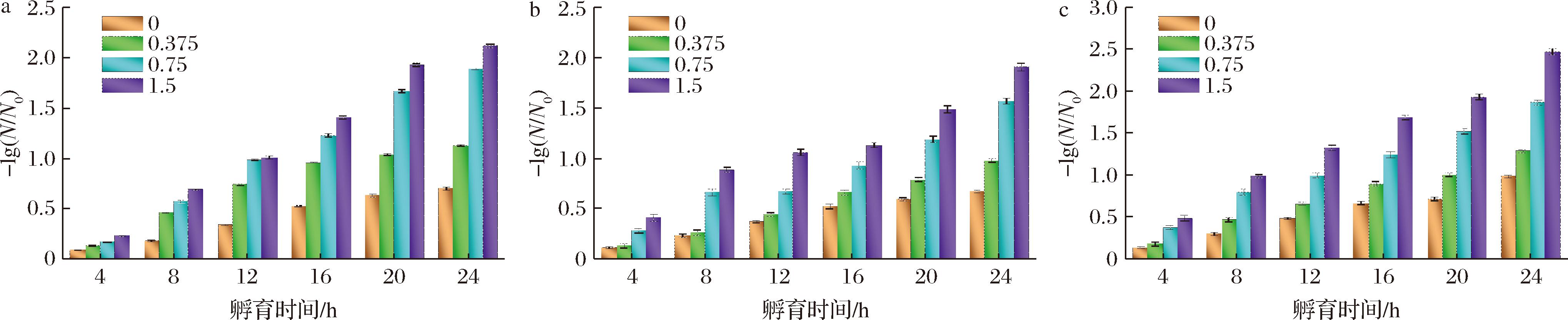
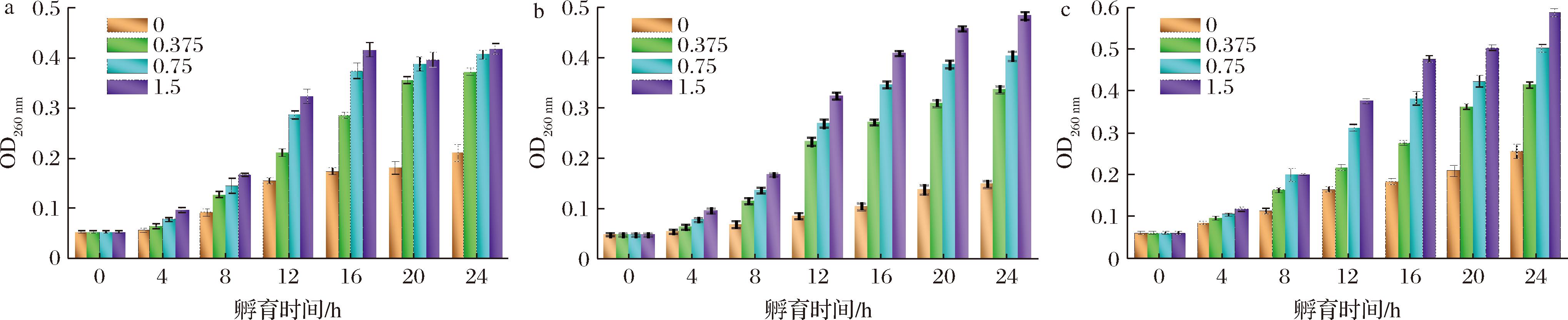
细胞膜渗透性改变会引起微生物细胞完整性遭到损害,甚至破裂,常伴随着细胞内蛋白质、核酸等营养物质的泄露,进而影响其正常生理功能。不同浓度的GML微乳液与不同优势腐败菌孵育后的核酸、蛋白质泄漏量变化如图2、图3所示,随着GML浓度增加,不同优势腐败菌的核酸、蛋白质泄露量均出现不同程度的增加,这表明GML微乳液可通过增加S.baltica、P.brenneri的细胞膜渗透性,导致胞内大分子物质(核酸、蛋白质)泄露和细胞结构遭到不可逆的破坏,进而影响细胞正常生长,达到抑菌的目的。究其原因,有可能是因为GML微乳液破坏了细胞膜对菌体的支撑保护功能[20]。对于核酸泄露量来讲,1.5 mg/mL GML微乳液对P.brenneri核酸泄露量的影响明显强于其他浓度,而不同浓度的GML微乳液作用于S.baltica时,会发现在孵育16 h内具有显著性差异,在16 h后几乎无差别,这表明GML微乳液对不同优势腐败菌细胞内核酸物质的泄露作用存在显著差异,尤其是对P. brenneri细胞的作用更为显著。同时,GML微乳液在16 h内即可基本实现S. baltica细胞内全部核酸物质的释放,表明其细胞完整性已达到最大程度的破坏。同时,GML微乳液对混合菌悬液核酸泄露量的影响明显强于其单独作用于S.baltica、P.brenneri时,这样的影响也反映在蛋白质泄漏量方面。以上的实验现象表明:相比较于单一优势腐败菌,GML微乳液对混合优势腐败菌(S.baltica、P.brenneri)的细胞结构破坏作用更为强烈,泄露的大量蛋白质、核酸物质作为菌体正常生长代谢所需物质,可阻碍S.baltica、P.brenneri的进一步繁殖代谢。不过,与核酸泄漏量不同的是,不同浓度的GML微乳液对S.baltica、P.brenneri蛋白质的泄漏量均具有显著性影响,尤其是1.5 mg/mL GML微乳液的影响最大。综上所述,GML微乳液可通过加剧S.baltica、P.brenneri细胞内蛋白质、核酸的泄漏量,造成细胞膜渗透性改变,细胞完整性破坏,且GML微乳液浓度越高,破坏力越大。
a-S.baltica菌悬液;b-P.brenneri菌悬液;c-混合菌悬液
图2 不同浓度GML微乳液对单一/混合优势腐败菌核酸泄漏量的影响
Fig.2 Effect of different concentrations of GML microemulsion on nucleic acid leakage content from single/mixed SSOs
a-S.baltica菌悬液;b-P.brenneri菌悬液;c-混合菌悬液
图3 不同浓度GML微乳液对单一/混合优势腐败菌蛋白质泄漏量的影响
Fig.3 Effect of different concentrations of GML microemulsion on protein leakage content from single/mixed SSOs
2.1.3 细胞形态变化
如图4所示,对照组的优势腐败菌细胞表面均完整光滑,且具有较好的饱满度,相比较于对照组(浓度为0),不同浓度的GML微乳液作用于S.baltica、P.brenneri和混合菌时,会观察到其细胞表面会由最开始的光滑状态逐渐转变为表面有粗糙感,继而出现不同程度的褶皱收缩,细胞之间也出现了一定的黏连,这表明GML微乳液可改变优势腐败菌原有的形态。结合前面蛋白质、核酸泄露量的实验结果,可得出GML微乳液引起的优势腐败菌细胞形态破坏可能与蛋白质、核酸的泄漏密切相关。这也在李妍萍等[17]的研究中得到了证实。对同一优势腐败菌,GML微乳液浓度越高,其细胞形态破坏程度越严重,且S.baltica、P.brenneri共存时,GML微乳液造成的细胞形态改变程度会比两者单独存在时更加严重,这与前面蛋白质、核酸泄漏量的变化趋势结果保持一致。上述现象的产生可能是由于S. baltica和P. brenneri在共存状态下,其生长代谢过程中存在物质利用和代谢产物的交互作用。这种相互作用导致物质跨膜运输时对细胞膜产生更大的压力和胁迫。当GML微乳液作用于这种共存的优势腐败菌体系时,其与细胞膜成分的相互作用被进一步强化,从而更快速地渗透进入细胞内部,表现出更强的细胞破坏能力。综上所述,高浓度的GML微乳液会通过改变优势腐败菌细胞膜渗透性,引起优势腐败菌细胞内生长代谢必需物质(蛋白质、核酸)向胞外释放,导致其正常的细胞形态遭到不可逆破坏,实现良好的抑菌效果。

a-S.baltica菌悬液;b-P.brenneri菌悬液;c-混合菌悬液
图4 不同浓度GML微乳液对单一/混合优势腐败菌细胞形态的影响
Fig.4 Effect of different concentrations of GML microemulsion on cellular morphology of single/mixed SSOs
2.1.4 胞外蛋白酶活性抑制效果
微生物繁殖代谢过程中分泌的胞外蛋白酶可将水产品中本身富含的蛋白质、多糖等生物聚合物逐渐降解成为小分子物质,这些小分子物质又可满足微生物繁殖的营养所需,引起水产品腐败变质[21]。因此,胞外蛋白酶活性在一定程度上可反映腐败菌的致腐潜能。如表2所示,GML微乳液对优势腐败菌S.baltica、P.brenneri和混合菌悬液胞外蛋白酶的抑制率会随着其浓度的增加而显著增大,尤其是混合菌的变化更加突出。这表明2种优势腐败菌处于共存状态时,GML微乳液通过抑制胞外蛋白酶的活性具有更强的抑菌效果。这可能与相关蛋白质合成受阻有一定的关联性。具体地,当GML微乳液质量浓度为1.5 mg/mL,混合菌的胞外蛋白酶抑制率可达71.92%,而S.baltica、P.brenneri相对较低,分别为65.4%、62.63%。这表明高浓度GML微乳液可显著抑制优势腐败菌分泌胞外蛋白酶。同时,抑菌圈直径的改变也可衡量GML微乳液对优势腐败菌的抑制效果,从表2中发现,增大GML微乳液浓度,可显著降低优势腐败菌的抑菌圈直径,且影响排名依次为:混合菌>S.baltica>P.brenneri。综上所述,GML微乳液可通过抑制胞外蛋白酶的分泌,从而起到抑菌的效果。
表2 不同浓度GML微乳液对单一/混合优势腐败菌胞外蛋白酶活性抑制效果的影响
Table 2 Effect of different concentrations of GML microemulsion on the inhibition effect of extracellular protease activities of single/mixed SSOs
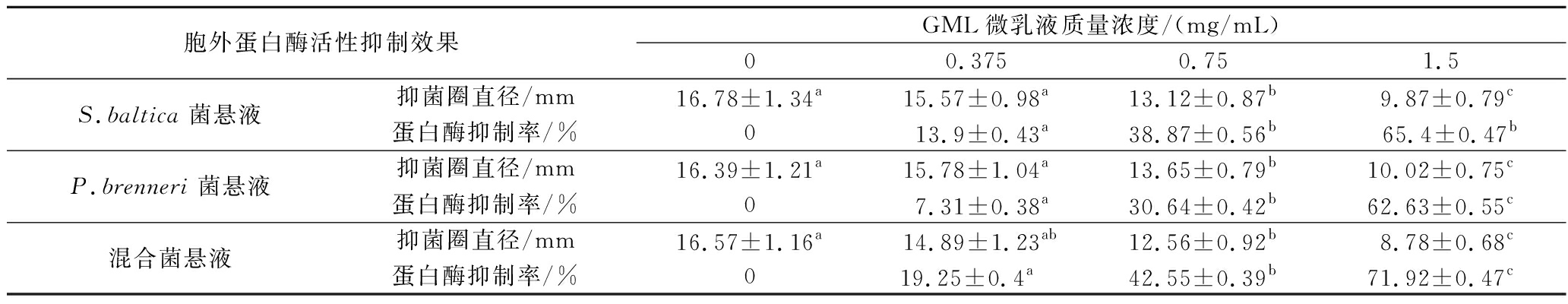
胞外蛋白酶活性抑制效果GML微乳液质量浓度/(mg/mL)00.3750.751.5S.baltica菌悬液抑菌圈直径/mm16.78±1.34a15.57±0.98a13.12±0.87b9.87±0.79c蛋白酶抑制率/%013.9±0.43a38.87±0.56b65.4±0.47bP.brenneri菌悬液抑菌圈直径/mm16.39±1.21a15.78±1.04a13.65±0.79b10.02±0.75c蛋白酶抑制率/%07.31±0.38a30.64±0.42b62.63±0.55c混合菌悬液抑菌圈直径/mm16.57±1.16a14.89±1.23ab12.56±0.92b8.78±0.68c蛋白酶抑制率/%019.25±0.4a 42.55±0.39b71.92±0.47c
注:同行不同小写字母表示存在显著差异(P<0.05)。
2.1.5 胞外碱性磷酸酶活性
碱性磷酸酶活性可反映微生物细胞壁结构的完整性。如图5所示,随着GML微乳液浓度的增加,S.baltica、P.brenneri的碱性磷酸酶活性均呈现出逐渐增加的变化趋势,这可能是因为高浓度GML微乳液可通过抑制碱性磷酸酶活性从细胞中的释放而降低细胞壁结构的破坏程度。目前已有研究证实:GML的抑菌特性与其本身具有的疏水性密切相关,这使得其可通过细胞壁与细胞膜结构相结合,进而影响菌体正常代谢[20]。如此看来,GML微乳液的疏水性与其细胞壁中胞外碱性磷酸酶活性有一定关联性,从而进一步影响其与细胞膜的相互作用。很明显,GML微乳液对S.baltica碱性磷酸酶活性的影响程度大于P.brenneri,这表明GML微乳液对S.baltica细胞壁结构的破坏程度更强,且当2种优势腐败菌共存时,GML微乳液对碱性磷酸酶活性的影响会更加突出。出现这样的现象,有可能是因为2种优势腐败菌细胞表面存在一定的结构差异性,当GML微乳液与混合菌悬液共存时,可能增强GML微乳液与2种优势菌细胞间相互作用,进而加剧了细胞壁结构破坏。值得注意的是,P.brenneri碱性磷酸酶活性对GML微乳液的浓度变化会比S.baltica更加敏感。
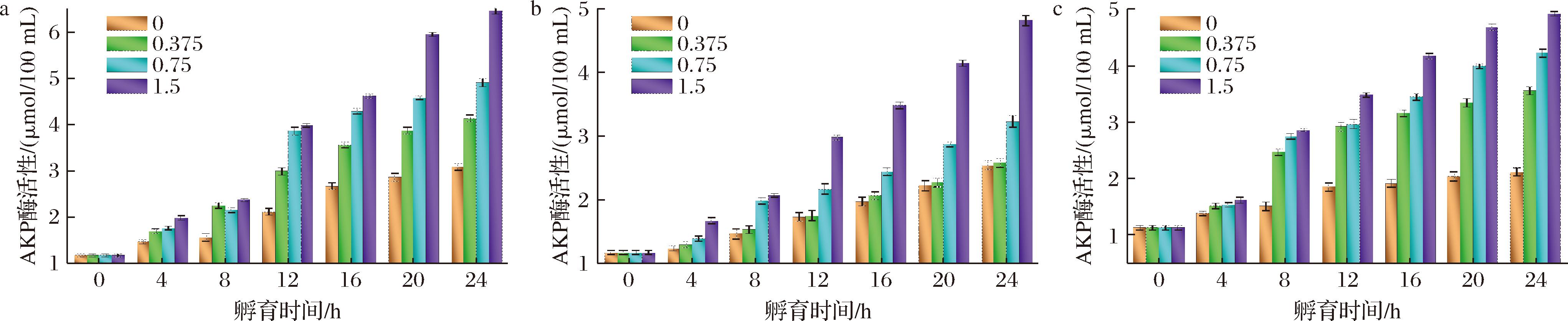
a-S.baltica菌悬液;b-P.brenneri菌悬液;c-混合菌悬液
图5 不同浓度GML微乳液对单一/混合优势腐败菌AKP酶活性的影响
Fig.5 Effect of different concentrations of GML microemulsion on AKPase activity of single/mixed SSOs
2.2 体内抑菌效果
2.2.1 菌落总数
图6显示了高质量浓度(1.5 mg/mL)GML微乳液对不同优势腐败菌接种模式下的大黄鱼块菌落总数变化情况,接种优势腐败菌的大黄鱼块初始菌落总数维持在3.1 lg CFU/g左右,这表明了优势腐败菌接种处理方法的有效性与准确性。随着贮藏时间的延长,在贮藏前9 d内,不同接种模式下的大黄鱼块菌落总数无显著性差异(P>0.05),随后,SB+PB组的增长速率明显滞后于SB、PB组,到贮藏21 d,SB+PB组菌落总数仅为6.28 lg CFU/g,而SB、PB组分别可达到7.77、8.49 lg CFU/g,这表明GML微乳液对混合接种优势腐败菌模式下的大黄鱼块具有更明显的抑菌效果。这与前面体外孵育中抑菌活性的实验结果保持一致,也同样证明了GML微乳液对2种优势菌的繁殖具有协同效应。这有可能是因为混合接种模式下的优势腐败菌代谢间存在紧密的互作关系,GML微乳液可影响两者间的互作关系而具有更好的抑菌效果。对于单一接种模式下的冷藏大黄鱼块,贮藏相同时间,会发现S.baltica的菌落总数会低于P.brenneri,这可能是因为S.baltica会对高浓度的GML微乳液更加敏感。这与前面体外抑菌实验中抑菌圈直径、减菌效果的结果保持一致。不过,考虑到大黄鱼与其他水产品类似,实际贮藏期间的微生物菌群是一个极其复杂且多样性的体系,且贮藏期间会经历特定的菌落演替,因此,基于多种腐败菌共存的冷藏大黄鱼块采用1.5 mg/mL GML微乳液是否还能实现优良的抑菌效果以及可能的抑菌机理还值得进一步研究。
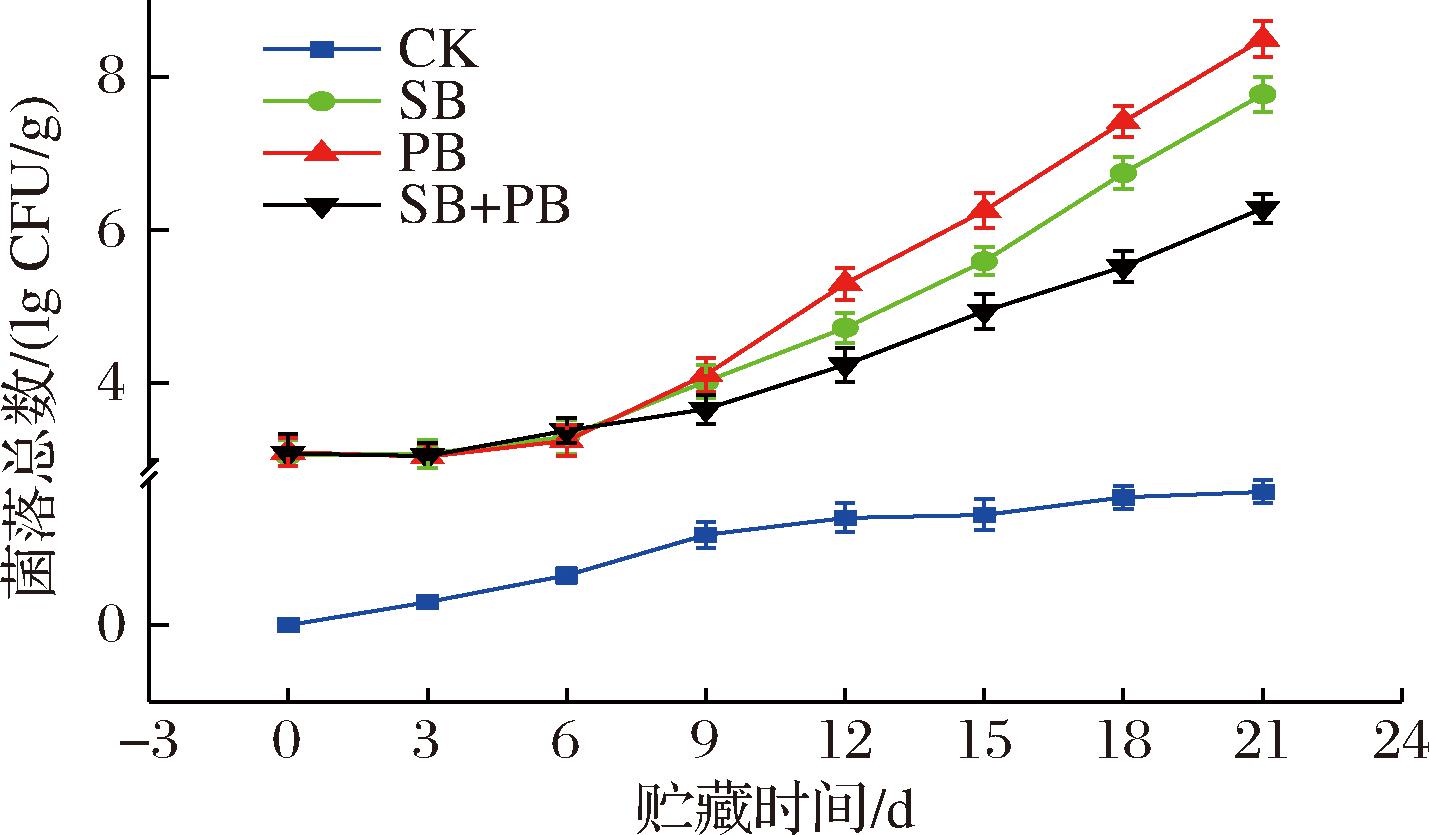
图6 不同优势腐败菌接种模式下的冷藏大黄鱼块菌落总数变化
Fig.6 Changes in TVC of chilled large yellow croaker blocks treated with different inoculation patterns of SSOs
2.2.2 感官特性
作为冷藏大黄鱼块品质特性的综合评价指标,高浓度GML微乳液对不同优势腐败菌接种模式下的感官得分的影响可用来评估其用于延缓优势腐败菌引起的冷藏大黄鱼块腐败变质的有效性。如图7所示,冷藏大黄鱼块的初始感官得分可达9.12,优势腐败菌接种组的大黄鱼感官得分从贮藏第2天开始就经历了持续性的下降,直至贮藏末期。这也反映了高浓度GML微乳液仅是在一定程度上延缓冷藏大黄鱼的腐败变质,但并不能阻止其品质劣变进程。对于不同接种模式,会发现:PB组的感官得分下降速率最快,SB组次之,SB+PB组相对迟缓,且SB+PB组在贮藏9 d后与SB组、PB组表现出显著性差异(P<0.05),这表明高浓度GML微乳液延缓优势腐败菌引起的冷藏大黄鱼腐败变质具有积极的效果,尤其是对优势腐败菌混合存在状态下的大黄鱼更有优势,这种优势在贮藏中后期尤其凸显。结合前面菌落总数的研究结果,GML微乳液可通过抑制大黄鱼贮藏期间微生物的繁殖,尤其是对2种优势腐败菌混合接种模式下的菌落总数影响更为明显,从而更好地延缓品质劣变进程。当然,蛋白质、脂质等作为微生物繁殖代谢的必需物质,GML微乳液的添加可减慢大黄鱼中大分子营养物质的代谢也是延缓感官劣变的又一大原因。
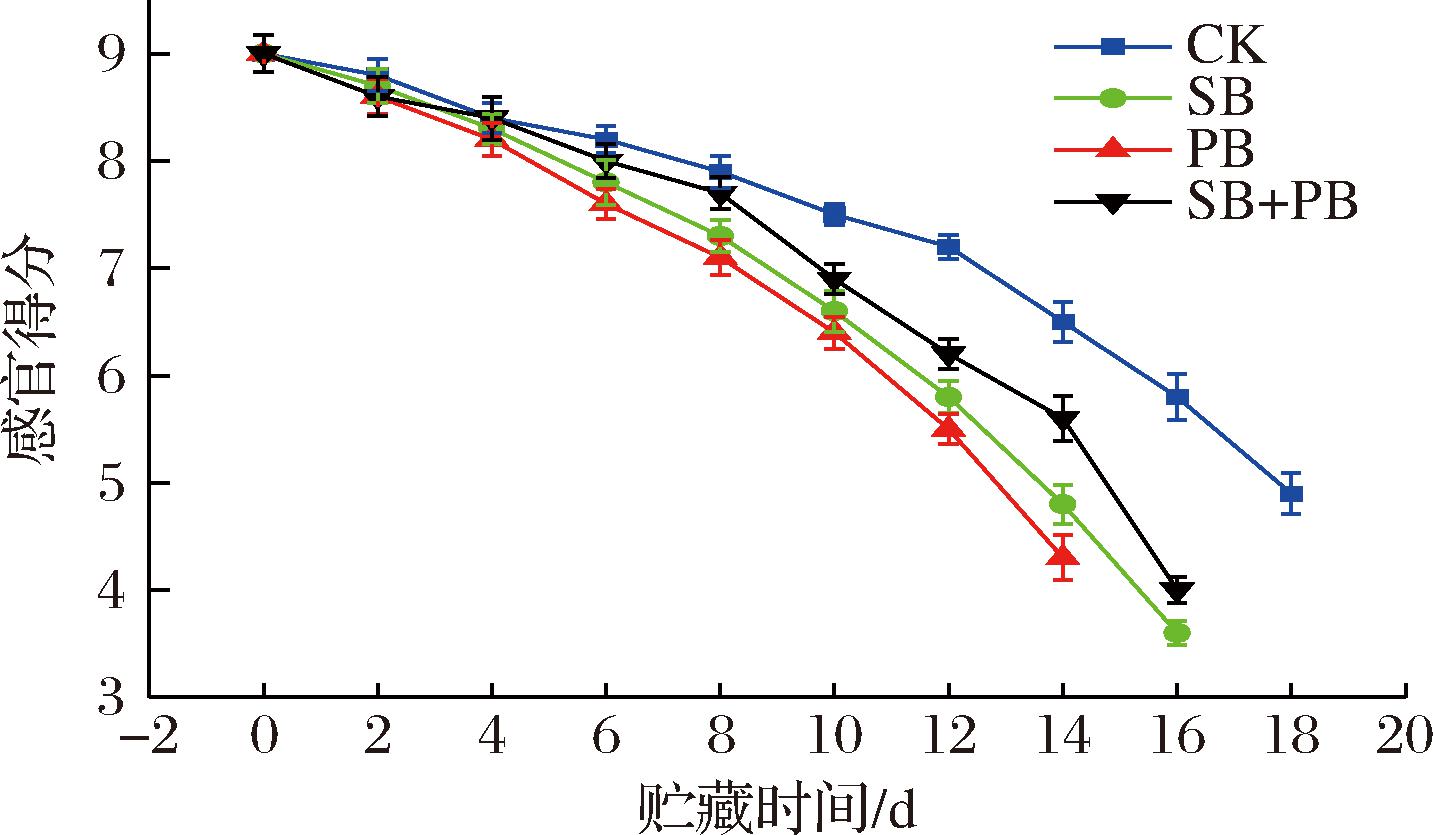
图7 不同优势腐败菌接种模式下的冷藏大黄鱼块感官得分变化
Fig.7 Changes in sensory score of chilled large yellow croaker blocks treated with different inoculation patterns of SSOs
2.2.3 氨基酸脱氨脱羧活性
氨含量、氨基酸脱羧酶活性可表征水产品贮藏期间游离氨基酸的脱氨脱羧作用[22],优势腐败菌极易引起水产品腐败变质的主要原因就在于其具有强烈的脱氨脱羧作用[23]。如图8所示,除CK组外,优势腐败菌接种组的冷藏大黄鱼块氨含量、氨基酸脱羧酶活性变化趋势具有一致性:氨含量在贮藏期间很长时间内均保持了快速增加的变化趋势,在贮藏后期会有略微的降低。与氨含量变化趋势不同,氨基酸脱羧酶活性在整个贮藏期间持续性增加。现有研究证明:游离氨是氨基酸脱氨作用的重要产物,而氨基酸脱羧作用需要氨基酸脱氨酶的参与[23]。因此,氨含量、氨基酸脱羧酶活性可分别作为衡量氨基酸脱氨活性、脱羧活性的重要指标。根据氨含量、氨基酸脱羧酶活性的变化趋势,可得出:冷藏大黄鱼在贮藏前期氨基酸脱氨作用明显,随着贮藏时间的延长,氨基酸脱羧活性迅速提升,甚至强于脱氨作用。对于不同的接种模式,可发现:SB+PB组的氨含量、氨基酸脱羧酶活性变化速率会比SB、PB组低。上述实验结果表明:1.5 mg/mL GML微乳液对延缓优势腐败菌混合接种模式下的冷藏大黄鱼块氨基酸脱氨脱羧作用效果比单一接种模式会更加突出。事实上,水产品贮藏期间肌肉蛋白劣变会经历以下3阶段:1)蛋白质进行不同程度的水解,释放肽、游离氨基酸;2)由氨基酸产生生物胺,主要包括尸胺、腐胺、组胺等;3)氨、有机酸类、挥发性有机物的积累,即氨基酸脱氨作用。上述3个阶段会涉及大量的中间代谢产物,部分小分子中间产物可被2种优势腐败菌共同利用,这会使混合接种模式下的大黄鱼优势腐败菌本身繁殖代谢比单一接种模式下更为剧烈,致腐能力更强。那么,相比较于单一优势腐败菌接种模式,GML微乳液的添加会通过干扰2种优势腐败菌对中间代谢产物的利用而影响肌肉蛋白劣变进程,进而表现出更好的保鲜效果。考虑到优势腐败菌的致腐潜能与氨基酸脱氨脱羧作用密切相关,因此,高浓度GML微乳液减缓优势腐败菌引起的大黄鱼块腐败变质与降低氨基酸脱氨脱羧活性、延缓肌肉蛋白劣变进程具有紧密关联性。另外,高浓度GML微乳液很有可能通过干扰2种优势腐败菌对中间代谢小分子产物的利用而表现出抑菌特性的增效作用。
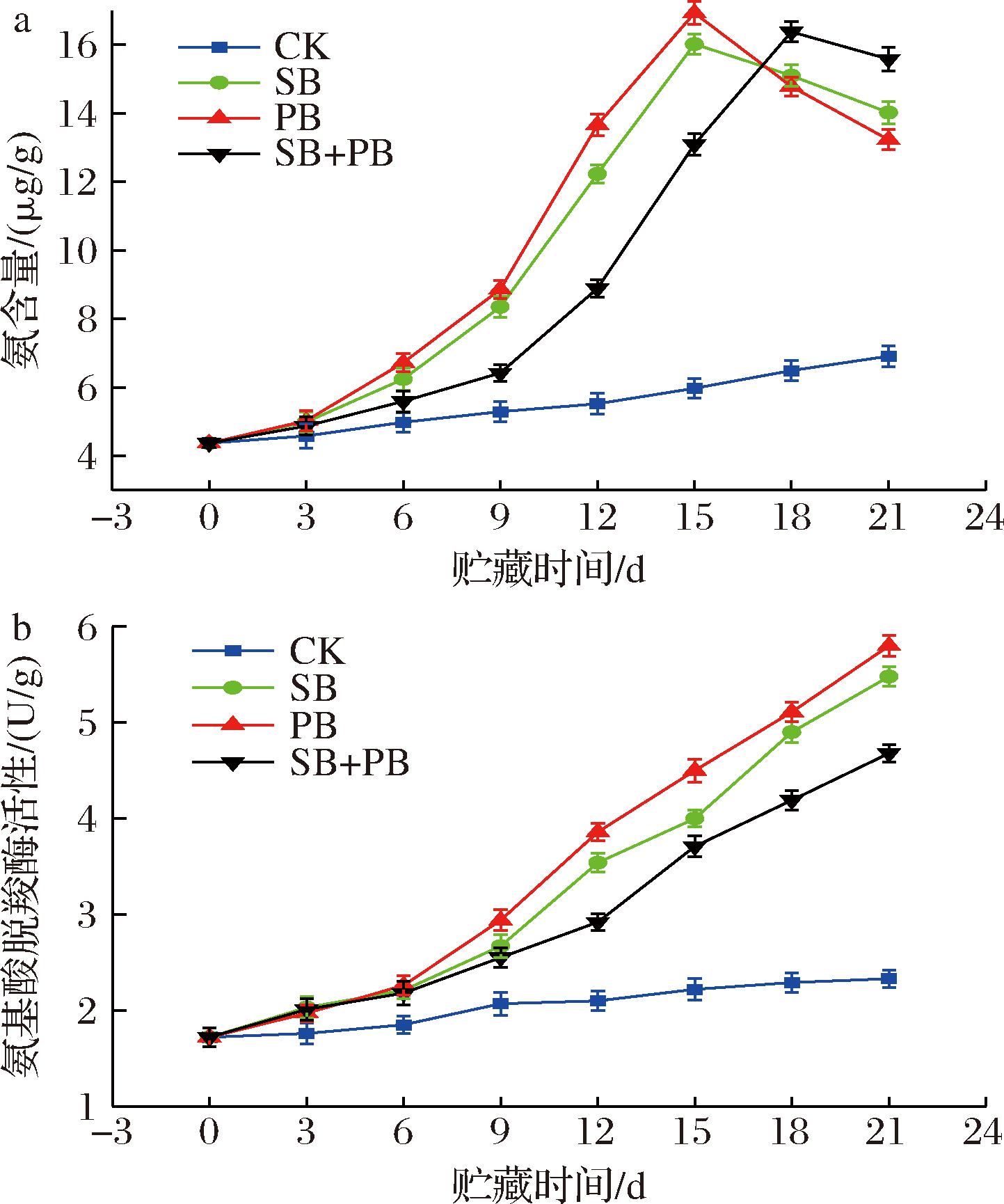
a-氨含量;b-氨基酸脱羧酶活性
图8 不同优势腐败菌接种模式下的冷藏大黄鱼块氨基酸脱氨脱羧活性变化
Fig.8 Changes in amino acid deamination and decarboxylation activities of chilled large yellow croaker blocks treated with different inoculation patterns of SSOs
2.2.4 TCA-可溶性肽含量
TCA-可溶性肽含量可用来衡量水产品贮藏期间因内源性蛋白酶或微生物分泌的胞外蛋白酶对肌肉蛋白质的水解作用[24]。如图9所示,TCA-可溶性肽含量呈现出逐渐增加的变化趋势,在优势腐败菌接种组中,从贮藏6 d开始,各组间就表现出显著性差异(P<0.05),其中SB+PB组的增长速度明显滞后于SB、PB组,相比较于TCA-可溶性肽含量初始值(0.71 μmol/g),贮藏末期,SB+PB组的TCA-可溶性肽含量增加了51.7%,而SB、PB组分别增加了55.63%、59.89%,这表明高浓度GML微乳液对延缓混合接种模式下的优势腐败菌引起的冷藏大黄鱼块蛋白质降解具有更加突出的优势。这与前面氨含量、氨基酸脱羧酶活性的实验结果保持一致。分析其原因,GML微乳液对于抑制混合优势腐败菌引起的氨基酸脱氨脱羧作用具有重要作用。对于单一接种模式,GML微乳液对S.baltica引起的大黄鱼蛋白质降解比P.brenneri明显,这可能是因为GML微乳液对S.baltica细胞膜的相关成分作用力比P.brenneri更为敏感。综上所述,高浓度GML微乳液可通过减慢蛋白质水解速率而实现延缓优势腐败菌引起的冷藏大黄鱼块的腐败变质进程,且对混合优势腐败菌引起的冷藏大黄鱼品质劣变更加明显。因肌肉蛋白质降解过程中会首先经历蛋白质的部分或完全水解,产生小肽类物质和游离氨基酸,游离氨基酸可进一步经微生物脱氨脱羧作用转化为其他小分子含氮类物质[25]。上面氨含量、氨基酸脱羧酶活性的结果已经证实了高浓度GML微乳液对延缓氨基酸脱氨脱羧的优势。结合TCA-可溶性肽含量的实验结果,更加有力地说明高浓度GML微乳液可通过减慢肌肉蛋白质的劣变进程(包括蛋白质水解、氨基酸脱氨脱羧作用)来实现延缓优势腐败菌导致的冷藏大黄鱼块腐败变质。
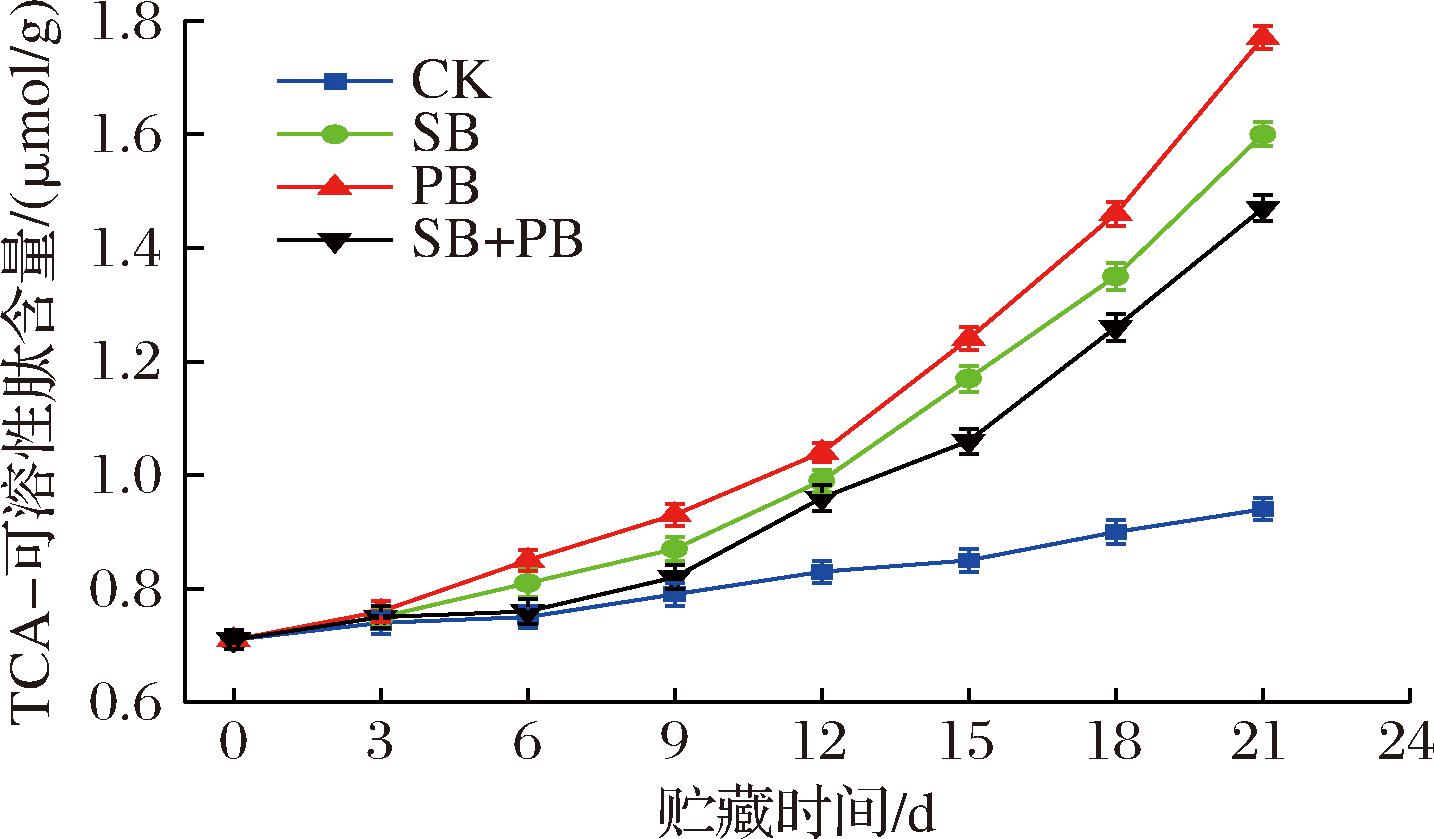
图9 不同优势腐败菌接种模式下的冷藏大黄鱼块TCA-可溶性肽含量变化
Fig.9 Changes in TCA-soluble peptides content of chilled large yellow croaker blocks treated with different inoculation patterns of SSOs
2.2.5 SDS-PAGE
SDS-PAGE图谱显示了高浓度GML微乳液对不同优势腐败菌接种模式下的大黄鱼块肌原纤维蛋白降解情况,如图10所示。观察到随着贮藏时间的延长,肌球蛋白重链(220 kDa)、肌动蛋白(45 kDa)、基础型肌球蛋白轻链MLC-1(22 kDa)发生了降解,但调节型肌球蛋白轻链(18 kDa)的降解并不明显。对于不同优势腐败菌接种模式下的冷藏大黄鱼肌原纤维蛋白,可发现:在相同的贮藏时间,SB+PB组的肌球蛋白重链、肌动蛋白和基础型肌球蛋白轻链降解程度最明显,SB次之,PB组降解程度相对较弱,这表明高浓度GML微乳液S.baltica引起的大黄鱼肌原纤维蛋白蛋白质降解程度比P.brenneri明显,且对这2种优势腐败菌混合接种模式下的肌原纤维蛋白降解程度比单一接种形式下更加明显。肌原纤维蛋白本身作为肌肉蛋白的重要组成部分,在本研究中不同接种模式下出现的不同程度降解也进一步证实了高浓度GML微乳液可通过减慢肌肉蛋白质的劣变进程来实现延缓优势腐败菌导致的冷藏大黄鱼块腐败变质的结果,且对混合优势腐败菌存在的冷藏大黄鱼品质特性劣变影响更为明显。
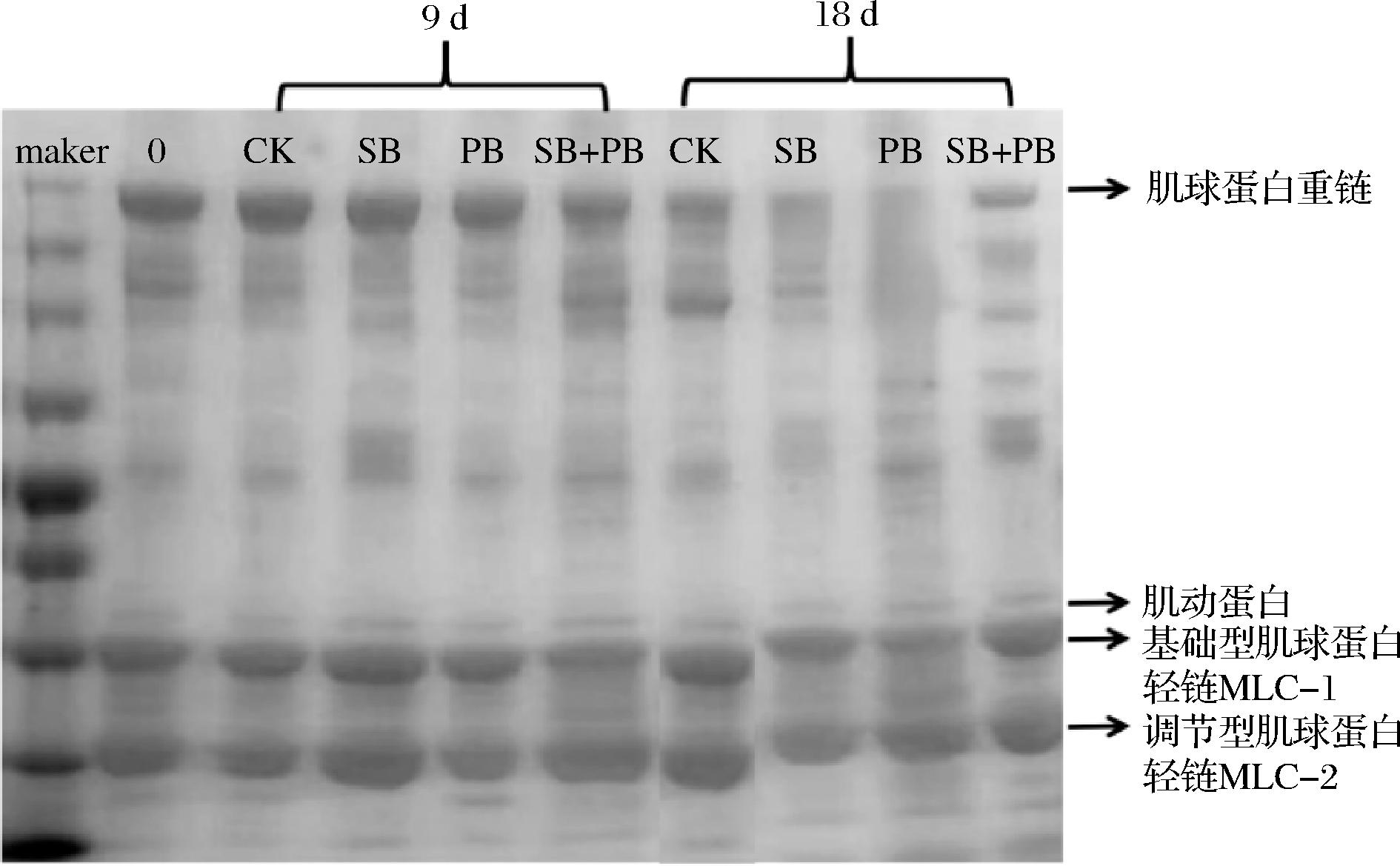
图10 不同优势腐败菌接种模式下的冷藏大黄鱼肌原纤维蛋白SDS-PAGE图谱
Fig.10 SDS-PAGE pattern of myofibril proteins of chilled large yellow croaker blocks treated with different inoculation patterns of SSOs
3 结论
本研究采用GML微乳液延缓优势腐败菌引起的大黄鱼腐败变质,在体外考察不同浓度GML微乳液对不同优势腐败菌抑菌特性的基础上,进一步将GML微乳液处理经不同优势腐败菌接种的大黄鱼块,通过体外抑菌孵育实验、体内抑菌效果的研究,结果表明,1.5 mg/mL GML微乳液表现出最优的抑菌效果,其通过破坏优势腐败菌菌体细胞壁/膜结构完整性,导致胞内蛋白质和核酸外泄,实现对菌体形态的不可逆损伤。值得注意的是,GML微乳液对混合优势腐败菌的抑制效果显著优于单一菌种,这可能源于其对生物被膜形成的干扰及对菌群互作网络的破坏。菌种敏感性分析显示,S. baltica对GML的敏感性显著高于P. brenneri,这可能与其细胞膜结构和组成更易与GML微乳液发生相互作用有关。相比较于单一优势腐败菌接种模式下,1.5 mg/mL GML微乳液明显延缓优势腐败菌混合接种模式下的大黄鱼块品质劣变,减缓菌落总数增加、感官特性劣变、氨含量和氨基酸脱羧酶活性改变及肌原纤维蛋白的降解,TCA-可溶性肽含量增加速率也会变缓,表现出良好的保鲜效果。综合看,本研究得出1.5 mg/mL GML微乳液对冷藏大黄鱼肌肉蛋白水解、氨基酸脱氨脱羧作用的影响明显,而蛋白水解、氨基酸脱氨脱羧正是优势腐败菌具有强致腐潜能的重要缘由。因此,GML微乳液可通过减慢冷藏大黄鱼肌肉蛋白质的劣变进程来延缓优势腐败菌导致的大黄鱼腐败变质。同时,GML微乳液对混合优势腐败菌存在的冷藏大黄鱼品质劣变影响更为明显。大黄鱼在混合优势腐败菌接种模式时,GML微乳液的添加很有可能通过干扰2种优势腐败菌对中间代谢产物的利用而影响肌肉蛋白劣变进程,从而具有更好的保鲜效果。
[1] CHEN Y S, NING Q, WANG S N, et al.Effects of cold treatments on lipidomics profiles of large yellow croaker (Larimichthys crocea) fillets by UPLC-Q-Exactive Orbitrap MS analysis[J].Journal of Food Composition and Analysis, 2022, 109:104481.
[2] FU L L, WANG C, RUAN X M, et al.Preservation of large yellow croaker (Pseudosciaena crocea) by Coagulin L1208, a novel bacteriocin produced by Bacillus coagulans L1208[J].International Journal of Food Microbiology, 2018, 266:60-68.
[3] WANG Y B, BAO X Y, WANG F F, et al.Dynamic detection of biogenic amines as a quality indicator and their relationship with free amino acids profiles in large yellow croaker (Pseudosciaena crocea)[J].Journal of Food Science, 2019, 84(2):254-260.
[4] LI Y, JIA S L, HONG H, et al.Assessment of bacterial contributions to the biochemical changes of chill-stored blunt snout bream (Megalobrama amblycephala) fillets:Protein degradation and volatile organic compounds accumulation[J].Food Microbiology, 2020, 91:103495.
[5] YI Z K, XIE J.Assessment of spoilage potential and amino acids deamination &decarboxylation activities of Shewanella putrefaciens in bigeye tuna (Thunnus obesus)[J].LWT, 2022, 156:113016.
[6] ZHUANG S, LIU X C, LI Y, et al.Biochemical changes and amino acid deamination &decarboxylation activities of spoilage microbiota in chill-stored grass carp (Ctenopharyngodon idella) fillets[J].Food Chemistry, 2021, 336:127683.
[7] KUULIALA L, AL HAGE Y, IOANNIDIS A G, et al.Microbiological, chemical and sensory spoilage analysis of raw Atlantic cod (Gadus morhua) stored under modified atmospheres[J].Food Microbiology, 2018, 70:232-244.
[8] YU D W, JIANG Q X, XU Y S, et al.The shelf life extension of refrigerated grass carp (Ctenopharyngodon idellus) fillets by chitosan coating combined with glycerol monolaurate[J].International Journal of Biological Macromolecules, 2017, 101:448-454.
[9] WANG B, ZHANG J W, CHITRAKAR B, et al.Preservation of duck eggs through glycerol monolaurate nanoemulsion coating[J].Current Research in Food Science, 2021, 4:752-757.
[10] 宋飞, 张希, 李想, 等.单甘油月桂酸酯及其复合保鲜剂对冷鲜肉保鲜效果的研究[J].食品工业科技, 2012, 33(15):341-344.SONG F, ZHANG X, LI X, et al.Study on the effect of glycerol monolaurate and complex preservative on the preservation of chilled pork[J].Science and Technology of Food Industry, 2012, 33(15):341-344.
[11] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control, 2016, 59:282-289.
[12] ZHU Z Y, YANG L Z, YU P, et al.Comparative proteomics and secretomics revealed virulence and antibiotic resistance-associated factors in Vibrio parahaemolyticus recovered from commonly consumed aquatic products[J].Frontiers in Microbiology, 2020, 11:1453.
[13] SAENGSUK N, LAOHAKUNJIT N, SANPORKHA P, et al.Physicochemical characteristics and textural parameters of restructured pork steaks hydrolysed with bromelain[J].Food Chemistry, 2021, 361:130079.
[14] TAN M T, YE J X, CHU Y M, et al.The effects of ice crystal on water properties and protein stability of large yellow croaker (Pseudosciaena crocea)[J].International Journal of Refrigeration, 2021, 130:242-252.
[15] 张嵩. 三聚甘油单月桂酸酯的酶法合成、广谱抗菌活性及其作用机制研究[D].广州:华南理工大学, 2020.ZHANG S.The Study on enzymatic synthesis, broad-spectrum antibacterial activity of triglycerol monolaurate and its action mechanism[D].Guangzhou:South China University of Technology, 2020.
[16] 葛阳杨. 大黄鱼源三种优势腐败菌致腐表型及其菌群互作效应研究[D].杭州:浙江工商大学, 2016.GE Y Y.Evaluation of spoilage potential and the interactions of three spoilage bacteria isolated from spoiled large yellow croaker[D].Hangzhou:Zhejiang Gongshang University, 2016.
[17] 李妍萍, 孙恒, 杨林狄, 等.月桂酸单甘油酯对珍珠龙胆石斑鱼源海豚链球菌体外抑菌活性及其作用机制[J].广东海洋大学学报, 2024, 44(5):22-30.LI Y P, SUN H, YANG L D, et al.In vitro antibacterial activity and mechanism of glycerol monolaurate against Streptococcus iniae isolated from pearl gentian grouper[J].Journal of Guangdong Ocean University, 2024, 44(5):22-30.
[18] VETTER S M, SCHLIEVERT P M.Glycerol monolaurate inhibits virulence factor production in Bacillus anthracis[J].Antimicrobial Agents and Chemotherapy, 2005, 49(4):1302-1305.
[19] SCHLIEVERT P M, PETERSON M L.Glycerol monolaurate antibacterial activity in broth and biofilm cultures[J].PLoS One, 2012, 7(7):e40350.
[20] SUN X H, ZHOU T T, WEI C H, et al.Antibacterial effect and mechanism of anthocyanin rich Chinese wild blueberry extract on various foodborne pathogens[J].Food Control, 2018, 94:155-161.
[21] WICKRAMASINGHE N N, RAVENSDALE J, COOREY R, et al.Transcriptional profiling of biofilms formed on chilled beef by psychrotrophic meat spoilage bacterium, Pseudomonas fragi 1793[J].Biofilm, 2021, 3:100045.
[22] ZHUANG S, TIAN L, LIU Y Y, et al.Amino acid degradation and related quality changes caused by common spoilage bacteria in chill-stored grass carp (Ctenopharyngodon idella)[J].Food Chemistry, 2023, 399:133989.
[23] ZHUANG S, TAN Y Q, HONG H, et al.Exploration of the roles of spoilage bacteria in degrading grass carp proteins during chilled storage:A combined metagenomic and metabolomic approach[J].Food Research International, 2022, 152:110926.
[24] 庄文静, 包建强, 郑稳, 等.微冻和冰藏期间大菱鲆鲜度及组织结构的变化规律[J].食品与发酵工业, 2024, 50(10):220-229.ZHUANG W J, BAO J Q, ZHENG W, et al.Changes law of freshness and microstructure of turbot during superchilling and ice storage[J].Food and Fermentation Industries, 2024, 50(10):220-229.
[25] XIANG Y, SUN C F, ZHAO Y Q, et al.Label-free proteomic analysis reveals freshness-related proteins in sea bass (Lateolabrax japonicus) fillets stored on ice[J].LWT, 2022, 155:112885.