人体由于环境或机体生理原因导致组织细胞不能充分获得氧气时(如:高空、井下、水底、商场、会议室、雾霾等环境,及人体呼吸系统、循环系统出现故障时),缺氧耐受力强具有重要意义。人体如果缺氧会出现头晕、耳鸣等不适,与在海拔几千米高原地区的低氧反应一样,非常难受,严重缺氧情况下可能还会导致心慌气短、呼吸困难,甚至死亡。提高身体缺氧耐受力可以帮助机体更好地应对缺氧环境,保护身体器官和组织的安全。相比于化学合成药物,天然物质因其不良反应小等特点较为突出,成为抗缺氧研究较为关注的内容。近年来国内外研究表明,中药(包括红景天、刺五加、人参、菟丝子、三七、党参)的单体活性成分及混合成分,及藏萝卜等众多天然活性物质在细胞、小鼠、大鼠等模型上均表现出一定的抗缺氧活性[1-2]。因此,研究开发提高缺氧耐受力的食品及其功能,借以避免或减轻人体缺氧的发生,满足人们的健康需求,具有十分重要的意义。
在“健康中国 2030”的国家重大战略的背景下,粮食精准营养与健康谷物食品的研究与开发是我国新时代的新使命,聚焦基于食品功能因子靶向传递的精准营养研究有重要意义。麦胚作为“功能性食品”的代表,富含多种优质蛋白、矿物质、维生素等生物活性物质,素有“生命之源”和“人类天然营养宝库”的美称。近年来,因微生物发酵麦胚提取物具有天然、安全、易接受,并可能产生新的健康益处而受到广泛关注[3-5]。经乳酸菌等菌株的生物发酵提高了麦胚中小肽,如谷胱甘肽(glutathione,GSH),氨基酸,如γ-氨基丁酸(γ-aminobutyric acid,GABA)等生物活性物质水平,使其抗氧化活性、抗菌能力等也得到了有效提升,已被批准为功能性膳食食品,在保健食品、营养补充剂等领域得到了广泛的应用[6-7],另有研究发现,麦胚肽可有效提高大鼠一次性力竭运动能力,具有抗疲劳效果,提高常压耐缺氧能力,及时清除骨骼肌自由基,减轻肠道和血液炎症反应[8]。因此,利用乳酸菌发酵麦胚开发具有精准营养的健康谷物制品潜力巨大,符合“健康中国”的战略定位。
课题组前期研究证实功能性乳酸菌膳食干预在改善肠道微生态环境异常的同时,对脂质过氧化等抗氧化相关指标的异常也发挥了潜在的抑制能力。目前,已有证据表明,改善肠道微生态环境中短链脂肪酸水平可提高缺氧耐受力[9-10],但缺氧耐受力的提高与肠道微生态环境的双向交流机制方面的研究仍十分有限。因此,进一步拓展缺氧耐受力与肠道微生态环境作用关系的研究,也是目前仍待解决的科学问题。果蝇作为十分活跃的模型生物,涉及遗传学的研究,发育基因调控的研究,各类神经疾病的研究,帕金森氏病、老年痴呆症、药物成瘾和酒精中毒、衰老与长寿、学习记忆与某些认知行为的研究等多个方面[11]。本文将在已有的研究基础上,进一步挖掘优良功能性乳酸菌菌株,以果蝇为模式动物,开发靶向提高体内缺氧耐受力的功能性食品,深入解析乳酸菌发酵麦胚提取物提高体内缺氧耐受力的作用效果及其潜在机制,具有重要的理论意义和应用价值。
1 材料与方法
1.1 材料与试剂
自然发酵酸菜,采集自黑龙江省肇东市;新鲜小麦胚芽,安阳漫天雪食品制造有限公司;抗氧化相关检测试剂盒、生工生物工程(上海)股份有限公司;MRS培养基、北京陆桥技术股份有限公司;Canton-S野生型红眼黑腹果蝇,哈尔滨工业大学生命学院KIM实验室。
1.2 仪器与设备
DL-CJ-2ND超净工作台,北京东联哈尔仪器制造有限公司;TGL-16离心机,上海医疗器械六厂;UV-1240分光光度计,上海仪电分析仪器有限公司;SN-RGX-350B人工气候培养箱,上海尚普仪器设备有限公司;UItiMate-3000 UPLC、Q-Exactive plus质谱仪,美国Thermo公司。
1.3 实验方法
1.3.1 乳酸菌发酵麦胚实验
取100 g优质小麦胚芽,按料液比1∶10(g∶mL)放入水中,接种5%乳酸菌液,未接种菌液的培养组为空白对照组(B),乳酸菌发酵组(M),于37 ℃发酵时间48 h。发酵结束后离心取上清液,冻干机中冻干密封,-20 ℃保存备用。
1.3.2 果蝇实验
选择3~5日龄的雄性黑腹果蝇,采用人工气候培养箱,控制温度25 ℃,湿度60%,每天12 h光照,每隔3 d更换培养基。发酵麦胚干预15 d(每片滤纸添加500 μL发酵麦胚提取物),基础培养基中加入1.25 mg维生素C作为阳性对照,同样干预15 d,最后对模型组、发酵麦胚组和阳性对照组进行5%氧气浓度2 h处理的缺氧造膜后[12],如表1的实验设计和图1缺氧装置,将果蝇进行冷冻麻醉,分装置于-60 ℃冰箱中备用。
表1 果蝇实验分组
Table 1 Source and identification result of experimental strains
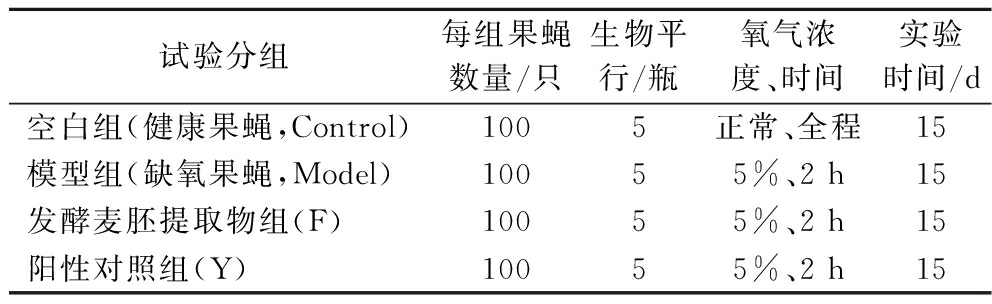
试验分组每组果蝇数量/只生物平行/瓶氧气浓度、时间实验时间/d空白组(健康果蝇,Control)1005正常、全程15模型组(缺氧果蝇,Model)10055%、2 h15发酵麦胚提取物组(F)10055%、2 h15阳性对照组(Y)10055%、2 h15
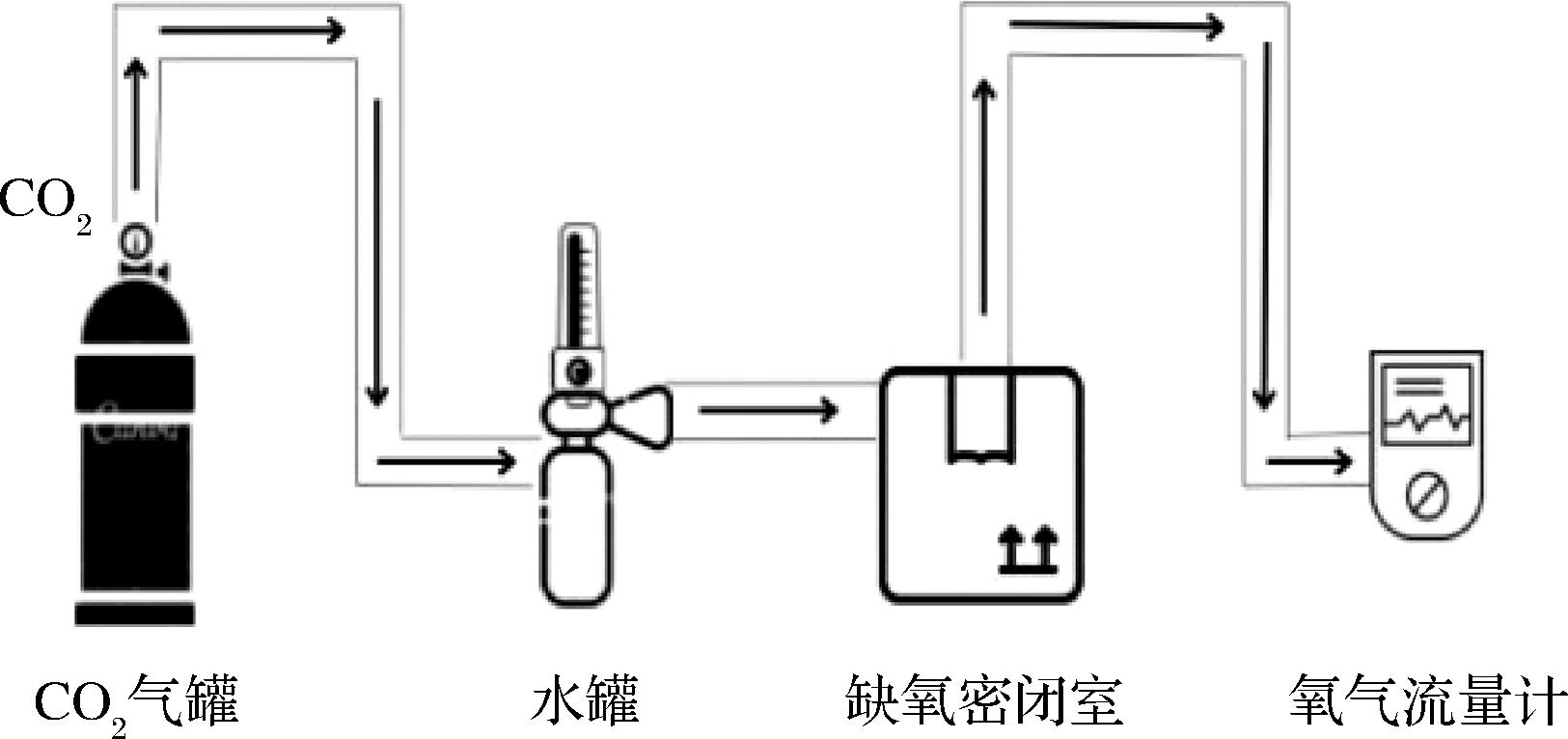
图1 缺氧装置示意图
Fig.1 Schematic diagram of hypoxia device
1.3.3 生存率和爬管行为实验
生存率实验是经过喂食和造模后,记录过程中每组死亡果蝇数量,按公式(1)计算:
生存率![]()
(1)
爬管实验是测试果蝇一般运动能力的行为学实验方法,用来评估果蝇的运动功能,研究影响果蝇行为的因素。爬管实验果蝇分为每组30只,每组包含5个重复,将实验果蝇转移至干净的玻璃管中(高20 cm,内径3.2 cm),轻拍管使所有果蝇落至底部,任果蝇爬行。统计所有果蝇在管内爬过6 cm线的时间,记录后并计算相关数据。
1.3.4 抗氧化能力检测实验
称取100 μL发酵液或者0.1 g整只果蝇,加入1 mL提取液,进行冰浴匀浆,然后10 000 r/min、4 ℃离心10 min,取上清液,置于冰上待测。采用总抗氧化能力检测试剂盒(DPPH法和ABTS法),在紫外-可见分光光度计在515 nm波长处测定吸光度,并按公式(2)计算菌株DPPH自由基清除率:
DPPH自由基清除率![]()
(2)
将ABTS阳离子自由基清除率测得的吸光度带入标准曲线,按公式(3)计算:
ABTS自由基清除率![]()
(3)
1.3.5 代谢组分析
取发酵麦胚提取物冻干粉10 mg或果蝇肠道10 mg,于400 μL 甲醇(提前-20 ℃预冷)研磨并沉淀蛋白,15 000 r/min高速离心15 min,取上清液400 μL于真空浓缩仪中进行浓缩,加入100 μL V(甲醇)∶V(水)=4∶1后涡旋30 s,15 000 r/min高速离心15 min取上清液于进样瓶中,采用UltiMate-3000 UPLC(2.1×100 mm T3色谱柱)和Q-Exactive plus质谱仪分析样品的非靶向代谢物。正离子流动相A相为含0.1%甲酸的水溶液,B相为含0.1%甲酸的乙腈;负离子:A相为5 mmol/L乙酸铵溶液,B相为乙腈。梯度洗脱:0~1.0 min,2% B;1.0~10 min,98% B;10~12 min,98% B;12~15 min,2% B。柱温35 ℃,流速0.3 mL/min,进样量1 μL。样品盘温度4 ℃。热电喷雾电离源(ESI)分别以正离子和负离子模式采集数据,全扫描范围分别为70~1 050 m/z。离子源参数设置如下:电源电压1.50 kV,毛细管温度250 ℃,ESI- 2 500 V,ESI+ 3 500 V。利用Compound Discovery 3.1软件的非靶向代谢工作流程处理质谱下机原始数据,包括数据提取、背景特征过滤、峰识别、去卷积、峰对齐和积分,与mzCloud、HMDB、KEGG 和 ChemSpider 数据库进行代谢物识别比对,数据处理滤除mzCloud 评分低于80分的物质及质控(quality control,QC)样品中出现<50%的代谢特征和QC样品中出现>30%相对标准偏差的代谢物,质量容限为10 mg/kg[13]。
1.3.6 GSH水平分析
采用四氧嘧啶检测方法对果蝇机体GSH水平进行检测[14]。
1.4 统计与分析
采用GraphPad Prism 8.0.2和R语言作图,并使用IBM SPSS Statistics 23和GraphPad Prism 8.0.2绘制95%置信区间的均数。以空白组为控制组,空白组与乳酸菌发酵组组间的差异显著性采用单因素方差分析(ANOVA),随后采用Dunnett’s多重比较检验,*P<0.05,**P<0.01,***P<0.001。实验数据均以“平均值±标准误差”表示。
2 结果与分析
2.1 乳酸菌发酵麦胚的提取物代谢组分析
对空白组和发酵麦胚组的样品进行代谢组检测,利用稀疏偏最小二乘回归分析法(Sparse partial lease square discriminant analysis,Sparse PLS-DA)分析空白组和接菌发酵组的代谢分布。如图2所示,在ESI+和ESI-模式下,不同乳酸菌发酵的代谢组之间存在自身体系的聚类,空白组与几种乳酸菌发酵麦胚提取物组的代谢组均可以很好地分离开,表明经过乳酸菌发酵的麦胚提取物的代谢组表现出了较明显的聚类,提示乳酸菌的发酵使麦胚体系发生了显著变化,且不同乳酸菌的发酵可以塑造独特的代谢体系。
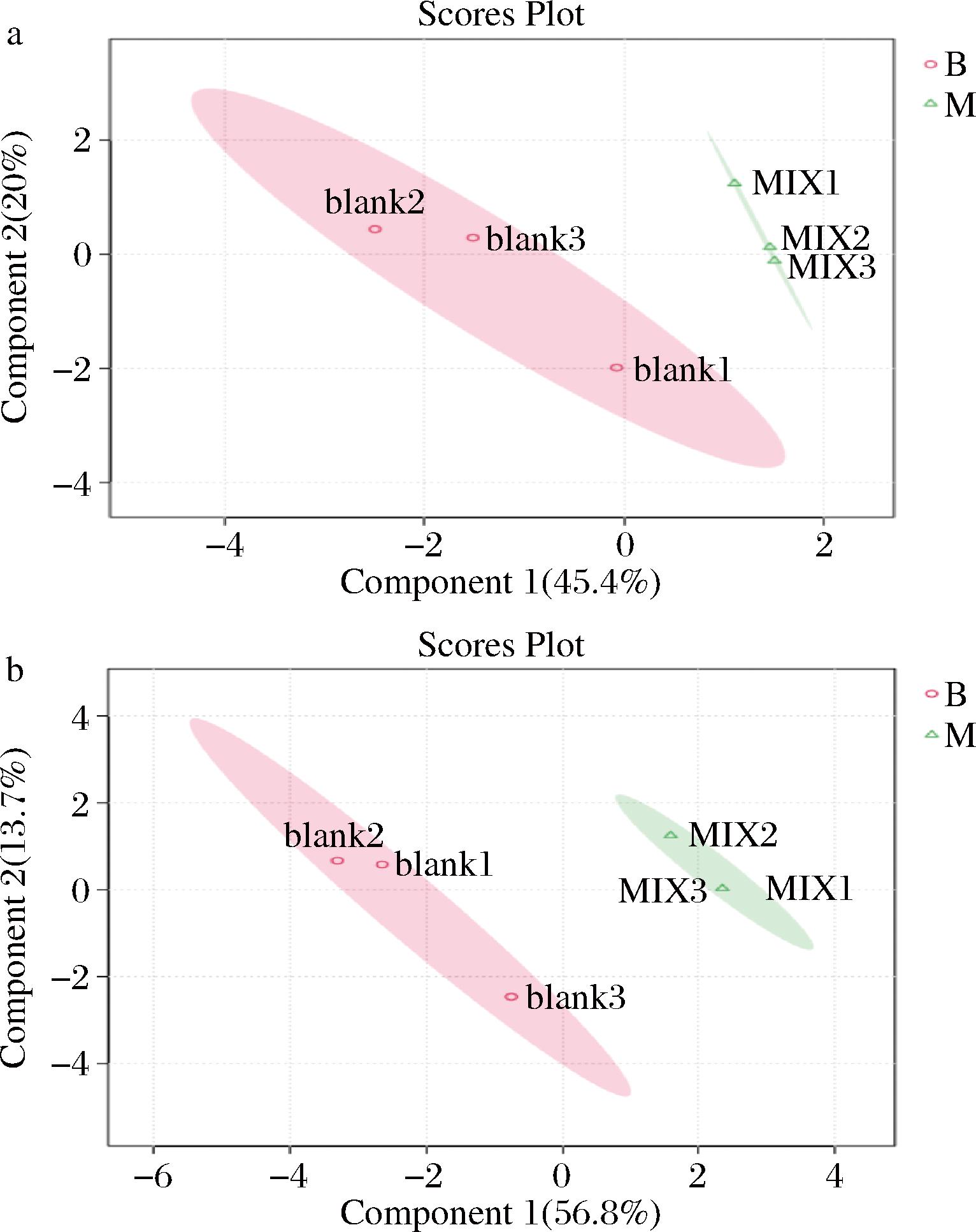
a-ESI+;b-ESI-
图2 乳酸菌发酵麦胚提取物代谢组Sparse PLS-DA结果
Fig.2 Sparse PLS-DA results of the extract metabolome of wheat germ extracts fermented by lactic acid bacteria
多项研究报道发酵工艺提高麦胚的抗氧化活性主要与发酵过程中通过微生物衍生水解释放的小分子肽(如GSH等)及氨基酸[15]。因此,基于Δmass和mzCloud Best Match≥80进行数据过滤,以变量投影重要性(variable importance in the projection,VIP)>1和|log2 fold change|>1为标准继续筛选显著差异代谢物,显著差异代谢物有18个,如表2所示。对空白组与乳酸菌组合发酵组的差异代谢物进行富集分析,基于基于化学结构(1 250种主要化学类代谢物或脂质组)数据库的富集分析(图3),发现差异代谢物显著集中在嘌呤嘧啶核苷酸、脂肪及其结合物、氨基酸和多肽、碳水化合物及其结合物等物质。将差异代谢物进行KEGG通路富集分析(图4),发现差异代谢物显著集中在嘌呤嘧啶代谢、精氨酸生物合成代谢、氨基酰基生物合成代谢、组氨酸代谢、淀粉和蔗糖代谢等通路。微生物在发酵过程中会进行一系列代谢活动,这些代谢活动会产生嘌呤和嘧啶核苷酸。研究发现,嘌呤在体内的转化过程,一部分会被转化成黄嘌呤,这是一种具有抗氧化、抗炎等作用的生物活性物质[16];L-精氨酸的生物合成与机体发挥抗糖化和抗氧化功能紧密相关,主要通过促进NRF-2核转位,维持糖化人血清白蛋白处理的H9c2心肌细胞的抗氧化解毒状态[16];此外,在活性氧存在的情况下,L-精氨酸可促进成骨,从而抵消氧化应激对骨稳态的影响[17]。组氨酸作为羟自由基和单线态氧的清除剂发挥抗氧化特性,凭借抗氧化、抗炎和螯合特性发挥对机体的保护作用[18]。综合以上结果,经乳酸菌发酵得到的麦胚提取物,优化了麦胚体系中具有抗氧化性能的代谢物分布。基于此,进一步考察发酵麦胚提取物的靶向代谢物和抗氧化能力。
表2 乳酸菌发酵麦胚提取物与空白对照组的差异代谢产物
Table 2 Differential metabolites between wheat germ extracts fermented by lactic acid bacteria and blank control group
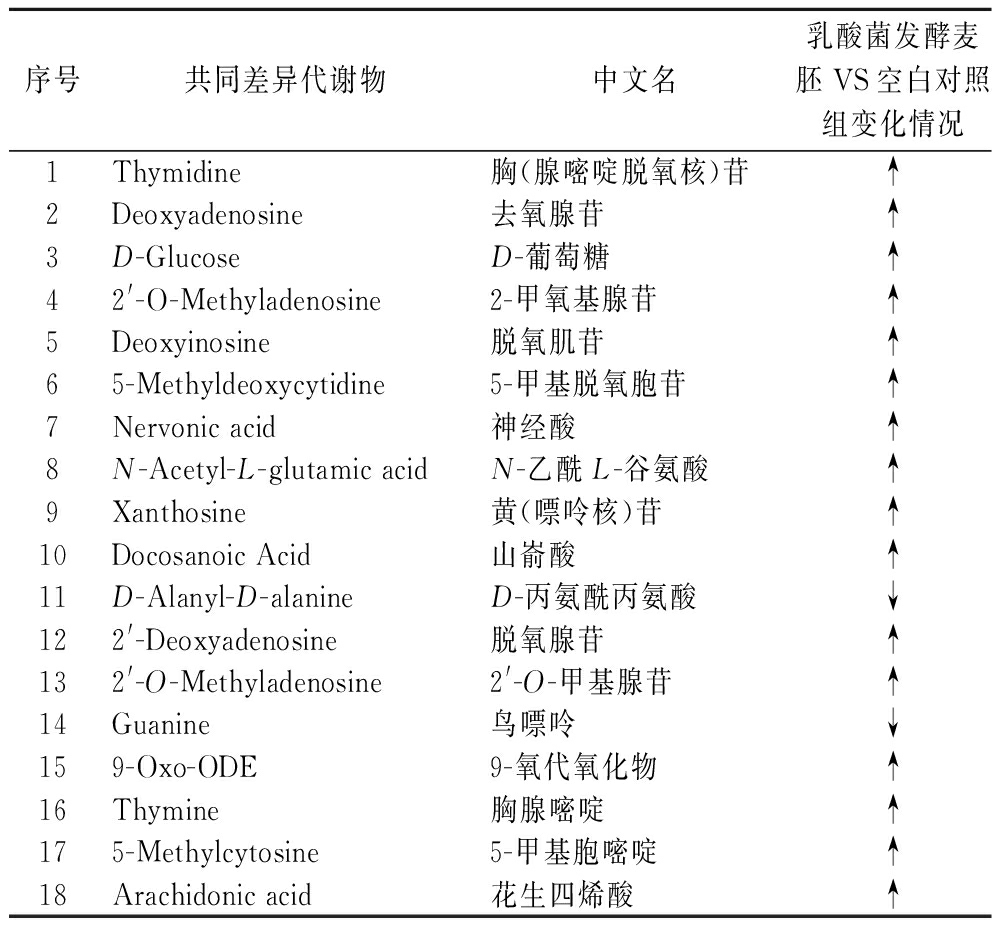
序号共同差异代谢物中文名乳酸菌发酵麦胚VS空白对照组变化情况1Thymidine胸(腺嘧啶脱氧核)苷↑2Deoxyadenosine去氧腺苷↑3D-GlucoseD-葡萄糖↑42'-O-Methyladenosine2-甲氧基腺苷↑5Deoxyinosine脱氧肌苷↑65-Methyldeoxycytidine5-甲基脱氧胞苷↑7Nervonic acid神经酸↑8N-Acetyl-L-glutamic acidN-乙酰L-谷氨酸↑9Xanthosine黄(嘌呤核)苷↑10Docosanoic Acid山嵛酸↑11D-Alanyl-D-alanineD-丙氨酰丙氨酸↓122'-Deoxyadenosine脱氧腺苷↑132'-O-Methyladenosine2'-O-甲基腺苷↑14Guanine鸟嘌呤↓159-Oxo-ODE9-氧代氧化物↑16Thymine胸腺嘧啶↑175-Methylcytosine5-甲基胞嘧啶↑18Arachidonic acid花生四烯酸↑
注:“↑”代表相对丰度上调,“↓”代表相对丰度下调。
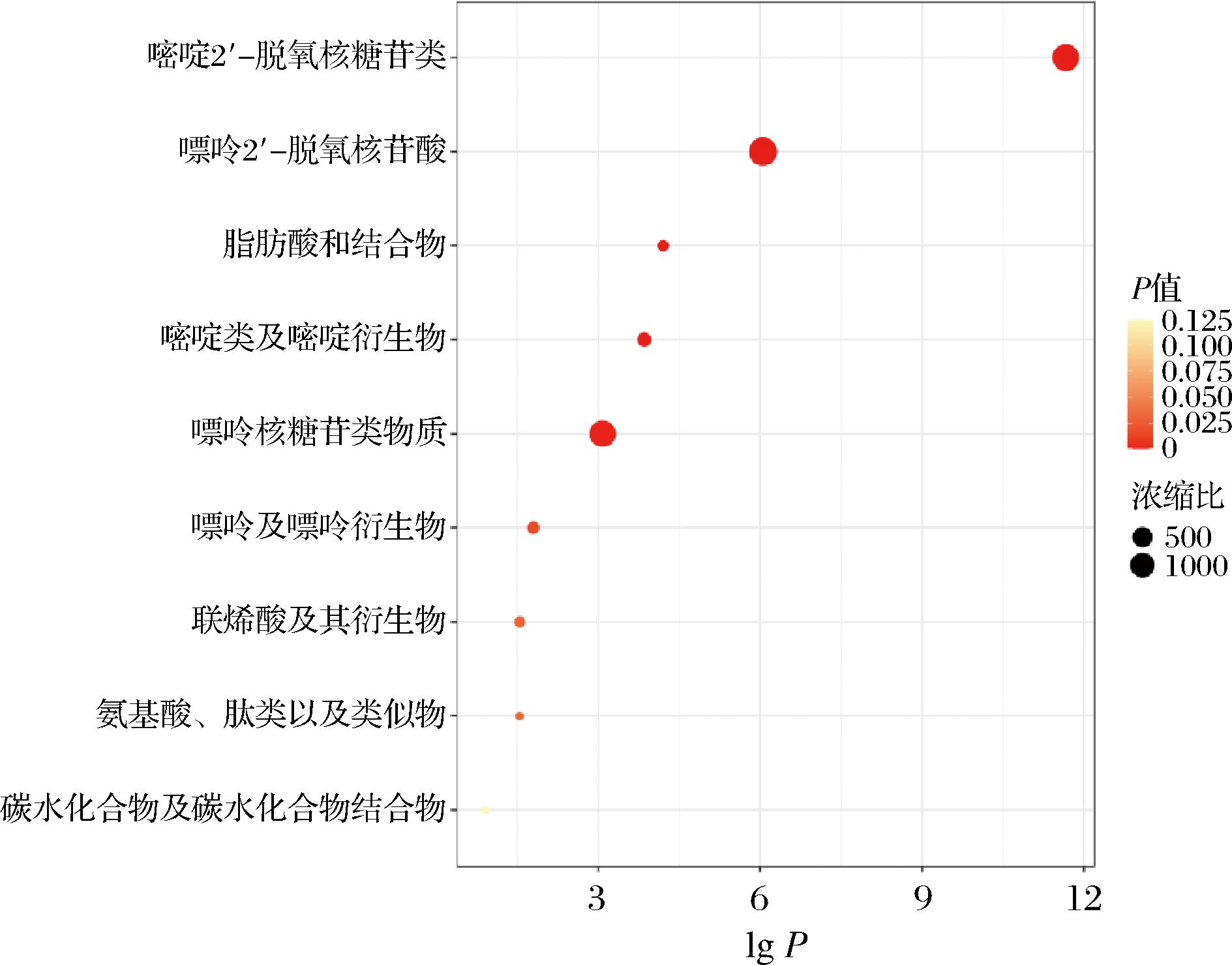
图3 乳酸菌发酵麦胚提取物代谢组差异代谢物基于化学结构(1 250种主要化学类代谢物或脂质组)数据库分析
Fig.3 Analysis of the extract metabolome of wheat germ extracts fermented by lactic acid bacteria based on main chemical class metabolite sets or lipid sets
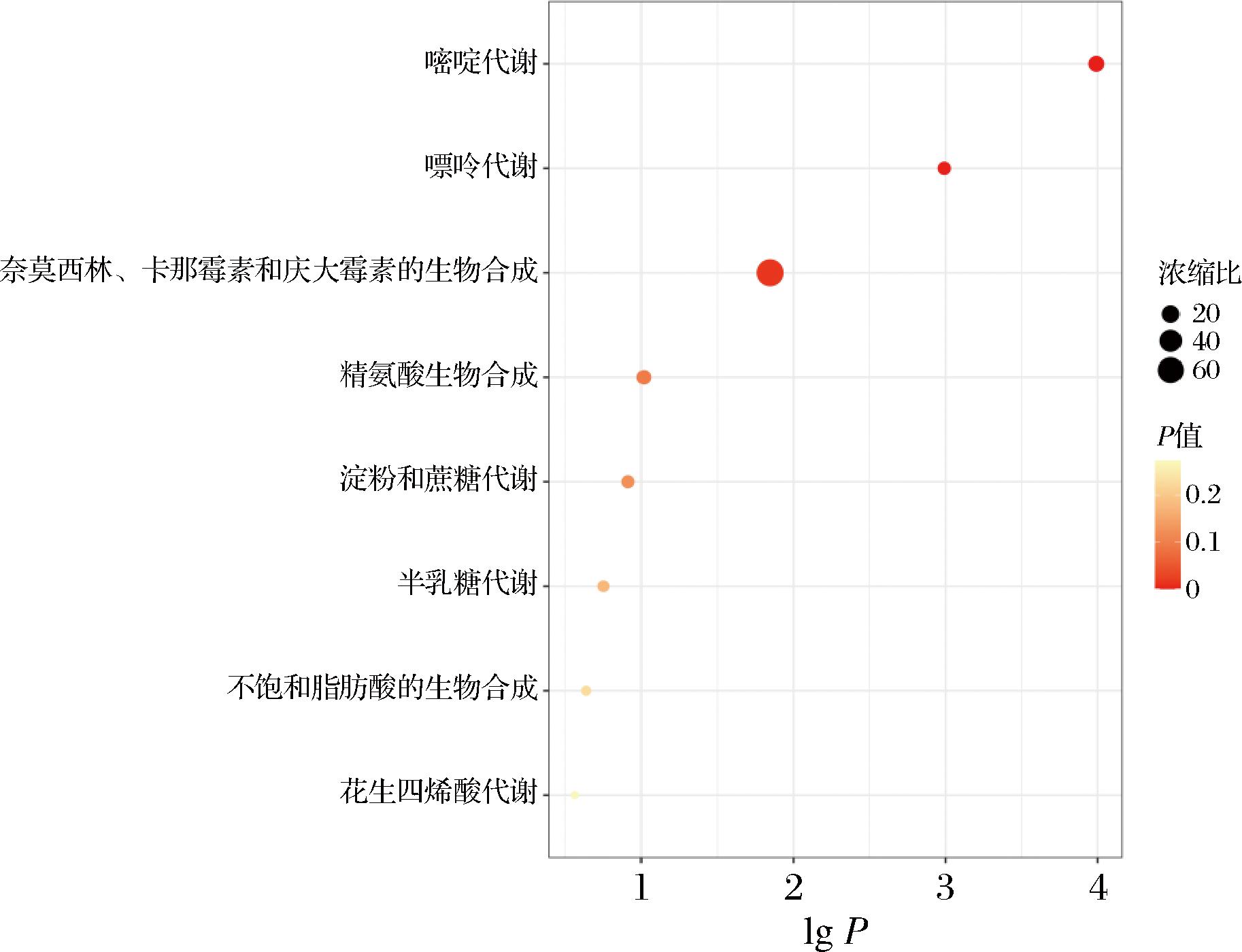
图4 乳酸菌发酵麦胚提取物代谢组差异代谢物KEGG富集分析
Fig.4 KEGG pathway analysis of the extract metabolome of wheat germ extracts fermented by lactic acid bacteria
2.2 乳酸菌发酵麦胚提取物中GSH水平分析
以上的代谢物研究,主要倾向于经乳酸菌生物发酵产生的不同于麦胚基底的物质,而无论发酵与否,GSH在小麦胚芽中的含量都较为丰富,占比约为0.456%。GSH是一种由甘氨酸、半胱氨酸和谷氨酸经肽键缩合而成的含硫活性三肽,具有较好的抗氧化性。已有报道乳酸菌的生物发酵可以增加麦胚体系中GSH的水平。如图5所示,与未经乳酸菌发酵的空白组麦胚提取物比,发酵麦胚提取物中GSH水平显著提高,GSH水平从8.2 mg/100 mL提高到34.6 mg/100 mL。GSH在人体内的生化防御体系起重要作用,具有多方面的生理功能。它的主要生理作用是能够清除掉人体内的自由基,作为体内一种重要的抗氧化剂,保护许多蛋白质和酶等分子中的巯基,因此,GSH水平的提高,可能对麦胚的抗氧化等生理功能存在潜在的提升作用。综上,继续对发酵麦胚提取物的抗氧化能力进行进一步分析。
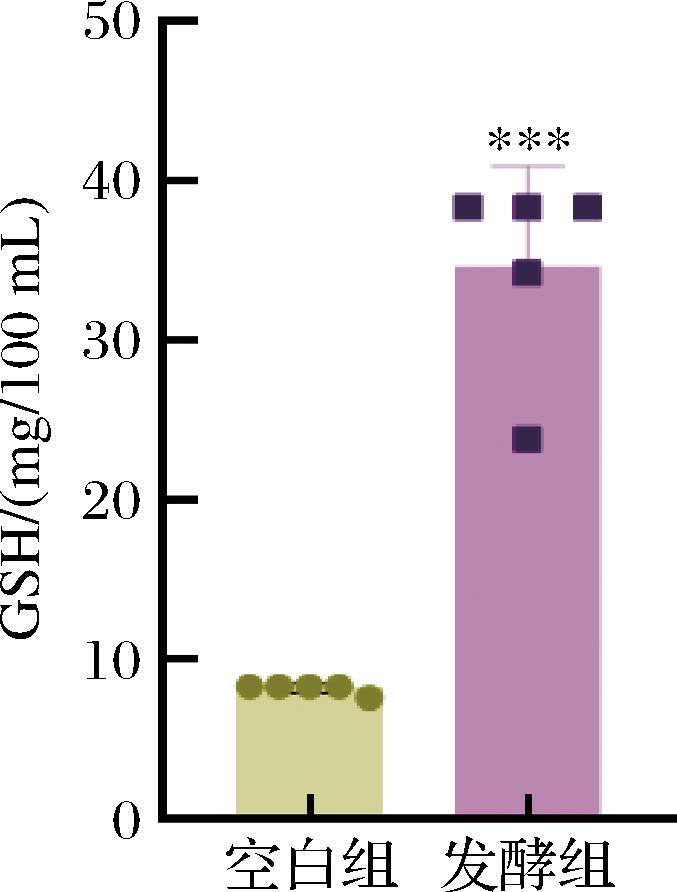
图5 乳酸菌发酵麦胚提取物的GSH水平
Fig.5 GSH levels of the extract of wheat germ extracts fermented by lactic acid bacteria
注:***P<0.001。
2.3 乳酸菌发酵麦胚提取物的抗氧化能力分析
已有研究表明,经乳酸菌发酵后,麦胚提取物的自由基清除率显著提高,抗氧化活性显著提高,并且乳酸菌发酵的麦胚饮料产品口感细腻、稳定性好[4]。如图6所示,与未经乳酸菌发酵的空白组麦胚提取物比,发酵麦胚提取物自由基清除率和总抗氧化能力均显著提高,这与已有报道结果一致。
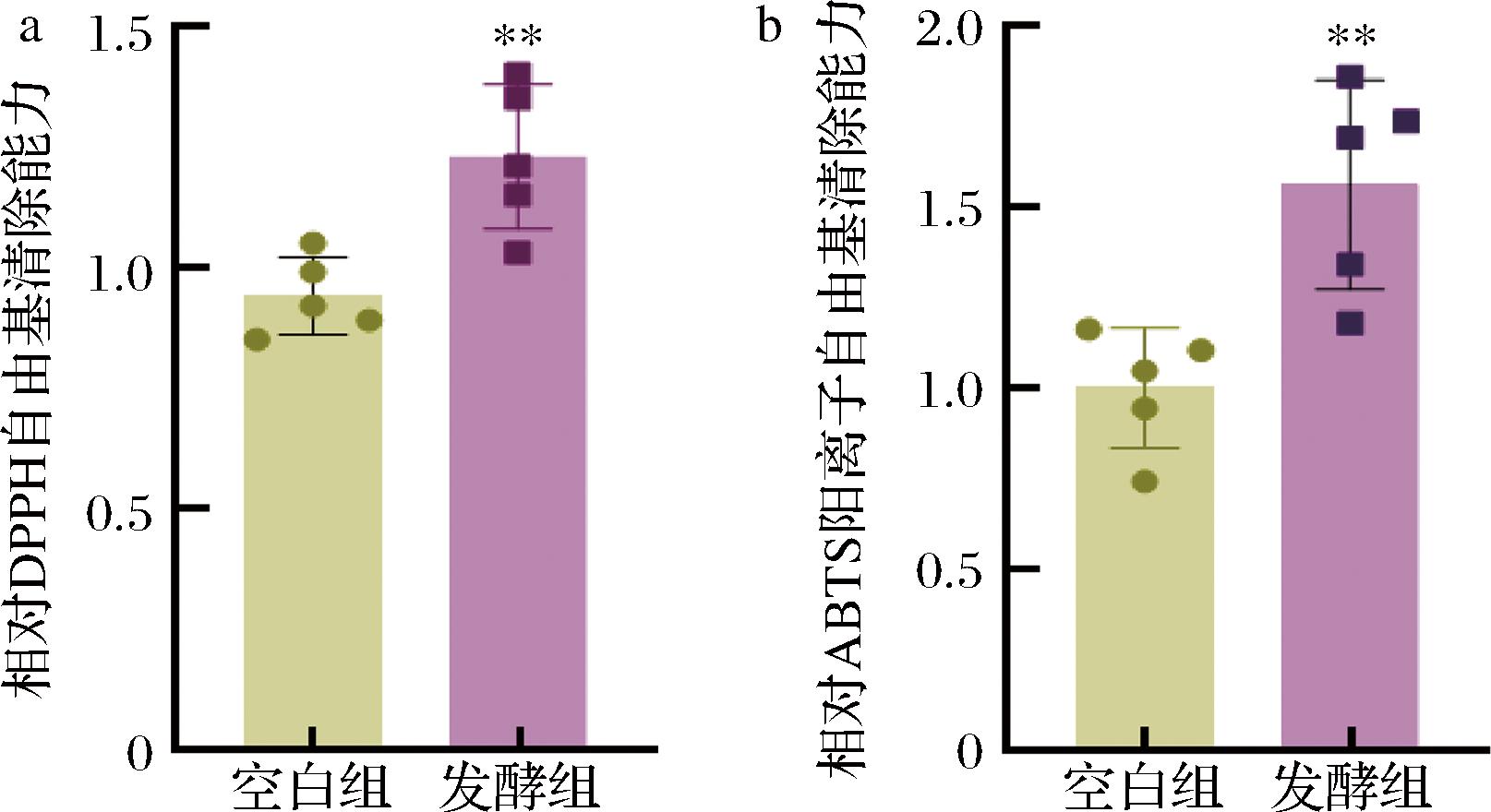
图6 乳酸菌发酵麦胚提取物的抗氧化能力
Fig.6 Antioxidant capacity of the extract of wheat germ extracts fermented by lactic acid bacteria
注:**P<0.01。
2.4 乳酸菌发酵麦胚提取物的抗氧化能力与发酵前后差异代谢物的相关性分析
已有研究表明发酵麦胚提取物体系氧化性能的抗提升与乳酸菌生物转化过程中的代谢物有关。因此,对本实验乳酸菌发酵麦胚提取物的抗氧化能力与发酵前后的差异代谢物丰度进行了相关性分析(图7),结果表明ABTS阳离子自由基清除能力与发酵麦胚中脱氧肌苷(r=0.978,P=0.018)、5-甲基脱氧胞苷(r=0.943,P=0.005)、谷胱甘肽(r=0.941,P=0.005)、鸟嘌呤(r=0.829,P=0.041)和脱氧腺苷(r=0.913,P=0.005)水平显著相关,DPPH自由基清除能力与发酵麦胚中N-乙酰L-谷氨酸(r=0.829,P=0.042)、2′-O-甲基腺苷(r=0.924,P=0.005)、神经酸(r=0.940,P=0.005)、山嵛酸(r=0.932,P=0.004)和葡萄糖(r =0.857,P=0.042)水平显著正相关。因而,在经乳酸菌发酵麦胚的体系中,主要通过生物转化增加以谷胱甘肽等物质为主的代谢物,提高体系的抗氧化潜力。
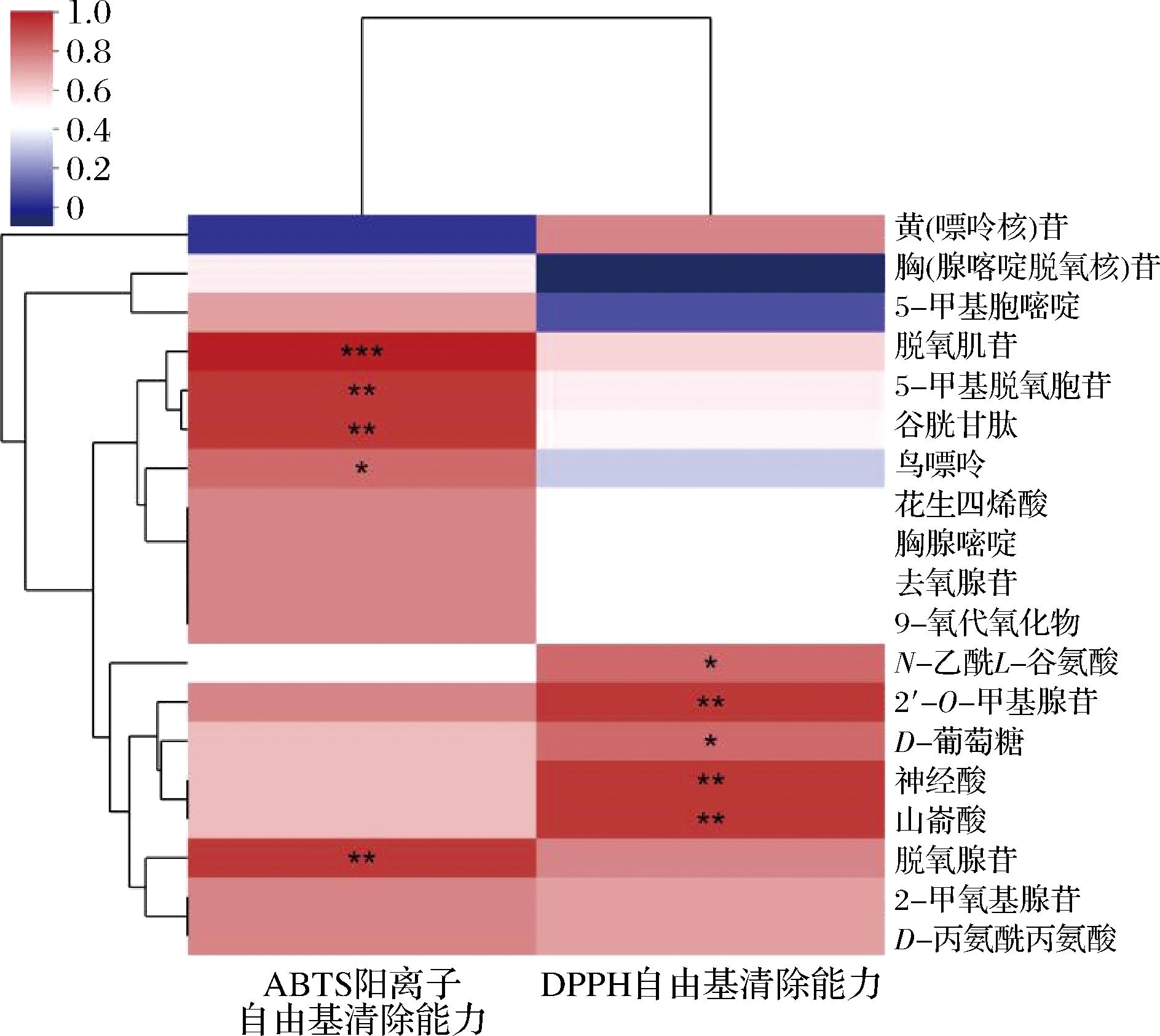
图7 乳酸菌发酵麦胚提取物的抗氧化能力与差异代谢物的相关性分析
Fig.7 Correlation analysis of antioxidant capacity and differential metabolites in wheat germ extracts fermented by lactic acid bacteria
2.5 乳酸菌发酵麦胚提取物对缺氧黑腹果蝇生存率和行为的影响
基于上述发酵麦胚提取物的优良抗氧化性能,将其作为膳食补充,每日添加在3~5日龄的雄性黑腹果蝇食物中,膳食干预15 d后,进行缺氧造膜,结果发现缺氧果蝇的生存率显著下降,爬管能力显著下降(图8),经阳性药物维生素C膳食干预后,生存率显著提升,爬管能力显著提升,而经发酵麦胚提取物的膳食干预,生存率(70.8%上升至86.7%)和爬管能力(85.2%上升至90.2%)也同样显著提升,因此,以维生素C为参照,乳酸菌发酵麦胚提取物可能通过调节缺氧果蝇的氧化应激状态进而辅助改善其行动能力,最终实现生存率的显著提升。
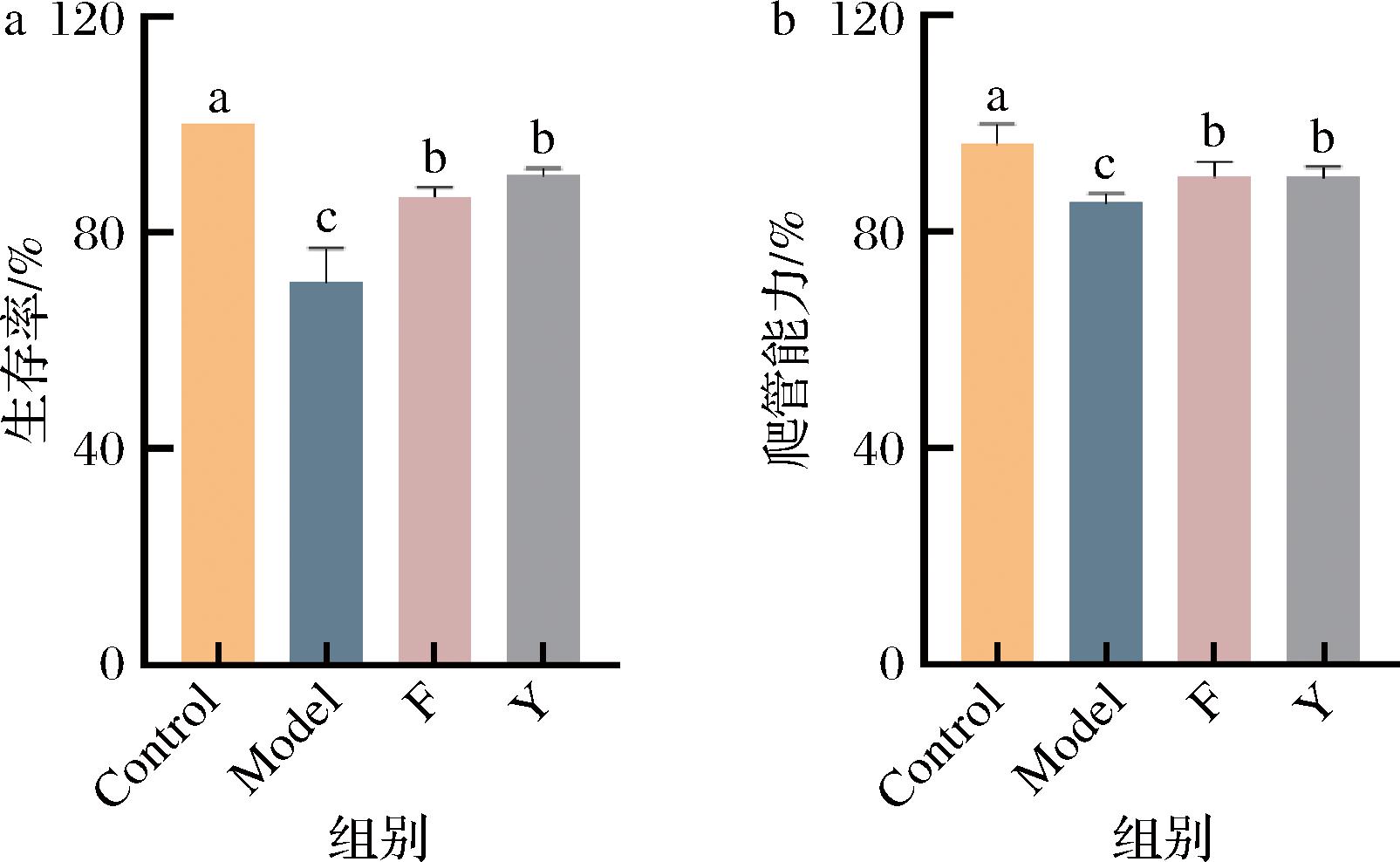
a-生存率;b-爬管能力
图8 黑腹果蝇的生存率和运动能力评价
Fig.8 Evaluation of survival and exercise capacity in Drosophila melanogaster
注:图中不同字母代表显著性差异(P<0.05)(下同)。
2.6 乳酸菌发酵麦胚提取物对缺氧黑腹果蝇氧化应激水平的影响
基于2.5节的结果,进一步考察了缺氧果蝇的氧化应激水平(图9),结果发现,缺氧果蝇DPPH和ABTS阳离子自由基清除能力都显著下降,阳性药物维生素C显著提升了缺氧果蝇的DPPH自由基清除能力,而膳食补充发酵麦胚提取物的DPPH自由基(20.3%上升至42%)和ABTS阳离子自由基(0.07 mmol/g上升至0.45 mmol/g)自由基清除能力均显著提升,这表明膳食补充乳酸菌发酵麦胚提取物对机体具有优良的抗氧化性能。因此,进一步考察膳食补充乳酸菌发酵麦胚提取物的缺氧果蝇的肠道代谢环境。
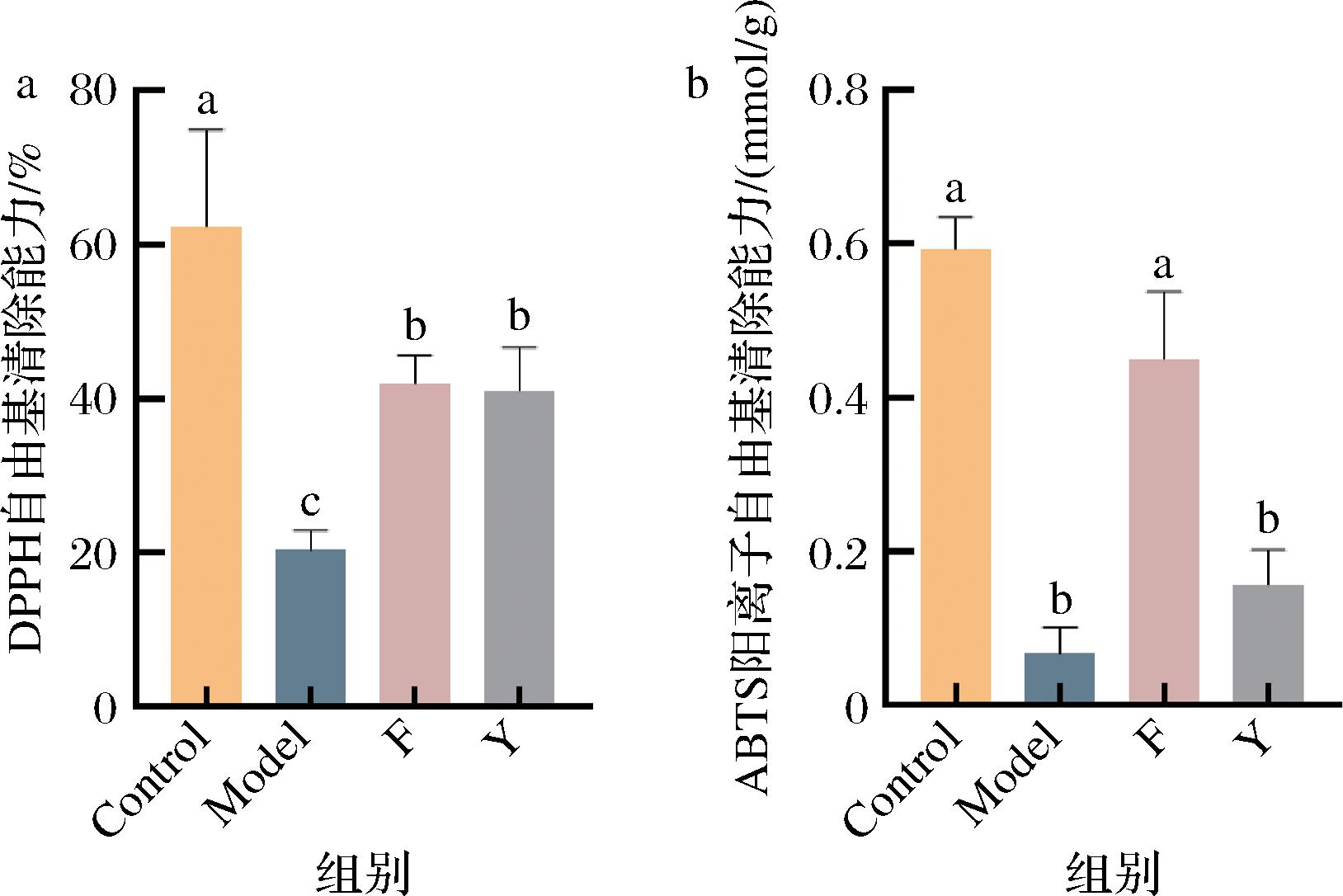
a-DPPH自由基;b-ABTS阳离子自由基
图9 乳酸菌发酵麦胚提取物对缺氧黑腹果蝇氧化应激水平的影响
Fig.9 Effect of extract of wheat germ extracts fermented by lactic acid bacteria on oxidative stress levels in D. melanogaster
2.7 乳酸菌发酵麦胚提取物对缺氧黑腹果蝇肠道代谢组的影响
为明确乳酸菌发酵麦胚提取物对缺氧果蝇肠道微生态环境的影响作用,对缺氧果蝇、健康果蝇和膳食补充发酵麦胚提取物的缺氧果蝇的肠道进行代谢组检测,利用Sparse PLS-DA,分析3组果蝇肠道的代谢分布,如图10所示。
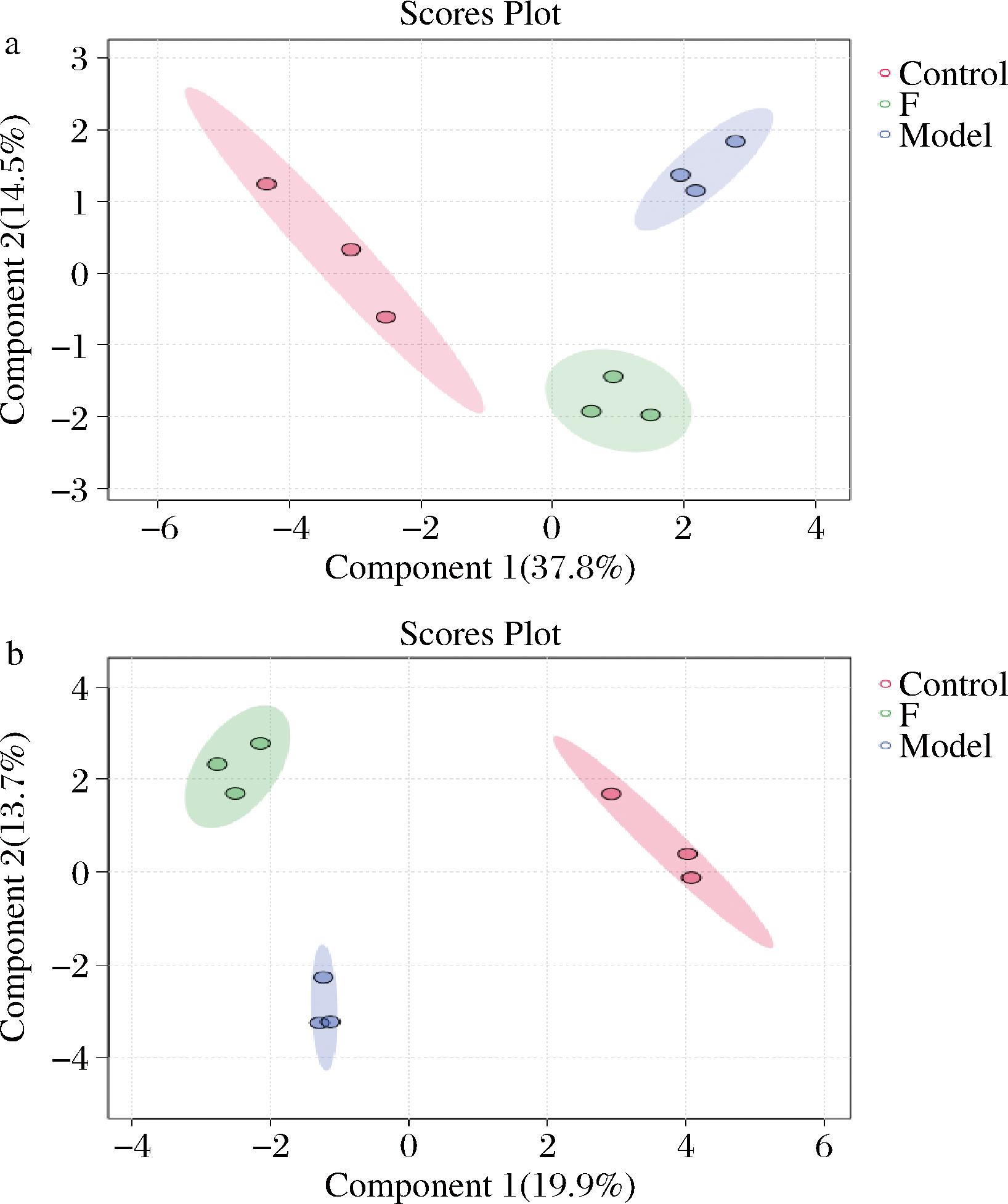
a-ESI+;b-ESI-
图10 黑腹果蝇肠道代谢组Sparse PLS-DA结果
Fig.10 Sparse PLS-DA results of the gut metabolome of D. melanogaster
结果发现,在ESI+和ESI-模式下,3组果蝇肠道的代谢组之间存在自身体系的聚类,空白组与模型组和干预组果蝇肠道代谢组均可以很好的分离开,膳食可以塑造独特的果蝇肠道微环境的代谢体系,提示膳食摄入乳酸菌发酵麦胚提取物使处于氧化应激状态的果蝇肠道代谢体系发生了显著变化,且膳食调控可以让其肠道微环境的代谢体系更趋于健康状态。
基于Δmass和mzCloud Best Match≥80进行数据过滤,以VIP>1和|log2 fold change|>1为标准继续筛选显著差异代谢物,如图11,其中显著差异的共同代谢物有23个,如表3。
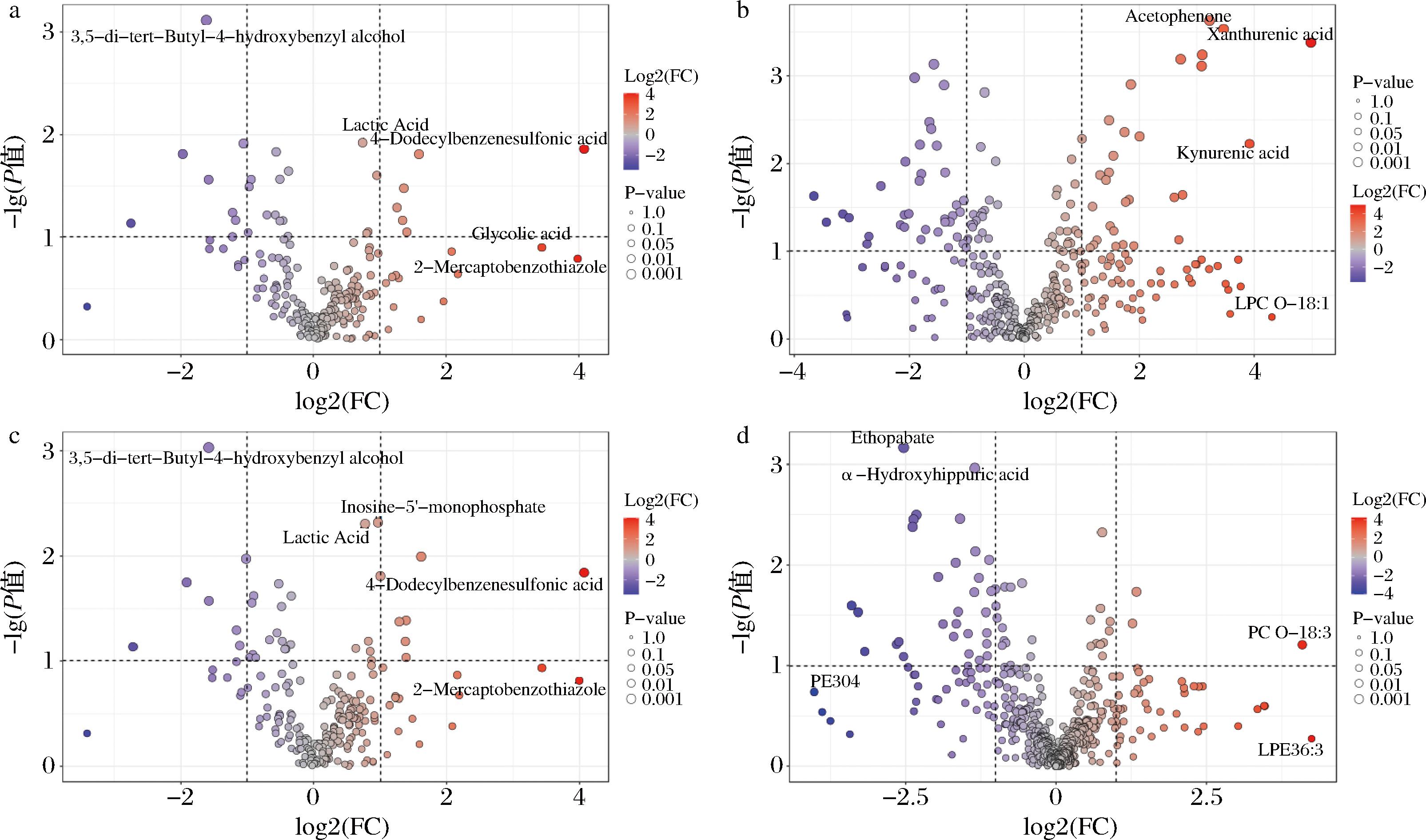
a-Control vs Model ESI-模式差异代谢物;b-Control vs Model ESI+模式火山图;c-Model vs F ESI-模式差异代谢物;d-Model vs F ESI+模式火山图
图11 黑腹果蝇肠道代谢组差异代谢物分析
Fig.11 Analysis of gut metabolome differential metabolites of D. melanogaster
表3 共同差异代谢产物
Table 3 Common differential metabolites

序号共同差异代谢物中文名Mode组VS Control组变化情况F组VS Model组变化情况1Kynurenic acid犬尿酸↑↓2Uric acid尿酸↑↓3Guanine鸟嘌呤↓↑4Xanthine黄嘌呤↓↑5Acetylcholine乙酰胆碱↓↑6Ethyl protocatechuate原儿茶酸乙酯↓↑7Indole-2-carboxylic acid吲哚-2-羧酸↓↑8Guanosine鸟苷↓↑9L-Glutamic acidL-谷氨酸↓↑10Adenosine腺苷↓↑11Inosine肌苷↓↑12N-AcetylhistamineN-乙酰组胺↓↑13Histamine组胺↓↑14Nervonic acid神经酸↓↑15Salicylic acid水杨酸↓↑16LPE 18∶1溶血磷脂酰乙醇胺(18∶1)↓↑17D-(-)-MannitolD-(-)甘露醇↑↓18DL-Stachydrine水苏碱↓↑191-Methyladenine1-甲基腺嘌呤↓↑20Tetradecanedioic acid十四烷二酸↓↑21Adenosine 3'5'-cyclic monophosphate腺苷3,5-环磷酸↑↓22Guanosine-3',5'-cyclic monophosphate鸟苷3,5,环磷酸↑↓23Didecyl phthalate邻苯二甲酸二癸酯↑↓
注:Control-健康果蝇组;Model-缺氧果蝇模型组;F-膳食补充乳酸菌发酵麦胚提取物的缺氧果蝇组。
对以上差异代谢物进行富集分析,基于1 250种主要化学类代谢物或脂质组数据库的富集分析,如图12,发现差异代谢物显著集中在四羧酸及其衍生物、蝶啶及其衍生物、嘌呤核糖核苷酸、γ-丁内酯、氨基酸、肽和类似物、苯甲酸及其衍生物、胺类、类黄酮苷、碳水化合物和碳水化合物结合物、α-羟基酸及其衍生物、脂肪酸和结合物、苯磺酸和衍生物、嘧啶核苷酸。其中类黄酮苷[19]、γ-丁内酯[20]、苯磺酸和衍生物[21]等差异代谢物,均具有一定的抗氧化能力。
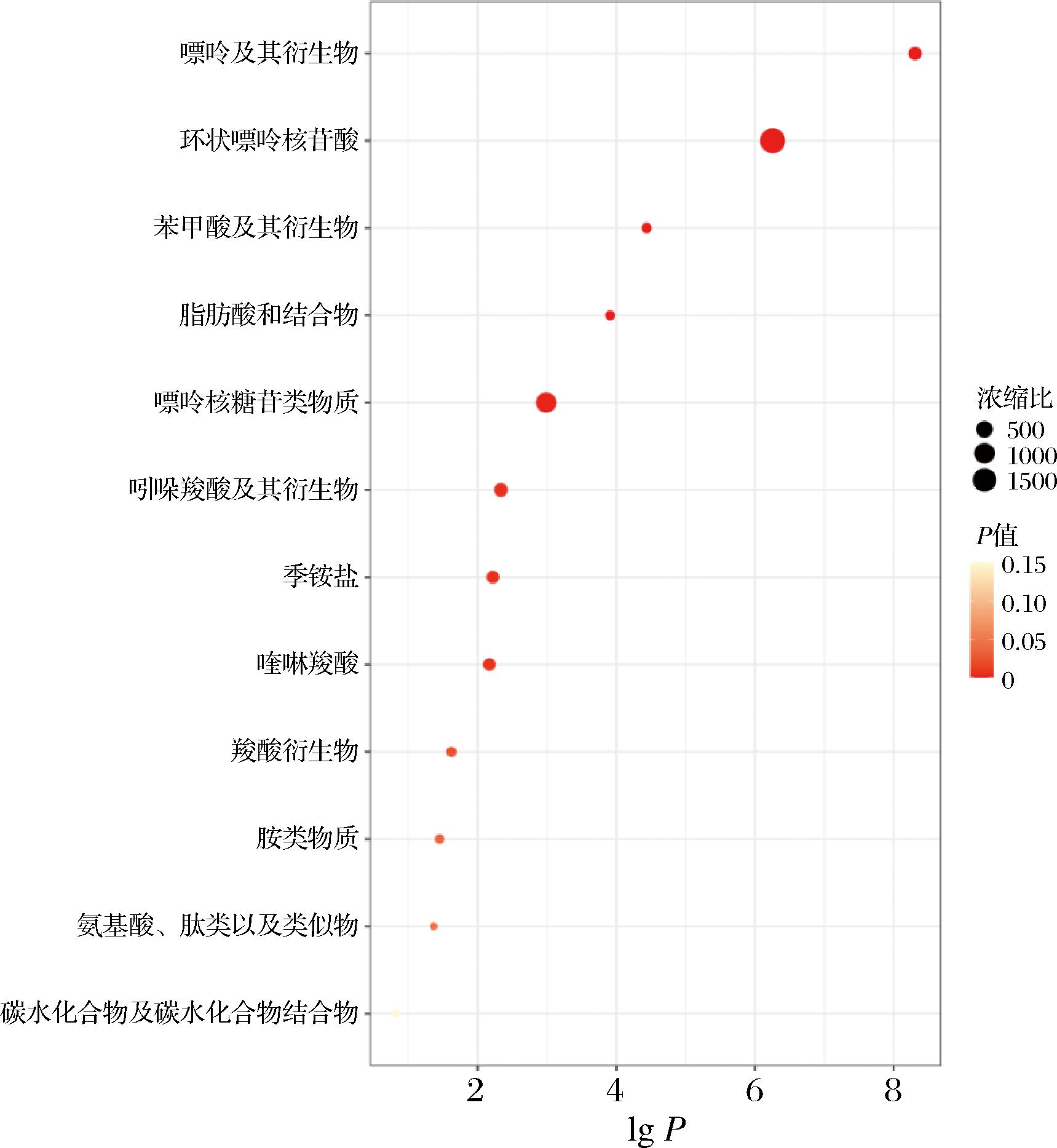
图12 黑腹果蝇肠道差异代谢物KEGG富集分析
Fig.12 KEGG pathway of the gut metabolome of D. melanogaster
将这些差异代谢物进行KEGG通路富集分析,如图13,发现这些差异代谢物显著集中在嘌呤代谢、组氨酸代谢、氮代谢、精氨酸生物合成、丁酸代谢、丙氨酸,天冬氨酸和谷氨酸的代谢、谷胱甘肽代谢等代谢途径。其中精氨酸、丙氨酸、天冬氨酸和谷氨酸是机体的能量源,也是具有很强的抗氧化功能的营养素,研究表明通过激活丝氨酸-甘氨酸-苏氨酸代谢轴,可以增强解毒作用,维持分子的合成周转、修复/维持以及减少氧化应激,保持肝功能的机制来达到延长寿命的效果[22-23];不饱和脂肪酸的生物合成途径在保护机体免受自由基损害,降低氧化应激,提高免疫力方面有着非常重要的作用[24]。
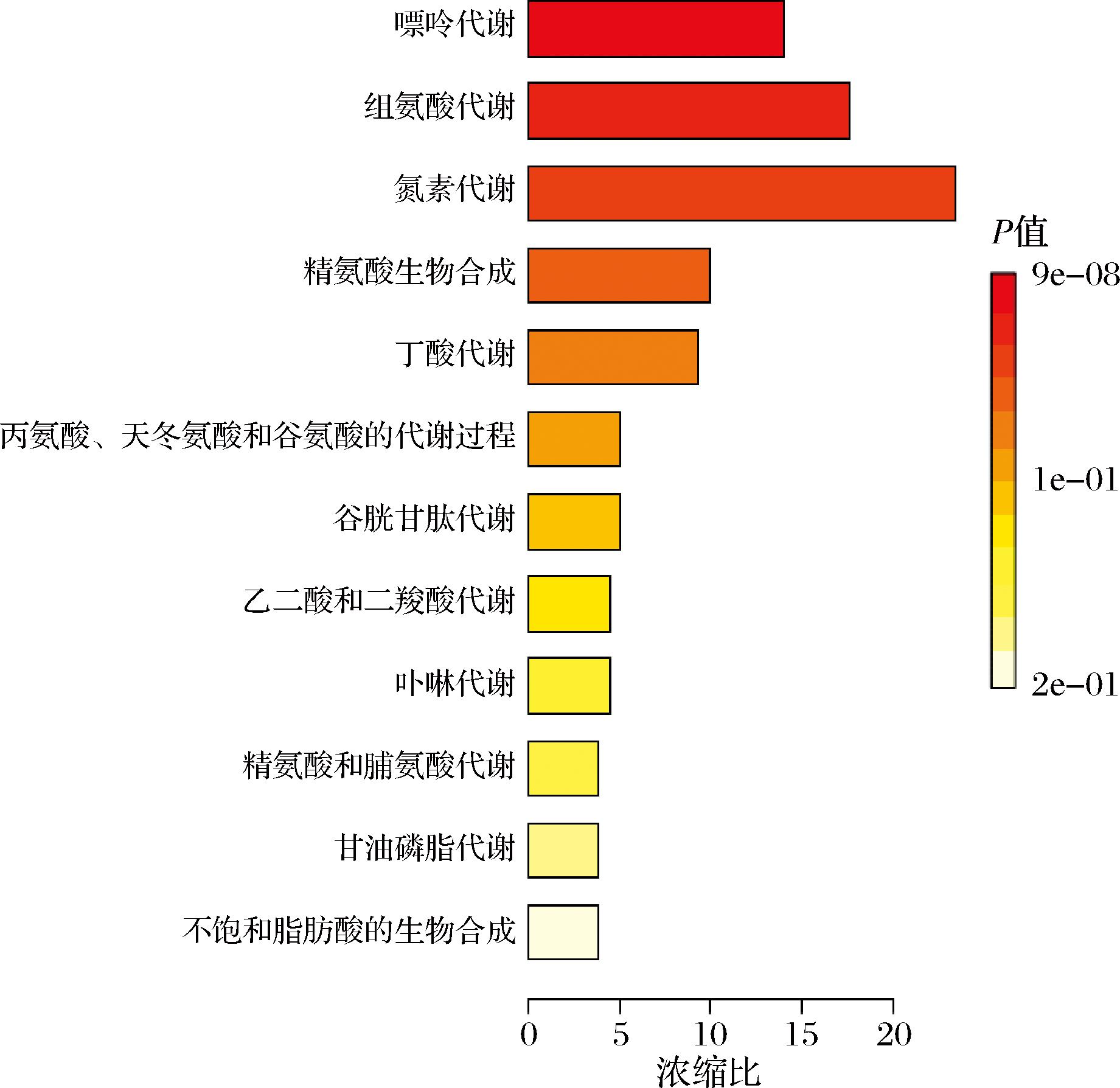
图13 黑腹果蝇肠道差异代谢物KEGG富集分析
Fig.13 KEGG pathway of the gut metabolome of D. melanogaster
2.8 缺氧果蝇表观指标和氧化应激指标与差异代谢物的相关性分析
为明确差异代谢物在缺氧果蝇表观指标和氧化应激指标,对缺氧果蝇表观指标和氧化应激指标与差异代谢物的相关性进行了分析,结果如图14所示,发现缺氧果蝇的表观指标、DPPH自由基清除率和ABTS阳离子自由基清除率与N-乙酰组胺和神经酸水平均显著正相关,尿酸和乙酰胆碱水平均显著负相关。此外,表观指标与组胺(r=0.813,P=0.008;r=0.924,P=0.000 3)、黄嘌呤(r=0.593,P=0.092;r=0.764,P=0.016)、水苏碱(r=0.695,P=0.038;r=0.773,P=0.015)和鸟嘌呤(r=0.712,P=0.031;r=0.857,P=0.003)水平也显著正相关;DPPH自由基清除与腺苷(r=0.683,P=0.042)、组胺(r=0.767,P=0.016)、黄嘌呤(r=0.667,P=0.050)、水苏碱(r=0.717,P=0.030)和鸟嘌呤(r=0.683,P=0.042)水平也显著正相关;ABTS阳离子自由基清除率与腺苷(r=0.669,P=0.049)显著正相关,与甘露醇(r=-0.678,P=0.045)显著负相关。已有研究表明,这些核苷酸类代谢物、胺类代谢物、嘌呤类代谢物及生物碱类代谢物主要参与细胞的多种生理过程包括能量代谢、信号转导、免疫反应、遗传信息传递等,在调节生物行为、降低机体氧化应激方面发挥着重要作用;这些表观指标和氧化应激指标的改善可能与缺氧果蝇膳食补充了乳酸菌发酵麦胚提取物有关,因此,乳酸菌发酵麦胚提取物可能通过对肠道代谢环境的调节进一步提高机体的缺氧耐受性的潜力。具体的机制将在后续研究中逐步开展。
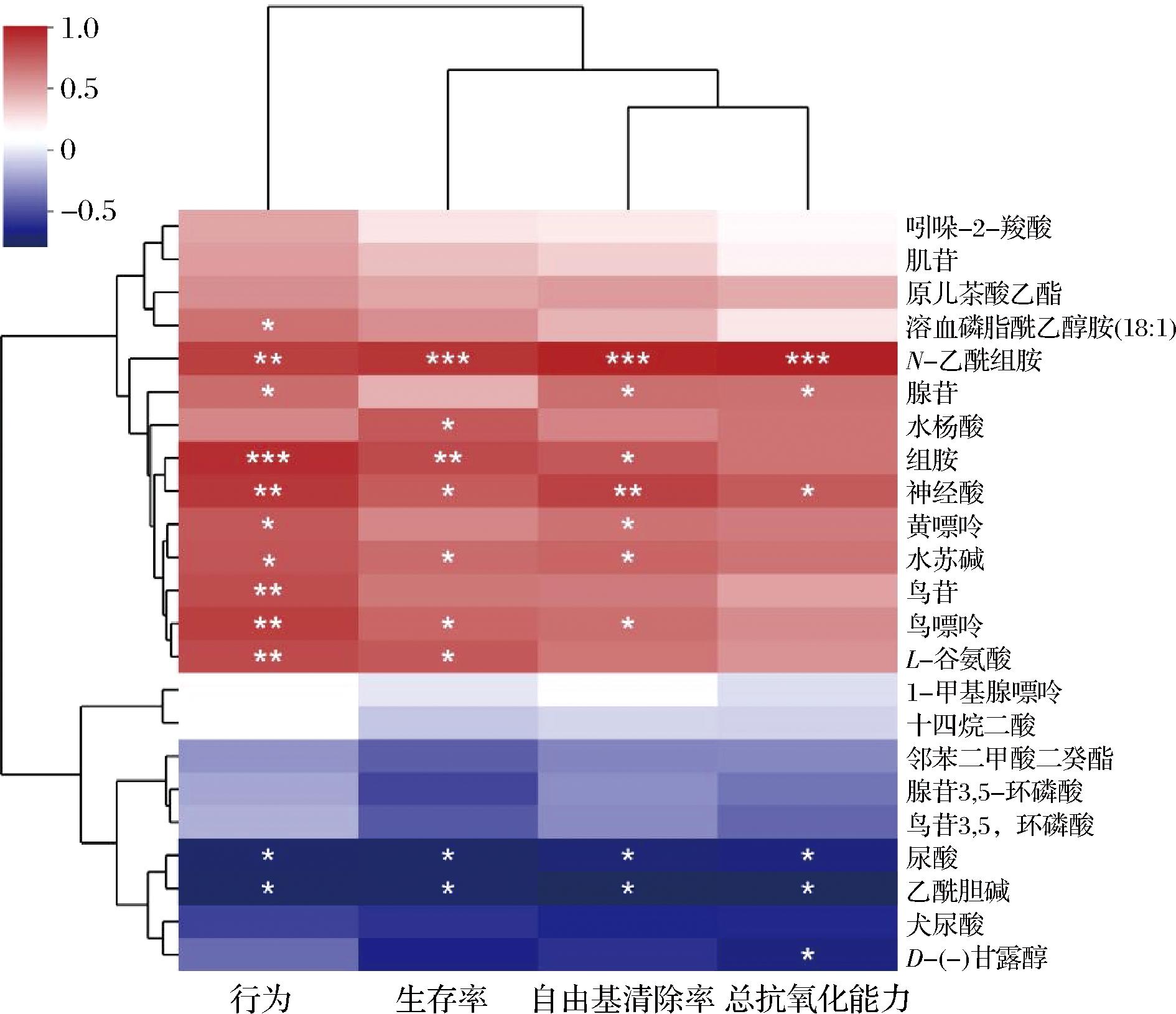
图14 缺氧果蝇表观指标和氧化应激指标与差异代谢物的相关性分析
Fig.14 Correlation analysis of apparent and oxidative stress indicators with differential metabolites in D. melanogaster
3 结论
生物发酵麦胚提取物在食品、饲料及医药等领域的应用受到广泛关注,本研究发现麦胚经乳酸菌发酵后,嘌呤嘧啶核苷酸、脂肪及其结合物、氨基酸和多肽、碳水化合物及其结合物等物质丰度提升,涉及嘌呤嘧啶代谢、精氨酸生物合成代谢、氨基酰基生物合成代谢、组氨酸代谢、淀粉和蔗糖代谢等通路。相关性分析发现,乳酸菌可能主要通过生物转化增加以GSH等物质为主的代谢物,增强体系的抗氧化潜力。以乳酸菌发酵麦胚提取物为抗氧化的膳食补充剂,以缺氧果蝇为模式生物,发现其可能通过调节缺氧果蝇肠道中参与机体能量代谢、信号转导、免疫反应等生理功能的核苷酸类、胺类、嘌呤类及生物碱类物质的丰度,改善其运动能力和机体氧化应激状态,改善其运动能力和机体氧化应激状态,并提升了生存率。因此,乳酸菌发酵麦胚提取物具有提高机体的缺氧耐受性的潜力。这为乳酸菌发酵麦胚提取物在缓解缺氧引起的机体氧化应激中的应用提供了科学依据。
[1] HOU Y, WANG X B, ZHANG Y, et al.Highland mate:Edible and functional foods in traditional medicine for the prevention and treatment of hypoxia-related symptoms[J].Current Opinion in Pharmacology, 2021, 60:306-314.
[2] HUA H, ZHU H, LIU C, et al.Bioactive compound from the Tibetan turnip (Brassica rapa L.) elicited[J].Food Function, 2021, 7(12):2901-2913.
[3] HU Z Y, ZHAO P H, LIAO A M, et al.Fermented wheat germ alleviates depression-like behavior in rats with chronic and unpredictable mild stress[J].Foods, 2023, 12(5):920.
[4] MUELLER T, VOIGT W.Fermented wheat germ extract:Nutritional supplement or anticancer drug?[J].Nutrition Journal, 2011, 10:89.
[5] TELEKES A, RESETAR A, BALINT G, et al.Fermented wheat germ extract (avemar) inhibits adjuvant arthritis[J].Annals of the New York Academy of Sciences, 2007, 1110(1):348-361.
[6] WU J, CHENG Y, DONG Y.Antioxidant activity of Lactobacillus plantarum DY-1 fermented wheat germ extract and its influence on lipid oxidation and texture properties of emulsified sausages[J].Journal of Food Quality, 2020, 2020(1):8885886.
[7] ZU X Y, MA X L, XIE X M, et al.2, 6-DMBQ is a novel mTOR inhibitor that reduces gastric cancer growth in vitro and in vivo[J].Journal of Experimental &Clinical Cancer Research, 2020, 39(1):107.
[8] ZHENG Z Q, YANG X X, LIU J, et al.Effects of wheat peptide supplementation on anti-fatigue and immunoregulation during incremental swimming exercise in rats[J].RSC Advances, 2017, 7(69):43345-43355.
[9] HUANG L, LI T Y, ZHOU M, et al.Hypoxia improves endurance performance by enhancing short chain fatty acids production via gut microbiota remodeling[J].Frontiers in Microbiology, 2022, 12:820691.
[10] YI X D, CAI R, SHAOYONG W K, et al.Melatonin promotes gut anti-oxidative status in perinatal rat by remodeling the gut microbiome[J].Redox Biology, 2023, 65:102829.
[11] OKRAY Z, HASSAN B A.Genetic approaches in Drosophila for the study neurodevelopmental disorders[J].Neuropharmacology, 2013, 68:150-156.
[12] MAHNEVA O, CAPLAN S L, IVKO P, et al.NO/cGMP/PKG activation protects Drosophila cells subjected to hypoxic stress[J].Comparative Biochemistry and Physiology.Toxicology &Pharmacology, 2019, 223:106-114.
[13] KONG Q M, CHEN Q, MAO X H, et al.Bifidobacterium longum CCFM1077 ameliorated neurotransmitter disorder and neuroinflammation closely linked to regulation in the kynurenine pathway of autistic-like rats[J].Nutrients, 2022, 14(8):1615.
[14] MAHMOUDI S, DEHKORDI M M, ASGARSHAMSI M H.Density functional theory studies of the antioxidants:A review[J].Journal of Molecular Modeling, 2021, 27(9):271.
[15] LIU F R, CHEN Z X, SHAO J J, et al.Effect of fermentation on the peptide content, phenolics and antioxidant activity of defatted wheat germ[J].Food Bioscience, 2017, 20:141-148.
[16] THAKUR M R, NACHANE S S, TUPE R S.Alleviation of albumin glycation-induced diabetic cardiomyopathy by L-Arginine:Insights into Nrf-2 signaling[J].International Journal of Biological Macromolecules, 2024, 264:130478.
[17] SHEN Y, WANG H M, XIE H W, et al.L-arginine promotes angio-osteogenesis to enhance oxidative stress-inhibited bone formation by ameliorating mitophagy[J].Journal of Orthopaedic Translation, 2024, 46:53-64.
[18] ACU A I, RUIZ A, CERD
A I, RUIZ A, CERD T, et al.Rapid and simultaneous determination of histidine metabolism intermediates in human and mouse microbiota and biomatrices[J].BioFactors, 2022, 48(2):315-328.
T, et al.Rapid and simultaneous determination of histidine metabolism intermediates in human and mouse microbiota and biomatrices[J].BioFactors, 2022, 48(2):315-328.
[19] XU H J, LI Z M, WU Y Q, et al.Advances on synthesis of flavonoid glycosides[J].Chinese Journal of Organic Chemistry, 2019, 39(7):1875.
[20] RAVEN L M, MORRIS P, GREENFIELD J R.Hyperglycaemia induced by gamma-butyrolactone[J].Diabetic Medicine, 2022, 39(8):e14850.
[21] HU J T, WANG S Y.Evaluation of anti-inflammatory effects of polysaccharide derived from Plantago ovata husk on trinitro benzenesulfonic acid-induced ulcerative colitis in mice[J].Indian Journal of Pharmaceutical Education and Research, 2023, 57(4):1140-1149.
[22] AON M A, BERNIER M, MITCHELL S J, et al.Untangling determinants of enhanced health and lifespan through a multi-omics approach in mice[J].Cell Metabolism, 2020, 32(1):100-116.e4.
[23] MITCHELL S J, BERNIER M, MATTISON J A, et al.Daily fasting improves health and survival in male mice independent of diet composition and calories[J].Cell Metabolism, 2019, 29(1):221-228.e3.
[24] KERMAN B E, SELF W, YASSINE H N.Can the gut microbiome inform the effects of omega-3 fatty acid supplementation trials on cognition?[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2024, 27(2):116-124.