钙是人体中含量最丰富的无机元素,参与多种生理活动,如肌肉收缩、神经冲动传递和细胞分化[1]。钙摄取不足会导致代谢性骨病、结肠癌和高血压等疾病[2]。因此,选择有效的钙补充剂是预防和治疗钙缺乏症的主要手段。食物来源活性肽-钙复合物作为新一代补钙产品可以与细胞膜相互作用,打开钙通道,促进钙吸收或者充当钙到细胞内的载体[3],同时肽-钙复合物的稳定性优于植酸钙或草酸钙,避免了胃肠道酸碱环境的损害[4]。已有研究表明牛骨胶原蛋白肽-钙复合物[5]和猪骨胶原肽-钙螯合物[6]可以显著改善Caco-2细胞单层中的钙转运,并逆转磷酸盐和植酸盐对钙吸收的抑制。卵黄高磷蛋白磷酸肽(phosvitin phosphopeptide,PPP)是卵黄高磷蛋白酶解后得到的富含磷酸丝氨酸的多肽,容易与金属离子结合。已有研究证明PPP有优异的钙结合能力,例如卵黄高磷蛋白酶解中得到的五肽EDDpSpS[7]和九肽DEEENDQVK[8]的钙结合能力分别为468 mg/g和151.1 mg/g。然而肽-钙复合物很容易被胃蛋白酶酶解,降低肽-钙的生物利用度,如酪蛋白磷酸肽-钙复合物在模拟胃消化阶段中游离钙释放率为82.0%,在胃液过早释放出Ca2+[9]。因此,构建、研究新型、稳定的钙递送系统尤为重要。
蛋白质/肽和糖类等生物聚合物已被用于组装保护性缓释载体,以延缓体内各种生物活性化合物的反应速率或释放速率[2]。美拉德反应是指含氨基化合物(氨基酸、肽、蛋白质)和含羰基化合物(还原糖、醛)之间发生的复杂反应,该反应是自发进行,是一种安全的修饰方法[10]。多糖是美拉德反应中必不可少的物质,葡聚糖(dextran,DX)是一种中性多糖,具有还原性,可抑制多肽与多糖之间静电络合的形成。其由葡萄糖残基通过α-1,6键连接,具有很高的灵活性,为糖基化分子间聚集提供强大的空间[11]。多肽与糖类物质形成的偶联物功能营养特性更好,也具有保护胃肠消化容易分解生物活性化合物的作用[12]。糖基化修饰的多肽表现出优异的钙结合能力。例如,酪蛋白磷酸肽(casein phosphopeptides,CPP)与可溶性膳食纤维(soluble dietary fiber,SDF)发生美拉德反应后,CPP-SDF偶联物提高了钙结合量,从11.63%提高到46.8%,共聚物中的SDF保护CPP免受胃蛋白酶水解,在胃中钙释放率从75%降至37%,因此大部分钙在肠道条件下以受控方式释放,从而提高钙的生物利用度[13]。壳寡糖(chitosan oligosaccharide,COS)修饰脱盐鸭蛋清肽(desalted duck egg white peptides,DPs)得到的美拉德反应产物DPs-COS偶联物具有最大的可溶性钙结合能力(17.25 mg/g),DPs-COS偶联物-钙复合物在胃中钙释放量为50%,比DPs-钙复合物降低了30%,同时缓解植酸的副作用[14]。在这些递送系统中,多糖作为防止胃蛋白酶降解的保护屏障,而蛋白质/多肽通过提供对生物活性化合物的亲和力作用,从而将生物活性物质输送到肠道中[15]。
基于上述研究,为了进一步提高PPP-Ca的钙结合量和胃肠稳定性,本研究通过美拉德反应制备PPP-DX,通过光谱和色谱法表征进一步研究PPP-DX的结构,并评估PPP-DX的持钙能力和在胃肠道消化中的稳定性。
1.1.1 材料与试剂
鸡蛋(褐壳鸡蛋),河北邯郸市馆陶县金鹏养鸡场;DX(10 000 Da)、碱性蛋白酶(200 U/mg),上海麦克林生物化工科技股份有限公司;CaCl2(99.8%)、胃蛋白酶(15 000 U/g)、胰酶(125 000 U/g)、邻苯二甲醛(o-phthalaldehyde,OPA),上海阿拉丁生化科技有限公司;胰蛋白酶(250 U/mg)、猪胆盐,北京索莱宝生物技术有限公司;钙含量检测试剂盒,碧云天生物技术有限公司。
1.1.2 仪器与设备
DF-101S恒温电热水浴锅,郑州卓诚仪器有限公司;FE28-Standard pH计,上海梅特勒-托利多国际有限公司;Vario Skan LUX酶标仪、NicoletTM iS50 傅里叶红外光谱仪,赛默飞世尔科技(中国)有限公司;H1850R高速冷冻离心机,湖南湘仪试验室仪器开发有限公司;BK-FD150冷冻干燥机,山东博科生物产业有限公司;F-7100荧光分光光度计,日本岛津仪器有限公司;SU3800扫描电子显微镜,日本日立公司;MOS-450圆二色谱仪,比奥罗杰中国有限公司。
1.2.1 PPP的制备
参照张晓维[16]的聚乙二醇沉淀法从鸡蛋中提取卵黄高磷蛋白。根据宋丽等[17]的酶解法制备PPP,即超纯水配制10 mg/mL的卵黄高磷蛋白溶液,0.1 mol/L的HCl溶液调节pH值至6.5,对其进行高温加压处理(121 ℃、0.10 MPa、15 min)。接着添加胰蛋白酶(酶与底物的质量比为1∶50),在pH 8.0、50 ℃下酶解4 h,随后在95 ℃下灭酶活力15 min。然后加入底物(卵黄高磷蛋白)质量分数5%的碱性蛋白酶,在40 ℃下酶解1.5 h,再次灭酶活力15 min。酶解液冷却后,在10 000×g离心10 min,最后将上清液冻干得到的样品即为PPP。
1.2.2 PPP-DX制备的工艺优化
将5 mg/mL PPP水溶液与DX按一定质量比混合,调节pH值并加热一定时间以促使湿法加热美拉德反应发生。反应完成后立即冰水浴中冷却终止反应。反应样品放入10 000 Da的透析袋中,用去离子水中透析24 h,接着以966×g离心10 min,最后将上清液冷冻干燥以获得PPP-DX。
影响湿法加热的美拉德反应的因素主要有反应物质量比、pH、温度和时间[18]。以接枝度为参考指标,考察各因素对PPP-DX制备的影响。
1.2.2.1 单因素实验
(a)PPP与DX质量比对反应接枝度的影响:将PPP与DX按1∶1、1∶2、1∶3、1∶4和1∶5的质量比混合,在90 ℃、pH 7.0的条件下反应180 min;
(b)体系pH对反应接枝度的影响:将PPP与DX按1∶3的质量比混合,分别将pH值调节至6.0、7.0、8.0、9.0和10.0,在90 ℃下反应180 min;
(c)温度对反应接枝度的影响:将PPP与DX按1∶3的质量比混合,调节pH值至7,在60、70、80、90、100 ℃下反应180 min;
(d)时间对反应接枝度的影响:将PPP与DX按1∶3的质量比混合,调节pH值至7,在90 ℃下反应90、120、150、180、210 min。
1.2.2.2 响应面实验设计
在单因素实验结果的基础上,以质量比、pH、温度和时间设计四因素三水平响应面实验,以接枝度为评价指标,得出最佳制备工艺。响应面实验设计如表1所示。
表1 响应面优化实验因素水平
Table 1 Level of experimental factors for response surface optimization

水平因素-101A-质量比1∶21∶31∶4B-pH678C-温度/℃8090100D-时间/min150180210
1.2.3 接枝度测定
参考曹琳等[19]的方法,使用OPA法测量接枝度。将80 mg OPA溶于2 mL甲醇中,与50 mL 0.1 mol/L四硼酸钠溶液、5 mL 200 g/L十二烷基硫酸钠溶液和200 μL β-巯基乙醇溶液混合,混合均匀后加入超纯水定容至100 mL得到OPA试剂,现用现配。200 μL样品(PPP和PPP-DX)和4 mL OPA试剂混合,在35 ℃的水浴中孵育2 min后,在340 nm处测定该样品溶液的吸光度,接枝度按公式(1)计算:
接枝度![]()
(1)
式中:A0,PPP在340 nm处的吸光度;A1,PPP-DX在340 nm处的吸光度。
1.2.4 PPP-DX结构表征
1.2.4.1 傅里叶红外光谱
将1 mg样品与160 mg KBr放入玛瑙研钵中混合均匀研磨,然后放入模具中压片,制成透明样品[17]。采集范围为4 000~400 cm-1,分辨率为4.0 cm-1,每个样品扫描16次,每次扫描前扣除KBr的背景。
1.2.4.2 圆二色谱分析
将PPP和PPP-DX样品用超纯水配制成0.1 mg/mL的溶液,在光程为0.1 cm的石英池中,对这些样品在190~260 nm的波长范围内进行了3次扫描,使用超纯水作为空白校正。二级结构组成采用杨氏算法(https://bestsel.elte.hu/index.php)进行计算[7]。
1.2.4.3 荧光光谱分析
采用荧光分光光度计对PPP和PPP-DX构象的变化进行评估,将PPP和PPP-DX样品用超纯水配制成1 mg/mL的溶液,在激发波长280 nm,发射波长范围为300~500 nm,狭缝宽度为2.5 nm,电压为600 mV的条件下获得荧光光谱[20]。
1.2.4.4 微观结构分析
使用扫描电子显微镜观察PPP和PPP-DX的微观结构,取适量的PPP和PPP-DX样品均匀涂抹在附有导电胶的载物台然后进行喷金,处理完成后将样品放入样品室后抽真空,上机扫描拍照。加速电压5 kV,放大倍数500倍。
1.2.5 PPP-DX和PPP钙结合能力测定
参考WU等[2]的方法并稍作修改,5 mg/mL的PPP-DX水溶液与50 mmol/L的CaCl2水溶液,将混合物以1∶1的质量比混合,0.1 mol/L的HCl溶液调节pH值至7.5,恒温50 ℃振荡40 min.反应完成后加入9倍体积的95%(体积分数)乙醇醇沉,在10 743×g离心20 min,弃上清液取沉淀物进行冷冻干燥得到PPP-DX与钙形成的复合物(PPP-DX-Ca)。
PPP与钙形成的复合物(PPP-Ca)的制备参考宋丽等[17]的制备方法,PPP用0.02 mmol/L Tris-HCl溶液(pH 7)配制成5 mg/mL的溶液。在PPP溶液中加入50 mmol/L CaCl2溶液,得到肽钙质量比为5∶1的混合液在40 ℃反应50 min,结束后加入9倍体积无水乙醇静置沉淀1 h,最后在13 000×g离心30 min,取沉淀冻干。
采用邻甲酚酞比色法[7]测量PPP-Ca和PPP-DX-Ca钙结合能力。在96孔板每孔加入50 μL钙标准样品,再加150 μL显色液,测定吸光度值,以钙含量为自变量x,以吸光度y为因变量,得到标准曲线方程(y=2.057 9x+0.029 6,R2=0.999 2),测量样品时,使用冻干样品配制1 mg/mL的水溶液,取50 μL样品溶液,再加150 μL显色液,测定样品的吸光度。然后通过标准曲线计算样品中的钙含量,按公式(2)计算钙结合量:
钙结合量![]()
(2)
式中:m1,样品中钙的质量g;m2,样品质量g。
1.2.6 PPP-DX的胃肠消化稳定性
在模拟胃肠道条件下评价PPP-Ca和PPP-DX-Ca的消化稳定性,模拟消化液的制备根据BRODKORB等[21]的方法。
胃阶段:8 mL的模拟胃液与8 mL 5 mg/mL的样品,用6 mol/L HCl溶液将其pH值调整为3.0,37 ℃、110 r/min孵育120 min。在0、30、60、120 min后取出2 mL消化液,并在100 ℃水浴灭酶10 min终止反应。
肠阶段:等量模拟肠液与从胃液中收集的食糜混合。用0.1 mol/L NaOH溶液将其pH值调整为7.0,37 ℃、110 r/min孵育4 h。在180、240、300、360 min时分别收集2 mL消化液并加入胰酶抑制剂终止反应。
总钙测定:不同时间的消化液以8 702×g离心15 min,取上清液,利用钙含量显色检测试剂盒测定钙含量;
游离钙测定:离心后的消化液样品取1 mL样品分别加入9 mL无水乙醇(稀释10倍),静止1 h再次进行离心8 702×g,4 ℃离心15 min测上清液的Ca2+。按公式(3)计算钙释放率。
钙释放率![]()
(3)
式中:m0,样品中总钙含量,m1,样品中游离钙含量。
所有试验重复进行3次,使用SPSS 20软件对数据进行分析,P<0.05为具有显著差异。响应面分析采用Design Expert 13软件,制图使用Origin 2021软件。
2.1.1 单因素试验
美拉德反应是蛋白质游离氨基和还原糖羰基之间的共价结合,接枝度表示反应前后的游离氨基含量的变化,接枝度越大,说明反应越完全。单因素试验结果如图1所示。
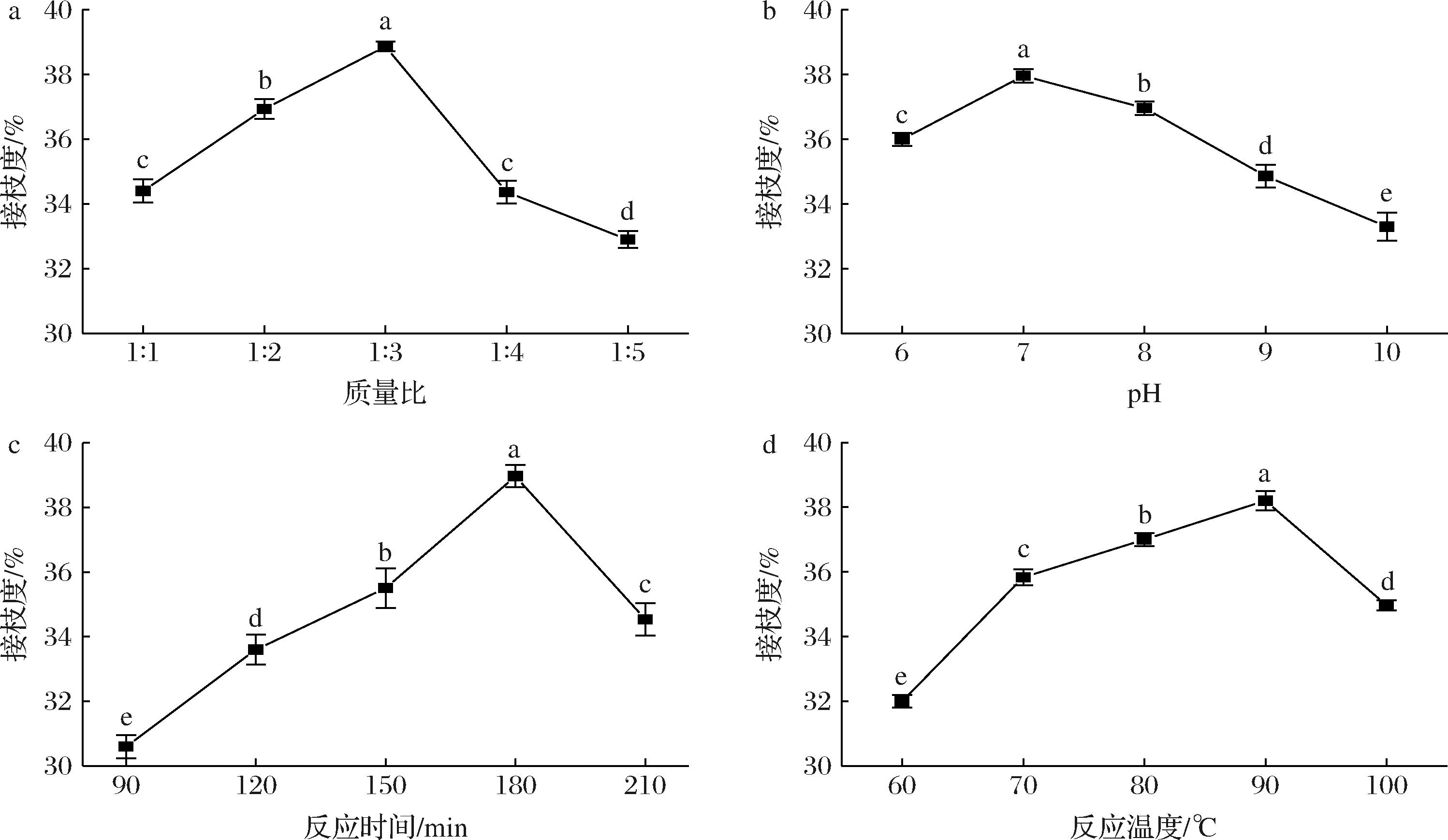
a-质量比;b-pH;c-反应时间;d-反应温度
图1 PPP与DX质量比、pH、反应时间、反应温度对接枝度的影响
Fig.1 Effect of the mass ratio of PPP to DX, pH, reaction time, and reaction temperature on grafting degree
注:不同小写字母表示具有显著性差异,P<0.05。
如图1-a所示,随着PPP与DX质量比的增加,接枝度先上升后下降,在1∶3时接枝度达到最大值,为(38.86±0.15)%。随着DX比例的增大,多糖提供的反应位点比较多,PPP易与DX接触从而有利于反应的进行,使得接枝度上升[11];但当DX过多时,由于多糖的空间位阻增大,降低了PPP与DX之间的接触概率,反而不利于反应的进行,导致接枝度下降[22]。因此,适当的比例有助于增加肽与多糖之间的有效碰撞,从而促进PPP-DX的形成,提高接枝度[22]。选择PPP与DX质量比1∶3为中位数进行响应面优化试验。
由图1-b,随着pH的增大,接枝度呈现先增加后减小的趋势。pH=7时达到最大值,为(37.96±0.20)%,这是因为pH影响多肽的溶解度,当反应环境的pH从酸性增加到中性时,PPP的溶解度增加,使溶液中的DX与PPP的反应部位充分接触,接枝度增加。美拉德反应控制在初级反应阶段,pH值继续增加到碱性时,美拉德反应的中间阶段会产生杂环化合物,如吡啶、呋喃等,这些降低了DX的利用率和接枝度[15]。在碱性环境中氨基反应较强烈,也更易发生褐变反应[23],因此选择pH=7作为中位数进行响应面试验。
随着糖基化时间的增加,接枝度呈现先升高再下降的趋势(图1-c),180 min达到最大值,为(38.96±0.35)%,反应初期PPP中游离氨基逐渐暴露与DX中羰基结合发生反应,接枝度随着反应时间延长而增大[19]。当反应达到一定时间后,有效的羰基和游离氨基减少,从而阻碍糖基化改性,同时在美拉德反应后期,部分已接枝的结合物可能发生降解,导致接枝度降低[20]。因此选择反应时间180 min作为中位数进行响应面试验。
随着反应温度的升高,接枝度呈现先增加后降低的趋势(图1-d),在90 ℃达到最大值,为(37.81±0.35)%。温度决定了溶液中分子的布朗运动速度,温度的升高有助于加速分子间的运动。PPP与DX分子运动增大,接触速率增大,因此接枝度显著提高。温度过高的情况下,多肽开始聚集,游离氨基减少[24],因此与多糖分子的反应速率降低,接枝度显著下降。因此选择反应温度90 ℃作为中位数进行响应面试验。
2.1.2 响应面优化结果
响应面试验方案与结果如表2所示,通过方差分析检验模型的充分性和显著性,如表3所示,回归模型极显著(P<0.000 1),失拟项不显著(P>0.05),模型拟合程度比较好,试验误差较小。可用于对PPP-DX制备进行分析预测二次多项式回归模型:Y=39.33-0.188 83A+0.017 5B+0.50C+0.644 2D-0.472 5AB-0.39AC+0.275AD-0.18BC+0.6BD+1.03CD-3.67A2-1.62B2-2.31C2-2.39D2。响应面相关系数拟合系数![]() 即该模型可解释97.14%的响应面变化,预测数据中的变化量
即该模型可解释97.14%的响应面变化,预测数据中的变化量![]() 为0.929 1,两者差值<0.2,说明此模型与试验之间拟合程度较高,适合用于优化PPP-DX的制备工艺。由F值可判断出各因素对接枝度的影响顺序为(D)时间>(C)温度>(A)PPP与DX质量比>(B)pH。
为0.929 1,两者差值<0.2,说明此模型与试验之间拟合程度较高,适合用于优化PPP-DX的制备工艺。由F值可判断出各因素对接枝度的影响顺序为(D)时间>(C)温度>(A)PPP与DX质量比>(B)pH。
表2 响应面试验方案与结果
Table 2 Response surface experimental design and results
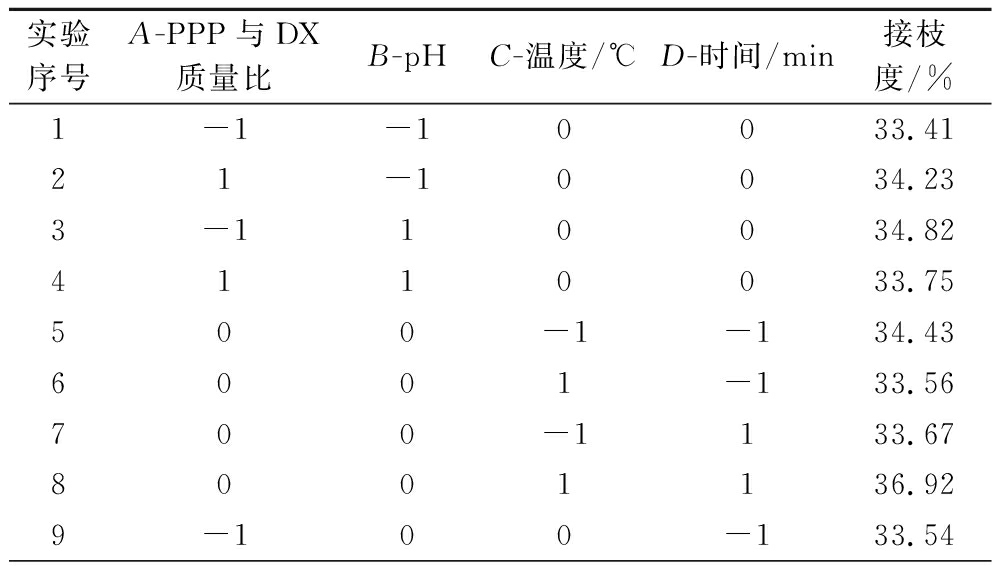
实验序号A-PPP与DX质量比B-pHC-温度/℃D-时间/min接枝度/%1-1-10033.4121-10034.233-110034.824110033.75500-1-134.436001-133.56700-1133.678001136.929-100-133.54
续表2
实验序号A-PPP与DX质量比B-pHC-温度/℃D-时间/min接枝度/%10100-131.9511-100133.8312100133.33130-1-1034.811401-1034.94150-11035.9916011035.4017-10-1032.541810-1033.3619-101034.3120101033.57210-10-135.2122010-133.88230-10135.7424010136.8125000039.2726000039.1827000039.0028000039.3629000039.82
表3 响应面试验方差分析
Table 3 Analysis of variance of response surface
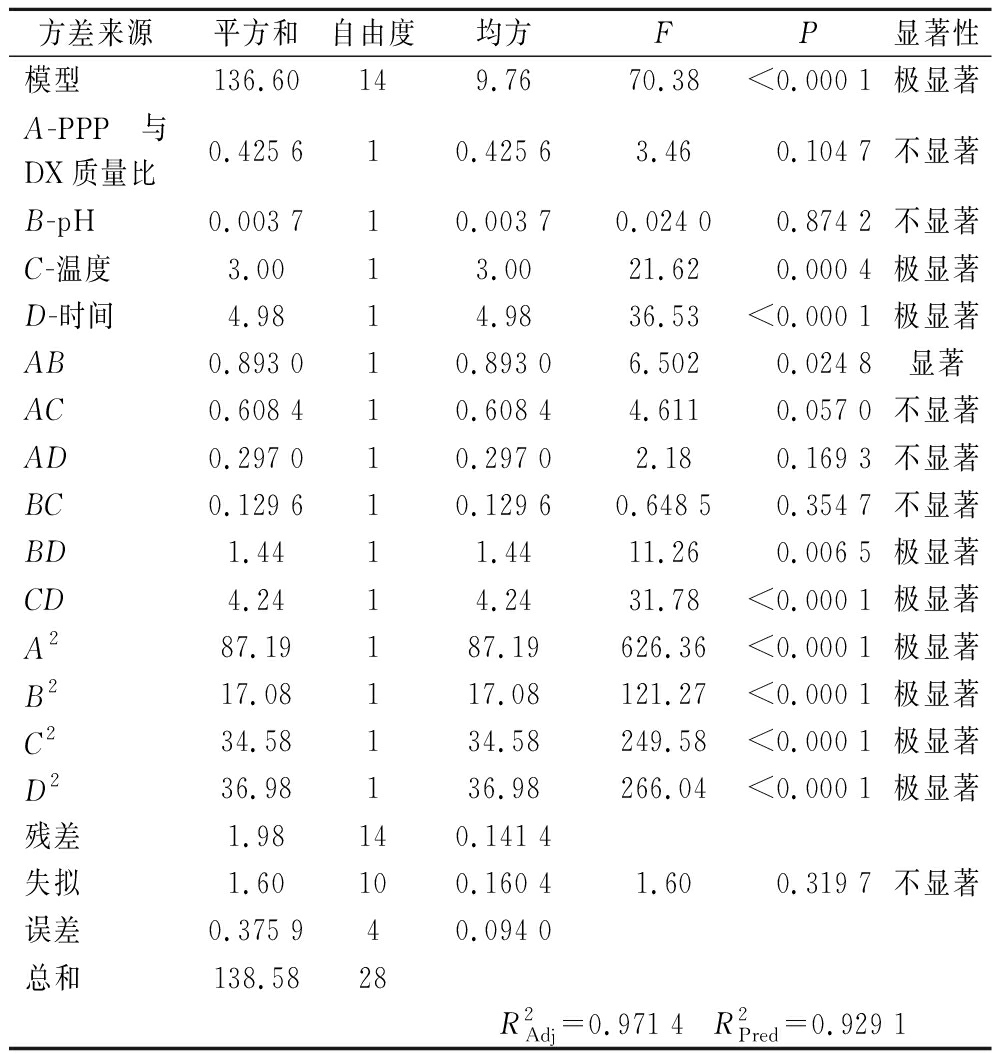
方差来源平方和自由度均方FP显著性模型136.60149.7670.38<0.000 1极显著A-PPP与DX质量比0.425 610.425 63.460.104 7不显著B-pH0.003 710.003 70.024 00.874 2不显著C-温度3.0013.0021.620.000 4极显著D-时间4.9814.9836.53<0.000 1极显著AB0.893 010.893 06.5020.024 8显著AC0.608 410.608 44.6110.057 0不显著AD0.297 010.297 02.180.169 3不显著BC0.129 610.129 60.648 50.354 7不显著BD1.4411.4411.260.006 5极显著CD4.2414.2431.78<0.000 1极显著A287.19187.19626.36<0.000 1极显著B217.08117.08121.27<0.000 1极显著C234.58134.58249.58<0.000 1极显著D236.98136.98266.04<0.000 1极显著残差1.98140.141 4失拟1.60100.160 41.600.319 7不显著误差0.375 940.094 0总和138.5828R2Adj=0.971 4 R2Pred=0.929 1
响应面优化理论结果为PPP与DX质量比1∶2.97,pH 7.03,时间185.07 min、温度91.47 ℃,预测接枝度39.42%。综合操作等实际因素,调整条件PPP与DX质量比1∶3,pH 7,时间185 min、温度90 ℃,在此条件下经验证接枝率为(39.12±0.43)%,与预测值无显著性差异。结果表明模型的适用性及条件优化的成功。许多研究已经采用湿法美拉德反应制备多肽-多糖偶联物,刘丽莉等[25]采用湿法美拉德制备卵白蛋白肽-DX偶联物,利用响应面优化后接枝度达到(35.67±0.74)%;张志颖等[20]利用正交试验优化亚麻籽胶改性乳清蛋白的制备工艺,最佳接枝度为25.07%。本研究经湿法美拉德反应制备的PPP-DX具有较高接枝度。
2.2.1 傅里叶红外光谱
傅里叶红外光谱常用于鉴定化合物中官能团变化情况,是研究多肽与多糖相互作用的一种有效方法。如图2所示,在3 700~3 200 cm-1,PPP和DX吸收带较宽主要由羟基拉伸振动和N—H变形振动的引起,然而PPP-DX具有更宽的吸收峰,这可能是由于引入了DX的羟基基团加强了氢键,且与N—H的振动吸收峰重叠而峰型变宽[26]。PPP和PPP-DX分别在2 886.9 cm-1和2 890.1 cm-1处有吸收峰,均是由CH2不对称伸缩引起的[27]。1 700~1 600 cm-1的特征吸收峰是酰胺Ⅰ带,主要来源于C![]() O的伸缩振动;N—H变化和C—N拉伸导致酰胺Ⅲ带(1 450~1 240 cm-1)吸收峰的变化,与PPP相比,PPP-DX酰胺Ⅰ带的吸收峰从1 648.2 cm-1至1 645 cm-1,且酰胺Ⅲ带的吸收峰发生变化,表明PPP的氨基与DX的羰基之间是共价结合,消耗了氨基[28]。DX在1 180~953 cm-1处出现一系列重叠峰,它被称为“糖”带,源自C—O—C、C—C和C—O的拉伸振动以及C—H的弯曲模式[25],PPP-DX具有DX的特征峰且都高于PPP,与芝麻蛋白水解物-阿拉伯胶美拉德偶联物红外谱图变化一致[27]。PPP和DX相互作用的位点主要存在于PPP的—NH2上。
O的伸缩振动;N—H变化和C—N拉伸导致酰胺Ⅲ带(1 450~1 240 cm-1)吸收峰的变化,与PPP相比,PPP-DX酰胺Ⅰ带的吸收峰从1 648.2 cm-1至1 645 cm-1,且酰胺Ⅲ带的吸收峰发生变化,表明PPP的氨基与DX的羰基之间是共价结合,消耗了氨基[28]。DX在1 180~953 cm-1处出现一系列重叠峰,它被称为“糖”带,源自C—O—C、C—C和C—O的拉伸振动以及C—H的弯曲模式[25],PPP-DX具有DX的特征峰且都高于PPP,与芝麻蛋白水解物-阿拉伯胶美拉德偶联物红外谱图变化一致[27]。PPP和DX相互作用的位点主要存在于PPP的—NH2上。
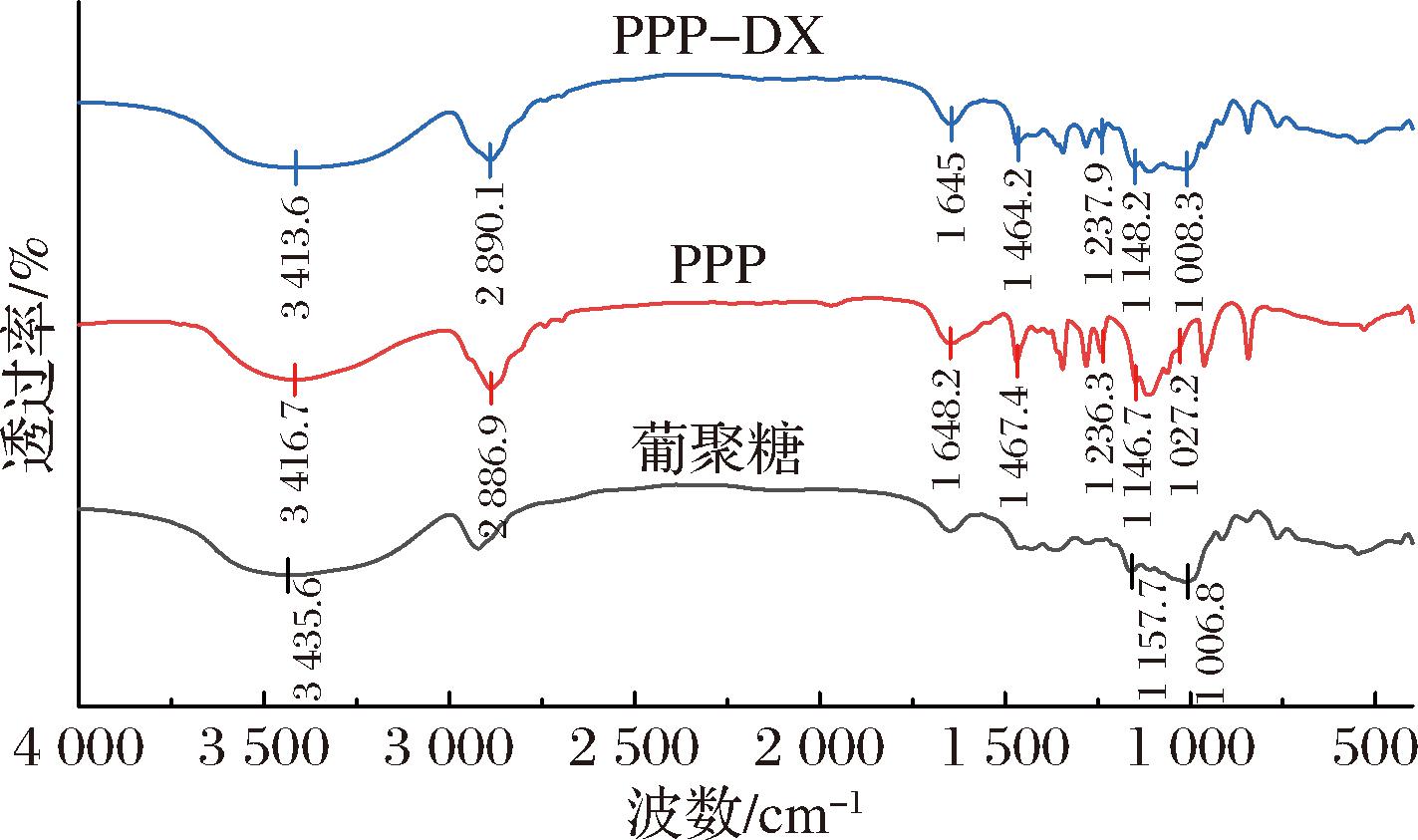
图2 PPP-DX,PPP和DX的傅里叶红外光谱图
Fig.2 FTIR spectra of PPP-DX, PPP, and DX
2.2.2 圆二色谱分析
采用圆二色谱法表征PPP和PPP-DX二级结构含量的变化。如图3所示,与PPP相比,PPP-DX的α-螺旋和β-转角含量分别降低了52.04%和47.10%以及β-折叠含量增加了62.93%,改变了PPP-DX的二级结构,α-螺旋区的氨基与DX的羰基共价结合,导致PPP-DX的α-螺旋结构减少,傅里叶红外光谱中也证明了PPP的氨基与DX的羰基发生反应,导致蛋白质内作用力的破坏和分子间作用力的重排,从而将更多的α-螺旋转化为β-折叠。PPP-DX的α-螺旋和β-折叠位于多肽链的内部,由于美拉德反应的发生,内部空间结构被破坏,从而促进了分子内和分子间氢键结构的破坏。同时,β-折叠含量增加可能与β-转角弱氢键结构转变为强氢键β-折叠有关,这与加热制备的绿豆分离蛋白-麦芽糖糊精偶联物二级结构变化一致[29]。
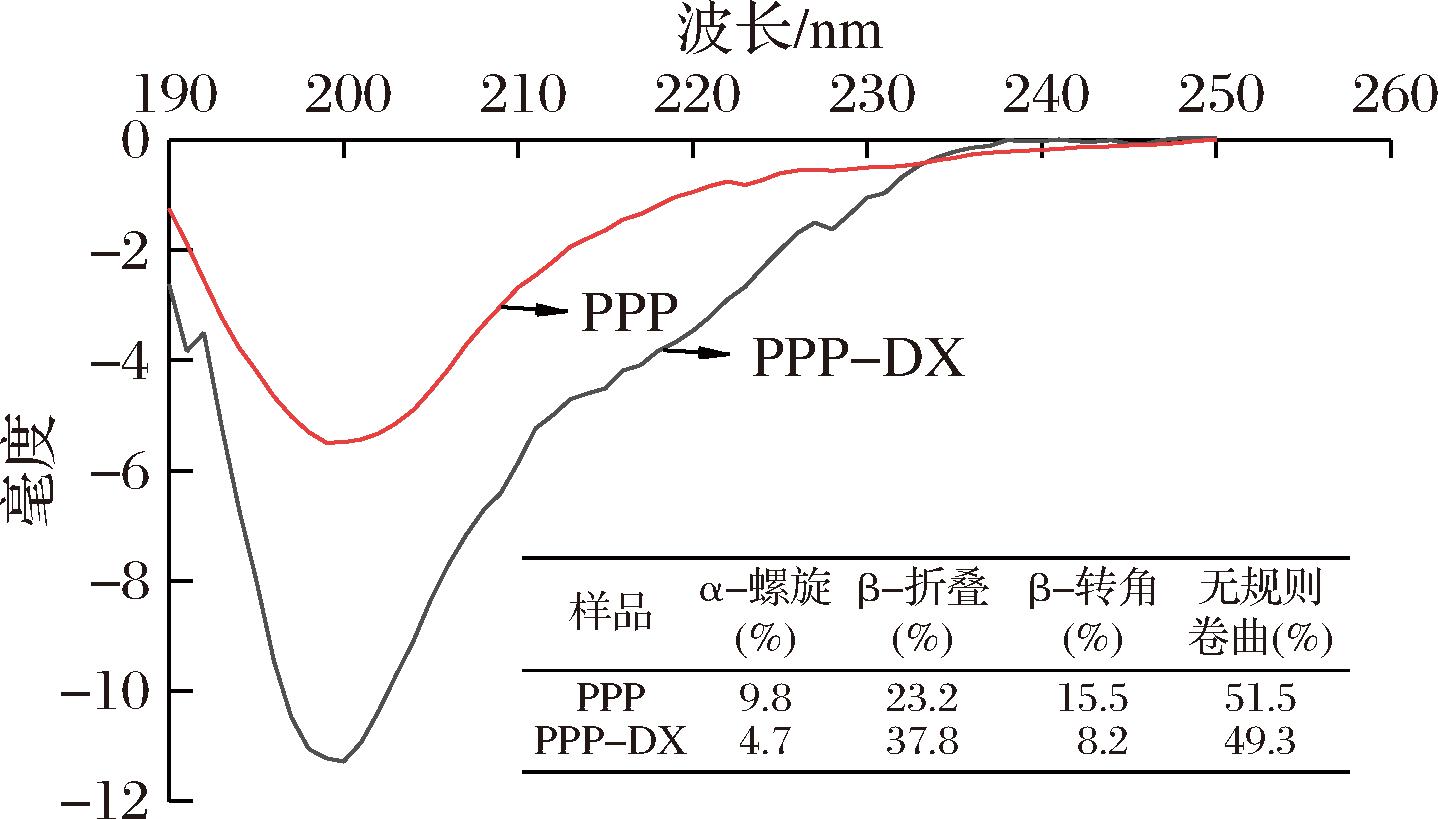
图3 PPP-DX、PPP圆二色谱图
Fig.3 CD spectra of PPP-DX and PPP
2.2.3 荧光光谱分析
内源性荧光光谱可以用来反映芳香族氨基酸荧光强度的变化,通常是色氨酸的荧光发射被用作蛋白质/多肽构象变化的指示剂[20]。如图4所示,在280 nm激发波长下,PPP的最大发射波长为357.2 nm,PPP-DX的荧光强度显著降低并且发生红移,一个原因是美拉德反应后,PPP-DX构象发生改变,圆二色谱也证实了美拉德反应后PPP构象发生变化[18]。另外一个原因是美拉德反应过程中PPP中的其他氨基酸接入了DX分子,屏蔽了PPP的色氨酸荧光发射强度,造成了光谱吸收强度下降[30]。

图4 PPP-DX、PPP荧光光谱图
Fig.4 Fluorescence spectra of PPP-DX and PPP
2.2.4 微观结构分析
如图5所示,DX为表面平整光滑的球状,PPP为碎片化薄片状,而PPP-DX表面呈现出凹凸不平、多孔的结构,球状的DX附着在片状的PPP上,且碎片状PPP逐渐开始融合,表观形态逐渐从碎片状变为有孔隙的片状。这种现象也证实了PPP与DX之间发生了偶联反应从而引起结构变化,该结果与傅里叶红外光谱、荧光光谱以及圆二色谱的结果一致。

a-DX;b-PPP;c-PPP-DX
图5 扫描电镜图(500×)
Fig.5 SEM images (500×)
PPP-Ca和PPP-DX-Ca中钙结合量分别为(74.33±4.39) mg/g和(159.06±2.19) mg/g。PPP-DX的钙结合量优于PPP,提高了1.14倍。这与之前的研究结果相似,CPP与DX的偶联物(CPP-DX)较CPP的钙结合量从15.76 mg/g提高到了48.33 mg/g[31]。这是因为美拉德反应有助于增强偶联物中活性基团的阳离子结合能力,DX是电中性的,不会在PPP-DX偶联物与Ca2+之间产生静电排斥[31];同时扫描电镜显示PPP-DX偶联物的多孔结构也增加了与钙的接触面,从而提高其钙结合量。此外,PPP-DX-Ca中钙结合量显著高于CPP-DX偶联物-钙复合物,表明PPP-DX有作为高效钙补充剂的潜力。
研究了PPP-Ca和PPP-DX-Ca在体外胃肠阶段的消化稳定性。如图6所示,PPP-DX-Ca和PPP-Ca在前2 h的胃消化阶段钙释放率分别为(43.33±1.52)%和(72.33±2.08)%。此外,接下来4 h的肠道消化阶段的钙释放率分别为(83.66±1.52)%和(87.00±1.00)%,表明PPP-DX降低了Ca2+在胃液中的降解速率。这是由于美拉德反应致使PPP的结构发生改变,偶联的DX在PPP表面产生了一定的空间位阻效应,减少了胃蛋白酶的水解作用,从而保护肽-钙在胃部环境中的稳定性[32],已有相关研究证实多肽-多糖复合物可以有效保护多肽中的钙稳定性,降低其在胃液中的降解速率,例如COS修饰核桃肽MMGGED制备钙递送体系COS-MMGGED-Ca在模拟胃液消化后,钙释放率从MMGGED-Ca的60.27%降低到了52.35%[33]。这些结果表明,PPP-DX可以有效保护Ca2+在胃液中的稳定性并在肠道中快速释放,达到控释的作用。
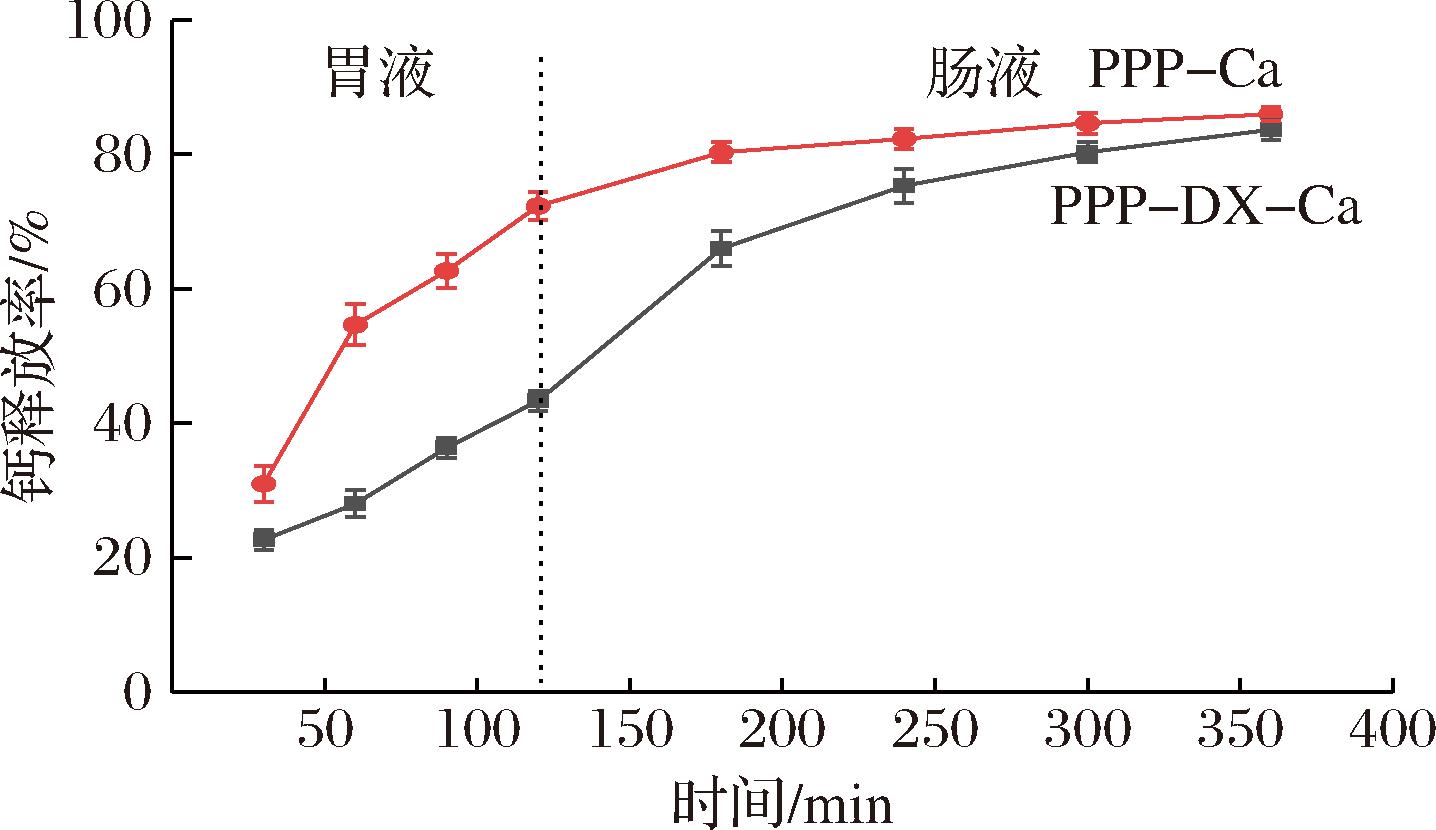
图6 PPP-Ca和PPP-DX-Ca在不同消化阶段的钙释放曲线
Fig.6 Calcium release curves of PPP-Ca and PPP-DX-Ca at different digestion stages
PPP-DX最佳制备条件为PPP与DX的质量比1∶3,pH值7,加热温度90 ℃、加热时间185 min,经验证,接枝率为(39.12±0.43)%。可证实美拉德反应是PPP的氨基与DX的羰基发生反应。PPP中的α-螺旋和β-转角转变为β-折叠,PPP-DX荧光强度降低,发生红移,DX的加入导致PPP变得凹凸不平有孔隙。此外,PPP-DX-Ca的钙结合量比PPP-Ca提高了1.14倍。与PPP-Ca相比,PPP-DX-Ca表现出良好的胃肠消化稳定性。本研究基于美拉德反应制备的PPP-DX-Ca具有更高的钙结合能力、胃肠稳定性,对新型钙补充剂的开发具有重要意义。
[1] LIN S T, LI J, HU X, et al.Potential dietary calcium supplement:Calcium-chelating peptides and peptide-calcium complexes derived from blue food proteins[J].Trends in Food Science &Technology, 2024, 145:104364.
[2] WU X P, WANG F F, CAI X X, et al.Glycosylated peptide-calcium chelate:Characterization, calcium absorption promotion and prebiotic effect[J].Food Chemistry, 2023, 403:134335.
[3] SUN N, WU H T, DU M, et al.Food protein-derived calcium chelating peptides:A review[J].Trends in Food Science &Technology, 2016, 58:140-148.
[4] WU X P, HU Y Y, ZHENG S H, et al.Food-derived calcium chelating peptides:Biological functional components for better calcium bioavailability[J].Trends in Food Science &Technology, 2024, 150:104595.
[5] QI L W, ZHANG H R, GUO Y J, et al.A novel calcium-binding peptide from bovine bone collagen hydrolysate and chelation mechanism and calcium absorption activity of peptide-calcium chelate[J].Food Chemistry, 2023, 410:135387.
[6] WU W M, HE L C, LIANG Y H, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284:80-89.
[7] SI K, GONG T T, DING S Y, et al.Binding mechanism and bioavailability of a novel phosvitin phosphopeptide (Glu-Asp-Asp-pSer-pSer) calcium complex[J].Food Chemistry, 2023, 404:134567.
[8] ZHANG X W, JIA Q, LI M Y, et al.Isolation of a novel calcium-binding peptide from phosvitin hydrolysates and the study of its calcium chelation mechanism[J].Food Research International, 2021, 141:110169.
[9] SONG L, CHEN Y, LIU Z T, et al.Preparation, characterization, and stability assessment of a nano-delivery system loaded with phosvitin phosphopeptide-calcium chelate[J].Food Bioscience, 2023, 56:103306.
[10] 李军, 涂宗财, 沙小梅, 等.反应条件对牛血清白蛋白-葡萄糖体系糖基化产物形成的影响[J].食品与发酵工业, 2019, 45(5):87-93;100.LI J, TU Z C, SHA X M, et al.Effects of reaction conditions on the formation of glycosylation products of bovine serum albumin-glucose system[J].Food and Fermentation Industries, 2019, 45(5):87-93;100.
[11] 王海燕, 李佳璇, 韦利芬, 等.川芎蛋白-葡聚糖共聚物的制备工艺优化及其抗氧化性[J].食品研究与开发, 2023, 44(17):90-98.WANG H Y, LI J X, WEI L F, et al.Preparation process optimization of Ligustrum chuanxiong protein-dextran conjugate and its antioxidant properties[J].Food Research and Development, 2023, 44(17):90-98.
[12] 丁俭, 黄祯秀, 杨梦竹, 等.食源蛋白水解物/多肽与糖类物质美拉德反应产物在食品应用中的研究进展[J].食品科学, 2023, 44(1):305-318.DING J, HUANG Z X, YANG M Z, et al.Review and prospect of Maillard reaction products from food-derived protein hydrolysates/peptides and saccharides in food application and research[J].Food Science, 2023, 44(1):305-318.
[13] GAO A, DONG S, WANG X, et al.Preparation, characterization and calcium release evaluation in vitro of casein phosphopeptides-soluble dietary fibers copolymers as calcium delivery system[J].Food Chemistry, 2018, 245:262-269.
[14] ZHAO M G, MA A M, HE H, et al.Desalted duck egg white peptides-chitosan oligosaccharide copolymers as calcium delivery systems:Preparation, characterization and calcium release evaluation in vitro and vivo[J].Food Research International, 2020, 131:108974.
[15] CHEN L, LIN S Y, HE X Q, et al.Characterization and in vitro calcium release of the novel calcium-loaded complexes using Antarctic krill protein and pectin:Effect of different blending sequences[J].Food Research International, 2024, 190:114589.
[16] 张晓维. 卵黄高磷蛋白的分离纯化、结构表征及功能特性研究[D].武汉:华中农业大学, 2014.ZHANG X W.Preparation, structure characterization and function of phosvitin from hen egg yolk[D].Wuhan:Huazhong Agricultural University, 2014.
[17] 宋丽, 朱临娴, 宋璐杉, 等.钙结合卵黄高磷蛋白磷酸肽的制备及其肽钙螯合物的结构表征[J].食品科学, 2023, 44(6):125-133.SONG L, ZHU L X, SONG L S, et al.Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate[J].Food Science, 2023, 44(6):125-133.
[18] URANGO A C M, MEIRELES M A A, SILVA E K.Maillard conjugates produced from proteins and prebiotic dietary fibers:Technological properties, health benefits and challenges[J].Trends in Food Science &Technology, 2024, 147:104438.
[19] 曹琳, 欧阳及锦, 韩梅, 等.糖基化对罗非鱼皮胶原蛋白肽热滞活性及结构特征的影响[J].食品与发酵工业, 2023, 49(1):176-184.CAO L, OUYANG J J, HAN M, et al.Effects of glycosylation on thermal hysteresis activity and structural characteristics of collagen peptides from tilapia skin[J].Food and Fermentation Industries, 2023, 49(1):176-184.
[20] 张志颖, 张琳璐, 白英, 等.亚麻籽胶-乳清蛋白改性物的制备及抗氧化性[J].食品与发酵工业, 2023, 49(1):146-153.ZHANG Z Y, ZHANG L L, BAI Y, et al.Preparation and antioxidant activity of flaxseed gum-whey protein[J].Food and Fermentation Industries, 2023, 49(1):146-153.
[21] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[22] 姜岚. 葡聚糖-酪蛋白磷酸肽-Ca2+递送体系的构建与评价[D].天津:天津科技大学, 2021.JIANG L.Construction and evaluation of dextran-casein phosphopeptide-Ca2 + delivery system[D].Tianjin:Tianjin University of Science and Technology, 2021.
[23] 张园园, 黄欣, 颜丹云, 等.酪蛋白酸钠-燕麦β-葡聚糖美拉德产物的制备及其性质[J].精细化工, 2022, 39(9):1901-1907.ZHANG Y Y, HUANG X, YAN D Y, et al.Preparation and properties of sodium caseinate-oat β-glucan conjugates obtained by the Maillard reaction[J].Fine Chemicals, 2022, 39(9):1901-1907.
[24] CHEN K N, YANG Q F, HONG H, et al.Physicochemical and functional properties of Maillard reaction products derived from cod (Gadus morhua L.) skin collagen peptides and xylose[J].Food Chemistry, 2020, 333:127489.
[25] 刘丽莉, 李玉, 杨陈柳, 等.糖基化卵白蛋白肽的制备工艺优化及特性与结构分析[J].食品与发酵工业, 2018, 44(8):181-187.LIU L L, LI Y, YANG C L, et al.Optimization of glycosylation process of ovalbumin peptide and its characterization and structure analysis[J].Food and Fermentation Industries, 2018, 44(8):181-187.
[26] 常雨晴, 顾盼, 张霖雯, 等.糖的种类对海参蛋白美拉德反应产物性质影响研究[J].中国食品添加剂, 2023, 34(5):39-47.CHANG Y Q, GU P, ZHANG L W, et al.Effects of sugar types on the properties of Maillard reaction products from sea cucumber protein[J].China Food Additives, 2023, 34(5):39-47.
[27] PARANDI E, MOUSAVI M, ASSADPOUR E, et al.Sesame protein hydrolysate-gum Arabic Maillard conjugates for loading natural anthocyanins:Characterization, in vitro gastrointestinal digestion and storage stability[J].Food Hydrocolloids, 2024, 148:109490.
[28] QU W J, ZHANG X X, HAN X, et al.Structure and functional characteristics of rapeseed protein isolate-dextran conjugates[J].Food Hydrocolloids, 2018, 82:329-337.
[29] AZIZNIA S, ASKARI G, EMAMDJOMEH Z, et al.Effect of ultrasonic assisted grafting on the structural and functional properties of mung bean protein isolate conjugated with maltodextrin through Maillard reaction[J].International Journal of Biological Macromolecules, 2024, 254:127616.
[30] ZHAO Z L, WANG W D, CHEN J, et al.Effect of ultrasound-assisted Maillard reaction on functional properties and flavor characteristics of oyster protein enzymatic hydrolysates[J].Ultrasonics Sonochemistry, 2024, 111:107113.
[31] JIANG L, LI S H, WANG N, et al.Preparation of dextran-casein phosphopeptide conjugates, evaluation of its calcium binding capacity and digestion in vitro[J].Food Chemistry, 2021, 352:129332.
[32] ZHONG L, XU J, HU Q H, et al.Improved bioavailability and antioxidation of β-carotene-loaded biopolymeric nanoparticles stabilized by glycosylated oat protein isolate[J].International Journal of Biological Macromolecules, 2024, 263:130298.
[33] WANG Z L, LIU L T, JIANG H F, et al.Glycated walnut meal peptide-calcium chelates (COS-MMGGED-Ca):Preparation, characterization, and calcium absorption-promoting[J].Food Chemistry, 2025, 462:140975.