花椒系芸香科花椒属,是一类传统的药食两用植物。花椒激发的麻味来源于其中的天然不饱和脂肪酸酰胺类物质,这类物质能够激活感觉神经元从而产生“麻”感[1],因此花椒中的酰胺类物质也被广泛称为麻味物质。麻味是衡量花椒品质的主要指标之一,可作为花椒分类的重要依据,麻味感受与花椒酰胺类物质含量、种类以及结构密切相关[2]。酰胺类物质属于氨基酸衍生物,是花椒中一类独特的次级代谢产物,可由脱羧和一系列化学修饰产生,其胺端通过酰胺键与12或14个碳的不饱和脂肪酸结合。脂肪链上具有共轭结构,双键位置和顺反异构的变化产生了不同种的酰胺类物质[3-4],如羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素和异羟基-γ-山椒素等。研究表明,花椒中这类烷基酰胺具有神经保护、镇痛麻醉、抗菌抗炎、光保护等多种药理活性[5-7],从花椒中提取酰胺类物质不仅能为花椒的风味研究提供基础性原料,更是研究其药理活性的基础性步骤。但花椒酰胺脂肪链上的不饱和结构化学稳定性极差[8],这限制了其在食品风味和生物医药领域的广泛应用,如何有效提高花椒酰胺物质在溶剂中的稳定性一直是国内外研究热点。
低共熔溶剂(deep eutectic solvent, DES)是一类由二元或多元的廉价且安全的组分通过氢键作用络合而形成的共晶混合物,其独特的分子间相互作用和排列使其对天然活性物质具有特殊的增溶和稳定作用。近年来DES被广泛应用于各种天然活性成分的提取,王夜梅等[9]利用DES从柑橘籽中提取柠檬苦素类化合物,能够达到较高的提取效率。陈珏[10]研究了DESs对丹酚酸B稳定性的影响及其作为口服制剂药物载体的可行性,明确DES是一种低毒且具有良好稳定性能的新型溶剂。相较于传统的离子溶液(ionic liquid, IL),DES的“绿色”属性更强,不仅原料廉价,制备也更简单,具有良好的生物降解性与低毒性,这使得DES在“绿色溶剂”中更具潜力。DES的制备过程简单,只需加热搅拌或研磨以增加熵,使得组分间达到共熔状态,没有副产物,不需要纯化最终产品。DES作为溶剂具有广谱极性,可通过调控氢键受体(hydrogen bond acceptor, HBA)和氢键供体(hydrogen bond donor,HBD)的种类和比例,针对不同目标物的特点设计、筛选出高效的DES[11]。
酰胺类物质有亲脂的脂肪酸基团,常用的提取方法有植物油浸提法、有机溶剂提取法、超临界流体提取法等。植物油提取得率低,有机溶剂提取有毒有污染,超临界提取设备昂贵,无法实现规模化[12]。本研究选用氯化胆碱、无水甜菜碱作为HBA,丙三醇、丙二醇、尿素、葡萄糖、蔗糖、乙酰丙酸作为HBD,制备不同组合的DESs。比较分析不同溶剂对羟基-α-山椒素的提取率差异和紫外光照射下的降解动力学,再结合傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)技术探究DES对酰胺类物质化学稳定性的保护作用及其机理,这对花椒酰胺类物质稳态化开发具有重要意义,为DES应用于天然产物的提取奠定基础。
红花椒采自中国四川汉源,新鲜红花椒采收后在40 ℃下烘干6 h至恒定质量,粉碎,过40目筛,于4 ℃储存备用。氯化胆碱、无水甜菜碱、丙三醇、丙二醇、尿素、葡萄糖、蔗糖、乙酰丙酸(均为分析纯),中国上海阿拉丁试剂有限公司;甲醇(色谱级)、乙醇(色谱级)、乙腈(色谱级)、碱性三氧化二铝(分析级),成都科龙化工试剂厂;羟基-α-山椒素(纯度≥95%),成都麦德生科技有限公司。
DF-101S集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;H1750R高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;RE-5299旋转蒸发仪,上海道京仪器有限公司;PHS-3C pH计,杭州奥立龙仪器有限公司;SNB-2黏度计,上海天美天平仪器有限公司;DDS-11A电导仪,上海雷磁创益仪器仪表有限公司;Aglient 1260 Infinity Ⅱ高效液相色谱仪,美国安捷伦科技有限公司;ZW40Z20W紫外灯,杭州亚光照明灯饰有限公司;Nicolet 6700傅里叶红外光谱仪,美国热电公司。
参考SANG等[13]的方法,并加以适当修改,制备了7种DES,不同DES的编号及组成见表1。首先,将各组分在40 ℃烘干4 h,分别称取HBA(氯化胆碱、甜菜碱)和HBD(丙三醇、丙二醇、尿素、葡萄糖、蔗糖、乙酰丙酸)按摩尔比1∶2混合于圆底烧瓶,再添加质量分数为20%的水,封口防止吸收额外的水分。将体系置于恒温加热磁力搅拌器中85 ℃搅拌2 h直至溶液均一透明,自然冷却至室温后无沉淀或絮状物析出,即成功制备DES。取出部分溶液进行pH、密度、电导率和黏度等理化性质检测,剩余样品存放于干燥器中待用。
表1 DESs的组分及英文缩写
Table 1 Components and English abbreviations of DES
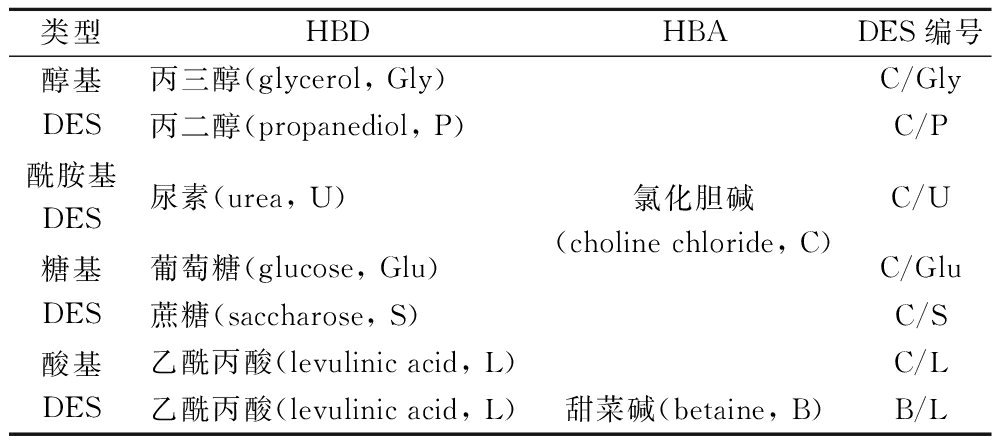
类型HBDHBADES编号醇基DES酰胺基DES糖基DES酸基DES丙三醇(glycerol, Gly)丙二醇(propanediol, P)尿素(urea, U)葡萄糖(glucose, Glu)蔗糖(saccharose, S)乙酰丙酸(levulinic acid, L)乙酰丙酸(levulinic acid, L)氯化胆碱(choline chloride, C)甜菜碱(betaine, B)C/GlyC/PC/UC/GluC/SC/LB/L
参考ZHAO等[14]的提取方法,并适当修改,提取工艺流程如图1所示,取10 g干花椒粉置于带塞圆底烧瓶,加入100 mL DES,密封后将圆底烧瓶置于恒温搅拌器中,在45 ℃下400 r/min搅拌2 h。待混合液冷却至室温后4 000 r/min离心20 min,取上清液通过碱性三氧化二铝柱进行柱层析分离(先取适量脱脂棉塞入10 mL移液管中压实,然后取10 g碱性三氧化二铝倒入其中夯实)。用色谱级甲醇进行洗脱,收集层析液,减压蒸干得到酰胺类物质提取物。同时用甲醇作为对照溶剂,提取操作与DES组一致。
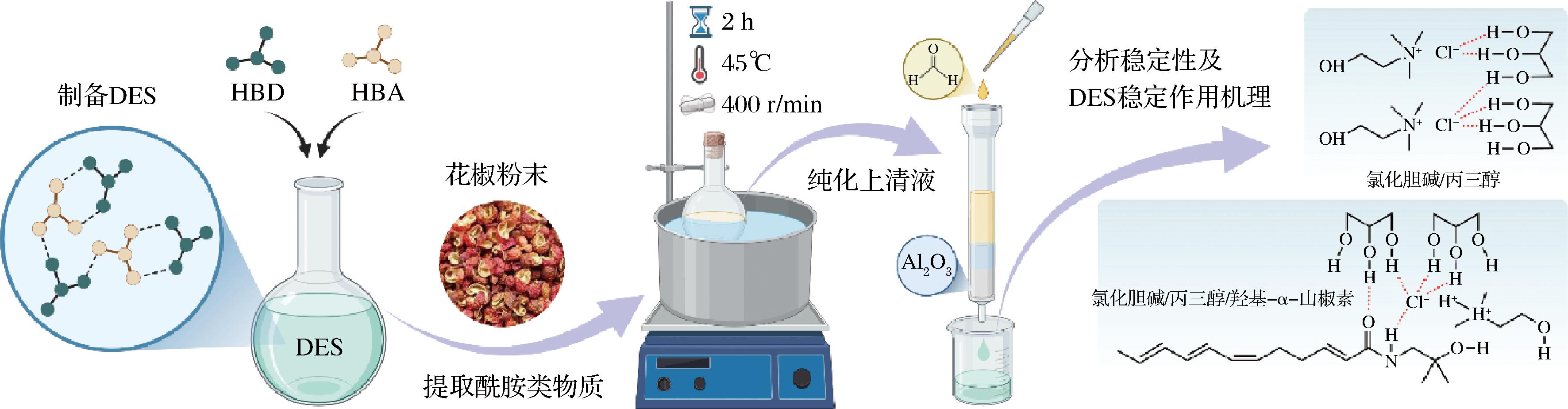
图1 花椒酰胺类物质的DES提取工艺流程图
Fig.1 Flowchart of the DES extraction process for alkylamides from Zanthoxylum bungeanum
羟基-α-山椒素标准溶液用色谱级甲醇配制,以吸收峰面积为纵坐标,标准品浓度为横坐标绘制标准曲线。提取物检测溶液用色谱级甲醇稀释,并过0.22 μm有机滤膜。
用安捷伦1260高效液相色谱系统定量检测酰胺类物质。配备Eclipse plus C18色谱柱(φ4.6 mm×250 mm, 5 μm)。流动相:A为水,B为乙腈。梯度洗脱条件:0~10 min, 45% B;10~30 min, 45%~50% B;30~35 min, 50%~65% B;35~40 min, 65%~100% B;35~40 min, 100%~45% B。柱温保持在30 ℃;流速和进样量分别设定为0.5 mL/min和20 μL;紫外检测波长270 nm。
对于液体样品:(a)DES组和(c)羟基-α-山椒素DES溶液组(1 000 μg/mL),分别取1滴加入KBr晶片,压成薄膜;对于固体样品:(b)羟基-α-山椒素组,称取1 mg羟基-α-山椒素加入100 mg KBr研磨混合,压制成片。空白KBr作为背景,置于红外光谱仪中检测,设置扫描范围为4 000~400 cm-1。
参考AGUILAR等[15]的方法适当调整,将提取物用色谱级甲醇或DES稀释至1 000 μg/mL,用石英试剂瓶装10 mL稀释好的样品溶液放入装有紫外灯的黑暗密闭空间,用40 W紫外灯对样品连续照射,分别在照射0、15、30、45、60、90 min时取样,用色谱级甲醇稀释10倍后,过0.22 μm有机膜,进行HPLC检测。
以高效液相色谱峰面积为纵坐标,建立羟基-α-山椒素标准品的浓度标准曲线。通过HPLC检测提取物得到相应的峰面积,代入标准曲线计算羟基-α-山椒素含量。酰胺类物质提取率按公式(1)计算:
提取率![]()
(1)
式中:c,提取物中酰胺类物质的质量浓度(以羟基-α-山椒素计),μg/mL;V,样品定容体积,mL;d,溶液稀释倍数;m,样品质量,g;w,水分含量,%。
参考CHEN等[16]的研究方法,以紫外光照射后羟基-α-山椒素保留率为指标,探究不同溶剂对酰胺类物质稳定性的影响,按公式(2)、公式(3)计算一级反应动力学常数k:
r/%=(Ai/A0)×100
(2)
ln(Ai/A0)=-kt
(3)
式中:r,羟基-α-山椒素保留率,%;Ai,紫外光照射一段时间后的峰面积;A0,提取物中羟基-α-山椒素的HPLC初始峰面积;t,紫外光照射时间,min。
羟基-α-山椒素的保质期(T0.9)与半衰期(T0.5)通过将r=90%、r=50%代入公式(3)计算。
所有数据点均为重复3次实验的“平均值±标准偏差”。数据采用Excel 2019、Origin 2021进行分析与图表绘制。
根据HPLC检测结果得到标准曲线:y=143.13x+37.67,R2=0.999 7,适用质量浓度范围为5~100 μg/mL,其中y为峰面积,x为羟基-α-山椒素标准品质量浓度(μg/mL)。经标准曲线计算出提取物中酰胺类物质的浓度,再代入公式计算提取率。
制备不同的DES提取花椒粉末中的酰胺类物质,如表2所示,7种DES具有不同的理化性质。这些DES均能从花椒中提取到羟基-α-山椒素(HαSS)、羟基-β-山椒素(HβSS)、羟基-ε-山椒素(HεSS)、羟基-γ-山椒素(HγSS)和羟基-γ-异山椒素(HγISS)5种主要酰胺类物质。提取率如图2,不同DES组的提取率差异较大,有3组DES(B/L、C/P和C/L)的提取率高于甲醇组(12.71%),分别是20.78%、16.23%、14.97%,其中最主要的羟基-α-山椒素的提取率分别为15.35%、12.56%、11.31%,均高于甲醇组的9.80%。说明通过调控DES组分能够制备合适的从花椒果皮中提取酰胺类物质的DES溶剂。与其他组DES相比,酸基DES(C/L和B/L)提取效率相对更高,这可能是由于溶剂呈弱酸性,能够与弱碱性的酰胺类物质发生一定程度的酸碱中和反应[17],这在某种程度上促进了酰胺的溶解,而且与糖基DES(C/Glu和C/S)相比,酸基DES黏度更低,传质效率更高,从而提高了提取效率,可以作为提取酰胺类物质的优质DES。
表2 DESs的理化性质
Table 2 The physicochemical properties of DESs
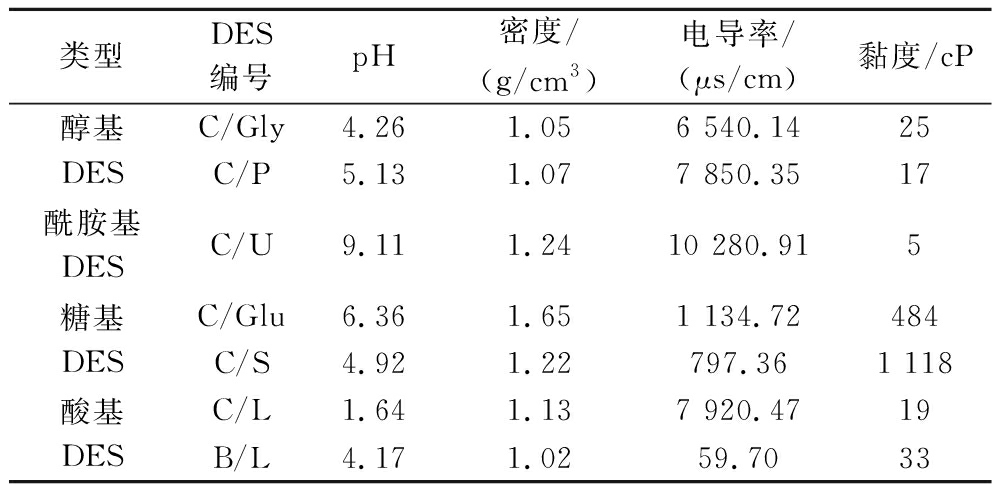
类型DES编号pH密度/(g/cm3)电导率/(μs/cm)黏度/cP醇基DESC/Gly4.261.056 540.1425C/P5.131.077 850.3517酰胺基DESC/U9.111.2410 280.915糖基DESC/Glu6.361.651 134.72484C/S4.921.22797.361 118酸基DESC/L1.641.137 920.4719B/L4.171.0259.7033
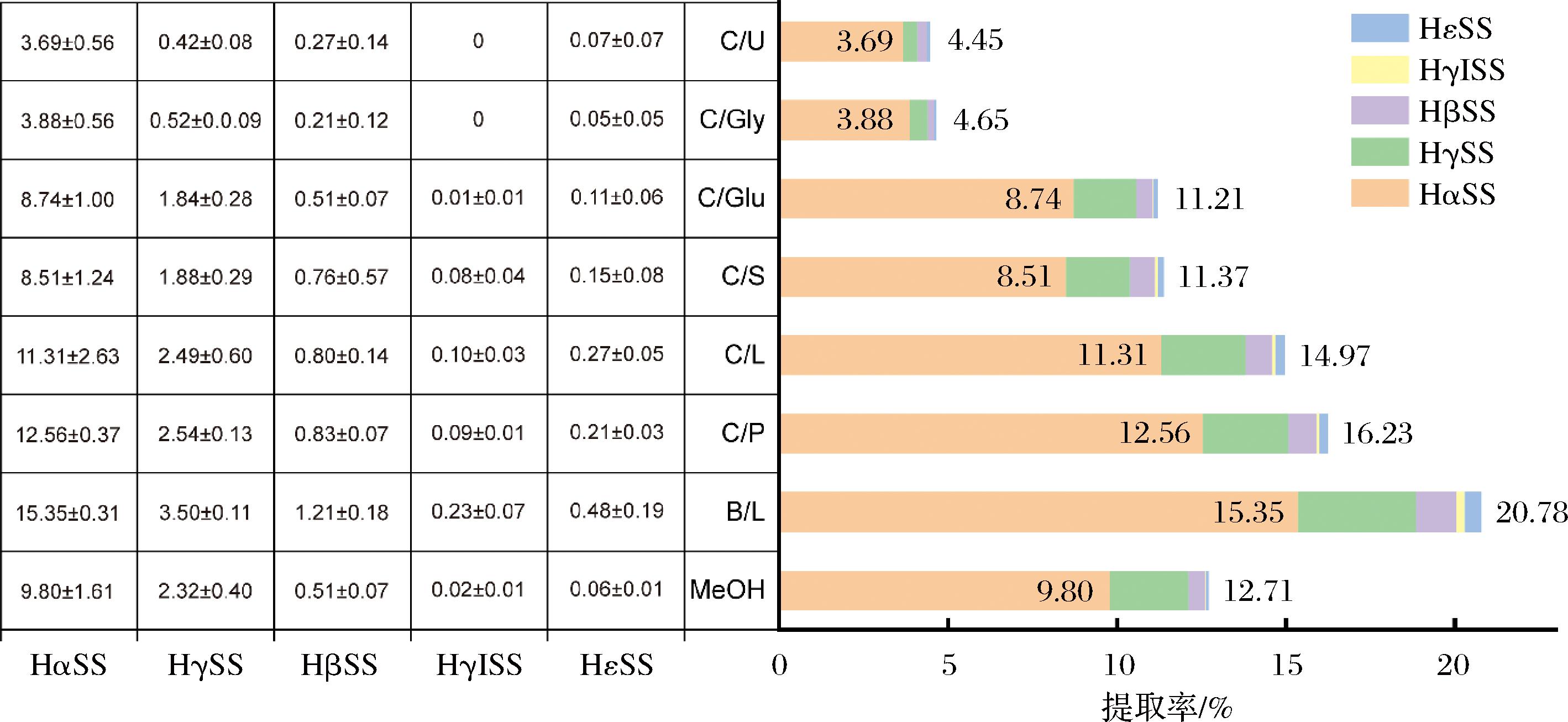
图2 不同溶剂对酰胺类物质的提取效率
Fig.2 The extraction rate of different solvents for alkylamides
对8种提取物(7个DES组与1个甲醇对照组)进行紫外光照射实验,结合HPLC检测浓度变化,探究酰胺类物质在不同溶剂中的稳定性。HPLC图谱如图3(以MeOH和C/Glu为例),溶解在甲醇中的酰胺类物质在紫外光照射下稳定性极差,在90 min时几种山椒素的峰几乎全部消失,对比同一时间的DES组,酰胺类物质的特征峰仍保持完整,直接说明了DES对酰胺类物质有较好的稳定效果。
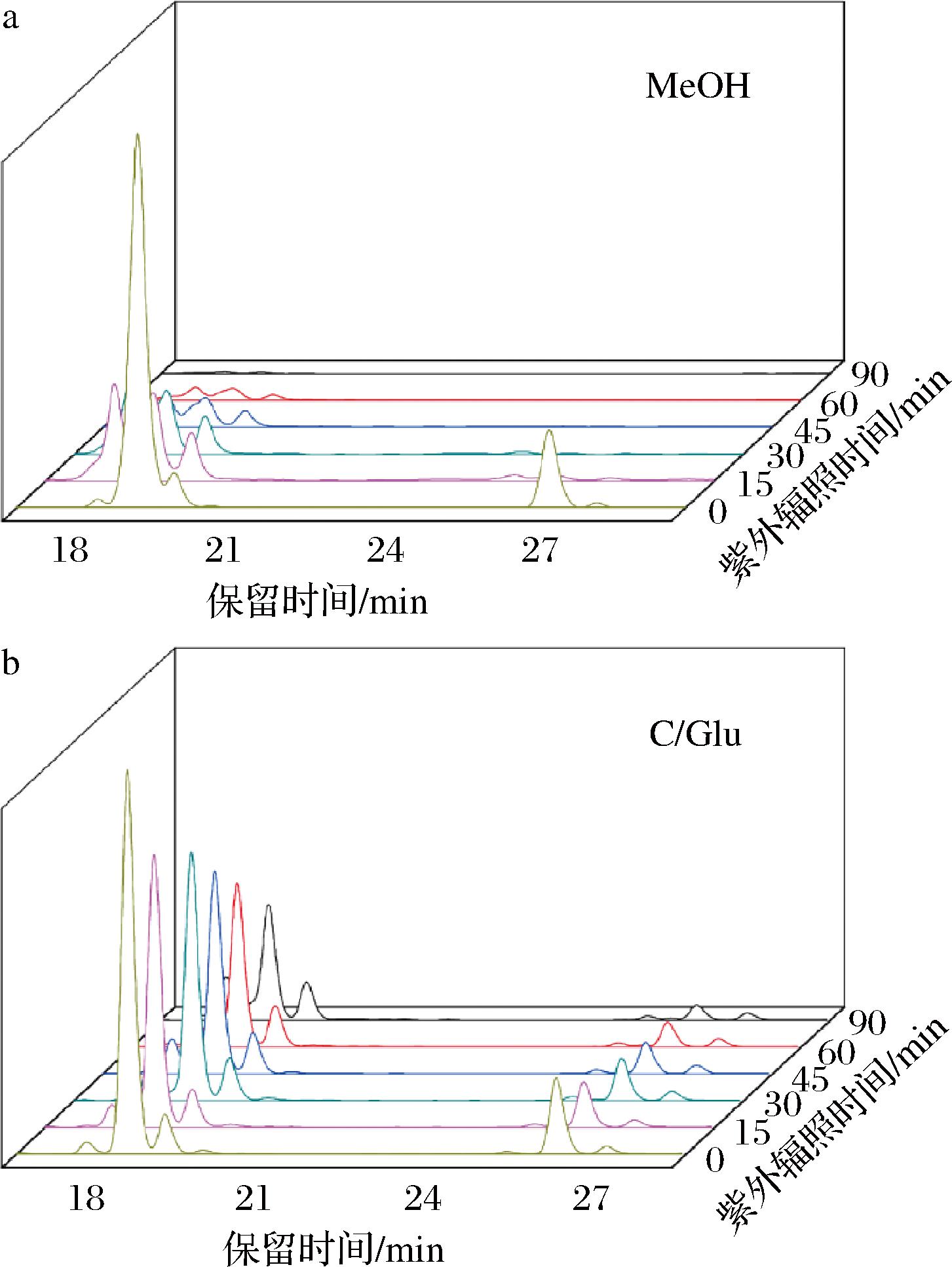
a-MeOH;b-C/Glu
图3 提取物在不同溶剂中经紫外光照射后的酰胺类物质含量变化
Fig.3 Changes in content of alkylamides in different solvents after ultraviolet irradiation
通过羟基-α-山椒素的标准曲线计算在不同溶剂中提取物经紫外光照射后羟基-α-山椒素的含量变化,计算保留率进行降解动力学分析,观察到不同溶剂中降解过程符合一级反应动力学方程,建立降解动力学曲线如图4所示,7种DES组的羟基-α-山椒素的一级降解动力学曲线远高于甲醇组,证明DES能极大改善酰胺类物质在紫外光照射条件下的化学稳定性。对保质期和半衰期计算,并进行保留率验证实验。发现T0.9和T0.5保留率分别在86.3~92.9 min和47.6~54.5 min。计算结果如表3所示,表中k值是速率常数,k值越小则保藏性越强。在紫外灯照射下,7种DES中保藏效果最好的是C/Glu,保藏效果最差的是C/U,k值分别是0.003 5和0.009 2,分别是甲醇(0.042 6)的1/12.2和1/4.6;T0.9分别是30.10 min和11.45 min,分别是甲醇(2.47 min)的12.19倍和4.64倍;T0.5分别是198.03 min和75.33 min,分别是甲醇(16.27 min)的12.17倍和4.63倍,进一步证实了DES对羟基-α-山椒素优异的保藏效果。
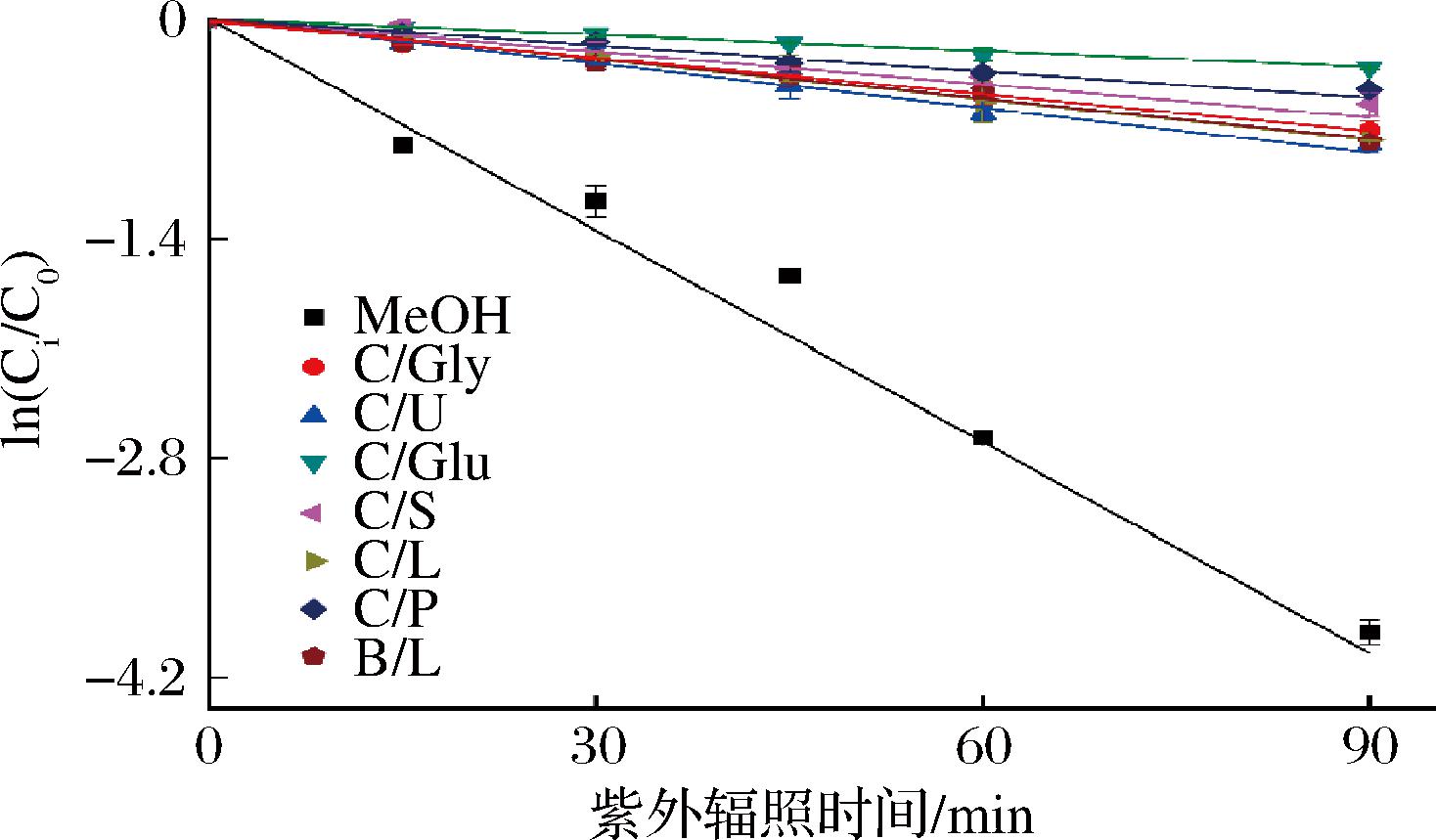
图4 不同溶剂中羟基-α-山椒素的一级降解动力学曲线
Fig.4 The first-order degradation kinetics curves of hydroxy-α-sanshool in different solvents
表3 提取物中羟基-α-山椒素在紫外光照射下的保质期与半衰期
Table 3 The shelf-life and half-life of hydroxy-α-sanshool in different extracts
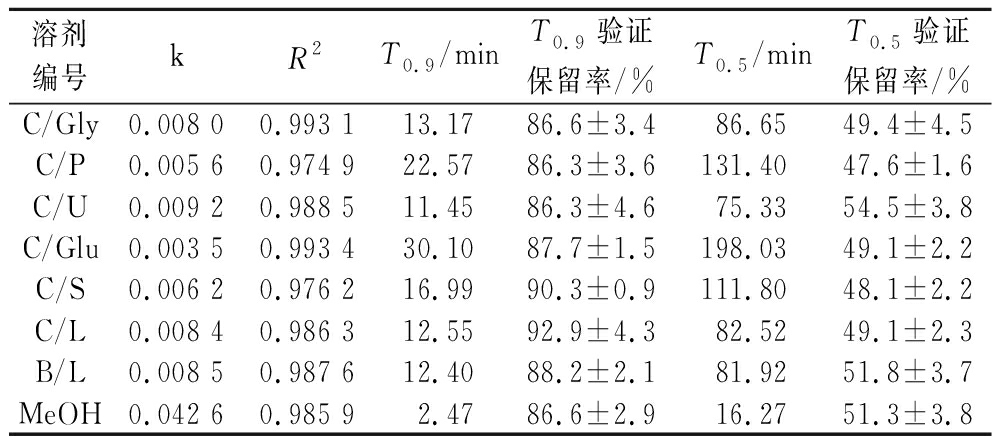
溶剂编号kR2T0.9/minT0.9验证保留率/%T0.5/minT0.5验证保留率/%C/Gly0.008 00.993 113.1786.6±3.486.6549.4±4.5C/P0.005 60.974 922.5786.3±3.6131.4047.6±1.6C/U0.009 20.988 511.4586.3±4.675.3354.5±3.8C/Glu0.003 50.993 430.1087.7±1.5198.0349.1±2.2C/S0.006 20.976 216.9990.3±0.9111.8048.1±2.2C/L0.008 40.986 312.5592.9±4.382.5249.1±2.3B/L0.008 50.987 612.4088.2±2.181.9251.8±3.7MeOH0.042 60.985 92.4786.6±2.916.2751.3±3.8
花椒酰胺类物质的脂肪链上具有共轭结构,对外界因素敏感,在常温光照下易发生转化、水解或异构化反应[4],紫外光的强作用性会加速这些转变,随着照射时间的延长,羟基-α-山椒素与其转化产物均会被破坏,从而导致酰胺物质的总量降低[18]。紫外光照射下在DES中的羟基-α-山椒素稳定性比在甲醇中更好,可能是酰胺类物质与DES体系之间发生了相互作用,从而提高了其化学稳定性。
为了进一步研究DES与酰胺类物质相互作用的机理,选择保藏效果较好、分子结构简单的C/Gly组DES进行FTIR分析,通过对DES(C/Gly)、羟基-α-山椒素(HαSS)以及含有羟基-α-山椒素的DES溶液(C/Gly/HαSS)进行FTIR分析。结果如图5-b所示,1 634 cm-1对应羟基-α-山椒素酰胺特征吸收峰Ⅰ(缔和状态下C![]() O伸缩振动),1 551 cm-1对应酰胺Ⅱ特征吸收峰(缔合状态下N—H弯曲振动),1 244 cm-1对应酰胺Ⅲ特征吸收峰(C—N伸缩振动)[16]。这些吸收特征符合HαSS的结构特征。
O伸缩振动),1 551 cm-1对应酰胺Ⅱ特征吸收峰(缔合状态下N—H弯曲振动),1 244 cm-1对应酰胺Ⅲ特征吸收峰(C—N伸缩振动)[16]。这些吸收特征符合HαSS的结构特征。
不同峰的红移和峰宽的变化提供了关键的分子相互作用的证据。由图5可知,图5-c中的C![]() O特征吸收峰相对于图5-a和图5-b发生了红移且峰宽更宽,吸收强度更大,即从1 641 cm-1(图5-a)和 1 634 cm-1(图5-b)移到1 649 cm-1(图5-c),可能是因为C/Gly的Cl-与HαSS的C
O特征吸收峰相对于图5-a和图5-b发生了红移且峰宽更宽,吸收强度更大,即从1 641 cm-1(图5-a)和 1 634 cm-1(图5-b)移到1 649 cm-1(图5-c),可能是因为C/Gly的Cl-与HαSS的C![]() O间形成了氢键;同样,—OH特征吸收峰也发生了类似现象,即3 384 cm-1(图5-a)和3 292 cm-1(图5-b)移到了3 396 cm-1(图5-c),且吸收峰的峰宽变宽,吸收强度变大,这说明HαSS的—OH与C/Gly的—OH可能形成了氢键。因为氢键的形成使参与形成氢键的原有化学键的力常数降低,吸收频率向低频移动[19]。氢键形成程度不同,对力常数的影响不同,使吸收频率有一定范围,即吸收峰变宽。形成氢键后,相应基团振动时偶极矩变化增大,因此吸收强度增大。这些光谱特征表明HαSS与C/Gly之间存在多重氢键相互作用。
O间形成了氢键;同样,—OH特征吸收峰也发生了类似现象,即3 384 cm-1(图5-a)和3 292 cm-1(图5-b)移到了3 396 cm-1(图5-c),且吸收峰的峰宽变宽,吸收强度变大,这说明HαSS的—OH与C/Gly的—OH可能形成了氢键。因为氢键的形成使参与形成氢键的原有化学键的力常数降低,吸收频率向低频移动[19]。氢键形成程度不同,对力常数的影响不同,使吸收频率有一定范围,即吸收峰变宽。形成氢键后,相应基团振动时偶极矩变化增大,因此吸收强度增大。这些光谱特征表明HαSS与C/Gly之间存在多重氢键相互作用。
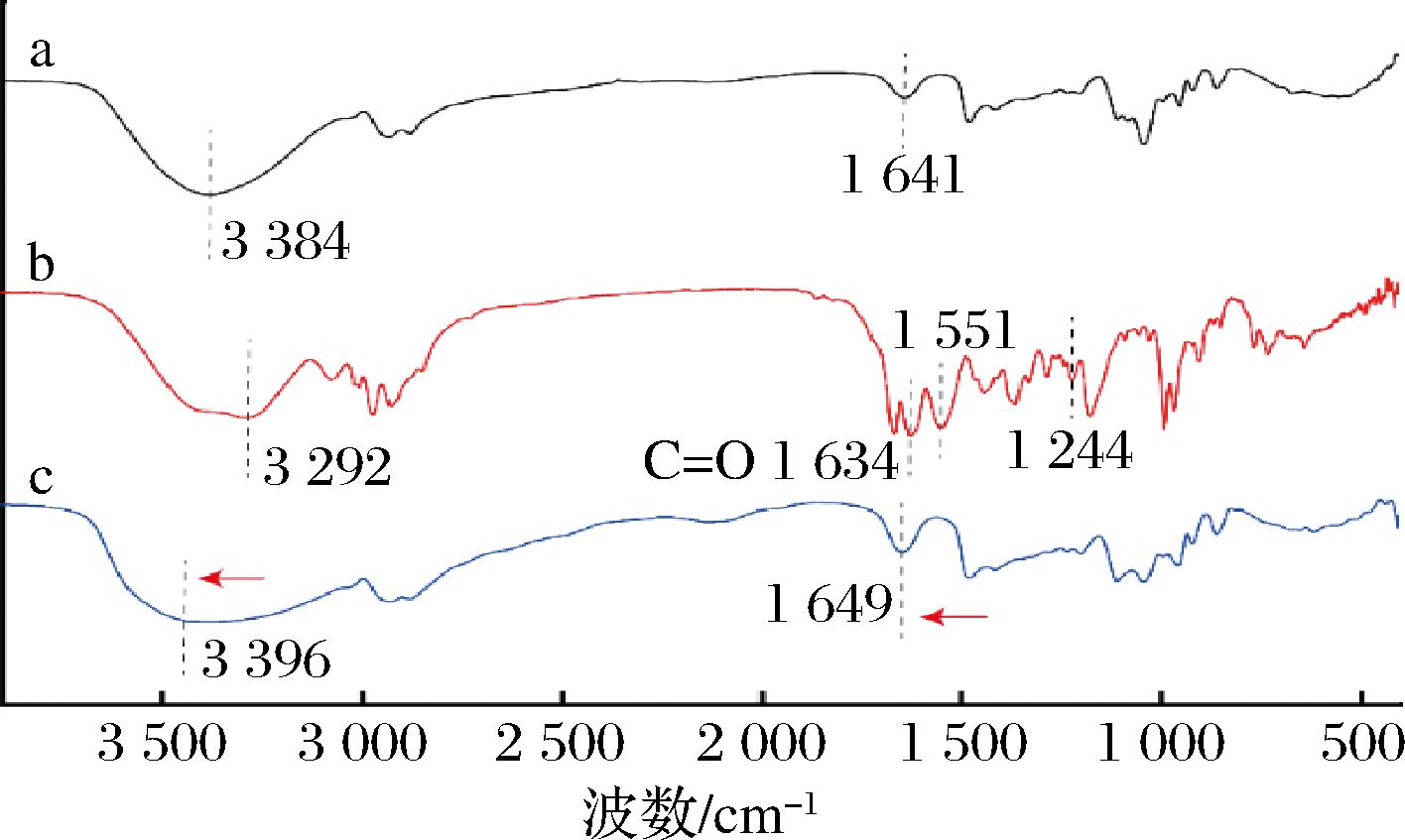
a-DES(C/Gly);b-羟基-α-山椒素(HαSS);c-含有羟基-α-山椒素的DES(C/Gly/HαSS)。
图5 红外光谱
Fig.5 Infrared spectrum
DES的合成主要是通过升温增熵,氢键受体和氢键供体在熔化温度下建立起氢键网络,形成类似于“液晶”的无色透明液体,其中所有的组分分子通过分子间和分子内氢键有序排列,构成一个稳定的网络基体[20]。根据红外光谱结果对DES的保藏机制进行了推测,溶液内各组分间的结构示意图如图6所示。HαSS含有—NH—,故能通过静电相互作用吸引大量Cl-,使得HαSS与DES间形成氢键[21],且C/Gly的—OH与HαSS的—OH和C![]() O间也能形成氢键。这种多重氢键机制进而使HαSS固定在C/Gly“晶体”中,紫外光照射在一定时间内仅能作用于“晶体”表面,无法深入到结构内部,这解释了DES为何能够延缓紫外光对羟基-α-山椒素的转化与降解作用,能够作为一种花椒酰胺类物质的保护剂,保护其在储存过程中的化学稳定性。
O间也能形成氢键。这种多重氢键机制进而使HαSS固定在C/Gly“晶体”中,紫外光照射在一定时间内仅能作用于“晶体”表面,无法深入到结构内部,这解释了DES为何能够延缓紫外光对羟基-α-山椒素的转化与降解作用,能够作为一种花椒酰胺类物质的保护剂,保护其在储存过程中的化学稳定性。
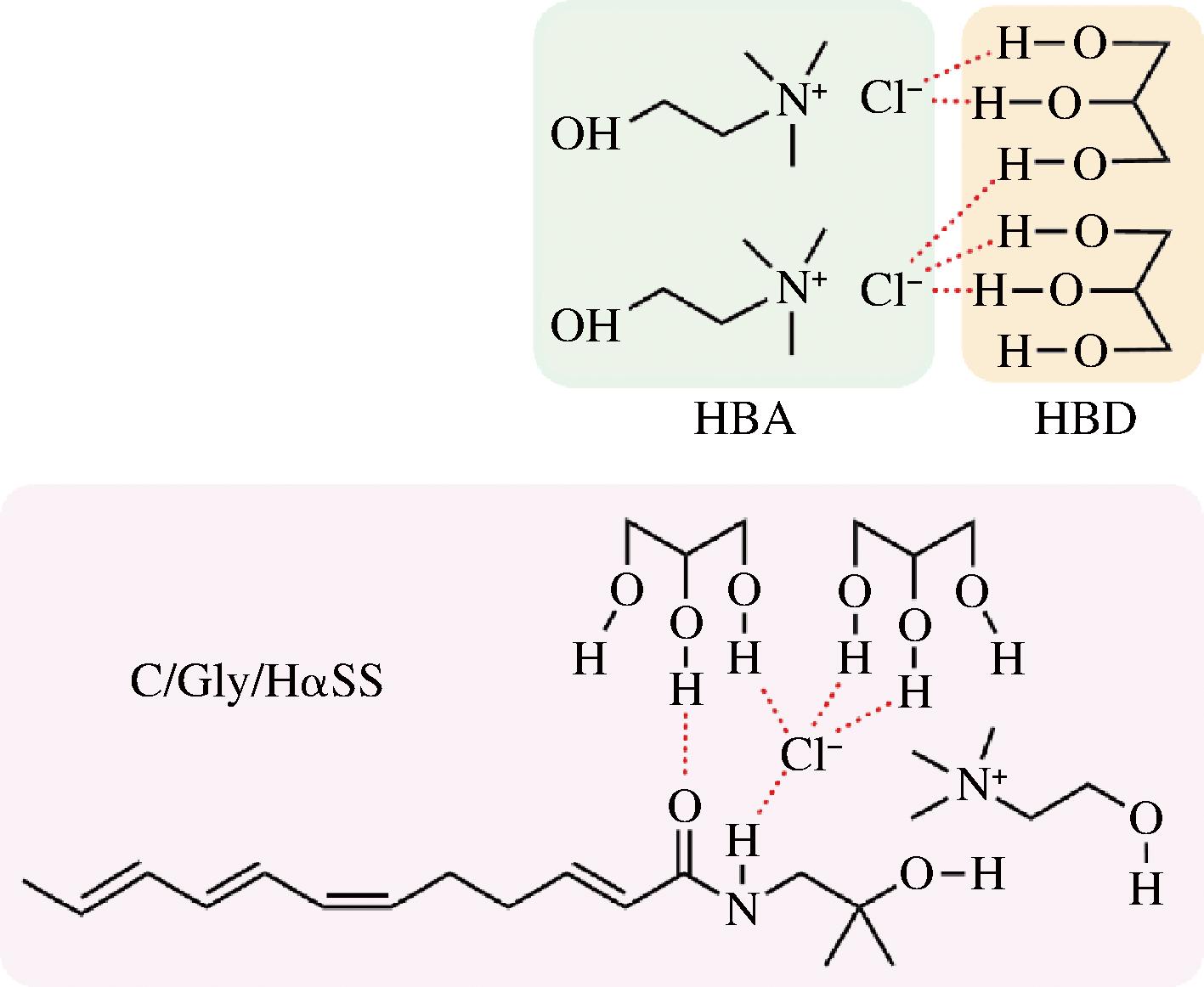
图6 分子结构示意图
Fig.6 The schematic diagram of molecular structure
注:虚线代表氢键。
DES绿色经济能针对不同目标化合物进行定制,进而能提高目标化合物的提取率。在这项工作中制备了以醇基为HBD的C/Gly和C/P,以酰胺基为HBD的C/U,以糖基为HBD的C/Glu和C/S,以酸基为HBD的C/L和B/L,从花椒中提取酰胺类物质,对比不同种类DES的提取率,发现酸基DES(B/L)的提取效率最高,远高于甲醇,能够对未来设计更多不同的提取花椒酰胺类物质的DES溶剂提供指导。
通过紫外光照射实验结合HPLC,对花椒酰胺物质在不同溶剂中的化学稳定性进行研究。发现花椒酰胺类物质提取物在不同溶剂中的降解过程均符合一级反应动力学方程,所有DES的保藏效果显著优于甲醇对照组,其中糖基DES(C/Glu)保藏效果最好。与有机溶剂(甲醇)相比,酰胺类物质在DES中的化学稳定性明显更高。利用FTIR技术对溶液中各组分的分子间结构进行分析,推测C/Gly的—OH与HαSS的—NH—、C![]() O和—OH间存在氢键相互作用。这说明DES对酰胺类物质优良的保护效果得益于其本身的黏度与氢键作用,羟基-α-山椒素被DES分子“锁”在“晶体基质”内部,阻碍了紫外光与羟基-α-山椒素的直接作用,从而延缓了羟基-α-山椒素的转化降解速率。
O和—OH间存在氢键相互作用。这说明DES对酰胺类物质优良的保护效果得益于其本身的黏度与氢键作用,羟基-α-山椒素被DES分子“锁”在“晶体基质”内部,阻碍了紫外光与羟基-α-山椒素的直接作用,从而延缓了羟基-α-山椒素的转化降解速率。
然而,目前制备得到的DES溶液仍然存在黏度大、溶解困难等缺点,在提取分离中存在一定阻碍,DES独特的优势还未被开发出来。未来还需开发出一种专门针对花椒特点的、成熟的低黏度DES,以应用于“捕捉”花椒中各种风味物质。
[1] BAUTISTA D M, SIGAL Y M, MILSTEIN A D, et al.Pungent agents from Szechuan peppers excite sensory neurons by inhibiting two-pore potassium channels[J].Nature Neuroscience, 2008, 11(7):772-779.
[2] BADER M, STARK T D, DAWID C, et al.All-trans-configuration in Zanthoxylum alkylamides swaps the tingling with a numbing sensation and diminishes salivation[J].Journal of Agricultural and Food Chemistry, 2014, 62(12):2479-2488.
[3] XU J X, LIN L W, HE M, et al.New alkylamides from the pericarps of Zanthoxylum schinifolium[J].Fitoterapia, 2024, 177:106057.
[4] 叶倩女, 石晓峰, 杨军丽.花椒属植物中酰胺类成分的结构与功能研究进展[J].中国中药杂志, 2023, 48(9):2406-2418.YE Q N, SHI X F, YANG J L.Research advance on structure and function of amides in Zanthoxylum plants[J].China Journal of Chinese Materia Medica, 2023, 48(9):2406-2418.
[5] LIU Y J, MENG X L, SUN L, et al.Protective effects of hydroxy-α-sanshool from the pericarp of Zanthoxylum bungeanum Maxim.On D-galactose/AlCl3-induced Alzheimer’s disease-like mice via Nrf2/HO-1 signaling pathways[J].European Journal of Pharmacology, 2022, 914:174691.
[6] LU I C, HU P Y, LIN C H, et al.Alkamides in Zanthoxylum species:Phytochemical profiles and local anesthetic activities[J].International Journal of Molecular Sciences, 2024, 25(22):12228.
[7] HAO D, WEN X, LIU L, et al.Sanshool improves UVB-induced skin photodamage by targeting JAK2/STAT3-dependent autophagy[J].Cell Death &Disease, 2019, 10:19.
[8] 杨瑞丽. 不同处理和贮藏条件对花椒及其制品麻味物质稳定性影响的研究[D].邯郸:河北工程大学, 2018.YANG R L.The study on the stability of numb-taste of Zanthoxylum and its product in different treatments and storage conditions[D].Handan:Hebei University of Engineering, 2018.
[9] 王夜梅, 李江南, 尹会平, 等.天然低共熔溶剂提取柑橘籽类柠檬苦素的工艺优化[J].食品与发酵工业, 2024, 50(3):174-181.WANG Y M, LI J N, YIN H P, et al.Optimization of natural extraction process of limonins from citrus seeds in deep eutectic solvents[J].Food and Fermentation Industries, 2024, 50(3):174-181.
[10] 陈珏. DESs对丹酚酸B稳定性、提取和药代动力学影响[D].太原:山西大学, 2017.CHEN J.The effect of deep eutectic solvents for stability, extraction and pharmacodynamics activity of salvianolic acid B[D].Taiyuan:Shanxi University, 2017.
[11] 叶彤彤, 林淑琼, 张俊, 等.绿色低共熔溶剂的生化特性及其多功效应用进展[J].食品与发酵工业, 2025, 51(5):361-370.YE T T, LIN S Q, ZHANG J, et al.Biochemical characteristics of green deep eutectic solvents and progress in their multi-functional applications[J].Food and Fermentation Industries, 2025, 51(5):361-370.
[12] 罗凯, 胡江, 黄秀芳, 等.花椒麻味物质的提取分离及其组分分析[J].食品科学, 2013, 34(24):88-91.LUO K, HU J, HUANG X F, et al.Extraction, purification and composition analysis of the numb-taste components of Zanthoxylum[J].Food Science, 2013, 34(24):88-91.
[13] SANG J, LI B, HUANG Y Y, et al.Deep eutectic solvent-based extraction coupled with green two-dimensional HPLC-DAD-ESI-MS/MS for the determination of anthocyanins from Lycium ruthenicum Murr.fruit[J].Analytical Methods, 2018, 10(10):1247-1257.
[14] ZHAO Z F, ZHU R X, ZHONG K, et al.Characterization and comparison of the pungent components in commercial Zanthoxylum bungeanum oil and Zanthoxylum schinifolium oil[J].Journal of Food Science, 2013, 78(10):C1516-C1522.
[15] AGUILAR K, GARV N A, LARA-SAGAH
N A, LARA-SAGAH N A V, et al.Ascorbic acid degradation in aqueous solution during UV-Vis irradiation[J].Food Chemistry, 2019, 297:124864.
N A V, et al.Ascorbic acid degradation in aqueous solution during UV-Vis irradiation[J].Food Chemistry, 2019, 297:124864.
[16] CHEN J, LI S F, YAO Z F, et al.Improved stability of salvianolic acid B from Radix Salviae miltiorrhizae in deep eutectic solvents[J].Analytical Methods, 2016, 8(11):2502-2509.
[17] DUAN L, DOU L L, GUO L, et al.Comprehensive evaluation of deep eutectic solvents in extraction of bioactive natural products[J].ACS Sustainable Chemistry &Engineering, 2016, 4(4):2405-2411.
[18] 严雅丽, 刘福权, 赵志峰, 等.花椒羟基-α-山椒素在紫外照射下的降解动力学及其转化机理研究[J].食品与机械, 2017, 33(9):26-29.YAN Y L, LIU F Q, ZHAO Z F, et al.Degradation kinetics and transformation mechanism research of hydroxy-α-sanshool from Zanthoxylum bungeanum exposed to UV radiation[J].Food &Machinery, 2017, 33(9):26-29.
[19] GAUTAM R, KUMAR N, LYNAM J G.Theoretical and experimental study of choline chloride-carboxylic acid deep eutectic solvents and their hydrogen bonds[J].Journal of Molecular Structure, 2020, 1222:128849.
[20] DAI Y T, VERPOORTE R, CHOI Y H.Natural deep eutectic solvents providing enhanced stability of natural colorants from safflower (Carthamus tinctorius)[J].Food Chemistry, 2014, 159:116-121.
[21] BAI C J, WEI Q F, REN X L.Selective extraction of collagen peptides with high purity from cod skins by deep eutectic solvents[J].ACS Sustainable Chemistry &Engineering, 2017, 5(8):7220-7227.