随着全球人口增长、健康饮食趋势的兴起以及可持续发展需求的推动,植物蛋白的需求量持续上升。植物蛋白作为动物蛋白的理想替代品,广泛来源于豆类、油料及谷物等,其中,油料因其相对较高的蛋白质含量,被认为是极具开发潜力的植物蛋白来源[1],其蛋白质主要从油菜籽、亚麻籽、奇亚籽和葵花籽等油籽饼中提取。菜籽蛋白氨基酸组成均衡,含有较高含量的赖氨酸(6.0 g/100 g)和含硫氨基酸(3~4 g/100 g)[2]。亚麻蛋白中谷氨酸和天冬氨酸的含量超过10%,不仅氨基酸种类丰富,同时具有较高的营养价值[3]。然而,由于油料蛋白的溶解性较低、乳化性能不足,限制了其在实际生产中的应用。为此,物理、化学和生物改性等技术已被用于改善油籽蛋白的功能特性,以拓展其应用范围[4]。化学改性因其操作繁琐且存在安全隐患而受到限制,酶法改性则因成本高且反应条件不稳定而存在挑战[5]。相比之下,物理改性以环保、无毒、高效等优势,在食品工业中具有广泛的应用前景。
超声波是一种绿色高效的物理改性技术,广泛应用于食品加工以及生物活性物质的提取中[6]。根据超声波频率和强度的不同,可分为低频(高强度)超声波(20~100 kHz;强度10~1 000 W/cm2)和高频(低强度)超声波(100 kHz~1 MHz;强度<1 W/cm2)[7]。低强度超声波常用作分析技术,可提供食品物化性质的相关信息。相比之下,高强度超声波可通过空化效应、机械效应和剪切应力改善溶液中蛋白质的理化性质以及结构和功能特性[8]。研究表明,超声波处理可以显著提高大豆蛋白[9]和乳清蛋白[10]等的功能特性,于淼等[9]研究表明,超声波处理通过破坏分子间的相互作用,导致游离巯基和二硫键含量变化,能够有效改善蛋白的溶解性、起泡性和乳化性。望运滔等[11]在450 W对鹰嘴豆蛋白进行了不同时间(5、10、15 min)的超声波处理,结果表明鹰嘴豆蛋白的溶解度、乳化性以及热致凝胶性随着超声波时间的增加而显著提高。XIONG等[12]研究发现,高强度超声波处理可引起豌豆分离蛋白的部分去折叠,结构趋于无序状态且颗粒尺寸减小,同时提升了其营养价值。此外,在对其他油料蛋白进行超声波处理后,AHMAD MALIK等[13]证明了超声波处理后葵花籽蛋白的流变性能和结构受到影响,使其产生了更好的功能特性,增加了在不同食品系统中的应用。值得注意的是,超声波处理的效果因处理条件和蛋白种类而异,对蛋白质理化特性产生多样化的影响。
目前,针对超声波技术在改善菜籽蛋白和亚麻蛋白功能特性方面的研究仍不够全面。因此,本研究拟通过超声波改性技术改善天然油料蛋白的功能特性。在超声波时间20 min、频率40 kHz下,探究不同超声波功率(360、480、600、720 W)对菜籽与亚麻分离蛋白品质特性的影响。分别从理化、结构、功能及消化特性4个方面进行对比分析,旨在为超声波改性油料蛋白方面提供一定的理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
菜籽分离蛋白粉末(纯度≥95%)、亚麻分离蛋白粉末(纯度≥90%),郑州博研生物科技有限公司;EDTA,沪试化学试剂有限公司;Tris,成都德斯特生物技术有限公司;5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithiobis-2-nitrobenzoic acid,DTNB),上海蓝季科技发展有限公司;胃蛋白酶(15 000 U/mg)、胰蛋白酶(30 000 U/mg)、牛血清蛋白、考马斯亮蓝G250,索莱宝科技有限公司;磷酸盐缓冲液、KH2PO4、NaOH、盐酸,均为分析纯,天津市富宇精细化工有限公司。
1.2 仪器与设备
JY92-IIDN超声细胞破碎仪,宁波新芝有限公司;RCD-1A高速分散均质机,常州越新仪器制造有限公司;RF-530内源荧光光谱仪、UV-1780紫外可见分光光度计、Nicolet-6700傅里叶红外光谱仪,岛津仪器有限公司;JSM-6610LV电镜扫描仪,日本Hitachi公司。
1.3 试验方法
1.3.1 超声波改性菜籽和亚麻蛋白
分别称取5份20.0 g菜籽分离蛋白和亚麻分离蛋白溶于1 000 mL蒸馏水中,于室温下以1 000 r/min磁力搅拌2 h,制备均匀的蛋白分散液。将超声波探头浸入蛋白分散液2 cm,设置超声波频率为40 kHz,分别在360、480、600、720 W的超声波功率下处理20 min(间歇模式:工作4 s,间隔2 s)。于-80 ℃冰箱中冻存48 h后冻干获得样品蛋白。
1.3.2 蛋白理化特性的测定
1.3.2.1 浊度
分别称取20 mg样品蛋白,用PBS缓冲液(0.01 mol/L,pH 7.0)配制成5 mg/mL蛋白溶液,室温条件下涡旋60 min使其溶解充分后,在600 nm下测定其紫外吸光度,将浊度量化为在600 nm处测得的透射光的百分比(%T600 nm)。
1.3.2.2 游离巯基
根据XIONG等[12]的方法稍作修改,分别称取10 mg样品蛋白溶于10 mL蒸馏水中,样品和Ellman以体积比为100∶1混合,其中Ellman由Tris-Gly缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,0.4 mol/L EDTA,pH 8.0)加入0.04 mL DTNB溶液(10 mmol/L)配制所得。将上述混合物避光静置40 min后,在412 nm处测定吸光度,游离巯基含量按公式(1)计算。
(1)
式中:A412,412 nm波长处的吸光度;ρ,样品质量浓度,mg/mL。
1.3.3 蛋白结构的测定
1.3.3.1 二级结构
称取研磨好的KBr 200 mg于研钵中,加入2 mg样品蛋白,研磨混合均匀后压片,通过傅里叶红外光谱仪(Fourier transform infrared spectrometer,FTIR)做全波段(400~4 000 cm-1)扫描,扫描128次。
1.3.3.2 三级结构
用PBS(0.01 mol/L,pH 7.0)配制1 mg/mL蛋白溶液,8 000 r/min离心10 min后,使用内源荧光光谱仪在狭缝波长5 nm,激发波长295 nm下测定样品的内源荧光光谱。
1.3.3.3 微观结构
将样品蛋白制成规则的小块。选择光滑的横截面于置物台上,喷金后通过电镜扫描仪观察(工作电压5 kV,放大倍数1 000倍)。
1.3.4 蛋白功能特性的测定
1.3.4.1 溶解度
考马斯亮蓝染色法测定蛋白溶解度。分别配制质量浓度为0.02、0.04、0.06、0.08、0.10 mg/mL的牛血清蛋白溶液,各取1 mL加入5 mL考马斯亮蓝溶液,漩涡振荡混匀后避光反应5 min,于595 nm波长处测定吸光值,得到蛋白质标准曲线回归方程为y=8.736x+0.619 1,R2=0.997 9。
分别称取100 mg蛋白样品溶于10 mL纯水中,旋涡振荡5 min,再以8 000 r/min离心20 min,取1 mL上清液加入5 mL考马斯亮蓝溶液,避光反应5 min后在595 nm处测定吸光值,根据标准曲线计算溶液中蛋白质溶解度。
1.3.4.2 起泡性及泡沫稳定性
称取0.2 g样品蛋白加入纯水配制质量分数为1%的蛋白溶液,置于烧杯中记录溶液高度(L),12 000 r/min高速均质2 min后,分别测量在0 min(L0)和静置30 min(L30)时蛋白溶液的泡沫高度,按公式(2)、公式(3)分别计算起泡性(foaming capacity,FC)与起泡稳定性(foam stability,FS)。
(2)
(3)
1.3.4.3 乳化性及乳化稳定性
纯水配制1 mg/mL样品蛋白溶液,取15 mL样品溶液加入7 mL菜籽油,10 000 r/min均质2 min后,从底部移取200 μL乳状液,加入5 mL SDS溶液(1 mg/mL,pH 7.0)混匀后。利用紫外分光光度计在500 nm处分别测定在0 min(A0)和静置20 min(A20)的吸光值,按公式(4)、(5)分别计算乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)。
(4)
(5)
式中:ρ,蛋白质质量浓度,g/mL;φ,溶液中油的体积比,1/3。
1.3.5 蛋白消化特性的测定
根据陈玉玉等[14]的方法模拟体外消化试验。配制模拟胃液(利用0.1 mol/L HCl溶液调节纯水pH值至1.2,加入5 g胃蛋白酶后蒸馏水定容至500 mL),及模拟肠液(将6.8 g KH2PO4加至250 mL蒸馏水中,用0.1 mol/L NaOH将溶液pH值调节至7.4,加入5 g胰蛋白酶后,用蒸馏水定容至500 mL)(现配现用)。
称取1 g蛋白样品与4 mL水混合,加入10 mL的模拟胃液,于37 ℃下水浴振荡2 h。在胃消化结束时,用2 mol/L NaOH溶液将pH值调至7以灭活胃蛋白酶。随后向上述溶液加入20 mL的模拟肠液,于37 ℃水浴振荡3 h。待消化反应结束后将消化产物于沸水浴中加热10 min以终止酶解反应。将消化产物在4 ℃下冷藏静置30 min,6 000 r/min离心20 min,弃去上清液,将每个消化阶段的沉淀物放于烘箱至恒重。采用凯氏定氮法测定酶解前后样品的蛋白质含量。按公式(6)计算蛋白质消化率:
消化率![]()
(6)
式中:m1,消化前样品的质量,g;m2,未消化物质的质量,g;w1,酶解前样品的蛋白质含量,%;w2,未消化物质的蛋白质含量,%。
1.4 数据处理及统计
所有数据平行测定3次,结果取平均值,采用SPSS 26.0、Nicolet Omnic和PeakFit 4.12软件对数据进行统计分析,Origin 2024b作图。
2 结果与分析
2.1 超声波改性对蛋白理化特性的影响
2.1.1 浊度
如图1所示,未处理的蛋白浊度较高,说明纯蛋白分散体系中蛋白分布不均,且颗粒较大。随着超声波功率的增加,浊度均出现先下降后上升的趋势,在功率480 W时,菜籽和亚麻分离蛋白溶液的浊度均显著降低至41.86%和48.29%,在机械力作用下,蛋白质的聚集状态有所改善,形成光散射的可能性小,因此溶液中的浊度降低,这与DU等[15]研究超声波对南瓜籽蛋白浊度的结果一致。而超声波功率达到600 W后,体系浊度升高,可能是因为高功率超声波处理增强了蛋白分子间的疏水相互作用,形成聚集体,聚集体在溶液中散射光线,造成混浊现象。
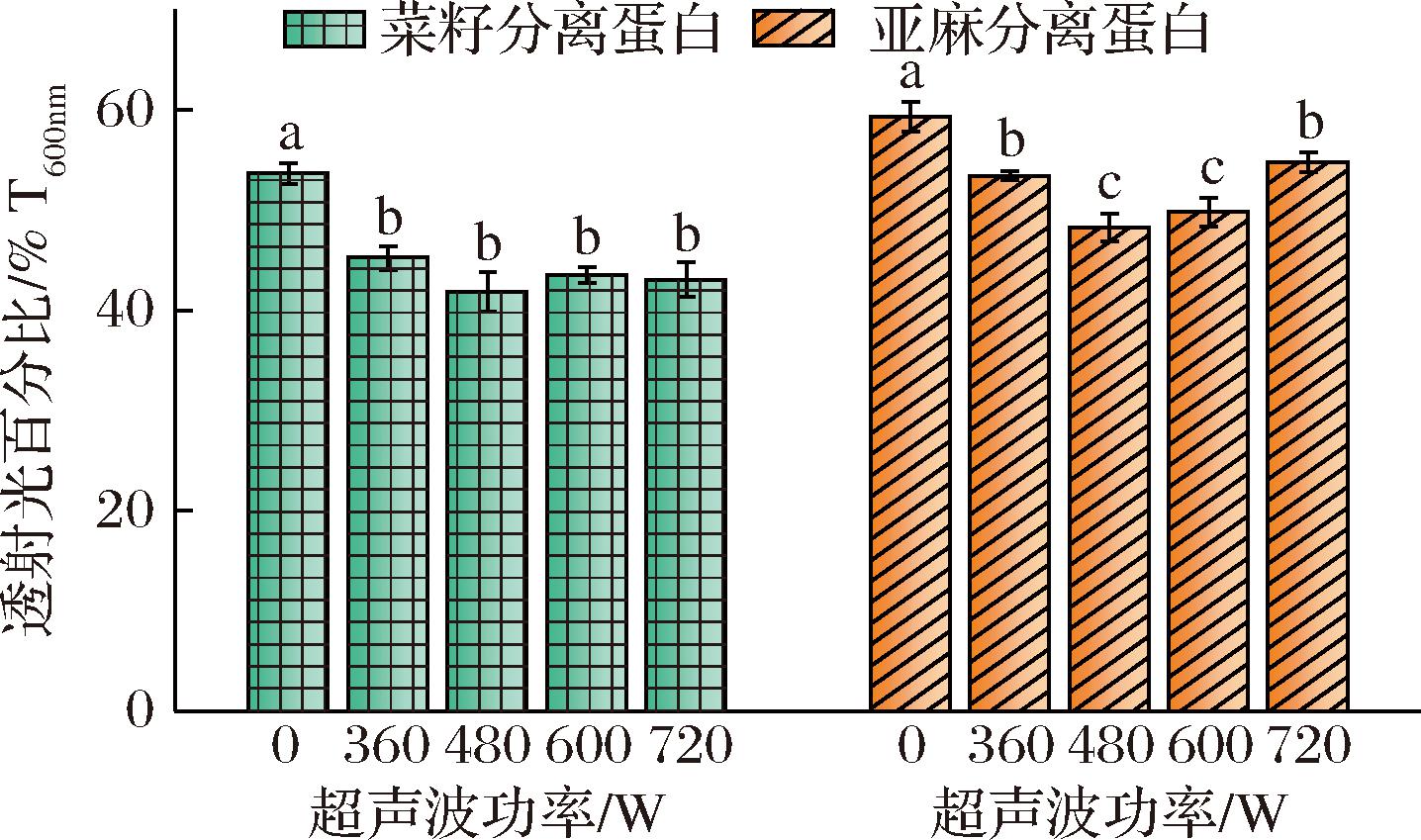
图1 不同超声波功率处理对蛋白浊度的影响
Fig.1 Effect of different ultrasound power treatments on protein turbidity
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 游离巯基含量
如图2所示,随着超声波功率的增加,菜籽和亚麻分离蛋白的游离巯基含量均显著增加(P<0.05),在480 W时达最大值,分别为28.60 μmol/g和34.37 μmol/g。这种增加可能是超声波处理破坏了蛋白质中的部分S—S键,导致形成新的S—H键。此外,超声波处理过程中机械力促进了蛋白质的部分展开,导致最初存在于蛋白质分子疏水内部的一些游离巯基基团暴露于表面[16]。而超声波功率达到600 W时,菜籽和亚麻分离蛋白的游离巯基含量开始下降,蛋白长时间暴露在高强度超声波下会产生H2O2,这可能会氧化游离—SH基团,导致游离巯基含量降低。李杨等[17]的研究结果表明,随着超声波功率和时间的持续增加,过量的自由基会导致游离巯基和游离氨基含量减少。

图2 不同超声波功率处理对蛋白游离巯基含量的影响
Fig.2 Effect of different ultrasound power treatments on protein free sulfhydryl content
2.2 超声波改性对蛋白结构的影响
2.2.1 二级结构
利用傅里叶红外光谱可以检测蛋白分子中酰胺键吸收红外辐射的频率及化学键的振动,从而分析蛋白质二级结构的含量和变化情况[18]。如图3所示,在不同超声波频率下同种蛋白之间观察到相似的FTIR曲线,说明超声波处理的样品骨架结构没有发生变化。所有样品在波数为3 300~3 500 cm-1具有宽而强的峰,通常称为酰胺A带,代表分子间氢键的O—H和N—H拉伸振动,在氢键存在下,肽的—NH基团被转移到较低的波数。在2 953 cm-1左右的弱峰观察到酰胺B带,该带对应于C—H拉伸振动。它略微向更高的波数移动,可能是由于强烈的空化效应引起了蛋白质去折叠,通过破坏疏水作用和氢键来影响蛋白质的二级结构。
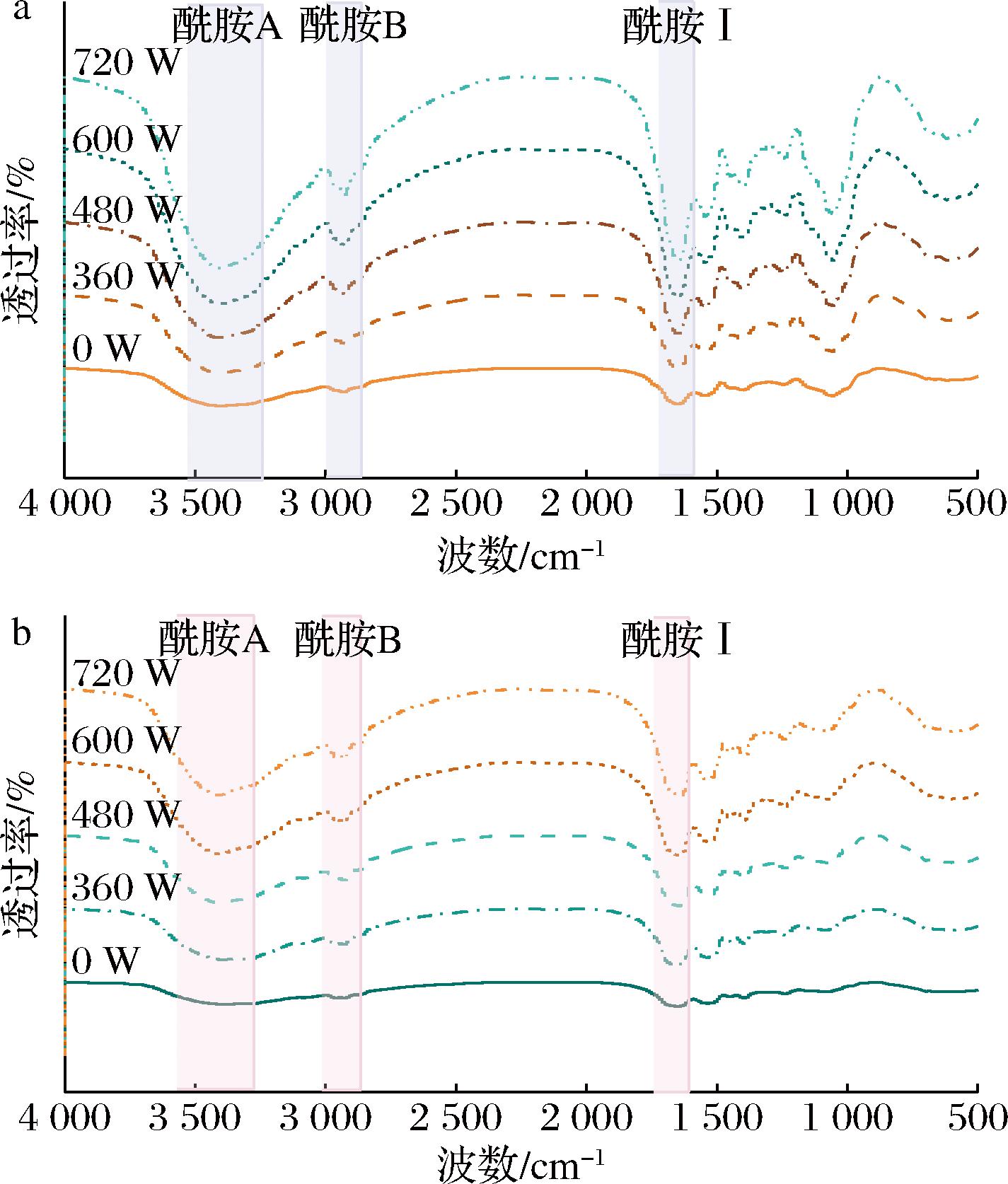
a-菜籽分离蛋白;b-亚麻分离蛋白
图3 不同超声波功率处理蛋白的傅里叶红外光谱图
Fig.3 FTIR spectra of proteins treated with different ultrasound powers
酰胺I带(1 700~1 600 cm-1)的蛋白质代表C![]() O(70%~85%)和C
O(70%~85%)和C![]() N(10%~20%)拉伸振动,广泛用于表征蛋白质的二级结构(α-螺旋、β-折叠、β-转角、无规卷曲),通常,α-螺旋和β-折叠埋在多肽链内,并利用C
N(10%~20%)拉伸振动,广泛用于表征蛋白质的二级结构(α-螺旋、β-折叠、β-转角、无规卷曲),通常,α-螺旋和β-折叠埋在多肽链内,并利用C![]() O和C
O和C![]() N之间的分子间作用力来稳定二级结构,相比于无规则卷曲具有更强的稳定性和紧密程度[19],如表1所示,360 W和480 W处理后菜籽分离蛋白α-螺旋和β-折叠含量从42.68%分别提高至44.08%和49.61%,亚麻分离蛋白从41.23%提高为52.01%和50.27%,说明此时的2种蛋白具有相对更稳定的二级结构,同时β-折叠结构含量减少,这表明空化效应产生的高能量和机械力破坏了原有分子间的相互作用力,使菜籽和亚麻分离蛋白的二级结构展开,但这种展开并未降低体系的稳定性,反而增强了其可操作性,促使形成更加稳定的功能性,对消化率具有一定积极的影响[20]。
N之间的分子间作用力来稳定二级结构,相比于无规则卷曲具有更强的稳定性和紧密程度[19],如表1所示,360 W和480 W处理后菜籽分离蛋白α-螺旋和β-折叠含量从42.68%分别提高至44.08%和49.61%,亚麻分离蛋白从41.23%提高为52.01%和50.27%,说明此时的2种蛋白具有相对更稳定的二级结构,同时β-折叠结构含量减少,这表明空化效应产生的高能量和机械力破坏了原有分子间的相互作用力,使菜籽和亚麻分离蛋白的二级结构展开,但这种展开并未降低体系的稳定性,反而增强了其可操作性,促使形成更加稳定的功能性,对消化率具有一定积极的影响[20]。
表1 不同超声波功率处理对蛋白二级结构含量的影响 单位:%
Table 1 Effect of different ultrasound power treatments on protein secondary structure content
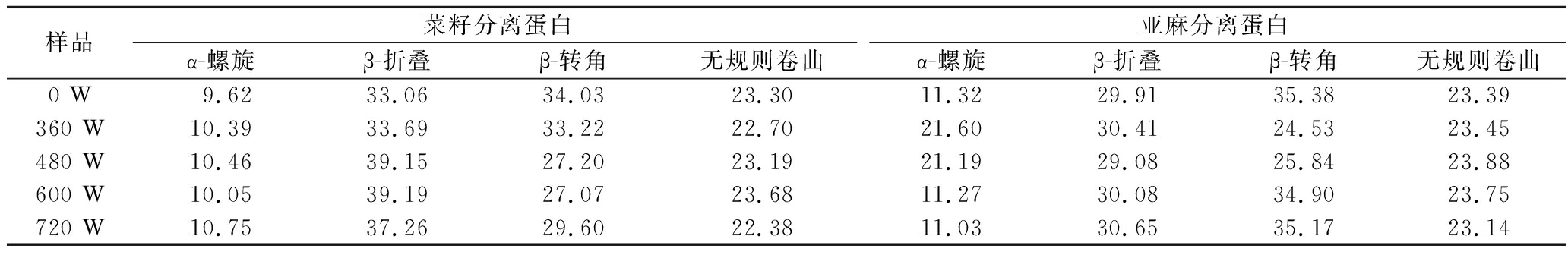
样品菜籽分离蛋白亚麻分离蛋白α-螺旋β-折叠β-转角无规则卷曲α-螺旋β-折叠β-转角无规则卷曲0 W9.6233.0634.0323.3011.3229.9135.3823.39360 W10.3933.6933.2222.7021.6030.4124.5323.45480 W10.4639.1527.2023.1921.1929.0825.8423.88600 W10.0539.1927.0723.6811.2730.0834.9023.75720 W10.7537.2629.6022.3811.0330.6535.1723.14
2.2.2 三级结构
蛋白质的内源荧光通常由色氨酸、酪氨酸和苯丙氨酸等荧光发色团产生[21]。如图4所示,未处理的菜籽分离蛋白和亚麻分离蛋白分别在波长310 nm和305 nm处具有最高荧光强度。2种蛋白随着超声波功率增加至480 W,分别出现了10 nm和15 nm的蓝移,不同程度的蓝移表明超声波处理后菜籽和亚麻分离蛋白的结构紧密化,暴露的荧光基团转移至疏水环境。同时,伴随着荧光强度的增加,说明超声波破坏了蛋白质分子的疏水作用,导致疏水基团和区域的展开和暴露[22],而过高的超声波功率处理后,蛋白发生变性交联将暴露的发色基团包埋,致使荧光强度逐渐减小。因此,适当的超声波处理可促使蛋白分子结构展开并改变三级结构。

a-菜籽分离蛋白;b-亚麻分离蛋白
图4 不同超声波功率处理对蛋白内源荧光光谱的影响
Fig.4 Effect of different ultrasound power treatments on the endogenous fluorescence spectra of proteins
2.2.3 微观结构
蛋白质的微观结构反应了蛋白质分子的聚集状态,如图5所示,当放大1 000倍后,不同超声波功率下的蛋白表面均有不同程度的破坏,由于分子间相互作用力,蛋白的聚合程度及分子间连接紧密度不一样[15]。240 W超声波对菜籽和亚麻分离蛋白的微观结构产生较小的影响。而在480 W时,蛋白结构松散、破碎颗粒较多,破碎程度较为显著,而720 W超声波处理后菜籽和亚麻分离蛋白均出现部分区域的团聚,体积密度变大,结果表明较高的超声波功率不利于改善蛋白质的功能特性。因此,适当的超声波处理可以改变蛋白质的聚集状态,使其粒径减小,从而改善蛋白质的溶解性和乳化性等。

a1~a5依次为超声波功率0、360、480、600、720 W处理的菜籽分离蛋白;b1~b5依次为亚麻分离蛋白
图5 不同超声波功率处理对蛋白微观结构的影响
Fig.5 Effect of different ultrasound power treatments on protein microstructure
2.3 超声波改性对蛋白功能特性的影响
2.3.1 溶解性
溶解度在食品蛋白的功能中起着关键作用,包括其乳化性能等。不同超声波功率对蛋白溶解度的影响如图6所示,与未处理蛋白的溶解度相比(菜籽蛋白52.25%,亚麻蛋白66.53%),功率480 W处理20 min后,菜籽和亚麻分离蛋白的溶解度分别提高了71%和37%倍,增强的溶解度是蛋白质内部相互作用的结果,这些相互作用导致蛋白质的结构变化,氨基酸的亲水基团暴露于水中,同时超声波的空化效应和机械力又能使粒径较大的蛋白分解成粒径较小的蛋白颗粒,提高蛋白溶解度[22]。而当超声波功率过高时,菜籽和亚麻分离蛋白结构被过度破坏,发生聚集现象,溶解度降低。在苏璋等[23]的研究中,观察到与本文相同的趋势,适度的超声波处理使原本不易溶解的蛋白质转化为更易溶解形式,从而增加蛋白质的溶解度。
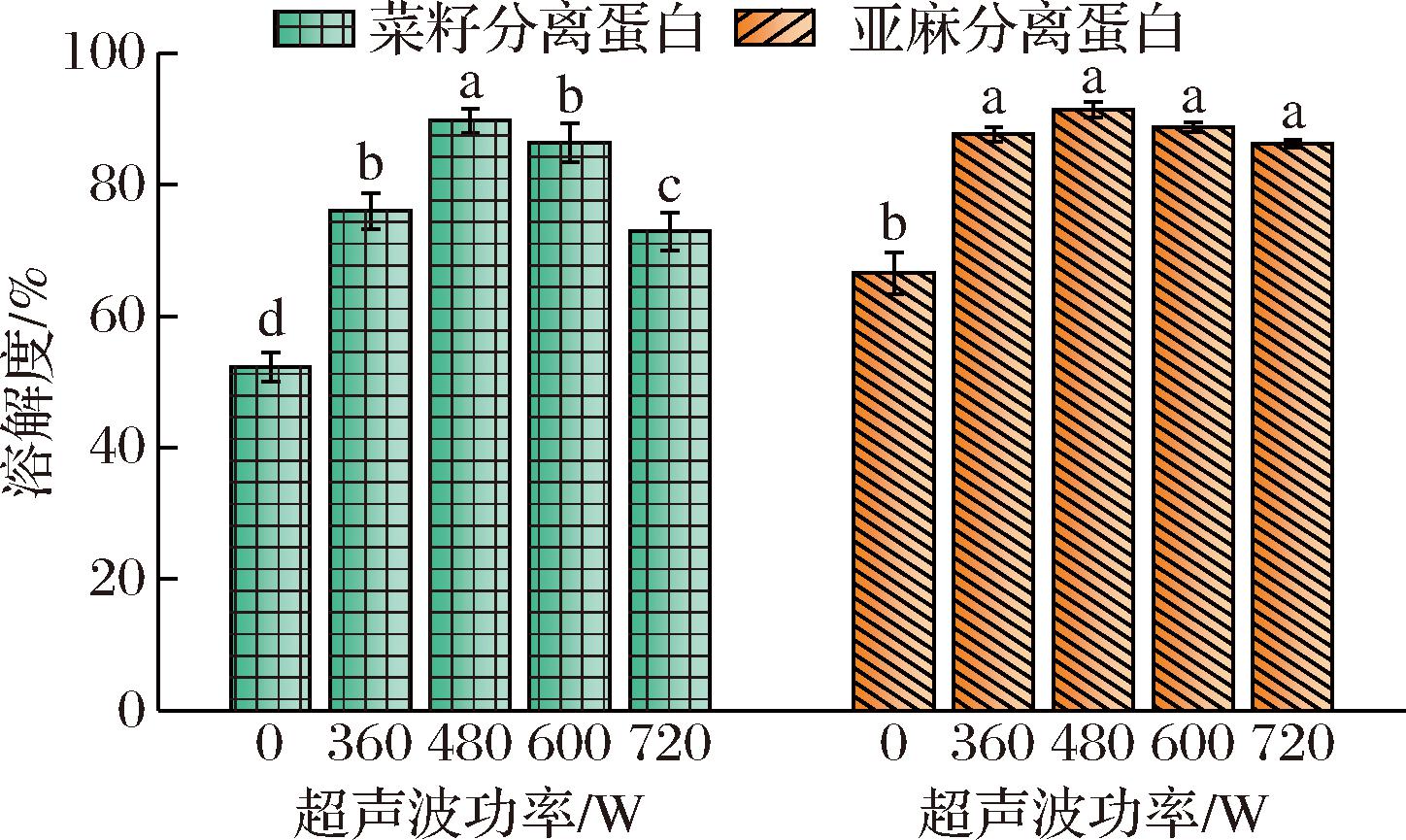
图6 不同超声波功率处理对蛋白溶解度的影响
Fig.6 Effect of different ultrasound power treatments on protein solubility
2.3.2 起泡性及泡沫稳定性
蛋白质的起泡性能主要由蛋白质分子的扩散作用、界面张力和疏水基团的分布等性质共同决定。如图7所示,菜籽蛋白和亚麻蛋白的起泡性及泡沫稳定性在超声波处理后都发生了变化。随着超声波功率的增加,2种蛋白的起泡性均呈现持续上升的趋势,在功率720 W时,起泡性分别达到了97.39%和91.42%,这是由于超声波的空化效应使蛋白结构松散,分子中的疏水基团暴露在表面,水的界面张力降低使蛋白质容易吸附,从而提高了蛋白溶液的起泡性。这与超声波处理南瓜籽蛋白[15]中的研究结果一致。与起泡性不同的是,菜籽和亚麻分离蛋白泡沫稳定性则在480 W时达到了峰值(分别为63.00%和60.74%)而后出现略微下降的趋势,推测原因可能是随着超声波功率的增加,蛋白分子中更多的疏水基团和区域暴露在表面,诱导了蛋白质聚集的增加,从而降低了蛋白质活性,导致相应的泡沫稳定性降低[24]。
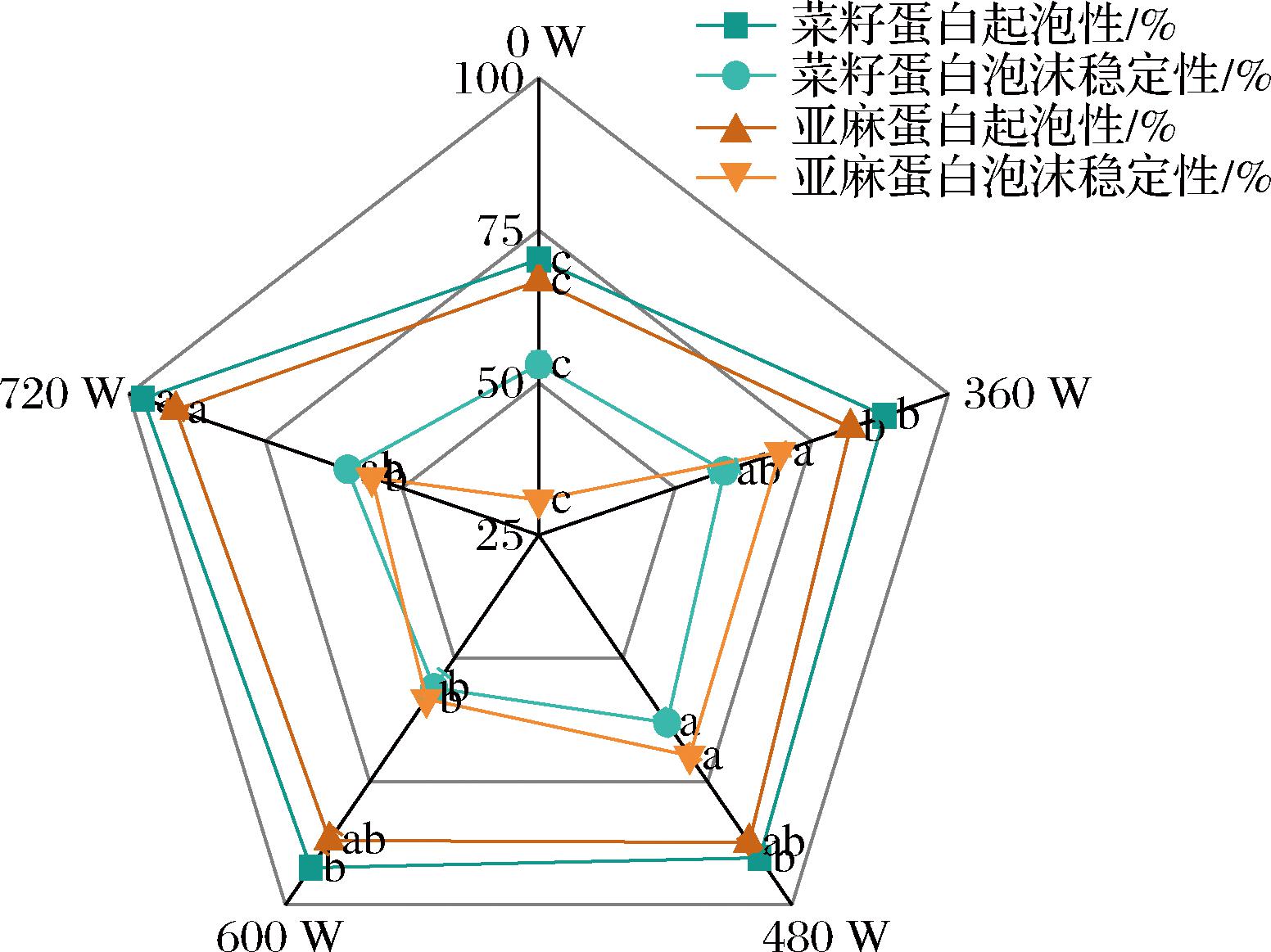
图7 不同超声波功率处理对蛋白起泡性及泡沫稳定性的影响
Fig.7 Effect of different ultrasound power treatments on foaming ability and foaming stability of proteins
2.3.3 乳化性及乳化稳定性
蛋白质形成和稳定乳液的能力在食品加工中至关重要,乳化性表示每单位重量蛋白质稳定的界面面积[8]。如图8所示,超声波处理后菜籽和亚麻分离蛋白的乳化性显著高于未处理样品(P<0.05),当超声波功率从0 W增加到720 W时,2种蛋白的乳化性均呈现先上升后下降的趋势,在480 W时达到峰值,分别为26.23 m2/g和36.34 m2/g,较未处理蛋白提高了59%和100%,此时,超声波处理的菜籽和亚麻分离蛋白发生变性解聚,颗粒减小,加快了蛋白质分子在油/水界面的扩散速率,进而提高了乳化活性。2种蛋白的乳化稳定性与乳化性趋势相似,菜籽分离蛋白在480 W时乳化稳定性达到了95.04%,亚麻分离蛋白则在360 W时到达了89.04%的峰值,而后均呈现下降趋势。随着超声功率的加强,蛋白变性引发疏水性残基增多,蛋白质分子之间的疏水相互作用增强,导致蛋白质聚集,进而可能会降低蛋白质的乳化稳定性。这与溶解性和浊度具有相似的变化趋势。
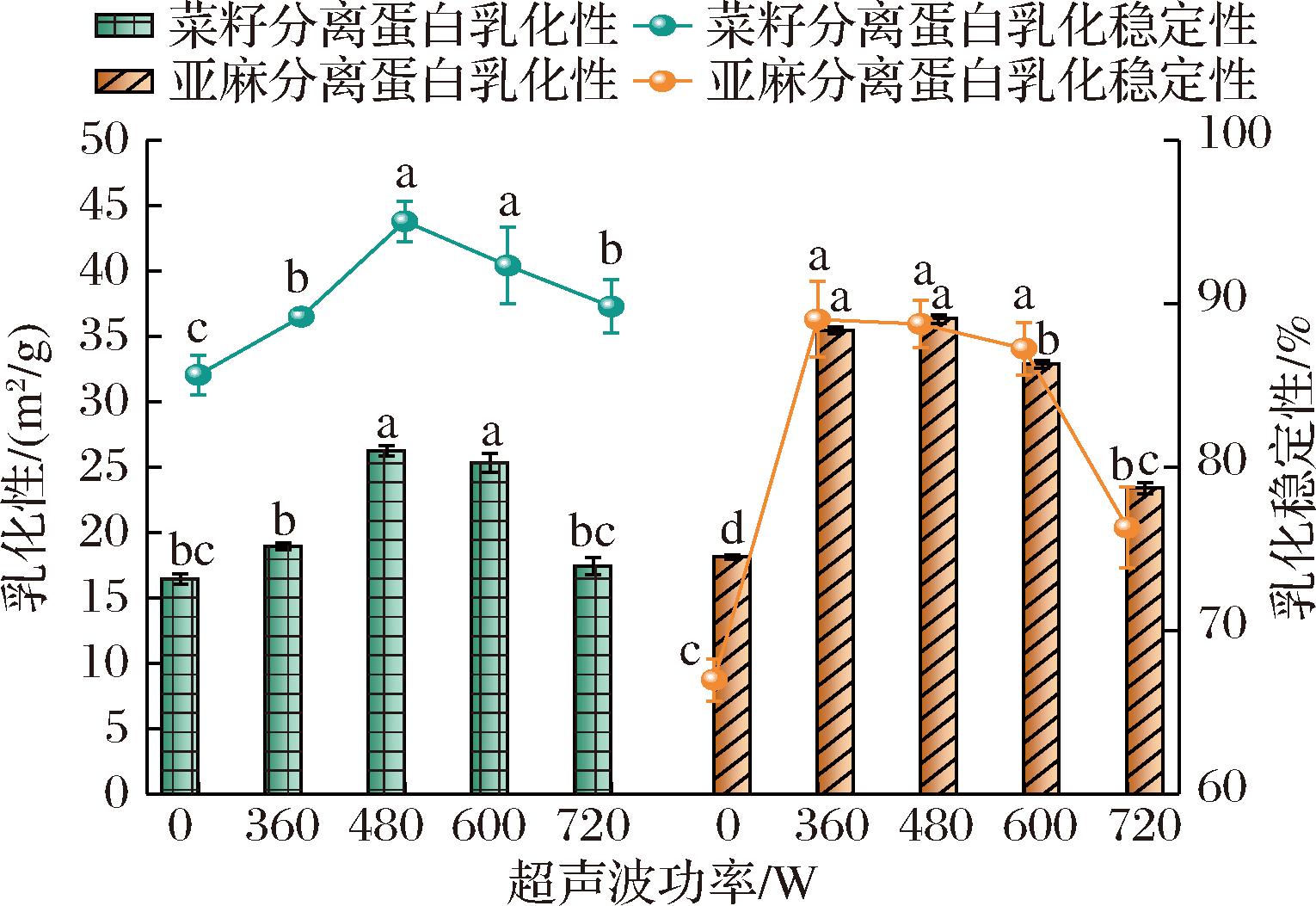
图8 不同超声波功率处理对蛋白乳化性及乳化稳定性的影响
Fig.8 Effect of different ultrasound power treatments on emulsifying property and emulsifying stability of proteins
2.4 超声波改性对蛋白体外消化率的影响
如表2所示,不同超声波功率对菜籽和亚麻分离蛋白的体外消化有显著影响(P<0.05),超声波功率480 W时,菜籽蛋白和亚麻籽分离蛋白在胃消化阶段消化率提升至39.76%和49.05%,较未处理蛋白分别提高了37.24%和55.4%,到了肠消化阶段后,菜籽和亚麻蛋白的消化率达到了74.54%和90.88%。蛋白质的消化率受其结构和聚集状态的影响,经过超声波处理后,空化作用和机械力共同作用下使蛋白分子被分解成较小的片段,导致其暴露更多接触位点,增加了蛋白质对消化酶的可及性;此外,超声波处理改变了蛋白分子构象,分子间趋于稳定,但分子内部稳定性减弱,从而使蛋白质消化率显著提高[14]。然而,功率过高的超声波处理并不会起到改善蛋白消化特性的作用,正如AGHABABAEI等[25]的研究中提到的,随着超声波振幅的增加蛋白质表面疏水性会发生改变,导致蛋白质形成致密的聚集体,从而降低了蛋白酶对多肽链的可及性。
表2 不同超声波功率处理对蛋白消化率的影响 单位:%
Table 2 Effect of different ultrasound power treatments on protein digestibility
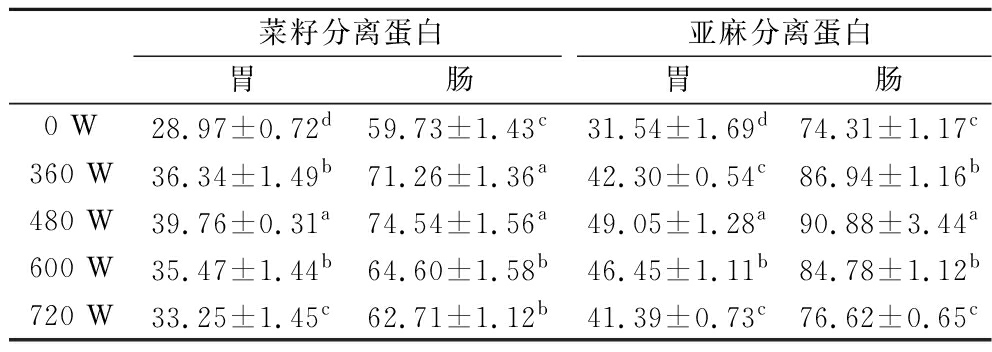
菜籽分离蛋白亚麻分离蛋白胃肠胃肠0 W28.97±0.72d59.73±1.43c31.54±1.69d74.31±1.17c360 W36.34±1.49b71.26±1.36a42.30±0.54c86.94±1.16b480 W39.76±0.31a74.54±1.56a49.05±1.28a90.88±3.44a600 W35.47±1.44b64.60±1.58b46.45±1.11b84.78±1.12b720 W33.25±1.45c62.71±1.12b41.39±0.73c76.62±0.65c
注:同一列不同小写字母表示差异显著(P<0.05)。
3 结论
本研究以菜籽分离蛋白和亚麻分离蛋白为研究对象,探究超声波功率对2种蛋白理化、结构、功能和消化特性的影响。结果表明,超声波改性对2种蛋白的品质特性均具有积极影响,超声波改性通过调整蛋白的二级和三级结构,改善了蛋白的功能特性。在超声波功率480 W,时间20 min条件下,2种蛋白的微观结构较为松散,表现出更低的浊度和更高的溶解度。起泡性和乳化性也得到了显著改善,同时增强了胃肠阶段的消化率。综上,超声波是一种有效的技术,可用于改善植物蛋白的功能特性和扩宽植物蛋白的应用范围。
尽管超声波改性技术在改善蛋白质功能特性方面具有显著优势,仍存在可控性不足、氧化效应等问题,需进一步优化超声波参数,完善改性模式,进一步探讨其作用规律,实现规模化与连续化。其次,从协同改性角度而言,单一超声波改性在实际应用中效果有限,未来应重点研究超声波与其他技术(如化学、酶法改性)的协同作用。随着设备与工艺的持续改进,协同改性将拓宽高功能性蛋白的应用领域,促进营养和健康食品的开发。
[1] CAN KARACA A, ASSADPOUR E, JAFARI S M.Plant protein-based emulsions for the delivery of bioactive compounds[J].Advances in Colloid and Interface Science, 2023, 316:102918.
[2] NEVARA G A, IBRAHIM S G, MUHAMMAD S K S, et al.Oilseed meals into foods:An approach for the valorization of oilseed by-products[J].Critical Reviews in Food Science and Nutrition, 2023, 63(23):6330-6343.
[3] 吕蕾, 曹凤.亚麻籽粕综合利用的初步研究[J].农产品加工, 2022(15):87-91.LV L, CAO F.Preliminary study on comprehensive utilization of flaxseed meal[J].Farm Products Processing, 2022(15):87-91.
[4] 李逍燕, 左硕静, 刘晓涵, 等.超声处理对牡蛎肌原纤维蛋白溶解性的影响[J].肉类研究, 2024, 38(7):8-14.LI X Y, ZUO S J, LIU X H, et al.Effects of ultrasonic treatment on solubility of oyster myofibrillar protein[J].Meat Research, 2024, 38(7):8-14.
[5] 赵康妤, 杨萍, 马俊坤, 等.超声协同热处理对菜籽蛋白结构及溶解性的影响[J].食品科学, 2025, 46(1):100-107.ZHAO K Y, YANG P, MA J K, et al.Effect of ultrasonic-assisted thermal treatment on the structure and solubility of rapeseed protein[J].Food Science, 2025, 46(1):100-107.
[6] BHARGAVA N, MOR R S, KUMAR K, et al.Advances in application of ultrasound in food processing:A review[J].Ultrasonics Sonochemistry, 2021, 70:105293.
[7] 王子凌, 熊可心, 蒋景淳, 等.高强度超声处理时间对克氏原螯虾肌原纤维蛋白理化性质的影响[J].食品科学, 2023, 44(23):13-20.WANG Z L, XIONG K X, JIANG J C, et al.Effect of high-intensity ultrasonic treatment time on physicochemical properties of myofibrillar protein from Procambarus clarkii[J].Food Science, 2023, 44(23):13-20.
[8] FLORES-JIMÉNEZ N T, ULLOA J A, SILVAS J E U, et al.Effect of high-intensity ultrasound on the compositional, physicochemical, biochemical, functional and structural properties of canola (Brassica napus L.) protein isolate[J].Food Research International, 2019, 121:947-956.
[9] 于淼, 裴昱博, 李春.基于超声波改性大豆分离蛋白的研究进展[J].食品科技, 2023, 48(12):222-228.YU M, PEI Y B, LI C.Development of ultrasonic modified soybean protein isolation[J].Food Science and Technology, 2023, 48(12):222-228.
[10] MENG Y Y, LIANG Z Q, ZHANG C Y, et al.Ultrasonic modification of whey protein isolate:Implications for the structural and functional properties[J].LWT, 2021, 152:112272.
[11] 望运滔, 王营娟, 田金风, 等.高强度超声对鹰嘴豆分离蛋白结构和功能特性的影响[J].食品与机械, 2020, 36(8):9-14;71.WANG Y T, WANG Y J, TIAN J F, et al.Effect of high intensity ultrasound on structural and functional properties of chickpea protein isolate[J].Food &Machinery, 2020, 36(8):9-14;71.
[12] XIONG T, XIONG W F, GE M T, et al.Effect of high intensity ultrasound on structure and foaming properties of pea protein isolate[J].Food Research International, 2018, 109:260-267.
[13] AHMAD MALIK M, SAINI C S.Rheological and structural properties of protein isolates extracted from dephenolized sunflower meal:Effect of high intensity ultrasound[J].Food Hydrocolloids, 2018, 81:229-241.
[14] 陈玉玉, 石梦梦, 王月琴, 等.超声对青稞蛋白理化性质和消化特性的影响[J].食品与发酵工业, 2024, 50(8):68-75.CHEN Y Y, SHI M M, WANG Y Q, et al.Effect of ultrasound on physicochemical properties and digestive characteristics of barley protein[J].Food and Fermentation Industries, 2024, 50(8):68-75.
[15] DU H Y, ZHANG J, WANG S Q, et al.Effect of high-intensity ultrasonic treatment on the physicochemical, structural, rheological, behavioral, and foaming properties of pumpkin (Cucurbita moschata Duch.)-seed protein isolates[J].LWT, 2022, 155:112952.
[16] ZHU Z B, ZHU W D, YI J H, et al.Effects of sonication on the physicochemical and functional properties of walnut protein isolate[J].Food Research International, 2018, 106:853-861.
[17] 李杨, 陈凡凡, 王中江, 等.超声预处理对大豆蛋白聚集体结构和乳化特性的影响[J].农业机械学报, 2020, 51(6):366-374.LI Y, CHEN F F, WANG Z J, et al.Effect of ultrasonic pretreatment on structure and functional properties of soy protein aggregates[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(6):366-374.
[18] 陈泽凡, 芦祥志, 汪金林, 等.热压对鲟鱼软骨明胶理化性质及风味的影响[J].食品工业科技, 2025,46(14):115-126.CHEN Z F, LU X Z, WANG J L, et al.Effect of hot-pressing conditions on the physicochemical properties and flavor of gelatin extracted from sturgeon cartilage(SCG)[J].Science and Technology of Food Industry, 2025,46(14):115-126.
[19] RESENDIZ-VAZQUEZ J A, UR AS-SILVAS J, ARM J E,et al.Effect of ultrasound-assisted enzymolysis on jackfruit (Artocarpus heterophyllus) seed proteins:structural characteristics, technofunctional properties and the correlation to enzymolysis[J].Journal of Food Processing &Technology, 2019, 10:1000796.
AS-SILVAS J, ARM J E,et al.Effect of ultrasound-assisted enzymolysis on jackfruit (Artocarpus heterophyllus) seed proteins:structural characteristics, technofunctional properties and the correlation to enzymolysis[J].Journal of Food Processing &Technology, 2019, 10:1000796.
[20] 田然, 冯俊然, 隋晓楠, 等.高强度超声处理对大豆7S和11S球蛋白结构和理化性质的影响[J].食品工业科技, 2022, 43(5):87-97.TIAN R, FENG J R, SUI X N, et al.Effect of high intensity ultrasound on the conformational and physicochemical properties of soy 7S and 11S globulin[J].Science and Technology of Food Industry, 2022, 43(5):87-97.
[21] ZHANG H X, CHEN G J, LIU M, et al.Effects of multi-frequency ultrasound on physicochemical properties, structural characteristics of gluten protein and the quality of noodle[J].Ultrasonics Sonochemistry, 2020, 67:105135.
[22] THAL A FLORES-JIMÉNEZ N, ARMANDO ULLOA J, ESMERALDA UR
A FLORES-JIMÉNEZ N, ARMANDO ULLOA J, ESMERALDA UR AS-SILVAS J, et al.Influence of high-intensity ultrasound on physicochemical and functional properties of a guamuchil Pithecellobium dulce (Roxb.) seed protein isolate[J].Ultrasonics Sonochemistry, 2022, 84:105976.
AS-SILVAS J, et al.Influence of high-intensity ultrasound on physicochemical and functional properties of a guamuchil Pithecellobium dulce (Roxb.) seed protein isolate[J].Ultrasonics Sonochemistry, 2022, 84:105976.
[23] 苏璋, 胡发广, 于鑫欣, 等.超声波辅助低共熔溶剂提取对咖啡蛋白结构和功能特性的影响[J].热带作物学报, 2024, 45(8):1714-1726.SU Z, HU F G, YU X X, et al.Effects of ultrasonic-assisted deep eutectic solvent extraction on the structure and functional properties of coffee protein[J].Chinese Journal of Tropical Crops, 2024, 45(8):1714-1726.
[24] 邹婕, 王琪, 马美湖, 等.高场强超声对蛋清液起泡特性的影响[J].中国食品学报, 2022, 22(1):163-171.ZOU J, WANG Q, MA M H, et al.Effects of high intensity ultrasound on foaming characteristics of egg white liquid[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(1):163-171.
[25] AGHABABAEI F, MCCLEMENTS D J, HADIDI M.Ultrasound processing for enhanced digestibility of plant proteins[J].Food Hydrocolloids, 2024, 155:110188.