油莎豆(Cyperus esculentus L.),又名虎坚果,是地中海地区代表作物,营养价值高[1]。在我国,油莎豆在食品工业中主要应用于榨油,榨油后剩余的豆粕用作饲料或直接废弃,豆粕中所含蛋白质未得到充分利用。研究发现,油莎豆蛋白(Cyperus esculentus L. protein, CEP)属优质植物蛋白,不仅适合糖尿病、消化疾病和心脏病患者食用[2],而且具有一定抗氧化能力。然而,天然的CEP溶解度、乳化性较低,限制其在食品工业中进一步应用[3]。现阶段,对于CEP改性方法多集中于物理改性,使用超声波[4]、球磨、高压均质、非热等离子体[5],通过改变CEP分子间的结构和聚集类型以提高其功能性。在蛋白质众多改性方法中,酶水解具有反应条件温和、副产物少等独特优势[6],并且酶水解可以增加蛋白的溶解度,使其在界面上更容易被吸附、乳化过程更容易进行[7]。
壳聚糖(chitosan, CTS)是自然界中唯一碱性多糖,其表面存在氨基和羟基2种活性基团,常被作为谷氨酰胺转氨酶(transglutaminase, TG酶)途径糖基化的底物[8]。TG酶催化蛋白质与多糖结合具有效率高、不破坏蛋白质的天然特性、安全性好等优势,适宜在食品加工中使用。WANG等[9]使用TG酶和CTS制备的糖基化玉米蛋白可显著延缓碎猪肉的脂质氧化。WANG等[10]使用TG酶制备了银耳多糖-乳铁蛋白复合凝胶,可用于递送生物活性物质。将蛋白水解物作为单一乳化剂在极端条件下仍会不稳定,加入其他天然乳化剂作为辅助乳化剂(如多糖),可进一步提高乳化能力[11]。乳液为热力学不稳定体系,随时间推移,液体食品会出现絮集、油水相分离现象,为保持产品性状稳定以延长货架期,在生产加工中常添加合成类乳化剂。目前食品行业中使用的合成类乳化剂(吐温-80)会诱发炎症和肥胖综合征,促使小鼠结肠炎的发生[12],因此天然来源的乳化剂对消费者更具吸引力。
为提升CEP的功能性以拓宽其在食品加工中的应用范围,本研究以CEP、壳聚糖为研究对象,研究酶水解、酶水解结合酶促糖基化对CEP乳化特性的影响。采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)和内源荧光光谱表征改性前后CEP结构的变化,并评价其内在构效关系,为开发食品及饮料乳化稳定剂提供新思路。
1 材料与方法
1.1 材料与试剂
冷榨油莎豆豆粕、CTS(脱乙酰度≥85%),青岛弘海生物技术有限公司;TG酶(1 000 U/g),江苏一鸣生物股份有限公司;硼砂,天津市科密欧化学试剂有限公司;甲醇、邻苯二甲醛(ortho-phthalaldehyde,OPA)、β-巯基乙醇,上海麦克林生化科技股份有限公司;赖氨酸、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),北京酷来搏科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate, SDS),德国Biofroxx公司;牛血清白蛋白、木瓜蛋白酶(800 U/mg),上海源叶生物科技有限公司。所有试剂均为分析纯。
1.2 仪器与设备
ZEN3700纳米激光粒度电位测定仪,英国Malvern公司;U-2910紫外-可见分光光度计,日本Hitachi 公司;T25高速分散机,德国IKA公司;水浴振荡器,上海力辰仪器科技有限公司;RF-6000荧光分光光度计,日本岛津公司;iS5傅里叶红外光谱仪,赛默飞世尔科技(中国)有限公司;Q10差示扫描量热仪,美国TA公司。
1.3 实验方法
1.3.1 CEP提取
参考ZHANG等[13]方法,采用碱提酸沉法制备CEP[凯氏定氮法测得蛋白质量分数为(81.29±1.23)%],冻干后在-20 ℃贮存、备用。
1.3.2 油莎豆蛋白水解物(Cyperus esculentus L.protein hydrolysate,CEPH)制备
参考木瓜蛋白酶最适反应条件,在温度38 ℃,反应pH 7.5条件下,以乳化稳定性为评价指标,通过单因素试验,依次考察底物质量分数(3%、4%、5%、6%、7%)、酶添加量(3 000、4 000、5 000、6 000、7 000 U/g)、酶解时间(1、2、3、4、5 h)对CEP乳化稳定性的影响。固定因素水平为底物质量分数5%、酶添加量5 000 U/g、酶解时间3 h,1次试验中只改变1个变量,其余条件保持不变。酶水解反应结束后,100 ℃灭酶10 min,水解液冷却至室温后4 000×g离心20 min,取上清液备用。
1.3.3 CEPH水解度测定
采用pH-stat法,利用酶解过程为维持pH值稳定所添加的1 mol/L NaOH标准溶液体积计算水解度,按公式(1)、公式(2)计算:
α=10pH-pK/(1+10pH-pK)
(1)
(2)
式中:pH,反应起始时pH值;pK,氨基酸平均解离常数,按7.0计算;Mp,参加水解反应的蛋白总量,g;htot,每克蛋白质中肽键物质的量(CEP为7.59 mmol/g)。
1.3.4 CEPH-CTS复合物制备单因素试验
参考TG酶最适反应温度,在50 ℃条件下,以接枝度为评价指标,通过单因素试验,依次考察反应时间(30、60、90、120、150 min)、蛋白水解物∶壳聚糖[1∶1、2∶1、3∶1、4∶1、5∶1,(质量比,下同)]、TG酶添加量(20、40、60、80、100 U/g)、反应pH(6.0、6.5、7.0、7.5、8.0)对接枝度的影响。固定因素水平为反应时间90 min、蛋白水解物∶壳聚糖=3∶1、TG酶添加量60 U/g、反应pH=7.0,1次试验中只改变1个变量,其余条件保持不变。反应结束后,在100 ℃灭酶10 min,水解液冷却至室温后在4 000×g离心20 min,取上清液备用。
1.3.5 接枝度测定
通过OPA法测定接枝度。将40 mg OPA溶于1 mL甲醇,依次加入2.5 mL 质量分数为20% SDS溶液、25 mL 0.1 mol/L硼砂溶液以及100 μL β-巯基乙醇,最后使用蒸馏水定容至50 mL,制得OPA试剂,避光保存。吸取200 μL样品溶液(蛋白质量浓度为1 mg/mL)与 4 mL OPA试剂充分混匀后,35 ℃水浴2 min,340 nm 处测定吸光度值。以赖氨酸作为标准物绘制标准曲线。接枝度计算如公式(3)所示:
(3)
式中:Cs,反应前体系中游离氨基的含量;Ct,反应后体系中游离氨基的含量。
1.3.6 CEPH-CTS复合物结构表征及功能性质
1.3.6.1 FTIR
将1 mg冻干样品与KBr混合并研磨成粉末,压制成薄片。傅里叶红外光谱仪用于全波长扫描,测量范围设置为4 000~400 cm-1,分辨率4 cm-1,进行32次扫描。
1.3.6.2 内源荧光
配置蛋白质量浓度为0.2 mg/mL样品溶液,使用荧光分光光度计扫描。狭缝宽度设置为5.0 nm,发射波长为300~450 nm,激发波长290 nm,扫描速度5 nm/s。
1.3.6.3 表面疏水性
将ANS(8 mmol/L,20 μL)分别与4 mL不同蛋白质量浓度(0.05~0.2 mg/mL)的样品混合,并在黑暗中反应15 min。在激发波长390 nm,发射波长470 nm和狭缝宽度5 nm条件下,使用荧光分光光度计测定荧光强度,以荧光强度与蛋白浓度的斜率代表样品的表面疏水性。
1.3.6.4 粒径、电位的测定
配置蛋白质量浓度为2 mg/mL的样品溶液,粒径和电位由激光粒度电位测定仪测量。分散相的折射率设为1.460,连续相的折射指数设为1.330,每个样品测定3次。
1.3.6.5 热稳定性
用差示扫描量热仪测量样品热稳定性。称取5 mg样品于铝坩埚中,温度以10 ℃/min的速度从30 ℃升至250 ℃,氮气流量为30 mL/min。
1.3.6.6 溶解度
利用双缩脲法测定溶液中蛋白含量,使用牛血清白蛋白为标准品绘制标准曲线,将样品蛋白浓度调整为2 mg/mL,10 000×g、4 ℃离心15 min。将上清液(1 mL)与双缩脲试剂(4 mL)混匀,25 ℃避光反应30 min后,540 nm处测定其吸光值。根据标准曲线计算可溶性蛋白含量,溶解度按公式(4)计算:
溶解度![]()
(4)
1.3.6.7 乳化特性
配置蛋白质量浓度为2 mg/mL的样品溶液。取3 mL待测样品溶液与1 mL大豆油混合,13 000 r/min 高速均质2 min,静置,分别在0 min和10 min时从容器底部抽取50 μL乳状液于离心管中,加5 mL 0.1%的SDS溶液并充分混匀。以0.1%的SDS调整仪器零点,于500 nm处测定吸光度值。乳化活性(emulsifying ability index,EAI)及乳化稳定性(emulsifying stability index,ESI)按公式(5)、公式(6)计算[14]:
(5)
(6)
式中:T,2.303;A0,0 min时的吸光度值;N,稀释倍数;φ,油相的体积分数;c,蛋白质质量浓度,g/mL; A10,溶液静置10 min后的吸光度值;ΔT,时间差,min。
1.4 数据分析
每个试验重复3次,使用SPSS 19.0对数据进行统计分析,并用 Duncan 法进行多极差验证(P<0.05),结果用“平均值±标准差”表示。所有图均用 Origin 2023 绘制。使用Peakfit 4.12计算蛋白质二级结构含量。
2 结果与分析
2.1 CEPH的制备
如图1所示,当底物质量分数5%,酶添加量4 000 U/g,酶解时间3 h,得到的CEPH的ESI较高,进行3次实验测得ESI为(51.53±0.75) min,水解度为(7.29±0.11)%。CEPH均在此条件下同步制备,冻干后备用。
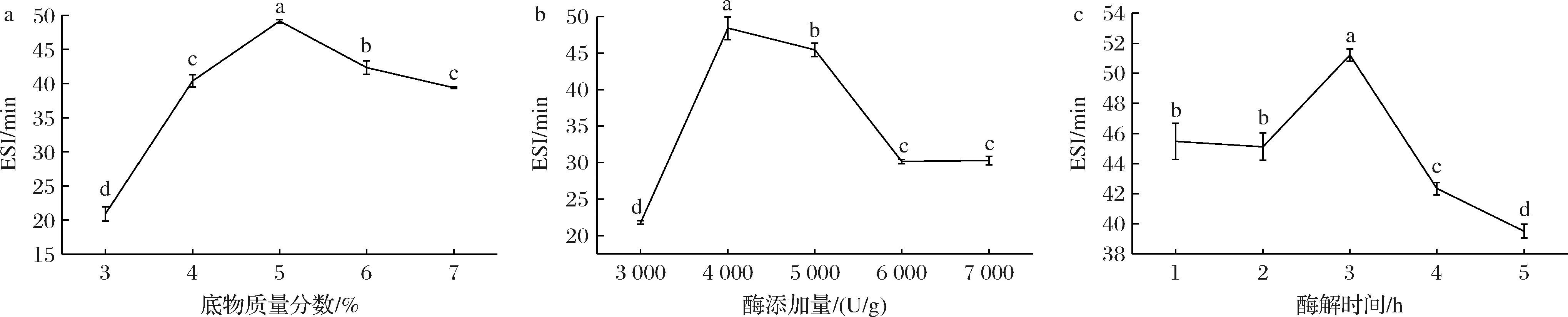
a-底物质量分数;b-酶添加量;c-酶解时间
图1 不同因素水平对CEP的ESI的影响
Fig.1 Effects of different factor levels on the ESI of CEP
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 CEPH-CTS复合物制备
如图2所示,当反应时间60 min,蛋白水解物∶壳聚糖=2∶1,TG酶添加量60 U/g,反应pH值为7时,得到的CEPH-CTS接枝度较高,进行3次实验测得接枝度为(40.24±0.53)%。CEPH-CTS均在此条件下同步制备,冻干后备用。
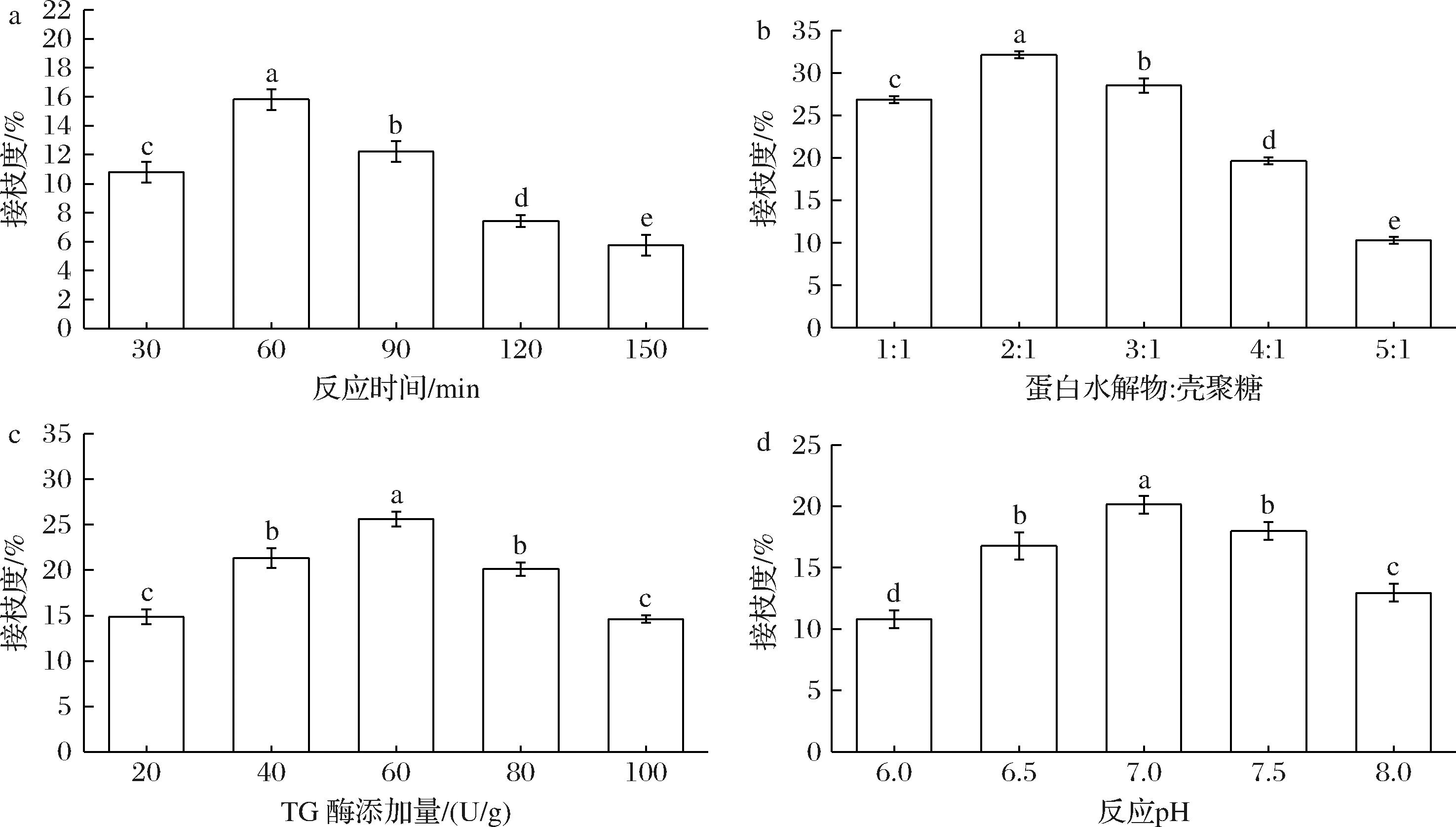
a-反应时间;b-蛋白水解物∶壳聚糖;c-TG酶添加量;d-反应pH
图2 不同因素水平对CEPH-CTS接枝度的影响
Fig.2 Effects of different factor levels on grafting degree of CEPH-CTS
2.3 CEPH-CTS复合物结构表征及功能性质
2.3.1 FTIR
如图3所示,CEPH与CEP相比,红外光谱未发生太大变化,但是酶水解后,3 278 cm-1处的N—H伸缩/O—H伸缩振动峰强度明显变大变宽。木瓜蛋白酶水解破坏了CEP的二级结构,导致肽链的断裂,因此C![]() O振动峰和N—H弯曲振动峰的强度较CEP明显变弱。在CEPH-CTS样品中,C
O振动峰和N—H弯曲振动峰的强度较CEP明显变弱。在CEPH-CTS样品中,C![]() O伸缩振动峰发生明显的偏移(1 650 cm-1),以及N—H的振动峰呈现出了明显的宽峰(CTS中存在大量氨基),这意味着CEPH与CTS通过TG酶的交联形成了复合物。此外,C—O的振动峰偏移至1 018 cm-1处,3 278 cm-1处的N—H伸缩振动峰明显变得更宽更强,进一步证实了两者之间发生了接枝反应。CEPH、CEPH-CTS 相较于CEP无规则卷曲含量分别增加6.24%和40.65%,表明改性后CEP柔性增加,具有更灵活的空间构象,柔性蛋白更易在油水界面处展开,增加覆盖的油水界面面积。CEPH-CTS α-螺旋含量增加(表1),根据先前研究发现,有序的构象会增加蛋白或肽之间的相互作用,从而形成更强的界面层[15]。CEPH-CTS由于α-螺旋含量高,理论上乳化性质更好。
O伸缩振动峰发生明显的偏移(1 650 cm-1),以及N—H的振动峰呈现出了明显的宽峰(CTS中存在大量氨基),这意味着CEPH与CTS通过TG酶的交联形成了复合物。此外,C—O的振动峰偏移至1 018 cm-1处,3 278 cm-1处的N—H伸缩振动峰明显变得更宽更强,进一步证实了两者之间发生了接枝反应。CEPH、CEPH-CTS 相较于CEP无规则卷曲含量分别增加6.24%和40.65%,表明改性后CEP柔性增加,具有更灵活的空间构象,柔性蛋白更易在油水界面处展开,增加覆盖的油水界面面积。CEPH-CTS α-螺旋含量增加(表1),根据先前研究发现,有序的构象会增加蛋白或肽之间的相互作用,从而形成更强的界面层[15]。CEPH-CTS由于α-螺旋含量高,理论上乳化性质更好。
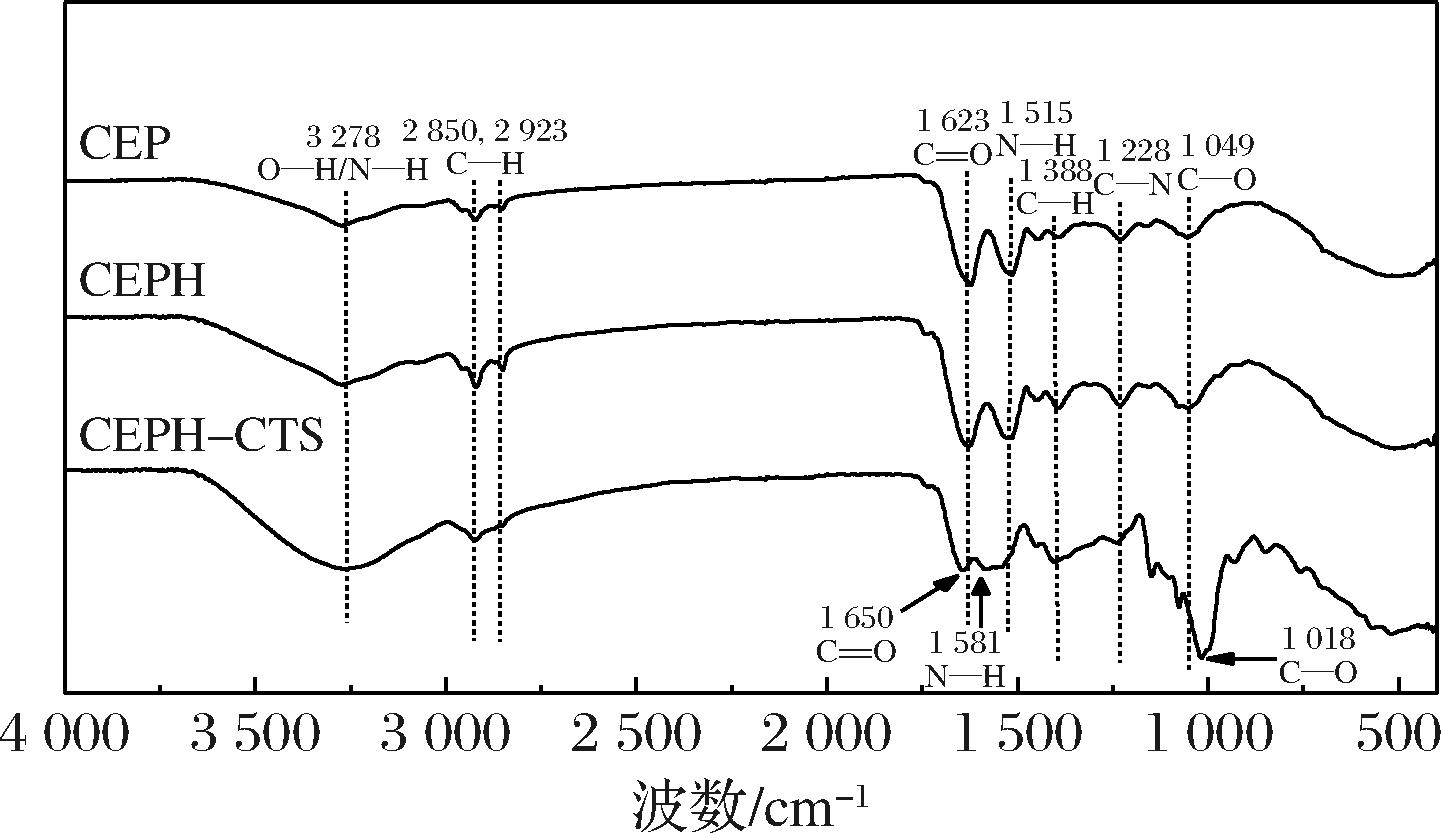
图3 CEP、CEPH和CEPH-CTS的FTIR
Fig.3 FTIR spectrum of CEP, CEPH, and CEPH-CTS
表1 CEP、CEPH和CEPH-CTS二级结构含量
Table 1 Secondary structure content of CEP, CEPH, and CEPH-CTS
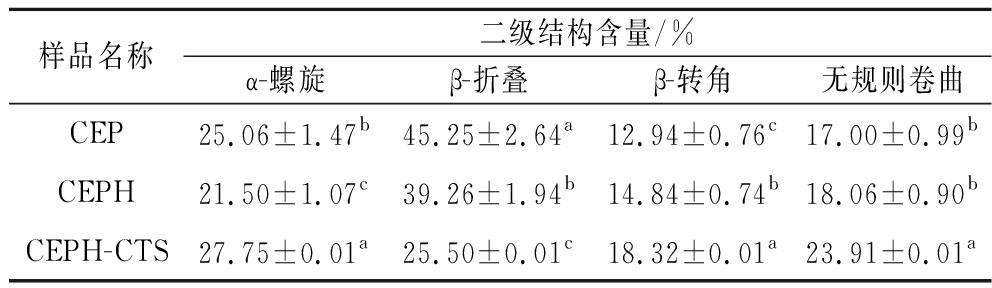
样品名称二级结构含量/%α-螺旋β-折叠β-转角无规则卷曲CEP25.06±1.47b45.25±2.64a12.94±0.76c17.00±0.99bCEPH21.50±1.07c39.26±1.94b14.84±0.74b18.06±0.90bCEPH-CTS27.75±0.01a25.50±0.01c18.32±0.01a23.91±0.01a
注:同列不同小写字母表示差异显著(P<0.05)。
2.3.2 粒径
如图4所示,CEP粒径呈较为广泛的双峰分布,CEP是由2种不同粒径的蛋白质聚集体组成。经过木瓜蛋白酶水解后,5 560 nm处的峰消失,蛋白粒径分布减小,此时有41.2%的蛋白粒径小于213.6 nm。CEPH-CTS粒径呈现单峰分布,表明CEPH-CTS由于共价相互作用紧密结合而产生了聚集。具有较大颗粒尺寸的蛋白水解物/肽可以在油水界面处形成致密且具有弹性相互支撑的薄膜,延缓液滴间的凝集,有助于改善和稳定蛋白的乳化性能[16],CEPH-CTS相较于CEPH具有较大的粒径,将有利于保持乳液界面的稳定性。
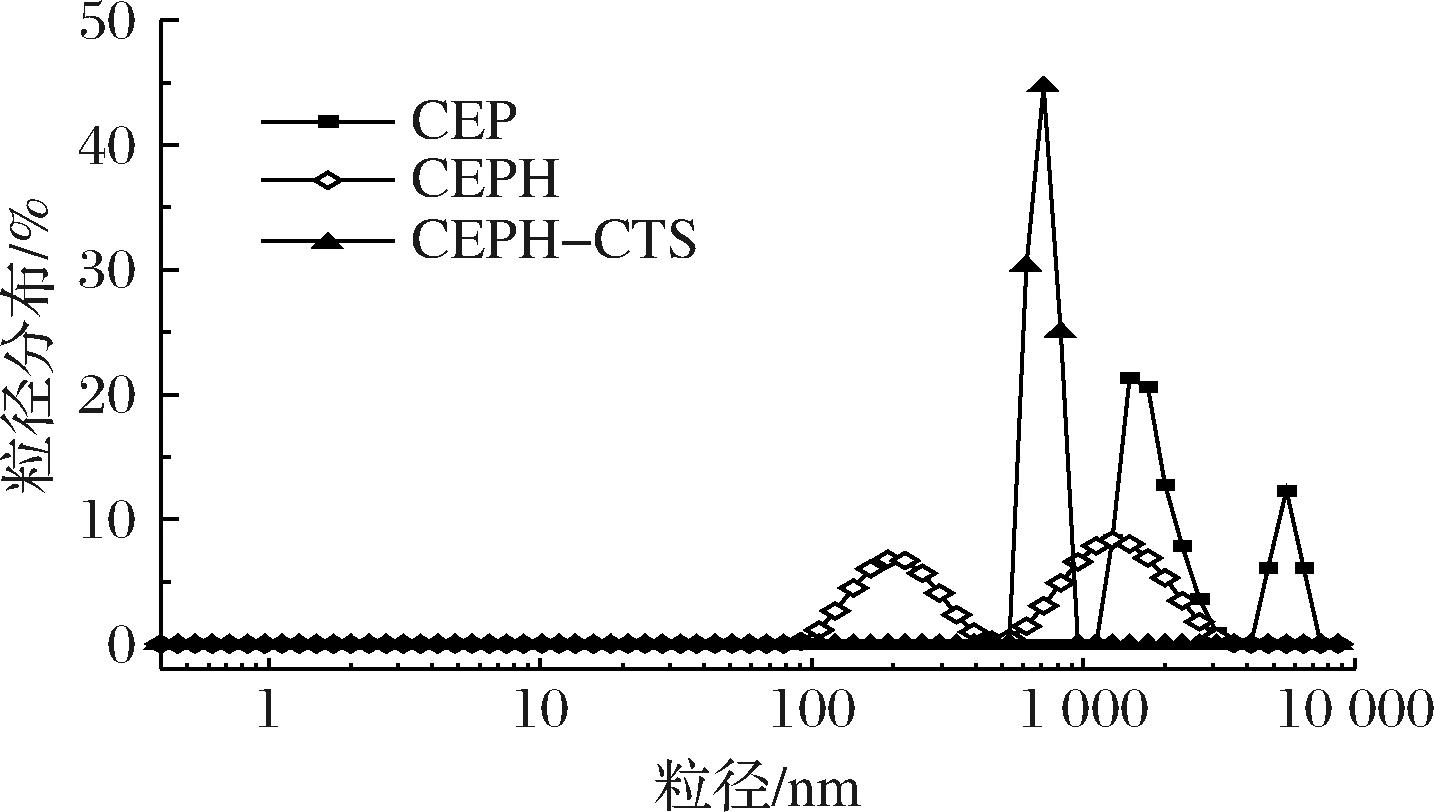
图4 CEP、CEPH和CEPH-CTS粒径分布
Fig.4 Particle size distribution of CEP, CEPH, and CEPH-CTS
2.3.3 内源荧光
一般来说,能产生荧光的芳香族氨基酸残基多数隐藏在蛋白质内部,当蛋白质分子的空间结构展开时,芳香族氨基酸的侧链基团会逐渐暴露在分子表面导致其吸收峰红移[17]。由图5可知,经过木瓜蛋白酶水解后,最大吸收峰发生红移,表明蛋白质三级结构展开,内部环境的亲水性增强。荧光强度主要受酪氨酸到色氨酸的能量转移和相邻基团荧光淬灭的影响。经糖基化,CEPH-CTS最大发射波长保持不变而荧光强度最低,CEPH-CTS由于CTS的引入,蛋白结构发生改变,发色基团被掩盖,导致荧光强度降低。
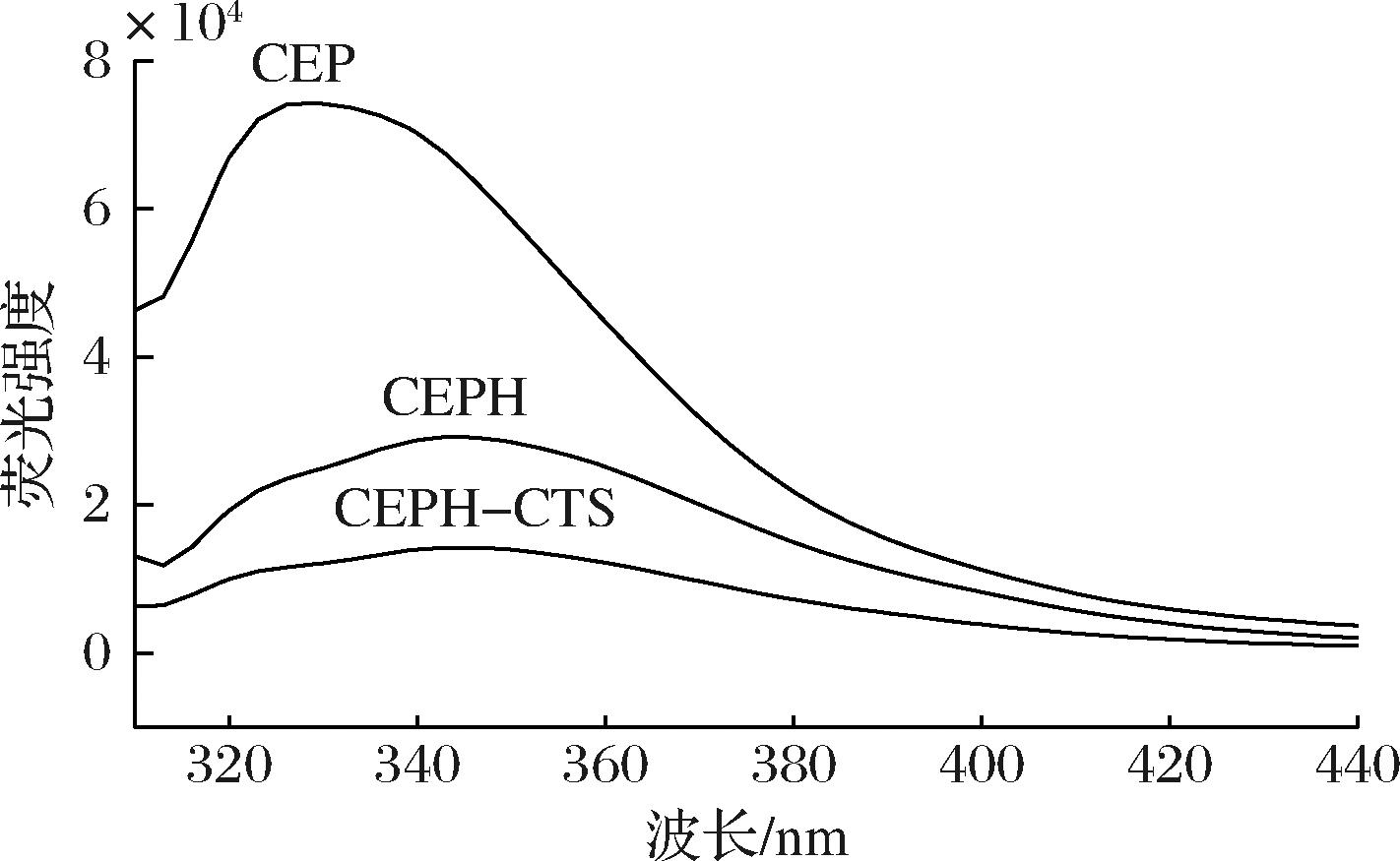
图5 CEP、CEPH和CEPH-CTS荧光光谱
Fig.5 Fluorescence spectrum of CEP, CEPH, and CEPH-CTS
2.3.4 表面疏水性
如图6所示,CEPH表面疏水性显著降低,与WANG等[18]研究一致,使用木瓜蛋白酶水解植物蛋白,酶解产物具有较低的表面疏水性。水解破坏了疏水区域,逐渐形成了亲水基团外露的构象,提高了蛋白在水中的分散性。壳聚糖引入了极性羟基,并且对CEPH的疏水性基团起到保护作用。同时,多糖会引起屏蔽效应,长多糖链使得ANS难以附着在疏水残基上[19],致使CEPH-CTS表面疏水性测定值较低。SHENG等[20]研究发现疏水环境可能更有利于形成β-折叠结构,暴露在外的疏水残基可防止水占据未折叠分子间的空隙。结合FTIR结果,CEP、CEPH、CEPH-CTS的β-折叠含量依次减少,表明酶水解及酶水解结合酶促糖基化较大地提高了CEP亲水性。
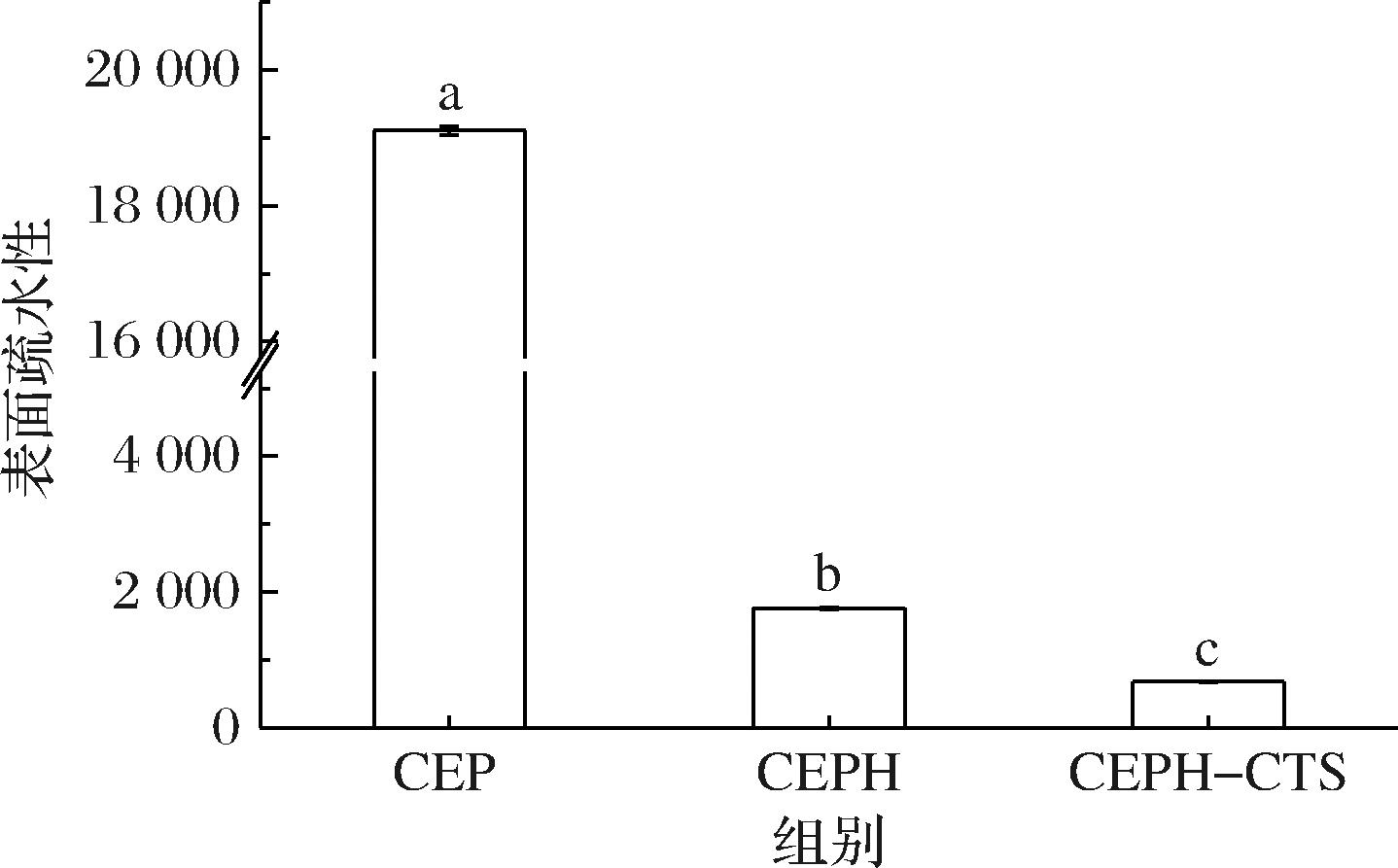
图6 CEP、CEPH和CEPH-CTS表面疏水性
Fig.6 Surface hydrophobicity of CEP, CEPH, and CEPH-CTS
2.3.5 Zeta电位
Zeta电位反映了乳液体系在静电相互作用下的潜在稳定性,Zeta电位绝对值越大,体系越稳定。如图7所示,CEPH的Zeta电位为(-45.80±0.71) mV,较CEP提高了1.7倍。酶解促使CEP肽键断裂,暴露出更多的COO—基团,表面负电荷数量增加,排斥力增强,提高了溶液稳定性。在试验中同时测定了CTS的Zeta电位为(41.97±0.84) mV,而CEPH-CTS的Zeta电位为(-9.95±0.36) mV,甚至低于CEP(-16.50±1.73) mV。交联使得分子间相互作用力发生变化,削弱了静电斥力,导致CEPH-CTS的Zeta电位绝对值降低。HE等[21]使用TG酶催化玉米醇溶蛋白水解物交联壳聚糖寡糖乳酸盐也得到相似结果。
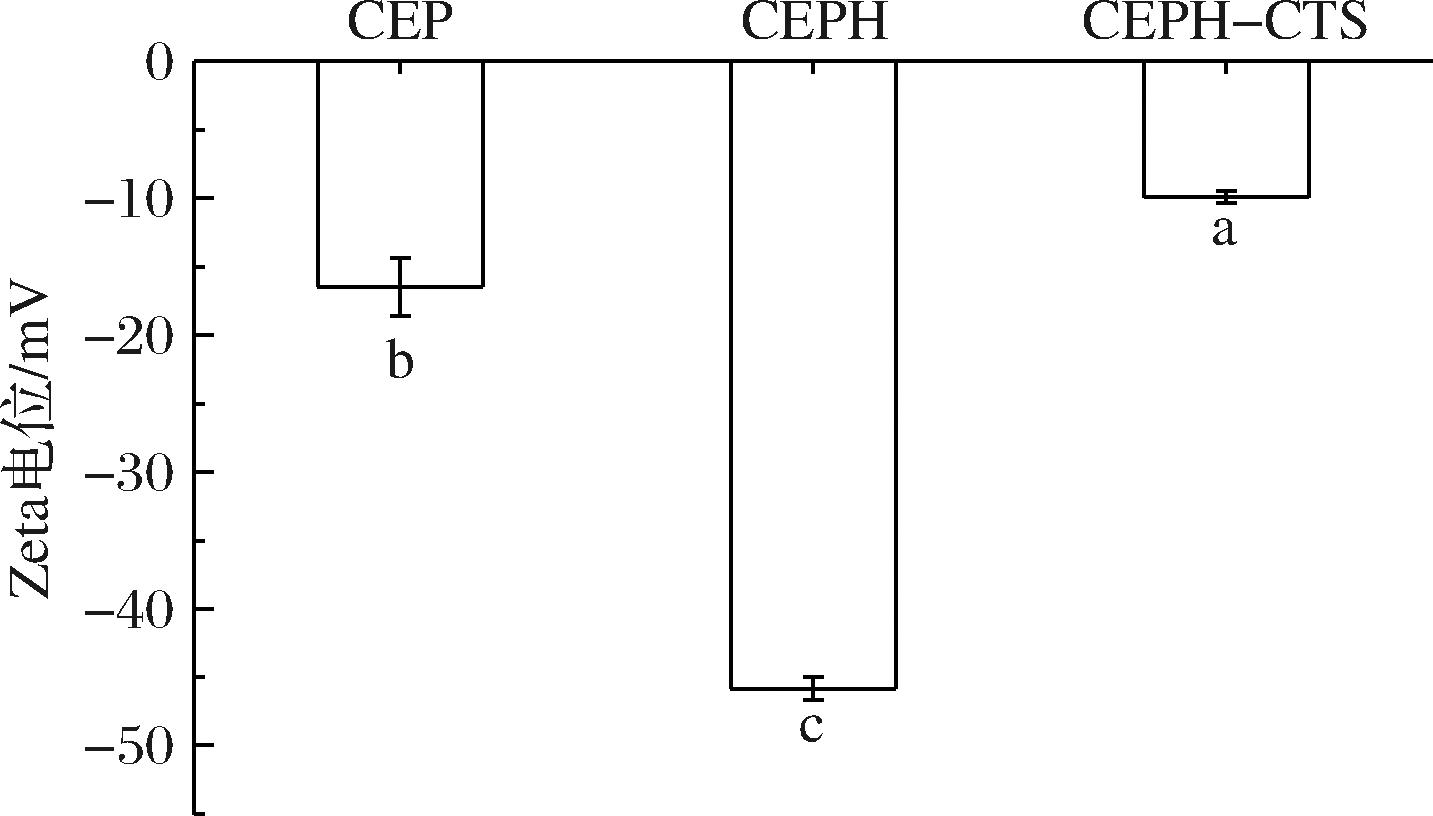
图7 CEP、CEPH和CEPH-CTS 的Zeta电位
Fig.7 Zeta potential of CEP, CEPH, and CEPH-CTS
2.3.6 热稳定性
Td反映热稳定性,ΔH反映有序程度。如图8所示,CEP、CEPH仅呈现1个吸热峰,CEPH-CTS具有2个吸热峰,这种变化是由于CTS的接枝引起的。如表2所示,CEP、CEPH、CEPH-CTS的ΔH依次递增,表明在相同质量情况下,CEPH比CEP具有更多维持空间构象的离子键等功能性官能团[22]。随着TG酶的加入,CEPH与CTS交织,CEPH-CTS具备更为有序的结构, 使得ΔH再次增加。与CEP相比,CEPH 样品具有较低的Td (68.66 ℃),这是因为CEPH具有较低分子质量,分子键被破坏,增加了蛋白水解物分子间的吸引力,导致CEPH水分含量升高,最终降低Td[23]。CEPH-CTS的Td高于CEPH,CTS阻碍CEPH分子间聚集,Td提升。同时可以说明TG酶促使CEPH与CTS 交联形成复杂的结构,因此需要更高的能量破坏原有结构,ΔH同时增加,这与SORDE等[24]研究结果一致。
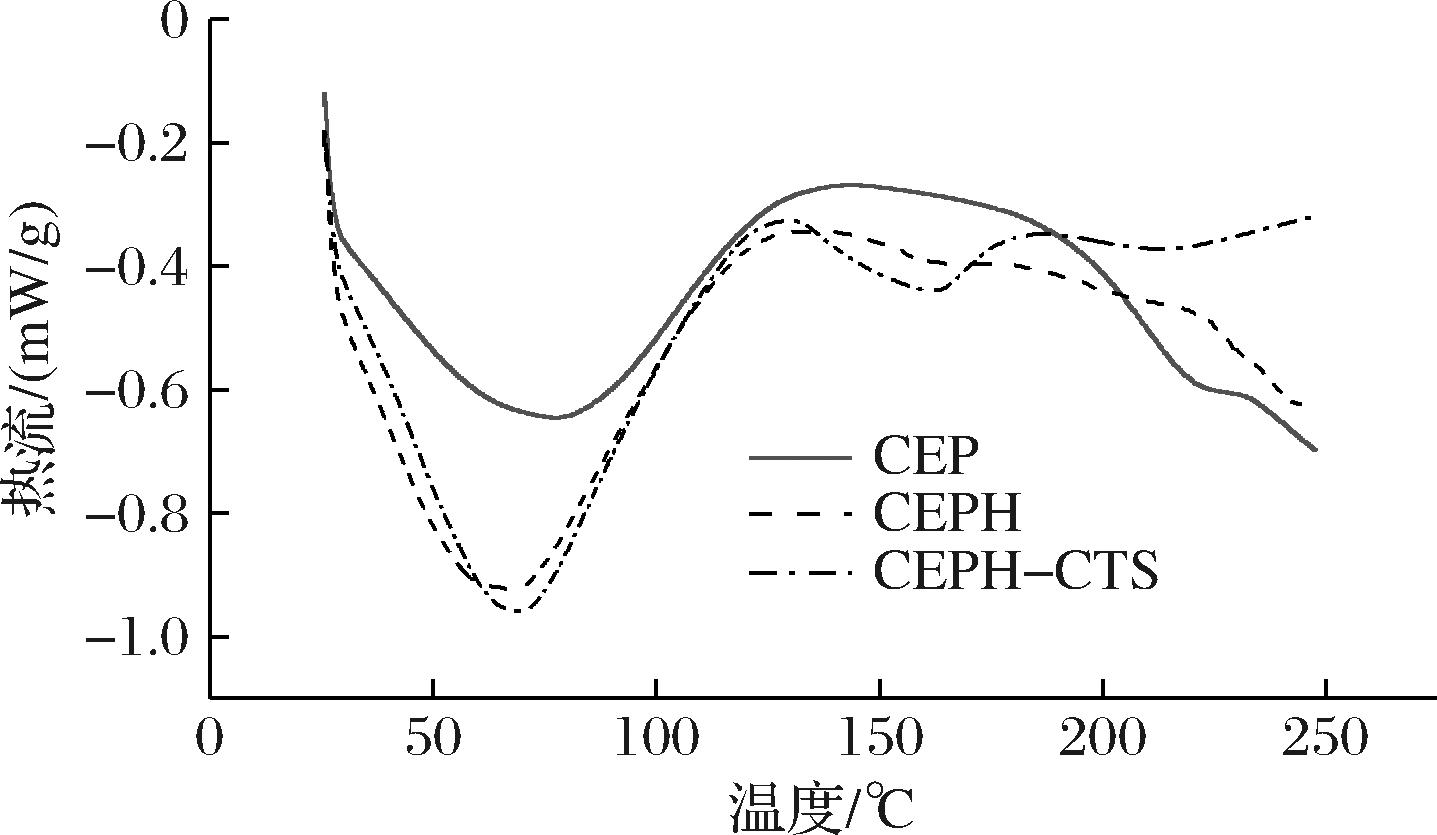
图8 CEP、CEPH和CEPH-CTS差示扫描量热图
Fig.8 Differential scanning calorimetry curves of CEP, CEPH and CEPH-CTS
表2 CEP、CEPH和CEPH-CTS DSC的Td与ΔH
Table 2 DSC Td and ΔH of CEP, CEPH, and CEPH-CTS
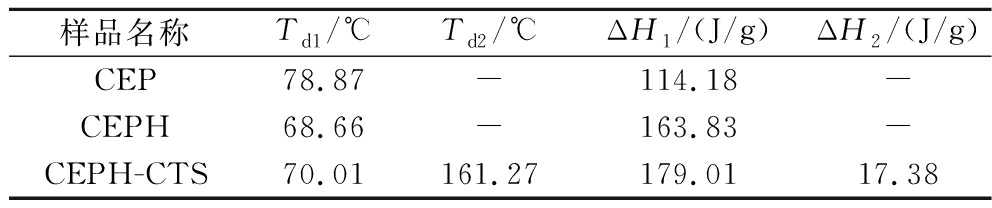
样品名称Td1/℃Td2/℃ΔH1/(J/g)ΔH2/(J/g)CEP78.87-114.18-CEPH68.66-163.83-CEPH-CTS70.01161.27179.0117.38
注:-代表无数据。
2.3.7 溶解度
如图9所示,与CEP相比,CEPH溶解度提高了76.85%,水解使得CEP的Zeta电位负值变大,净电荷增多促进斥力,增强蛋白质与水的相互作用。CEPH-CTS溶解度最高为 (76.75±1.86)%。将糖类与蛋白质共轭往往会增加蛋白质的溶解度,CTS多羟基的亲水基团的引入进一步提高CEPH对水分子的亲和力。
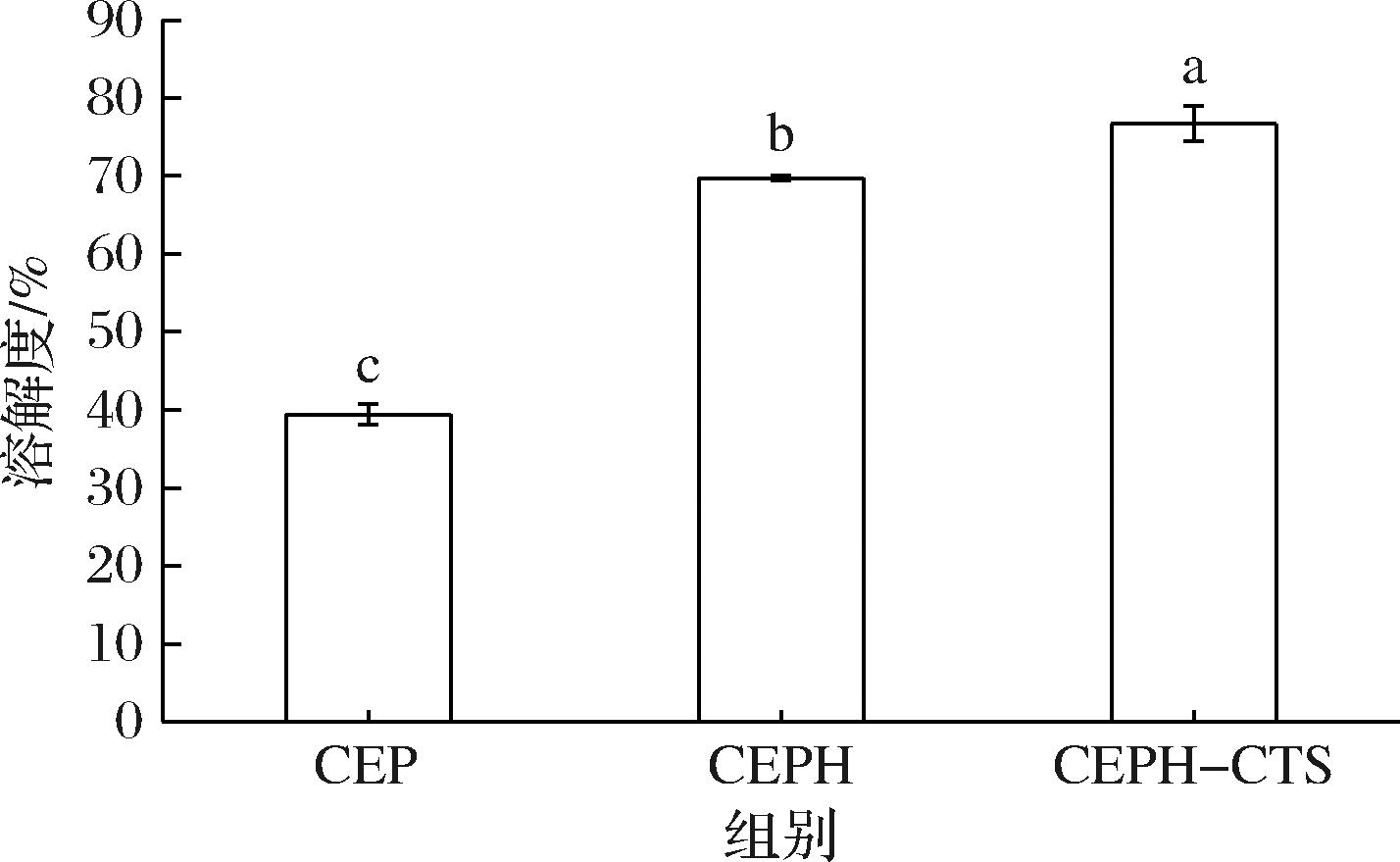
图9 CEP、CEPH和CEPH-CTS 溶解度
Fig.9 Results of solubility of CEP, CEPH, and CEPH-CTS
2.3.8 乳化特性
如图10所示,CEP的ESI最低,为(14.79±0.21)min,CEPH、CEPH-CTS的 ESI依次递增,分别为(51.53±0.75)和(72.55±0.79) min。原因如下:CEPH溶解度提升,增加了CEPH在水溶液中的有效浓度并提高了迁移率,ESI提升;CEPH-CTS形成立体的复杂结构,可结合更多的水分子,致使界面膜更厚,降低了界面张力[25];CEPH-CTS可将疏水性蛋白质分子重新定向至油相,而将亲水性糖定向到水相,依靠糖链长度增加油水界面层强度,进一步延缓油滴的聚集和凝聚[26]。与ESI趋势不同,CEPH的EAI最大,为(40.97±0.13) m2/g,而CEPH-CTS略有降低为(40.72±0.17) m2/g,粒径结果显示,较大的粒径减慢CEPH-CTS在界面吸附速率。
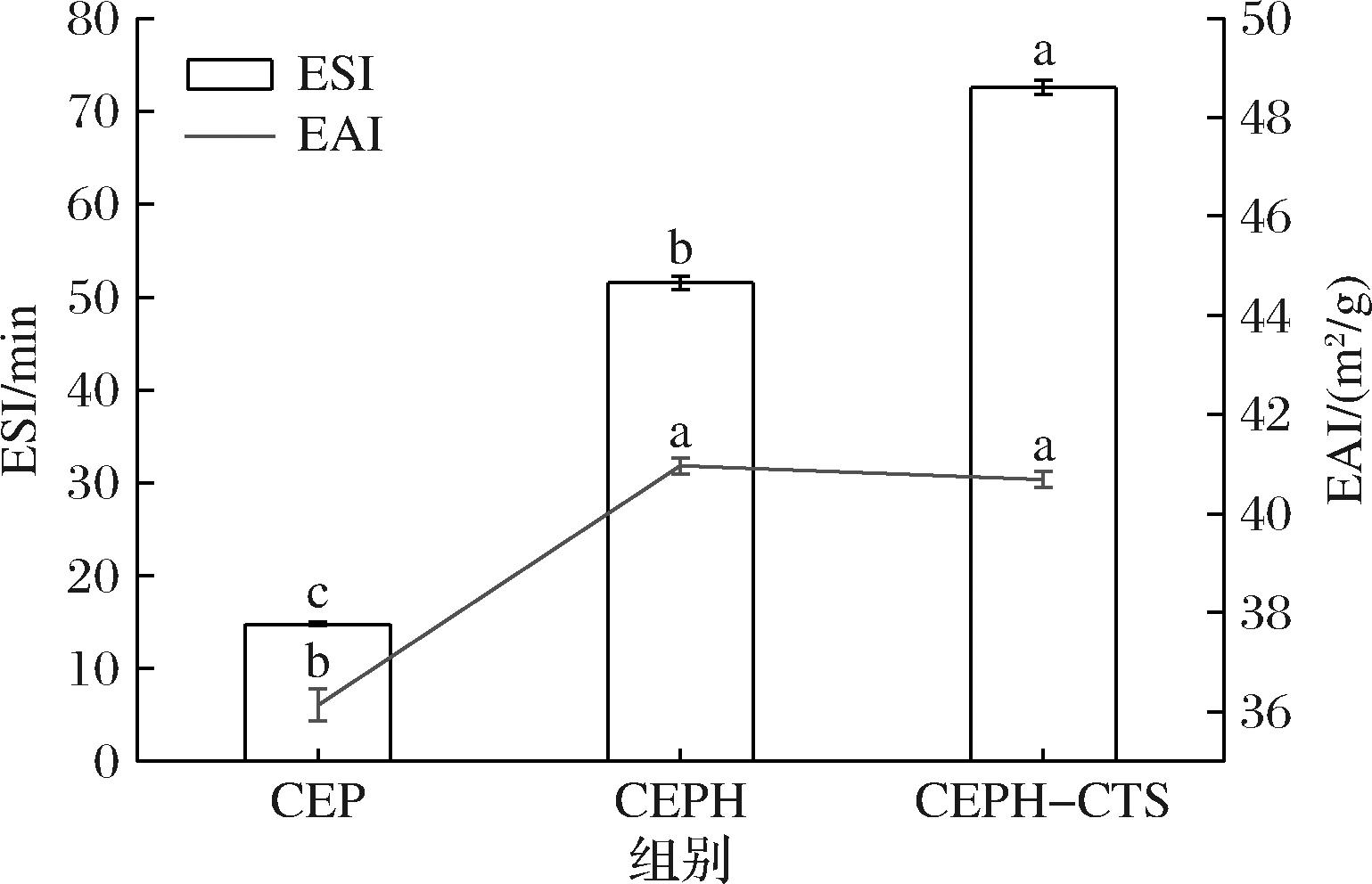
图10 CEP、CEPH和CEPH-CTS乳化活性和乳化稳定性
Fig.10 Emulsifying ability and emulsifying stability of CEP, CEPH, and CEPH-CTS
3 结论
本文探究了不同改性方法对于CEP乳化特性的影响,制备了CEPH-CTS。酶水解结合酶促糖基化可使CEP溶解度和乳化稳定性显著提高。CEPH-CTS的乳化稳定性相比CEP、CEPH提高390.53%和40.79%。首先利用木瓜蛋白酶在底物质量分数5%,加酶量4 000 U/g条件下水解CEP,获得水解度(7.29±0.11)%的CEPH;随后使用TG酶催化CEPH与CTS结合,通过单因素试验得到最适接枝条件为:反应时间60 min、蛋白水解物∶壳聚糖为2∶1、TG酶添加量60 U/g、反应pH=7。结果表明,使用木瓜蛋白酶水解破坏了CEP疏水区域,肽链被切断,CEPH亲水性增强;粒径的减小和表面疏水性的下降使得CEPH溶解度增大,乳化过程更易进行。CTS引入了极性羟基,CEPH-CTS表面疏水性再次降低而溶解度再次提升,保证了溶液的蛋白浓度;较为均匀的粒径分布以及多糖在连续相形成的立体空间结构使得乳化稳定性升高。CEPH-CTS具有更高的热变性焓值,这将有利于CEPH-CTS在极端温度条件下保持乳液的稳定。CEPH-CTS可作为一种新型乳化剂在食品中使用。
[1] YU Y L, LU X Y, ZHANG T H, et al.Tiger nut (Cyperus esculentus L.):Nutrition, processing, function and applications[J].Foods, 2022, 11(4):601.
[2] CHUKWUMA E R, OBIOMA N, CHRISTOPHE O I.The phytochemical composition and some biochemical effects of Nigerian tigernut (Cyperus esculentus L.) tuber[J].Pakistan Journal of Nutrition, 2010, 9(7):709-715.
[3] 王琳, 周国卫, 于志超, 等.pH值偏移处理对油莎豆蛋白结构及乳化性质的影响[J].食品科学, 2020, 41(22):34-41.WANG L, ZHOU G W, YU Z C, et al.Effect of pH-shifting treatment on the structure and emulsifying properties of Cyperus esculentus L.protein[J].Food Science, 2020, 41(22):34-41.
[4] CUI Q, WANG L, WANG G R, et al.Ultrasonication effects on physicochemical and emulsifying properties of Cyperus esculentus seed (tiger nut) proteins[J].LWT, 2021, 142:110979.
[5] LI C X, LI W Y, ZHANG X, et al.The changed structures of Cyperus esculentus protein decide its modified physicochemical characters:Effects of ball-milling, high pressure homogenization and cold plasma treatments on structural and functional properties of the protein[J].Food Chemistry, 2024, 430:137042.
[6] LIU C, BHATTARAI M, MIKKONEN K S, et al.Effects of enzymatic hydrolysis of fava bean protein isolate by alcalase on the physical and oxidative stability of oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry, 2019, 67(23):6625-6632.
[7] CHEN L, CHEN J S, REN J Y, et al.Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J].Journal of Agricultural and Food Chemistry, 2011, 59(6):2600-2609.
[8] 崔心禹, 樊永康, 夏琛, 等.转谷氨酰胺酶促壳聚糖/壳聚糖衍生物对蛋白质糖基化作用的研究进展[J].化工进展, 2019, 38(7):3341-3348.CUI X Y, FAN Y K, XIA C, et al.A review on glycosylation of protein catalyzed by transglutaminase with chitosan/chitosan derivatives[J].Chemical Industry and Engineering Progress, 2019, 38(7):3341-3348.
[9] WANG X J, ZHENG X Q, LIU X L, et al.Preparation of glycosylated zein and retarding effect on lipid oxidation of ground pork[J].Food Chemistry, 2017, 227:335-341.
[10] WANG K N, SUN H, WANG J H, et al.Mechanism on microbial transglutaminase and Tremella fuciformis polysaccharide-mediated modification of lactoferrin:Development of functional food[J].Food Chemistry, 2024, 454:139835.
[11] YAN J K, YANG Z Y, QIAO X, et al.Interfacial characteristics and in vitro digestion of emulsion coated by single or mixed natural emulsifiers:Lecithin and/or rice glutelin hydrolysates[J].Journal of the Science of Food and Agriculture, 2022, 102(7):2990-2999.
[12] CHASSAING B, KOREN O, GOODRICH J K, et al.Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J].Nature, 2015, 519(7541):92-96.
[13] ZHANG A Q, WANG L, SONG T R, et al.Effects of high pressure homogenization on the structural and emulsifying properties of a vegetable protein:Cyperus esculentus L[J].LWT, 2022, 153:112542.
[14] CAO G S, SHI Y X, LI J, et al.Plant proteins from Semen astragali complanati:Functional and physicochemical properties and antioxidant activity[J].LWT, 2024, 212:116919.
[15] RICARDO F, PRADILLA D, CRUZ J C, et al.Emerging emulsifiers:Conceptual basis for the identification and rational design of peptides with surface activity[J].International Journal of Molecular Sciences, 2021, 22(9):4615.
[16] LIN D Q, SUN L C, CHEN Y L, et al.Peptide/protein hydrolysate and their derivatives:Their role as emulsifying agents for enhancement of physical and oxidative stability of emulsions[J].Trends in Food Science &Technology, 2022, 129:11-24.
[17] ZHANG X X, WANG L, CHEN Z X, et al.Effect of electron beam irradiation on the structural characteristics and functional properties of rice proteins[J].RSC Advances, 2019, 9(24):13550-13560.
[18] WANG Y Y, WANG C Y, WANG S T, et al.Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J].Food Chemistry, 2021, 345:128765.
[19] ZHENG Y M, LI Z Y, LU Z Y, et al.Structural characteristics and emulsifying properties of lotus seed protein isolate-dextran glycoconjugates induced by a dynamic high pressure microfluidization Maillard reaction[J].LWT, 2022, 160:113309.
[20] SHENG L, TANG G Y, WANG Q, et al.Molecular characteristics and foaming properties of ovalbumin-pullulan conjugates through the Maillard reaction[J].Food Hydrocolloids, 2020, 100:105384.
[21] HE W Y, TIAN L, FANG F, et al.Limited hydrolysis and conjugation of zein with chitosan oligosaccharide by enzymatic reaction to improve functional properties[J].Food Chemistry, 2021, 348:129035.
[22] ARNTFIELD S D, MURRAY E D.The influence of processing parameters on food protein functionality I.differential scanning calorimetry as an indicator of protein denaturation[J].Canadian Institute of Food Science and Technology Journal, 1981, 14(4):289-294.
[23] ASAITHAMBI N, SINGHA P, SINGH S K.Effect of hydrodynamic cavitation and drying technique on moisture sorption isotherm and structural properties of egg white protein hydrolysate powder[J].Food and Bioprocess Technology, 2025, 18(3):2296-2313.
[24] SORDE K L, ANANTHANARAYAN L.Effect of transglutaminase treatment on properties of coconut protein-guar gum composite film[J].LWT, 2019, 115:108422.
[25] ZHANG X Y, SUN Z Z, ZENG Q, et al.Utilization of ovalbumin-propylene glycol alginate complex system for superior foam:The effect of pH-driven phase behavior[J].Food Hydrocolloids, 2023, 135:108169.
[26] JIANG S J, ZHAO X H.Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product[J].International Dairy Journal, 2011, 21(4):198-205.