γ-聚谷氨酸(γ-polyglutamic acid, γ-PGA)是纳豆表面白色黏性物质的主要成分之一,是一种水溶性聚合物,由D-或L-谷氨酸经酰胺键连接氨基和γ-羧基,对人体和环境无毒无害,能食用,有生物降解性,可以大量吸附水和金属离子,目前已被开发出在食品工业、化妆品工业、药物载体等领域具有多种用途[1]。作为污水处理的絮凝剂时,尽管其具有较大的分子质量,但其表面所含的负电荷不利于水体中同样带负电荷的胶体絮凝。TANIGUCHI等[2]使用交联聚谷氨酸絮凝多种废水但偶尔需要加入聚氯化铝进行前处理,MA等[3]用聚谷氨酸复配CaO絮凝褐藻,这些处理手段均可调整聚谷氨酸所带表面电荷。阳离子改性是一种可行的增加正电荷的方式,但目前对γ-PGA阳离子改性的研究较少,仅董志鹏[4]利用醚化和曼希尼反应制备了阳离子改性的γ-PGA絮凝剂,但其用于海水絮凝时依然需要与FeCl3复配使用,方能取得较高的絮凝效率。
壳聚糖(chitosan, CTS)是天然多糖甲壳素脱乙酰基的产物,表面带有由氨基(—NH3)和羟基(—OH)等官能团构成的活性吸附位点,被认为是一种绿色安全的絮凝剂组分。高正电性的壳聚糖通过电荷中和或吸附桥接机制使水体中带负电性的胶体不稳定,从而发生絮凝[5]。但是壳聚糖较差的水溶性和较低的分子质量限制了其在絮凝中的应用,目前,通过季铵盐改性可以提高壳聚糖的溶解性及其絮凝效率[6],但若不能进一步提高壳聚糖的分子质量,其絮凝效果仍无法满足包括微藻采收在内的许多应用场景。
微藻作为一种高效绿色的生物反应器而备受关注,可用于生产油脂、蛋白质或作为食品及饲料原料[7-8]。目前,微藻生物量的收获是微藻生物反应器推广使用的主要难点,是微藻生物质生产过程中最昂贵的步骤(约占总成本的20%~30%)[9]。而混凝-絮凝技术是最有效的收获技术之一,可显著降低收获成本,有着广阔的应用前景。目前常用的商业絮凝剂可分为无机絮凝剂和有机合成絮凝剂,前者包括铁盐、铝盐等,后者如聚丙烯酰胺等。尽管无机絮凝剂对收获非常有效,但其使用量较大可能造成残留污染,并增加人类健康风险问题。同时从微藻细胞中分离这些化学絮凝剂也极其困难,这限制了微藻的下游加工[10]。有机合成絮凝剂聚丙烯酰胺虽然降低了用量,但有证据表明其对微藻损伤较为严重,会提前导致微藻细胞破裂[11]。相比之下壳聚糖等天然基絮凝剂既降低了用量,又避免了损伤,可能是一种良好的收获方法。
本研究使用聚谷氨酸和壳聚糖2种生物高分子作为原料,制备季铵盐改性的聚谷氨酸-壳聚糖生物高分子絮凝剂,用于小球藻培养液中藻体的絮凝采收,并通过傅里叶变换红外光谱、扫描电镜、zeta电位测定等多种分析手段,对改性产物进行表征,同时,探究改性产物的絮凝机理。
1 材料与方法
1.1 材料与试剂
CTS(脱乙酰度91.3%,黏度73 mPa·s),中国上海毕得医药;改性剂2,3-环氧丙基三甲基氯化铵(glycidyl trimethyl ammonium chloride, GTA)(纯度≥95%),中国上海麦克林生化科技股份有限公司;HCl、NaOH(分析纯),中国上海国药集团化学试剂有限公司。
γ-PGA,本实验室用地衣芽孢杆菌(Bacillus licheniformis) WX-02 (CCTCC M208065)发酵生产,具体过程参照王思等[12]的实验方案,在其发酵培养基的基础上增加了40 g/L的谷氨酸钠作为合成底物,具体配方(g/L):80 葡萄糖,40 谷氨酸钠,15 NaNO3,7 NH4Cl,0.5 MgSO4·7H2O,0.5 K2HPO4·3H2O,0.15 CaCl2,0.04 FeCl3,0.04 MnSO4·H2O,调pH值至7.2。
絮凝用微藻藻液来自于武汉水生所高密度培养小球藻(Chlorella sp.CMBB266),用去离子水稀释至OD680=1.5±0.15。
1.2 仪器与设备
5L台式玻璃发酵罐,迪必尔生物工程(上海)有限公司;SBA生物传感分析仪,山东省科学院生物研究所;MS-H340-S4四联磁力搅拌器,大龙兴创实验仪器;FiveEasy Plus FP20 pH计,梅特勒托利多国际有限公司;FD5-2.5E实验室型冷冻干燥机,金西盟(北京)仪器有限公司;Nicolet IS5傅里叶红外光谱仪、Quattro S扫描电镜,赛默飞世尔科技公司;UV-5900PC分光光度计,中国元析仪器;Mastersizer 2000纳米粒度仪,马尔文帕纳科;Vario EL cube元素分析仪,德国元素分析系统公司。
1.3 实验方法
1.3.1 γ-PGA发酵生产
地衣芽孢杆菌在含50 mL LB液体培养基的250 mL锥形瓶中37 ℃、220 r/min旋转摇床中培养10 h作为种子液。然后接种于含3 L前述γ-PGA发酵培养基的5 L发酵罐,发酵14 h后补加180 g葡萄糖。36 h发酵结束,将发酵液调酸、离心除菌、盐析复溶后所得较纯净PGA酸性溶液。
1.3.2 PGA-CTS的合成
根据发酵液中γ-PGA含量(通常为40 g/L)进行计算后稀释,使60 mL反应液中γ-PGA的质量为1.5 g,用锡纸完全封闭烧杯口,调pH值至5左右,加热至50 ℃。称取1.5 g CTS粉末少量多次加入γ-PGA溶液中,搅拌10 min至形成较均一的浊液。
1.3.3 PGA-CTS-GTA的合成
将若干GTA溶于40 mL水中,用滴管将其逐滴滴入1.3.1节制备的PGA-CTS浊液中,将pH调整到目标pH,反应温度调整为目标温度,反应一段时间。反应过程中每隔50~60 min测量pH值并回调至反应初始值。反应结束后将反应液冷却至室温,调pH值至6~8,置于透析膜中过夜透析,冷冻干燥。
1.3.4 絮凝实验
参考DONG等[13]和WANG等[14]对于微藻絮凝的实验方法,用稀释藻液进行絮凝实验。实验前先以300 r/min搅拌2 min得到均匀混合物。用去离子水新鲜配制质量浓度为0.5%的PGA-CTS-GTA原液,在50 ℃下磁力搅拌至完全溶解或分布均匀。实验中的所有搅拌过程均采用四联磁力搅拌器进行,评价絮凝剂在室温下的絮凝性能。絮凝程序为300 r/min快速混合1 min,沉降15 min。然后立即收集上清液,用分光光度计测量在680 nm下的吸光度。絮凝剂的絮凝效率即浊度去除效率(turbidity removal efficiency,TRE)按公式(1)计算:
(1)
式中:A1、A0,处理后藻液液面下2 cm、原藻液液面下2 cm的吸光度。
1.4 发酵参数检测
1.4.1 生物量的检测
菌体光密度法:取发酵液0.5 mL,加0.5 mL 6 mol/L盐酸,12 000 r/min离心5 min。弃上清液,加1 mL去离子水重悬,用去离子水稀释到合适比例测定OD600。
1.4.2 葡萄糖和谷氨酸含量检测
使用SBA生化传感分析仪测定,将发酵液12 000 r/min离心3 min,取上清液用适量去离子水稀释至合适倍数直接测定。
1.4.3 NaNO3含量检测
水杨酸消化法:以等体积去离子水作对照,取0.1 mL稀释10~20倍的发酵液于试管中,加入0.4 mL 50 g/L水杨酸硫酸溶液,摇晃混匀室温静置20 min,加9.5 mL 80 g/L NaOH溶液,静置溶液5 min,测定OD410,配制NaNO3梯度浓度标准品,根据标准曲线计算NaNO3浓度。
1.4.4 聚谷氨酸含量检测
CTAB法:以等体积去离子水作对照,取1 mL稀释500倍的发酵液于比色皿中,加入1 mL 0.15 mol/L CTAB的20 g/L NaOH溶液吹匀后反应3~5 min,测定OD400,配制聚谷氨酸梯度浓度标准品,根据标准曲线计算聚谷氨酸浓度。
1.5 表征
1.5.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
对PGA-CTS和PGA-CTS-GTA的化学结构进行表征,扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数16。
1.5.2 扫描电子显微镜分析
将干燥的PGA-CTS和PGA-CTS-GTA裁剪至合适大小,黏在导电胶上喷金,用场发射扫描电子显微镜观察二者表面形貌,拍照观察并记录。
1.5.3 元素分析(elemental analysis,EA)计算取代度
将干燥的PGA-CTS和PGA-CTS-GTA粉末用元素分析仪C/N模式测量C、N元素含量。通过反应前PGA-CTS的CN质量比与反应后干燥产物PGA-CTS-GTA的CN质量比可计算季铵化程度DQ,其计算过程大致如下:设PGA-CTS和PGA-CTS-GTA的碳氮比分别为RC/N和![]() 设季铵度为DQ,1∶1的PGA-CTS分子式可表示为C5.5H9NO3.5,PGA-CTS-GTA分子式可表示为(C5.5H9NO3.5)1-DQ,(C11.5H21N2O3.5Cl)DQ,则有如下关系,如公式(2)~公式(4)所示:
设季铵度为DQ,1∶1的PGA-CTS分子式可表示为C5.5H9NO3.5,PGA-CTS-GTA分子式可表示为(C5.5H9NO3.5)1-DQ,(C11.5H21N2O3.5Cl)DQ,则有如下关系,如公式(2)~公式(4)所示:
(2)
(3)
公式(2)代入公式(3)得:
解得式(4):
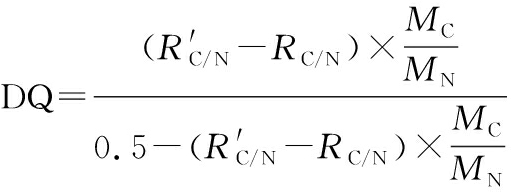
(4)
式中:MC、MN,C、N的相对原子质量。
1.5.4 Zeta电位测定
精确称量定量样品并配制成0.5 g/L的PGA-CTS-GTA溶液,利用稀NaOH溶液和稀HCl溶液将其调为pH 2.5~10.5的溶液,使用纳米粒度仪测量各个体系的Zeta电位。
2 结果与分析
2.1 γ-PGA发酵生产
在发酵过程中测量菌体生长情况及底物和γ-PGA产物的浓度,结果如图1所示。随着发酵时间增长,菌体不断消耗葡萄糖和NaNO3,并将谷氨酸聚合成γ-PGA,当发酵时间超过24 h,菌体浓度OD600值达到8.16后不再增长甚至有所下降,但γ-PGA仍可继续合成至36 h发酵结束,此时γ-PGA质量浓度达到42.5 g/L。这可能是由于发酵液中γ-PGA浓度过高导致黏度较大,进而造成溶氧传质不佳,从而导致菌体生长缓慢甚至死亡。发酵液经过简单处理后即作为反应底物,无需将γ-PGA纯化和干燥后再复溶,可显著降低反应成本。
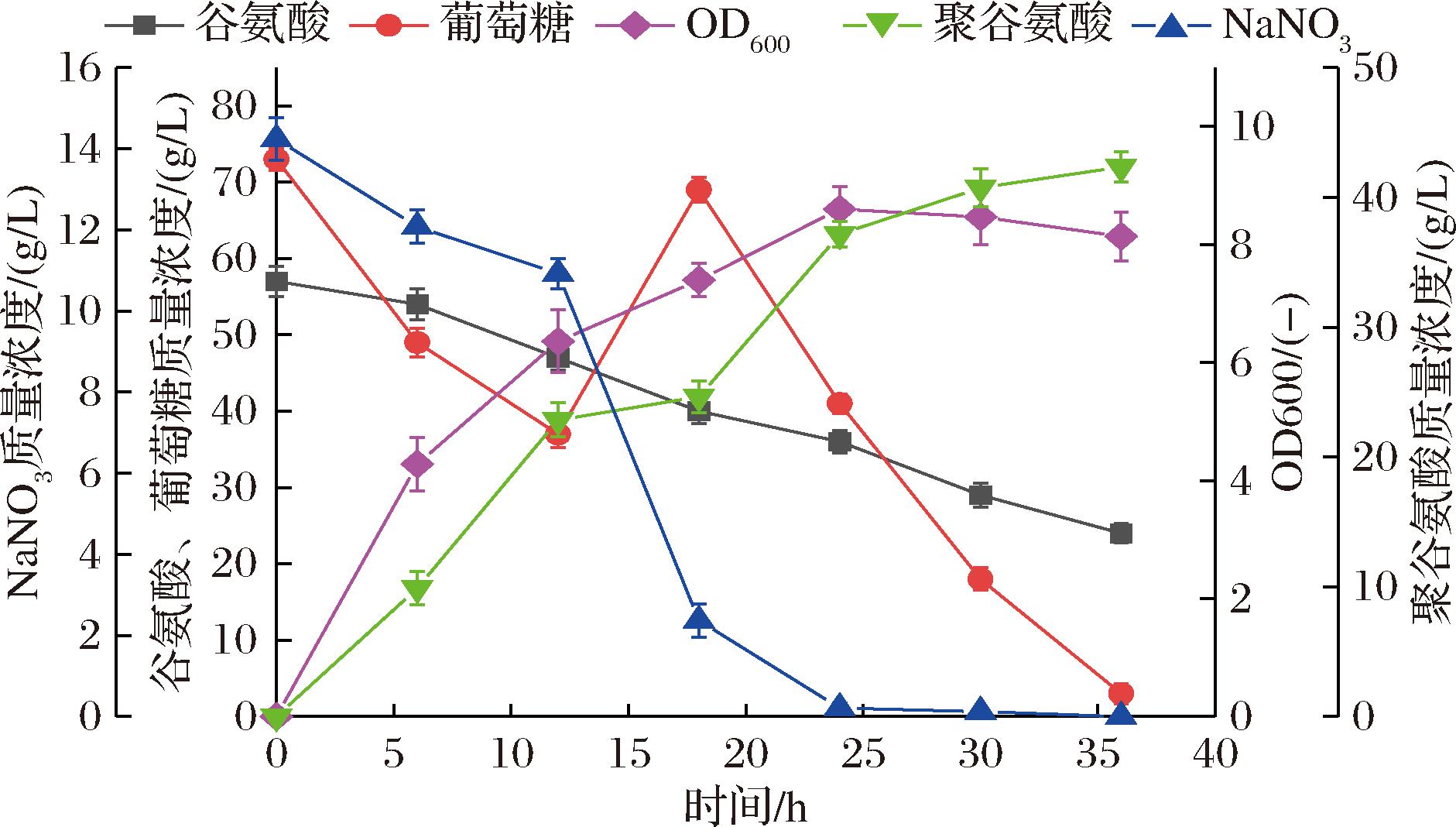
图1 地衣芽孢杆菌发酵产γ-PGA菌浓度及底物和产物浓度变化(14 h补加180 g葡萄糖)
Fig.1 Concentration changes of B. licheniformis during fermentation to produce γ-PGA, and substrate and product concentration changes (180 g glucose added after 14 h)
2.2 反应pH对微藻絮凝的影响
如图2所示,反应pH值维持在3.0附近时,制备得到的聚谷氨酸/壳聚糖混合改性物的絮凝效果最佳,投加量为50 mg/L时絮凝效率达到64.44%,而投加量为100 mg/L时絮凝效率达到71.48%。随着反应pH值提高到4.5时,投加50、100 mg/L混合高分子改性物的絮凝效率分别为31.37%和43.67%,相比反应pH值为3.0时分别下降了33.07%和27.81%。当pH值提高到接近中性的6.0和偏碱性的8.0时,混合高分子改性物的絮凝效果显著降低,50~300 mg/L投加量对应的絮凝效率均低于20%。目前报道的与GTA反应的途径以碱性条件或非均相为主,本研究则是在酸性条件下进行反应。其反应机理可能为酸性条件下环氧基的质子化活化,质子化后的氧鎓环亲电性大大增强,极容易被氨基等亲核基团进攻开环发生加成反应。
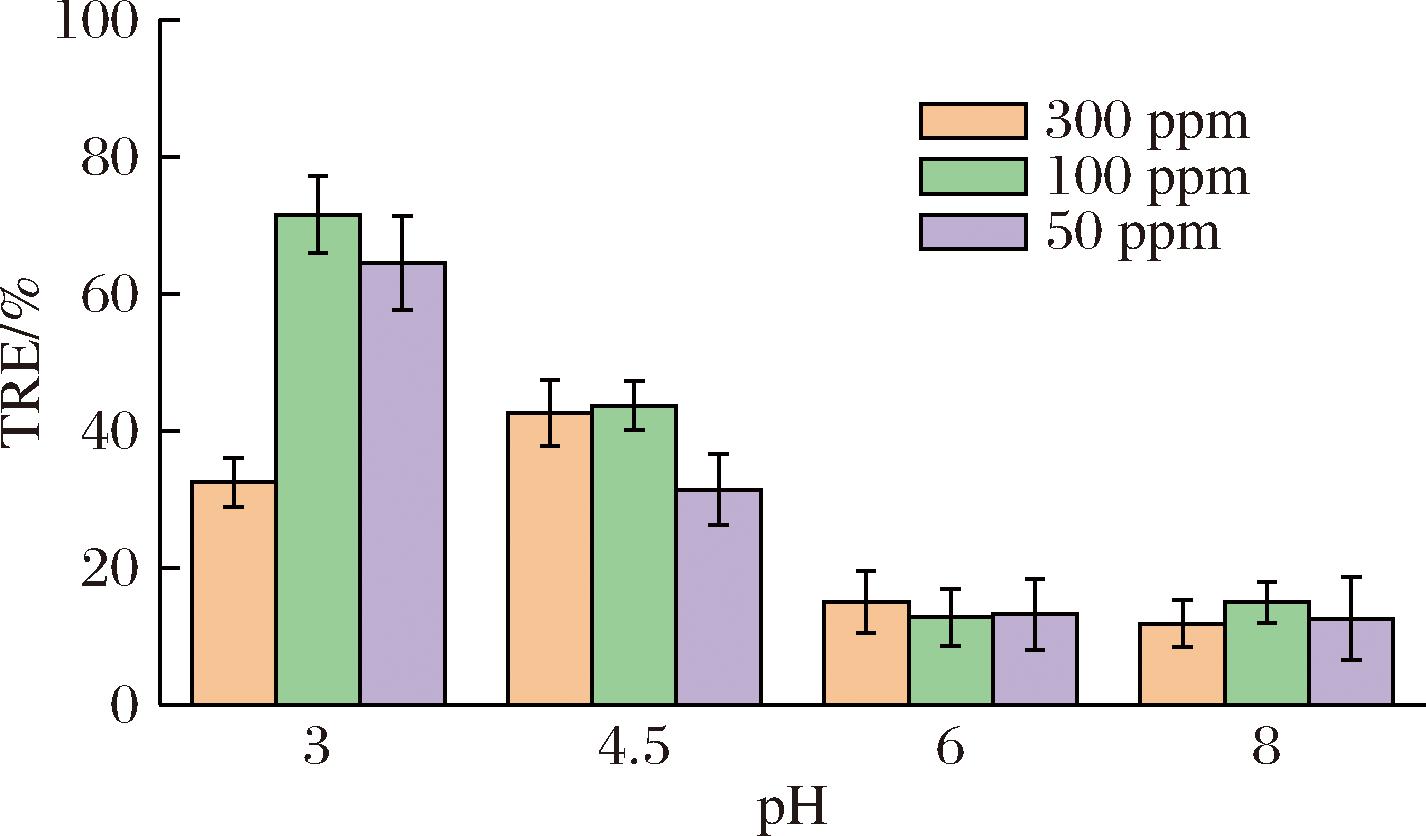
图2 反应pH对微藻絮凝的影响
Fig.2 Effect of reaction pH on microalgae flocculation
2.3 改性剂添加量对微藻絮凝的影响
当固定聚谷氨酸和壳聚糖混合物(1∶1,质量比)总质量浓度为30 g/L时,季铵盐添加浓度设定为高分子混合物浓度的5、7、9、11倍,絮凝结果如图3所示。其中,季铵盐与高分子混合物浓度比为5∶1时,制备得到的改性混合物在50、100 mg/L投加量下的絮凝效果分别43.93%和51.45%;当季铵盐与高分子混合物浓度比提高至7∶1时,50、100 mg/L的改性混合物对应絮凝效果达到59.15%和61.51%,相比浓度比5∶1的条件下均提高了10%左右。进一步提高季铵盐与高分子混合物浓度比并不会提升改性混合物的絮凝效果。这是因为反应底物PGA-CTS中活性基团量是固定的,未到最适添加量时,反应底物的活性基团远大于参加反应的醚化剂物质的量,PGA-CTS分子链上有着充足的活性基团提供给醚化剂进行阳离子改性;若醚化剂添加量超过最适点后,可供反应的活性基团个数在不断减少逐渐趋于饱和,PGA-CTS-GTA的微藻絮凝效率变化趋于平稳。
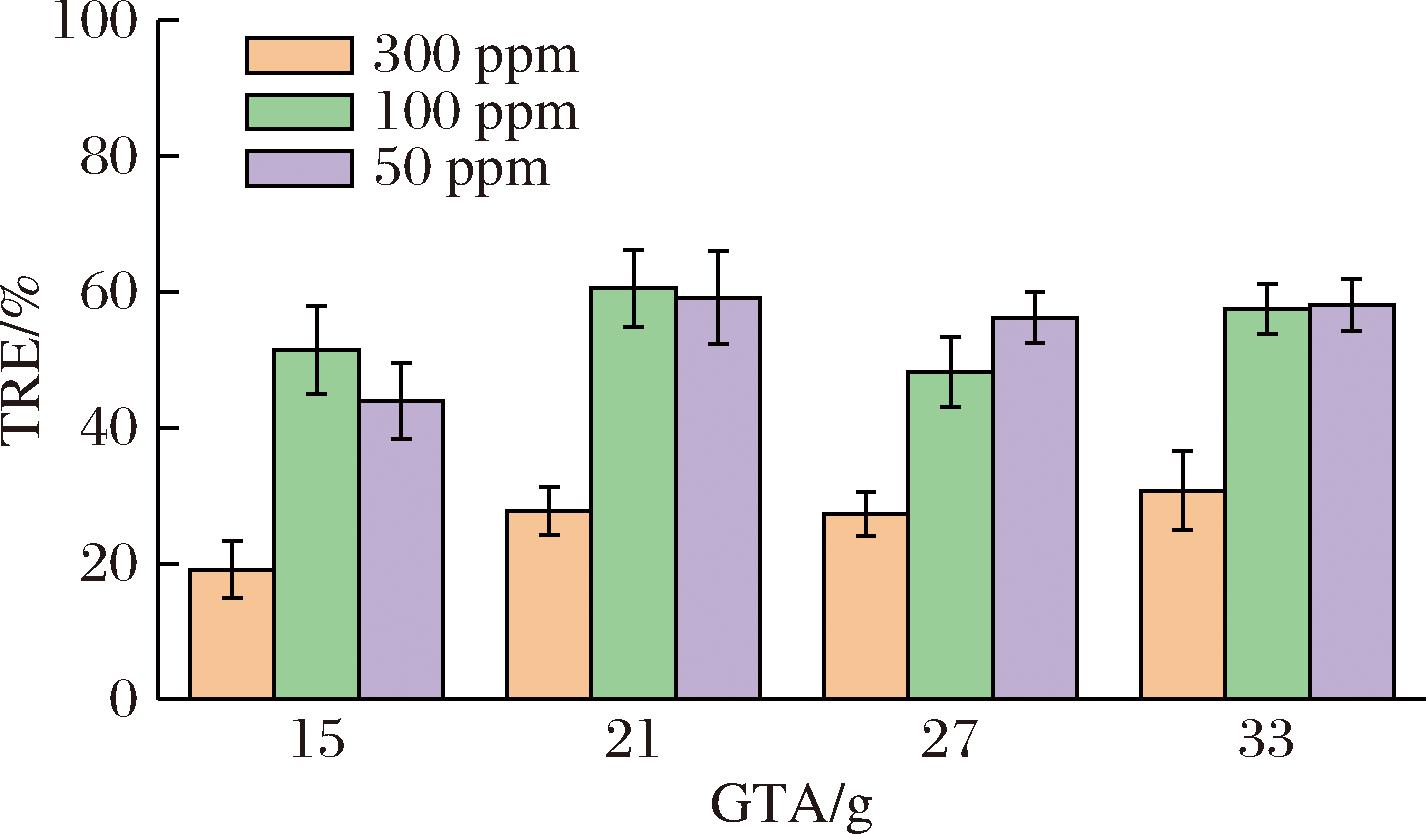
图3 改性剂添加量对微藻絮凝的影响
Fig.3 Effect of modifier dosage on microalgae flocculation
2.4 反应时间对微藻絮凝的影响
维持前述季铵盐与高分子混合物浓度比与反应pH,调整反应时间从0.5 h到7 h,如图4观察到随着反应时间的延长,絮凝效果先上升再下降。当反应时间低于3 h时,絮凝效果随反应时间增长而迅速上升,至3 h时投加量为50、100 mg/L的絮凝效果分别为71.36%和39.05%;在50、100 mg/L投加量下最佳絮凝效果出现在4 h,絮凝效果分别为73.26%和66.78%;在此之后随着反应时间增加絮凝效果缓慢下降。反应底物PGA-CTS中的活性基团量在反应初期发生反应的比例较低;反应时间增加后季铵盐改性比例的增加导致絮凝效果变好;超过最适点后一段时间内可供反应的活性基团个数趋于饱和, PGA- CTS-GTA的微藻絮凝效率趋于平稳;时间过长后PGA分子质量变低,造成PGA-CTS-GTA降低从而影响絮凝结果。再者是随着反应的不断进行,醚化剂接枝到PGA-CTS-GTA分子链上的量不断增多,使得PGA-CTS周围的空间位阻在不断增加,不利于反应继续进行。
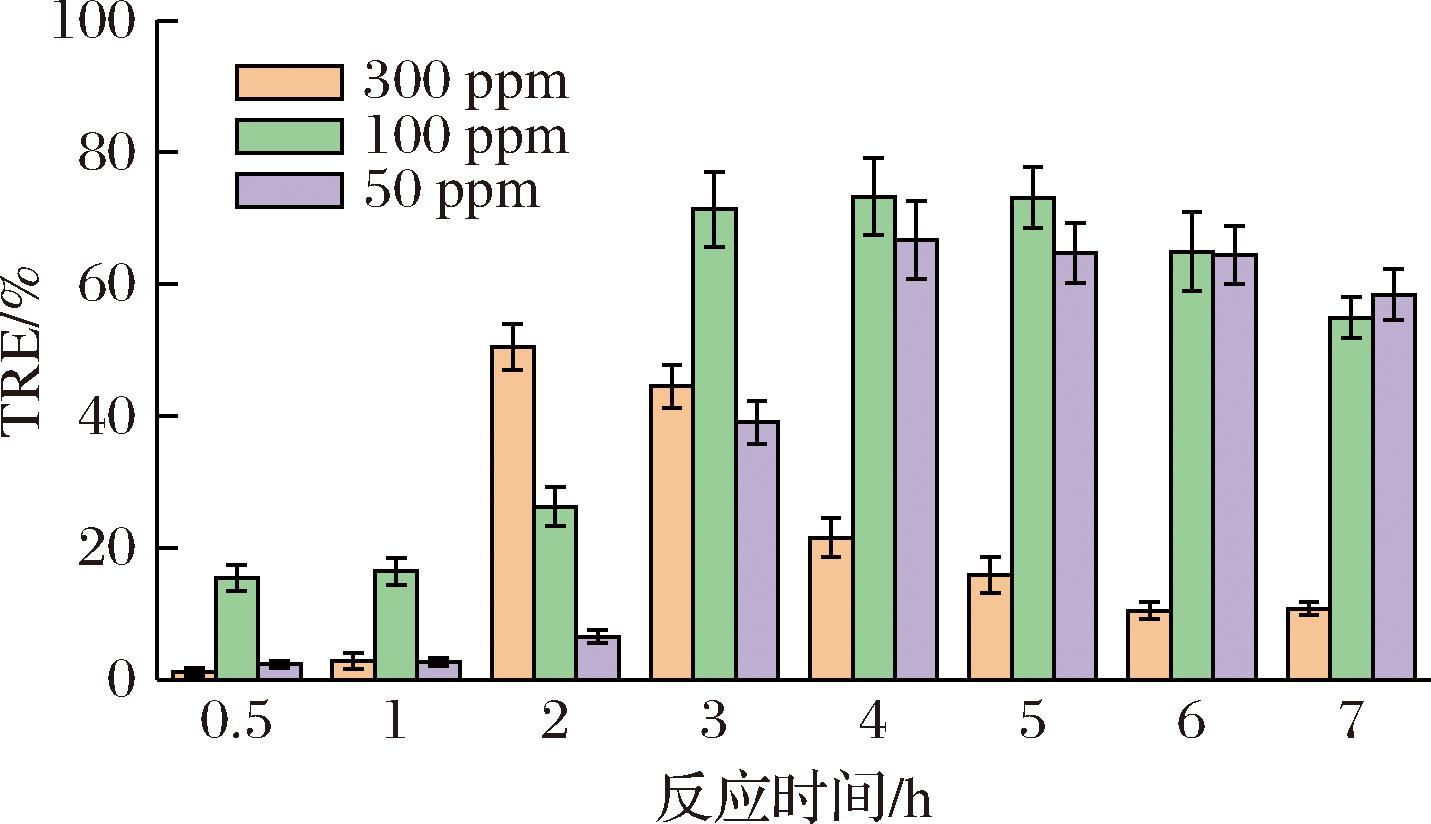
图4 反应时间对微藻絮凝的影响
Fig.4 Effect of reaction time on microalgae flocculation
2.5 反应温度对微藻絮凝的影响
固定反应时间为4 h,调节反应温度为45、55、65、75、85 ℃,结果如图5所示。其中在65 ℃时制备得到的改性混合物在50、100 mg/L投加量下的絮凝效果分别32.01%和68.48%,而温度升高至75 ℃时,50、100 mg/L的改性混合物对应絮凝效果达到67.54%和71.63%,相比65 ℃的条件下50 mg/L提高了1倍,但100 mg/L投加量下仅提高了3.15%。进一步提高季铵盐与高分子混合物反应温度并不会提升改性混合物的絮凝效果,对于大于100 mg/L投加量时甚至有明显负面作用。尽管提高温度可以提高季铵盐接枝反应速率,但PGA在酸性条件下温度越高降解速度越快,造成PGA-CTS-GTA分子质量损失,降低了微藻絮凝效率[15]。
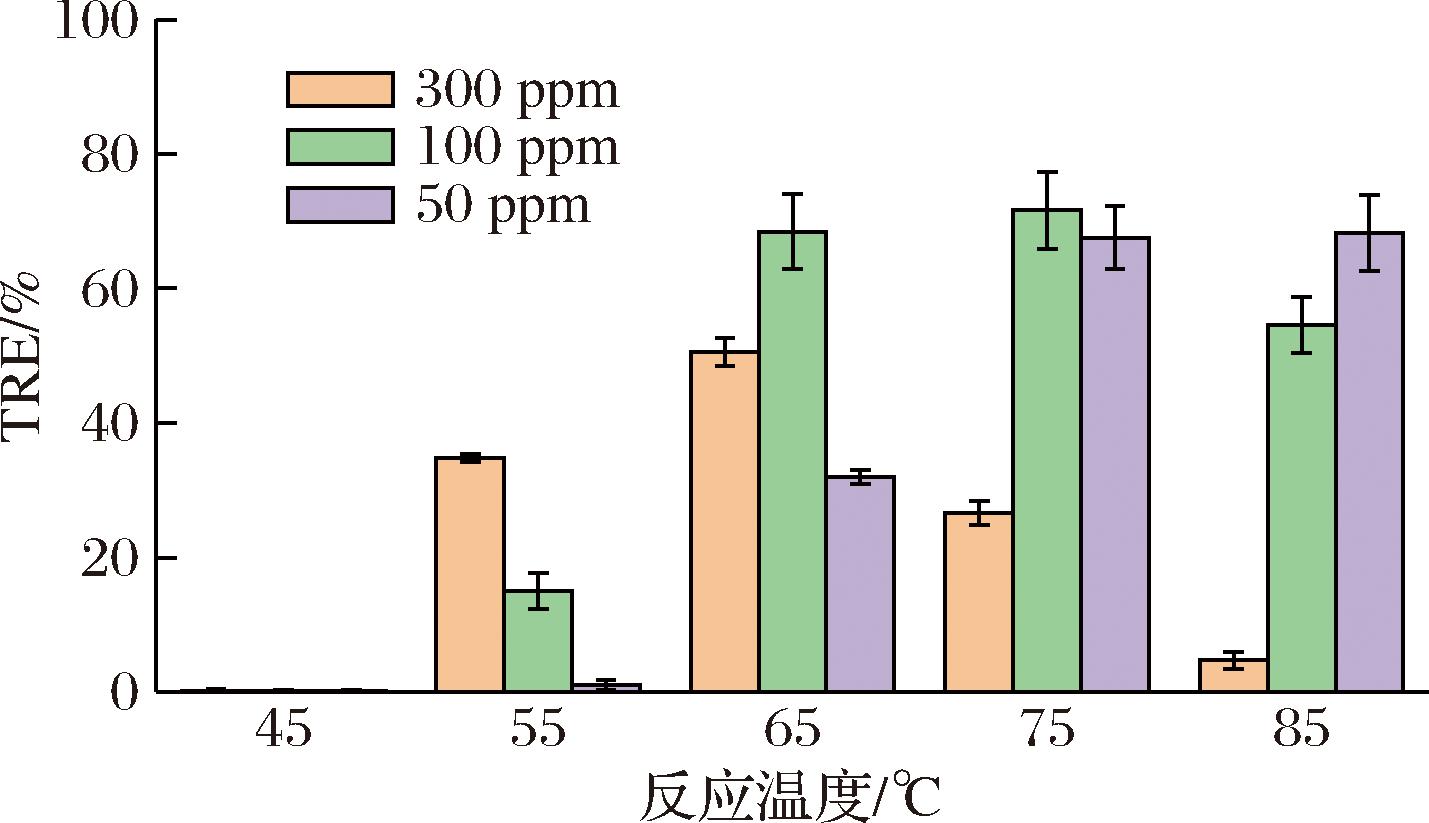
图5 反应温度对微藻絮凝的影响
Fig.5 Effect of reaction temperature on microalgae flocculation
2.6 FTIR分析
红外光谱分析可研究PGA-CTS-GTA化学组成及结构,光谱测量结果如图6所示。无论是壳聚糖和聚谷氨酸的纯物质,还是改性前后的聚谷氨酸/壳聚糖混合物,均在3 400~3 200 cm-1范围内有特征峰,羟基(O—H)和胺基(N—H)的拉伸形成的特征峰在此范围内。壳聚糖及含壳聚糖的混合物在1 080 cm-1处有特征峰出现,而聚谷氨酸纯物质则没有,有文献证实1 080 cm-1处的峰值对应于壳聚糖中糖苷的吸收[16]。与壳聚糖和聚谷氨酸纯物质的图谱对比,聚谷氨酸/壳聚糖混合物中未出现新的特征峰,表明2种物质的混合未产生新的化学键,应是通过物理作用而结合。季铵盐改性后的聚谷氨酸/壳聚糖在1 484 cm-1处出现了一个新的特征峰,这与文献报道季铵盐改性高分子聚合物的报道结果十分相近,这应该是季铵盐取代基上甲基(C—H)的不对称拉伸而形成的[17]。另外,壳聚糖纯物质的游离氨基(C—N)在1 596 cm-1的特征峰[18],在改性混合物中有所减弱。上述结果均表明混合物中壳聚糖的部分氨基与季铵盐发生接枝反应。同时,改性混合物在1 741 cm-1处出现了另一个特征峰,该峰被证实是酯键(C![]() O)的特征吸收峰;此外,改性前的混合物在1 150 cm-1处叔羟基(C—O)拉伸振动的特征峰消失了,这表明季铵盐通过形成酯键成功与聚谷氨酸侧链上的羧基接枝。以上分析结果能证实,季铵盐分别与壳聚糖和聚谷氨酸上的游离基团发生接枝反应。通过查阅相关文献,认为季铵盐与壳聚糖和聚谷氨酸的接枝反应原理应是:在酸性条件下季铵盐醚化剂中的环氧基团发生质子化,形成更为活泼的中间体;γ-PGA中羧酸氧原子的孤对电子可以攻击环氧基团中带正电的碳原子,导致环氧基团开环,形成酯键[19];壳聚糖的氨基作为亲核试剂也能攻击质子化的环氧基团,导致环氧开环,形成β-氨基醇[20]。
O)的特征吸收峰;此外,改性前的混合物在1 150 cm-1处叔羟基(C—O)拉伸振动的特征峰消失了,这表明季铵盐通过形成酯键成功与聚谷氨酸侧链上的羧基接枝。以上分析结果能证实,季铵盐分别与壳聚糖和聚谷氨酸上的游离基团发生接枝反应。通过查阅相关文献,认为季铵盐与壳聚糖和聚谷氨酸的接枝反应原理应是:在酸性条件下季铵盐醚化剂中的环氧基团发生质子化,形成更为活泼的中间体;γ-PGA中羧酸氧原子的孤对电子可以攻击环氧基团中带正电的碳原子,导致环氧基团开环,形成酯键[19];壳聚糖的氨基作为亲核试剂也能攻击质子化的环氧基团,导致环氧开环,形成β-氨基醇[20]。
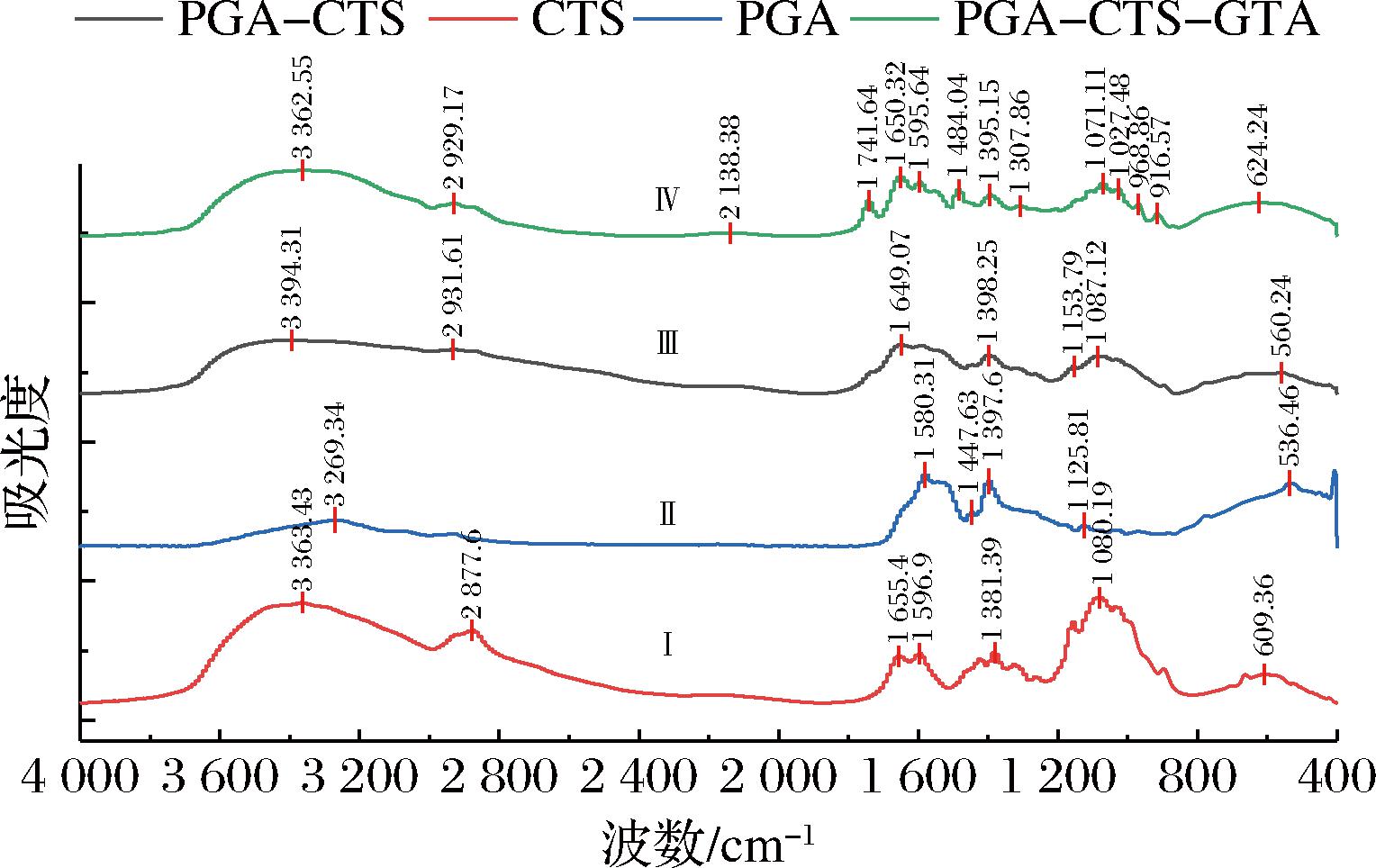
图6 PGA、CTS、PGA-CTS、PGA-CTS-GTA红外光谱图
Fig.6 FTIR of PGA, CTS, PGA-CTS and PGA-CTS-GTA
2.7 SEM分析
如图7所示,聚谷氨酸/壳聚糖混合物表面比较光滑,内部呈现多孔网状结构,这是聚谷氨酸和壳聚糖因电荷作用交联而形成的。虽然这种多孔网状结构能起到一定的吸水和持水作用,但交联形成的不溶性物质,既不能提供电荷中和,也无法起到网捕卷扫的作用,无法起到絮凝作用。改性后的聚谷氨酸/壳聚糖混合物内部依然能看到多孔结构,而表面则明显变得粗糙,这一现象与淀粉、半乳甘露聚糖等高分子物质改性后的微结构变化相似[21-22]。这是因为季铵盐的接入对高分子物质表面产生破坏作用,季铵化反应主要在高分子物质表面进行,改性剂有向高分子物质内部扩散渗透的趋势,且因阳离子化作用破坏高分子物质分子内氢键,分子链间距变大,致使颗粒规整度降低[23]。

a-PGA-CTS;b-PGA-CTS-GTA
图7 改性物微观结构
Fig.7 Microstructure of substance after modification
2.8 元素分析计算取代度
对壳聚糖、聚谷氨酸、以及改性后的聚谷氨酸/壳聚糖混合物进行了C、H和N元素的分析,以此计算出改性聚谷氨酸/壳聚糖混合物的取代度,结果如表1所示。壳聚糖和聚谷氨酸所含C、H和N质量分数的检测值与理论值非常接近,说明提供的样品纯度较高。根据公式计算出,壳聚糖单独阳离子化的0.31,与文献报道的结果接近[24];而聚谷氨酸/壳聚糖混合阳离子化的取代度则为0.49,高于壳聚糖单独阳离子化水平,这与混合改性物絮凝效果更佳的结果相吻合。
表1 元素分析计算取代度
Table 1 Elemental analysis for calculating degree of substitution
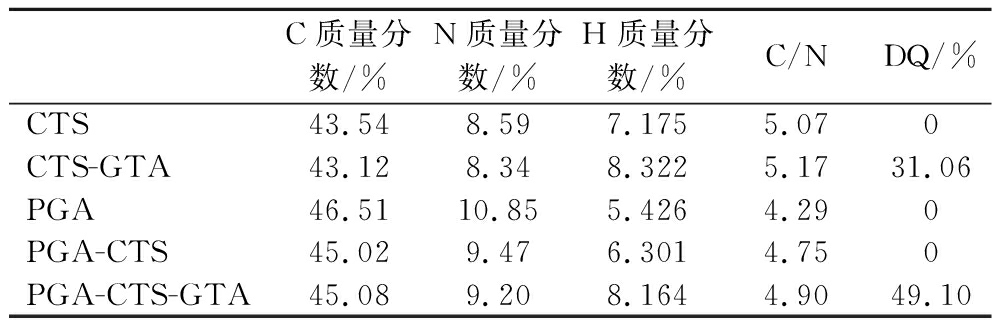
C质量分数/%N质量分数/%H质量分数/%C/NDQ/%CTS43.548.597.1755.070CTS-GTA43.128.348.3225.1731.06PGA46.5110.855.4264.290PGA-CTS45.029.476.3014.750PGA-CTS-GTA45.089.208.1644.9049.10
2.9 Zeta电位分析絮凝机理
如图8所示,聚谷氨酸/壳聚糖混合改性物在pH<10时都表现出阳离子的特性,pH>10时则呈现负电荷。未改性的聚谷氨酸/壳聚糖混合物由于在较大pH范围下均以不溶性状态呈现,故无法测定其Zeta电位-pH曲线。有文献报道,壳聚糖由于其分子链上的伯氨基的存在,在pH<8时都表现出阳离子特性,酸性条件下最高达到20 mV,pH>8时,Zeta电位<0 mV;聚谷氨酸由于分子链侧链羧基的存在,在整个pH范围内表现出较强的负电性[25]。对比结果表明,季铵盐改性后的聚谷氨酸/壳聚糖混合物在更大的pH范围呈现阳离子特性,且所带正电荷量大于壳聚糖本身。另外,微藻发酵液的Zeta电位-pH曲线表明,除强酸性的绝大部分pH范围内,微藻发酵液的Zeta电位均为负值,因此,加入改性的聚谷氨酸/壳聚糖混合物能够中和微藻发酵液的负电荷,使得藻细胞聚集成团而沉淀。
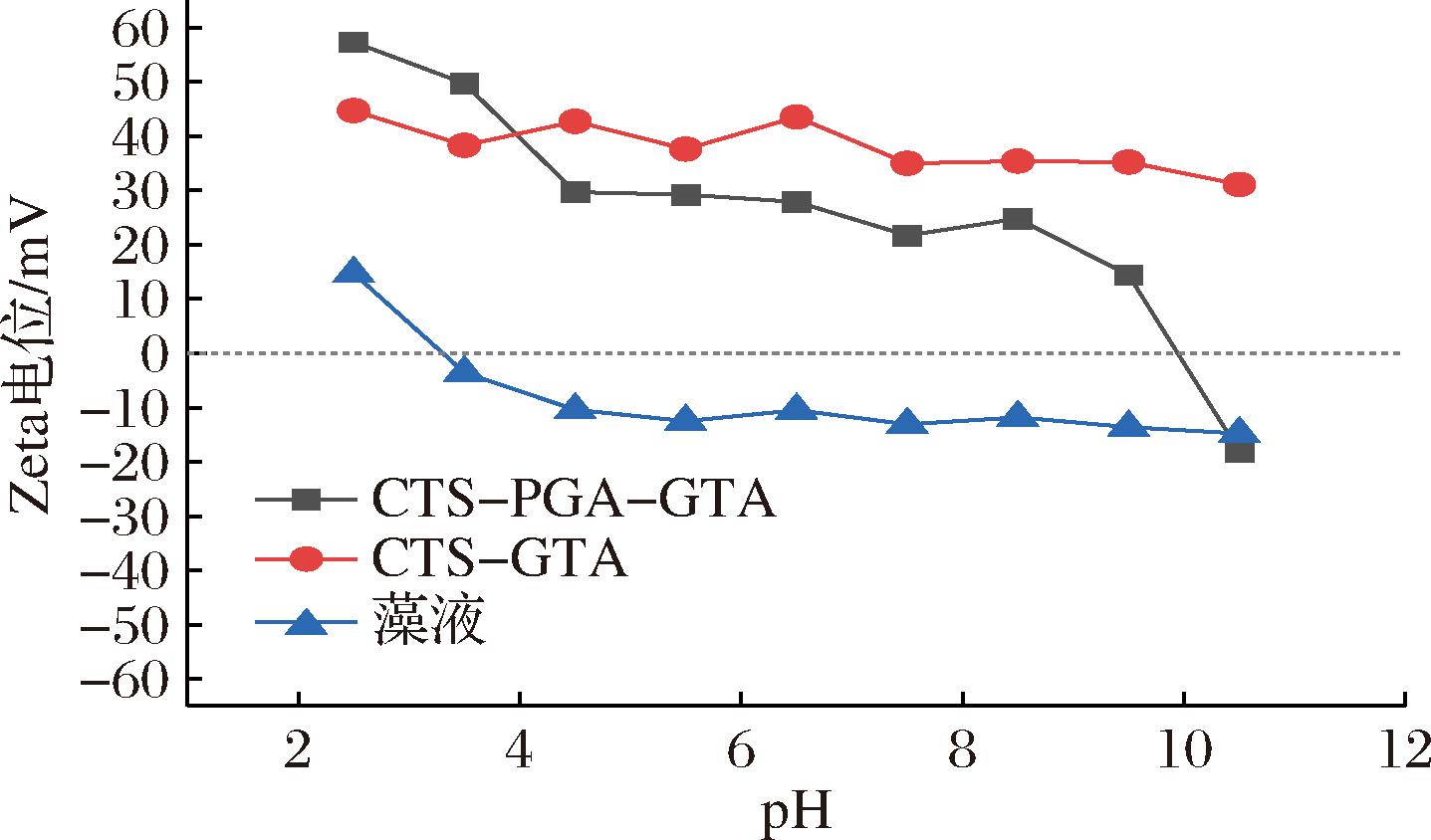
图8 pH对Zeta电位影响
Fig.8 Effect of pH on Zeta potential
2.10 添加量与沉降时间对絮凝结果的影响
针对PGA-CTS-GTA絮凝剂投加量和藻体沉降时间的关系进行了分析,投加质量浓度分别选用20、50、100、200 mg/L,沉降时间分别为0.25、0.5、1、2 h,结果如图9所示。改性高分子混合物投加量在50 mg/L及以下时,沉降时间即便达到2 h,絮凝效率也不佳,低于30%;改性高分子混合物投加量在100 mg/L及以上时,絮凝效率明显提高,0.5 h即可达到80%以上,其中100 mg/L投加量在沉降1 h的絮凝效率达到91.2%,这和聚丙烯酰胺、Al2(SO4)3等絮凝剂的絮凝效率差别不大[11,26]。同时沉降2 h和沉降1 h相比,絮凝结果几乎相同,因此认为PGA-CTS-GTA在1 h就达到了沉降平衡,无需继续延长时间。
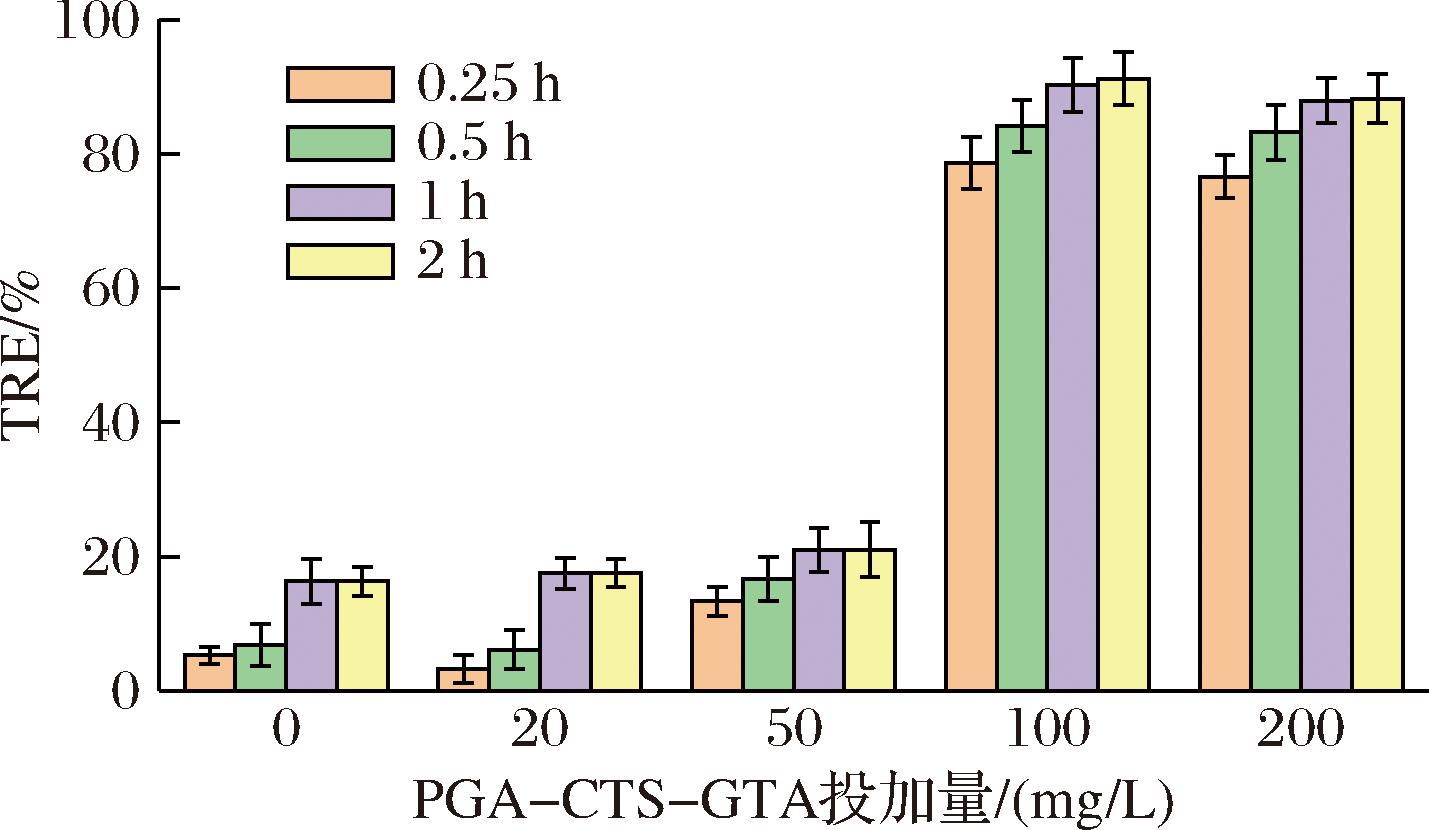
图9 添加量与沉降时间对絮凝结果的影响
Fig.9 Effect of dosage and settling time on flocculation results
2.11 经济性分析
目前,市售的成品壳聚糖和γ-PGA的价格分别为100、1 500元/kg,醚化剂2,3-环氧丙基三甲基氯化铵的售价为35元/kg。本研究为降低成本,使用发酵液粗提的γ-PGA溶液,根据文献报道和实际生产进行测算,约为55.3元/kg [27]。根据前述的制备方法,制备季铵盐改性PGA-CTS-GTA的原料成本约在320元/kg,虽然远高于市售的阳离子聚丙烯酰胺(20元/kg),但生物安全性和环保效益是其相比阳离子聚丙烯酰胺的优势。而且,本研究已验证了使用发酵液粗提的γ-PGA的可行性,相比使用成品γ-PGA在成本上已体现出了明显优势,为新型生物高分子絮凝剂的开发提供了科学依据和技术支持。若能在后续的研究中降低醚化剂用量,提高阳离子度,则能够进一步降低PGA-CTS-GTA的制备成本,有望达到更广泛的环境效益和更好的经济效益。
3 结论
本研究通过在酸性条件下开环加成制备了一种PGA-CTS-GTA絮凝剂,并研究了反应pH、改性剂GTA添加量、反应时间、反应温度对微藻絮凝的影响。当反应pH值为3,GTA与PGA-CTS混合物质量比为7∶1,反应时间4 h,反应温度75 ℃时制备得到的PGA-CTS-GTA对微藻培养液有最佳絮凝效果,在100 mg/L投加量下300 r/min搅拌1 min、沉降1 h后絮凝效果达到了91.2%。通过红外光谱分析和Zeta电位测定表明,PGA-CTS底物与GTA反应成功,改性物PGA-CTS-GTA带有正电荷,能与培养液中的微藻产生电中和反应,使微藻聚集沉降。另外,扫描电镜和絮片的显微镜观察结果表明,PGA-CTS两种物质的混合显著增大了底物整体分子质量,在絮凝中可发挥架桥与网扑卷扫的作用,使絮凝的效果进一步增强。同时因其单独使用而无需与其他金属离子复配,可以避免金属离子的污染而更加安全环保。综上所述,PGA-CTS-GTA具有良好的絮凝能力,使其在微藻采收、食品加工中营养物质的回收具有潜在应用价值,上述研究结果为进一步优化天然高分子混合物改性提供了参考实例。
[1] PAL P, SINGH A K, SARANGI P K, et al.Production of gamma-polyglutamic acid microgel by Bacillus species:Industrial applications and future perspectives[J].Polymers for Advanced Technologies, 2024, 35(9):e6565.
[2] TANIGUCHI M, KATO K, SHIMAUCHI A, et al.Proposals for wastewater treatment by applying flocculating activity of cross-linked poly-γ-glutamic acid[J].Journal of Bioscience and Bioengineering, 2005, 99(3):245-251.
[3] MA X C, ZHENG H L, ZHOU W G, et al.Enhanced harvesting of Chlorella vulgaris using combined flocculants[J].Applied Biochemistry and Biotechnology, 2016, 180(4):791-804.
[4] 董志鹏. 阳离子改性γ-聚谷氨酸絮凝剂的制备及絮凝性能研究[D].天津:河北工业大学, 2018.DONG Z P.Synthesis of cationic modified poly (γ-glutamic acid) and research of its flocculation performance[D].Tianjin:Hebei University of Technology, 2018.
[5] LIANG C L, YANG Y R, XIA Y Q, et al.The optimization of Chlorella vulgaris flocculation harvesting by chitosan and calcium hydroxide[J].Indian Journal of Microbiology, 2022, 62(2):266-272.
[6] YIN Z H, CHU R Y, ZHU L D, et al.Application of chitosan-based flocculants to harvest microalgal biomass for biofuel production:A review[J].Renewable and Sustainable Energy Reviews, 2021, 145:111159.
[7] KHOO K S, AHMAD I, CHEW K W, et al.Enhanced microalgal lipid production for biofuel using different strategies including genetic modification of microalgae:A review[J].Progress in Energy and Combustion Science, 2023, 96:101071.
[8] MAHATA C, DAS P, KHAN S, et al.The potential of marine microalgae for the production of food, feed, and fuel (3F)[J].Fermentation, 2022, 8(7):316.
[9] DEEPA P, SOWNDHARARAJAN K, KIM S.A review of the harvesting techniques of microalgae[J].Water, 2023, 15(17):3074.
[10] TANG D Y Y, KHOO K S, CHEW K W, et al.Potential utilization of bioproducts from microalgae for the quality enhancement of natural products[J].Bioresource Technology, 2020, 304:122997.
[11] LABEEUW L, COMMAULT A S, KUZHIUMPARAMBIL U, et al.A comprehensive analysis of an effective flocculation method for high quality microalgal biomass harvesting[J].Science of The Total Environment, 2021, 752:141708.
[12] 王思, 李鑫, 彭芳, 等.D, L-肽链内切酶基因cwlO缺失促进地衣芽孢杆菌利用L-谷氨酰胺合成聚γ-谷氨酸[J].微生物学通报, 2023, 50(7):2798-2811.WANG S, LI X, PENG F, et al.Deletion of cwlO facilitates the L-glutamine utilization of Bacillus licheniformis for poly-γ-glutamic acid production[J].Microbiology China, 2023, 50(7):2798-2811.
[13] DONG C L, CHEN W, LIU C.Flocculation of algal cells by amphoteric chitosan-based flocculant[J].Bioresource Technology, 2014, 170:239-247.
[14] WANG Y L, WANG X L, TIAN L P, et al.Removal effect and mechanism of amphiphilic chitosan modified microbubbles on Microcystis aeruginosa[J].Journal of Water Process Engineering, 2022, 46:102585.
[15] 佟盟, 徐虹, 王军.γ-聚谷氨酸降解影响因素及其生物降解性能的研究[J].南京工业大学学报(自然科学版), 2006, 28(1):50-53.TONG M, XU H, WANG J.Influence effects and performance of γ-PGA degradability[J].Journal of Nanjing University of Technology (Natural Science Edition), 2006, 28(1):50-53.
[16] TANG F L, LYU L M, LU F, et al.Preparation and characterization of N-chitosan as a wound healing accelerator[J].International Journal of Biological Macromolecules, 2016, 93(Pt A):1295-1303.
[17] ZOU X, ZHAO X W, YE L.Synthesis of cationic chitosan hydrogel with long chain alkyl and its controlled glucose-responsive drug delivery behavior[J].RSC Advances, 2015, 5(116):96230-96241.
[18] MORENO-V SQUEZ M J, VALENZUELA-BUITIMEA E L, PLASCENCIA-JATOMEA M, et al.Functionalization of chitosan by a free radical reaction:Characterization, antioxidant and antibacterial potential[J].Carbohydrate Polymers, 2017, 155:117-127.
SQUEZ M J, VALENZUELA-BUITIMEA E L, PLASCENCIA-JATOMEA M, et al.Functionalization of chitosan by a free radical reaction:Characterization, antioxidant and antibacterial potential[J].Carbohydrate Polymers, 2017, 155:117-127.
[19] 邢其毅. 基础有机化学[M].第4版.北京:北京大学出版社, 2016:316-318.XING Q Y.Basic Organic Chemistry[M].4th ed.Beijing:Peking University Press, 2016:316-318.
[20] CHENG D H, LIN J, LU S, et al.Flocculation of quaternary chitosan on acid dyeing waste water[J].Advanced Materials Research, 2013, 821-822:531-534.
[21] LIU M Y, WU Z K, MENG Y C, et al.Cationic etherification modification of corn starch and its sizing property[J].Textile Research Journal, 2023, 93(15-16):3680-3691.
[22] SHARMA D, KUMAR V, SHARMA P.Application, synthesis, and characterization of cationic galactomannan from ruderal species as a wet strength additive and flocculating agent[J].ACS Omega, 2020, 5(39):25240-25252.
[23] 周捷. 阳离子型芋头淀粉絮凝剂的制备及其性能研究[D].苏州:苏州科技大学, 2018.ZHOU J.Preparation and properties of cationic taro starch flocculant[D].Suzhou:Suzhou University of Science and Technology, 2018.
[24] LI H B, DU Y M, XU Y M, et al.Interactions of cationized chitosan with components in a chemical pulp suspension[J].Carbohydrate Polymers, 2004, 58(2):205-214.
[25] 李萌. 壳聚糖改性粘土和聚谷氨酸复合预处理红薯淀粉废水研究[D].南京:南京大学, 2020.LI M.Study on the pre-treatment of sweet potato starch wastewater by chitosan modified clay compounded with polyglutamic acid[D].Nanjing:Nanjing University, 2020.
[26] ZHU L D, LI Z H, HILTUNEN E.Microalgae Chlorella vulgaris biomass harvesting by natural flocculant:Effects on biomass sedimentation, spent medium recycling and lipid extraction[J].Biotechnology for Biofuels, 2018, 11:183.
[27] ZHANG X H, WU W, MOU H X, et al.Synthesis of super-high-viscosity poly-γ-glutamic acid by pgdS-deficient strain of Bacillus licheniformis and its application in microalgae harvesting[J].Microorganisms, 2024, 12(12):2398.