杂环胺(heterocyclic amines,HAAs)极易在高蛋白食品油炸过程中生成,可表现出明显的致突变性和致癌性[1]。与人类多种癌症的患癌风险增加相关。近些年油炸食品的消费量不断攀升,HAAs的暴露风险越来越高,控制油炸食品中HAAs的形成对于保障食品安全至关重要。加工工艺及条件的调整如加工温度、时间或添加抗氧化剂都可以减少HAAs的形成[2]。
目前,已有研究验证了多酚和黄酮的代表性物质没食子酸和芦丁在苏氨酸模拟体系中对HAAs的抑制效果,富含多酚和黄酮的外源活性物质在抑制HAAs的生成方面具有良好的应用前景[3-5]。
花椒和辣椒是川渝地区常用的特色调味料,在川菜加工中有举足轻重的地位。花椒其化学成分主要包括挥发油、生物碱、酚类、黄酮类物质,辣椒除含有辣椒素外还富含酚类、萜类、黄酮类、醛类等活性物质,2种香辛料都具有抗氧化、抑菌等功效。花椒精油、辣椒精油是从天然植物花椒果壳和辣椒中提取出来的具有天然麻辣味的油状液体,具有香气浓郁、麻味纯正等特点,具有突出的抗氧化活性[6]。XUE等[7]用3种香料(辣椒素、辣椒素酰胺和胡椒碱)处理烤牛肉饼,并观察到游离HAAs的产生显著减少。当在炸牛肉和鸡肉丸中添加大蒜、洋葱、红辣椒、辣椒粉、生姜和黑胡椒粉时,所有香料都会显著抑制不同肉类系统中致癌物的形成,特别是HAAs[8]。以往研究中多以肉糜为基质添加香辛料粉末达到抑制效果[9-11],而家庭或商业烹饪中肉类常进行简单切分后加工[12],以保持肉类原始的口感,但关于香辛料成分如花椒和辣椒精油对煎炸肉类HAAs生成和抑制的影响鲜有报道。因此,本文以条状猪里脊为基质,以川渝地区常用香辛料及其精油为研究对象,探究其在实际应用中对油炸猪里脊中HAAs的抑制效果,以期提出更实用的控制HAAs的建议。
1 材料与方法
1.1 材料与试剂
三元杂交猪里脊肉(7~9月龄,宰后排酸成熟12 h),重庆市北碚区天生丽街超市,置于4 ℃冰箱待用;菜籽油,四川省天府好粮油有限公司。
乙腈、甲醇、MgSO4,阿拉丁生化科技股份有限公司;冰乙酸,上海麦克林生化科技股份有限公司;无水醋酸钠,上海贤鼎生物科技有限公司;乙酸铵,上海源叶生物科技有限公司;13种杂环胺混标:2-氨基-6-甲基二吡啶并[1,2-a:3′,2′-d]咪唑(GIu-P-2)、2-氨基-3-甲基-咪唑并[4,5-f]-喹喔啉(IQx)、2-氨基-3,4-二甲基-咪唑并[4,5-f]-喹啉(MeIQ)、2-氨基-6-甲基二吡啶并[1,2-a:3′,2′-d]咪唑(GIu-P-1)、8-MeIQx(2-氨基-3,8-二甲基咪唑并[4,5-f]-喹喔啉)、9H-吡啶并[3,4-b]吲哚(Norharman)、2-氨基-3,4,8-三甲基-咪唑并[4,5-f]-喹喔啉(4,8-DiMeIQx)、2-氨基-3,7,8-三甲基-咪唑并[4,5-f]- 喹喔啉(7,8-DiMeIQx)、1-甲基-9H-吡啶[3,4-b]吲哚(Harman)、2-氨基-3,4,7,8-四甲基-3H-咪唑[4,5-f]-喹喔啉(4,7,8-TriMeIQx)、2-氨基-1-甲基-6-苯基咪唑并[4,5-b]-吡啶(PhIP)、2-氨基-9H-吡啶并[2,3-b]吲哚(AɑC)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(Trp-P-1),天津阿尔塔科技有限公司;花椒精油、辣椒精油、辣椒素、辣椒红素(纯度均为99%),上海源叶生物科技有限公司;羟基-ɑ-山椒素(纯度为99%),南京本草益康生物科技有限公司。
1.2 仪器与设备
35A电炸锅,中山市斯乐得电器有限公司;030700全自动测色色差仪,美国Hunter Lab公司;TA.XT Plus990000质构仪,英国SMS公司;LCMS-8060 NX010502超高效液相色谱-三重四极杆质谱联用仪,日本岛津公司;FB09B小型研磨机,浙江苏泊尔股份有限公司;SS-95切条机,永康市我趣工贸有限公司。
1.3 实验方法
1.3.1 样品制备
清洗猪里脊并沥干表面附着水分,放入切条机中切条(1.5 cm×1.5 cm×5 cm),称重。
猪里脊的腌制:花椒精油、辣椒精油的质量按猪里脊样品质量的2%、4%、6%和8%称取,与样品混合均匀,一同放入真空袋中抽真空,并于25 ℃下腌制1 h。
电炸锅提前预热10 min,达到设定温度后[2],在设定的170 ℃油炸温度下油炸猪里脊3 min,考察腌料的影响。将油炸好的里脊条冷却至室温并称重,部分样品用料理机打成粉末后于-80 ℃冰箱保存,用于相关指标的测定。
1.3.2 方法学考察
参考NY/T 3904—2021《肉及肉制品中杂环胺检测 液相色谱-串联质谱法》进行。称取油炸后的猪里脊样品2 g于50 mL离心管中,加入陶瓷均质子和10 mL超纯水,立即置于涡旋振荡器上涡旋1 min,后加入10 mL 1%乙酸-乙腈溶液(体积分数,下同),涡旋5 min至样品与有机溶液混合均匀后超声提取30 min。
分别吸取100 μg/mL的13种杂环胺混标溶液10、20、50、100、200、500 μL,用甲醇定容至100 mL,得到质量浓度为1.0、2.0、5.0、10.0、20.0、50.0 μg/L的杂环胺混合标准溶液。将猪里脊条样本处理后得到的基质溶液用于配制质量浓度为0.2、0.5、1、2、5、10、20、50 μg/L的杂环胺标准基质溶液待测,以杂环胺的浓度为横坐标,对应的响应面积为纵坐标绘制杂环胺的标准曲线方程。
取未经处理的猪里脊分别加入一定浓度的杂环胺标准品,使得样品内杂环胺含量达到2、10、20 ng/g,按照与油炸猪里脊一样的方法前处理后进行分析。得到的杂环胺含量与加标浓度之比为杂环胺的方法回收率。在空白油炸猪里脊样品中加入已知浓度的杂环胺标准品溶液,在不同时间进行前处理并质谱分析,计算得到杂环胺含量的相对标准偏差(relative standard deviation,RSD),即为精密度。
按梯度逐级稀释标准溶液用于质谱分析。仪器响应信噪比(S/N)为3时对应的杂环胺标准品浓度为检出限,信噪比为10时为定量限。
1.3.3 花椒麻素类物质的测定
参考文献[13]的方法,花椒精油溶于乙醇中并稀释至400 mg/mL,经滤膜过滤后用高效液相色谱仪进行分析。流速0.8 mL/min;检测波长270 nm,流动相:A-水,B-甲醇,0 min, 50% A,15 min,30% A,25 min,30% A,26 min,50% A(均为体积分数);进样量20 μL;柱温40 ℃。
1.3.4 辣椒素类物质和辣椒红素的测定
辣椒素类物质:参考GB/T 21266—2007《辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法》进行。配制4 mg/mL的辣椒精油乙醇溶液,取1 mL上述物质用高效液相色谱仪进行测定。
辣椒红素:配制0.5 mg/mL辣椒精油乙醇溶液,于460 nm处测定吸光度[14]。
1.3.5 多酚含量的测定
参考谭康维[15]的方法,准确称取辣椒和花椒精油1.0 g,转移至50 mL离心管中,加入45 mL 70%(体积分数)乙醇水溶液,常温超声提取90 min,超声结束后移至容量瓶中用蒸馏水定容至1 L。以蒸馏水为对照组,取1 mL精油乙醇提取液在725 nm波长处测定吸光值。分别取0~6 mL没食子酸标准溶液(25 μg/mL)于25 mL棕色容量瓶中,加入 1 mL福林-酚试剂(0.6 mol/L),充分摇匀静置5 min,加入2 mL 0.15 g/mL Na2CO3溶液,充分混匀后定容,移至25 ℃水浴锅反应30 min。以吸光度为纵坐标y,没食子酸的质量浓度为横坐标x,绘制标准曲线。
1.3.6 黄酮含量的测定
参考谭康维[15]的方法,用30 mL 70%(体积分数)乙醇水溶液溶解芦丁标准品制取芦丁标准品溶液用于标准曲线绘制。吸取上述芦丁标准品溶液 0、0.04、0.08、1.2、1.6、2.0、2.4 mL分别置于10 mL容量瓶中并加入0.4 mL NaNO2溶液(5 g/100 mL),摇匀静置6 min,加入0.4 mL Al(NO3)3溶液(10 g/100 mL)静置6 min后加入4 mL NaOH溶液(1 mol/L),最后用蒸馏水定容,于510 nm波长测定吸光度。空白组不添加芦丁标准品溶液。以510 nm波长处测得的吸光度为纵坐标y,芦丁标准品溶液质量浓度为横坐标x,绘制标准曲线。将上述1 mL精油乙醇提取液在510 nm波长处测定吸光值,代入标准曲线方程得到总黄酮含量。
1.3.7 DPPH自由基清除能力的测定
花椒精油抗氧化能力通过DPPH自由基清除能力进行评价[16]。将花椒精油溶解在甲醇中,其体积分数与油炸过程中使用的花椒精油-菜籽油溶液体积分数(0.5%、1.0%、1.5%、2.0%)相同。将2 mL待测溶液与2 mL 0.2 mmol/L DPPH(溶解在95%乙醇中)混合,2 mL甲醇与DPPH以相同剂量混合作为空白。在室温下黑暗中反应30 min,在517 nm处测量吸光值,并按公式(1)计算清除率:
DPPH自由基清除率![]()
(1)
式中:A空白、A样品,空白、样品在517 nm处的吸光度。
辣椒精油DPPH 自由基清除率测定根据前人的方法稍作修改[17],将辣椒精油与甲醇溶液混合,配制成不同浓度的辣椒油溶液,其体积分数与油炸过程中使用的辣椒精油-菜籽油溶液体积分数(0.5%、1.0%、1.5%、2.0%)相同,用活性炭进行脱色处理。随后将2 mL待测溶液与2 mL 0.2 mmol/L DPPH(溶解在95%乙醇中)混合,2 mL甲醇与DPPH以相同剂量混合作为空白。在室温下黑暗反应30 min,在517 nm处测量吸光值,并按公式(1)计算清除率。
1.3.8 油炸猪里脊中杂环胺的测定
参考NY/T 3904—2021《肉及肉制品中杂环胺检测 液相色谱-串联质谱法》进行。称取试样2 g(精确到0.000 1 g)放入50 mL离心管中,加入陶瓷均质子和10 mL超纯水,立即涡旋1 min后加入10 mL 1%乙酸-乙腈溶液,涡旋5 min,室温下超声提取30 min。加入4 g MgSO4,1 g无水醋酸钠,涡旋混合1 min。混合物在4 ℃、10 000 r/min离心10 min,取上层有机溶液6 mL移入15 mL离心管中,加入0.9 g MgSO4、0.3 g乙二胺-N-丙基硅烷(ethylenediamine-N-propylsilane,PSA)和0.3 g End Capped-C-18EC 固相萃取填料后2 800 r/min均质1 min。离心5 min(4 ℃,10 000 r/min);取上清液1 mL,30 ℃氮吹,在干物质中加入0.50 mL甲醇复溶,涡旋溶解。通过0.22 μm聚偏二氟乙烯(polyvinylidene fluoride,PVDF)过滤膜过滤膜过滤,得到的溶液用于UHPLC-MS/MS分析。
液相色谱条件:色谱柱,Zorbax SB-C18 (2.1 mm×50 mm, 1.8 μm);流动相A为乙酸-乙酸铵缓冲液,B为乙腈;梯度洗脱程序:0~0.5 min,95%~95%A,0.5~5 min,95%~85% A,5~7 min,85%~73% A,7~8 min,73%~45% A,8~8.5 min ,45%~73% A,8.5~9 min,73%~95% A,9~10 min ,95%~95% A;流速0.4 mL/min;柱温30 ℃;进样量2.0 μL。质谱条件:采用电喷雾离子源,正离子模式(ESI+)进行电离和多反应监测进行质谱数据采集。ESI+参数:干燥气温度200 ℃;干燥气流量10 L/min;雾化气压力40 V;鞘气温度260 ℃;鞘气流量11 L/min;毛细管电压,正电压4 000 V,喷嘴电压,正电压0 V。
1.3.9 蛋白质羰基含量的测定
使用蛋白质羰基含量检测试剂盒进行检测,根据试剂盒的操作说明,测定对应波长下的吸光度,并依据相关公式进行计算。
1.3.10 硫代巴比妥酸反应物(thiobarbituric acid reactants,TBARS)值的测定
准确称取2 g样品,接入10 mL 0.4%(体积分数)TBA,均质机匀浆后再置于涡旋振荡器上涡旋5 min。混合均匀后沸水加热30 min,冷却至室温后,4 ℃,6 000 r/min离心10 min,取出上清液5 mL加入5 mL氯仿,静置分层后取澄清上清液在532 nm和600 nm波长处测定吸光值,按照公式(2)计算TBARS值:
(2)
式中:A532、A600,样品在532 nm、600 nm波长处吸光值;m,样品质量,g。
1.3.11 数据分析
数据采用SPSS 26进行单因素方差分析(ANOVA)。经Tukey检验,差异有统计学意义(P<0.05)。结果以“平均值±标准偏差”表示。采用Origin 2021 Pro绘图。
2 结果与分析
2.1 方法学考察
由表1可知检测方法具有良好的线性,13种杂环胺的标准曲线R2>0.998。方法的检测范围最大可达到0.08~50 ng/mL,最小为0.25~50 ng/mL,满足杂环胺痕量的检测要求。
表1 QuEChERS方法提取猪里脊基质中13种杂环胺的方法学参数
Table 1 QuEChERS method to extract 16 kinds of heterocyclic amine methodological parameters

HAAs线性范围/(ng/mL)回归方程R2添加量/(ng/mL)回收率/%精密度/%Glu-P-20.15~50y=12 553.5x-951.0800.99920101.692.591073.724.28264.883.54IQx0.12~50y=11 655.6x+1 622.490.99920100.223.641082.992.86297.83.62MeIQ0.13~50y=68 787.3x-8 120.290.9992080.001.331067.462.99284.602.93Glu-P-10.08~50y=11 998.0x+4 097.550.99820107.683.511078.412.81277.632.878-MeIQx0.10~50y=8 830.29x+9 781.860.99920106.622.321094.541.11298.107.93Norharman0.20~50y=17 424.0x+40 044.20.9982097.472.3810108.674.372140.033.064,8-DiMeIQx0.10~50y=23 126.5x-1 049.820.9982085.121.2510150.552.922110.259.37,8-DiMeIQx0.25~50y=16 554.1x+4 140.960.99820102.551.611097.292.052113.439.44Harman0.15~50y=54 895.1x+19 392.00.9992099.560.761092.341.132143.454.044,7,8-Tei-MeIQx0.10~50y=17 561.5x-264.6130.9982090.291.661093.500.552113.185.72PhIP0.10~50y=68 472.4x+10 873.00.9992088.233.521083.991.92297.150.22AɑC0.15~50y=8 906.67x-284.2100.99820143.342.8910129.650.932154.550.73Trp-P-10.15~50y=8 906.67x-284.2100.9982067.475.7 1055.750.6258.081.52
13种杂环胺的加标回收率在73.72%~154.55%(Glu-P-2、MeIQ和Trp-P-1除外),在各个加标水平下样品中杂环胺的回收率比较稳定,在添加量为20 ng/mL回收率接近于100%。
精密度是反映实验结果重复性的指标,精密度越小,实验重复性越好,实验结果越准确,如表1所示,精密度为0.55%~9.44%(n=6),表明使用该方法得到的实验结果稳定。
本实验采用的提取检测方法回收率超过70%,相对标准偏差及精密度均在20%内,该方法有良好的重复性,满足样品中杂环胺的测定。在高添加量下个别杂环胺的回收率大于100%,这可能是由电离的机制增强效应引起的。
2.2 花椒和辣椒精油性质
2.2.1 花椒和辣椒精油中活性物质含量
按1.3.4节和1.3.5节的方法建立了测定多酚含量的标准曲线y=23.735x-1.033,黄酮的标准曲线y=152.74x-6.576 2,两者R2均大于0.99,可用于实际检测。
花椒和辣椒2种精油中酚类、黄酮类物质、花椒麻素类物质、辣椒素类物质、辣椒红素等活性物质含量如表2所示。花椒精油中的黄酮含量低于辣椒精油,而多酚含量高于辣椒精油。
表2 花椒精油和辣椒精油中活性物质含量
Table 2 Content of total flavonoids and total phenols in pepper essential oil and chili essential oil

活性物质含量/(mg/g)黄酮多酚花椒麻素类物质辣椒素类物质辣椒红素花椒精油74.25±2.343.09±0.6452.10±4.53——辣椒精油104.29±5.852.35±0.26—24.00±1.2643.90±2.20标准曲线y=152.74x-6.576 2R2=0.997 9y=23.735x-1.033 4R2=0.992 1y=92 341x+57 124R2=0.998 9y=5 229.7x+3 531R2=0.998 2y=0.008 1x+0.052 8R2=0.995 2
花椒精油中花椒麻素类物质含量为(52.10±4.53)mg/g,辣椒精油中辣椒素类物质含量(24.00±1.26) mg/g,辣椒精油中的呈色物质辣椒红素含量为(43.90±2.20)mg/g。
2.2.2 花椒和辣椒精油DPPH自由基清除能力
油炸过程中,不管是油脂还是样品中产生的自由基都对杂环胺的形成起到重要作用[18],花椒和辣椒精油中的天然抗氧化活性成分对油炸过程中产生的自由基有潜在的清除作用,从而抑制杂环胺的产生,达到减控杂环胺的作用。DPPH自由基清除率常用来衡量一个物质的抗氧化能力的强弱[19]。如图1所示,随花椒和辣椒精油浓度的增加,对DPPH自由基清除率呈现出上升的趋势,且花椒精油的DPPH自由基清除率始终大于辣椒精油且具有显著差异性(P>0.05),在2%(质量分数,下同)下清除率接近90%。2%辣椒精油的清除率仅为55%,在8%下清除率为84%,显著低于花椒精油对DPPH自由基的清除能力。酚类化合物和类黄酮是香料中的重要抗氧化剂,这可能是因为花椒中含有的酚酸和类黄酮,尤其是绿原酸和芦丁发挥了较强的抗氧化作用[20-21]。
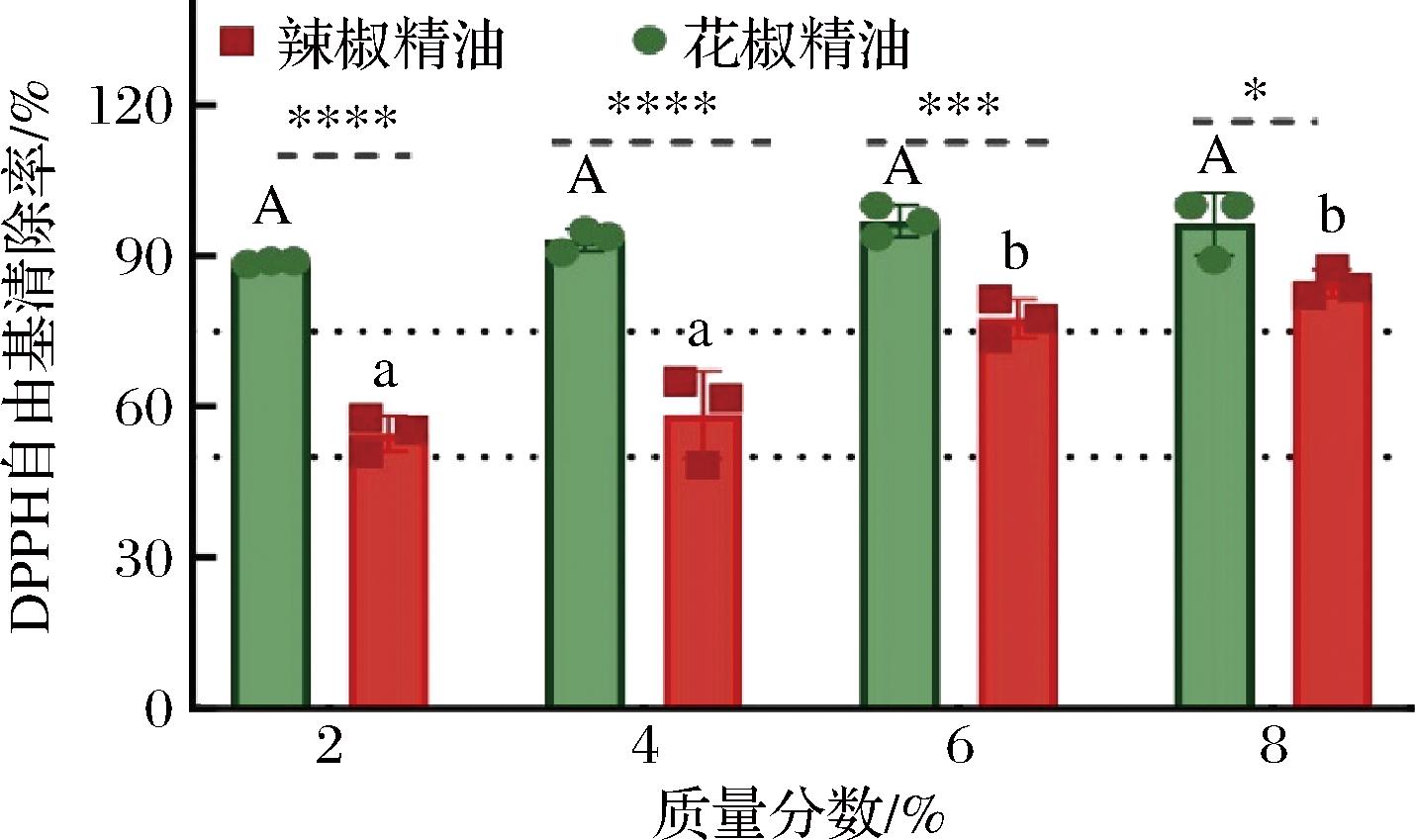
图1 花椒精油和辣椒精油清除DPPH自由基活性
Fig.1 DPPH free radical scavenging activity of pepper essential oil and chili essential oil
注:相同大写字母表示花椒精油不同添加浓度下DPPH自由基清除率的平均值差异不显著(P>0.05),不同小写字母表示辣椒精油不同添加浓度下DPPH自由基清除率的平均值差异显著(P<0.05)。*表示相同浓度相同油炸条件下辣椒精油与花椒精油的平均值差异 性,**P<0.01,***P<0.001, ****P<0.000 1。
2.3 花椒和辣椒精油对猪里脊杂环胺的影响
添加不同浓度的花椒和辣椒精油对油炸猪里脊杂环胺含量的影响如图2和图3所示。总体上与空白组相比,2种精油对已检出的多种杂环胺的产生有显著的抑制作用(P>0.05),杂环胺含量随着花椒和辣椒精油浓度的增加而降低。随着花椒精油添加浓度的升高,杂环胺的抑制率先增加后降低,在6%时抑制率相对最高。随着辣椒精油添加浓度的升高其抑制能力逐渐增强,与研究认为的香辛料等具有抗氧化性的物质对杂环胺的产生有抑制作用相符[9,22]。
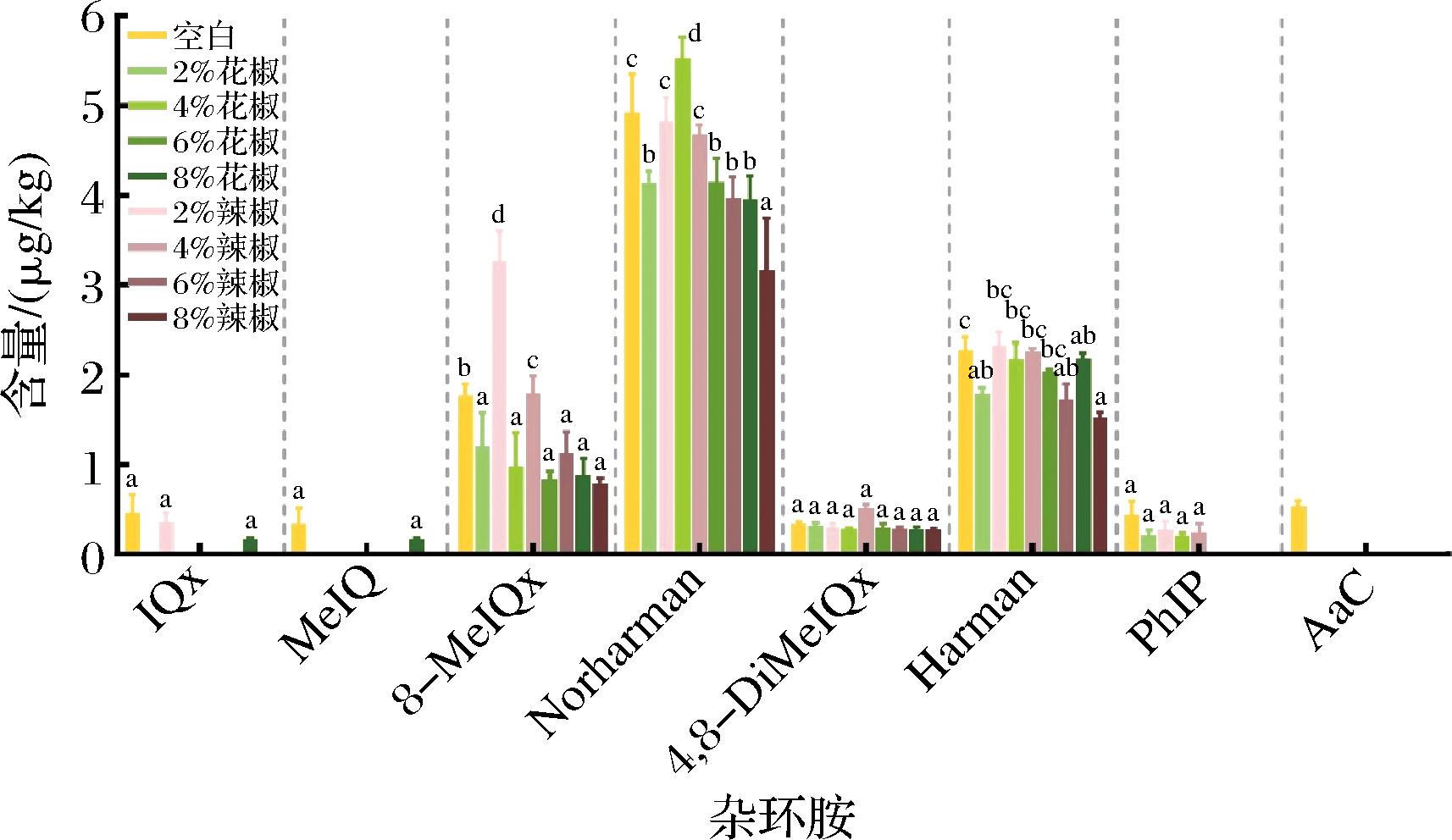
图2 花椒精油和辣椒精油对油炸猪里脊中杂环胺含量的影响
Fig.2 Effects of pepper essential oil and chili essential oil on heterocyclic aromatic amines in fried pork tenderloin
注:不同小写字母表示差异显著(P<0.05)。
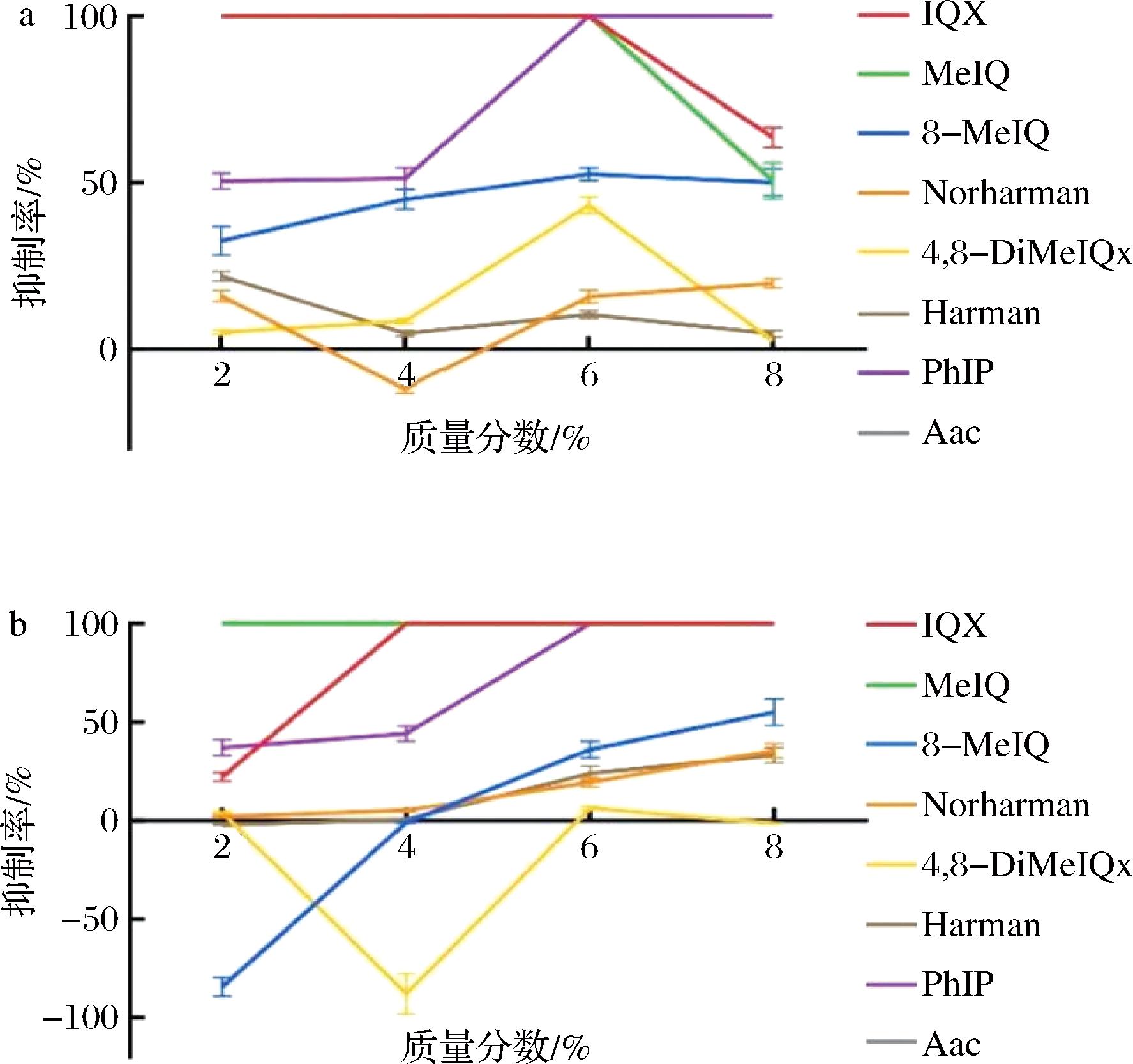
a-花椒精油;b-辣椒精油
图3 花椒精油和辣椒精油对杂环胺的抑制率
Fig.3 The inhibitory rates of pepper essential oil and chili essential oil on heterocyclic amines
花椒中能有效抑制杂环胺产生的主要抗氧化物质是酚类和生物碱,通过与中间体结合的方式抑制Norharman的生成[23]。由图2可知,添加花椒精油后,多数杂环胺含量随浓度升高而下降,但Norharman含量随精油浓度增加先降低后上升再降低,在添加量为4%时含量最高,超过了对照组。本实验中加热温度较高,且反应较剧烈,因此这种现象可能与加热温度有关。吕美[24]在牛肉饼中添加陈皮再进行煎烤后也发现Norharman的含量有所增加。UZUN等[25]在研究牛肉丸的杂环胺生成过程中也发现罗勒叶的使用量和蒸煮温度会影响杂环胺的形成。花椒精油对于Harman的抑制效果无明显规律,这可能是由多种化合物拮抗作用的结果[26]。结合图3中花椒精油的抑制率的变化趋势,在添加量为6%时,花椒精油对于杂环胺的综合抑制率最好,提升浓度后,抑制率显示出下降趋势。
辣椒精油对杂环胺的生成也展现出较好的抑制作用,检出的杂环胺含量随辣椒精油添加浓度的升高而逐渐降低,抑制率在8%时达到最大,但是对4,8-DiMeIQx和8-MeIQx却无明显抑制作用。JEONG等[27]研究发现添加辣椒提取物对MeIQx和4,8-DiMeIQx的产生无抑制作用。特别注意到,在质量分数为2%时,辣椒精油促进了8-MeIQx的大量增加,MERYEM等[28]也发现了类似的结果。辣椒中含有类胡萝卜素、黄酮类物质、维生素、有机酸、可溶性糖以及游离氨基酸等多种营养成分,辣椒中的可溶性糖可作为杂环胺的部分前体物,维生素C可抑制卤煮牛肉中的杂环胺[29],阿魏酸和香豆酸是辣椒中的黄酮类化合物,它们对4,8-DiMeIQx的生成具有抑制作用,却对MeIQx具有促进作用。另外,有研究表明单独添加辣椒素能大大抑制杂环胺的生成[19]。因此,辣椒精油对肉制品中杂环胺生成的抑制作用是辣椒中多种物质共同作用的结果。
2.4 机理研究
2.4.1 花椒和辣椒精油对猪里脊蛋白质羰基的影响
蛋白质的氧化降解会产生蛋白质羰基,羰基化是蛋白质的不可逆、非酶化修饰,涉及氧化应激和其他诱导机制从而形成羰基部分,如醛类和酮类。在以往研究中发现生成杂环胺的中间体有甲醛、乙醛、苯乙醛和2,5-二甲基吡嗪[30],其中含有醛类物质,因此蛋白质羰基含量可以用来表征参与杂环胺生成反应的中间体物质含量以及蛋白质的氧化程度。研究表明,HAA的形成主要由2条途径组成:自由基和羰基。抗氧化剂有能力通过其在美拉德工艺中的抗氧化特性消除自由基,从而有效地减少有害HAAs的产生。如图4所示,花椒和辣椒精油添加量越大,油炸后猪里脊中的蛋白质羰基含量越低,一定程度上表明添加花椒和辣椒精油都能抑制蛋白质氧化,减少中间体的生成,从而阻断杂环胺的生成,随着添加量的升高花椒精油组的蛋白质羰基含量先迅速降低,再缓慢下降,在4%后保持稳定,辣椒精油组的蛋白质羰基含量在2%后呈线性下降。在0~6%的添加量下,花椒精油组的蛋白质羰基含量低于辣椒精油组,在此添加范围内,花椒麻素具有的抗氧化能力和还原力可能起到了主要作用,在8%时花椒精油组反而高于辣椒精油,由此可看出,花椒精油抑制蛋白质氧化能力有一定的添加量依赖性[31]。
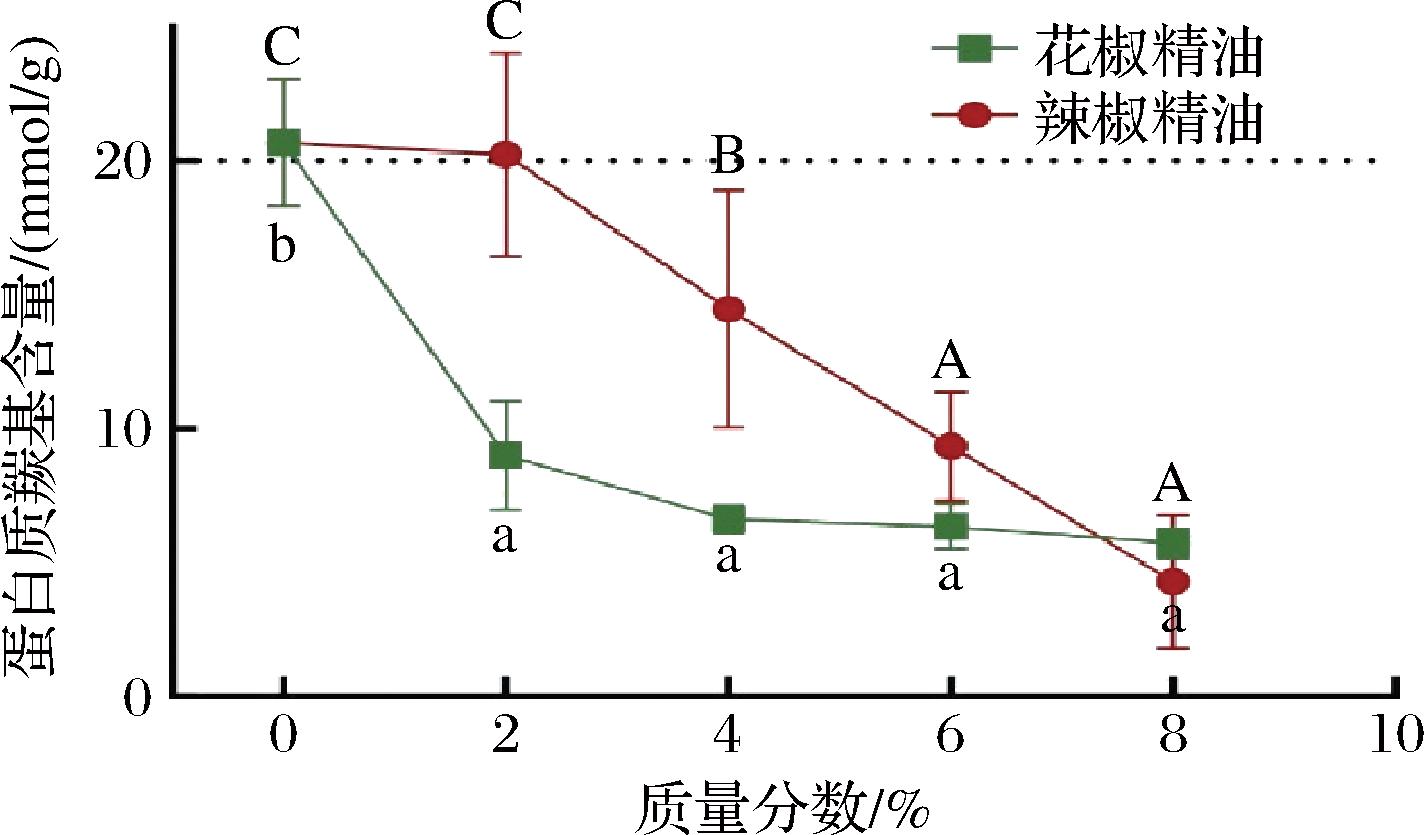
图4 不同花椒精油和辣椒精油添加量对油炸猪里脊中羰基含量的影响
Fig.4 Effects of pepper essential oil and chili essential oil with different concentration on total protein carbonyl values in fried pork tenderloin
注:不同大写字母表示辣椒精油不同添加量相同油炸条件的平均值差异显著(P<0.05),不同小写字母表示花椒精油不同添加量相同 油炸条件的平均值差异显著(P<0.05)。
2.4.2 花椒和辣椒精油对猪里脊TBARS值的影响
脂质的氧化程度可以由TBARS值来表示,脂质氧化会产生一系列自由基和中间产物,为杂环胺的生成提供了更多的反应底物[30]。如图5所示,添加花椒和辣椒精油都能使猪里脊的TBARS值下降,且质量分数较大时(6%~8%),花椒和辣椒精油的抗脂质氧化能力相当。辣椒精油组的TBARS值在质量分数4%时开始显著下降,在6%~8%时略有反弹,可能是由于高质量分数的抗氧化物质也可能有促氧化性。有研究表明抗氧化剂也可能产生促氧化作用,而抗氧化剂的质量分数可能会影响其促氧化或抗氧化作用[32-33]。花椒精油组的TBARS值随着质量分数增加呈阶梯式下降趋势,对脂质氧化有很好的抑制作用。花椒和辣椒精油中的抗氧化物质可以通过清除脂肪酸自由基和羟基自由基的方式来抑制油炸猪里脊中脂质的氧化,还可以将肉中的Fe2+和Cu+转化为非活性形式抑制脂质氧化[34]。有研究证明自由基化合物在杂环胺的形成中起到重要作用,会通过脂质氧化和美拉德反应来形成杂环胺的中间体[30],因此可以通过抑制脂质氧化来减少自由基的产生和中间体的积累,从而减少熟肉和化学模型体系中杂环胺形成所需要的反应底物,抑制杂环胺形成 [35-36]。
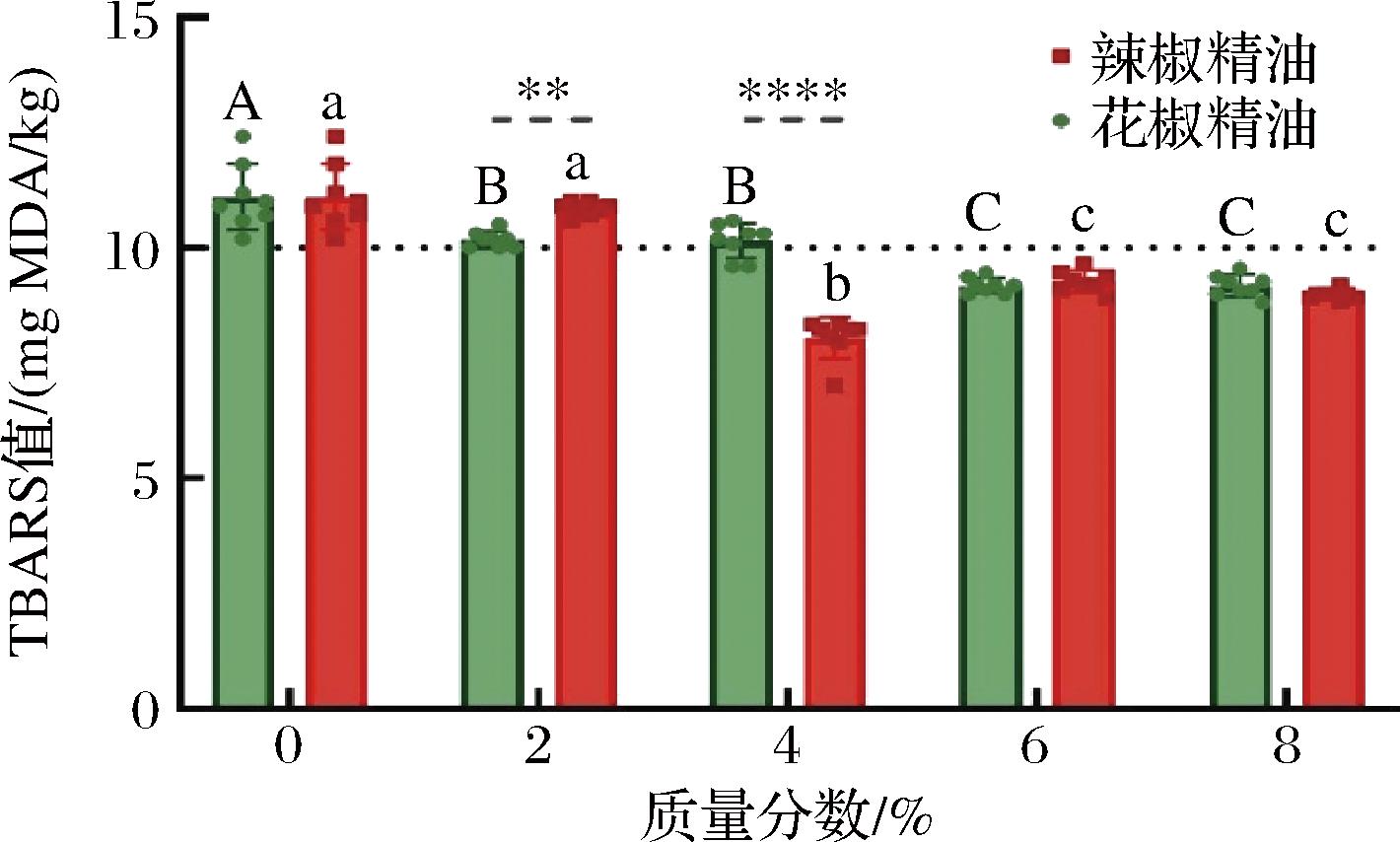
图5 不同花椒精油和辣椒精油添加量对油炸猪里脊TBARS值的影响
Fig.5 Effects of pepper essential oil and chili essential oil with different concentrations on TBARS values in fried pork tenderloin
注:不同大写字母表示花椒精油不同质量分数相同油炸条件的平均值差异显著(P<0.05),不同小写字母表示辣椒精油不同质量分数相同油炸条件的平均值差异显著(P<0.05)。*表示相同质量分数相同油炸条件下辣椒精油与花椒精油的平均值差异性,**P<0.01, ****P<0.000 1,未标注表示差异不显著。
3 结论
本研究旨在探讨花椒精油和辣椒精油对油炸猪里脊中杂环胺生成和抑制的影响。花椒精油、辣椒精油具有黄酮、多酚、花椒麻素类物质、辣椒素类物质、辣椒红素等活性物质,具有良好的抗氧化作用。添加不同质量分数花椒精油和辣椒精油对油炸猪里脊的杂环胺具有明显的抑制作用,多数杂环胺的生成量会随2种精油浓度升高而降低,其中花椒精油质量分数为6%时,对所检出的8种杂环胺的综合抑制效果最佳;辣椒精油则在质量分数为8%时达到最优抑制率,少部分杂环胺的生成量会随着质量分数的上升先上升,后浓度继续升高而杂环胺含量下降。添加2种精油均能够降低油炸猪里脊中的羰基含量和TBARS值,显著抑制蛋白质和脂质氧化,这有利于减少在氧化过程中杂环胺中间体和自由基的生成,进而有助于降低杂环胺的生成量。后续研究可以进一步深入解析2种精油添加对油炸猪里脊中杂环胺生成的抑制机理。
[1] BARZEGAR F, KAMANKESH M, MOHAMMADI A.Heterocyclic aromatic amines in cooked food:A review on formation, health risk-toxicology and their analytical techniques[J].Food Chemistry, 2019, 280:240-254.
[2] 黄欣娅, 戴宏杰, 郭婷, 等.油炸条件对猪里脊品质和杂环胺形成的影响[J].食品与发酵工业, 2025, 51(3):171-181.HUANG X Y, DAI H J, GUO T, et al.Effects of frying conditions on quality and heterocyclic aromatic amines of pork tenderloin heterocyclic amines[J].Food and Fermentation Industries, 2025, 51(3):171-181.
[3] CHENG Y Q, YU Y J, WANG C, et al.Inhibitory effect of sugarcane (Saccharum officinarum L.) molasses extract on the formation of heterocyclic amines in deep-fried chicken wings[J].Food Control, 2021, 119:107490.
[4] CHENG X R, MA J H, AMADOU I, et al.Electrophilic components from Xiaoheiyao (rhizomes of in ula nervosa Wall.) alleviate the production of heterocyclic aromatic amines via creatinine inhibition[J].Food Chemistry, 2023, 404:134561.
[5] YANG X Y, BLECKER C, LIU H, et al.Effect of plant polyphenols with different m-hydroxy and o-hydroxy groups on the inhibition of heterocyclic amines formation in roasted meat[J].Food Control, 2023, 153:109960.
[6] ZHANG S M, WANG R C, CHU J B, et al.Vegetable extracts:Effective inhibitors of heterocyclic aromatic amines and advanced glycation end products in roasted Mackerel[J].Food Chemistry, 2023, 412:135559.
[7] XUE C Y, HE Z Y, QIN F, et al.Effects of amides from pungent spices on the free and protein-bound heterocyclic amine profiles of roast beef patties by UPLC-MS/MS and multivariate statistical analysis[J].Food Research International, 2020, 135:109299.
[8] WANG Y, HUI T, ZHANG Y W, et al.Effects of frying conditions on the formation of heterocyclic amines and trans fatty acids in grass carp (Ctenopharyngodon idellus)[J].Food Chemistry, 2015, 167:251-257.
[9] 樊贺雨, 胡晖宇, 李昌, 等.6种传统香辛料抑制油炸牛肉饼中杂环胺形成的作用[J].食品工业科技, 2022, 43(17):78-86.FAN H Y, HU H Y, LI C, et al.The inhibitory effect of six traditional spices on the formation of heterocyclic aromatic amines in fried beef patties[J].Science and Technology of Food Industry, 2022, 43(17):78-86.
[10] ZHANG H L, LV X M, SU W M, et al.Exploring the roles of excess amino acids, creatine, creatinine, and glucose in the formation of heterocyclic aromatic amines by UPLC-MS/MS[J].Food Chemistry, 2024, 446:138760.
[11] KILIC S, OZ E, OZ F.Effect of turmeric on the reduction of heterocyclic aromatic amines and quality of chicken meatballs[J].Food Control, 2021, 128:108189.
[12] ZHANG L, HU Y Y, LIU Q, et al.Cyanidin and rutin inhibit the formation of heterocyclic aromatic amines in chemical modeling systems and smoked chicken drumsticks[J].Food Chemistry, 2023, 398:133869.
[13] LUO J J, KE J X, HOU X Y, et al.Composition, structure and flavor mechanism of numbing substances in Chinese prickly ash in the genus Zanthoxylum:A review[J].Food Chemistry, 2022, 373(Pt B):131454.
[14] 江英, 武占省, 田丽萍.辣椒红色素提取与检测方法的研究进展[J].食品研究与开发, 2005, 26(3):27-29;31.JIANG Y, WU Z S, TIAN L P.Research progress on Capsicum red pigment[J].Food Research and Development, 2005, 26(3):27-29;31.
[15] 谭康维. 鸡肉烤制过程中杂环胺生成及抑制研究[D].广州:华南理工大学, 2023.TAN K W.Study on the formation and inhibition of heterocyclic amines in chicken during roasting[D].Guangzhou:South China University of Technology, 2023.
[16] XIA L, YOU J M, LI G L, et al.Compositional and antioxidant activity analysis of Zanthoxylum bungeanum seed oil obtained by supercritical CO2 fluid extraction[J].Journal of the American Oil Chemists’ Society, 2011, 88(1):23-32.
[17] 王莹莹, 汪学德, 王东营, 等.辣椒油树脂挥发性成分分析及其抗氧化活性研究[J].中国调味品, 2022, 47(9):20-24;49.WANG Y Y, WANG X D, WANG D Y, et al.Analysis of volatile components of Capsicum oleoresin and study on antioxidant activity[J].China Condiment, 2022, 47(9):20-24;49.
[18] KIKUGAWA K.Involvement of free radicals in the formation of heterocyclic amines and prevention by antioxidants[J].Cancer Letters, 1999, 143(2):123-126.
[19] ZENG M M, ZHANG M R, HE Z Y, et al.Inhibitory profiles of chilli pepper and capsaicin on heterocyclic amine formation in roast beef patties[J].Food Chemistry, 2017, 221:404-411.
[20] CHEN Y P, CHUNG H Y.Antioxidant and flavor in spices used in the preparation of chinese dishes[M]. Encyclopedia of Food Chemistry.Oxford:Academic Press, 2019:1-9.
[21] LU M, YUAN B, ZENG M M, et al.Antioxidant capacity and major phenolic compounds of spices commonly consumed in China[J].Food Research International, 2011, 44(2):530-536.
[22] 李雨竹, 汪永, 谢婷婷, 等.生姜和辣椒及其活性组分对卤煮牛肉中杂环胺生成的影响[J].肉类研究, 2020, 34(6):45-51.LI Y Z, WANG Y, XIE T T, et al.Effects of ginger and chili pepper as well as their bioactive components on the formation of heterocyclic amines in stewed beef[J].Meat Research, 2020, 34(6):45-51.
[23] ZAMORA R, HIDALGO F J.2-Amino-1-methyl-6-phenylimidazo[4, 5-b] pyridine (PhIP) formation and fate:An example of the coordinate contribution of lipid oxidation and Maillard reaction to the production and elimination of processing-related food toxicants[J].RSC Advances, 2015, 5(13):9709-9721.
[24] 吕美. 香辛料的抗氧化性及其对煎烤牛肉饼中杂环胺形成的影响[D].无锡:江南大学, 2011.LYU M.Antioxidant capacity of spices and its influence on the formation of heterocyclic amines[D].Wuxi:Jiangnan University, 2011.
[25] UZUN I, OZ F.Effect of basil use in meatball production on heterocyclic aromatic amine formation[J].Journal of Food Science and Technology, 2021, 58(8):3001-3009.
[26] EDNA HEE P T, LIANG Z J, ZHANG P Z, et al.Formation mechanisms, detection methods and mitigation strategies of acrylamide, polycyclic aromatic hydrocarbons and heterocyclic amines in food products[J].Food Control, 2024, 158:110236.
[27] JEONG K J, SEO J K, AHAMED Z, et al.Paprika extract as a natural antioxidant in cold-stored pork patties:Effect on oxidative stability and heterocyclic amines inhibition[J].Food Chemistry:X, 2023, 20:100936.
[28] NURAY M, OZ F.The effect of using different types and rates of onion-water extract in meatball production on the formation of heterocyclic aromatic amines[J].Journal of the Science of Food and Agriculture, 2019, 99(7):3538-3547.
[29] 李进. 香辛料抑制卤肉中β-咔啉类杂环胺形成的物质基础及机理初步研究[D].武汉:华中农业大学,2019.LI J.Preliminary study on the substance and mechanism of the inhibition of spice on the formation of β-carbolines heterocyclic amines in braised meat[D].Wuhan:Huazhong Agricultural University,2019.
[30] CHANG C, WU G C, ZHANG H, et al.Deep-fried flavor:Characteristics, formation mechanisms, and influencing factors[J].Critical Reviews in Food Science and Nutrition, 2020, 60(9):1496-1514.
[31] OZ E, AOUDEH E, MURKOVIC M, et al.Heterocyclic aromatic amines in meat:Formation mechanisms, toxicological implications, occurrence, risk evaluation, and analytical methods[J].Meat Science, 2023, 205:109312.
[32] UNAL K, KARAKAYA M, OZ F.The effects of different spices and fat types on the formation of heterocyclic aromatic amines in barbecued sucuk[J].Journal of the Science of Food and Agriculture, 2018, 98(2):719-725.
[33] OZ F, ZAMAN A, KAYA M.Effect of chitosan on the formation of heterocyclic aromatic amines and some quality properties of meatball[J].Journal of Food Processing and Preservation, 2017, 41(4):e13065.
[34] LU F, KUHNLE G K, CHENG Q F.The effect of common spices and meat type on the formation of heterocyclic amines and polycyclic aromatic hydrocarbons in deep-fried meatballs[J].Food Control, 2018, 92:399-411.
[35] TENGILIMOGLU-METIN M M, HAMZALIOGLU A, GOKMEN V, et al.Inhibitory effect of hawthorn extract on heterocyclic aromatic amine formation in beef and chicken breast meat[J].Food Research International, 2017, 99:586-595.
[36] 姚瑶,彭增起,邵斌,等.20种市售常见香辛料的抗氧化性对酱牛肉中杂环胺含量的影响[J].中国农业科学, 2012,45(20):4252-4259.YAO Y, PENG Z Q, SHAO B, et al.Effects of the antioxidant capacities of 20 spices commonly consumed on the formation of heterocyclic amines in braised sauce beef[J].Scientia Agricultura Sinica, 2012, 45(20):4252-4259.