牡蛎是一种重要的海洋经济贝类,牡蛎包括肉和壳两部分。牡蛎肉中含有丰富的蛋白质,其水解后可得到牡蛎肽,牡蛎肽具有多种生物活性,如抗氧化、降血糖、降血脂、降血压及缓解疲劳等[1]。然而,牡蛎肽稳定性较差,其吸收利用存在层层阻碍,在到达吸收位点之前可能已经被降解而导致生物活性丧失,这极大地削弱了牡蛎肽在保健食品及医药领域的应用[2]。牡蛎壳占牡蛎总体质量的60%,主要成分是CaCO3,也含有少量镁、铝、铁、锰等元素[3]。但由于牡蛎壳无法食用,常被当做废弃物堆积在滩涂等地,造成资源浪费。
近年来,随着纳米科技的蓬勃发展,纳米颗粒作为活性物质递送载体在医药及功能食品领域的应用引起了广泛研究。纳米载体主要可分为无机和有机载体、生物载体以及复合载体。无机载体制备简单,颗粒大小及形貌等特性易于控制,良好的生物相容性、生物可降解性及药物释放可控等特点,使其成为纳米载体领域中备受关注的研究方向之一[4]。其中,兼具pH响应性与高比表面积的纳米碳酸钙(nano-calcium carbonate,CaCO3 NPs)是一种重要的无机载体,其作为活性物质递送载体在医药与功能食品领域展现出独特潜力。VERGARO等[5]开发了以CaCO3 NPs为载体模板的纳米胶囊,其能够在癌细胞的核周区域释放大部分顺铂,展现出抗肿瘤药物递送潜力。RAO等[6]构建了磷酸盐稳定的无定形CaCO3纳米粒子,其具有高效负载和释放姜黄素的特性。然而,未经修饰的CaCO3 NPs在生理环境中的稳定性较差,容易因pH波动而过快降解。此外,CaCO3 NPs过高的表面能极易导致其颗粒发生团聚。因此,有必要对CaCO3 NPs进行稳定化修饰处理。
活性肽消化稳定性差的问题已严重影响其活性应用。近些年来,纳米载体递送成为提升活性肽稳定性、促进其活性发挥的重要策略。张佩[7]研发的pH响应性智能复合水凝胶递送系统不仅能够提高牡蛎降糖肽在胃环境中的稳定性,而且具有肠道靶向释放特性;崔巍[8]构建的TBC/MSN/P28递送体系具有良好的缓释性能,能更好地促进P28活性肽充分发挥成骨诱导活性;RAJCHAKIT等[9]开发的金纳米颗粒-抗菌肽递送体系有效提升了抗菌肽的血清稳定性,并强化了其对革兰氏阳性/阴性菌的抗菌效能,同时展现出更优的杀菌动力学特性及抗生物膜活性。因此,通过构建纳米递送体系保护活性肽,不仅能够提高活性肽在胃肠道中的稳定性,而且还具有缓释效应,有利于提高活性肽的生物利用度。
本研究以牡蛎壳和牡蛎肽为研究对象,旨在利用牡蛎壳制备CaCO3 NPs,构建一种牡蛎肽的稳定化递送体系,避免牡蛎肽在体内发挥活性前被大量降解,促进其活性发挥,同时减少牡蛎壳资源浪费及其造成的污染,提高牡蛎资源综合利用率。该研究不仅拓展了海洋生物资源高值化利用路径,还为功能性肽类的递送系统设计提供了新思路。
1 材料与方法
1.1 材料与试剂
牡蛎,广东省湛江市东风市场;六偏磷酸钠、海藻酸钠(sodium alginate,ALG)、聚乙二醇、棕榈酸对硝基苯酯(p-nitrophenyl palmitate,p-NPP)(均为分析纯),上海麦克林生化科技有限公司;Tris-HCl缓冲液、透析袋、PBS(pH=2.0和6.8)、胰脂肪酶(猪胰,30 000 U/g)、人工胃液、人工小肠液(含胰酶和磷酸盐),上海源叶生物科技有限公司;碱性蛋白酶(地衣芽孢杆菌,≥200 000 U/g),北京索莱宝科技有限公司;盐酸、NaOH及其他试剂均为分析纯,广州市西陇化学试剂有限公司。
1.2 仪器与设备
FA2004B电子天平,上海高致精密仪器有限公司;PHS-2F型pH计,上海仪电科学仪器股份有限公司;SHJ-6AB磁力搅拌水浴锅,常州金坛良友仪器公司;Varioskan LUX全自动酶标仪、Thermo Lynx 6000落地式超速离心机,美国热电公司;Cary 60紫外可见-分光光度计,安捷伦科技有限公司;Bruker Tensor 27傅里叶红外光谱仪,德国Bruker公司;XFB-500型手提式多功能粉碎机,上海广沙工贸有限公司;GZX-9140MBE电热鼓风干燥箱,上海博迅医疗生物仪器股份有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;Zetasizer Nano ZSE纳米粒度仪、X’ Pert PRO型X射线衍射仪,Malvern Panalytical公司;JSM-7610F热场发射扫描电镜,日本电子株式会社。
1.3 实验方法
1.3.1 CaCO3 NPs的制备
将牡蛎壳预处理后干燥粉碎过100目筛备用。取2.5 g牡蛎壳粉与1 mol/L HCl溶液在常温常压下反应2 h,随后调节pH值至11,反应30 min,抽滤,加盐酸调pH至中性,得精制CaCl2溶液。
使用Tris-HCl配制1%(体积分数)明胶溶液[10],并将CaCl2溶液加入其中,随后用注射器逐滴加入相同体积和浓度的Na2CO3溶液,速率控制在25 mL/min,在45 ℃反应3 h,随后8 000 r/min离心10 min,洗涤沉淀,烘箱(55 ℃,24 h)烘干备用。
1.3.2 ALG修饰纳米碳酸钙的制备
ALG是一种天然的多糖类聚合物,含有大量羧基基团,可与Ca2+、Fe2+、Ba2+等二价阳离子发生离子交换反应,形成交联网络结构,从而增加纳米颗粒的稳定性,抑制其在溶液中的聚集和沉淀。
配制5 mg/mL的CaCO3 NPs溶液,将相同浓度的ALG溶液逐滴加入CaCO3 NPs悬浊液后,在750 r/min及室温条件下混合搅拌2 h,8 000 r/min离心10 min,用超纯水洗涤后,采用冷冻干燥,得修饰后的纳米碳酸钙颗粒(ALG-CaCO3 NPs),收集备用。
1.3.3 ALG修饰纳米碳酸钙的修饰条件优化
1.3.3.1 单因素试验
以ALG质量浓度(0.5、2、5、7、10 mg/mL)、反应时间(0.5、1、2、3、4 h)和反应温度(25、35、45、55、65 ℃)为考察因素,根据1.3.2节的方法进行修饰条件优化,并以粒径、电位为评价指标。
1.3.3.2 正交试验
根据单因素试验结果,确定ALG浓度、反应时间以及反应温度3个水平因素,并按照L9(43)正交表进行正交试验,以粒径、电位为指标,确定ALG修饰CaCO3 NPs的最佳条件。
1.3.4 牡蛎肽-CaCO3 NPs纳米体系(PEG-OBP-ALG-CaCO3 NPs)的构建
1.3.4.1 牡蛎肽的制备
牡蛎肉按照料液比1∶3(g∶mL)加水榨汁,随后拿去匀浆,将pH值调至8后,加入碱性蛋白酶(加酶量为4 000 U/g牡蛎肉),50 ℃水浴酶解3 h,随后100 ℃灭酶15 min,冰水浴冷却至室温后4 ℃ 8 000 r/min离心15 min,用4层脱脂纱布过滤,收集上清液,冷冻干燥后备用[11]。
1.3.4.2 牡蛎肽-CaCO3 NPs纳米体系的构建
牡蛎肽中的某些肽段可通过键合作用改变胰脂肪酶的质子结构和共价结构,从而有效抑制胰脂肪酶的活性,是一种潜在的天然胰脂肪酶抑制剂[12],为了提高牡蛎肽在胃肠道中的稳定性,保护其生物活性,本研究构建牡蛎肽-CaCO3 NPs纳米体系(以下简称为纳米体系)。首先将5 mg/mL牡蛎肽(oyster bioactive peptides,OBP)逐滴加入到5 mg/mL ALG-CaCO3 NPs溶液中,室温反应30 min,得OBP-ALG-CaCO3 NPs溶液。
然后制备100 g/L 的聚乙二醇(polyethylene glycol,PEG)溶液,在1 000 r/min的磁力搅拌条件下将PEG溶液滴到OBP-ALG-CaCO3 NPs溶液中,反应2 h,随后9 000 r/min离心15 min,移取上清液用于后续指标测定,洗涤沉淀,冷冻干燥,收集备用。
1.3.5 牡蛎肽-CaCO3 NPs纳米体系的包封率和装载量
采用紫外分光光度法对纳米体系中负载的牡蛎肽进行含量测定。通过测定牡蛎肽214 nm处的吸光度值建立牡蛎肽标准曲线[7]。纳米体系的包封率和装载量分别按公式(1)、公式(2)计算:
包封率![]()
(1)
装载量![]()
(2)
1.3.6 牡蛎肽-CaCO3 NPs纳米体系的结构表征
1.3.6.1 粒径和zeta电位的测定
取适量样品溶于六偏磷酸钠溶液中,超声后用动态光散射粒度仪(dynamic light scattering,DLS)测量纳米颗粒:CaCO3 NPs、ALG-CaCO3 NPs以及纳米体系的粒径和电位,每次测试3次,取其平均值[7]。
1.3.6.2 扫描电镜分析
利用扫描电镜对纳米颗粒:CaCO3 NPs、ALG-CaCO3 NPs以及纳米体系表面形貌进行观察。将一定量干燥的样品粉末溶于无水乙醇中,超声混匀至分散液无明显粉末且溶液不浑浊,随后取一滴滴至硅片亮面上,自然风干后喷金,放入设备进行检测[8]。
1.3.6.3 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
KBr干燥后,按照100∶1的比例分别将KBr与CaCO3 NPs、ALG-CaCO3 NPs和纳米体系混合均匀后进行研磨,压成透明薄片后进行检测,扫描波数范围为4 000~400 cm-1[7]。
1.3.6.4 X射线衍射(X-ray diffraction,XRD)分析
采用XRD分析纳米颗粒的物相晶型,分析条件:电压40 kV,电流40 mA,Cu-K-α辐射装置,扫描角度7°~80°,扫描速度4°/min[13]。
1.3.7 牡蛎肽-CaCO3 NPs纳米体系的胃肠道pH响应释放特性
根据徐梦晴[14]的方法进行调整。将5 mg/mL样品溶液置于3.5 kDa透析袋中,在37 ℃恒温振荡器中,于pH 2.0和pH 6.8的PBS中模拟牡蛎肽在胃肠道的释放条件。在0.5、1、2、3、4、5、6、7、8、12、24、36 h的时间间隔取5 mL样液,并重新补入5 mL PBS,通过紫外可见分光仪测定上清液中释放的游离牡蛎肽,并根据标准曲线,按公式(3)计算牡蛎肽的累计释放率,探究其体外释放情况。
牡蛎肽累积释放率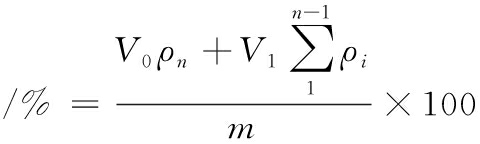
(3)
式中:V0,释放介质总体积,mL;ρn,第n次取样时释放介质中牡蛎肽的质量浓度,mg/mL;V1,每次取样体积,mL;ρi,第1次到第n-1次时释放介质中牡蛎肽质量浓度之和,mg/mL;m,牡蛎肽-CaCO3 NPs纳米体系中牡蛎肽总含量,mg。
1.3.8 牡蛎肽-CaCO3 NPs纳米体系的消化稳定性
1.3.8.1 体外模拟消化
分别将牡蛎肽和纳米体系置于人工胃液中,在恒温振荡器中(37 ℃,135 r/min)模拟胃消化2 h。消化完毕后,用NaOH溶液调节其pH值至6.8,离心收集上清液待用。取相同体积的胃消化液和人工小肠液,混匀,同样置于恒温振荡器中(37 ℃,135 r/min)模拟胃肠消化4 h。消化完毕后100 ℃水浴灭酶10 min,冷却至室温,离心后取上清液进行胰脂肪酶抑制实验,评价其消化稳定性。
1.3.8.2 胰脂肪酶抑制活性测定
依次加入Tris-HCl缓冲液、样品和0.5 mg/mL胰脂肪酶溶液于离心管中,混匀,37 ℃水浴10 min。随后加入300 μL p-NPP底物溶液,充分混匀,于37 ℃水浴反应30 min,在405 nm处测定其吸光值,每组3个平行,抑制率按公式(4)计算。
抑制率![]()
(4)
式中:R,胰脂肪酶抑制率,%;A1,样品组吸光值;A2,样品对照组吸光值;A3,阴性对照组吸光值;A4,空白对照组吸光值。
1.4 数据处理
所有实验进行3次重复,实验结果均采用“平均值±标准差”来表示。使用JMP Pro 16.2.0软件对实验数据进行处理和分析,显著性差异采用Tukey HSD分析,P<0.05在统计学意义上认为是有显著差异。数据图像采用Origin 2024绘制。
2 结果与分析
2.1 CaCO3 NPs的制备
CaCO3 NPs是通过探究盐酸浓度、明胶浓度、反应温度以及时间来制备的,如电子版增强出版附图1、附表1、附表2所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042967)。制备的CaCO3 NPs颗粒具有良好的粒径值[(182.2±9.5) nm],且其zeta电位为(-27.8±0.8) mV,颗粒较为稳定,PDI为(0.350±0.102),具有良好分散性[15]。
2.2 ALG-CaCO3 NPs修饰条件的确定
2.2.1 单因素试验
研究报道,ALG是一种由β-D-甘露糖醛酸(M段)和α-L-古洛糖醛酸(G段)按1→4糖苷键连接而成的聚阴离子共聚物,其G段可与CaCO3 NPs中的Ca2+发生反应,对CaCO3 NPs具有稳定化修饰效果[16]。李准等[17]研究发现可通过ALG修饰纳米二氧化硅减弱其在水溶液中的团聚现象,提高其稳定性。因此,本研究中利用ALG对CaCO3 NPs进行稳定化修饰,考察了ALG质量浓度、反应时间以及反应温度对ALG-CaCO3 NPs的影响。图1为单因素试验结果,综合粒径、电位指标可得,ALG质量浓度5 mg/mL、制备时间2 h以及温度35 ℃的修饰条件下制得的CaCO3 NPs的粒径值和电位值最好(P<0.05),稳定性较高。图1-a显示,随着ALG浓度的增大,CaCO3 NPs的修饰产物(ALG-CaCO3 NPs)粒径呈现先降低后缓慢升高的趋势,这可能是由于ALG通过静电作用吸附在CaCO3 NPs表面,从而达到抑制CaCO3 NPs生长的目的,但当ALG浓度增大到一定值后,随着其吸附在CaCO3 NPs表面的量增多,反而会造成粒子粒径的增大[18]。而电位绝对值在ALG质量浓度为0.5~5 mg/mL时呈现升高趋势,在5 mg/mL达到电位绝对值最大(-38.4±1.2) mV,说明ALG修饰对CaCO3 NPs具有稳定性作用[19];而当质量浓度高于5 mg/mL时ALG-CaCO3 NPs的电位绝对值又缓慢下降(但电位绝对值仍大于30 mV,此时体系仍处于稳定状态),这与LEI等[20]的研究结果相似,可能是由于过量ALG聚集导致负电荷分布不均匀,从而改变了纳米颗粒的电荷特性。如图1-b所示,随着反应时间的增加,粒径值先降低后缓慢升高,而电位绝对值整体呈先升高后降低的趋势,在2 h有最小粒径值和最大电位绝对值,分别为(342.8±7.4) nm、(-50.6±0.9) mV,体系很稳定。混合初期,ALG吸附在CaCO3 NPs表面,形成单层包覆结构,抑制颗粒团聚从而降低粒径,同时ALG的负电荷特性会使得电位绝对值升高,随着反应时间增加,CaCO3 NPs中的Ca2+与ALG形成三维网络结构,导致局部聚集,粒径增大,而Ca2+的中和效应会降低表面的负电荷密度,造成电位绝对值减小[21]。温度的升高会促进CaCO3 NPs与ALG交联,使得ALG-CaCO3 NPs结合更为紧密,因此,在35 ℃时粒径和电位均有所下降(图1-c),但温度高于一定值后也会导致ALG吸水溶胀从而导致粒径增加[22]。
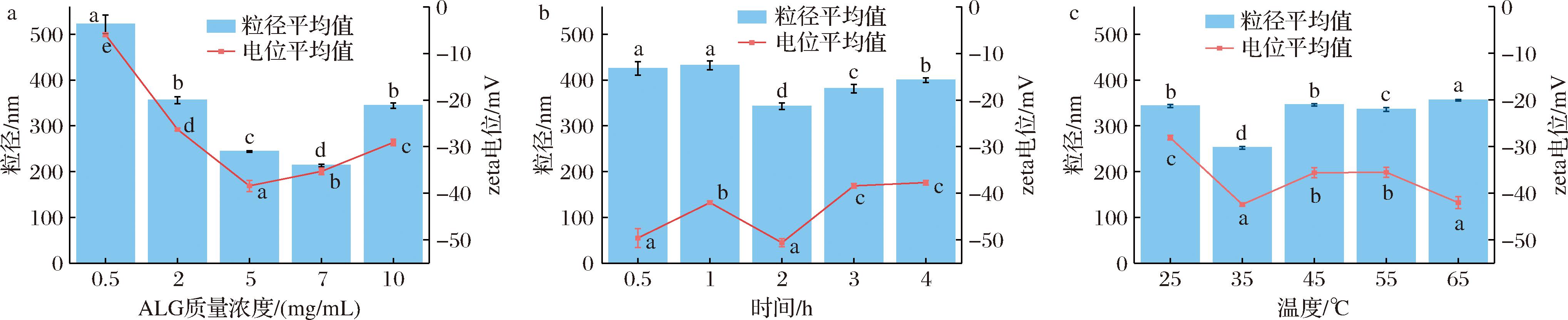
a-ALG;b-时间;c-温度
图1 ALG浓度、时间及温度对CaCO3粒径和电位的影响
Fig.1 Impacts of ALG concentration, time, and temperature on the particle size and zeta potential of CaCO3
注:不同小写字母表示显著性差异(P<0.05)(下同)。
2.2.2 正交试验
在单因素试验的基础上进行正交试验,结果如表1所示。根据正交试验结果可知,影响ALG修饰CaCO3 NPs的各因素主次关系为:A>B>C,其中ALG浓度的影响最大,温度次之,时间的影响最小,通过比较各因子k值可得ALG修饰的最优组合为A2B2C2,即ALG质量浓度5 mg/mL、温度35 ℃、反应时间2 h。在此条件下制备得到的ALG-CaCO3 NPs具有最小粒径值和最佳电位绝对值(225.8±1.5) nm,(-33.4±1.3) mV。
表1 ALG修饰正交试验结果
Table 1 Results of orthogonal experiment with sodium alginate modification
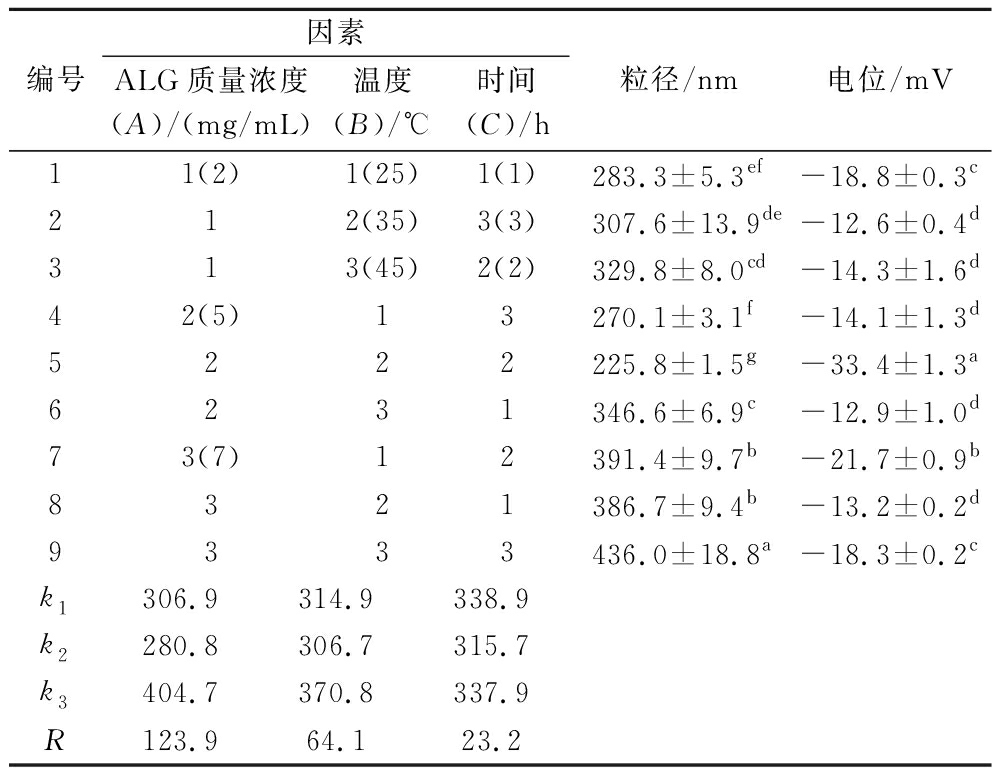
编号因素ALG质量浓度(A)/(mg/mL)温度(B)/℃时间(C)/h粒径/nm电位/mV11(2)1(25)1(1)283.3±5.3ef-18.8±0.3c212(35)3(3)307.6±13.9de-12.6±0.4d313(45)2(2)329.8±8.0cd-14.3±1.6d42(5)13270.1±3.1f-14.1±1.3d5222225.8±1.5g-33.4±1.3a6231346.6±6.9c-12.9±1.0d73(7)12391.4±9.7b-21.7±0.9b8321386.7±9.4b-13.2±0.2d9333436.0±18.8a-18.3±0.2ck1306.9314.9338.9k2280.8306.7315.7k3404.7370.8337.9R123.964.123.2
注:不同小写字母表示为显著性差异(P<0.05)。
2.3 牡蛎肽-CaCO3 NPs纳米体系的包封率和装载量
采用紫外分光光度法对纳米体系中负载的牡蛎肽进行含量测定,通过测定牡蛎肽在214 nm处的吸光度来建立标准曲线(y=0.799 6x+0.005 7,R2=0.999 3),根据公式进行计算,结果表明纳米体系的包封率和装载量分别为(35.69±2.22)%和(19.71±1.60)%。
2.4 CaCO3 NPs、ALG-CaCO3 NPs及纳米体系的结构表征
2.4.1 粒径、zeta电位及形貌特征分析
对最佳条件下制备所得到的CaCO3 NPs、ALG-CaCO3 NPs及纳米体系进行结构表征。结果表明,与CaCO3 NPs相比,ALG-CaCO3 NPs和纳米体系的粒径值分别从(182.2±9.5) nm显著增大至(225.8±1.5) nm和(288.7±7.6) nm(P<0.05)。这可能是由于修饰后,CaCO3 NPs表面的Ca2+与ALG交联形成蛋盒结构,致使其粒径增大[23],随后经过PEG包封后负载牡蛎肽,其粒径进一步增大。相比于CaCO3 NPs颗粒,ALG-CaCO3 NPs和纳米体系电位绝对值均显著性增大,分别从(27.8±0.8) mV升高至(33.4±1.3) mV和(30.5±0.8) mV(P<0.05)。这是因为ALG带负电荷,其通过静电作用修饰在CaCO3 NPs颗粒表面而导致其电位绝对值增大。但纳米体系与ALG-CaCO3 NPs相比,其电位绝对值下降。这可能是由于带正电荷的PEG接枝在纳米颗粒表面以及牡蛎肽负载到纳米颗粒中导致纳米体系整体电荷发生变化,但其电位绝对值仍大于30 mV,体系较稳定[24]。研究表明,纳米颗粒的大小直接影响着其黏液渗透及上皮层运输能力,且在500 nm以下的粒径范围内,尤其是小于200 nm的纳米颗粒,更容易穿过黏液被肠上皮细胞摄取[25],而本研究制备的纳米体系粒径值较小,有利于其渗透黏液从而被吸收。
CaCO3 NPs、ALG-CaCO3 NPs和纳米体系的形貌见图2,CaCO3 NPs由鳞片状颗粒聚集成球形(图2-a),且部分小型纳米颗粒会发生团聚,其形貌与文献报道一致,为球霰石晶型[26]。通过Nano measurer软件对图2-a中小型颗粒进行粒径分布计算,结果见图2-b,CaCO3 NPs粒径主要分布在100~200 nm,平均粒径约为199.8 nm,比前面DLS所测的水合粒径(182.2 nm)略大一些。本研究制备的CaCO3 NPs粒径与赵健辉[26]制备的CaCO3 NPs粒径具有一致性。
与未修饰的CaCO3 NPs相比,经过ALG修饰后的CaCO3 NPs颗粒团聚现象有所改善,粒径大小分布较均匀,平均粒径大约为246 nm(图2-c),此外,修饰后的CaCO3 NPs颗粒孔隙更大,疏松结构明显,这与前面推断ALG交联形成的蛋盒结构使CaCO3 NPs的粒径值变大,且其存在一定孔隙结构的结论相符,即ALG-CaCO3 NPs存在一定的空间来负载牡蛎肽[27]。由图2-d可看出负载了牡蛎肽的纳米体系整体表面较为粗糙,且与负载牡蛎肽前相比,孔隙减小,说明牡蛎肽负载到了ALG-CaCO3 NPs的孔隙中。
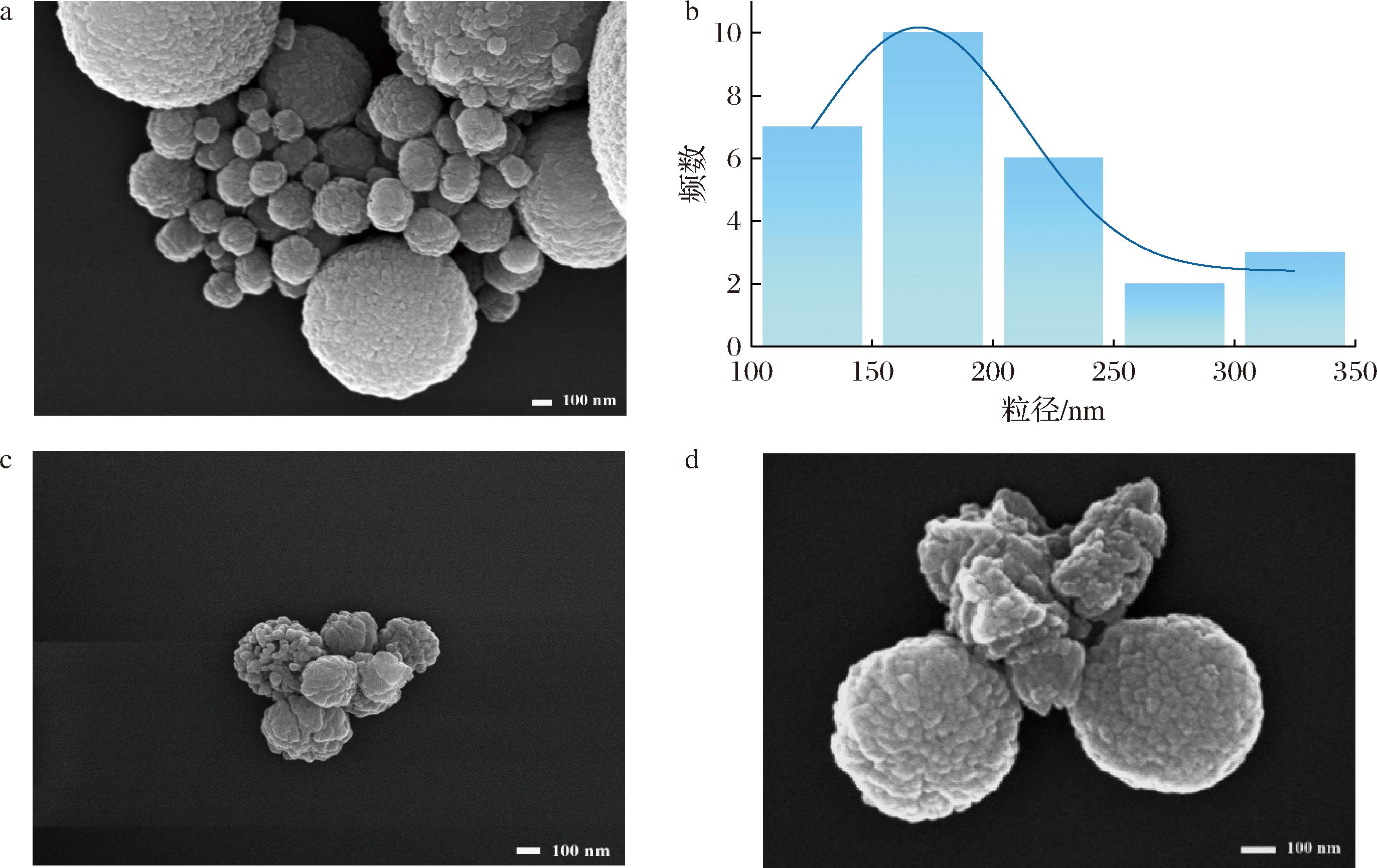
a-CaCO3 NPs;b-CaCO3 NPs粒径分布;c-ALG-CaCO3 NPs;d-牡蛎肽-CaCO3 NPs纳米体系
图2 三种纳米颗粒的扫描电镜图及CaCO3 NPs粒径分布
Fig.2 Scanning electron microscope images of three types of nanoparticles and particle size distribution of CaCO3 NPs
2.4.2 FTIR和XRD分析
FTIR谱图(图3-a)显示CaCO3 NPs具有1 466、1 082、875、746 cm-1特征吸收峰,以上特征峰分别为CaCO3的V3主吸收峰,V1、V2及V4次吸收峰,V3与V1与C—O键的不对称伸缩振动、对称拉伸振动,V2及V4与![]() 的弯曲振动有关[26]。此外,根据文献报道,875、746 cm-1吸收峰属于球霰石特征吸收峰[28],说明本研究制备的CaCO3 NPs为球霰石型,这与扫描电镜和XRD图分析所得的结论一致。
的弯曲振动有关[26]。此外,根据文献报道,875、746 cm-1吸收峰属于球霰石特征吸收峰[28],说明本研究制备的CaCO3 NPs为球霰石型,这与扫描电镜和XRD图分析所得的结论一致。

a-FTIR图;b-XRD图
图3 三种纳米颗粒的FTIR图和XRD图谱
Fig.3 FTIR and XRD pattern of three types of nanoparticles
经过ALG修饰后,ALG-CaCO3 NPs出现了3 439 cm-1和2 905 cm-1两个特征峰,二者分别是由—OH伸缩振动和饱和C—H伸缩振动所引起的[29]。由于![]() 中C—O的不对称伸缩振动以及—COO-的伸缩振动引起的重叠,ALG-CaCO3 NPs在1 663、1 485 cm-1以及1 434 cm-1处显示出宽带[30]。并且与CaCO3 NPs相比,ALG-CaCO3 NPs峰型出现了分裂,这是因为部分羧基中原羰基C
中C—O的不对称伸缩振动以及—COO-的伸缩振动引起的重叠,ALG-CaCO3 NPs在1 663、1 485 cm-1以及1 434 cm-1处显示出宽带[30]。并且与CaCO3 NPs相比,ALG-CaCO3 NPs峰型出现了分裂,这是因为部分羧基中原羰基C![]() O和C—O平均化(即2个平均化的C—O),出现分离的反对称伸缩振动(1 485 cm-1)和对称伸缩振动(1 434 cm-1),这说明ALG是通过羧基与Ca2+结合来对纳米颗粒进行的修饰[31]。此外,ALG-CaCO3 NPs在1 082 cm-1处的峰型有略微增强,这是由于ALG中C—O—C的伸缩振动引起的[32]。综上表明,ALG成功修饰了CaCO3 NPs。
O和C—O平均化(即2个平均化的C—O),出现分离的反对称伸缩振动(1 485 cm-1)和对称伸缩振动(1 434 cm-1),这说明ALG是通过羧基与Ca2+结合来对纳米颗粒进行的修饰[31]。此外,ALG-CaCO3 NPs在1 082 cm-1处的峰型有略微增强,这是由于ALG中C—O—C的伸缩振动引起的[32]。综上表明,ALG成功修饰了CaCO3 NPs。
牡蛎肽的特征峰主要是3 500~3 200 cm-1(分子间氢键O—H伸缩振动)、3 500~3 100 cm-1(N—H伸缩振动)、1 700~1 400 cm-1(酰胺I带和酰胺II带)[7]。而本研究纳米体系中的牡蛎肽特征峰不明显,这可能是由于其被负载到纳米颗粒孔隙内部,从而导致FTIR无法检测到其特征吸收峰[33]。其次,CaCO3 NPs可能存在强烈红外吸收的官能团,这些官能团的特征吸收峰可能会掩盖牡蛎肽的特征吸收峰,从而造成牡蛎肽特征峰在FTIR谱图中不明显,这与刘圆圆[34]研究中的活性分子负载后其FTIR谱图无明显变化的结果一致。此外,形成纳米体系后,一些特征峰从3 439、1 663 cm-1移动到3 420、1 633 cm-1,说明牡蛎肽、PEG和ALG-CaCO3 NPs之间存在静电相互作用[35]。综上结果表明,牡蛎肽成功负载到了纳米体系上,且其可能主要通过静电相互作用与纳米体系进行结合。
图3-b显示3种样品均在21°、25°、27°、32°、44°、49°、50°、55°有强衍射峰,这与球霰石标准卡片一致,说明3种样品均为球霰石型CaCO3 NPs,此结果与FTIR结果一致。
2.5 牡蛎肽-CaCO3 NPs纳米体系的胃肠道pH响应释放特性
如图4所示,36 h后,纳米体系在pH=2.0的最终释放量(40.31±0.63)%显著小于其在pH=6.8的最终释放量(93.12±3.76)%(P<0.001)。这可能是因为在胃液酸性条件下ALG会收缩,从而减弱牡蛎肽从纳米体系中的释放[16],避免牡蛎肽在到达吸收位点前被分解而导致活性丧失、生物利用度低等问题,且纳米体系中的CaCO3 NPs会先与胃液反应,从而保护牡蛎肽。而在pH=6.8时,纳米体系的累积释放量显著提高至(93.12±3.76)%,这是因为由胃环境到肠环境过程中随着pH的增加,ALG会发生溶胀,蛋盒结构逐渐被破坏,从而导致牡蛎肽的释放[36],这表明在肠道环境中,纳米体系能最大程度释放牡蛎肽。因此,纳米体系能够在胃环境中有效保护牡蛎肽,减少其分解,而在肠环境中牡蛎肽能更好地释放,显示出显著的靶向肠道缓释特性,这一特性有利于提高牡蛎肽的利用率。
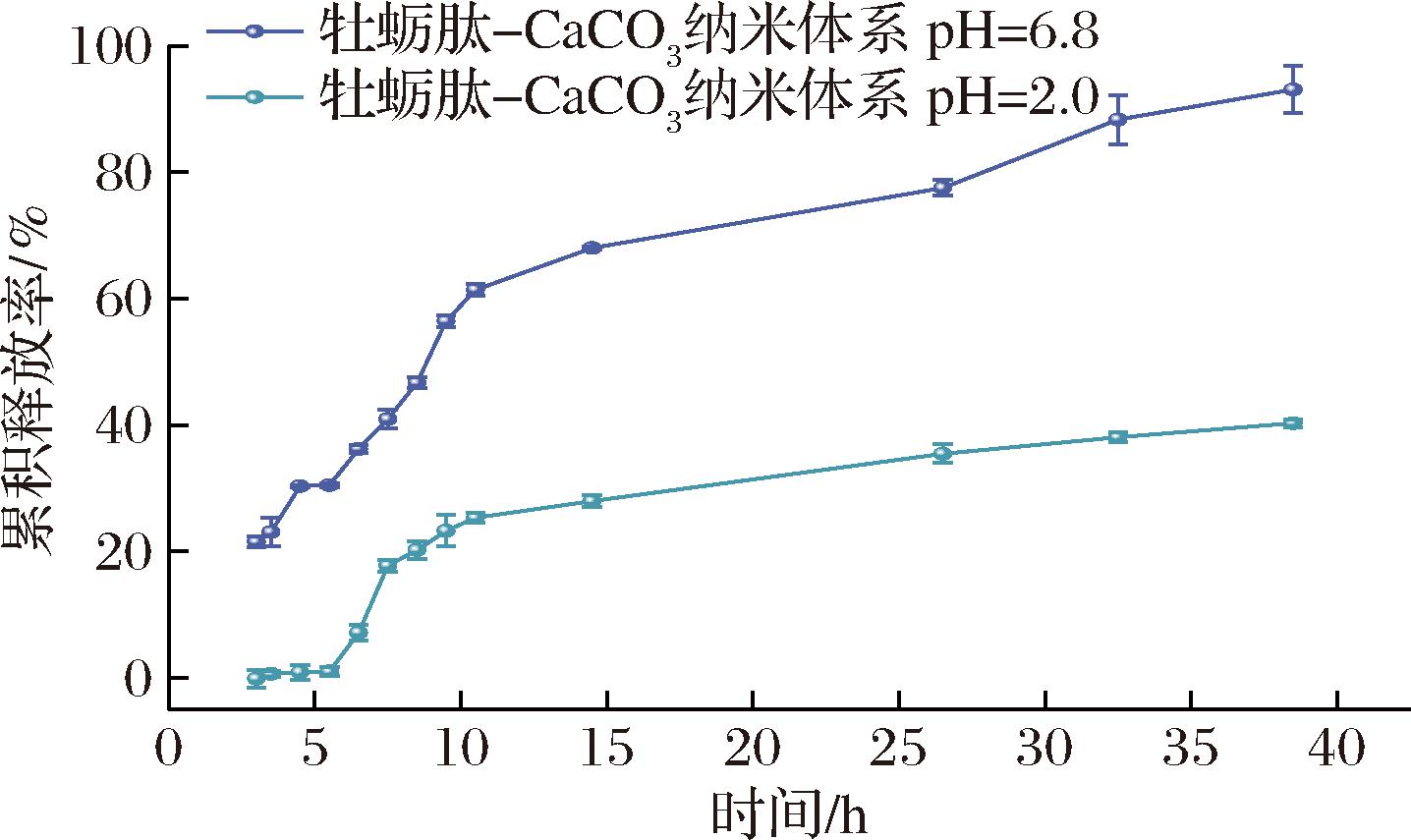
图4 牡蛎肽-CaCO3 NPs纳米体系在不同pH条件下的累计释放率
Fig.4 Cumulative release rates of oyster peptide-CaCO3NPs nano-system under different pH conditions
2.6 牡蛎肽及牡蛎肽-CaCO3 NPs纳米体系的消化稳定性
如图5所示,未消化前,牡蛎肽对胰脂肪酶的抑制率为(69.62±1.79)%,经过胃消化后其对胰脂肪酶的抑制率显著降低到(23.66±0.93)%(P<0.001)。这可能是因为胃部是极酸环境且含有胃蛋白酶等消化酶,在此条件下,牡蛎肽中对胰脂肪酶具有抑制作用的肽段被破坏或消化分解为活性较弱的短肽段和游离氨基酸,因此消化后的牡蛎肽对胰脂肪酶抑制率下降[37]。随后经过复杂的肠道环境,在急剧变化的pH和胰酶作用下,牡蛎肽中具有胰脂肪酶抑制活性成分的肽段进一步被分解,其抑制率显著降低到(4.75±0.38)%(P<0.001)。由此可见,牡蛎肽经过胃肠消化后胰脂肪酶抑制活性显著降低,其消化稳定性较差。
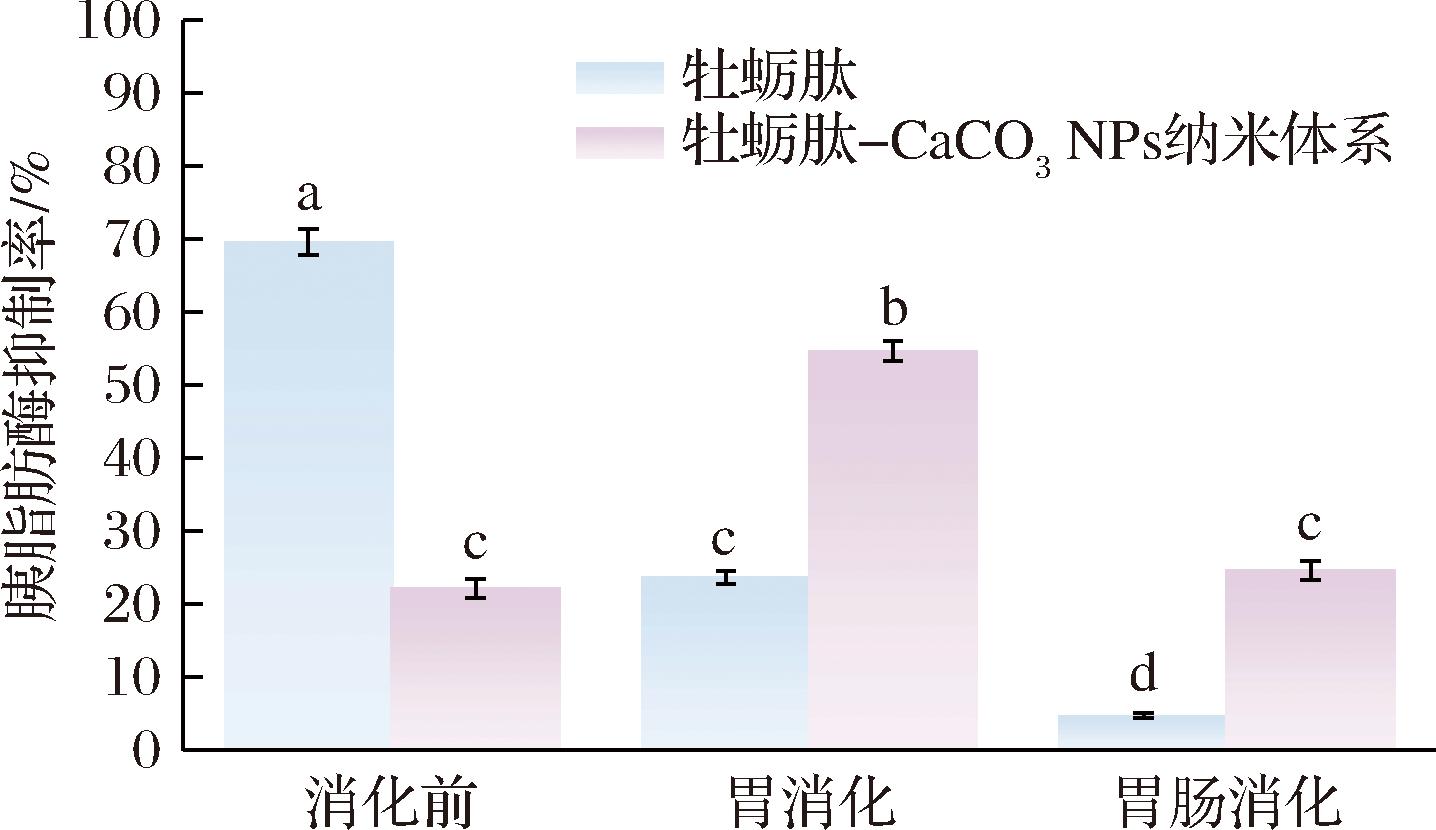
图5 牡蛎肽及牡蛎肽-CaCO3 NPs纳米体系的胰脂肪酶抑制率
Fig.5 The pancreatic lipase inhibition rate of oyster peptides and oyster peptide-CaCO3 NPs nano-system
未消化前,纳米体系对胰脂肪酶的抑制率为(22.16±1.32)%,经过胃消化后,其对胰脂肪酶的抑制率显著提高到(54.73±1.37)%(P<0.001)。这可能因为胃消化过程中,纳米体系的结构发生改变,这种结构变化可能使其更容易与胰脂肪酶发生相互作用,从而增强其抑制效果[19]。其次,被释放出来的牡蛎肽适当水解为更小的肽段或氨基酸,这些小分子肽段具有更高的生物活性和抑制能力[38]。同时,与经过胃消化后的牡蛎肽相比,其对胰脂肪酶的抑制率显著提高(P<0.001),从(23.66±0.93)%升高到(54.73±1.37)%,这表明纳米体系保护了牡蛎肽,避免了其与胃液及胃蛋白酶等消化酶长时间的直接接触而导致的过度消化分解,保护了牡蛎肽活性所依赖的结构,提高了其胰脂肪酶抑制活性,即提高了其消化稳定性。随后进行肠道消化,虽然纳米体系的胰脂肪酶抑制率降低至(24.67±1.31)%,但仍显著高于相同条件下牡蛎肽的胰脂肪酶抑制率(P<0.001)。综上结果说明,纳米体系能够提高牡蛎肽经过胃肠消化后的胰脂肪酶抑制活性,提高其消化稳定性。
3 结论
本研究探究了ALG对CaCO3 NPs稳定化修饰的工艺条件以及牡蛎肽-CaCO3 NPs纳米体系的结构稳定性、pH响应释放以及消化稳定性。通过单因素和正交试验,确定了ALG修饰CaCO3 NPs的最佳工艺参数:ALG质量浓度5 mg/mL、温度35 ℃、反应时间2 h。结构表征研究发现,ALG的修饰能够有效抑制CaCO3 NPs纳米颗粒团聚现象;构建的牡蛎肽-CaCO3 NPs纳米体系具有良好的包封率和装载量。体外释放研究表明,牡蛎肽-CaCO3 NPs纳米体系的pH响应释放特性有效保护了牡蛎肽在胃酸环境中的稳定性,同时促进了其在肠道中的释放。消化实验结果显示,牡蛎肽-CaCO3 NPs纳米体系显著提高了牡蛎肽在胃肠道中的胰脂肪酶抑制活性保留率。本研究通过构建pH响应型纳米递送体系,不仅提高了牡蛎肽的消化稳定性,而且为牡蛎壳资源的高值化利用提供了新思路。
[1] 赵强, 魏祥玲, 孙建安, 等.牡蛎资源的综合开发利用研究进展[J].中国食品添加剂, 2021, 32(7):150-159.ZHAO Q, WEI X L, SUN J A, et al.Research progress on comprehensive utilization of oyster resources[J].China Food Additives, 2021, 32(7):150-159.
[2] 曹文红, 章超桦.生物活性肽的吸收机制[J].药物生物技术, 2006, 13(5):384-388.CAO W H, ZHANG C H.Absorption mechanism of peptides in the gastrointestinal tract[J].Pharmaceutical Biotechnology, 2006, 13(5):384-388.
[3] 韦承忠. 牡蛎壳在化工生产和环境保护资源化利用中的研究进展[J].食品工业, 2022, 43(10):202-207.WEI C Z.Research progress of oyster shell resource utilization in chemical production and environmental protection[J].The Food Industry, 2022, 43(10):202-207.
[4] JADHAV V, ROY A, KAUR K, et al.Recent advances in nanomaterial-based drug delivery systems[J].Nano-Structures &Nano-Objects, 2024, 37:101103.
[5] VERGARO V, PAPADIA P, LEPORATTI S, et al.Synthesis of biocompatible polymeric nano-capsules based on calcium carbonate:A potential cisplatin delivery system[J].Journal of Inorganic Biochemistry, 2015, 153:284-292.
[6] RAO C H, LI M, SUN X Q, et al.Preparation and characterization of phosphate-stabilized amorphous calcium carbonate nanoparticles and their application in curcumin delivery[J].Materials Chemistry and Physics, 2020, 255:123552.
[7] 张佩. CMCS/CMC复合水凝胶负载牡蛎降糖肽稳态体系的构建及其吸收转运机制研究[D].湛江:广东海洋大学, 2023.ZHANG P.Construction of a stable system of oyster hypoglycemic peptides based on CMCS/CMC composite hydrogel and its absorption and transport mechanism[D].Zhanjiang:Guangdong Ocean University, 2023.
[8] 崔巍. 负载BMP-2小分子活性肽的介孔二氧化硅纳米微球结合煅烧骨支架材料诱导骨再生的实验研究[D].武汉:华中科技大学, 2017.CUI W.Induction of bone regeneration:a novel combination of mesoporous silica nanoparticles loaded with BMP-2-related peptide combined with true bone ceramics scaffold[D].Wuhan:Huazhong University of Science &Technology, 2017.
[9] RAJCHAKIT U, LAMBA S, WANG K, et al.Size-controlled synthesis of gold nanoparticles tethering antimicrobial peptides with potent broad-spectrum antimicrobial and antibiofilm activities[J].Molecular Pharmaceutics, 2024, 21(2):596-608.
[10] GAUTAM M, SANTHIYA D, DEY N.Zein coated calcium carbonate nanoparticles for the targeted controlled release of model antibiotic and nutrient across the intestine[J].Materials Today Communications, 2020, 25:101394.
[11] 苏小洁, 陈忠琴, 曹文红, 等.牡蛎DPP-Ⅳ抑制肽的结构特征及其协同花色苷的活性增效作用研究[J].食品与发酵工业, 2024, 50(15):87-96.SU X J, CHEN Z Q, CAO W H, et al.Structural characterization and synergistic inhibition of DPP-Ⅳ activity of oyster peptides and anthocyanins[J].Food and Fermentation Industries, 2024, 50(15):87-96.
[12] CHEN H, DONG X T, ZHAO Y Q, et al.Oyster-derived peptides as pancreatic lipase inhibitors:Kinetics, molecular interactions, and gastrointestinal stability[J].Food Bioscience, 2025, 63:105637.
[13] 赵历, 卓民权, 龚福忠, 等.碳化法制备球霰石碳酸钙微球及形成机理[J].无机盐工业, 2021, 53(3):38-43.ZHAO L, ZHUO M Q, GONG F Z, et al.Synthesis of vaterite CaCO3 microspheres by carbonization method and its formation mechanism[J].Inorganic Chemicals Industry, 2021, 53(3):38-43.
[14] 徐梦晴. 纳米碳酸钙载药体系构建及其用于肿瘤精准治疗研究[D].武汉:华中农业大学, 2021.XU M Q.Construction of nano calcium carbonate drug delivery system for tumor precision therapy[D].Wuhan:Huazhong Agricultural University, 2021.
[15] POLITI F A S, CARVALHO S G, RODERO C F, et al.Piperine-loaded nanoparticles incorporated into hyaluronic acid/sodium alginate-based membranes for the treatment of inflammatory skin diseases[J].International Journal of Biological Macromolecules, 2023, 227:736-748.
[16] 徐薇, 李慧雪, 刘霄莹, 等.海藻酸盐纳米载体递送亲脂性活性物质及其应用研究进展[J].食品科学, 2024, 45(17):242-252.XU W, LI H X, LIU X Y, et al.Research progress on alginate nanocarrier delivery of lipophilic active substances and its application[J].Food Science, 2024, 45(17):242-252.
[17] 李准, 李旋坤, 孙雯, 等.海藻酸钠修饰对纳米SiO2在水中团聚行为的影响及机制[J].山东化工, 2020, 49(12):39-41.LI Z, LI X K, SUN W, et al.Effect and mechanismof sodium alginate modification on the aggregation of nano-SiO2 in water[J].Shandong Chemical Industry, 2020, 49(12):39-41.
[18] LIU Y J, YU B R, DAI X G, et al.Biomineralized calcium carbonate nanohybrids for mild photothermal heating-enhanced gene therapy[J].Biomaterials, 2021, 274:120885.
[19] 谷峙樾. 协同转运复合纳米球的制备与性能[D].唐山:华北理工大学, 2019.GU Z Y.Preparation and properties of cooperative transport composite nanospheres[D].Tangshan:North China University of Science and Technology, 2019.
[20] LEI W Z, QI M D, SONG J L, et al.Adsorption of polyphenolic compounds by sodium alginate-modified starch nanoparticles in a multiphase system:Kinetic, thermodynamic and release characteristics studies[J].Food Hydrocolloids, 2025, 162:110900.
[21] 赵应许, 纵瑞强, 高欣玉, 等.XDLVO理论解析不同离子条件下海藻酸钠微滤膜污染[J].环境科学, 2014, 35(4):1343-1350.ZHAO Y X, ZONG R Q, GAO X Y, et al.Fouling behavior of sodium alginate during microfiltration at various ionic compositions:XDLVO approach[J].Environmental Science, 2014, 35(4):1343-1350.
[22] 庞子健, 徐源, 姜硕, 等.温度响应型淀粉醚/海藻酸钠复合凝胶的制备及其性能[J].大连海洋大学学报, 2022, 37(3):505-512.PANG Z J, XU Y, JIANG S, et al.Preparation and characterization of thermoresponsive starch ether/sodium alginate composite hydrogels[J].Journal of Dalian Ocean University, 2022, 37(3):505-512.
[23] ZHANG X J, WANG K, HU J Y, et al.Role of a high calcium ion content in extending the properties of alginate dual-crosslinked hydrogels[J].Journal of Materials Chemistry A, 2020, 8(47):25390-25401.
[24] CAO N P, ZHAO Y H, CHEN H B, et al.Poly(ethylene glycol) becomes a supra-polyelectrolyte by capturing hydronium ions in water[J].Macromolecules, 2022, 55(11):4656-4664.
[25] XU M Z, QI Y M, LIU G S, et al.Size-dependent in vivo transport of nanoparticles:Implications for delivery, targeting, and clearance[J].ACS Nano, 2023, 17(21):20825-20849.
[26] 赵健辉. 甘草次酸修饰碳酸钙空腔纳米球的肝靶向研究[D].唐山:华北理工大学, 2020.ZHAO J H.Liver targeting of glycyrrhetinic acid modified calcium carbonate hollow nanospheres[D].Tangshan:North China University of Science and Technology, 2020.
[27] 宋晓慧, 潘明宇, 徐坚峰, 等.球霰石在药物装载及控释中的应用[J].生物化学与生物物理进展, 2025, 52(1):162-181.SONG X H, PAN M Y, XU J F, et al.Applications of vaterite in drug loading and controlled release[J].Progress in Biochemistry and Biophysics, 2025, 52(1):162-181.
[28] 窦佳红. 瞬时纳米沉淀法制备球霰石型碳酸钙及其负载抗癌药物缓控释的研究[D].上海:华东理工大学, 2020.DOU J H.Preparation of vaterite CaCO3 particles by flash nano-precipitation technique for targeted and extended anticancer drug delivery[D].Shanghai:East China University of Science and Technology, 2020.
[29] 池如镜, 王志超, 张梦博, 等.海藻酸钠修饰磁性纳米粒子驱动液及其正渗透分离性能[J].膜科学与技术, 2020, 40(4):72-79.CHI R J, WANG Z C, ZHANG M B, et al.Sodium alginate modified magnetic nanoparticle draw solution and its forward osmosis performance[J].Membrane Science and Technology, 2020, 40(4):72-79.
[30] DONG Y J, HE Y H, FAN D D, et al.Preparation of pH-sensitive chitosan-deoxycholic acid-sodium alginate nanoparticles loaded with ginsenoside Rb1 and its controlled release mechanism[J].International Journal of Biological Macromolecules, 2023, 234:123736.
[31] 回瑞华, 关崇新, 侯冬岩.羧酸及其盐红外光谱特性的研究[J].鞍山师范学院学报, 2001, 3(1):95-98.HUI R H, GUAN C X, HOU D Y.Study on IR characteristics of carboxylic acid and their salts[J].Journal of Anshan Teachers College, 2001, 3(1):95-98.
[32] 牛冠超. pH响应型海藻酸钠基水凝胶对染料吸附性能研究[D].哈尔滨:黑龙江大学, 2024.NIU G C.Study on the adsorption properties of pH responsive sodium alginate based hydrogels for dyes[D].Harbin:Heilongjiang University, 2024.
[33] MICHELY L, CHESNEAU C, DIKA E, et al.Easy way for fabricating calcium carbonate hybrid microparticles-supported carrier:Focus on the loading of several hydrosoluble cargos all at once[J].Journal of Drug Delivery Science and Technology, 2022, 74:103485.
[34] 刘园园. 以磷酸钙为基材构建负载阿贝西利和维生素E琥珀酸酯双药共递体系的研究[D].成都:四川大学, 2021.LIU Y Y, Study on the construction of a dual-drug co-delivery system loaded with abemaciclib and vitamin E succinate based on calcium phosphate[D].Chengdu:` Sichuan University, 2021.
[35] 高就, 吴俊杰, 焦文雅, 等.6-姜烯酚玉米醇溶蛋白纳米颗粒的构建及其生物利用度分析[J].食品科学, 2024, 45(9):44-50.GAO J, WU J J, JIAO W Y, et al.Construction and bioavailability analysis of 6-shogaol-loaded zein nanoparticles[J].Food Science, 2024, 45(9):44-50.
[36] 王维聪, 张馨睿, 滕敏, 等.pH敏感型海藻酸钠/木炭缓释凝胶球的制备及性能[J].林业工程学报, 2022, 7(2):128-134.WANG W C, ZHANG X R, TENG M, et al.Preparation and performance of pH sensitive sodium alginate/charcoal slow-release gel spheres[J].Journal of Forestry Engineering, 2022, 7(2):128-134.
[37] 王华, 苏小洁, 陈忠琴, 等.不同处理方式对牡蛎降糖肽结构序列及消化特性的影响[J].食品工业科技, 2025,46(13):55-64.WANG H, SU X J, CHEN Z Q, et al.Effect of different treatments on the structure sequence and digestive characteristics of oyster hypoglycemic peptides[J].Science and Technology of Food Industry, 2025,46(13):55-64.
[38] ZHU D Y, YUAN Z, WU D, et al.The dual-function of bioactive peptides derived from oyster (Crassostrea gigas) proteins hydrolysates[J].Food Science and Human Wellness, 2023, 12(5):1609-1617.