Kex2是一种Ca2+离子依赖型丝氨酸内切蛋白酶,与枯草杆菌蛋白酶有远亲关系[1-2],可以特异性地识别肽链内部的双碱性氨基酸残基对,并在其羧基侧水解肽键,这些碱性氨基酸对可以是赖氨酸-精氨酸、精氨酸-精氨酸、脯氨酸-精氨酸[3-6]。该内切蛋白酶最早发现于酵母M1杀伤因子的加工过程,后来发现它同样可用于酵母α交配因子的加工和分泌过程[7-8]。Kex2全长814个氨基酸(amino acid,aa),共有7个结构域,分别为信号肽(1~19 aa)、前体肽(20~113 aa)、催化域(114~410 aa)、P结构域(411~624 aa)、丝氨酸苏氨酸富集区(625~679 aa)、跨膜区(680~699 aa)、胞浆结构域(700~814 aa),信号肽主要用于新生成的肽链在细胞内的转移,前体肽具有分子伴侣的功能,可以协助后续翻译的肽链完成正确折叠,P结构域由8条β折叠构成,形成独特的桶装结构,P结构域同样帮助酶分子的折叠,丝氨酸苏氨酸富集区是主要的糖基化位点,跨膜区和胞浆区对催化活性没有显著的贡献,但可用于成熟酶分子在细胞器间的转运,最终将Kex2定位于酵母细胞分泌途径的末端分区,分泌蛋白经过Kex2的加工,切除前体肽从而得到成熟蛋白[6,8]。
在生物体内Kex2是一种重要的前体蛋白加工酶,如荷尔蒙前体、神经肽前体以及胰岛素前体的加工处理等,事实上在生物体内绝大多数的双碱性氨基酸位点的酶切都是由Kex2或其类似物完成的[8]。同样由于其独特的位点特异性及高效性,Kex2在现代药物研究领域也有重要的应用价值,如在表达肽链的设计时,可以人为添加Kex2酶切位点将辅助序列(如前导序列、连接序列、纯化标签等)和目的序列进行融合,从而有助于后续的酶切处理。虽然其他蛋白内切酶(如胰蛋白酶)也可用于肽链酶切,但其识别位点为单个碱性氨基酸,在蛋白质内可能存在较多的潜在位点,因而在酶切处理中容易造成错切,而双碱性氨基酸对出现的概率则显著下降,且经过Kex2酶切后,肽链C端碱性氨基酸残基对可以用外切酶(如羧肽酶B)进行切除进而得到天然的序列。SREENIVAS等[9]在法夫驹形氏酵母(巴斯德毕赤酵母)中表达了甘精胰岛素单链,该单链是B链和A链的融合,B链和A链由2个精氨酸连接,在分泌表达的过程中融合链被法夫驹形氏酵母自身Kex2酶切形成双链,分析结果发现,分泌表达的单链仅有3%被成功酶切成双链,而在该重组菌中使用强启动子(FLD1)进一步过表达了Kex2后,分泌产物中>90%的产物为酶切成功的双链甘精胰岛素。
法夫驹形氏酵母作为一种重组蛋白表达工具最早起源于上个世纪90年代早期,如今已在药品、食品及其他工业领域的蛋白或酶的生产中得到了广泛应用[10],大量的重组蛋白都在法夫驹形氏酵母中得到了成功表达,如胰岛素、乙肝表面抗原、表皮生长因子等[11]。和细菌表达系统(如大肠杆菌)相比,法夫驹形氏酵母表达系统具有高效的分泌途径,可将重组表达的蛋白有效分泌到细胞外,从而简化后续分离和纯化步骤,法夫驹形氏酵母还可以进行翻译后修饰如糖基化、二硫键形成等,有助于新生肽链完成正确折叠从而得到活性蛋白[12-15],因此很多在细菌表达系统中仅能得到无活性包涵体的蛋白质都可以在法夫驹形氏酵母中成功表达。此外与其他真核表达系统相比,法夫驹形氏酵母培养简单、生长快速、且在甲醇利用过程中无溢流代谢,因此容易实现高密度发酵,从而有效提高重组蛋白的表达量,外源蛋白表达量可达到细胞质总蛋白的30%[16-17],HASSLACHER等[18]利用法夫驹形氏酵母表达的羟基腈裂解酶,其表达量达到了可溶总蛋白的50%。法夫驹形氏酵母醇氧化酶(alcohol oxidases,AOX)基因启动子受到严格调控,可以用于控制重组蛋白的表达,法夫驹形氏酵母表达系统还有丰富的操作工具,宿主菌有野生营养型的X33,His缺陷型的GS115,甲醇慢利用型(mut-)KM71以及其他的衍生菌株,Thermo fisher公司开发的PichiaPink表达系统可实现通过菌落颜色进行转化株的快速筛选等,这些都为使用法夫驹形氏酵母表达异源蛋白提供了巨大的便利。
Kex2酶的重组表达多使用法夫驹形氏酵母进行。王彤[19]利用GS115菌株表达了来源于法夫驹形氏酵母的Kex2(PPKex2),通过高密度发酵,上清液中蛋白浓度最高为0.88 g/L,最高酶活力产率为38.6 U/L发酵液。郭晋霞[20]在X33菌株中表达了Kex2的2~660 aa序列,得到纯化样的比活力为16.7 U/mg。刘颖颖等[21]在GS115菌株中表达了Kex2,使用BMMY培养基(buffered methanol-complex medium)对重组菌进行培养,然后通过透析除盐、强阴离子纯化得到电泳纯Kex2,经测定比活力为14.2 U/mg。目前Kex2的生产仍存在活力偏低的问题,市售商品重组Kex2的比活力约为10 U/mg,且价格高昂,为其规模化应用带来困难,也给使用者造成较大经济负担。本研究对酿酒酵母来源的Kex2进行了法夫驹形氏酵母表达,以期获得比活力高、稳定性良好的Kex2,同时开发适用于规模化生产的纯化工艺。
1 材料与方法
1.1 基因、质粒、菌株
通过NCBI查询来自酿酒酵母的Kex2序列,选取前体肽至丝氨酸苏氨酸富集区域,密码子优化后进行基因合成(苏州金唯智生物科技有限公司)并克隆于质粒pPICZαA中,在目的基因3′端添加终止密码子。宿主菌(野生营养型法夫驹形氏酵母X33),上海碧云天生物技术有限公司。
1.2 试剂
限制性内切酶,生工生物工程(上海)股份有限公司;博来霉素,上海懋康生物科技有限公司;蛋白浓度测定试剂盒、电泳试剂盒,上海碧云天生物技术有限公司;电泳分子质量标准,宝生物工程(大连)有限公司;Boc-QRR-pNA,杭州专肽生物技术有限公司;蛋白胨,美国OXOID公司;酵母粉,法国Lesaffre公司;葡萄糖、山梨醇、甘油、磷酸、氨水及其余均为国产分析纯试剂。
1.3 培养基
酵母浸出粉蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20。
YPD固定培养基(含博来霉素100 mg/L)(g/L):酵母粉10,蛋白胨20,葡萄糖20,琼脂粉18,121 ℃高温灭菌后冷却至40~50 ℃,加入博来霉素母液,使博来霉素终质量浓度为100 mg/L,倒平板。
酵母浸出粉蛋白胨甘油(yeast extract peptone glycerol,YPG)培养基(g/L):酵母粉10,蛋白胨20,甘油20。
基础盐培养基(basal salts medium,BSM)(g/L):H3PO4(体积分数85%)26.7mL,CaSO4 0.93,K2SO4 18.2,MgSO4·7H2O 14.9,KOH 4.13,甘油40。
1.4 设备
SCIENTZ-2C电转仪,宁波新芝生物科技股份有限公司;HZQ-211C恒温振荡器,上海一恒科学仪器有限公司;5 L四联发酵罐,上海保兴生物设备工程有限公司;AutoPre25D-M402纯化设备,苏州Inscinstech智能科技有限公司;Varioskan LUX多功能酶标仪,Thermo Fisher公司;LC-MP-31电导率仪,力辰科学仪器(湖南)有限公司。
1.5 重组菌构建
含有目的基因的表达质粒(pPICZαA-Kex2)使用限制性内切酶Sac I进行酶切线性化(37 ℃酶切15 min),电泳检验酶切完成情况,通过酚氯仿法对线性化的质粒进行纯化;取5 μg纯化的线性化质粒与事先制备好的X33感受态细胞(80 μL)混匀,转移至冰浴5 min的0.2 cm电转杯中,电击法转化(2 000 V,25 μF,400 Ω),将电击后的感受态细胞转入1 mL预冷的1 mol/L山梨醇中,30 ℃静止孵育2 h,将孵育的菌液涂布于YPD固定(含博来霉素100 mg/L)培养基上,30 ℃倒置培养72 h,挑取平板长出的菌落进行PCR鉴定,挑取4个成功转化的菌落进行划线纯化。由于法夫驹形氏酵母细胞壁较厚,因此在菌落PCR前对细胞进行预处理以促进其释放基因组DNA,预处理程序如下:挑取少量菌落重悬于20 μL无菌水,使用100 ℃金属浴加热10 min,然后置于-80 ℃冷冻5 min,再次于100 ℃加热5 min,处理后的菌悬液取1 μL作为扩增模板。
1.6 Kex2表达株筛选
使用BSM培养基通过5 L罐发酵进行了表达株初步筛选。从4个纯化平板上各挑取1个单菌落,分别接入YPD培养基中,30 ℃、220 r/min振荡培养24 h得到一级种子液,取5 mL一级种子液接入到100 mL YPG培养基中同等条件下培养12 h得到二级种子液,将二级种子液接入到5 L×4发酵罐中(起始培养体积2 L),30 ℃、通气量1 vvm搅拌培养,当起始培养基中碳源耗尽,溶解氧(dissolved oxygen,DO)突升继续补甘油至湿重达到180~200 g/L,开始甲醇补料,补料过程中保持甲醇为限制性底物,通过搅拌转速控制及补充纯O2,保持DO不低于20%,诱导补料时间约50 h,停止甲醇补料待DO上升后终止发酵,离心收集上清液并测定浓度,电泳检测表达情况。
1.7 Kex2表达
挑选表达量较高的菌株,按照1.5节所述方法进行发酵表达,诱导时间60 h,获得Kex2酶。
1.8 Kex2纯化
发酵液离心收集上清液,将上清液使用750 kDa中空纤维柱过滤,收集滤出液,随后使用5 kDa中空纤维柱对滤出液进行浓缩,浓缩液使用醋酸钠缓冲液(pH 5.0)进行稀释,使用阴离子交换柱进行纯化,电泳检验纯化效果。
1.9 Kex2活性测定
以Boc-QRR-pNA为底物,检测波长为405 nm,Boc-QRR-pNA在该波长下无吸收峰,Kex2能够水解RR羧基端共价键,产生游离的对硝基苯胺(p-nitroaniline,pNA),该物质在405 nm处有吸收峰,在一定范围内吸光值与pNA成正比。酶活力定义:在温度25 ℃、pH 8.0(50 mmol/L Tris-HCl溶液)条件下1 min内水解1 μmol/L底物所需的酶量定义为1个活力单位[1 U=1 μmol/(L·min)]。
反应采用96孔酶标板进行,取底物溶液200 μL(Boc-QRR-pNA 100 μmol/L)加入到反应孔中,将纯化的酶样稀释到5~10 μg/mL,取20 μL加入到200 μL反应底物中,混匀,在波长405 nm下每隔20 s记录1次吸光值A405,连续记录3 min,通过稀释纯化酶样品保证每分钟内吸光值的变化不超过0.04,每次活力测定做3个重复。按公式(1)计算活力单位数:
活力单位数![]()
(1)
式中:ΔA,某一时间跨度内吸光值的变化量;ε,该体系下摩尔消光系数,7 840.58 L/(mol·cm);L,220 μL体系光程,0.605 73 cm;Δt,时间跨度,min;TV,反应体系总体积,220 μL;SV,加入的样品体积,20 μL。
比活力按公式(2)计算:
比活力![]()
(2)
式中:m,待测样中Kex2的质量,mg。
1.10 Kex2酶活力稳定性研究
向纯化后的Kex2中加入适量甘油,使终浓度为10%(体积分数),分别于冷冻(-20 ℃)、冷藏(2~8 ℃)、室温下保存,定期进行活性测定,连续测定3个月。将含甘油10%(体积分数)的Kex2于-20 ℃冷冻2 h随后取出于室温融化解冻,连续进行3次冻融并测定每次冻融后比活力,检验其冻融稳定性。将纯化后的Kex2进行冷冻干燥,获得固体粉末酶,分别于冷冻(-20 ℃)、冷藏(2~8 ℃)、室温下保存,定期进行活性测定,连续测定3个月,以检验其保存稳定性。
2 结果与分析
2.1 质粒线性化
使用限制性内切酶Sac I对表达质粒进行了线性化,酶切结束使用80 ℃温育20 min使酶失活,取2 μL进行电泳检测,结果显示酶切后条带单一且其迁移速率明显低于酶切前样,说明质粒被完全切开(图1),使用酚氯仿纯化1次,75%(体积分数)乙醇沉淀、12 000 r/min离心5 min,沉淀使用无酶无菌水溶解备用。
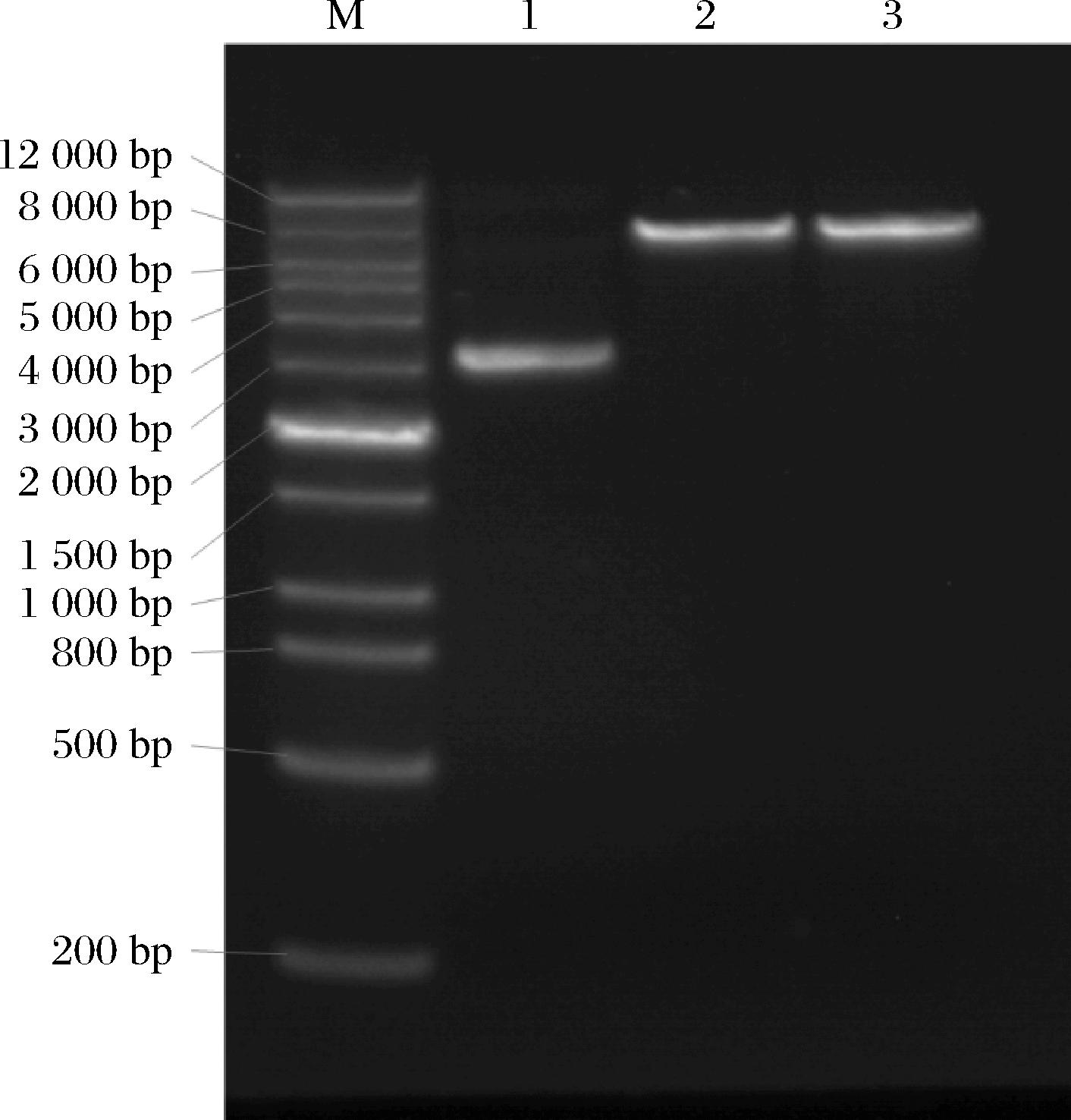
M-DNA marker;1-环状质粒(切前);2~3-线性化质粒。
图1 质粒线性化结果
Fig.1 Result of plasmid linearization
2.2 质粒转化
涂布平板于30 ℃培养3 d后成功长出菌落,随机挑取5~6个菌落使用通用引物5′AOX1、3′AOX1进行PCR鉴定。电泳结果显示随机挑选的6个转化菌落均扩增出2条特异性条带(图2),分别对应X33自身醇氧化酶基因片段(2.2 kb)和外源整合片段(2.5 kb),而作为对照的X33菌落仅扩增出2.2 kb条带,说明外源Kex2基因片段成功整合至X33染色体。
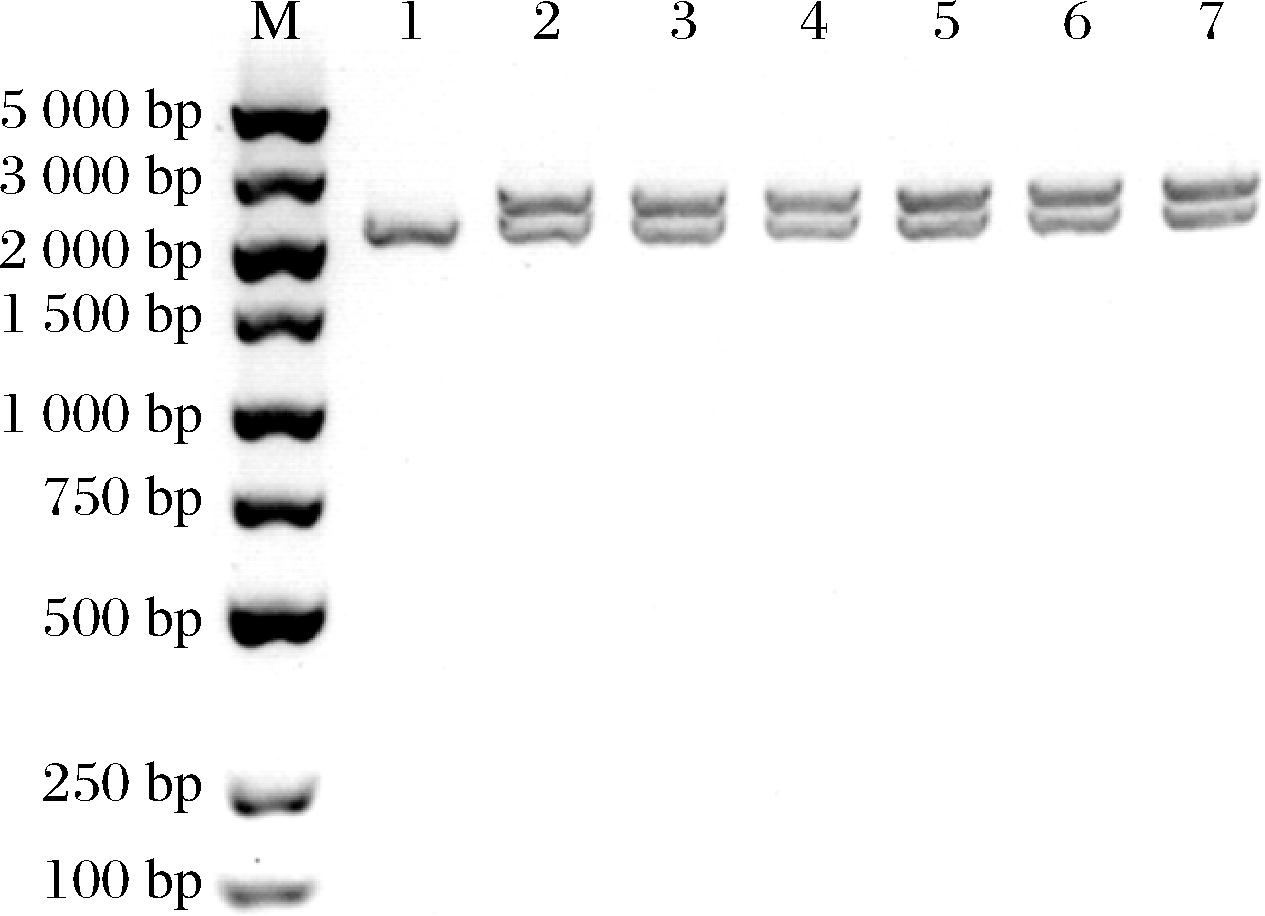
M-DNA Marker;1-X33;2~7-菌落1~6。
图2 转化菌落PCR结果
Fig.2 PCR results of transformant colony
2.3 Kex2表达株筛选
使用5 L四联罐对随机筛选的4个转化株进行了发酵表达,首先以甘油为碳源进行菌体细胞增殖,随后利用甲醇进行Kex2的基因诱导表达,取发酵上清液进行电泳检测,结果显示4个转化株在44.3~97.2 kDa之间有明显表达条带(图3),重组Kex2的理论分子质量为70 kDa,而诱导前发酵上清液中无此条带,说明Kex2分泌表达成功。
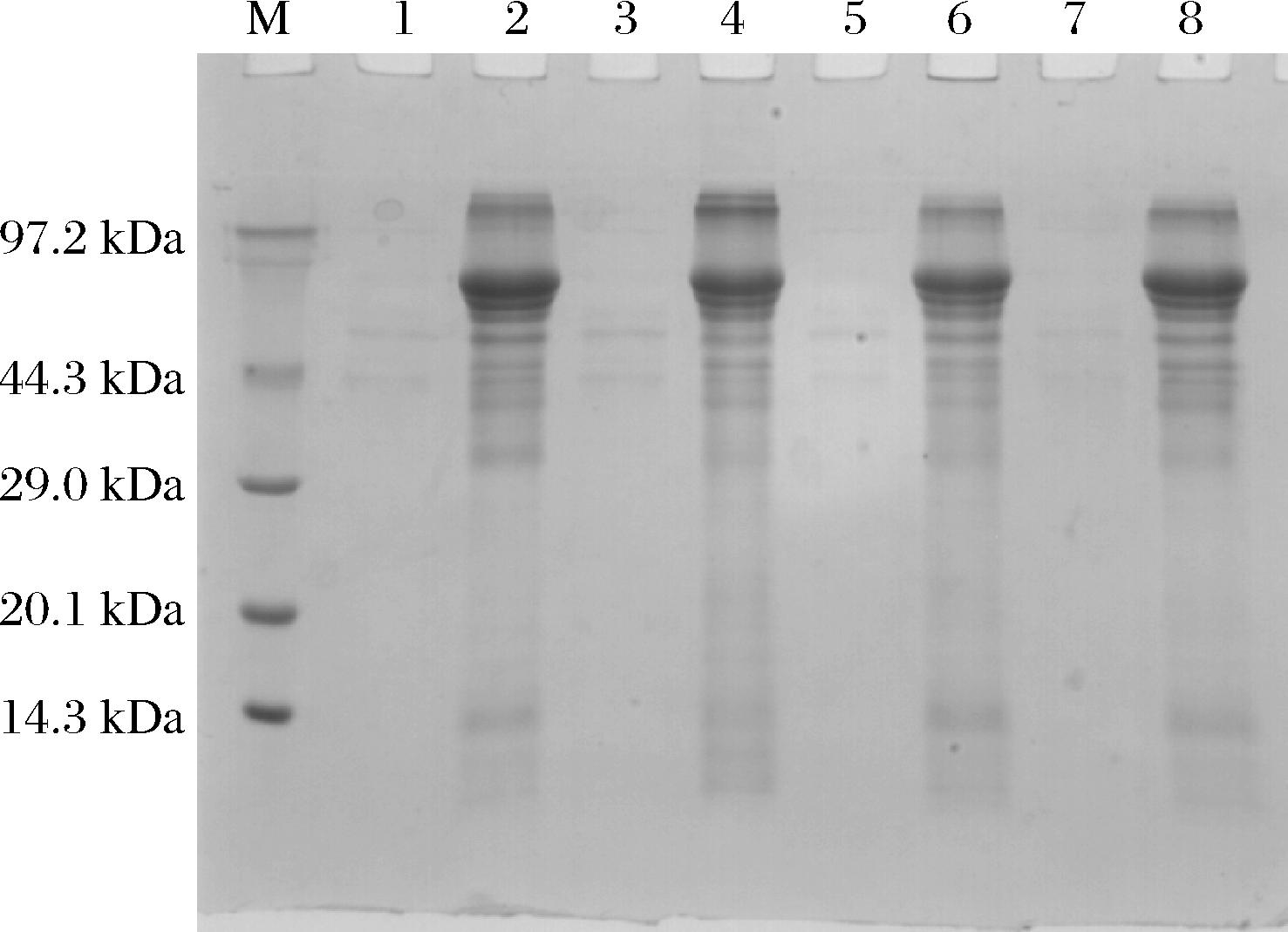
M-DNA Marker;1-转化株1诱导前;2-转化株1诱导后;3-转化株2诱导前;4-转化株2诱导后;5-转化株3诱导前;6-转化株3诱导后;7-转化株4诱导前;8-转化株4诱导后。
图3 四个转化株分别发酵后电泳结果
Fig.3 SDS-PAGE analysis of culture supernatant of four transformants
通过Bradford法测定发酵上清液总蛋白浓度,结果显示转化株1、2、3、4总蛋白质量浓度分别为2.164、1.802、1.918、2.018 g/L,结合电泳结果,确定选用转化株1进行后续研究。
2.4 Kex2表达
使用1.6节中所述培养基及方法进行Kex2的发酵表达,为进一步提高表达量,在发酵过程中延长诱导时间至60 h,在诱导过程中定时取样进行电泳监测(图4),由电泳图可见随着诱导时间延长,发酵上清液中目的蛋白含量逐渐增加,经Bradford法测定,发酵结束后上清液中总蛋白质量浓度为2.53 g/L,比表达株筛选时有所提高。
M-DNA Marker;1-诱导前;2-诱导24 h;3-诱导48 h;4-诱导60 h。
图4 发酵上清液电泳结果
Fig.4 SDS-PAGE results of culture supernatant
2.5 Kex2纯化
发酵上清液中含有较高的离子强度,经测定其电导率为15 μS/cm,无法直接进行离子交换柱上样,需对其进行预处理。首先使用750 kDa中空纤维柱对2.25 L发酵离心上清液进行过滤,在循环液体积低于起始体积1/3时加入和起始离心上清液等体积的10 mmol/L HAc-NaAc (pH 5.0)缓冲液对循环液进行洗涤,超滤循环至最小体积时,收集滤出液共3.85 L,测定总蛋白浓度计算超滤总蛋白收率,滤出液使用5 kDa中空纤维柱进行浓缩以除去发酵液中的离子,当浓缩至最小体积时加入适量10 mmol/L HAc-NaAc(pH 5.0)缓冲液对浓缩液进行换液,最终获得浓缩换液样3.0 L,测定其总蛋白浓度计算浓缩总蛋白收率(表1)。经测定浓缩换液样电导率为3.0 μS/cm。
表1 纯化各步骤收率
Table 1 Recovery rate of each step for purification of recombinant Kex2
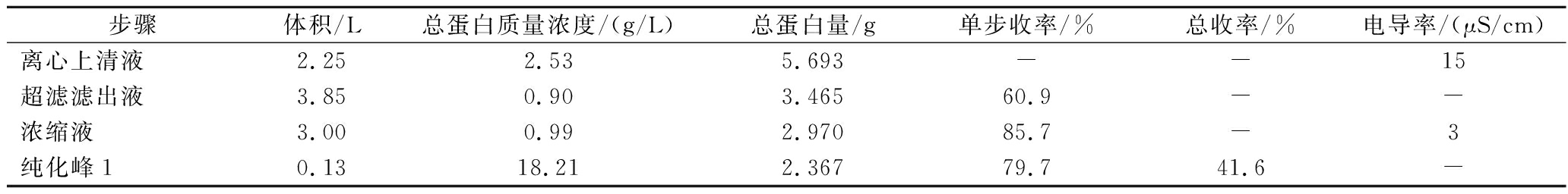
步骤体积/L总蛋白质量浓度/(g/L)总蛋白量/g单步收率/%总收率/%电导率/(μS/cm)离心上清液2.252.535.693--15超滤滤出液3.850.903.46560.9--浓缩液3.000.992.97085.7-3纯化峰10.1318.212.36779.741.6-
注:-表示未测定数值,(下同)。
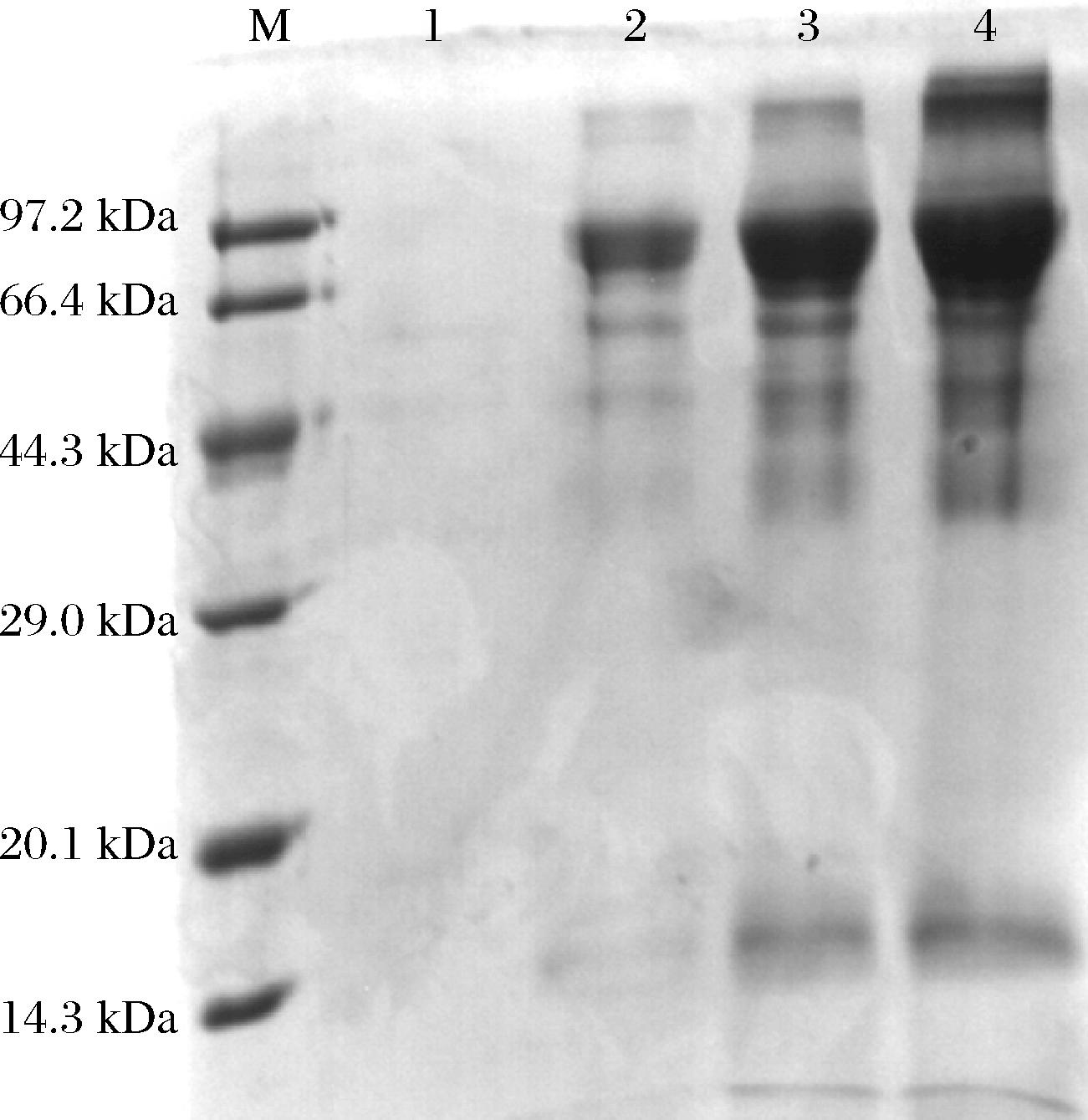
使用Q Sepharose Fast Flow离子交换柱纯化重组酶Kex2,首先使用10 mmol/L HAc-NaAc溶液(pH 5.0),平衡2~3个柱体积,再使用10 mmol/L HAc-NaAc溶液+1 mol/L NaCl溶液进行梯度洗脱,收集洗脱峰(图5)进行电泳及活性检测。电泳分析结果(图6)显示,Kex2主要存在于洗脱峰1中,洗脱峰2中含有少量目的酶,另外从柱前样和洗脱峰1的电泳条带相对位置看,纯化过程中Kex2可能存在一定程度的自切。活性检测结果显示洗脱峰1比活力为20.24 U/mg,洗脱峰2比活力为5.25 U/mg。
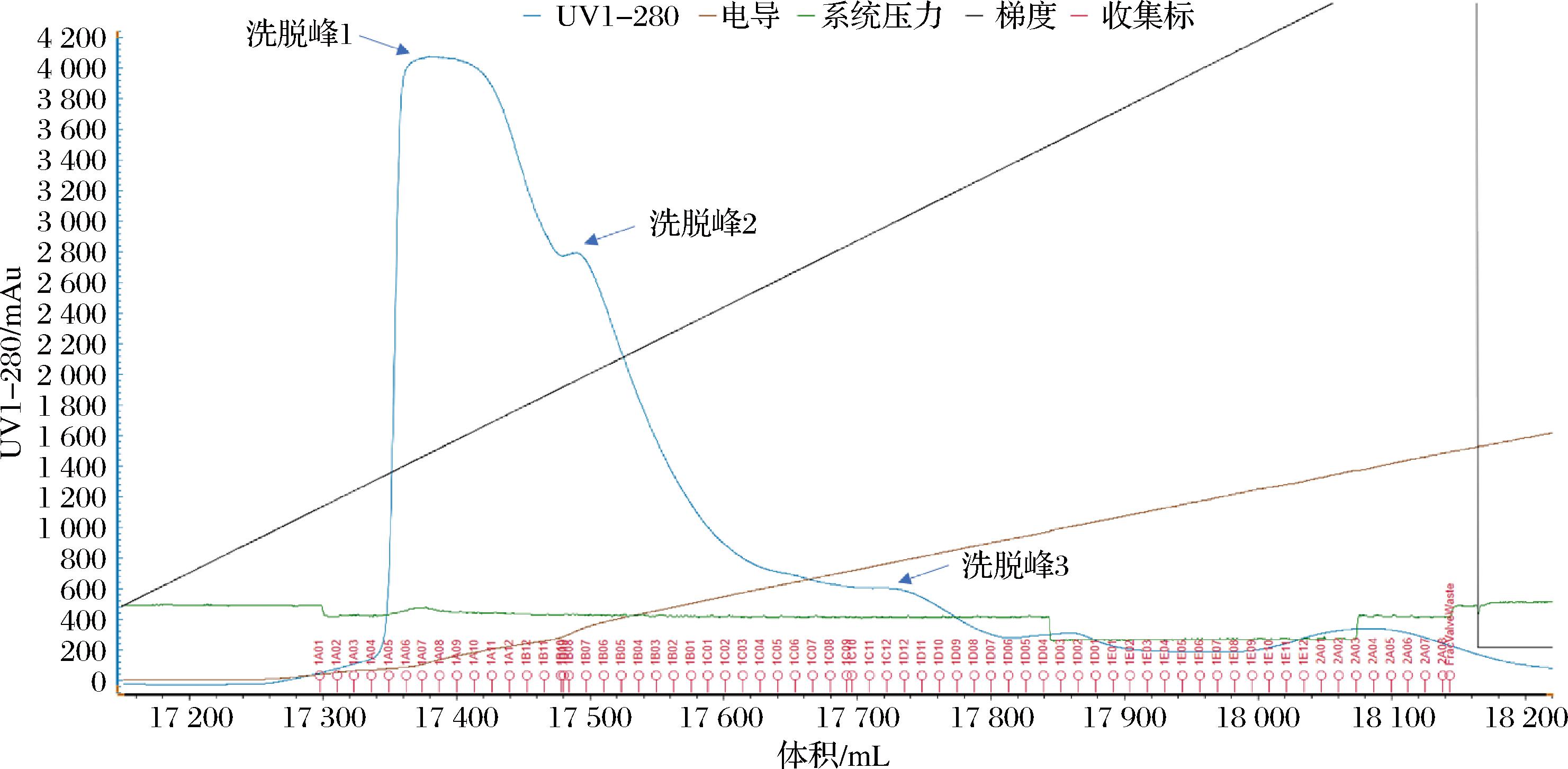
图5 Kex2离子交换柱纯化图谱
Fig.5 Purification profile of Kex2 on ion exchange chromatography
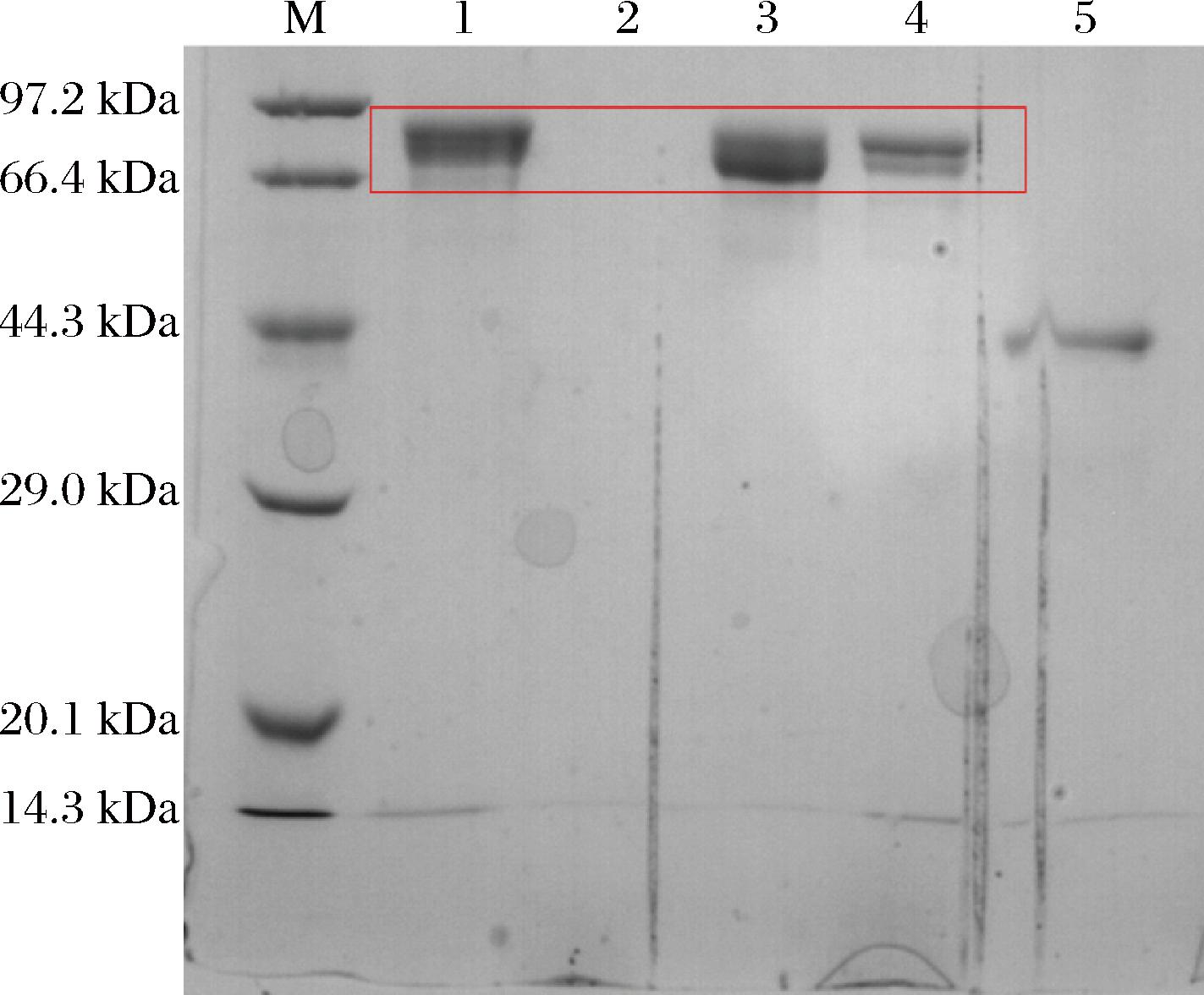
M-Protein Marker;1-柱前样;2-流穿样;3-洗脱峰1;4-洗脱峰2;5-洗脱峰3。
图6 纯化组分电泳结果
Fig.6 SDS-PAGE analysis of fractions after purification
2.6 Kex2稳定性研究
向纯化洗脱峰1加入适量体积的甘油,使终浓度为10%(体积分数,下同),然后分装至0.2 mL离心管,将其分别于-20 ℃、冷藏(2~8 ℃)、室温(20~25 ℃)下保存定期测定其比活力,结果显示含10%甘油的Kex2溶液在-20 ℃及冷藏条件下均较为稳定,起始比活力为20.04 U/mg,3个月后分别为15.56、16.62 U/mg,在室温条件下下降明显,在保存2个月后其比活力由原来的20.04 U/mg大幅下降至2.54 U/mg(图7)。
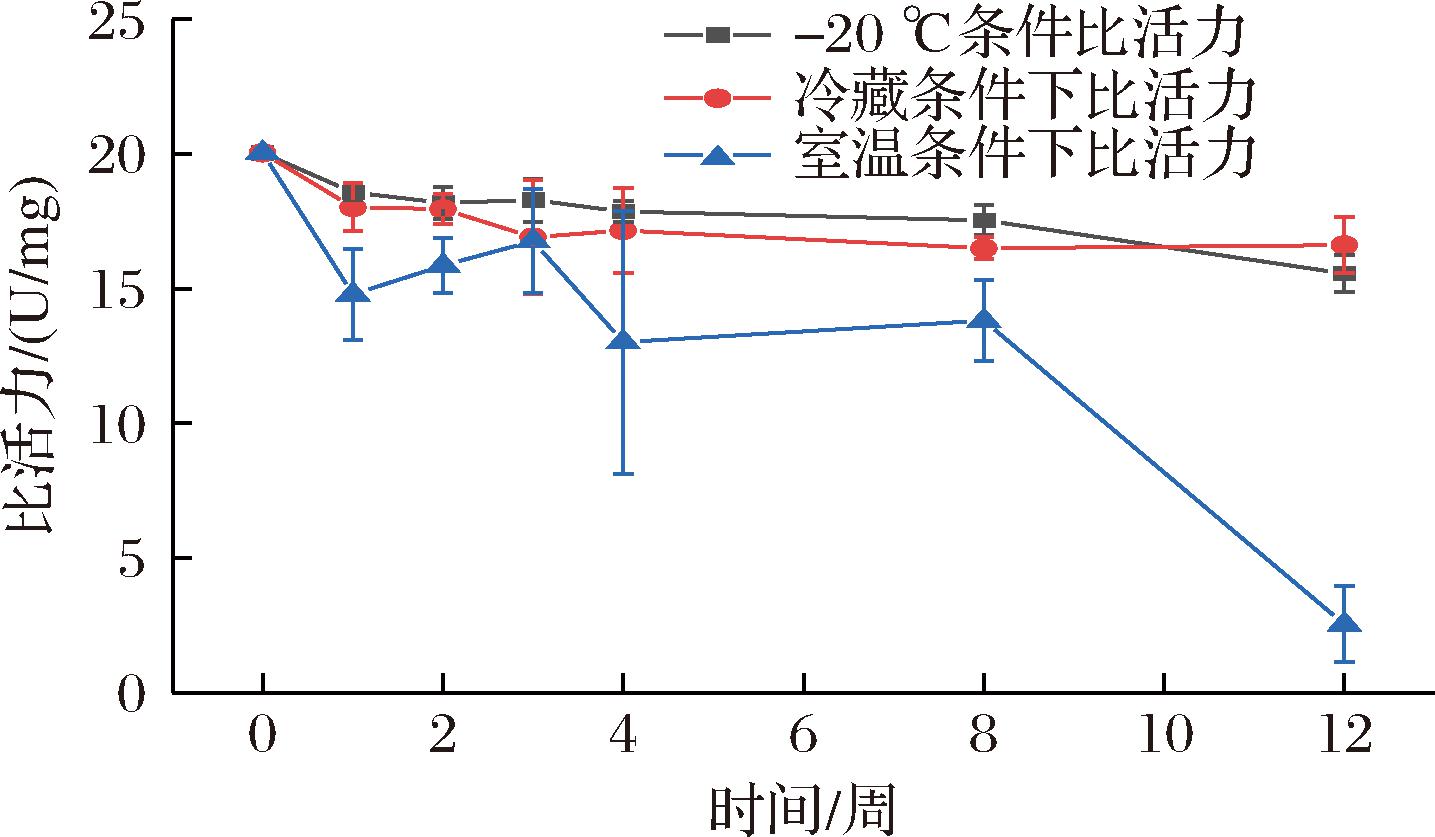
图7 溶液状态Kex2(含10%甘油)保存稳定性
Fig.7 Stability of Kex2 in buffered solution containing 10% (volume fraction) glycerol
加10%甘油的纯化酶放入-20 ℃冰箱2 h取出于室温解冻测定其比活力,共进行3次连续冻融,分别测定样品每次冻融后的剩余比活力,每次测定做3次重复(图8),结果显示比活力由起始的18.81 U/mg降至17.2 U/mg,方差分析显示冻融3次后酶比活力无显著性下降(P=0.22>0.05)。
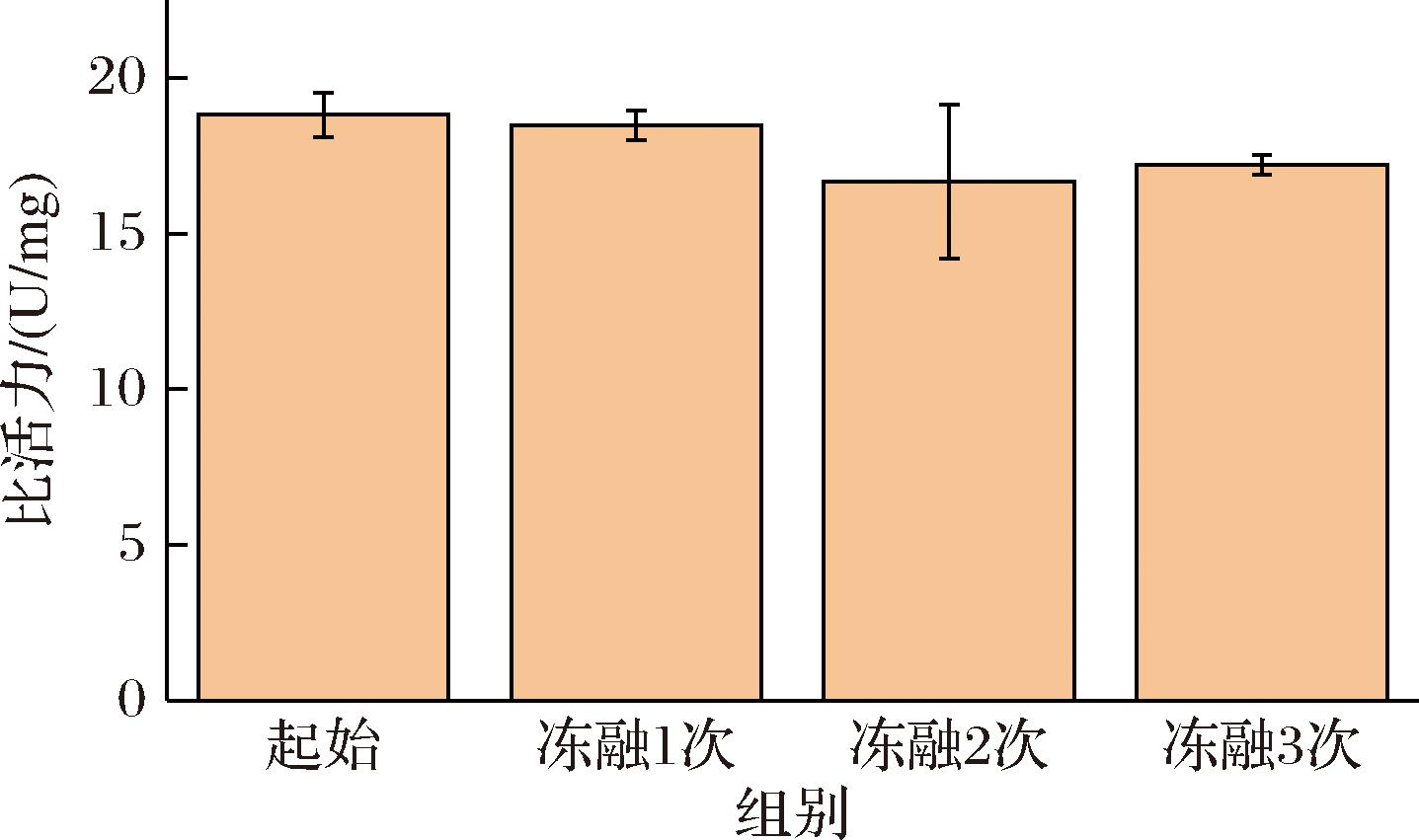
图8 连续3次冻融剩余比活力
Fig.8 Residual activity of Kex2 after repeated freeze-thawing for 3 cycles
将纯化洗脱峰1分装至0.2 mL离心管,进行冷冻干燥获得冻干粉,将冻干粉分别于-20 ℃、冷藏(2~8 ℃)、室温(20~25 ℃)下保存定期测定其比活力。结果显示与10%甘油保护的Kex2类似,冻干粉在-20 ℃及冷藏条件下均较为稳定,冻干样起始比活力为19.63 U/mg,-20 ℃及冷藏条件下3个月后分别为16.93、15.27 U/mg,而室温条件下酶活力下降明显,在保存3个月后其比活力由原来的19.64 U/mg下降至0.81 U/mg(图9)。室温下溶液状态的Kex2(含10%甘油)比活力较冻干粉下降的慢,可能是甘油对酶具有一定的保护效果。
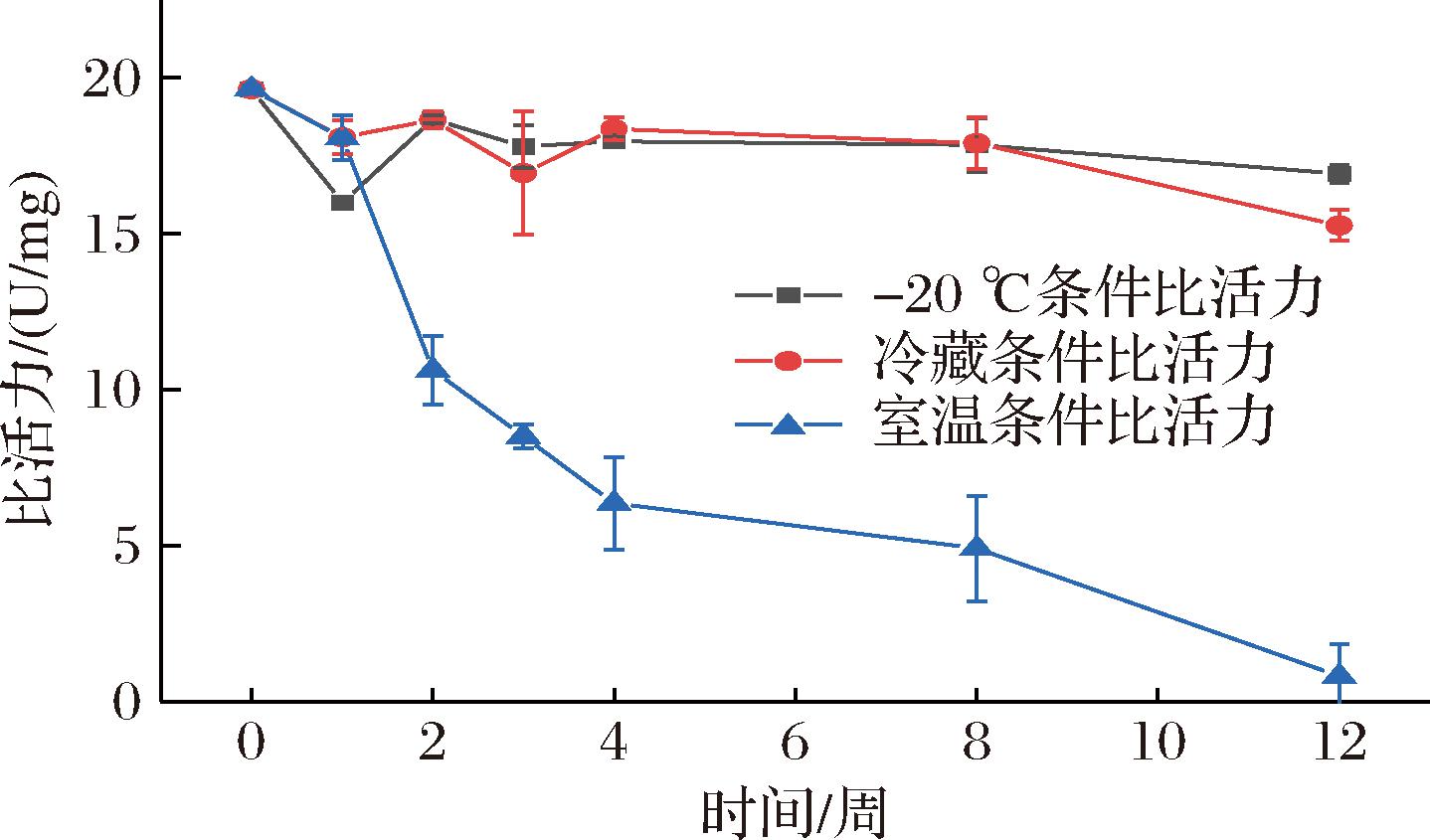
图9 冻干粉酶活力稳定性
Fig.9 Stability of lyophilized Kex2
3 结论与讨论
目前来源于酿酒酵母的Kex2已经实现商业化,但仍普遍存在价格较高,活性偏低等问题,本研究使用法夫驹形氏酵母表达了来自酿酒酵母的Kex2,去掉其自身信号肽,以酿酒酵母α交配因子信号肽引导其进行分泌表达。通过菌落PCR及发酵表达进行了转化子的初步筛选,在5 L发酵罐中其发酵上清液中总蛋白质量浓度达到2.53 g/L,为降低Kex2使用成本奠定了基础,后续通过发酵条件(如培养基组成、诱导温度及时间、补料速率、比生长速率控制等)优化预计可实现产量的进一步提高。另外本研究未考察外源基因拷贝数对Kex2产量的影响,有报道显示合适的基因拷贝数可以有效提高目的蛋白的表达量,因此优化目的基因整合数是进一步提高Kex2表达量的重要途径,另外通过转化株间的酶活力筛选也有望获得更高比活的菌株。
使用BSM培养基发酵完成后离心上清液中仍含有较多的固体颗粒且具有较高的离子强度,直接上样可能造成样品流穿或对纯化柱带来损坏。本研究通过不同孔径的超滤柱配合使用,成功实现了发酵液上柱前预处理,完全达到纯化柱上样要求(溶液澄清、电导率<5.0 μS/cm),两步处理总蛋白收率为52.2%。该方法避免了简单的稀释上样带来的上样体积过大及部分流穿损失等问题。在不进行超滤换液的情况下,仅通过稀释将发酵上清液电导率由>15 μS/cm降低至5.0 μS/cm约需4~6倍体积(数据未列出)的稀释缓冲液,规模化生产时将产生大量的废液,部分研究者采用了透析的方式对发酵上清液进行预处理,但该方法难以规模化生产。
预处理后的Kex2溶液使用离子交换柱一步纯化得到纯化组分,经测定其比活力达到20.24 U/mg,目前商业化Kex2酶的比活力约为5~10 U/mg,YANG等[6]、刘颖颖等[21]、郭晋霞[20]分别表达了Kex2酶,其比活力亦达到10.36、14.2、16.7 U/mg。通过纯化组分和柱前样的电泳图可以看出,纯化组分的分子质量略微偏小,可能是Kex2在纯化过程中存在一定的自切[22],后续通过纯化条件(如流动相pH)优化有望解决此问题。对纯化的Kex2稳定性进行了研究,结果显示在连续冻融3次后其比活力无显著下降,使用10%甘油保护的液态酶在-20 ℃和冷藏(2~8 ℃)条件下保存3个月剩余比活力分别为初始值的77.7%、82.9%,冻干粉状态下在-20 ℃和冷藏(2~8 ℃)条件下保存3个月剩余比活力分别为初始值的86.2%、77.8%。较好的稳定性具有重要的应用意义,另外该酶在室温条件下活性下降较快,后续可能需要对其酶制剂做进一步的研究,以提高其在室温条件下的稳定性。本研究提供了产量和活力均较高且稳定性较好的Kex2,对其进一步的工业化应用具有明显促进意义。
[1] MANFREDI M A, ANTUNES A A, DE OLIVEIRA PASSOS JESUS L, et al.Specificity characterization of the α-mating factor hormone by Kex2 protease[J].Biochimie, 2016, 131:149-158.
[2] FULLER R S, BRAKE A, THORNER J.Yeast prohormone processing enzyme (KEX2 gene product) is a Ca2+-dependent serine protease[J].Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(5):1434-1438.
[3] BRENNER C, BEVAN A, FULLER R S.11] Biochemical and genetic methods for analyzing specificity and activity of a precursor-processing enzyme:Yeast Kex2 protease, kexin[J].Methods in Enzymology, 1994, 244:152-167.
[4] MIZUNO K, NAKAMURA T, OHSHIMA T, et al.Characterization of KEX2-encoded endopeptidase from yeast Saccharomyces cerevisiae[J].Biochemical and Biophysical Research Communications, 1989, 159(1):305-311.
[5] JIN Y J, YANG N, TENG D, et al.Molecular modification of Kex2 P1’ site enhances expression and druggability of fungal defensin[J].Antibiotics, 2023, 12(4):786.
[6] YANG F, LIU L, LIU Y Y, et al.Effect of K225 residue to the catalytic efficiency of Kex2 protease[J].Protein Expression and Purification, 2020, 176:105725.
[7] KIM M J, PARK S L, KIM S H, et al.Modulation of Kex2p cleavage site for in vitro processing of recombinant proteins produced by Saccharomyces cerevisiae[J].Journal of Microbiology and Biotechnology, 2023, 33(11):1513-1520.
[8] ROCKWELL N C, KRYSAN D J, KOMIYAMA T, et al.Precursor processing by Kex2/furin proteases[J].ChemInform, 2003, 34(6):4525-4548.
[9] SREENIVAS S, KRISHNAIAH S M, GOVINDAPPA N, et al.Enhancement in production of recombinant two-chain Insulin Glargine by over-expression of Kex2 protease in Pichia pastoris[J].Applied Microbiology and Biotechnology, 2015, 99(1):327-336.
[10] PATRA P, DAS M, KUNDU P, et al.Recent advances in systems and synthetic biology approaches for developing novel cell-factories in non-conventional yeasts[J].Biotechnology Advances, 2021, 47:107695.
[11] ZHU T C, SUN H B, WANG M Y, et al.Pichia pastoris as a versatile cell factory for the production of industrial enzymes and chemicals:Current status and future perspectives[J].Biotechnology Journal, 2019, 14(6):1800694.
[12] KARBALAEI M, REZAEE S A, FARSIANI H.Pichia pastoris:A highly successful expression system for optimal synthesis of heterologous proteins[J].Journal of Cellular Physiology, 2020, 235(9):5867-5881.
[13] ZHANG A L, LUO J X, ZHANG T Y, et al.Recent advances on the GAP promoter derived expression system of Pichia pastoris[J].Molecular Biology Reports, 2009, 36(6):1611-1619.
[14] ZHANG C B, MA Y, MIAO H B, et al.Transcriptomic analysis of Pichia pastoris (Komagataella phaffii) GS115 during heterologous protein production using a high-cell-density fed-batch cultivation strategy[J].Frontiers in Microbiology, 2020, 11:463.
[15] AKISHEV Z, KIRIBAYEVA A, MUSSAKHMETOV A, et al.Constitutive expression of Camelus bactrianus prochymosin B in Pichia pastoris[J].Heliyon, 2021, 7(5):e07137.
[16] UNVER Y, GUN B S, ACAR M, et al.Heterologous expression of azurin from Pseudomonas aeruginosa in the yeast Pichia pastoris[J].Preparative Biochemistry &Biotechnology, 2021, 51(7):723-730.
[17] GAO J C, JIANG L H, LIAN J Z.Development of synthetic biology tools to engineer Pichia pastoris as a chassis for the production of natural products[J].Synthetic and Systems Biotechnology, 2021, 6(2):110-119.
[18] HASSLACHER M, SCHALL M, HAYN M, et al.High-level intracellular expression of hydroxynitrile lyase from the tropical rubber TreeHevea brasiliensisin microbial hosts[J].Protein Expression and Purification, 1997, 11(1):61-71.
[19] 王彤. 毕赤酵母来源Kex2蛋白酶的高效表达及酶学性质研究[D].无锡:江南大学, 2019.WANG T.High-level expression and characterization of Pichia pastoris Kex2[D].Wuxi:Jiangnan University, 2019.
[20] 郭晋霞. 重组双碱基内肽酶在毕赤酵母中的表达制备及酶活鉴定[D].重庆:重庆理工大学, 2016.GUO J X.Preparation of recombinant Kex2 in Pichia pastoris and its enzyme activity identification[D].Chongqing:Chongqing University of Technology, 2016.
[21] 刘颖颖, 王之可, 李素霞.Kex2蛋白酶在毕赤酵母中的表达、纯化和性质研究[J].中国生化药物杂志, 2015, 35(1):37-39;42.LIU Y Y, WANG Z K, LI S X.Expression, purification and properties of recombinant Kex2 in Pichia pastoris[J].Chinese Journal of Biochemical and Pharmaceuticals, 2015, 35(1):37-39;42.
[22] GERMAIN D, DUMAS F, VERNET T, et al.The pro-region of the Kex2 endoprotease of Saccharomyces cerevisiae is removed by self-processing[J].FEBS Letters, 1992, 299(3):283-286.