小麦麸质是小麦中主要的贮藏蛋白,由10%~15%高度异质化的非麸质蛋白和80%~85%的麸质蛋白组成。非麸质蛋白主要为球蛋白和白蛋白,能溶解于水或盐溶液中。麸质蛋白则由麦谷蛋白和麦醇溶蛋白组成,通过分子内和分子间的二硫键连接形成广泛的网状结构[1]。这种网状结构赋予了小麦麸质诸多性质,如持水性、凝聚性和黏弹性,使麸质成为食品工业中的重要成分。麸质常作为食品添加剂使用,用于增强食品的质地、持水能力和风味[2-3]。
尽管小麦麸质在食品加工中展现出诸多优越的功能特性,但其应用过程中仍面临挑战[4]。例如,麸质可能引发部分人群的过敏反应,如乳糜泻和非乳糜泻性麸质敏感症,限制了其在特定人群中的应用范围[5-6]。此外,麸质的功能特性有时难以完全满足不同食品产品对质地、稳定性和口感的多样化需求,这需要通过改性来优化其性能。且随着消费者对食品安全、健康和天然成分的关注不断提升,如何在不使用或减少化学添加剂的情况下改良麸质,也成为食品工业亟需解决的问题。这些因素共同驱动着研究人员和行业专家寻求新的方法,以调整麸质的结构和功能特性,从而提升其在食品加工中的应用潜力。
这些挑战促使研究人员和行业专家探索通过物理、化学和生物方法来改变麸质的结构和功能特性,以降低其致敏性或增强其在食品加工中的性能。近年来,低频(20~100 kHz)高强度(功率密度1~10 W/mL)超声波作为一种食品预处理技术受到了广泛关注,特别是在消费者日益关注食品安全、健康、营养和疾病预防的背景下。超声波通过空化作用影响液体体系,在超声波传播过程中产生大量空化气泡,这些气泡在几次周期内迅速膨胀和压缩,最终达到临界尺寸并发生崩溃。空化气泡的爆裂产生局部的高温(5 000 K)和高压(1 000 atm),并伴随强烈的剪切力湍流流动。此外,超声波还可以打破水分子中的氢氧键,产生具有氧化性的羟自由基,这些自由基可氧化蛋白质并以不同方式影响底物。因此,超声波可以通过物理、化学等机制共同作用于蛋白质[7-8]。
近年来,许多研究表明,超声波对食品加工和处理具有显著影响,特别是在麸质蛋白的改性方面。例如,超声波与转谷氨酰胺酶预处理的结合已被发现能够增加麸质水解产物的水解程度,增强鲜味并减少苦味[9]。另一项研究表明,超声波改善了麸质蛋白的结构特性,使添加马铃薯浆的馒头具有更好的质地和品质[10]。类似地,多频超声波被证明能够增强麸质的理化性质,提高面团的弹性和面条的品质[11]。超声波处理已被证实能增强小麦麸质的功能特性,如起泡性和乳化能力[12]。但在高强度超声波改性麸质蛋白方面目前研究较少。
本研究旨在阐明高强度超声波改变麸质蛋白结构和功能特性的机制,为小麦麸质在食品工业中的更好应用提供科学依据。本研究不仅为现有研究提供了补充,也为未来麸质改性及应用研究提供了新思路。研究结果可能有助于开发针对性的食品加工方法,改善食品的质地、风味和营养价值,同时可能减少麸质的致敏性并增强食品安全性。
1 材料与方法
1.1 材料与试剂
小麦麸质,山东佰兴生物科技有限公司。产品指标如下:水分含量≤8%;粗蛋白含量(N×5.7,干基)≥75%;灰份含量(干基)≤1.0%;脂肪含量(干基)≤1.0%;粗细度:CB30号筛通过率≥99.5%,且CB36筛通过率≥95%;吸水率(干基)≥160%。其余试剂若未提及均为分析纯,麦克林试剂公司。
1.2 仪器与设备
JY92-IIN超声波细胞破碎仪,宁波新芝生物科技股份有限公司;FDU-1200冻干机,日本东京理化器械株式会社;Infinite 200 Pro酶标仪,瑞士TECAN公司;F-4700荧光分光光度计,日本HITACHI公司;T27傅里叶变换红外光谱仪,德国BRUKER公司。
1.3 小麦麸质样品制取与超声波处理
将30 g/L的小麦麸质悬浮液在室温下均匀搅拌10 min,以确保充分混合。随后,将200 mL样品转移到烧杯中,并使用超声波细胞破碎仪在26 ℃下处理20 min,超声波功率分别为0、200、300、400、500、600 W,超声波探头为6 mm。在处理过程中,使用冰水浴保持低温。处理结束后,使用冻干机进行冻干,再将所得样品粉碎并通过100目筛网,并储存于-20 ℃备用。未经超声波处理的样品标记为对照组。通常将超声波功率密度达到1 W/mL及以上视为高强度超声波。本实验所用的超声波处理均在200 mL水溶液体系中进行,因此最低处理功率(200 W)已满足高强度超声波的标准。故本文采用超声波总功率(W)来表征超声波强度,而非以W/mL表示。
1.4 可溶性蛋白含量
将100 mg样品溶解在10 mL的磷酸盐缓冲液(0.01 mol/L,pH 7.0)中,并在室温下搅拌1 h。然后,将混合物在13 600×g下离心30 min,收集上清液用于蛋白质浓度的测定,使用BCA蛋白质测定试剂盒。在562 nm处使用酶标仪测量样品的吸光度。
1.5 游离巯基含量
基于LI等[13]的方法,并稍作修改。将50 mg的样品溶解在5 mL反应缓冲液中,缓冲液含有3 mmol/L EDTA、0.01 g/mL SDS、8 mol/L尿素和0.2 mol/L Tris-HCl(pH 8.0),然后将溶液充分混合并在室温下振荡1 h。接着,加入0.05 mL Ellman试剂[5,5′-二硫代双(2-硝基苯甲酸),在0.2 mol/L Tris-HCl(pH 8.0)中,质量浓度为4 mg/mL)],混合物在黑暗中孵育30 min。孵育后,混合物在13 600×g下离心15 min,收集上清液并在412 nm处测量其吸光度。使用Bradford法测定麸质蛋白浓度,游离巯基含量以μmol SH/g蛋白表示。
1.6 非共价相互作用
非共价相互作用是维持蛋白质三级结构的关键作用力,主要包括离子键、氢键和疏水相互作用,参照G MEZ-GUILLÉN等[14]的方法。将150 mg样品溶解在10 mL以下试剂中:0.05 mol/L NaCl(S1)、0.6 mol/L NaCl(S2)、0.6 mol/L NaCl+1.5 mol/L尿素(S3)和0.6 mol/L NaCl+8 mol/L尿素(S4)。在充分均质化后,悬浮液在室温下振荡1 h,随后在5 000×g下离心15 min。使用Bradford法测定可溶性蛋白含量。离子键、氢键和疏水相互作用的贡献通过分别比较S1与S2、S2与S3、S3与S4中溶解的蛋白质含量来确定,可溶蛋白含量以mg/mL来表示。
MEZ-GUILLÉN等[14]的方法。将150 mg样品溶解在10 mL以下试剂中:0.05 mol/L NaCl(S1)、0.6 mol/L NaCl(S2)、0.6 mol/L NaCl+1.5 mol/L尿素(S3)和0.6 mol/L NaCl+8 mol/L尿素(S4)。在充分均质化后,悬浮液在室温下振荡1 h,随后在5 000×g下离心15 min。使用Bradford法测定可溶性蛋白含量。离子键、氢键和疏水相互作用的贡献通过分别比较S1与S2、S2与S3、S3与S4中溶解的蛋白质含量来确定,可溶蛋白含量以mg/mL来表示。
1.7 表面疏水性
使用8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针评估样品的表面疏水性[15]。将样品溶解在磷酸盐缓冲液(10 mmol/L,pH 7.0)中,并充分搅拌,达到最终蛋白质质量浓度为0.5 mg/mL。然后将样品稀释成5个浓度梯度,质量浓度范围为0.001~0.5 mg/mL。每个样品中加入0.04 mL ANS试剂(8 mmol/L ANS在10 mmol/L磷酸盐缓冲液,pH 7.0),混合物在黑暗中孵育30 min。使用390 nm的激发波长和470 nm的发射波长测量荧光强度,狭缝宽度均设置为5 nm。绘制荧光强度与蛋白质浓度的关系图,并通过线性区域的斜率(S0)来评估表面疏水性。
1.8 荧光光谱
荧光光谱常用于评估蛋白质三级结构的变化,主要因为蛋白质中的色氨酸、酪氨酸和苯丙氨酸残基能够在特定波长下吸收光并在不同波长下发射荧光。通过分析发射荧光的强度和波长,可以确定蛋白质三级结构的变化。参照WU等[16]的方法。样品溶解在磷酸盐缓冲液(10 mmol/L,pH 7.0)中,并充分搅拌,达到最终蛋白质质量浓度为0.5 mg/mL。使用荧光分光光度计测量样品溶液的荧光强度。激发和发射光狭缝宽度均设置为5 nm,激发光波长为280 nm,发射光波长范围为300~450 nm。
1.9 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)
参照LIU等[17]的方法进行。冻干样品(1 mg)与KBr(100 mg)混合,并使用研钵和杵充分研磨。将混合物压制成均匀的薄片。使用红外光谱仪在4 000~400 cm-1的波数范围内进行光谱扫描,分辨率为4 cm-1。使用OMNIC软件对光谱进行基线校正和去卷积处理,并通过PeakFit 4.12软件进行分析。
1.10 体外消化率
基于KUANG等[18]的方法,并略作修改。将含有50 mg蛋白质的麸质样品溶解在5 mL人工胃液中(胃蛋白酶活性为182 U/mg),并轻轻搅拌。样品在37 ℃下消化1 h。消化完成后,加入100 μL的1 mol/L NaOH以停止反应。随后,加入5 mL胰酶溶液(40 U/mg胰蛋白酶和0.5 U/mg胰凝乳蛋白酶)。使用1 mol/L NaOH溶液调节混合物的pH至7.8,样品在37 ℃下继续消化1 h。
消化完成后,将样品浸入沸水中浸泡5 min以结束消化。然后,将混合物在室温下以5 000×g离心15 min,收集上清液以测定水解度。水解度通过邻苯二甲醛法测定,并以丝氨酸为标准。麸质的消化率通过比较消化过程中释放的自由氨基酸数与蛋白质中总氨基酸数来计算,结果以水解度(%)表示。水解度按公式(1)计算:
水解度![]()
(1)
1.11 统计学分析
本研究所得数据使用SPSS进行处理,并使用Origin 8.0绘制图表。所有数据以“平均值±标准差”的形式呈现。统计分析采用单因素方差分析(analysis of variance,ANOVA)。P<0.05被认为具有统计学显著性。每项测量均进行了3次重复。
2 结果与分析
2.1 可溶性蛋白含量分析
溶解度在反映蛋白质的结构和功能特性方面起着至关重要的作用,这对其在食品工业及其他领域的应用具有重要意义[19]。如图1所示,随着超声波功率的增加,小麦麸质的可溶性蛋白含量逐渐下降。在对照组中,可溶性蛋白质量浓度为404 μg/mL。相比之下,经过200、300 W超声波处理的组别可溶性蛋白含量显著降低,分别为376、348 μg/mL,降幅分别为7%和14%。在更高功率的超声波处理下,可溶性蛋白的减少幅度较小。600 W处理组的可溶性蛋白质量浓度最低,为323 μg/mL,相较于对照组减少了21%。这些结果与之前的研究一致,高强度超声波(20 kHz,400 W,50%占空比)在猕猴桃的处理中也降低了可溶性蛋白含量[20]。这可能是由于超声波处理过程中强烈的空化效应,破坏了小麦麸质分子之间的氢键或肽键,从而导致溶解度的下降。此外,过程中生成的反应性羟自由基可将巯基氧化为二硫键,从而改变蛋白质的二级和三级结构。超声波还可能增强蛋白质之间的相互作用,形成更多的不可溶复合物,从而进一步降低蛋白质的溶解度[21]。
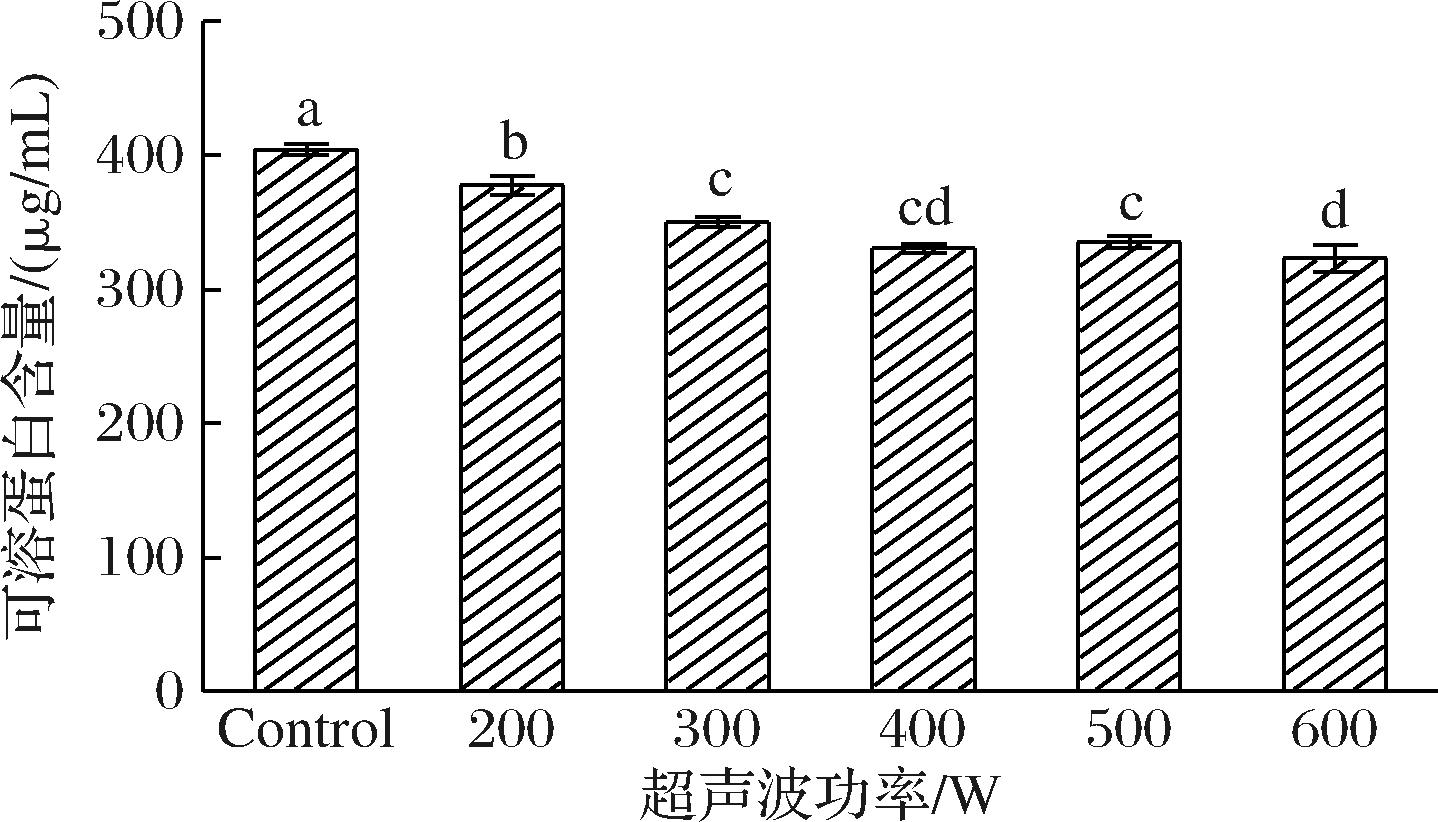
图1 不同功率下样品的可溶蛋白含量图
Fig.1 Soluble protein content of the samples under different power levels
注:不同字母表示存在显著性差异(P<0.05)(下同)。
2.2 化学相互作用分析
为了研究小麦麸质三级结构的变化,评估其化学相互作用是至关重要的。在本实验中,重点测量了游离巯基含量,以及离子键、氢键和疏水相互作用的贡献。这些相互作用共同作用,维持蛋白质的空间构象,确保其在各种生物环境中的功能完整性和稳定性。
如图2-a所示,对照组与200、300 W超声波处理组之间游离巯基含量没有显著差异。然而,当超声波功率增至400 W时,样品的游离巯基含量比对照组增加了约11%,并达到了所有组别中的最高值。随着超声波功率的进一步增加,巯基含量略有下降,但仍显著高于对照组。这与JIANG等[22]的研究结果一致,超声波的空化效应导致蛋白质的变性、解聚和展开,暴露出更多原本隐藏于蛋白质结构中的巯基。然而,在较高功率的超声波处理下(500、600 W),巯基含量出现了轻微的下降,这可能是由于过量的羟自由基生成,进一步氧化了巯基。
非共价相互作用是维持蛋白质三级结构的主要作用力。超声波处理显著降低了离子键的强度,且随着功率的增加,这一效应更加明显(图2-b)。然而,对照组的离子键含量仅为0.048 mg/mL,表明离子键在维持麸质蛋白三级结构中的作用较小。如图2-c所示,超声波处理对氢键含量没有显著影响。并且与离子键类似的是,对照组的氢键含量为0.29 mg/mL,这表明氢键也不是维持麸质蛋白三级结构的主要作用力。
如图2-d所示,疏水相互作用则表现出更多变化,随着超声波功率从控制组增加到300 W,疏水相互作用从1.03 mg/mL降至0.7 mg/mL。然而,当功率进一步增加至400 W和600 W时,表面疏水相互作用开始再次上升,从0.86 mg/mL增加到1.19 mg/mL。这一趋势可能是由于在较低功率下(200~300 W),超声波处理引起的蛋白质展开和聚集,减少或遮蔽了蛋白分子上的一些疏水结合位点。而在较高功率下(400~600 W),蛋白分子的进一步聚集可能产生了更多的分子间疏水结合位点,导致疏水相互作用增加。
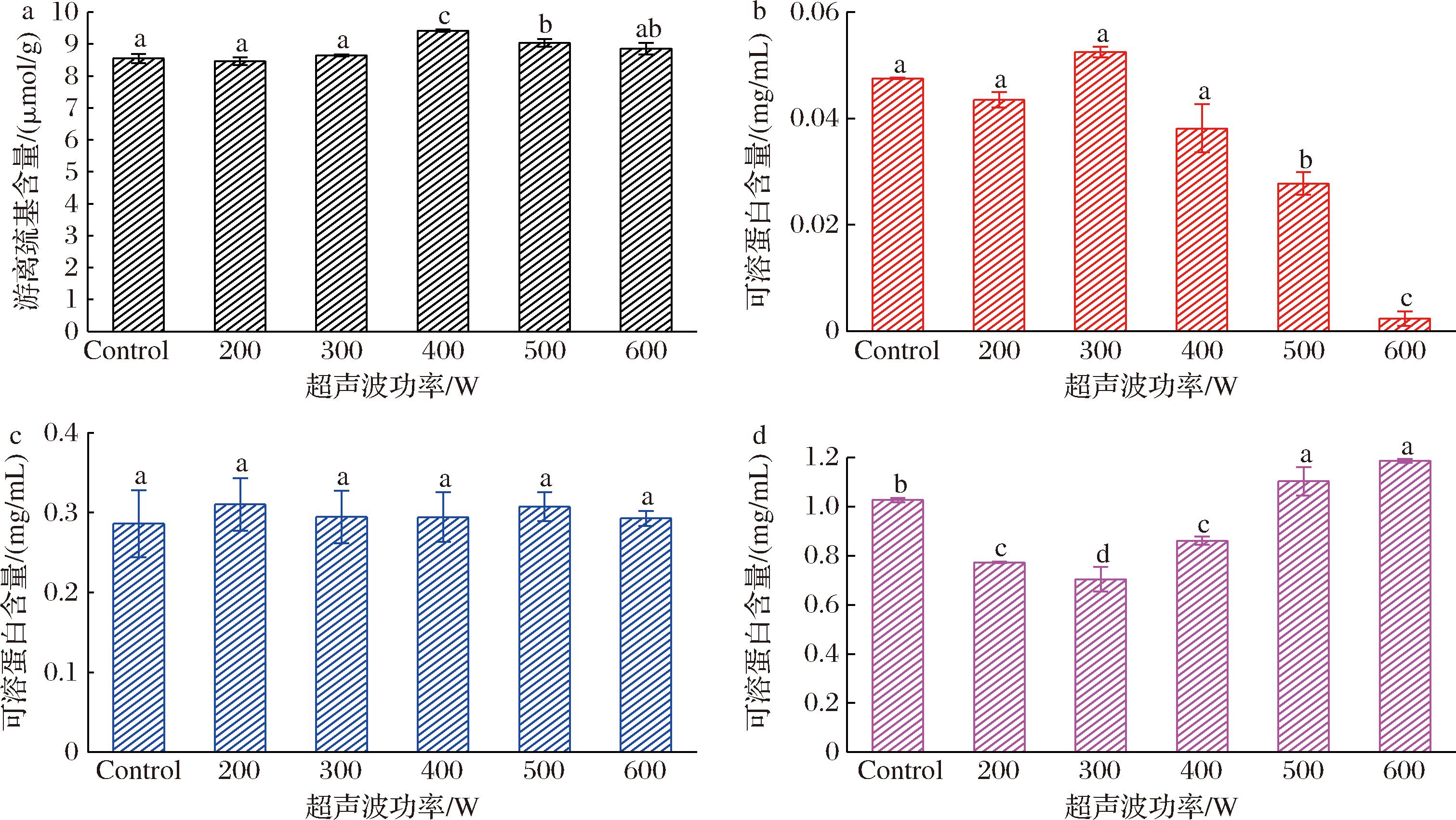
a-游离巯基含量;b-离子键;c-氢键;d-疏水相互作用
图2 不同功率下样品的化学相互作用变化图
Fig.2 Changes in the chemical interactions of the samples under different power levels
2.3 表面疏水性分析
表面疏水性在蛋白质的功能特性和结构特性中起着至关重要的作用,影响其溶解度、聚集行为以及与其他分子(如脂质或疏水性药物)的相互作用。蛋白质的表面疏水性有助于理解其稳定性、折叠状态以及与其他生物分子的相互作用[23]。
如图3-a所示,超声波处理显著影响了麸质蛋白质的表面疏水性。与对照组(4 057)相比,200 W超声波处理组表现出最为显著的变化(4 893),增长幅度接近21%。随着超声波功率的增加,样品的表面疏水性逐渐增加,在600 W时达到了峰值(5 384),增幅约为33%。这与RESENDIZ-VAZQUEZ等[24]的研究结果一致,表明超声波的空化效应产生了湍流、剪切力和微流化作用,导致麸质蛋白的展开,暴露出原本埋藏在蛋白质结构中的疏水基团,从而增加了蛋白质的疏水性。

a-表面疏水性;b-荧光光谱图;c-FTIR图;d-二级结构比例图
图3 不同功率下样品的二级与三级结构变化图
Fig.3 Changes in secondary and tertiary structures of the samples at different power levels
2.4 荧光光谱分析
由于荧光光谱主要依赖于蛋白质中色氨酸、酪氨酸和苯丙氨酸残基等显色团的存在,它可以有效反映这些基团的暴露,从而指示蛋白质三级结构的变化[25]。
如图3所示,随着超声波功率的增加,样品的荧光强度显著增加。这表明超声波的展开效应暴露了之前埋藏在蛋白质中的疏水基团,从而增强了荧光强度。
根据VERA等[26]的研究,最大发射波长(λmax)>330 nm表示色氨酸处于极性环境中,而λmax<330 nm则表示处于非极性环境中。在本研究中,对照组的最大荧光强度出现在340 nm,而所有超声波处理样品均表现出λmax的偏移。λmax的变化反映了蛋白质空间构象的变化。ZHANG等[27]的研究指出,超声波处理改变了色氨酸或酪氨酸周围其他氨基酸的空间排列和相互作用,从而导致蛋白质构象的变化。
综上所述,这种构象变化对蛋白质的致敏性以及在食品领域的应用可能具有深远影响。一方面,蛋白质空间构象的改变可能会极大地影响其在人体内被免疫细胞识别和相互作用的方式,从而在一定程度上降低其潜在的致敏性;另一方面,更大程度的疏水基团暴露也会影响蛋白质在乳化、起泡或凝胶化等功能方面的表现。
2.5 FTIR分析
酰胺I带(1 700~1 600 cm-1)在FTIR中(图3-c)可以检测到蛋白质在外部因素作用下的二级结构变化[28]。酰胺I带主要源自C![]() O(羰基)伸缩振动,具有很高的灵敏度并有着强烈的信号,因此特别适用于分析超声波处理后样品的二级结构变化。在该区域中,一些特定的吸收峰被广泛用于分析二级结构变化:1 664~1 646 cm-1范围对应于α-螺旋,1 637~1 600 cm-1和1 700~1 682 cm-1与β-折叠相关,1 681~1 664 cm-1表示β-转角,1 645~1 637 cm-1表示无规卷曲。这些谱峰的对应关系对于分析蛋白质的二级结构至关重要,其中每个范围分别反映了蛋白质构象中的不同结构。通过去卷积和曲线拟合,可以计算样品中每种二级结构的相对比例。如图3-d所示,高强度超声波对蛋白质的二级结构产生了显著的影响。在低功率(200 W)下,β-折叠的含量增加,而α-螺旋和无规卷曲结构减少,表明蛋白质发生了向更有序构象的转变。在300、400 W时,α-螺旋的含量部分恢复,但在更高的超声波功率(500、600 W)下,β-折叠结构再次占主导地位,同时α-螺旋和无规卷曲的含量减少。
O(羰基)伸缩振动,具有很高的灵敏度并有着强烈的信号,因此特别适用于分析超声波处理后样品的二级结构变化。在该区域中,一些特定的吸收峰被广泛用于分析二级结构变化:1 664~1 646 cm-1范围对应于α-螺旋,1 637~1 600 cm-1和1 700~1 682 cm-1与β-折叠相关,1 681~1 664 cm-1表示β-转角,1 645~1 637 cm-1表示无规卷曲。这些谱峰的对应关系对于分析蛋白质的二级结构至关重要,其中每个范围分别反映了蛋白质构象中的不同结构。通过去卷积和曲线拟合,可以计算样品中每种二级结构的相对比例。如图3-d所示,高强度超声波对蛋白质的二级结构产生了显著的影响。在低功率(200 W)下,β-折叠的含量增加,而α-螺旋和无规卷曲结构减少,表明蛋白质发生了向更有序构象的转变。在300、400 W时,α-螺旋的含量部分恢复,但在更高的超声波功率(500、600 W)下,β-折叠结构再次占主导地位,同时α-螺旋和无规卷曲的含量减少。
除了酰胺I带,OH伸缩区域(4 000~3 000 cm-1)也可以用于分析的结构变化,特别是与氢键相关的变化。如图3-c所示,样品在大约3 300 cm-1处表现出一个宽广且强烈的吸收峰,表明麸质蛋白分子聚合物中存在大量的分子间或分子内氢键。随着超声波功率从控制组增加到400 W,吸收峰向较低波数(从3 303 cm-1到3 276 cm-1)发生了偏移。在500 W时,吸收峰移回移至较高波数(3 305 cm-1),但在600 W时,吸收峰再次向较低波数偏移。这些变化表明,在较低功率(200~400 W)下,超声波破坏了原始结构并重新排列了蛋白分子,暴露出更多的极性区域并形成了更强的氢键,导致分子聚集。而在500 W时,强烈的超声波在蛋白质展开过程中破坏了氢键,反映在峰值向较高波数的偏移。然而,在600 W时,尽管氢键被破坏,但过强的超声波强度促进了蛋白分子进一步聚集,导致交联增强并形成更强的氢键。
综上所述,超声波处理对麸质蛋白质的二级结构和氢键产生了显著的影响,促进了分子重新排列、氢键增强和分子聚集,这些变化通过β-折叠含量的增加和α-螺旋结构的减少得到了体现。这种对蛋白结构的重排和聚集在一定程度上也可能减弱麸质的致敏性。当关键表位因聚集或结构重排而被遮蔽时,致敏肽段与免疫系统的相互作用概率相对降低,从而有助于减少潜在的过敏风险。
2.6 消化率分析
如图4所示,小麦麸质的消化率在不同超声波功率下表现出显著差异。与对照组(16.2%)相比,200 W超声波处理后水解度降至13.7%,减少约15%。在300 W下,水解度回升至15.7%,与对照组无显著差异。然而,当超声波功率增加至500 W时,水解度降至所有处理组中的最低值,仅为12.4%,减少约23%。在600 W时,水解度略微回升至13.8%,但仍显著低于对照组的水平。
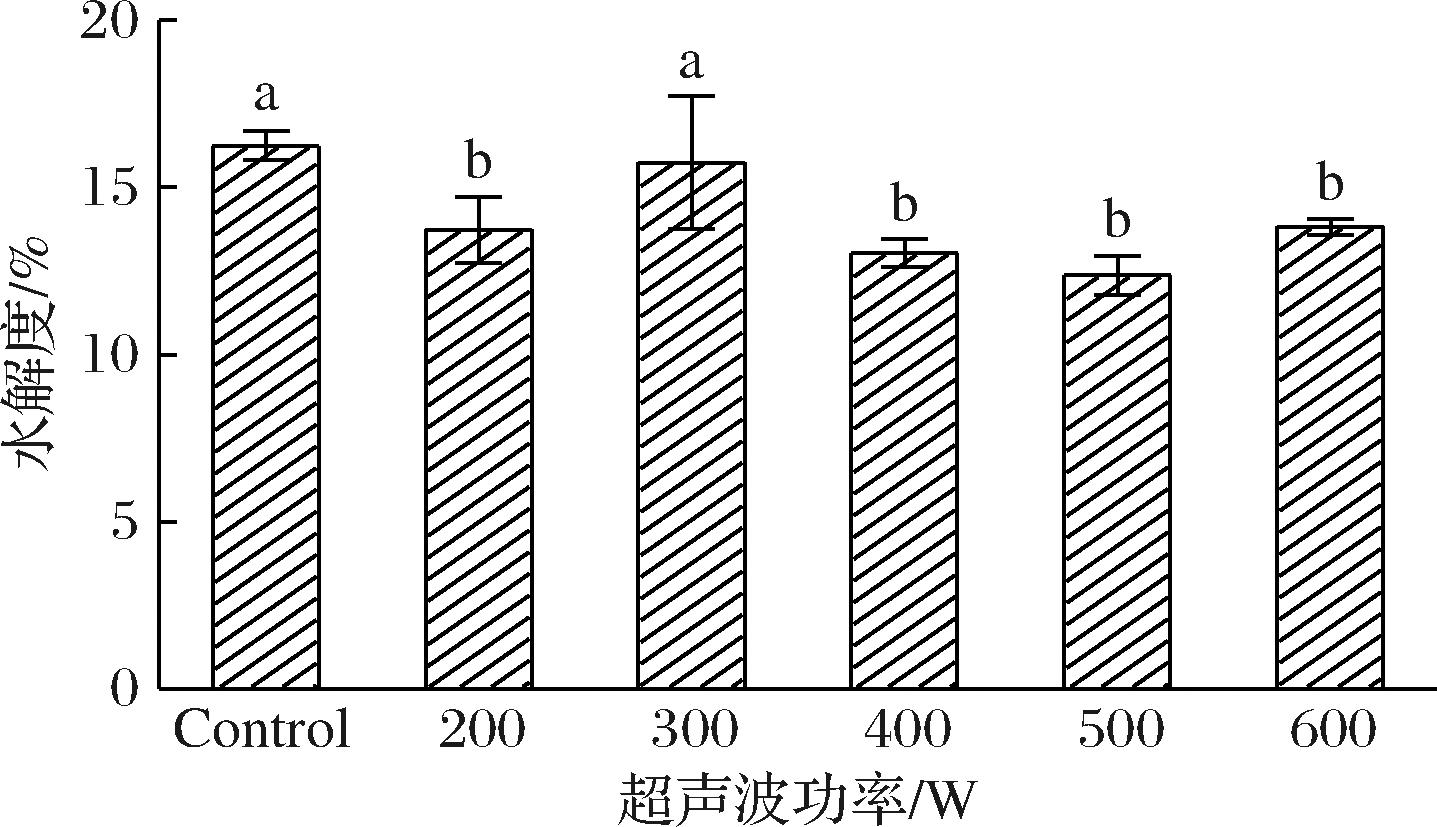
图4 不同功率下样品的消化率变化图
Fig.4 Changes in digestibility of the samples at different power levels
消化率下降可能与超声波处理引起的2个现象有关:一是更多疏水性基团的暴露,二是蛋白质聚集的促进[29]。这些变化可能会阻碍蛋白质与酶的相互作用,从而降低水解效率。这与之前的研究结果一致[30],研究者观察到在超声波处理蚕豆后,蛋白质的消化率降低,并且发现其与β-折叠结构的增加相关。这可能是由于这些结构具有较强的疏水性。这也表明超声波的强度和处理条件对蛋白质消化率的变化有着至关重要的作用,尤其在高强度条件下,蛋白质的结构变化往往更为显著,进而影响其消化特性。
值得注意的是,部分前人研究更关注通过酶法水解或超声波与酶协同处理来提高蛋白质的水解度,从而减少潜在致敏肽段的生成,实现“脱敏”目的。而本研究观察到小麦麸质在高强度超声波处理下消化率下降,一方面与更多疏水区域暴露和蛋白质聚集所导致的酶作用位点遮蔽相关;另一方面,这种聚集和结构重排过程理论上有可能屏蔽部分过敏原表位,降低机体对蛋白质的免疫识别几率,从而在一定程度上实现减弱致敏性的效果。综上所述,高强度超声波处理在降低小麦麸质消化率的同时,可能带来一定程度的“脱敏”潜力,为食品加工及功能性产品研发提供新的思路和方向,同时也为未来在食品工业中应用该技术时优化处理条件提供了重要参考和指导。
3 结论
本研究表明,高强度超声波显著改变了小麦麸质的结构特性、功能特性和消化率。超声波处理降低了可溶性蛋白质含量,尤其是在较高功率水平下,这是由于蛋白质聚集和结构变化,如氢键和肽键的破坏。随着超声的去折叠效应,暴露了埋藏于蛋白分子内的疏水基团,麸质蛋白表面疏水性增加,在600 W时表面疏水性达到最高。荧光光谱分析表明,超声波引起的蛋白质展开暴露了先前被埋藏的疏水区域,改变了蛋白质的三级结构。FTIR分析显示,随着超声波功率的增加,蛋白质的二级结构发生了显著变化,表现为α-螺旋的减少以及β-折叠的增加,这说明超声波处理使得麸质蛋白与蛋白之间的相互作用变强,从而增强了蛋白质聚集。由于蛋白质聚集增加和酶-蛋白质相互作用减少,消化率在较高超声波功率下显著下降。总体而言,高强度超声波有效地改变了面筋的结构和功能特性,为改善面筋在食品加工中的表现并潜在降低其过敏性提供了一种可能的方法。这些发现为利用超声波优化面筋在食品应用和过敏性研究中的特性提供了新的见解。
[1] BIESIEKIERSKI J R.What is gluten?[J].Journal of Gastroenterology and Hepatology, 2017, 32(Suppl 1):78-81.
[2] VERAVERBEKE W S, DELCOUR J A.Wheat protein composition and properties of wheat glutenin in relation to breadmaking functionality[J].Critical Reviews in Food Science and Nutrition, 2002, 42(3):179-208.
[3] ASGAR M A, FAZILAH A, HUDA N, et al.Nonmeat protein alternatives as meat extenders and meat analogs[J].Comprehensive Reviews in Food Science and Food Safety, 2010, 9(5):513-529.
[4] CATASSI C, VERDU E F, BAI J C, et al.Coeliac disease[J].The Lancet, 2022, 399(10344):2413-2426.
[5] IVERSEN R, SOLLID L M.The immunobiology and pathogenesis of celiac disease[J].Annual Review of Pathology, 2023, 18:47-70.
[6] KIVEL L, CAMINERO A, LEFFLER D A, et al.Current and emerging therapies for coeliac disease[J].Nature Reviews Gastroenterology &Hepatology, 2020, 18(3):181-195.
L, CAMINERO A, LEFFLER D A, et al.Current and emerging therapies for coeliac disease[J].Nature Reviews Gastroenterology &Hepatology, 2020, 18(3):181-195.
[7] RAHMAN M M, LAMSAL B P.Ultrasound-assisted extraction and modification of plant-based proteins:Impact on physicochemical, functional, and nutritional properties[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(2):1457-1480.
[8] SORIA A C, VILLAMIEL M.Effect of ultrasound on the technological properties and bioactivity of food:A review[J].Trends in Food Science &Technology, 2010, 21(7):323-331.
[9] SU G W, ZHENG X, ZOU J, et al.Insight into the advantages of premixing yeast-wheat gluten and combining ultrasound and transglutaminase pretreatments in producing umami enzymatic protein hydrolysates[J].Food Chemistry, 2021, 342:128317.
[10] SONG J L, JIANG L J, QI M M, et al.Study of ultrasonic treatment on the structural characteristics of gluten protein and the quality of steamed bread with potato pulp[J].Ultrasonics Sonochemistry, 2023, 92:106281.
[11] ZHANG H X, CHEN G J, LIU M, et al.Effects of multi-frequency ultrasound on physicochemical properties, structural characteristics of gluten protein and the quality of noodle[J].Ultrasonics Sonochemistry, 2020, 67:105135.
[12] ZHANG H H, CLAVER I P, ZHU K X, et al.The effect of ultrasound on the functional properties of wheat gluten[J].Molecules, 2011, 16(5):4231-4240.
[13] LI C F, CHEN G J, RAN C X, et al.Adlay starch-gluten composite gel:Effects of adlay starch on rheological and structural properties of gluten gel to molecular and physico-chemical characteristics[J].Food Chemistry, 2019, 289:121-129.
[14] G MEZ-GUILLÉN M C, BORDER
MEZ-GUILLÉN M C, BORDER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (Sardina pilchardus) muscle gels[J].LWT - Food Science and Technology, 1997, 30(6):602-608.
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (Sardina pilchardus) muscle gels[J].LWT - Food Science and Technology, 1997, 30(6):602-608.
[15] HASKARD C A, LI-CHAN E C Y.Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS-) fluorescent probes[J].Journal of Agricultural and Food Chemistry, 1998, 46(7):2671-2677.
[16] WU D, WU C, MA W C, et al.Effects of ultrasound treatment on the physicochemical and emulsifying properties of proteins from scallops (Chlamys farreri)[J].Food Hydrocolloids, 2019, 89:707-714.
[17] LIU Z Q, ZHENG Z, ZHU G B, et al.Modification of the structural and functional properties of wheat gluten protein using a planetary ball mill[J].Food Chemistry, 2021, 363:130251.
[18] KUANG J W, XU K, DANG B, et al.Interaction with wheat starch affect the aggregation behavior and digestibility of gluten proteins[J].International Journal of Biological Macromolecules, 2023, 253:127066.
[19] GAO K, RAO J J, CHEN B C.Plant protein solubility:A challenge or insurmountable obstacle[J].Advances in Colloid and Interface Science, 2024, 324:103074.
[20] WANG J, WANG J, KRANTHI VANGA S, et al.Influence of high-intensity ultrasound on the IgE binding capacity of Act d 2 allergen, secondary structure, and in-vitro digestibility of kiwifruit proteins[J].Ultrasonics Sonochemistry, 2021, 71:105409.
[21] ZHANG Z Y, ZHANG X F, CHEN W, et al.Conformation stability, in vitro digestibility and allergenicity of tropomyosin from shrimp (Exopalaemon modestus) as affected by high intensity ultrasound[J].Food Chemistry, 2018, 245:997-1009.
[22] JIANG L Z, WANG J, LI Y, et al.Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62:595-601.
[23] WANG X S, TANG C H, LI B S, et al.Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids, 2008, 22(4):560-567.
[24] RESENDIZ-VAZQUEZ J A, ULLOA J A, UR AS-SILVAS J E, et al.Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J].Ultrasonics Sonochemistry, 2017, 37:436-444.
AS-SILVAS J E, et al.Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J].Ultrasonics Sonochemistry, 2017, 37:436-444.
[25] JIA J Q, MA H L, ZHAO W R, et al.The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry, 2010, 119(1):336-342.
[26] VERA A, VALENZUELA M A, YAZDANI-PEDRAM M, et al.Conformational and physicochemical properties of quinoa proteins affected by different conditions of high-intensity ultrasound treatments[J].Ultrasonics Sonochemistry, 2019, 51:186-196.
[27] ZHANG Y Y, WANG B R, WANG W T, et al.Study on the mechanism of ultrasonic treatment impact on the dough’s fermentation capability[J].Journal of Cereal Science, 2021, 100:103191.
[28] ZHOU R X, SUN J, QIAN H F, et al.Effect of the frying process on the properties of gluten protein of you-Tiao[J].Food Chemistry, 2020, 310:125973.
[29] JACKSON M, MANTSCH H H.The use and misuse of FTIR spectroscopy in the determination of protein structure[J].Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2):95-120.
[30] MART NEZ-VELASCO A, LOBATO-CALLEROS C, HERN
NEZ-VELASCO A, LOBATO-CALLEROS C, HERN NDEZ-RODR
NDEZ-RODR GUEZ B E, et al.High intensity ultrasound treatment of faba bean (Vicia faba L.) protein:Effect on surface properties, foaming ability and structural changes[J].Ultrasonics Sonochemistry, 2018, 44:97-105.
GUEZ B E, et al.High intensity ultrasound treatment of faba bean (Vicia faba L.) protein:Effect on surface properties, foaming ability and structural changes[J].Ultrasonics Sonochemistry, 2018, 44:97-105.