大米米糠是稻米加工的主要副产品,主要成分是碾米去掉的果皮、种皮、糊粉层和胚芽等[1]。米糠每年产量约为6 800万t[2],主要产于亚洲国家[3]。米糠不仅富含膳食纤维、蛋白质和脂肪等营养物质,还含有人体必需的不饱和脂肪酸和多种生物活性化合物,包括植物甾醇、生育酚和谷维素等[2, 4-7]。米糠也是可溶性和不溶性膳食纤维的良好来源,其含量为20%~51%[8]。这些物质具有抗炎、抗氧化、抗肿瘤、抗癌、增强免疫力、保护神经、调节脂质代谢和糖代谢等作用[9-14],其大分子营养物质还可作为化妆品中的皮肤调理剂、产品增黏剂[15]。但是目前国内外对米糠营养成分的研究主要集中在米糠蛋白、米糠油和生物活性化合物上,对米糠膳食纤维,尤其可溶性膳食纤维提取优化及其物化性质的研究较少。米糠一般用作动物饲料或者被当作废弃物丢掉,利用率极低,本试验探究了米糠可溶性膳食纤维的制备工艺、结构表征和物化特性等,目的是提高米糠的利用率,为米糠营养物质的开发提供理论依据和数据支持,同时提升其社会经济效益。
膳食纤维(dietary fiber,DF)根据溶解度分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)[16]。与IDF相比,摄入SDF可降低多种慢性病的患病风险,因此为提高产品价值,将IDF转变为SDF显得尤为重要[17]。方法包括物理方法、生物方法和化学方法,化学试剂可能会破坏分子结构,生物方法时间较长,相比之下物理方法简便又高效,超声即是物理方法的一种[18]。超声处理安全性高,改善其理化性质的同时保留营养成分,通过空化、剪切和湍流作用破坏细胞壁,释放化合物,有效提高SDF的含量[16, 19]。GU等[20]研究了超声辅助碱性提取的柑橘皮SDF,通过比较其处理前后的分子组成、分子质量、理化性质、抗氧化性质以及肠道调节能力,发现处理后的柑橘皮SDF总糖含量较高,分子质量>15 kDa,热稳定性更强,相同浓度下自由基清除能力更强,且调节了肠道微生物菌群的组成,增加了拟杆菌属的丰度,促进了短链脂肪酸丙酸的产生。李丹等[21]通过响应面试验,利用高温蒸煮结合超声波酶法提取菠萝蜜籽SDF,对处理前后SDF进行结构表征和物化特性,结果表明与处理前SDF相比,在最佳提取条件下,SDF提取率提高了7.46%,结构更加疏松多孔,结晶度增加,呈现出更好的热稳定性;其持水力、持油力、膨胀力、葡萄糖吸附力、胆固醇吸附力、胆酸盐吸附力、亚硝酸根离子吸附力均显著(P<0.05)优于处理前SDF。上述研究表明,超声处理能够有效增加SDF提取率,并改善其物化特性。
因此,本文通过超声处理优化米糠SDF提取工艺,分析SDF结构表征、理化性质和功能特性,为提升米糠的剩余价值提供参考,同时为促进米糠产品的开发、提高其附加值,提供借鉴意义。
1 材料与方法
1.1 材料与试剂
米糠,吉林省农业科学院水稻研究所提供;初萃东北玉米胚芽油,中粮悠采厨房食品(上海)有限公司;葡萄糖,天津市光复科技发展有限公司;胆固醇,生工生物工程(上海)股份有限公司;硫酸,北京化工厂;冰乙酸,天津市富宇精细化工有限公司;新鲜鸡蛋,市售;NaNO2,天津市大茂化学试剂厂;NaOH,北京化工厂;无水Na2CO3,国药集团化学试剂有限公司;盐酸萘乙二胺、对氨基苯磺酸,上海麦克林生化科技股份有限公司;无水乙醇,太仓新太酒精有限公司。
1.2 仪器与设备
KQ5200DV型数控超声波清洗器,昆山市超声仪器有限公司;TL8R立式低速冷冻离心机,湖南赫西仪器装备有限公司;HWS26型电热恒温水浴锅,上海一恒科学仪器有限公司;SCIENTZ-10 N/A冷冻干燥机,宁波新芝生物科技股份有限公司;电子天平,赛多利斯科学仪器(北京)有限公司;SHZ-D(Ⅲ)(不锈钢)循环水真空泵,上海力辰邦西仪器科技有限公司。
1.3 实验方法
1.3.1 超声提取米糠SDF
参考GENG等[22]的方法,称取10.0 g脱脂米糠,超声处理后,3 000 r/min离心10 min,收集上清液,加入4倍体积60 ℃预热好的无水乙醇,沉淀4 h,3 000 r/min离心10 min,弃去上清液,沉淀40 ℃烘干即为SDF样品。SDF提取率计算如公式(1)所示:
SDF提取率![]()
(1)
式中:m,SDF质量,g;M,米糠质量,g。
1.3.1.1 单因素试验
液料比:在超声功率160 W、超声时间30 min条件下,分别添加10∶1、15∶1、20∶1、25∶1、30∶1(mL∶g)液料比蒸馏水,探究液料比对SDF提取率的影响。
超声功率:在液料比20∶1(mL∶g)、超声时间30 min条件下,分别设定超声功率120、140、160、180、200 W,探究超声功率对SDF提取率的影响。
超声时间:在液料比20∶1(mL∶g)、超声功率160 W条件下,分别设定超声时间10、20、30、40、50 min,探究超声时间对SDF提取率的影响。
1.3.1.2 响应面优化试验设计
基于单因素试验结果,选取液料比、超声功率和超声时间,根据Box-Behnken试验原理作三因素三水平响应面分析,优化超声提取米糠可溶性膳食纤维工艺,响应面试验因素水平见表1。
表1 Box-Behnken 设计试验因素水平表
Table 1 Box-Behnken design test factor level table
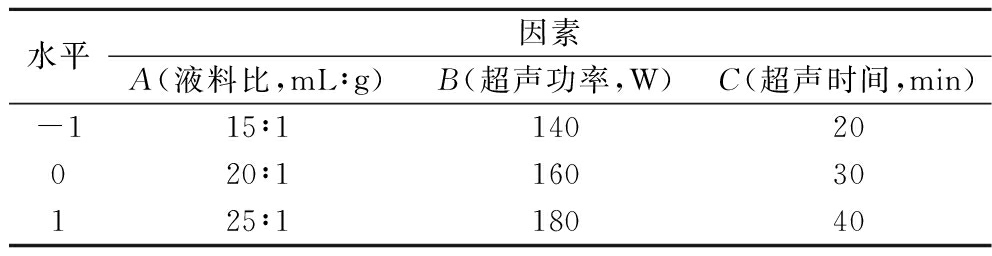
水平因素A(液料比,mL∶g)B(超声功率,W)C(超声时间,min)-115∶114020020∶116030125∶118040
1.3.2 米糠SDF结构测定
1.3.2.1 傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)分析
参考XING等[23]方法,称取2 mg米糠SDF样品与200 mg KBr充分混匀,研磨均匀,压片,在4 000~400 cm-1波数范围内进行扫描。
1.3.2.2 X-射线衍射(X-ray diffraction,XRD)图分析
参考SANG等[24]方法,利用XRD仪进行测定,衍射角范围为5°~90°,扫射速度为10 °/min。
1.3.2.3 扫描电子显微镜(scanning electron microscope,SEM)分析
参考ZHOU等[25]的方法,喷金后,在3 000倍下观察米糠SDF形貌图像。
1.3.3 米糠SDF理化性质测定
1.3.3.1 持水力测定
参考ZHANG等[26]的方法,称取0.2 g米糠SDF样品与20 mL蒸馏水充分混匀,25 ℃静置2 h,5 000 r/min离心10 min,弃去上清液,收集沉淀物称重。持水力计算如公式(2)所示:
持水力![]()
(2)
式中:m,样品干重,g;m1,样品吸水后湿重,g。
1.3.3.2 持油力测定
参考LIU等[27]的方法,称取0.1 g米糠SDF样品与5 g玉米油充分混匀,25 ℃静置2 h,8 000 r/min离心30 min,弃去上清液,收集沉淀物称重。持油力计算如公式(3)所示:
持油力![]()
(3)
式中:m,样品干重,g;m1,样品吸油后湿重,g。
1.3.3.3 膨胀力测定
参考YANG等[28]的方法,称取0.1 g米糠SDF样品与5 mL蒸馏水充分混匀,记录体积,25 ℃静置24 h,记录膨胀后体积。膨胀力计算如公式(4)所示:
膨胀力![]()
(4)
式中:m,样品质量,g;V,干样体积,mL;V1,样品膨胀后体积,mL。
1.3.3.4 溶解力测定
参考XIONG等[29]的方法,称取0.1 g米糠SDF样品与5 mL蒸馏水充分混匀,再于90 ℃水浴1 h,冷却,8 000 r/min离心10 min。上清液倒入蒸发皿中,105 ℃烘干至恒重。溶解力计算如公式(5)所示:
溶解力指数![]()
(5)
式中:m,样品质量,g;m0,蒸发皿质量,g;m1,蒸发皿与样品恒重之和,g。
1.3.4 米糠SDF功能特性测定
1.3.4.1 葡萄糖吸附力测定
参考LI等[30]的方法,称取0.1 g米糠SDF样品与25 mL的50 mmol/L的葡萄糖标准溶液充分混匀,分别将pH值调至2.0与7.0,模拟胃环境与肠道环境。37 ℃下水浴振荡反应2 h,吸附平衡后,4 800 r/min离心10 min,取上清液,采用DNS法测定上清液中的葡萄糖含量,另准备一组不加葡萄糖的样品作为空白对照,540 nm处测定吸光度。葡萄糖吸附能力以每克样品吸收的葡萄糖质量(mg)表示,按公式(6)计算:
葡萄糖吸附力![]()
(6)
式中:m,样品质量,g;m1,吸附前葡萄糖质量,mg;m2,吸附后葡萄糖质量,mg。
1.3.4.2 胆固醇吸附力测定
参考YANG等[31]的方法,取新鲜蛋黄与蒸馏水按1∶9的比例充分混匀。称取0.5 g米糠SDF样品加入25 mL搅打均匀的蛋黄乳液,分别将pH值调至2.0与7.0,模拟胃环境与肠道环境。37 ℃下水浴振荡反应2 h,吸附平衡后,4 800 r/min离心10 min,取上清液,采用邻苯二甲醛法测定上清液中胆固醇含量,550 nm处测定吸光度。胆固醇吸附力以每克样品吸收的胆固醇毫克数表示,计算如公式(7)所示:
胆固醇吸附力![]()
(7)
式中:m,样品质量,g;m1,吸附前胆固醇质量,mg;m2,吸附后胆固醇质量,mg。
1.3.4.3 亚硝酸根离子吸附力测定
参考DU等[32]的方法,称取0.25 g米糠SDF样品与25 mL亚硝酸钠标准液充分混匀,分别将pH值调至2.0与7.0,模拟胃环境与肠道环境。37 ℃下水浴振荡反应2 h,吸附平衡后,4 800 r/min离心10 min,取上清液,538 nm处测定吸光度。亚硝酸根离子吸附力以每克样品吸收的亚硝酸根离子质量表示(mg/g),计算如公式(8)所示:
亚硝酸根离子吸附力![]()
(8)
式中:m,样品质量,g;m1,吸附前亚硝酸根离子质量,mg;m2,吸附后亚硝酸根离子质量,mg。
1.4 数据处理与分析
实验进行3次重复,实验数据采用“平均值±标准差”表示;使用SPSS 26.0软件进行单因素方差分析,P<0.05为差异显著;采用Design Expert 13.0软件和Origin 10.1软件进行数据分析和绘图。
2 结果与分析
2.1 超声提取米糠SDF单因素试验
2.1.1 单因素试验结果
2.1.1.1 液料比对SDF提取率的影响
由图1可知,米糠SDF的提取率随着液料比的增加而升高,比例继续增大超过20∶1(mL∶g,下同)后,提取率开始下降,且SDF提取率在液料比为20∶1时达到最高为5.54%,显著高于其余处理的SDF提取率(P<0.05)。试验初始提取率提高是因为当液体体积增大时,米糠中的SDF与溶剂充分接触进而水解溶出,当液体体积过多时,超声效果被放大,破坏了米糠SDF的结构,提取率下降[33]。
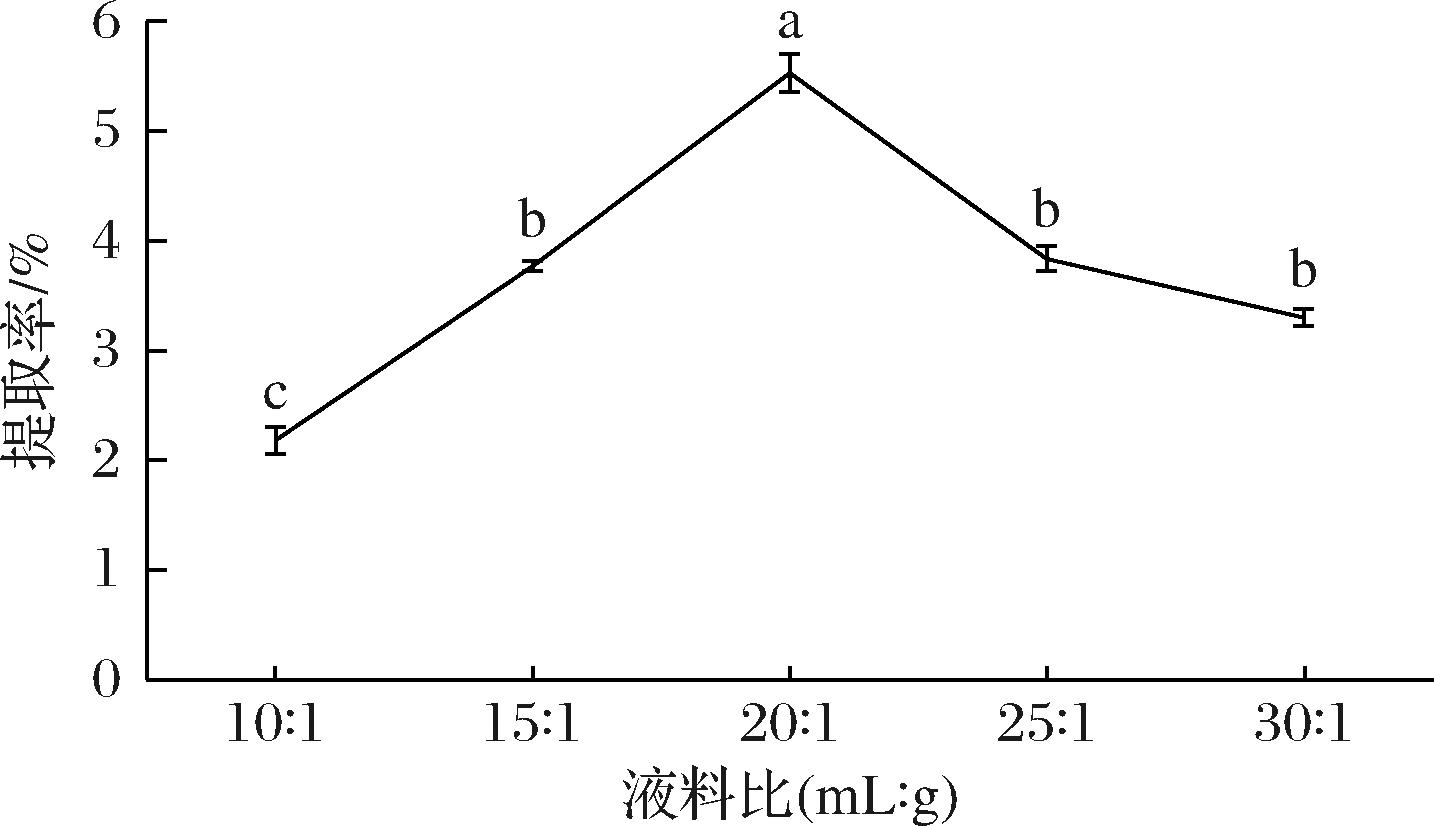
图1 液料比对SDF提取率的影响
Fig.1 Effect of liquid-solid ratio on SDF extraction rate
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.1.2 超声功率对SDF提取率的影响
由图2可知,米糠SDF的提取率随着超声功率的增大而升高,功率超过160 W后,提取率开始下降,且SDF提取率在超声功率160 W时达到最高为4.23%,显著高于其余处理的SDF提取率(P<0.05)。试验初始,提取率提高是因为超声湍流、剪切等作用在一定功率范围内逐渐增强,SDF提取效果扩大,当超声功率超过临界值持续增大时,机械效应过强,破坏了SDF的结构,导致SDF提取率下降[34]。
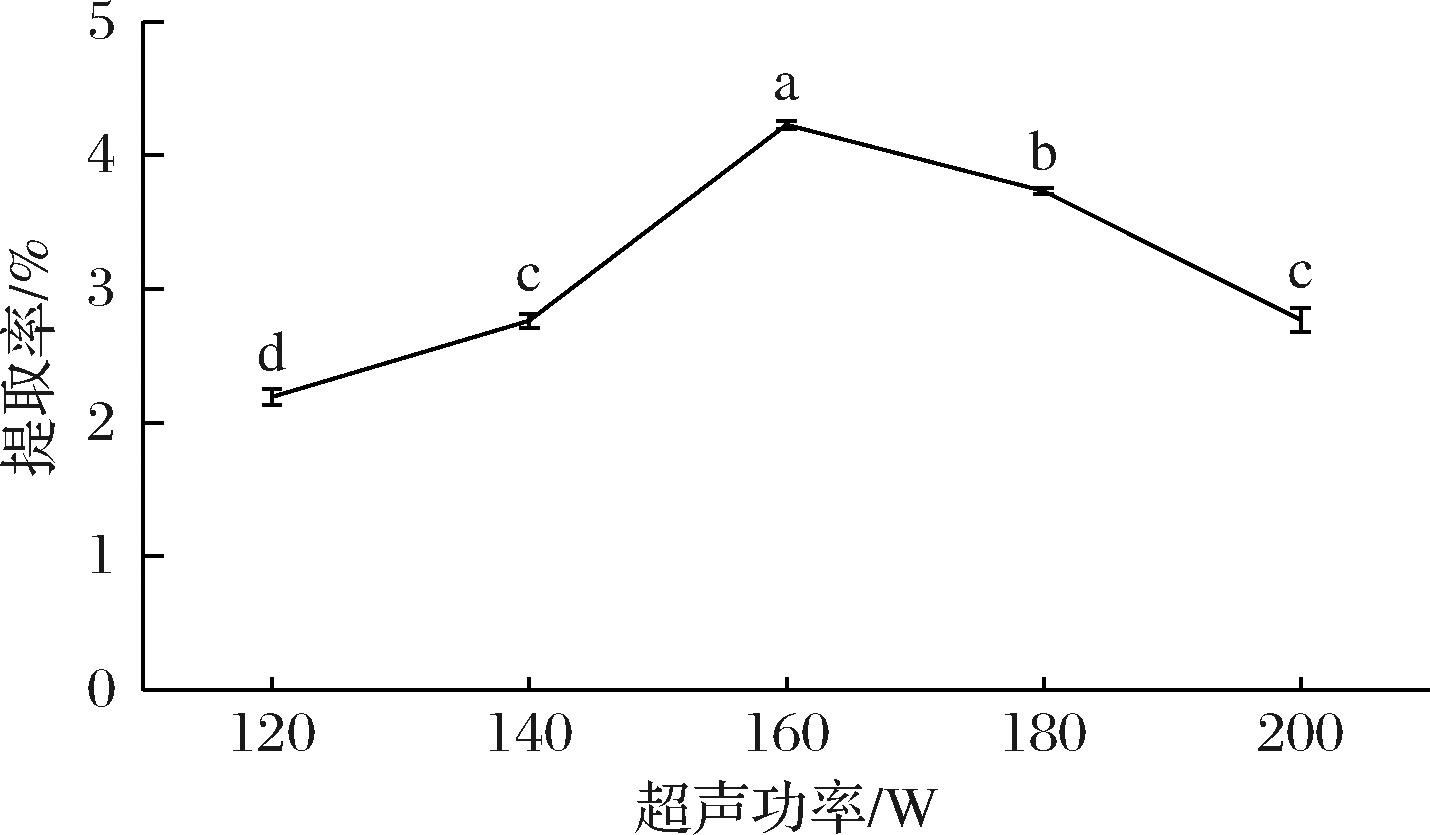
图2 超声功率对SDF提取率的影响
Fig.2 Effect of ultrasonic power on SDF extraction rate
2.1.1.3 超声时间对SDF提取率的影响
由图3可知,米糠SDF提取率随着超声时间的延长而增加,超过30 min后提取率开始下降,且SDF提取率在超声时间30 min时达到最高为5.32%,显著高于其余处理的SDF提取率(P <0.05)。试验初始提取率提高是因为超声的空化、剪切等累积作用加强,时间过长时米糠中其他杂质相继溶出,致使SDF提取率逐步下降[35]。
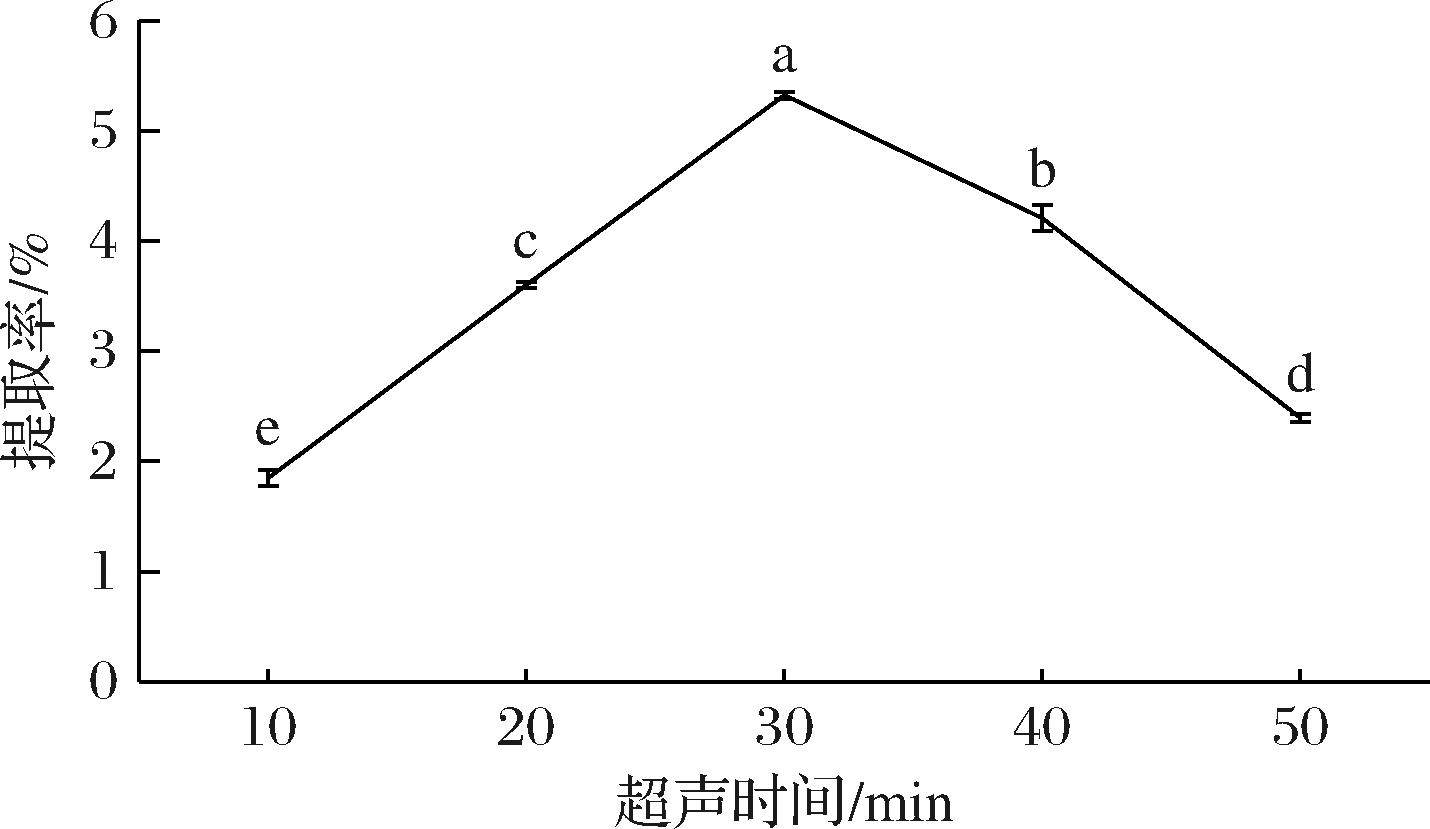
图3 超声时间对SDF提取率的影响
Fig.3 Effect of ultrasound time on SDF extraction rate
2.2 响应面优化超声提取米糠SDF工艺试验
2.2.1 响应面试验结果
对表2中数据进行二次回归分析,得到液料比(A)、超声功率(B)和超声时间(C)三因素对米糠SDF提取率(Y)影响的回归模型为Y=7.090 00+0.085 00A-0.001 20B-0.048 70C-0.210 00AB-0.010 00AC-0.142 50BC-0.726 30A2-0.333 80B2-0.658 70C2。
表2 Box-Behnken 试验结果
Table 2 Results of Box-Behnken test
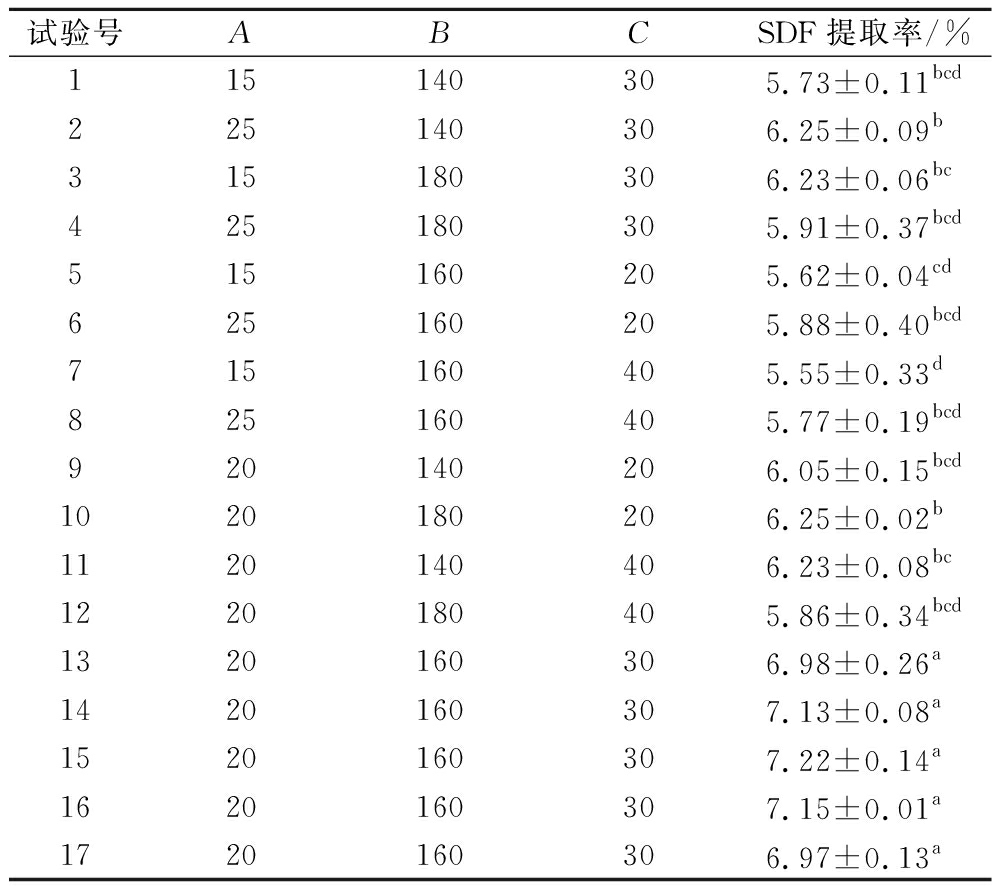
试验号ABCSDF提取率/%115140305.73±0.11bcd225140306.25±0.09b315180306.23±0.06bc425180305.91±0.37bcd515160205.62±0.04cd625160205.88±0.40bcd715160405.55±0.33d825160405.77±0.19bcd920140206.05±0.15bcd1020180206.25±0.02b1120140406.23±0.08bc1220180405.86±0.34bcd1320160306.98±0.26a1420160307.13±0.08a1520160307.22±0.14a1620160307.15±0.01a1720160306.97±0.13a
注:不同小写字母表示差异显著(P<0.05)。
2.2.2 回归模型分析和显著性检验
由表3可知,该回归模型P<0.01,呈现极显著特征,失拟项P=0.625 4>0.05,不显著,因此模型可靠,可用于回归值的预测。确定系数![]() 和C2作用达到极显著水平(P<0.01),A和BC作用达到显著水平(P<0.05),表明此回归模型拟合程度较好,可用于米糠SDF提取率工艺参数的预测和分析。对比F值,三因素对米糠SDF提取率的影响主次顺序为A>C>B,即液料比>超声时间>超声功率。
和C2作用达到极显著水平(P<0.01),A和BC作用达到显著水平(P<0.05),表明此回归模型拟合程度较好,可用于米糠SDF提取率工艺参数的预测和分析。对比F值,三因素对米糠SDF提取率的影响主次顺序为A>C>B,即液料比>超声时间>超声功率。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
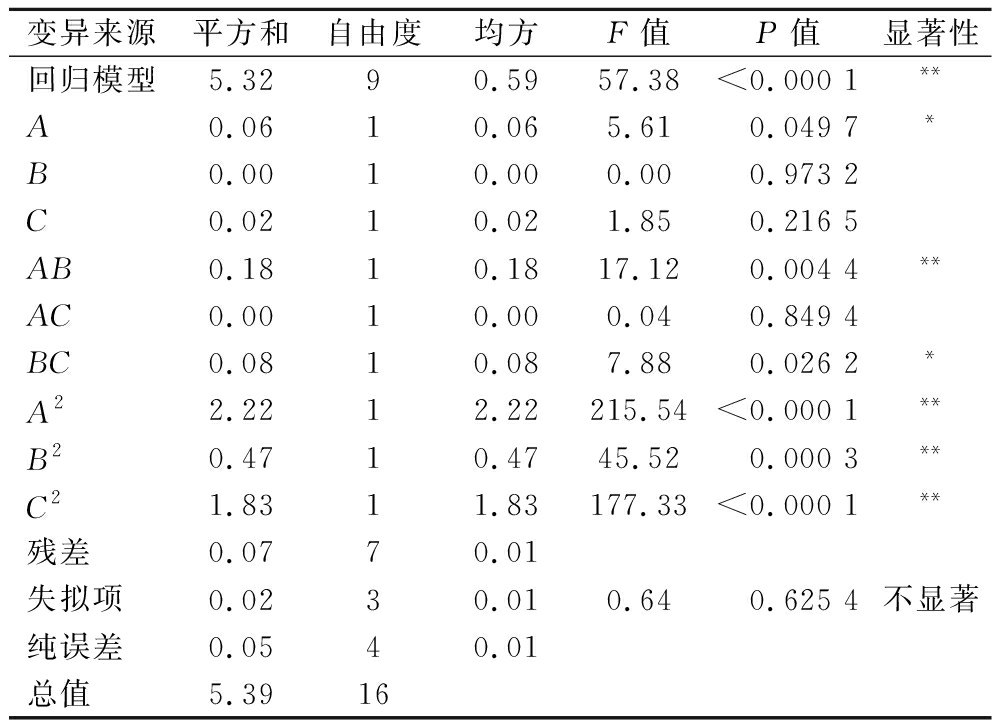
变异来源平方和自由度均方F值P值显著性回归模型5.3290.5957.38<0.000 1**A0.0610.065.610.049 7*B0.0010.000.000.973 2C0.0210.021.850.216 5AB0.1810.1817.120.004 4**AC0.0010.000.040.849 4BC0.0810.087.880.026 2*A22.2212.22215.54<0.000 1**B20.4710.4745.520.000 3**C21.8311.83177.33<0.000 1**残差0.0770.01失拟项0.0230.010.640.625 4不显著纯误差0.0540.01总值5.3916
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2.2.3 响应面分析各因素两两交互作用对SDF提取率的影响
根据回归方程,绘出响应面和等高线图,通过响应面图的坡度和等高线的陡峭程度,分析米糠SDF提取过程中液料比、超声功率和超声时间3个变量对响应值的影响情况。由图4可知,在液料比与超声功率交互图中,SDF提取率随着液料比的增加呈现先上升后下降的趋势,当液料比较小时,随着超声功率的加强,SDF提取率先大幅上升后下降;当液料比较大时,随着超声功率的加强,SDF提取率先缓慢上升后下降。这表明液料比与超声功率两因素之间存在明显的交互作用。如图5所示,在液料比和超声时间交互作用图中,SDF随着液料比和超声时间的增加呈现先上升后下降的趋势,存在明显的交互作用。如图6所示,在超声功率和超声时间交互作用图中,SDF随着超声功率和超声时间的增加呈现先上升后下降的趋势,存在交互作用。
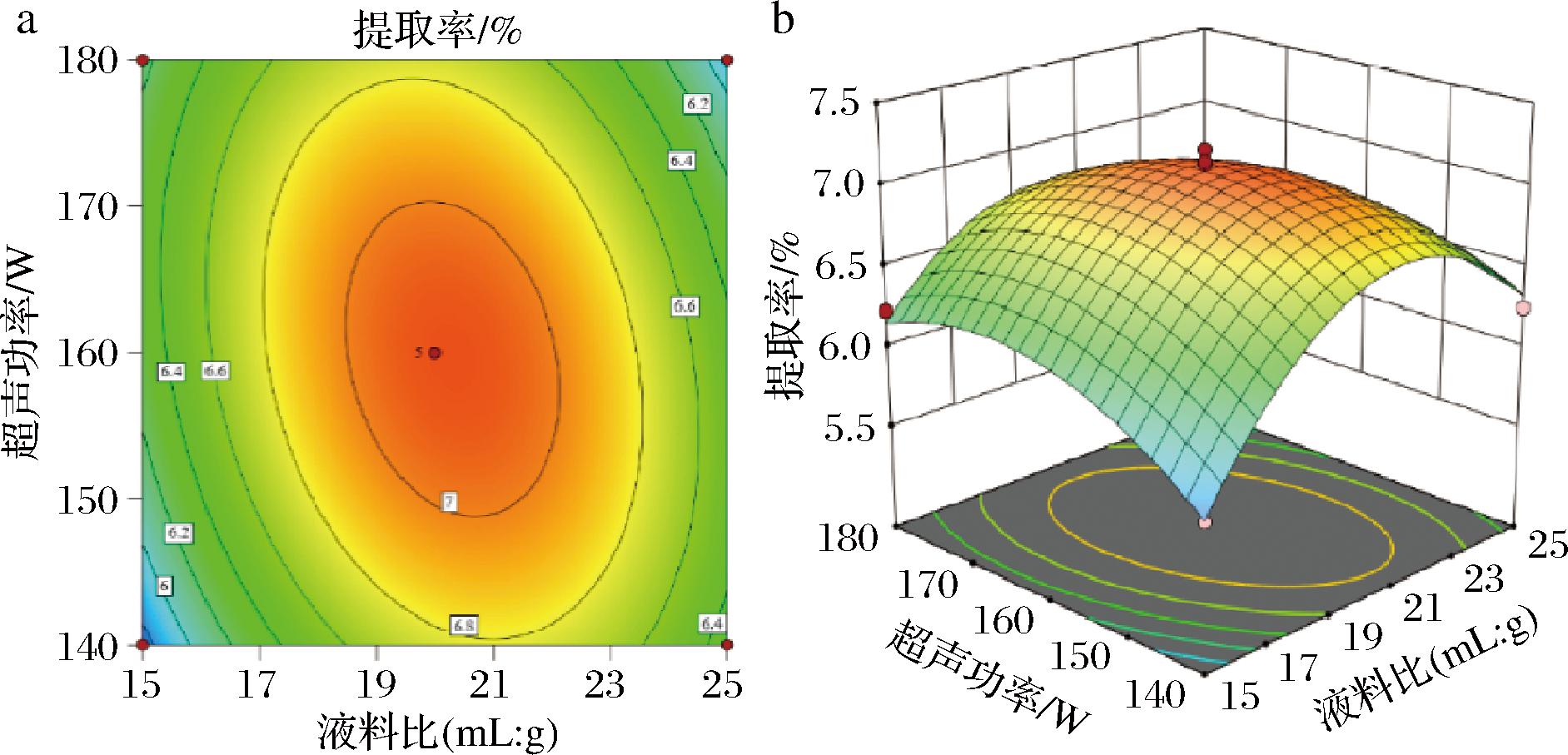
a-等高线图;b-响应面图
图4 米糠SDF提取率受液料比和超声功率交互作用影响的等高线图和响应面图
Fig.4 Contour and response surface plots of rice bran SDF extraction rate as affected by the interaction of liquid-solid ratio and ultrasonic power
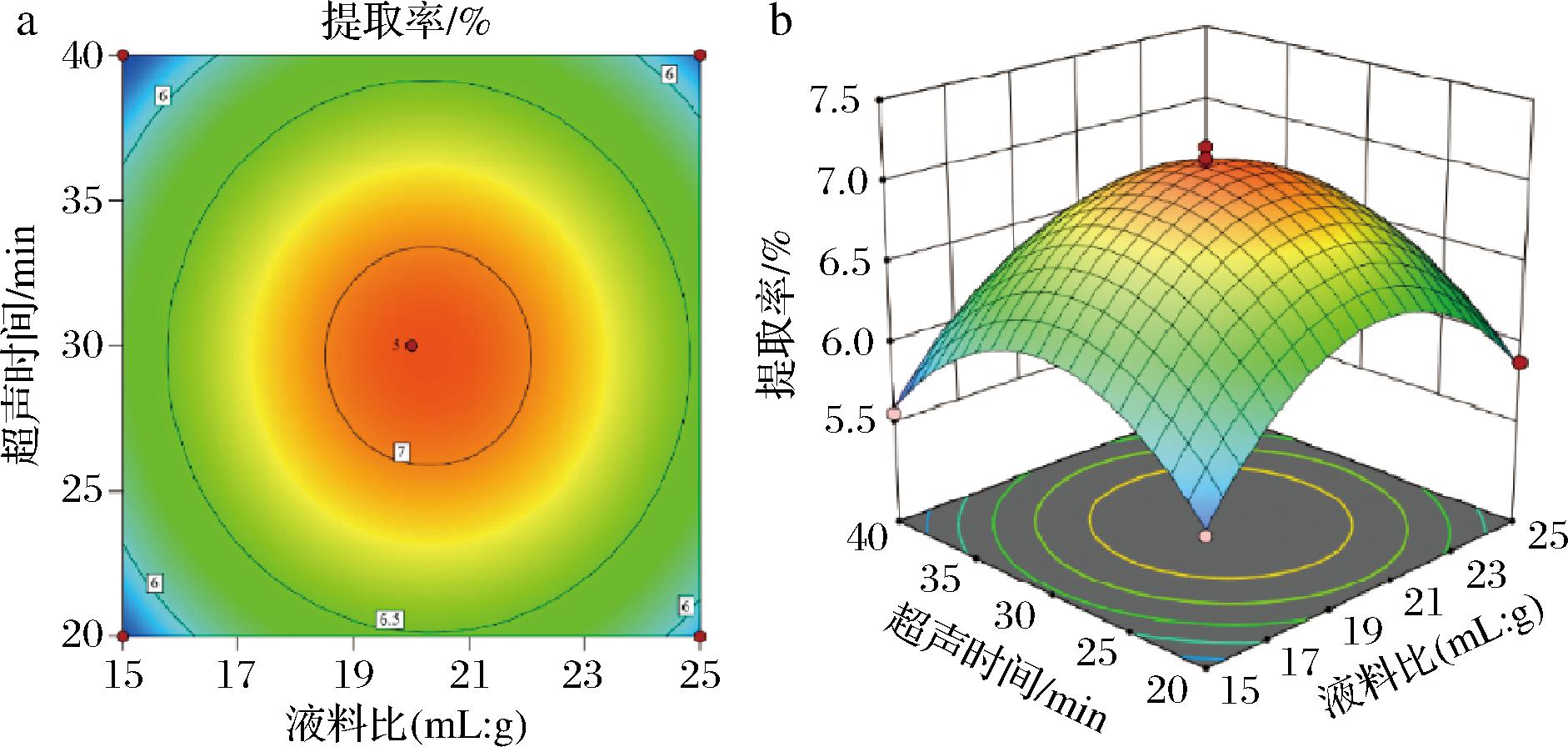
a-等高线图;b-响应面图
图5 米糠SDF提取率受液料比和超声时间交互作用影响的等高线图和响应面图
Fig.5 Contour and response surface plots of rice bran SDF extraction rate as affected by the interaction of liquid-solid ratio and ultrasonic time
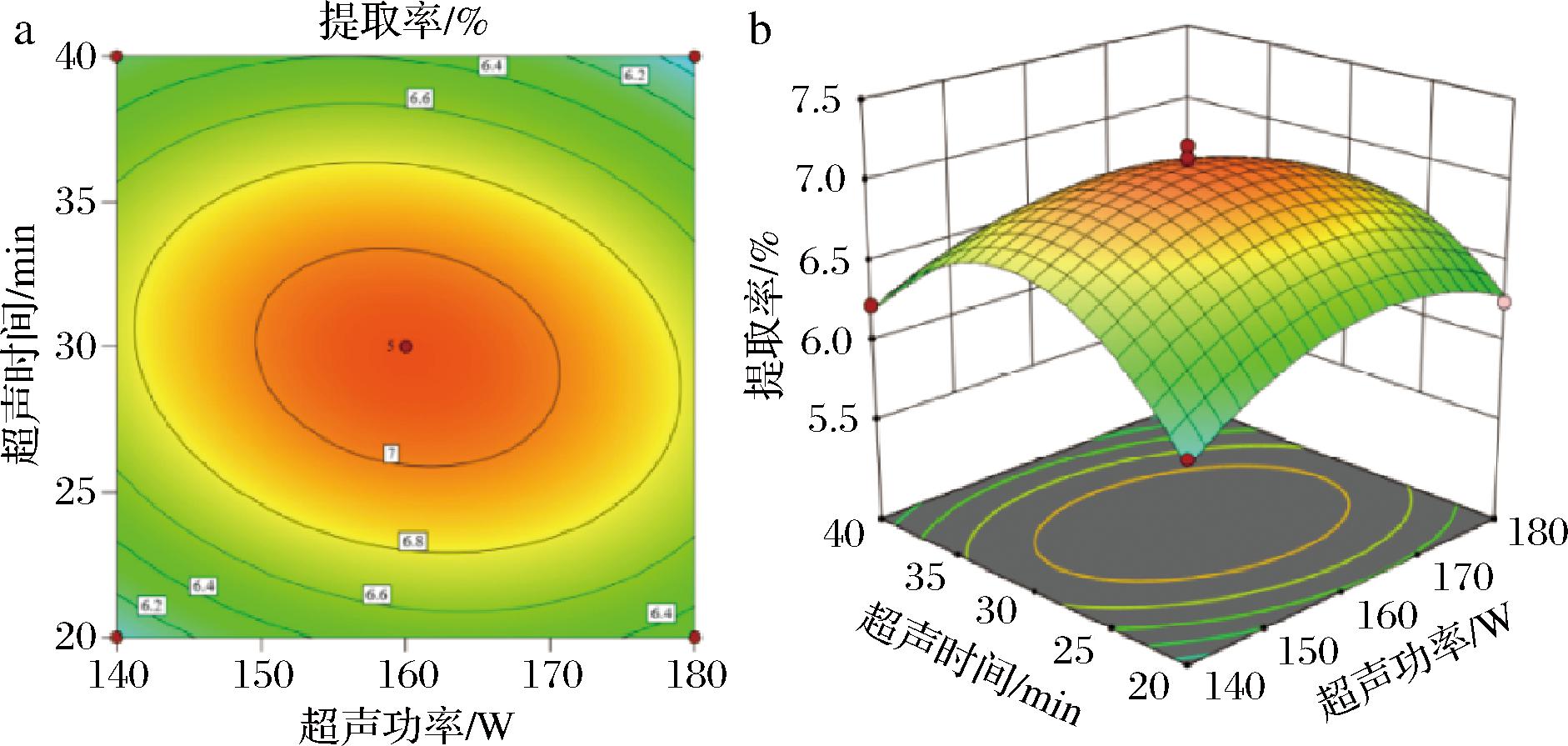
a-等高线图;b-响应面图
图6 米糠SDF提取率受超声功率和超声时间交互作用影响的等高线图和响应面图
Fig.6 Contour and response surface plots of rice bran SDF extraction rate as affected by the interaction of ultrasonic power and ultrasonic time
2.2.4 超声处理最佳提取工艺条件的确定和验证试验
根据回归方程模拟分析,预测米糠SDF的最佳提取工艺为液料比20.305 5∶1(mL∶g)、超声功率159.730 0 W、超声时间29.641 3 min,在此条件下米糠SDF提取率的预测值为7.093 5%。考虑现实可操作性和便捷性要求,调整工艺参数为液料比20∶1(mL∶g)、超声功率160 W、超声时间30 min,在此条件下,进行验证实验,测得SDF提取率为(7.04±0.07)%,基本与预测值相合,表明调整后的参数准确可靠。处理前SDF提取率为(1.23±0.07)%,处理后含量提高了472.36%。
2.3 超声处理对米糠结构的影响
2.3.1 FTIR分析
FTIR可以检测样品官能团的组成,反映出样品结构的变化。如图7所示,B-SDF与U-SDF的特征吸收峰的峰型类似,但强度存在差异。3 361 cm-1附近的宽而强的吸收峰主要是由于纤维素和半纤维素的—OH拉伸振动引起的,暴露的—OH有助于其亲水性[36-37]。2 930 cm-1和1 542 cm-1附近的弱吸收峰是甲基和亚甲基的C—H键伸缩振动产生的[38-39];1 600 cm-1处的吸收峰归因于SDF中羰基—COOH的伸缩振动[40];1 400~1 200 cm-1处的弱峰是典型的C—H键的变角振动峰[41];1 075 cm-1附近的较宽吸收峰可能与醚键的伸缩振动有关[42];844 cm-1处的峰对应于β-糖苷键的拉伸振荡[43]。以上都是多糖的特征峰,表明2种样品均具有典型膳食纤维结构,但超声处理对其官能团造成了一定程度的破坏,致使吸收峰的强度略有不同,U-SDF的结构也因此发生了改变。
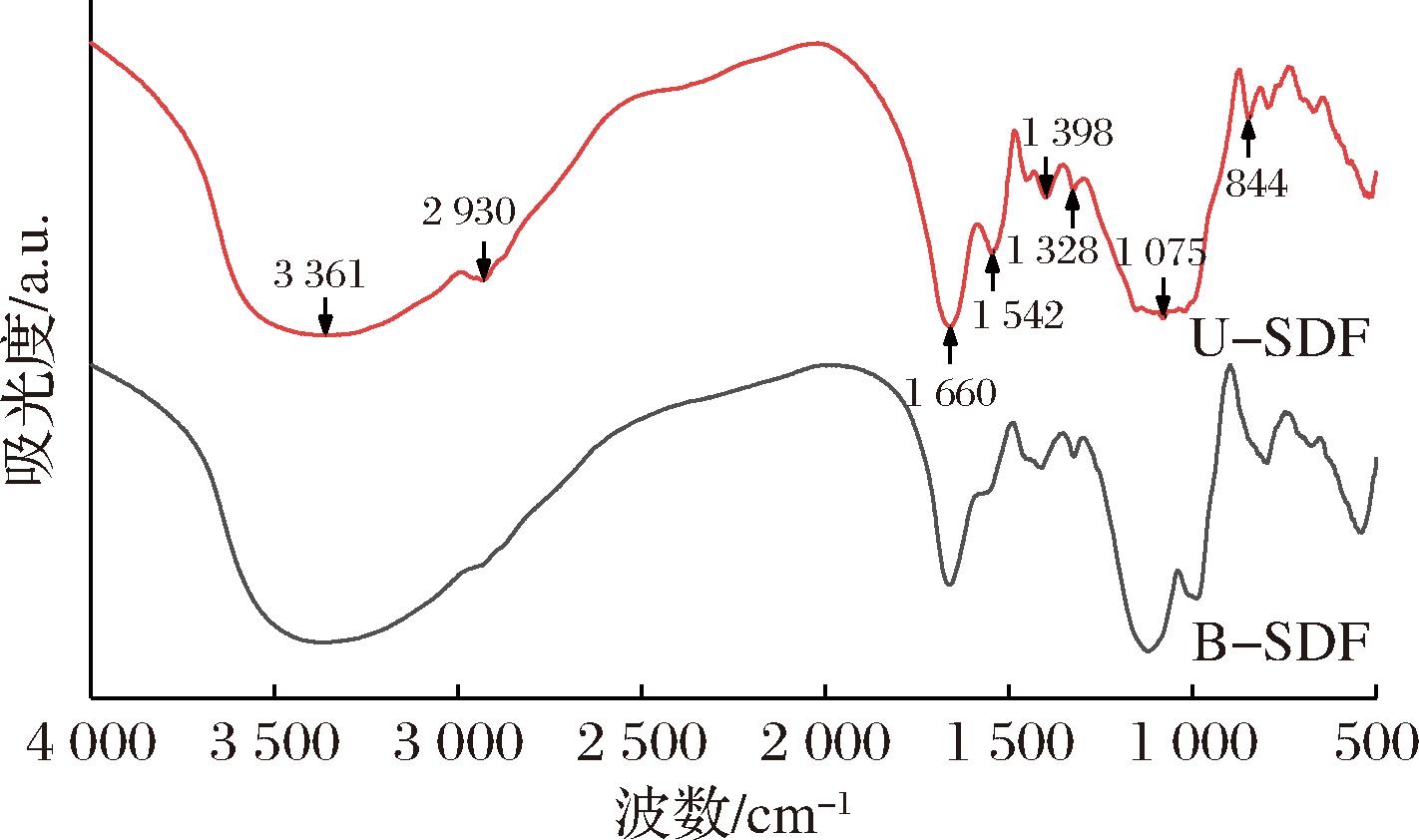
图7 米糠SDF处理前后的FTIR图
Fig.7 FTIR plots of rice bran SDF before and after modification
2.3.2 XRD分析
由图8可知,B-SDF在21.42°有尖锐的衍射峰,表面其晶粒较大,分子排列有规律,结构有序;U-SDF与B-SDF相比,无明显尖锐衍射峰,衍射强度降低,在20°~30°有着较宽的衍射峰;但是二者峰型相似,表明两者都是由有序的纤维素结晶区域和无序的纤维素、半纤维素非晶区域共同构成[44-45]。SDF的结晶度与其物理和化学特性密切相关,在结晶区域,由于定向良好的分子链,纤维素分子表现出很强的分子间结合力、致密的结构和很高的密度;相反,在非结晶区域,由于分子间距离较大,纤维素分子链取向不良,分子排列无序,密度较低[46]。超声效应在一定程度上破坏了晶体结构,纤维素在结晶区降解,增加了非结晶区比例,降低了聚合度,使分子重排,结晶区从有序状态变为无序状态,显示出非晶态的特征。由于水无法进入天然纤维素的晶体中,结晶度的降低会相应地降低纤维的强度、硬度和稳定性等物理特性,水分子更易进入纤维素中,提高持水力和膨胀力等化学特性[47]。晶区和非晶区结构对功能特性的影响也不同,晶体区域有序结构的降低导致SDF的结构更加松散,从而改善其生理活性[48]。
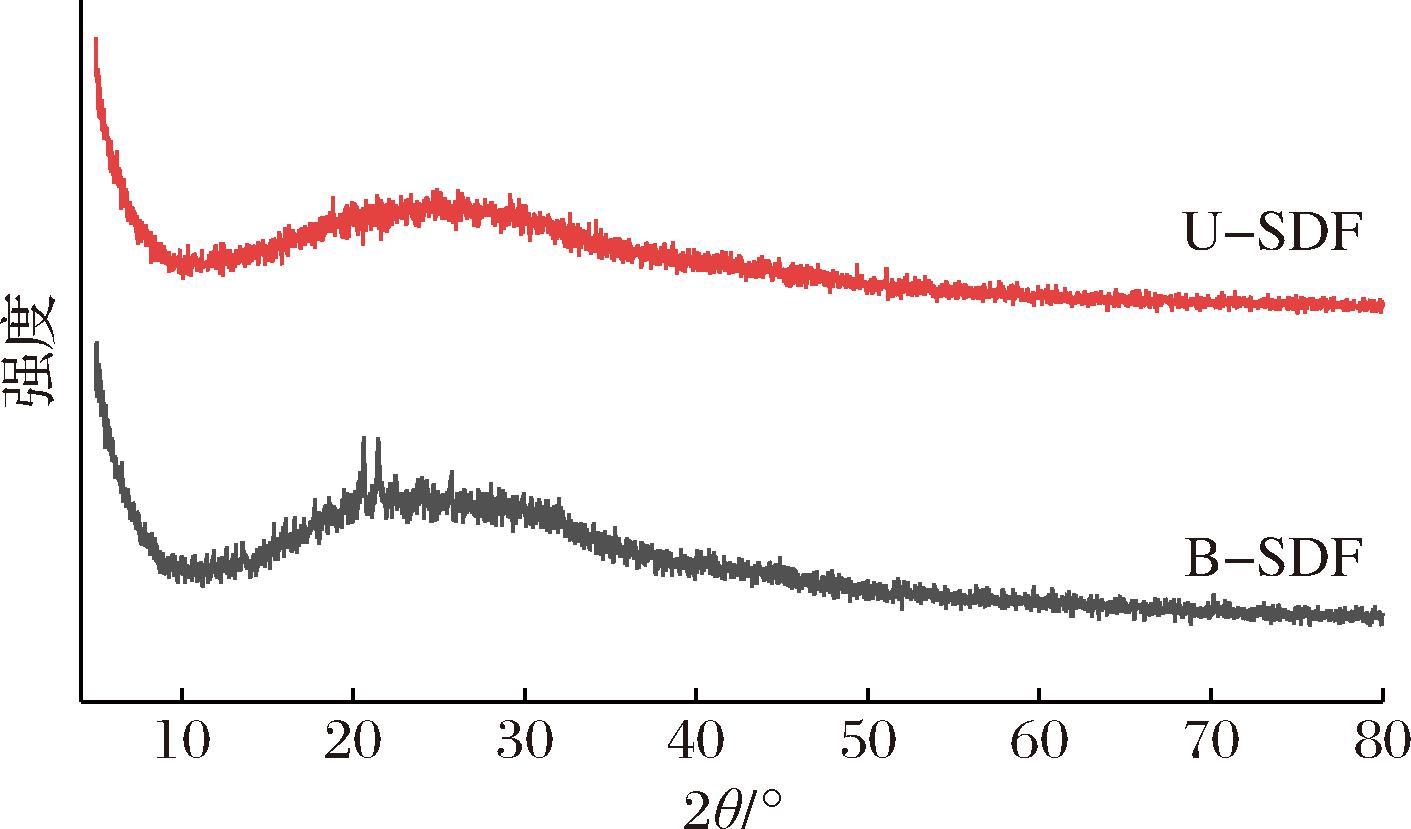
图8 米糠SDF处理前后的XRD图
Fig.8 XRD plots of rice bran before and after SDF modification
2.3.3 SEM分析
由图9可知,B-SDF团块大,表面粗糙无孔洞,而U-SDF表面分布均匀、疏松多孔,这可能是因为超声的机械效应破坏了SDF结构的完整性,导致内部空隙增加,比表面积增大[49-50]。比表面积越大,吸附有机分子和离子的能力越强,与油性成分结合的能力也越强,有助于提升其功能特性[51-52],超声效应使SDF暴露出更多的极性基团,有助于更多物质更容易进入纤维素内部,提高SDF的吸附性能,改善了其物化性质[53]。

图9 米糠SDF处理前后的SEM图
Fig.9 SEM images of rice bran SDF before and after modification
2.4 超声处理对米糠理化性质的影响
由图10可知,U-SDF的持水力由(0.37±0.13)g/g增加到(1.08±0.13)g/g,提高了195.45%;持油力由(1.43±0.40)g/g增加到(2.93±0.25)g/g,提高了104.65%;膨胀力由(0.17±0.06)mL/g增加到(0.90±0.36)mL/g,提高了439.99%;溶解力由(32.37±0.94)%增加到(55.23±5.52)%,提高了70.65%,且都呈现显著性差异(P<0.05)。超声的剪切、空化、湍流等作用使FTIR中U-SDF的特征峰发生偏移、XRD中U-SDF尖锐衍射峰的消失,改变了SDF结构,SEM微观结构图也证实了这一点,SDF结构的变化引起了相应理化特性的改变[54]。超声处理使FTIR特征峰发生偏移,产生具有多糖的特征吸收峰,化学键伸缩震动,暴露更多氢键和羟基,增加SDF的亲水性,提高SDF的持水力、膨胀力和溶解力[55]。超声处理调整了结晶区和非晶区之间的比例,使得水分子更容易进入SDF内部,提高持水力、膨胀力和溶解力[56]。SEM图中U-SDF结构松散多孔,使SDF暴露了更多的亲水性基团(如极性基团和醛酸基团),吸附更多的油脂和水分,有效结合胆固醇,有助于降低血液中胆固醇水平,并对健康产生积极作用[57]。
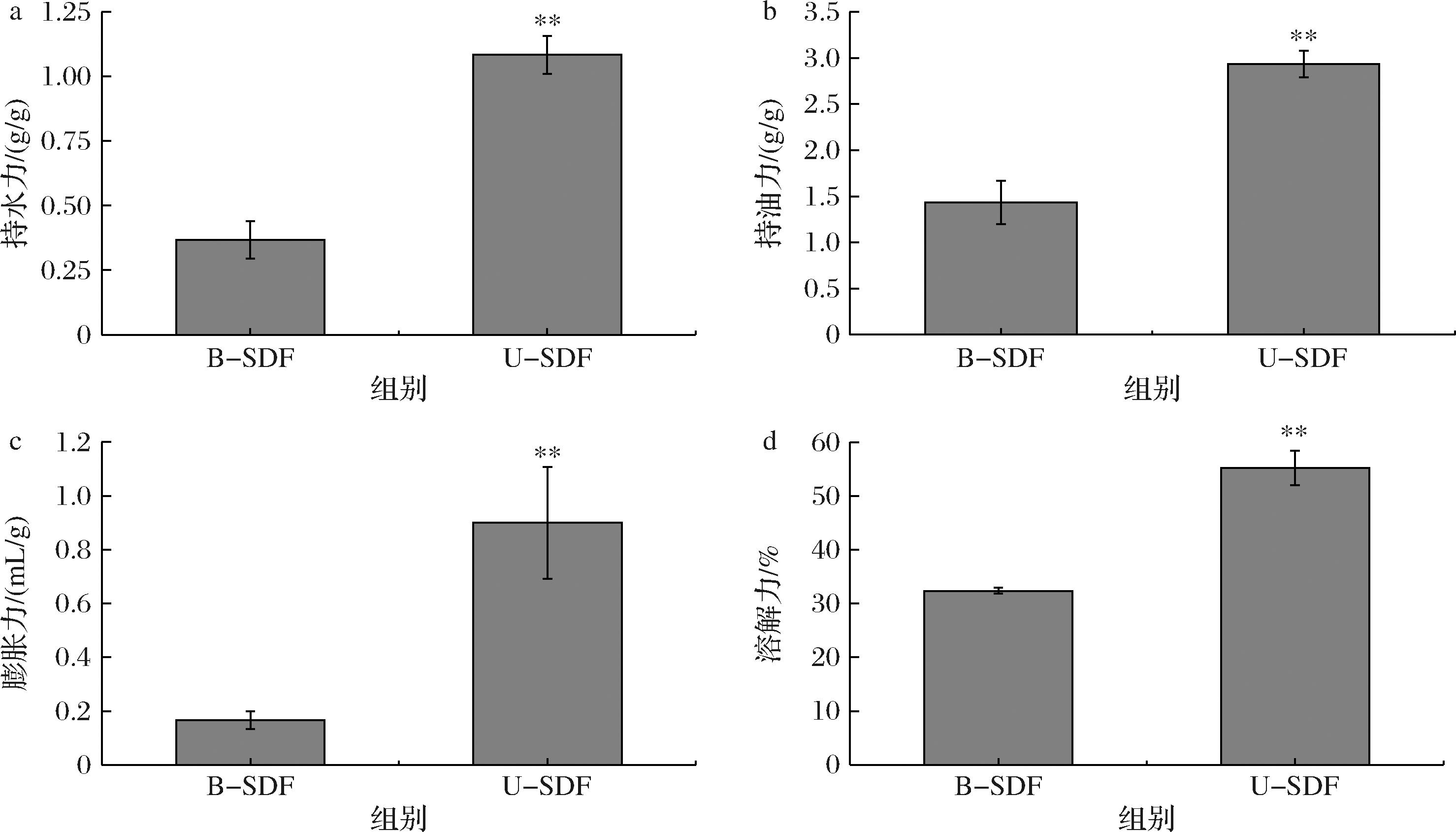
a-持水力;b-持油力;c-膨胀力;d-溶解力
图10 米糠SDF处理前后理化性质图
Fig.10 Physicochemical properties of rice bran before and after SDF modification
注:**表示差异极显著(P<0.01)(下同)。
2.5 超声处理对米糠功能特性的影响
如图11所示,在体外模拟的胃环境(pH=2.0)、肠环境(pH=7.0)中,U-SDF具有更强的吸附力,葡萄糖吸附力由(14.71±2.58)、(34.27±0.92) mg/g增加到(19.71±2.08)、(47.65±1.76) mg/g,分别增强了25.38%、39.05%;胆固醇吸附力由(139.36±4.16)、(236.66±2.41) mg/g增加到(156.82±1.80)、(249.01±0.02) mg/g;分别增强了12.53%、5.22%;亚硝酸根离子吸附力由(42.64±0.33)、(19.36±0.24) mg/g增加到(47.03±1.01) mg/g、(21.99±0.22) mg/g,分别增强了1.04%、13.58%,均呈现显著性差异(P<0.05),表现了良好的体外降血糖、降血脂功能,降低了亚硝酸盐致癌的机率。超声处理改变了SDF的结构,使其变得松散多孔,提供更多的结合位点,使更多的活性基团与其他分子结合,增强吸附性[58-59]。葡萄糖吸附力增强与超声的物理作用有关,超声处理使SDF结构相对疏松多孔,从而增强了U-SDF的吸附作用,更有利于吸附葡萄糖分子,同时,超声处理后暴露出更多的极性和非极性基团,使葡萄糖更容易进入SDF内部,增强了与葡萄糖分子的相互作用,因此,U-SDF能有效吸附胃肠道中的葡萄糖分子,调节餐后血糖诱导的血糖波动[49,60]。超声处理使U-SDF的内部无序区增加,空间阻挡力下降,促进了SDF对胆固醇和亚硝酸根离子的物理和化学吸附[61]。酸度和碱度对U-SDF的吸附力有很大影响:对于葡萄糖和胆固醇的吸附,SDF在肠内环境(pH=7.0)的吸附力强于胃内(pH=2.0),这表明SDF对葡萄糖和胆固醇吸附作用主要发生的在肠内,原因在于在酸性条件下,葡萄糖、胆固醇和SDF表面都有一定数量的正电荷,它们相互排斥,削弱了SDF的吸附作用[62]。对于亚硝酸根离子的吸附,在酸性环境中,亚硝酸盐离子与氢离子反应产生HNO2并进一步产生氮氧化合物,这些化合物可以轻松快速地与SDF中的有机酸结合,例如糖醛酸和酚酸,因此,SDF对亚硝酸根离子的吸附作用主要发生在胃内[63]。

a-葡萄糖吸附力;b-胆固醇吸附力;c-亚硝酸根离子吸附力
图11 米糠SDF处理前后功能特性图
Fig.11 Functional properties of rice bran before and after SDF modification
注:#表示差异显著(P<0.05),##表示差异极显著(P<0.01),*表示差异显著(P<0.05)。
3 结论
本文探究了超声处理对米糠SDF提取率、结构表征、理化性质和功能特性的影响,结果表明,超声处理可以提高米糠可溶性膳食纤维含量,改善其物化特性和功能特性。当液料比20∶1(mL∶g)、超声功率160 W、超声时间30 min时,米糠SDF含量最高,为(7.04±0.07)%,提高了4.72倍。由于超声的机械效应,经过处理的SDF持水力、持油力、膨胀力和溶解力提高,葡萄糖吸附力、胆固醇吸附力和亚硝酸根离子吸附力增强。本研究通过对米糠进行超声处理,提高了米糠SDF的含量,改善了SDF的物化特性和功能性质,使米糠更易于开发利用,为相关食品加工提供了理论依据。
[1] SOOKWONG P, MAHATHEERANONT S.Supercritical CO2 extraction of rice bran oil-the technology, manufacture, and applications[J].Journal of Oleo Science, 2017, 66(6):557-564.
[2] SPAGGIARI M, DALL’ASTA C, GALAVERNA G, et al.Rice bran by-product:From valorization strategies to nutritional perspectives[J].Foods, 2021, 10(1):85.
[3] ARDIANSYAH.A short review:Bioactivity of fermented rice bran[J].Journal of Oleo Science, 2021, 70(11):1565-1574.
[4] LI Q Y, LIU K L, CAI G L, et al.Developing lipase inhibitor as a novel approach to address the rice bran rancidity Issue─A critical review[J].Journal of Agricultural and Food Chemistry, 2024, 72(7):3277-3290.
[5] PRAKASH J, RAMASWAMY D H S.Rice bran proteins:Properties and food uses[J].Critical Reviews in Food Science and Nutrition, 1996, 36(6):537-552.
[6] RONIE M E, MAMAT H, AZIZ A H A, et al.Rice bran as a potent ingredient:Unveiling its potential for value-added applications[J].Food Science and Biotechnology, 2025, 34(3):577-598.
[7] TAN B L, NORHAIZAN M E, CHAN L C.Rice bran:From waste to nutritious food ingredients[J].Nutrients, 2023, 15(11):2503.
[8] SHARIF M K, BUTT M S, ANJUM F M, et al.Rice bran:A novel functional ingredient[J].Critical Reviews in Food Science and Nutrition, 2014, 54(6):807-816.
[9] AL-DOURY M K W, HETTIARACHCHY N S, HORAX R.Rice-endosperm and rice-bran proteins:A review[J].Journal of the American Oil Chemists’ Society, 2018, 95(8):943-956.
[10] BURLANDO B, CORNARA L.Therapeutic properties of rice constituents and derivatives (Oryza sativa L.):A review update[J].Trends in Food Science &Technology, 2014, 40(1):82-98.
[11] CHEN B J, QIAO Y J, WANG X, et al.Extraction, structural characterization, biological functions, and application of rice bran polysaccharides:A review[J].Foods, 2023, 12(3):639.
[12] HUANG W G, LIU B H, SHI D M, et al.Research progress on the quality, extraction technology, food application, and physiological function of rice bran oil[J].Foods, 2024, 13(20):3262.
[13] LIU Z G, LIU X X, MA Z, et al.Phytosterols in rice bran and their health benefits[J].Frontiers in Nutrition, 2023, 10:1287405.
[14] YU Y H, ZHANG J J, WANG J, et al.The anti-cancer activity and potential clinical application of rice bran extracts and fermentation products[J].RSC Advances, 2019, 9(31):18060-18069.
[15] Amended final report on the safety assessment of Oryza Sativa (rice) bran oil, Oryza Sativa (rice) germ oil, rice bran acid,Oryza Sativa (rice) bran wax, hydrogenated rice bran wax, Oryza Sativa (rice) bran extract, Oryza Sativa (rice) extract, Oryza Sativa (rice) germ powder, Oryza Sativa (rice) starch, Oryza Sativa (rice) bran, hydrolyzed rice bran extract, hydrolyzed rice bran protein, hydrolyzed rice extract, and hydrolyzed rice protein[J].International Journal of Toxicology, 2006, 25 Suppl 2:91-120.
[16] LI Y N, YU Y S, WU J J, et al.Comparison the structural, physicochemical, and prebiotic properties of litchi pomace dietary fibers before and after modification[J].Foods, 2022, 11(3):248.
[17] BADER UL AIN H, SAEED F, AHMED A, et al.Improving the physicochemical properties of partially enhanced soluble dietary fiber through innovative techniques:A coherent review[J].Journal of Food Processing and Preservation, 2019, 43(4):e13917.
[18] YANG Y Y, MA S, WANG X X, et al.Modification and application of dietary fiber in foods[J].Journal of Chemistry, 2017, 2017(1):9340427.
[19] 邵芳芳, 胡发广, 董文江, 等.超声辅助低共熔溶剂制备咖啡果皮可溶性膳食纤维[J].热带作物学报, 2024, 45(1):176-186.SHAO F F, HU F G, DONG W J, et al.Preparation of soluble dietary fiber from coffee peel by UltrasonicAssisted deep eutectic solvent[J].Chinese Journal of Tropical Crops, 2024, 45(1):176-186.
[20] GU Q, GAO X, ZHOU Q Q, et al.Characterization of soluble dietary fiber from citrus peels (Citrus unshiu), and its antioxidant capacity and beneficial regulating effect on gut microbiota[J].International Journal of Biological Macromolecules, 2023, 246:125715.
[21] 李丹, 汪秀妹, 梁杰, 等.高温蒸煮结合超声酶法改性菠萝蜜籽膳食纤维工艺优化及结构表征[J].食品工业科技, 2023, 44(23):203-212.LI D, WANG X M, LIANG J, et al.Process optimization and structure characterization of jackfruit seed dietary fiber modified by high temperature cooking combined with ultrasonic enzymatic method[J].Science and Technology of Food Industry, 2023, 44(23):203-212.
[22] GENG N N, SONG J F, LUO S W, et al.Ultrasound-assisted enzymatic extraction of soluble dietary fiber from fresh corn bract and its physio-chemical and structural properties[J].Quality Assurance and Safety of Crops &Foods, 2022, 14(2):119-130.
[23] XING Y H, ZHOU Y M, KUANG C Y, et al.Structural, physicochemical and functional properties of dietary fibers from tea residue modified by steam explosion[J].Frontiers in Sustainable Food Systems, 2024, 7:1326102.
[24] SANG J Q, LI L, WEN J, et al.Evaluation of the structural, physicochemical and functional properties of dietary fiber extracted from newhall navel orange by-products[J].Foods, 2021, 10(11):2772.
[25] ZHOU Y D, SUN Q J, TENG C, et al.Preparation and improvement of physicochemical and functional properties of dietary fiber from corn cob fermented by Aspergillus niger[J].Journal of Microbiology and Biotechnology, 2024, 34(2):330-339.
[26] ZHANG W M, ZENG G L, PAN Y G, et al.Properties of soluble dietary fiber-polysaccharide from Papaya peel obtained through alkaline or ultrasound-assisted alkaline extraction[J].Carbohydrate Polymers, 2017, 172:102-112.
[27] LIU J, WANG Z W, WANG Z Y, et al.Physicochemical and functional properties of soluble dietary fiber from different colored quinoa varieties (Chenopodium quinoa Willd)[J].Journal of Cereal Science, 2020, 95:103045.
[28] YANG R H, SONG X N, WANG T X, et al.Superfine grinding combined with enzymatic modification of pea dietary fibre:Structures, physicochemical properties, hypoglycaemic functional properties, and antioxidant activities[J].LWT, 2024, 207:116651.
[29] XIONG M, FENG M, CHEN Y L, et al.Comparison on structure, properties and functions of pomegranate peel soluble dietary fiber extracted by different methods[J].Food Chemistry:X, 2023, 19:100827.
[30] LI N, FENG Z Q, NIU Y G, et al.Structural, rheological and functional properties of modified soluble dietary fiber from tomato peels[J].Food Hydrocolloids, 2018, 77:557-565.
[31] YANG C R, SI J Y, CHEN Y, et al.Physicochemical structure and functional properties of soluble dietary fibers obtained by different modification methods from Mesona chinensis Benth.residue[J].Food Research International, 2022, 157:111489.
[32] DU X J, WANG L, HUANG X, et al.Effects of different extraction methods on structure and properties of soluble dietary fiber from defatted coconut flour[J].LWT, 2021, 143:111031.
[33] 刘钊, 周雪丽.超声辅助碱法提取菠萝蜜种子可溶性膳食纤维的研究[J].食品工程, 2024(3):51-55;75.LIU Z, ZHOU X L.Study on ultrasonic assisted alkaline extraction of soluble dietary fiber from jackfruit seeds[J].Food Engineering, 2024(3):51-55;75.
[34] 马恺扬, 宋欣欣, 胡昕迪, 等.H2O2协同超声辅助提取绿豆可溶性膳食纤维及其体外α-葡萄糖苷酶抑制活性研究[J].粮食与油脂, 2023, 36(9):90-95.MA K Y, SONG X X, HU X D, et al.Study on the ultrasound assisted extraction of soluble dietary fiber from mung beans with H2O2 and its in vitro α-glucosidase inhibitory activity[J].Cereals &Oils, 2023, 36(9):90-95.
[35] 余祚庆, 彭飞, 俞禧, 等.超声辅助复合酶法提取板栗仁中可溶性膳食纤维工艺优化及其结构表征[J].河北科技师范学院学报, 2024, 38(1):48-54;61.YU Z Q, PENG F, YU X, et al.Optimization of ultrasonic-assisted composite enzyme extraction process for soluble dietary fiber in chestnut kernels and its structural characterization[J].Journal of Hebei Normal University of Science &Technology, 2024, 38(1):48-54;61.
[36] 陈燕霞, 赵东, 刘磊, 等.不同加工方式对米糠可溶性膳食纤维结构和抗氧化活性的影响[J].现代食品科技, 2023, 39(6):124-131.CHEN Y X, ZHAO D, LIU L, et al.Effects of different processing methods on the structure and antioxidant activity of soluble dietary fibers in rice bran[J].Modern Food Science and Technology, 2023, 39(6):124-131.
[37] LEI J Y, ZHANG Y T, GUO D D, et al.Extraction optimization, structural characterization of soluble dietary fiber from Morchella importuna, and its in vitro fermentation impact on gut microbiota and short-chain fatty acids[J].CyTA-Journal of Food, 2022, 20(1):128-142.
[38] 李悦, 张钰, 张玉萍, 等.汽爆对麦麸可溶性膳食纤维功能性质的影响[J].粮食与油脂, 2022, 35(11):48-51.LI Y, ZHANG Y, ZHANG Y P, et al.Effect of steam explosion on functional property of soluble dietary fiber from wheat bran[J].Cereals &Oils, 2022, 35(11):48-51.
[39] XIE F Y, ZHAO T, WAN H C, et al.Structural and physicochemical characteristics of rice bran dietary fiber by cellulase and high-pressure homogenization[J].Applied Sciences, 2019, 9(7):1270.
[40] 曹家玮, 郭益孜, 李艳, 等.羧甲基化与接枝化改性对小米糠膳食纤维结构与理化性质的影响[J].食品研究与开发, 2023, 44(15):43-49.CAO J W, GUO Y Z, LI Y, et al.Effects of carboxymethylation and grafting on structure and physicochemical properties of millet bran dietary fiber[J].Food Research and Development, 2023, 44(15):43-49.
[41] 魏许召, 刘荟萃, 杨雨晨, 等.乳酸菌固态发酵对青稞麸皮可溶性膳食纤维物理、结构及功能特性的影响[J].食品工业科技, 2025, 46(9):11-20.WEI X Z, LIU H C, YANG Y C, et al.Effects of solid-state fermentation of lactic acid bacteria on the physical, structural and functional properties of soluble dietary fiber from highland barley bran[J].Science and Technology of Food Industry, 2025, 46(9):11-20.
[42] 沈康, 郭瑞成, 徐天旭, 等.DEAE-52纤维素柱层析纯化处理对西梅可溶性膳食纤维的影响[J].食品与发酵工业, 2024, 50(17):209-217.SHEN K, GUO R C, XU T X, et al.Effect of DEAE-52 cellulose column chromatography on soluble dietary fiber of prune[J].Food and Fermentation Industries, 2024, 50(17):209-217.
[43] 付慧珍, 李国豪, 陈佳雨, 等.提取方法对刺梨果渣可溶性膳食纤维理化性质及功能的影响[J].食品与发酵工业, 2023, 49(22):223-230.FU H Z, LI G H, CHEN J Y, et al.Effect of extraction methods on physicochemical and functional properties of soluble dietary fibers from Rosa roxburghii Tratt.pomace[J].Food and Fermentation Industries, 2023, 49(22):223-230.
[44] OUYANG H, GUO B L, HU Y, et al.Effect of ultra-high pressure treatment on structural and functional properties of dietary fiber from pomelo fruitlets[J].Food Bioscience, 2023, 52:102436.
[45] ZHAI X Y, AO H P, LIU W H, et al.Physicochemical and structural properties of dietary fiber from Rosa roxburghii pomace by steam explosion[J].Journal of Food Science and Technology, 2022, 59(6):2381-2391.
[46] TANG C D, WU L R, ZHANG F S, et al.Comparison of different extraction methods on the physicochemical, structural properties, and in vitro hypoglycemic activity of bamboo shoot dietary fibers[J].Food Chemistry, 2022, 386:132642.
[47] MA Q Y, MA Z Y, WANG W X, et al.The effects of enzymatic modification on the functional ingredient - Dietary fiber extracted from potato residue[J].LWT, 2022, 153:112511.
[48] 徐磊, 张倩, 王佩瑶, 等.碱性过氧化氢处理对藕渣可溶性膳食纤维结构及流变学特性的影响[J].中国食品学报, 2024, 24(5):245-253.XU L, ZHANG Q, WANG P Y, et al.Effect of alkaline hydrogen peroxide treatment on the structure and rheological properties of soluble dietary fiber from lotus root residue[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(5):245-253.
[49] JIA M Y, CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloids, 2019, 94:468-474.
[50] XIONG M, ZHENG S Y, BAI T M, et al.The difference among structure, physicochemical and functional properties of dietary fiber extracted from Triticale and hull-less barley[J].LWT, 2022, 154:112771.
[51] HUA X, XU S N, WANG M M, et al.Effects of high-speed homogenization and high-pressure homogenization on structure of tomato residue fibers[J].Food Chemistry, 2017, 232:443-449.
[52] JAO W C, WU S J.Influence of high hydrostatic pressure treatment on the soluble dietary fiber content and physicochemical characteristics of edamame[J].LWT, 2024, 202:116294.
[53] MA W J, LIANG Y T, LIN H S, et al.Fermentation of grapefruit peel by an efficient cellulose-degrading strain, (Penicillium YZ-1):Modification, structure and functional properties of soluble dietary fiber[J].Food Chemistry, 2023, 420:136123.
[54] HUANG L R, ZHANG W X, CHENG J, et al.Antioxidant and physicochemical properties of soluble dietary fiber from garlic straw as treated by energy-gathered ultrasound[J].International Journal of Food Properties, 2019, 22(1):678-688.
[55] JIANG G H, RAMACHANDRAIAH K, WU Z G, et al.The influence of different extraction methods on the structure, rheological, thermal and functional properties of soluble dietary fiber from Sanchi (Panax notoginseng) flower[J].Foods, 2022, 11(14):1995.
[56] DICKINSON E.Hydrocolloids acting as emulsifying agents-How do they do it?[J].Food Hydrocolloids, 2018, 78:2-14.
[57] QIAO H Z, SHAO H M, ZHENG X J, et al.Modification of sweet potato (Ipomoea batatas Lam.) residues soluble dietary fiber following twin-screw extrusion[J].Food Chemistry, 2021, 335:127522.
[58] CHENG Y N, XUE P Y, CHEN Y, et al.Effect of soluble dietary fiber of navel orange peel prepared by mixed solid-state fermentation on the quality of jelly[J].Foods, 2023, 12(8):1724.
[59] YANG L Q, ZHU R A, ZHANG N, et al.Effects of different extraction methods on the structural and functional properties of soluble dietary fibre from sweet potatoes[J].Foods, 2024, 13(15):2395.
[60] YANG C X, YAO J Q, ZHANG T, et al.Mixed fermentation of navel orange peel by Trichoderma viride and Aspergillus niger:Effects on the structural and functional properties of soluble dietary fiber[J].Food Bioscience, 2024, 57:103545.
[61] SI J Y, YANG C R, CHEN Y, et al.Structural properties and adsorption capacities of Mesona chinensis Benth residues dietary fiber prepared by cellulase treatment assisted by Aspergillus niger or Trichoderma reesei[J].Food Chemistry, 2023, 407:135149.
[62] JI R, ZHANG X L, LIU C H, et al.Effects of extraction methods on the structure and functional properties of soluble dietary fiber from blue honeysuckle (Lonicera caerulea L.) berry[J].Food Chemistry, 2024, 431:137135.
[63] HUO X Y, FENG C, ZHENG Y J, et al.Effects of combining ultrasound and dual enzymolysis with hydroxypropylation, acrylate grafting, or phosphate grafting on the physicochemical and functional properties of oil palm mesocarp expeller dietary fiber[J].LWT, 2024, 212:117012.