辣椒(Capsicum spp.L)是最重要的蔬菜之一,在全球广泛种植,我国辣椒产量和产值均居世界首位,其含有多种氨基酸、蛋白质、矿物质、维生素等营养成分[1]。辣椒具有独特的辛辣风味,果实富含的辣椒素可应用于食品和医药行业,具有较高的商品价值。然而,辣椒在采收和贮运过程中易产生机械损伤,为病原菌提供了入侵伤口。辣椒采后受生物胁迫产生的病害主要分为细菌性病害(如软腐病)和真菌性病害(如炭疽病、疫病、灰霉病和黑霉病等)[2-3]。辣椒软腐病常发生在运输贮藏过程中,主要由革兰氏阴性菌(G-)果胶杆菌引起,其发病与环境的湿度和温度有关,侵染严重时果实损失量可超过30%[4],造成巨大的经济损失。因此寻找绿色高效的方法控制辣椒采后细菌性病害导致的果实腐烂具有重要意义。
果胶杆菌属(Pectobacterium spp.)包括4个种,其中的胡萝卜软腐果胶杆菌(Pectobacterium carotovorum)主要有3个流行性亚种,分别为Pcb(P.carotovorum subsp.brasiliense)、Pcc(P.carotovorum subsp.carotovorum)和Pco(P.carotovorum subsp.odoriferum)[5]。Pcc是流行性最广、致病性最强的亚种,可引发辣椒、大白菜、土豆、芹菜等多种蔬菜的软腐病[6],发病症状多表现为水浸状、褐变软化,直至腐烂出水,且散发出刺激性臭味[7]。Pcc具有易在果实表皮附着、侵染性强、增殖快、诱发果实软腐病症状快等特点,对由Pcc引发的辣椒软腐病的控制带来了挑战。
当前果蔬采后软腐病的控制方式主要有物理防治法、化学防治法和生物防治法。28 kV/cm脉冲电场处理或伽马射线处理可以有效杀灭软腐病原菌[8-9]。1 mg/L ClO2溶液可以很好地抑制果胶杆菌Pcc的生长[10],一些化学杀菌剂(如薄荷精油[11])和抗生素类药物(如中生菌素、四霉素等[12])对软腐病具有较好的防治效果。在生物防治方面,主要使用一些拮抗微生物进行病害控制,如植物乳植杆菌LAB2[13]、枯草芽孢杆菌1151[14]和解淀粉芽孢杆菌S917[15]。另外,噬菌体phiPccP-1等被报道通过裂解细菌达到病害控制效果[16]。物理防治方法的效果持久性较差,化学防治方法存在药物残留等安全性问题,拮抗微生物类生物防治方法的效果较不稳定。因此探索一种绿色、高效、稳定的辣椒软腐病控制方法尤为重要。
细菌素是一类由细菌核糖体产生的多肽或蛋白质,可以有效抑制或者杀死微生物,属于食品生物防腐剂,具有绿色高效的优点[17]。乳酸链球菌素(nisin)是当前已经广泛用于食品工业的商业化细菌素,由乳酸乳球菌(Lactococcus lactis)产生,但它存在抑菌谱较窄,不能抑制革兰氏阴性菌的问题[18]。研究发现了一株能够控制辣椒软腐病的拮抗乳酸菌副干酪乳酪杆菌WX322[19-20],该拮抗乳酸菌产生一种新型细菌素paracin wx3。但是,该新型细菌素控制由Pcc引发的辣椒软腐病的效果暂不明确。本研究旨在探究细菌素paracin wx3对Pcc的控制效果,以及维持辣椒采后品质的能力,以期为降低Pcc引起的辣椒软腐发病率、延长辣椒贮藏期、保持辣椒良好商品价值提供新的技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
薄皮青椒,来自重庆市北碚区,选取形态正常、品质优良、无腐烂、无病虫害的辣椒进行实验。细菌素paracin wx3:保藏于西南大学果蔬物流保鲜与营养品质调控研究中心,来源于前期实验室从四川泡菜分出的副干酪乳杆菌WX322,经大肠杆菌BL21(DE3) pLysS异源表达得到[19]。
果胶杆菌Pcc CBJ3,分离于重庆市北碚区腐烂辣椒,菌种保藏于西南大学果蔬物流保鲜与营养品质调控研究中心-80 ℃冰箱。
1.1.2 试剂及培养基
NaClO、三氯乙酸,成都市科隆化学品有限公司;琼脂粉,北京索莱宝科技有限公司;草酸,天津希恩恩生化科技有限公司;PBS,金克隆(北京)生物技术有限公司;NaCl,重庆跃翔化工有限公司;硫代巴比妥酸,南京都莱生物技术有限公司;2,6-二氯靛酚钠盐水合物,上海阿拉丁生化科技股份有限公司;卡那霉素(kanamycin,Kana),大连美仑生物技术有限公司;LB肉汤,青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
生物安全柜,青岛海尔生物医疗股份有限公司;A16K高速台式离心机,湖南安君研仪器有限公司;手提式高压蒸汽灭菌器,上海申安医疗器械厂;恒温恒湿培养箱,宁波乐电仪器制造有限公司;SU8010扫描电镜,日本日立公司;TGL-16M台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;GS-15水果质地分析仪,北京阳光亿事达科技有限公司;CR-400色差仪,柯尼卡美能达控股公司;PAL-1手持式糖度计,广州市爱拓科学仪器有限公司;HS-GM-IMS分析仪,德国多特蒙德公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1 细菌素对辣椒软腐病的体外体内控制效果
1.3.1.1 细菌素对辣椒软腐病原菌Pcc的体外控制效果
参照YI等[21]方法略有修改,将果胶杆菌Pcc CBJ3划板过夜培养后用无菌棉棒接种于灭菌生理盐水中,调节OD600 nm=0.1,肉汤2倍逐级稀释细菌素paracin wx3以测定对Pcc CBJ3的最小抑菌浓度(minimal inhibit concentration,MIC)。
1.3.1.2 不同浓度细菌素对辣椒软腐病的体内控制效果
新鲜的青椒用2%(质量分数)NaClO浸泡消毒后打孔,自然晾干。生理盐水调节对数期果胶杆菌Pcc CBJ3至浓度为103 CFU/mL。辣椒每孔接种15 μL Pcc CBJ3菌悬液,室温放置2 h至菌液吸收。随后,孔中分别加入不同浓度的细菌素paracin wx3(2 MIC、4 MIC、8 MIC、16 MIC)各30 μL。以pH 6.0无菌PBS为空白对照。在25 ℃、相对湿度85%下贮藏辣椒。记录辣椒表观变化、测量辣椒果实发病率和病斑直径。一个平行10个果实,每个处理重复3个平行。
1.3.1.3 不同浓度细菌素对辣椒软腐病原菌Pcc数量的影响
参照李广等[14]的方法略有修改,用浓度分别为2 MIC、4 MIC、8 MIC、16 MIC的细菌素paracin wx3处理预先接种病原菌的青椒,以PBS为空白对照。所接种辣椒软腐病原菌为带有绿色荧光蛋白的Pcc CBJ3-GFP。每天取辣椒接种孔周围大小相同的组织于生理盐水,稀释涂布于含有Kana抗性的LB平板。28 ℃培养1 d,选择有绿色荧光的Pcc计数,每个处理5个平行,每个平行15个果实。
1.3.2 扫描电镜
1.3.2.1 细菌素对果胶杆菌细胞形态的影响
对数期Pcc CBJ3中加入paracin wx3至终浓度分别为4 MIC和16 MIC,25 ℃、150 r/min处理2 h。以PBS代替paracin wx3为对照。用生理盐水洗涤后将菌悬液滴加于载玻片,用2.5%(质量分数,下同)戊二醛过夜固定。0.1 mol/L的PBS清洗后,使用乙醇溶液梯度脱水。载玻片干燥后喷金,在扫描电镜下观察果胶杆菌Pcc CBJ3的细胞形态。
1.3.2.2 细菌素对辣椒表皮病原菌分布的影响
青椒的准备和细菌素处理过程均与1.3.1.2节相同,分别用4 MIC、16 MIC的paracin wx3处理青椒,用PBS代替细菌素作为对照。在25 ℃贮藏2 d,取青椒孔周围直径1 cm组织,置于4 ℃、2.5%戊二醛溶液中过夜固定。将辣椒组织用不同浓度乙醇溶液梯度脱水,干燥并喷金后,在扫描电镜下观察辣椒组织形态。
1.3.3 细菌素对辣椒贮藏品质的影响
按照1.3.1.2节的步骤在辣椒中接种软腐病原菌Pcc CBJ3,随后使用16 MIC paracin wx3处理,PBS代替细菌素作为空白对照。每个处理3个平行,每个平行30个辣椒。取辣椒孔周围1 cm的组织,液氮速冻,存于-80 ℃冰箱待测。
1.3.3.1 失重率
对不同处理的青椒,每天称重,失重率按公式(1)计算:
失重率![]()
(1)
式中:m0,初始辣椒果实质量,g;mn,第n天辣椒果实质量,g。
1.3.3.2 硬度
采用水果质地分析仪对青椒孔附近随机3个部位的硬度进行测定。
1.3.3.3 可溶性固形物
辣椒果肉2 g榨汁过滤后离心,用手持式糖度计测定上清液中的可溶性固形物含量。
1.3.3.4 色差
用色差仪每天记录青椒孔周围随机3处的L*、a*、b*值的变化,每个平行5个辣椒,每个处理重复3个平行。
1.3.3.5 丙二醛(malondialdehyde,MDA)含量
参照WANG等[22]的方法,稍作修改。0.5 g样本组织液氮研磨,加入5%(体积分数)三氯乙酸溶液10 mL萃取并离心,加入2 mL 0.5%(质量分数)硫代巴比妥酸与萃取上清液1∶1混合。涡旋混匀后于100 ℃加热30 min,冷却、离心得上清液,根据颜色进行稀释,分别测定450、532、600 nm下的溶液吸光值。每个处理3个平行,每个平行10个青椒。MDA含量按公式(2)计算。
MDA/(μmol/g FW)=[6.45×(OD532 nm-OD600 nm)-0.56×OD450 nm]×Vt×Vr/(Vs×m)
(2)
式中:Vt,三氯乙酸萃取液的总体积;Vr,与硫代巴比妥酸混合的溶液总体积;Vs,混合溶液中萃取液的体积;m,样品的质量,g。
1.3.3.6 辣椒抗坏血酸含量测定
参照YI等[23]的方法,略有修改,不同处理的辣椒果实样品各取0.5 g研磨并用草酸提取,使用2,6-二氯靛酚进行滴定。抗坏血酸含量表示为(mg/100 g)。
1.3.4 细菌素对辣椒中挥发性风味成分的影响
1.3.4.1 挥发性成分测定
细菌素对青椒的处理过程同1.3.3节。在贮藏第2天,取2 g辣椒伤口组织于20 mL玻璃瓶,45 ℃萃取30 min,经顶空-气相色谱-离子迁移谱仪(headspace gas chromatography ion mobility spectrometry,HS-GC-IMS)分析,比对各挥发性成分的保留指数(retention index,RI)及漂移时间与GC-IMS谱库,分析不同处理间的辣椒挥发性成分差异。
1.3.4.2 正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)建模与预测分析
采用OPLS-DA建模进行辣椒软腐病潜在主要挥发性化合物预测。
1.4 数据处理
结果表示均为“平均值±标准差”。使用Excel 2020进行数据记录,Graphpad 8.0.2进行作图和数据分析。SIMCA 14.1进行HS-GC-IMS及OPLS-DA分析[24],使用单因素AVOVA检验和独立样本t检验进行显著性分析。
2 结果与分析
2.1 细菌素paracin wx3对辣椒软腐病的体外体内控制效果
2.1.1 细菌素paracin wx3对辣椒软腐病原菌Pcc的体外控制效果
细菌素paracin wx3对辣椒软腐病原菌果胶杆菌Pcc CBJ3的MIC值为16 μg/mL。此外,测得nisin对Pcc CBJ3的MIC值>1 024 μg/mL。在NOURI等[25]研究中,纳米乳化油对Pcc的MIC值为590 μg/mL,百里香制剂对Pcc的MIC值则为290 μg/mL。大蒜提取物对果胶杆菌的MIC值为0.5 g/mL[26],远高于细菌素paracin wx3的MIC值。在体外,细菌素paracin wx3控制软腐病原菌Pcc所需的浓度较低,具有高效抑菌活性。
2.1.2 细菌素paracin wx3对辣椒软腐病的体内控制效果
如图1-b所示,PBS处理的对照组在第1天开始出现软腐病,发病率达45%,在后续的2 d内发病率持续升高,到第3天发病率最高,达到96.66%,果实近乎完全发病状态,而细菌素paracin wx3显著减少了辣椒软腐发病率,且发病率随着细菌素浓度的增大而下降。在第1天,各个浓度的细菌素处理组发病率皆为0%;在第2天,1 MIC和2 MIC发病率分别为10%和1.66%;在第3天,16 MIC发病率仍为0%,其他浓度处理组发病率均小于25%。如图1-c所示,对照组病斑直径总体更高,在第1天病斑直径为(5.66±0.66) mm,在贮藏第3天上升至(55.33±10.33) mm。在第3天,4 MIC和8 MIC的病斑直径分别为(16.5±1.5) mm和(11±1) mm,显著低于1 MIC的(33.3±8.3) mm和2 MIC的(29±9) mm。由图1-a可知,在贮藏第3天,对照组辣椒已经腐烂变形至流水,而细菌素paracin wx3处理组仍保持完好的辣椒形态。细菌素paracin wx3浓度越高,控制辣椒软腐病效果越强,且16 MIC可以完全抑制辣椒软腐发病。由此可见,在体内,细菌素paracin wx3能够有效控制由果胶杆菌Pcc CBJ3引起的辣椒软腐病。
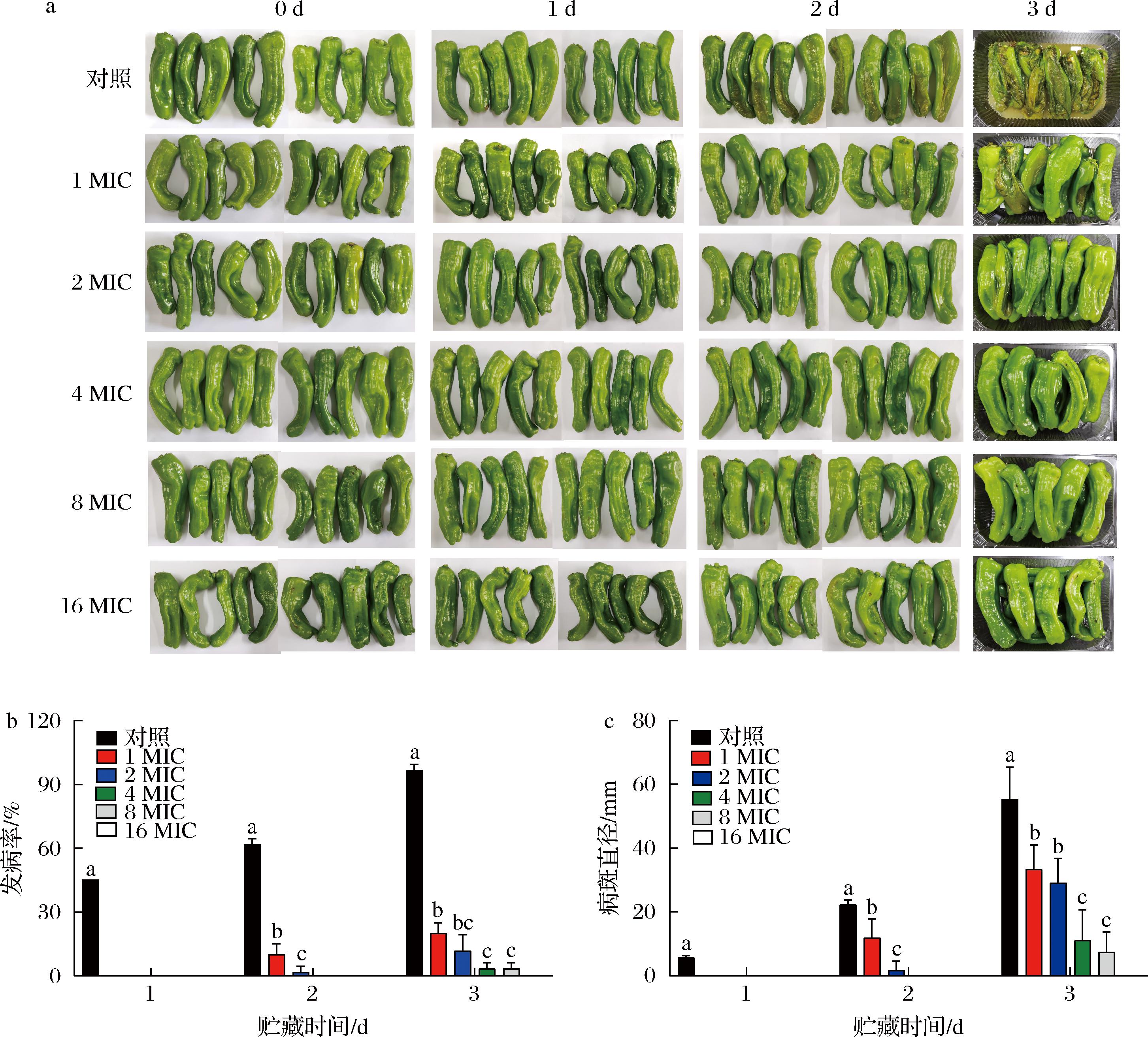
a-paracin wx3果实发病症状;b-发病率;c-病斑直径
图1 细菌素paracin wx3对辣椒软腐病发病率和病斑直径的影响
Fig.1 Effect of bacteriocin paracin wx3 on disease incidence and lesion diameter of pepper soft rot
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.3 细菌素paracin wx3对辣椒中病原菌数量的影响
由图2可见,与对照组辣椒上的病原菌数量相比,所有浓度细菌素处理组病原菌数量显著降低,且随着细菌素浓度增加,病原菌的数量呈现逐渐降低趋势。在贮藏第2天,对照组病原菌数量为8.74 lg CFU/mL,而4 MIC、8 MIC、16 MIC浓度paracin wx3的辣椒病原菌数量显著降低,分别为6.89、6.73、6.05 lg CFU/mL。在贮藏第3天,4 MIC、8 MIC、16 MIC处理组之间无显著性差异,果胶杆菌数量平缓增长,而对照组果胶杆菌数量则在第3天持续上升,达到9.73 lg CFU/mL。由此可见,细菌素paracin wx3能够抑制果胶杆菌Pcc CBJ3在辣椒体内生长繁殖。
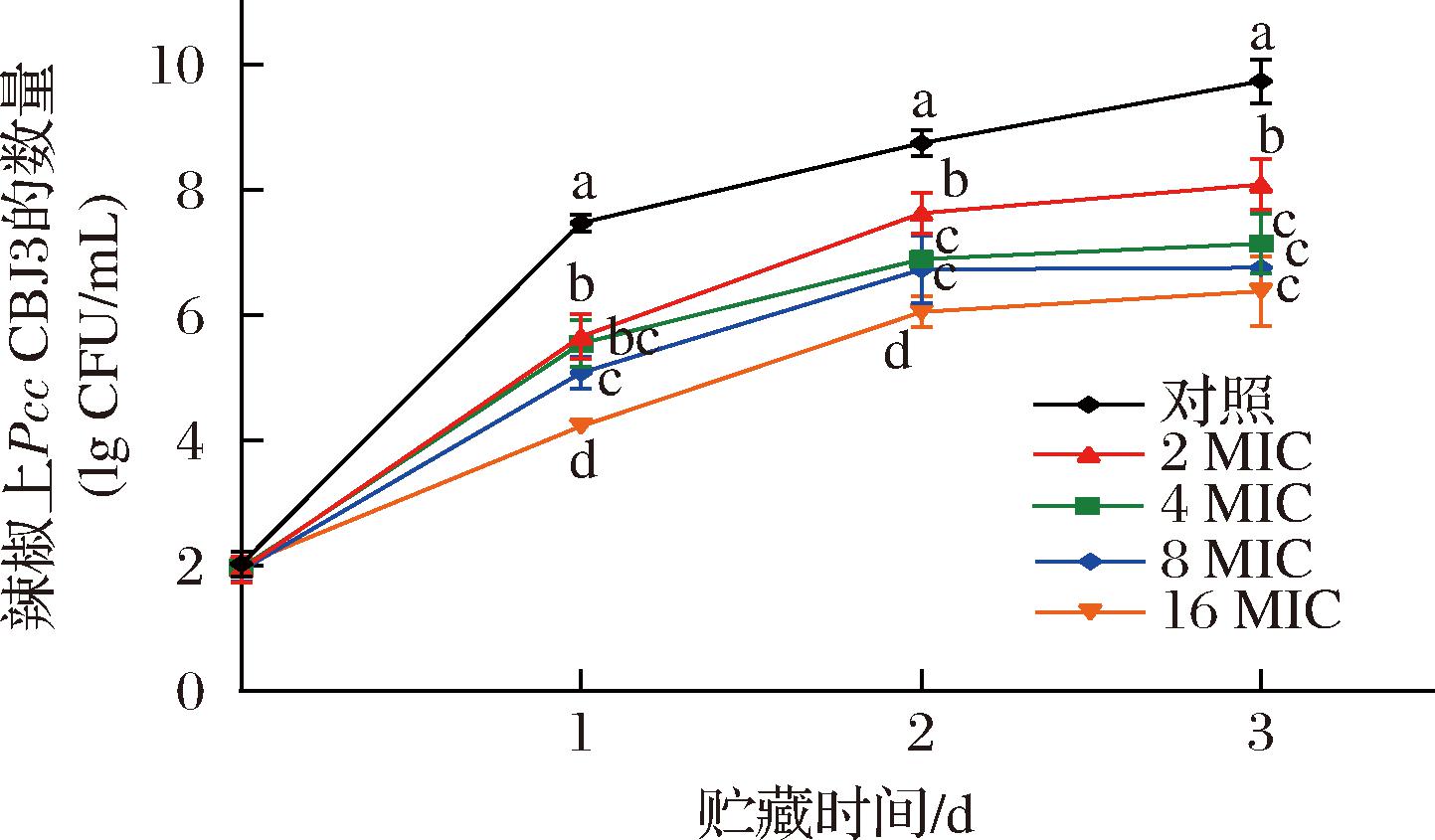
图2 细菌素paracin wx3对辣椒中病原菌Pcc CBJ3数量的影响
Fig.2 Effect of bacteriocin paracin wx3 on the number of pathogen Pcc CBJ3 on pepper
2.2 细菌素paracin wx3对辣椒软腐病原菌细胞形态和辣椒表皮病原菌分布的影响
2.2.1 细菌素paracin wx3对果胶杆菌细胞形态的影响
由图3可知,对照组的辣椒软腐病原菌Pcc CBJ3呈现细胞形态完整状态,细胞表面光滑平整。4 MIC细菌素paracin wx3处理导致细胞表面出现粗糙纹路,细胞表面局部形成孔洞,造成细胞形变。当处理浓度提升至16 MIC,细胞表面形成的孔洞更大,导致细胞被膜大面积塌陷。细菌素最主要的杀菌机制与细胞被膜有关,包括抑制肽聚糖合成、在细胞膜上形成孔[27]。由此可推测,细菌素paracin wx3可能是通过在细胞膜上形成孔发挥杀菌作用。
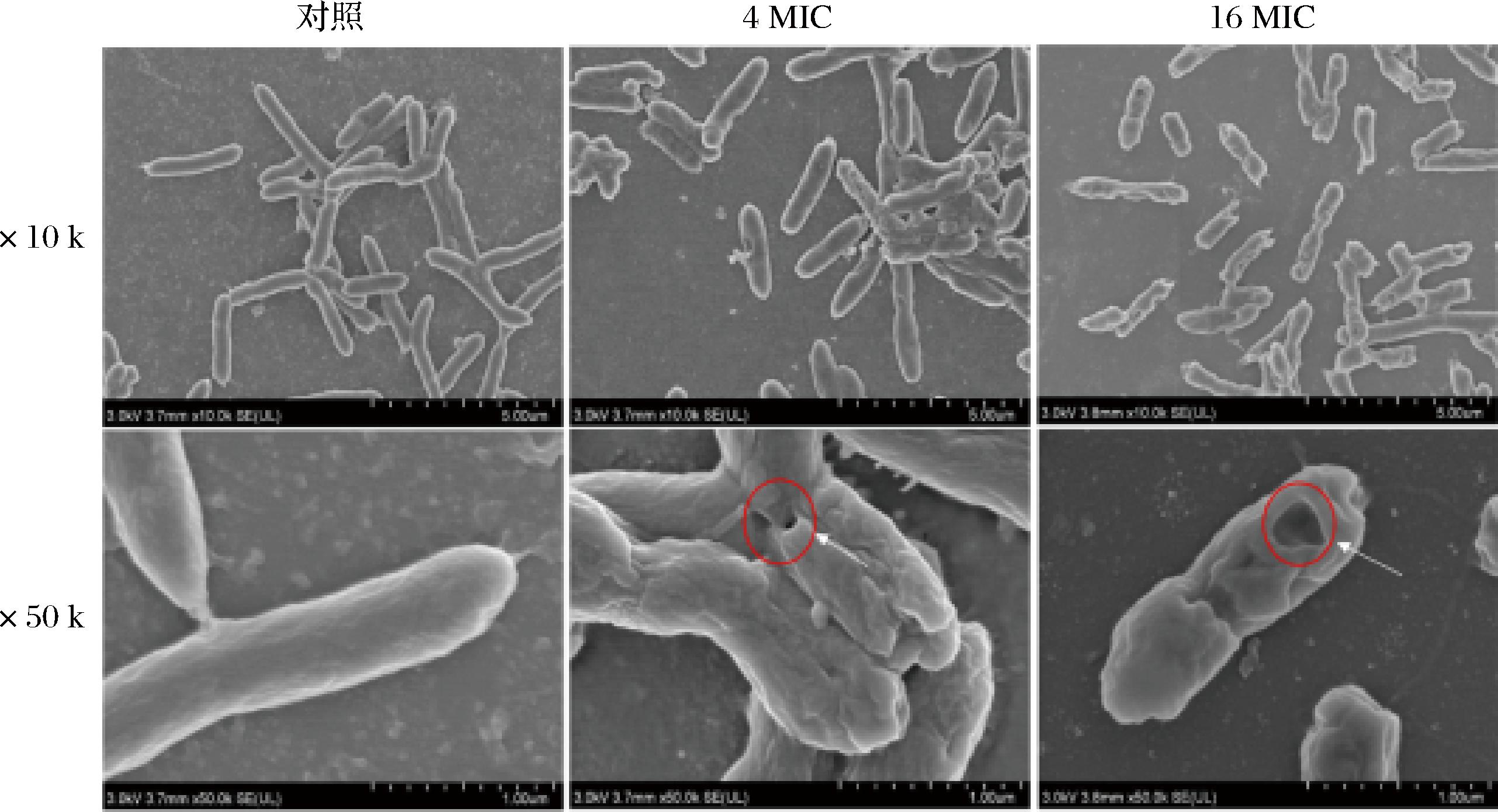
图3 细菌素paracin wx3对Pcc CBJ3形态的影响
Fig.3 Effect of bacteriocin paracin wx3 on the morphology of Pcc CBJ3
2.2.2 细菌素paracin wx3对辣椒表皮果胶杆菌分布的影响
由图4结果可知,对照组辣椒表面Pcc CBJ3菌体数量多且成团聚集,菌体细胞形态基本完好、细胞表面光滑。随着辣椒组织表面出现凹陷,Pcc大量分布于辣椒表皮凹陷处。而16 MIC细菌素paracin wx3处理的辣椒组织表面较为完好、平整,辣椒表皮分布的Pcc菌体数量较少。并且,大部分菌体细胞形态模糊,无完整细胞轮廓,细胞出现类似溶解现象而连接成片。由此可见,细菌素paracin wx3通过破坏细胞被膜杀死果胶杆菌,从而减少病原菌在辣椒表皮的分布数量,进而控制辣椒软腐病发展,减轻病症。
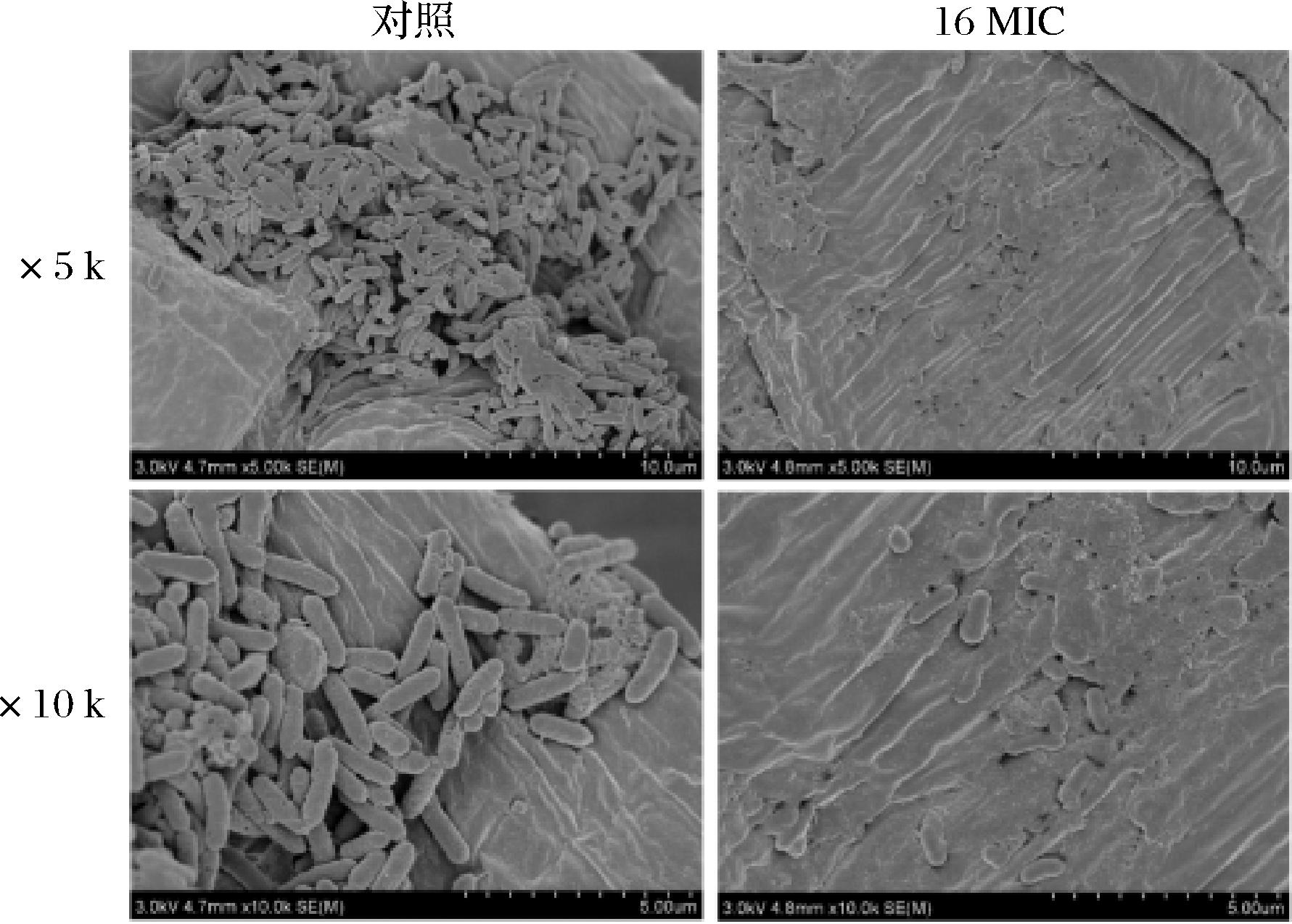
图4 细菌素paracin wx3对辣椒表皮果胶杆菌分布的影响
Fig.4 Effects of bacteriocin paracin wx3 on the distribution of Pectobacterium on pepper surface
2.3 细菌素paracin wx3对辣椒果实品质的影响
2.3.1 失重率
如图5-a所示,在贮藏第1天,2组辣椒失重率无显著差异;在贮藏第2天,对照组失重率迅速上升到20.2%,细菌素paracin wx3处理组为2.35%,失重率无明显增加;在贮藏第3天,2组差异达到最大,对照组失重率达到34.88%,而处理组为3.307%,显著低于对照(P<0.05)。该结果表明细菌素paracin wx3处理可以有效降低辣椒的失水。
2.3.2 硬度
如图5-b所示,辣椒的硬度与贮藏时间相关,总体呈现辣椒硬度逐渐降低趋势。对照组辣椒的硬度比细菌素paracin wx3处理组降低更快,在贮藏第2、3天分别为0.156 6 kg和0.139 7 kg,皆显著低于paracin wx3细菌素处理组的0.264 6 kg和0.234 5 kg。由此表明,细菌素paracin wx3处理能够减少果实软化,较好地维持辣椒的硬度。
2.3.3 可溶性固形物含量
如图5-c所示,辣椒的可溶性固形物在贮藏期前2 d无显著差异,在贮藏第2天,处理组的可溶性固形物的含量降低至3.86%,显著低于对照组4.43%(P<0.05),在第3天对照组则降低至4.3%,处理组为4.03%,仍显著低于对照组。推测可能是辣椒软腐导致水分析出,辣椒植物细胞壁逐渐被降解,可溶性物质析出。

a-失重率;b-硬度;c-可溶性固形物含量;d-a*值;e-b*值;f-L*值;g-MDA含量;h-抗坏血酸含量
图5 细菌素paracin wx3处理对辣椒果实品质的影响
Fig.5 Effects of bacteriocin paracin wx3 treatment on the fruit quality of pepper
2.3.4 色差
a*值代表红绿色,如图5-d所示,自贮藏1 d后辣椒的a*值整体呈现上升趋势。其中对照组上升地更快,paracin wx3处理组则升高较缓,在第3天为-15.13,显著低于对照组的-10.15(P<0.05),表明细菌素处理可以较好地保持辣椒绿色色泽。b*值表示蓝黄色,对照组的b*值在第3天激增至35.33,paracin wx3处理则可以减缓其增长速度,表明果胶杆菌可以使得青椒表皮变黄,细菌素处理可以缓解此变化(图5-e)。L*值表示辣椒果实亮度,如图5-f所示,随着贮藏时间增加,辣椒L*值总体呈现降低趋势,相较于对照组,paracin wx3处理可以保持较好的L*值,在第3天可维持果实亮度在46.66。由此可见,细菌素paracin wx3处理能够减少由果胶杆菌引起的青椒色泽暗淡黄化,维持较好的表皮绿色。
2.3.5 MDA含量
MDA含量与果实衰老及逆境伤害密切相关,可以反映细胞膜脂过氧化的强弱。如图5-g所示,在贮藏期间辣椒中MDA含量逐渐积累,在贮藏第1天,对照组和paracin wx3处理组的MDA含量差异不显著;在第2、3天,对照组MDA积累增多,显著高于paracin wx3处理的果实,第3天对照组为1.24 μmol/g FW,处理组为0.54 μmol/g FW。该结果表明paracin wx3处理可以降低辣椒果实的膜质过氧化,减少MDA积累,延缓果实衰老。
2.3.6 抗坏血酸含量
如图5-h所示,在果实贮藏期间,对照组的抗坏血酸含量总体呈现降低趋势,在贮藏第2天和第3天分别为28.47 mg/100 g和35.41 mg/100 g。而paracin wx3处理组辣椒的抗坏血酸含量显著高于对照组(P<0.05),总体变化呈现稳定趋势,在第3天抗坏血酸含量仍可保持53.48 mg/100 g。该结果表明paracin wx3处理可以减少辣椒的营养物质维生素C的流失。
2.4 细菌素paracin wx3对辣椒软腐的挥发性风味成分的影响
2.4.1 细菌素paracin wx3对辣椒挥发性成分的影响
如图6-a所示,对辣椒的挥发性成分进行HS-GC-IMS分析发现,以处理为参照,对照组较paracin wx3处理组挥发性化合物浓度水平更高,2组处理皆含有以醇类、酮类、酯类、醛类为主的共34种挥发性物质,为总59种风味物质的57.62%。挥发性化合物三维图谱表明2组处理之间的物质成分浓度存在差异,其中有45种挥发性成分浓度差异显著(图6-b)。主成分分析可以可视化解释数据差异,2组处理的挥发性成分类别有明显差异,PC1为主要差异占76%,PC2则占比较低为13%(图6-c)。图6-d为挥发性物质指纹图谱,红色代表化合物相对丰度高,可以看出对照组总体挥发性化合物浓度更高,其中如苯乙烯、萘烷、2-甲基-2-丙烯醛、3-丁烯腈、2-甲基-2-丙醇、1-丁醇等化合物浓度显著上升。而细菌素paracin wx3处理组则含有更多的3-戊酮、5-甲基-3-庚酮、2-己醇、丙烯腈、六甲基环三硅氧烷等挥发性化合物。由此可见,细菌素paracin wx3处理可以减缓软腐病带来的恶臭,降低有害挥发性物质的形成。
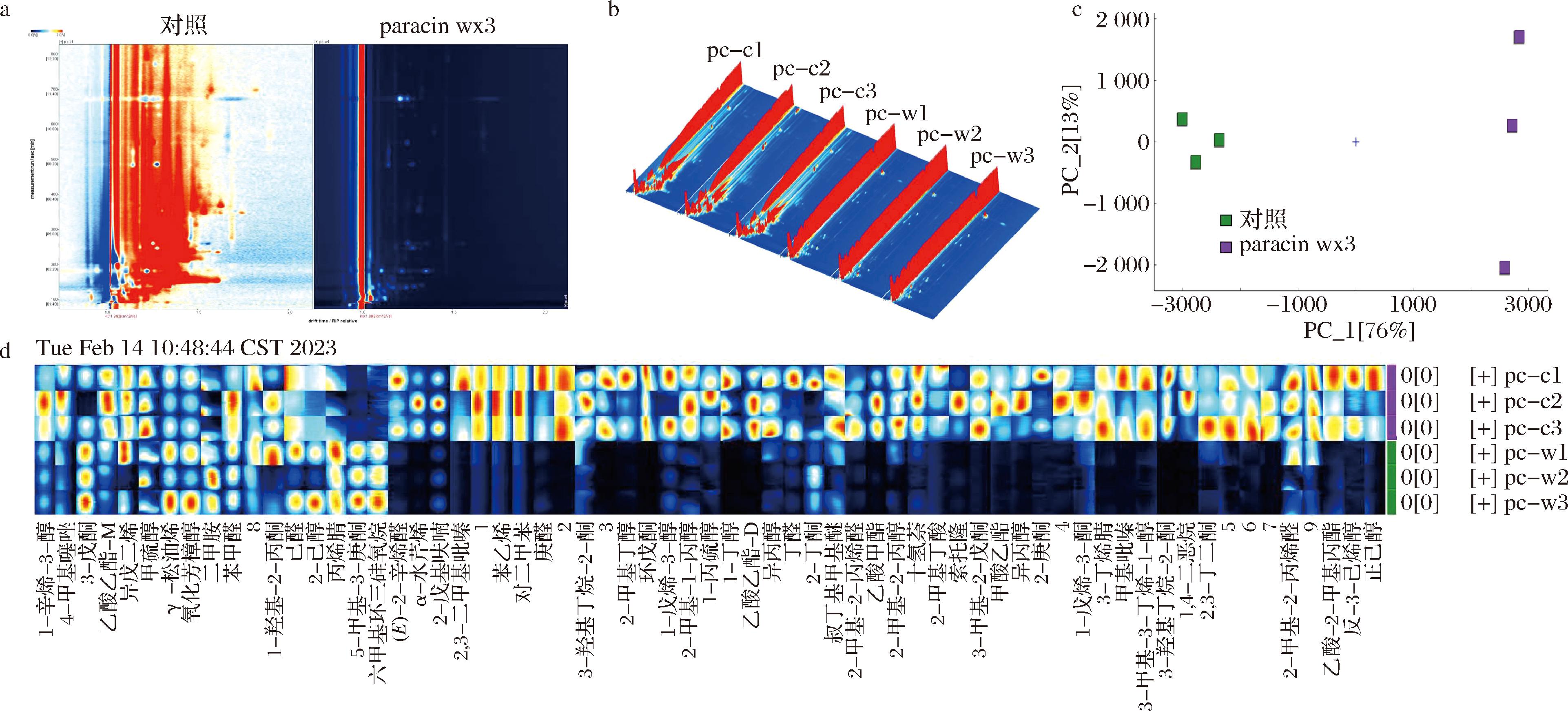
a-差异对比图(以处理为参照,从蓝色到红色表示浓度水平逐渐升高);b-挥发性物质三维图谱(c1、c2、c3为对照组,w1、w2、w3为处理组);c-主成分分析图;d-挥发性物质指纹图谱(颜色接近红色则相对浓度越高,近蓝色则越低。
图中末尾出字母M为单体物质,字母D为二聚体物质,单独数字为未知化合物。)
图6 辣椒挥发性风味物质的HS-GC-IMS图谱
Fig.6 HS-GC-IMS spectrum of volatile aroma substances of pepper
2.4.2 辣椒软腐关键挥发性物质预测
OPLS-DA是一种可以通过变量投影重要性(variable importance in projection,VIP)值判别组间代谢物差异的分析方式,可以通过S-plot预测相关性最强的代谢物。
由图7-a分析,模型中R2X[1]=0.707,特征值为4.24,R2X[2]=0.163,特征值为0.977,其中paracin wx3处理组分布比对照组更为集中。OPLS-DA内部关系图则代表了2种处理的组内关系,可以看出平行重复性均较佳(图7-b)。可解释度R2=0.998,拟和度Q2=0.989,均接近1,表明2组处理各自样品内部拟合度较高,且组间无出现线性拟合(图7-c)。VIP贡献值可以用来预测2组不同处理的挥发性化合物差异,VIP值>1时,2组存在差异,数值越高则差异越大。由图7-d可知,2组处理共存在33种不同挥发性物质。其中1
S-plot散点图可对不同挥发性化合物的影响程度进行预测,越靠近图像的两端代表影响力越大。如图7-e所示,自变量为负值时,影响力大的挥发性物质有5-甲基-3-庚酮、丙烯腈、二甲胺、3-戊酮、2-己醇等;自变量为正值时,影响力大的挥发性物质分别为对二甲苯、苯乙烯、3-丁烯、萘烷等。推测这些刺激性气味的生成量可能与辣椒腐烂状态有关,辣椒在受到果胶杆菌侵染发生软腐病害时会散发出恶臭,该臭味的来源可能是这些挥发性化合物。
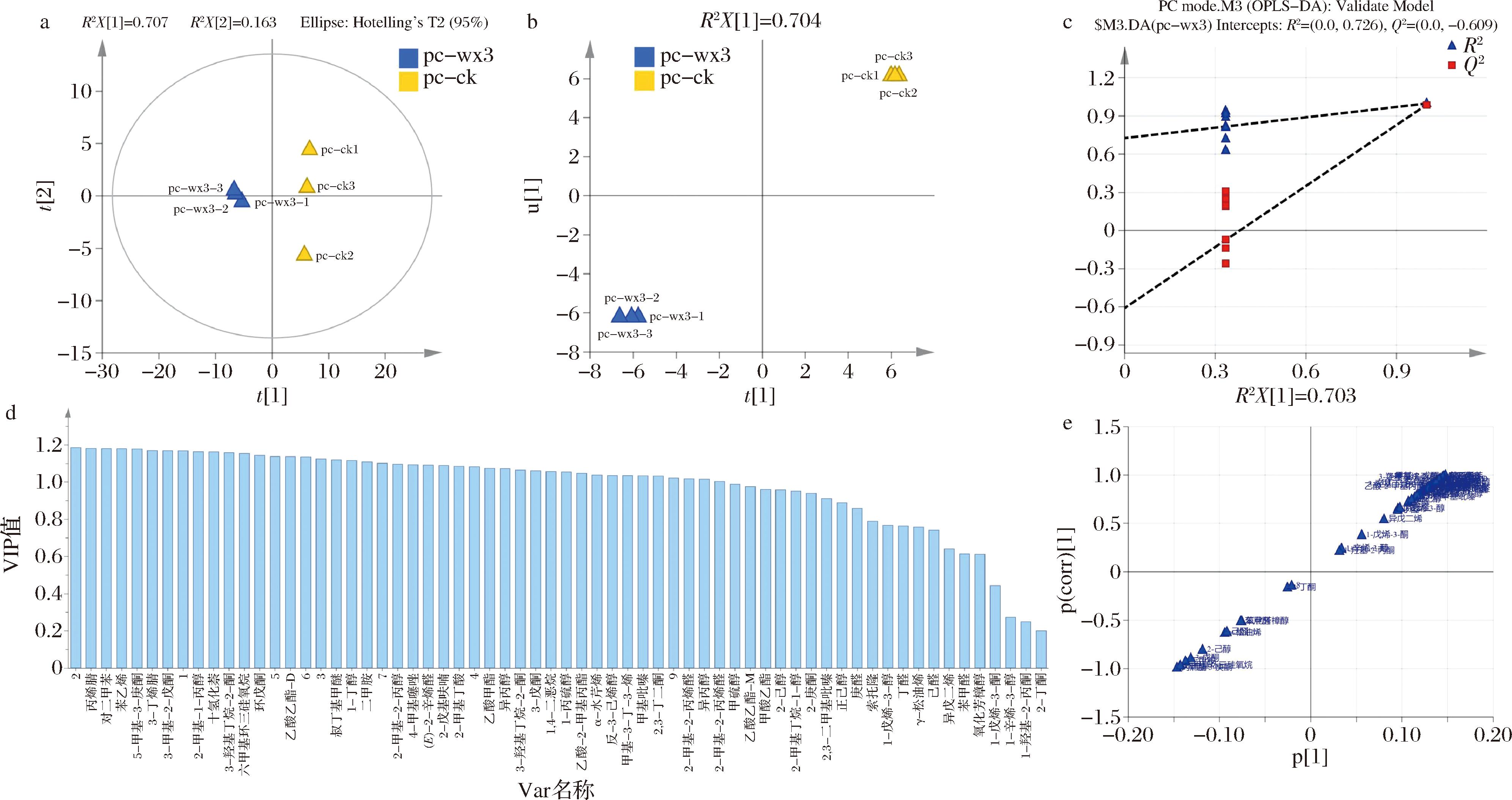
a-不同处理的主成分分析-X图(其中黄色为对照,蓝色为paracin wx3处理组);b-不同处理的内部关系图;c-不同处理的线性拟合图
(蓝色为可解释度R2,红色为拟和度Q2);d-VIP贡献值预测图(单独数字代表未知化合物);e-S-plot图
图7 OPLS-DA结果
Fig.7 OPLS-DA results
3 结论
副干酪乳酪杆菌WX322所产新型细菌素paracin wx3对辣椒软腐病原菌Pcc具有强抑菌活性,能够弥补商业化细菌素nisin的不足。细菌素paracin wx3可以有效控制辣椒软腐病,且细菌素浓度越高,控制效果越强,16 MIC则可以达到完全抑制辣椒软腐发病。细菌素paracin wx3主要通过在细胞膜上形成孔杀死Pcc,从而减少辣椒上果胶杆菌的数量,进而减轻辣椒软腐症状。细菌素paracin wx3处理也可以较好地维持辣椒贮藏期间的果实品质,延缓失水失重、果实软化,维持良好的果实颜色和果皮光泽,降低可溶性固形物的析出,并有效减少辣椒MDA的积累,维持较好的维生素C含量。此外,细菌素paracin wx3处理可以降低辣椒腐败过程中挥发性臭味物质的生成。综上所述,细菌素paracin wx3可以有效控制辣椒软腐病,延长辣椒贮藏期,为辣椒贮藏保鲜提供了一种绿色环保、高效安全的技术参考,具有良好的应用前景。
[1] XIE Z W, PENG W Y, MA Q Q, et al.Research progress on nutrient composition of green pepper[J].E3S Web of Conferences, 2021, 251:02064.
[2] 肖晶, 陈维信, 刘爱媛, 等.辣椒采后病害发生情况[J].中国蔬菜, 2008(6):13-16.XIAO J, CHEN W X, LIU A Y, et al.Situation of post-harvest diseases of pepper[J].China Vegetables, 2008(6):13-16.
[3] TIAMIYU Q O, ADEBAYO S E, IBRAHIM N.Recent advances on postharvest technologies of bell pepper:A review[J].Heliyon, 2023, 9(4):e15302.
[4] 刘秀云. 辣椒软腐病综合防治技术[J].西北园艺, 2022(9):49-51.LIU X Y.Comprehensive control techniques of pepper soft rot[J].Northwest Horticulture, 2022(9):49-51.
[5] 马俊秀, 闫更轩, 陈盛宇, 等.蔬菜软腐病生物防治策略研究进展[J].湖北农业科学, 2022, 61(13):51-57.MA J X, YAN G X, CHEN S Y, et al.Research progress on biological control strategies of vegetable soft rot[J].Hubei Agricultural Sciences, 2022, 61(13):51-57.
[6] LI X Y, FU L, CHEN C L, et al.Characteristics and rapid diagnosis of Pectobacterium carotovorum ssp.associated with bacterial soft rot of vegetables in China[J].Plant Disease, 2020, 104(4):1158-1166.
[7] 黄宇飞. 胡萝卜软腐果胶杆菌巴西亚种全基因组解析及致病相关基因功能研究[D].沈阳:沈阳农业大学,2019.HUANG Y F.Analysis of whole genome and pathogenic related gene function of Pectobacterium carotovorum subsp.brasiliense[D].Shenyang:Shenyang Agricultural University, 2019.
[8] 张元元. 娃娃菜软腐病病原菌鉴定及高压脉冲电场抑菌机理的研究[D].南京:南京农业大学,2020.ZHANG Y Y.Identification of pathogenic bacteria causing soft rot in baby cabbage and study on bacteriostatic mechanism of high pulsed electric field[D].Nanjing:Nanjing Agricultural University, 2020.
[9] JEONG R D, CHU E H, PARK D H, et al.Control of postharvest bacterial soft rot by gamma irradiation and its potential modes of action[J].Plant Pathology Journal, 2016, 32(2):157-161.
[10] 乔勇进, 甄凤元, 刘晨霞, 等.二氧化氯对果胶杆菌(P.carotovorum subsp.carotovorum)抑制效果的研究[J].上海农业学报, 2018, 34(6):74-80.QIAO Y J, ZHEN F Y, LIU C X, et al.The inhibition study of chlorine dioxide on P.carotovorum subsp.carotovorum[J].Acta Agriculturae Shanghai, 2018, 34(6):74-80.
[11] PÉREZ-V ZQUEZ M A K, PACHECO-HERN
ZQUEZ M A K, PACHECO-HERN NDEZ Y, LOZOYA-GLORIA E, et al.Peppermint essential oil and its major volatiles as protective agents against soft rot caused by Fusarium sambucinum in cera pepper (Capsicum pubescens)[J].Chemistry &Biodiversity, 2022, 19(1):e202100835.
NDEZ Y, LOZOYA-GLORIA E, et al.Peppermint essential oil and its major volatiles as protective agents against soft rot caused by Fusarium sambucinum in cera pepper (Capsicum pubescens)[J].Chemistry &Biodiversity, 2022, 19(1):e202100835.
[12] 梁欢, 徐进, 王晓宁, 等.11种杀菌剂对马铃薯软腐病的防治效果[J].植物保护, 2020, 46(5):309-315.LIANG H, XU J, WANG X N, et al.Control effects of eleven bactericides on potato soft rot[J].Plant Protection, 2020, 46(5):309-315.
[13] 李晓芬, 李广, 曾凯芳, 等.植物乳杆菌LAB2对辣椒软腐病的控制作用及辣椒贮藏品质的影响[J].食品与发酵工业, 2023, 49(17):136-144.LI X F, LI G, ZENG K F, et al.Soft rot controlling of pepper by Lactobacillus plantarum LAB2 and its effect on storage quality of pepper[J].Food and Fermentation Industries, 2023, 49(17):136-144.
[14] 李广, 李晓芬, 易兰花.拮抗菌枯草芽孢杆菌1151及其所产抗菌肽对辣椒采后软腐病的控制作用[J].食品与发酵工业, 2023, 49(10):78-84.LI G, LI X F, YI L H.Control effect of antagonistic Bacillus subtilis 1151 and its antimicrobial peptides on soft rot of postharvest pepper[J].Food and Fermentation Industries, 2023, 49(10):78-84.
[15] LI G, LI X F, ZHANG T F, et al.Controlling soft rot of postharvest chilli pepper (Capsicum annuum L.) by an antagonist Bacillus amyloliquefaciens S917:Efficacy and action mode[J].Biological Control, 2023, 178:105133.
[16] VU N T, KIM H, LEE S, et al.Bacteriophage cocktail for biocontrol of soft rot disease caused by Pectobacterium species in Chinese cabbage[J].Applied Microbiology and Biotechnology, 2023, 108(1):11.
[17] G LVEZ A, ABRIOUEL H, L
LVEZ A, ABRIOUEL H, L PEZ R L, et al.Bacteriocin-based strategies for food biopreservation[J].International Journal of Food Microbiology, 2007, 120(1-2):51-70.
PEZ R L, et al.Bacteriocin-based strategies for food biopreservation[J].International Journal of Food Microbiology, 2007, 120(1-2):51-70.
[18] 姚文俊, 杨勇, 刘希, 等.微生物源乳酸链球菌素(Nisin)及在食品中应用研究进展[J].中国调味品, 2023, 48(1):215-220.YAO W J, YANG Y, LIU X, et al.Research progress of nisin from microorganism and its application in food[J].China Condiment, 2023, 48(1):215-220.
[19] QI T, WANG S P, DENG L L, et al.Controlling pepper soft rot by Lactobacillus paracasei WX322 and identification of multiple bacteriocins by complete genome sequencing[J].Food Control, 2021, 121:107629.
[20] 祁腾. Lactobacillus paracasei WX322产细菌素的挖掘、异源表达及其对辣椒细菌性软腐病的控制研究[D].重庆:西南大学,2021.QI T.Mining and heterologous expression of bacteriocins produced by Lactobacillus paracasei WX322 and its controlling pepper bacterial soft rot[D].Chongqing:Southwest University, 2021.
[21] YI L H, ZENG P, WONG K Y, et al.Controlling Listeria monocytogenes in ready-to-eat leafy greens by amphipathic α-helix peptide zp80 and its antimicrobial mechanisms[J].LWT, 2021, 152:112412.
[22] WANG Q, DING T, ZUO J H, et al.Amelioration of postharvest chilling injury in sweet pepper by Glycine betaine[J].Postharvest Biology and Technology, 2016, 112:114-120.
[23] YI L H, QI T, LI X F, et al.Controlling soft rot of green pepper by bacteriocin paracin wx3 and its effect on storage quality of green pepper[J].Food Chemistry, 2024, 447:138962.
[24] BYLESJÖ M, RANTALAINEN M, CLOAREC O, et al.OPLS discriminant analysis:Combining the strengths of PLS-DA and SIMCA classification[J].Journal of Chemometrics, 2006, 20(8-10):341-351.
[25] NOURI M, BAGHAEE-RAVARI S, EMADZADEH B.Nano-emulsified savory and thyme formulation show limited efficacy to suppress Pectobacterium carotovorum subsp.carotovorum compared with pure oil[J].Industrial Crops and Products, 2021, 161:113216.
[26] WASANA W P, KURUPPUARACHCHI K A P P, YAPA P N, et al.Antimicrobial activity of selected spices against Pectobacterium carotovorum isolated from some vegetables in Sri Lanka[J].Journal of Science of the University of Kelaniya, 2019, 12:34-44.
[27] COTTER P D, ROSS R P, HILL C.Bacteriocins:A viable alternative to antibiotics?[J].Nature Reviews Microbiology, 2012, 11(2):95-105.