化学保鲜法在现代果蔬保鲜技术中发挥着不可替代的作用,迫切需要开发作用多元且安全性高的新型化学保鲜剂,来源于植物的天然化合物成为关注焦点。绿原酸(chlorogenic acid, CHA)是植物苯丙烷代谢途径上的关键产物,参与了植物的逆境防御反应[1],可用于采后保鲜。CHA处理可诱导苹果采后灰霉病抗性[2],抑制桃[3]和樱桃番茄[4]的采后病害,提高葡萄的采后贮藏品质[5]。此外,CHA能够活化人类免疫系统[6],无安全隐患,具备成为新一代保鲜剂的潜力,但其多元化的作用还有待挖掘。李子是我国重要的经济水果,但果实常温货架期短、低温适应性较差的生理特点制约运销半径,贮藏温度低于7 ℃时果实发生冷害,表现出果肉褐变、表皮坏死凹陷、风味劣变等症状[7],品质下降严重,亟需开发安全、高效、操作简便的冷害防控技术。研究发现CHA处理增强番茄幼苗[8]和柑橘植株[9]的抗寒能力,意味着CHA具有防控采后果蔬冷害的可能。本文研究了外源CHA处理对采后李果实抗冷能力的影响及其相关机制,旨在为新型李果实保鲜剂的开发提供新的理论依据和策略。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
试验材料为采自内蒙古自治区呼和浩特市李子种植园的‘大紫’李(Prunus salicina Lindl.cv ‘Dazi’)。选取生长状况良好的7龄果树初熟期果实,采收期为花后90~110 d,果面紫红色着色面积1/6~1/5,大小一致、无机械损伤及病虫害。
1.1.2 试剂
CHA、酚酸、木质素液相色谱标品,美国Sigma-Aldrich公司;RNA提取试剂盒,南京集思慧远生物科技有限公司;反转录试剂盒、qRT-PCR试剂盒,北京全式金生物技术股份有限公司;其他提取测定用化学试剂为国产分析纯。
1.2 主要仪器设备
CR-400色差计,日本柯尼卡美能达公司;GY-4数显果实硬度计,博特仪器有限公司;DDSJ-318电导率仪,上海仪电科学仪器股份有限公司;UV5紫外分光光度计,瑞士梅特勒托利多公司;Light Cycler 96荧光定量PCR仪,瑞士罗氏公司;1260InfinityⅡ高效液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 处理和取样方法
300颗符合实验要求的果实采收后立即运往实验室,于20 ℃放置24 h散去田间热后,以50颗为一个实验组,随机分为6组,随机选取其中3组使用50 mg/L 的CHA水溶液浸泡30 min,为CHA处理组;另外3组使用蒸馏水浸泡30 min,为对照组。
处理后果实自然晾干,放置于0 ℃(相对湿度90%)冷库贮藏。分别在贮藏的第0、10、20、30、40、50天进行冷害发生率和冷害指数统计,并从每个实验组中随机抽取5个果实,先进行色差和硬度检测,然后切制成1.0 cm×1.0 cm×1.0 cm立方体,用液氮速冻,再将从采用相同处理的实验组中抽取的果实冻样混匀,保存于-80 ℃超低温冰箱,用于其他生理指标检测。CHA处理组和对照组在每个取样时间点分别合计保存15个果实的果肉组织样本。
1.3.2 冷害发生率和冷害指数
参照文献[10]的方法。
冷害发生率:每个实验组中出现冷害症状的果实数量与该组取样时总果实数的比值,用%表示。
冷害指数:通过目测评估切面褐变面积百分比评判,具体分级标准如下:0级(无褐变)、1级(褐变面积<25%)、2级[25%~50%)、3级[50%~75%)和4级(≥75%),按公式(1)计算:
冷害指数![]()
(1)
每个实验组单独进行计算,对3个相同处理的实验组数据进行统计学分析。
1.3.3 L*值、a*值和硬度
硬度:对每个实验组中抽取的5个果实进行硬度测定。在每个果实的赤道处等距取3个点,削去测定位点果皮,使用果实硬度计测定。测定直径为8 mm,压入深度为10 mm。
L*值和a*值:对每个实验组中抽取的5个果实进行L*值和a*值测定。延腹缝线剖开果实,选取剖面上的3个点使用色差计测定果肉L*值和a*值,测色光斑直径为10 nm。
1.3.4 细胞膜稳定性及抗氧化酶活性
离子渗透率和丙二醛(malondialdehyde,MDA)含量,多酚氧化酶(polyphenol oxidase,PPO)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性的测定,参照文献[10]的方法测定。
1.3.5 原果胶和可溶性果胶含量
参考曹建康等[11]的方法稍作调整。称取1.0 g样品在体积分数95%的乙醇(下同)中研磨匀浆,煮沸20 min,10 000 r/min离心,收集上清液,沉淀重复上述步骤3次,合并上清液,定容到100 mL,加入咔唑试剂读取530 nm处吸光值,采用半乳糖醛酸标准溶液制作标准曲线,换算结果为可溶性果胶含量,单位为mg/g。将沉淀加入5 mL 0.5 mol/L硫酸煮沸1 h,离心收集上清液并定容到100 mL,进行与可溶性果胶同样的测定操作,将换算后的结果与可溶性果胶含量相加得到原果胶含量,单位为mg/g。每个指标每个取样点重复测定3次。
1.3.6 质地相关酶活性测定
多聚半乳糖醛酸酶(polygalacturonas,PG)活性测定参考曹建康[11]的方法,稍作调整。取10.0 g果实冻样用20 mL预冷乙醇(95%)研磨后离心,收集沉淀加入10 mL预冷乙醇(80%),振荡浸提10 min,离心后向沉淀物中加入5 mL pH 5.5的50 mmol/L乙酸-乙酸钠缓冲液,混匀、离心,上清液作为酶提取液。测定:0.5 mL酶提取液与1.5 mL底物(1%多聚半乳糖醛酸溶液)在37 ℃反应1 h后定时加入1.5 mL 3,5-二硝基水杨酸试剂煮沸反应5 min,然后冷却并稀释至25 mL,测定540 nm处吸光值。以标准浓度的葡萄糖溶液作为标准曲线。
β-半乳糖苷酶(β-galactosidase,β-GAL)活性测定参考曹建康等[11]的方法,提取方式同上。测定体系:0.5 mL酶提取液与1.5 mL底物(10 mmol/L水杨苷溶液),反应条件和测定方法同上。
纤维素酶(cellulase,Cx)活性测定参考曹建康等[11]的方法,提取方式同上。测定体系:0.5 mL酶提取液与1.5 mL底物(10 g/L羧甲基纤维素溶液),反应条件和测定方法同上。
1.3.7 总酚、酚酸、木质素、木质素单体含量测定
1.3.7.1 总酚含量
参照文献[10]的方法测定。
1.3.7.2 酚酸含量
1.0 g样品加入10 mL 甲醇溶液(85%)95 ℃水浴提取2 h,过滤并用提取液清洗残渣2次,合并提取液,减压蒸馏至5 mL左右时改为氮气吹干,甲醇(85%)溶解结晶定容到5 mL。0.45 μm微孔滤膜过滤后供液相分析。色谱条件:流动相A乙腈;流动相B 0.5%乙酸水溶液;C18反向柱;柱温30 ℃、流速1.0 mL/min、检测波长275 nm、进样量10 μL。用6种酚酸(CHA、咖啡酸、p-香豆酸、阿魏酸、芥子酸、反式肉桂酸)标准品制作混合标准曲线,采用外标法计算含量。每个指标每个取样点重复测定3次[12]。
1.3.7.3 木质素含量
采用乙酰溴法测度木质素含量。将10 g样品用50 mL 75%乙醇溶液研磨后离心,沉淀置于50 ℃条件下烘干水分,加入25%乙酰溴溶液(冰乙酸溶解)于70 ℃反应30 min。冷却后加入1 mL NaOH、0.1 mL盐酸羟胺,用冰乙酸定容至10 mL,取1 mL上清液定容至4 mL,于280 nm测OD值。每个指标每个取样点重复测定3次[12]。
1.3.7.4 木质素单体含量
10 g用50 mL乙酸乙酯超声波提取30 min后离心,上清液减压蒸馏至体积为5 mL左右后改为N2吹干,晶体加入1 mL甲醇复溶,过0.45 μm滤膜,作为液相色谱备用。色谱条件:C18反相柱,流动相为甲醇(A)和0.1%磷酸水溶液(B),梯度洗脱程序(0~10 min,20%~45%A;10~15 min,45%~60%A);流速1.0 mL/min,柱温30 ℃,二极管阵列检测器,检测波长280 nm,进样量10 μL。松柏醇、对香豆醇、芥子醇标准品制作标准曲线,采用外标法计算3种单体含量[13]。每个指标每个取样点重复测定3次。
1.3.8 PsPL、PsCASE、PsDREB、PsCBF相对表达量
RNA提取、反转录、qRT-PCR条件采用实验室已建立的针对相同试材的方法[10],采用PsACTIN作为内参基因,引物信息见表1,基因信息来源于NCBI。
表1 引物信息
Table 1 Primer information

基因名称基因ID正向引物反向引物PsACTINLOC18779708TCCAGCAGCTTCCATTCCAATTTGCCCTGGACTATGAGCAAGPsPLLOC109948128TGGCAAATCCTCTTGCTTGTGATCAGCCTCAATCTGAACTTGAACPsCASELOC18787014TCCACTAGTCCGACGGTTGTCTTACAACTGCTTTGCGGCTPsDREBLOC117627721CGTGGAAACTGAAGCTGATGCACCTACAATCTTTATCAGCAACT-CAPsCBFLOC18776669CCAGGATATGGCTCGGGACTTCATCACTGCTGCCGTTGC
1.3.9 数据分析及图表制作
各指标测定值均取平行数据平均值,对数据进行方差分析(ANOVA);利用邓肯多重方法对数据进行差异性显著分析(P<0.05为显著),使用Origin 2024绘制点线图和柱状图;采用皮尔逊(Pearson)相关性分析法对各指标进行相关性分析,相关性热力图采用联川生物云平台绘制,Inkscape编辑文字并转置格式。
2 结果与分析
2.1 CHA处理对李果实冷害发生率和冷害指数的影响
图1-a结果显示,0 ℃(相对湿度90%)贮藏条件下初熟期采摘的李果实冷害发生率随着贮藏时间的延长持续上升,贮藏第50天时对照组冷害发生率达到90%;相同条件下CHA处理组冷害发生率始终显著低于对照组(P<0.05),第50天时为75%。果实冷害指数也随着贮藏时间的延长持续上升(图1-b),贮藏第50天时,对照组果实冷害指数达到0.41;CHA处理组冷害指数也始终显著低于对照组(P<0.05或P<0.01),第50天时为0.30。贮藏第50天时,CHA处理组与对照组的冷害发生率之比为0.83,冷害指数之比为0.73,冷害指数下降幅度大于冷害发生率,外源CHA处理能够缓解采后李果实的冷害发生。
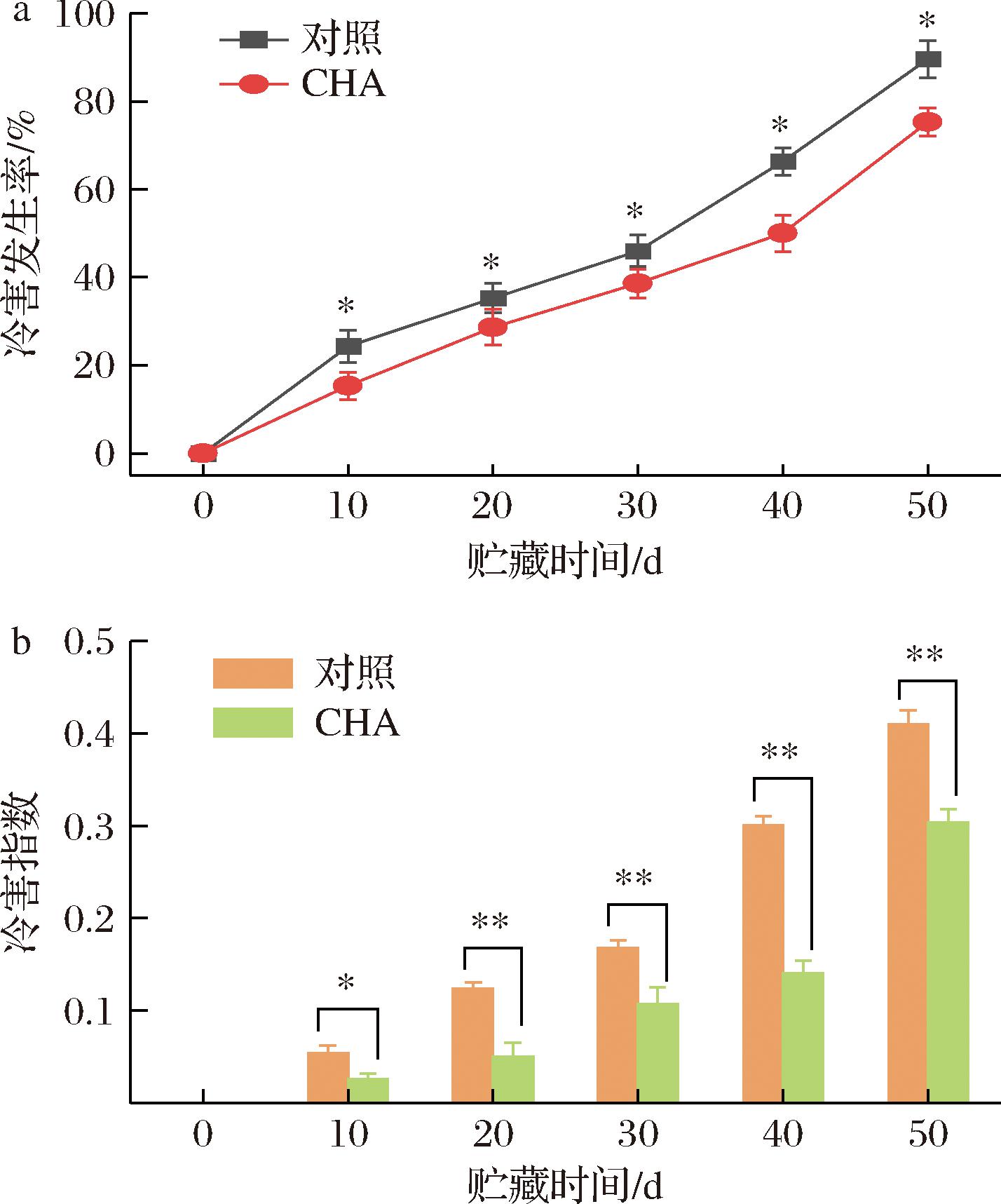
a-冷害发生率;b-冷害指数
图1 CHA处理对0 ℃贮藏期间李果实冷害发生率和冷害指数的影响
Fig.1 Effects of chlorogenic acid treatment on chilling injury incidence and chilling injury index in plum fruit during storage at 0 ℃
注:*表示P<0.05;**表示P<0.01;***表示P<0.001(下同)。
2.2 CHA处理对李果实色泽和PPO活性的影响
L*值表示果肉亮度,与褐变程度负相关。如图2-a所示,对照组果实L*值在贮藏第20天时低于50,第50天时低于25,有棕褐色物质出现,CHA处理组果实L*值始终显著高于对照组(P<0.05),直到贮藏第30天时仍维持在50以上,没有明显的褐色物质产生。果实于初熟期采摘,少量叶绿素导致a*值初始为负值,随着叶绿素分解,a*值升高。本品种正常成熟时果肉颜色为淡黄色,a*值为正但上升缓慢,对照组a*值上升速度快且数值较高(图2-a),是果肉褐变初期产生的红棕色物质引起,但贮藏第20天后褐变程度过高,有褐色物质生成,a*值又呈现下降趋势,与L*值低于50的时间点相同。CHA处理组a*值贮藏期间始终显著低于对照组(P<0.05或P<0.01),且没有观察到下降的趋势,意味着没有明显的棕褐色出现,褐变程度低于对照组。图2-c结果显示,对照组果实PPO活性在贮藏第20天和第30天时具有明显的高峰,与L*值迅速下降和a*值迅速升高的时间段相对应,而CHA处理组果实PPO活性贮藏期间没有明显的峰值出现,在第10、20、30和50天显著低于对照组(P<0.05或P<0.01)。CHA处理显著抑制PPO活性,并影响褐变进程。
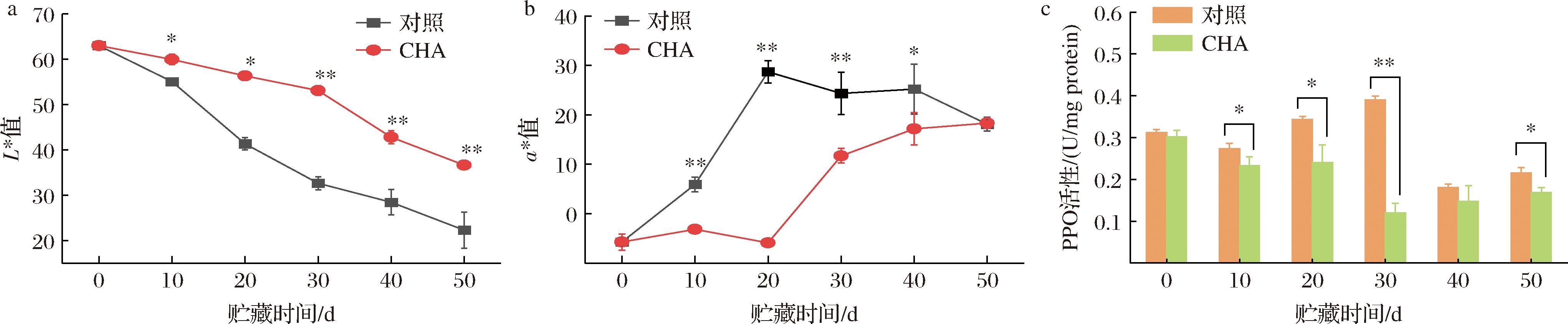
a-L*值;b- a*值;c-PPO活性
图2 CHA处理对0 ℃贮藏期间李果实色泽和PPO活性的影响
Fig.2 Effects of CHA treatment on color indexes and PPO activity in plum fruit during storage at 0 ℃
2.3 CHA处理对李果实细胞膜稳定性及抗氧化酶活性的影响
离子渗透率与细胞膜完整性呈负相关。图3-a显示采后离子渗透率呈上升趋势,在不同实验组中离子渗透率上升的速率有较大差异,对照组果实离子渗透率上升迅速,贮藏结束时接近80%,CHA处理组果实李子渗透率在贮藏期间始终显著低于对照组(P<0.01),贮藏结束时上升至65%。CHA处理果实细胞膜完整性更好。MDA积累意味着氧化损伤。图3-b显示贮藏期间果实的MDA不断积累,但CHA处理组MDA含量上升速度小于对照组,贮藏第30天以后MDA含量显著低于对照组(P<0.05或P<0.01),说明低温胁迫加速了李果实的衰老,CHA处理缓解氧化损伤。
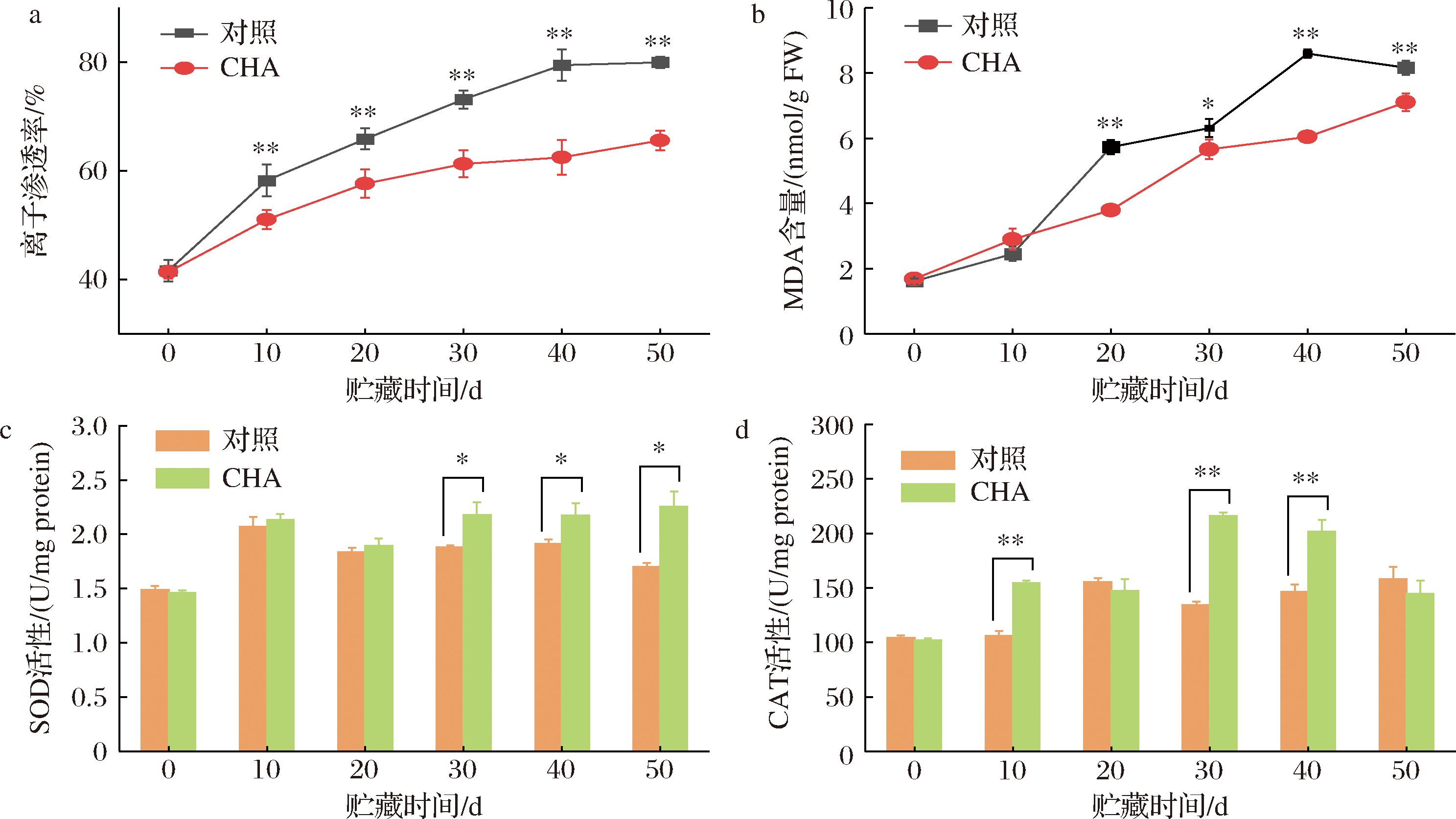
a-离子渗透率;b-MDA含量;c-SOD活性;d-CAT活性
图3 CHA处理对0 ℃贮藏期间李果实细胞膜稳定性及抗氧化酶活性的影响
Fig.3 Effects of CHA treatment on cell membrane stability and antioxidant enzyme activity in plum fruit during storage at 0 ℃
SOD和CAT是细胞内最重要的抗氧化酶,能够减轻细胞的氧化损伤。图3-c结果显示,对照组SOD活性在贮藏第10天时上升到初始值的1.4倍,随后有所下降,说明冷胁迫对于SOD一定程度上具有诱导作用;CHA处理组果实的SOD活性则在贮藏期间始终保持在相对较高的活性,在贮藏第30天以后显著高于对照组(P<0.05),最高达到贮藏初期的1.5倍。图3-d结果显示,对照组CAT活性从贮藏第20天以后上升1.3~1.5倍,晚于SOD活性上升时间,CHA处理组果实CAT活性从贮藏第10天时开始上升,早于对照组,在贮藏第10、30和40天时显著高于对照组(P<0.01),最高达到贮藏初期的2.2倍。表明CHA处理提高了采后李果实的抗氧化能力。
2.4 CHA处理对李果实质地相关指标及酶活性的影响
李果实成熟期硬度会自然下降,但软化过快是冷害引发的次生伤害,影响耐贮性。图4-a显示对照组果实硬度在贮藏第30天之前急速下降,与褐变速度最快的时期相对应,说明硬度下降也与发生冷害有关。而CHA处理组果实硬度在贮藏期间始终显著高于对照组(P<0.05),表明处理能够缓解冷害引发的硬度下降。
果实软化的主要原因是果胶和纤维素水解导致的细胞壁解体。图4-b、图4-c显示贮藏期间对照组和处理组的可溶性果胶含量持续上升,相应的原果胶含量持续下降,但变化速度不同,对照组果实可溶性果胶含量上升速度和原果胶含量的下降速度比处理组快,贮藏期间对照组可溶性果胶含量始终显著高于处理组(P<0.05),而原果胶含量则显著低于对照组(P<0.05或P<0.01)。PG催化多聚半乳糖醛酸裂解,导致果胶解聚,图4-d显示对照组果实的PG活性在贮藏期间整体呈现上升趋势,贮藏末期时(第50天)PG活性上升到贮藏初期(第0天)的3.48倍,而CHA处理组PG活性始终显著低于对照组(P<0.05或P<0.01),贮藏末期最高值为贮藏初期的1.89倍。β-GAL分解具有半乳糖苷键结构的多糖,参与果胶和纤维素的解聚。图4-e显示,对照组果实在贮藏第30天出现了明显的β-GAL活性峰值,与褐变和硬度急剧下降的时间段相对应,而CHA处理组果实的β-GAL不仅活性峰值推迟到贮藏第40天出现,且贮藏期间始终显著低于对照组(P<0.05或P<0.01)。Cx是催化纤维素水解的主要酶,其活性上升经常伴随着逆境的出现。图4-f显示对照组李果实Cx持续上升,贮藏末期活性达到初期的4.73倍,而CHA处理组果实的Cx活性上升较慢,贮藏末期时仅上升到初期的2.76倍,在贮藏期间始终显著低于对照组(P<0.05或P<0.01)。CHA处理延缓了细胞壁降解,维持果实硬度。
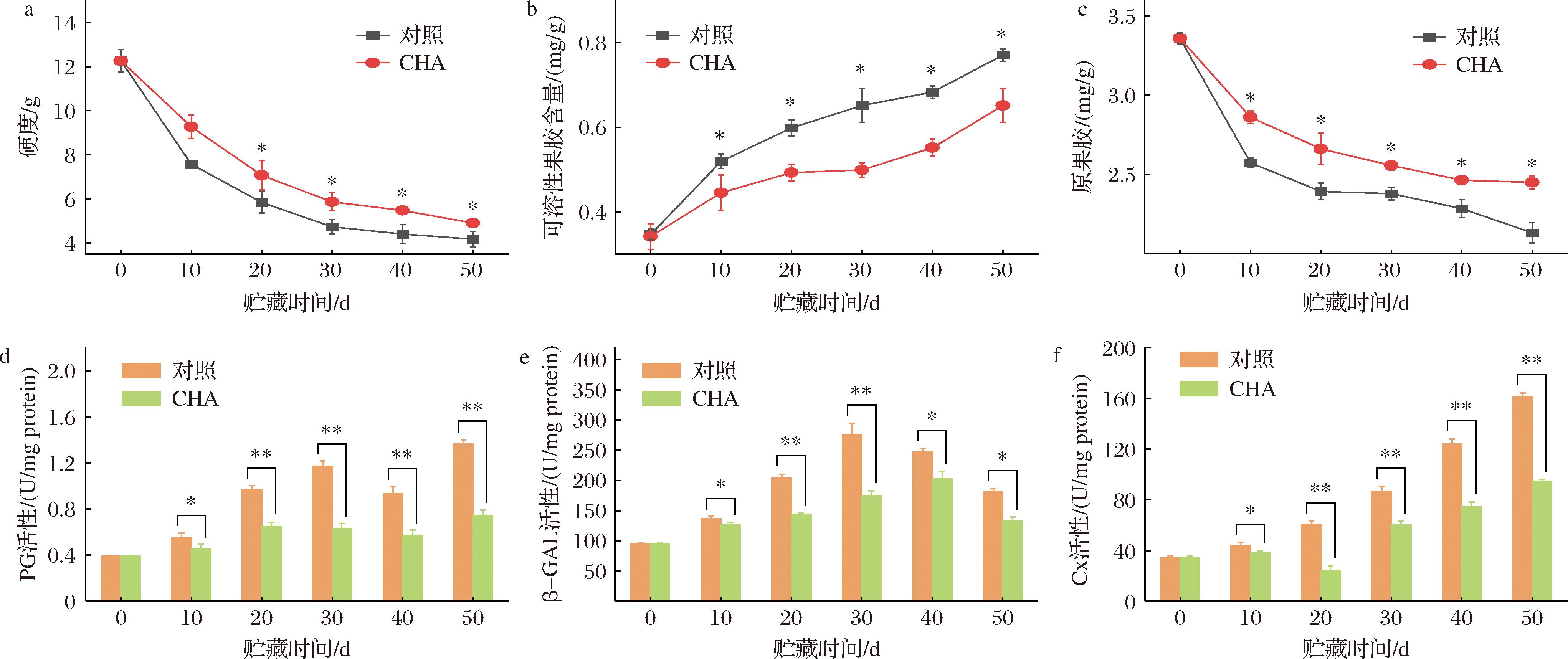
a-果实硬度;b-可溶性果胶含量;c-原果胶含量;d-PG活性;e-β-GAL活性;f-Cx活性
图4 CHA处理对0 ℃贮藏期间李果实质地和酶活性的影响
Fig.4 Effects of CHA treatment on texture and enzyme activity in plum fruit during storage at 0 ℃
2.5 CHA处理对李果实抗冷和细胞壁物质代谢相关基因表达量的影响
PL编码果胶裂解酶的合成,导致原果胶分解。图5-a显示对照组李果实PsPL表达量在贮藏第10天的峰值后持续下降,CHA处理组果实PsPL无明显峰值,表达量持续下降并始终显著低于对照组(P<0.05)。CASE是编码纤维素合成酶的基因,具有加强细胞壁的作用,图5-b结果显示,对照组果实PsCASE表达量在贮藏初期(0~20 d)下降迅速,表明低温胁迫导致可能影响细胞壁的合成和稳定性,而CHA处理组果实中PsCASE表达量下降速度较慢,在贮藏第10、20、40和50天显著高于对照组(P<0.05)。上述结果意味着CHA处理对于细胞壁结构的稳定作用发生在转录水平。
植物DREB/CBF转录因子作为AP2/ERF转录因子家族的重要成员,参与了植物非生物逆境应答过程,其中干旱应答元件结合蛋白(dehydration responsive element binding protein, DREB)响应的逆境信号较为广泛,C重复序列结合子(C-repeat binding factor,CBF)转录因子则专一响应冷胁迫[14],二者均与活性氧清除相关基因表达有关[15]。图5-c、图5-d显示,2种转录因子均受到低温逆境的诱导,对照组中PsCBF响应冷胁迫更为积极,贮藏第10天时表达量开始显著升高,第20天到达高峰,随后有所下降,CHA的响应则出现在贮藏第30天,该时期同时也是表达量峰值,随后迅速下降。CHA处理组果实的PsDREB响应时间提前到贮藏第10天,并始终显著高于对照组(P<0.05或P<0.01),PsCBF表达量始终显著高于对照组(P<0.05或P<0.01),且贮藏中后期(贮藏第30~40天)仍然上升。说明CHA处理诱导了冷胁迫防御相关转录因子表达,提高了果实的低温适应性。
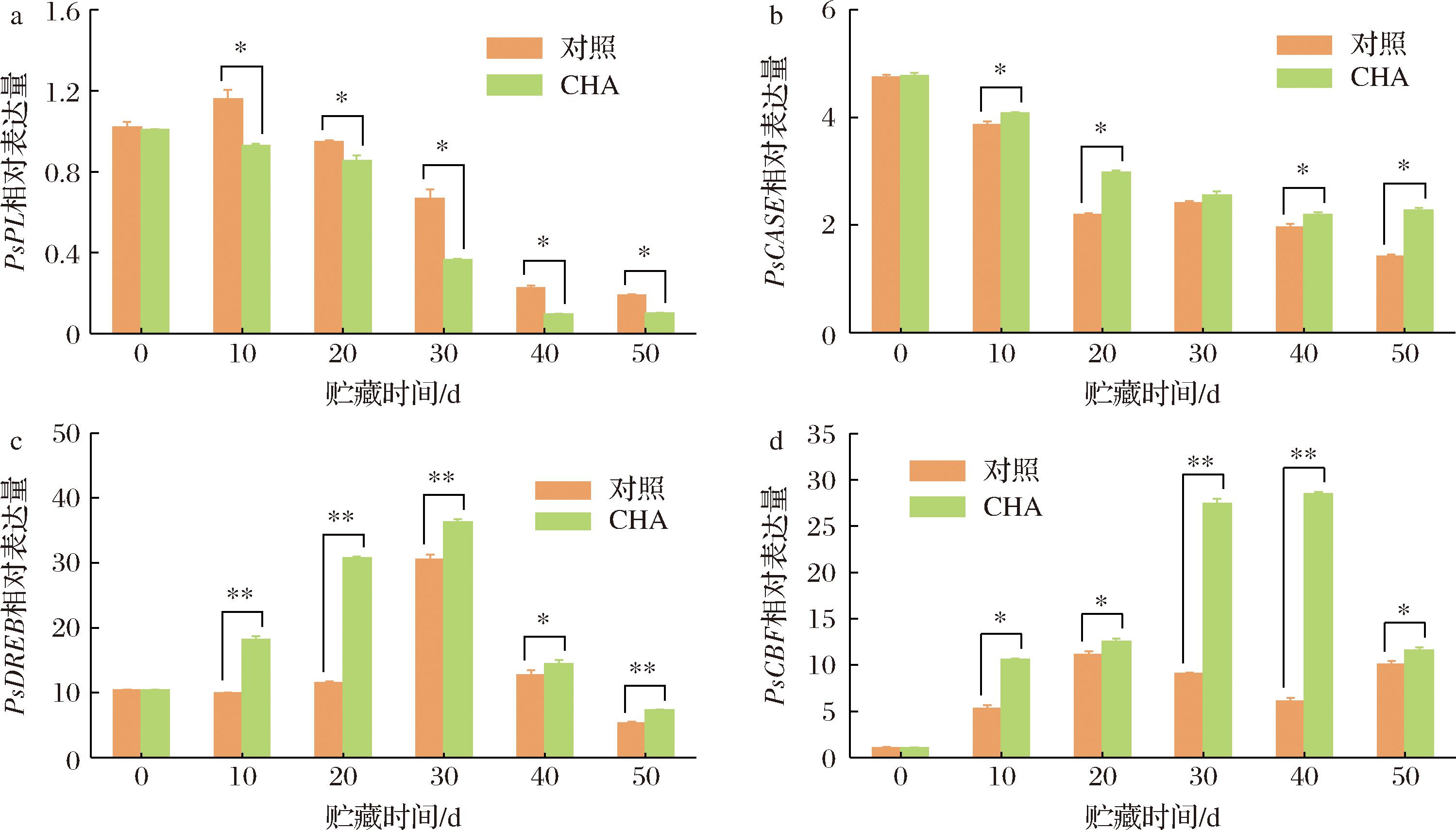
a-PsPL;b-PsCASE;c- PsCBF;d-PsDREB
图5 CHA处理对0 ℃贮藏期间李果实相关基因相对表达量的影响
Fig.5 Effects of CHA treatment on relative expression level of related genes in plum fruit during storage at 0 ℃
2.6 CHA处理对李果实木质素及单体含量的影响
由3种结构单体对香豆醇、松柏醇、芥子醇聚合形成的木质素是植物次生细胞壁的重要构成成分,参与植物的逆境胁迫防御,发挥抗氧化、稳定细胞壁,进而保护细胞膜的作用。表1显示在贮藏期间果实木质素总量先上升后下降,对照组果实木质素总量上升到贮藏第20天然后开始下降,CHA处理组果实木质素含量上升到贮藏第30天,峰值显著高于对照组(P<0.05),并在第20天以后始终显著高于同时期对照组(P<0.05)。贮藏第50天时,CHA组果实木质素平均含量为对照组的2.1倍。单体变化方面,李果实中的木质素单体以对香豆醇和松柏醇为主,CHA处理组对香豆醇平均含量提高42.5%,松柏醇平均含量提高74.2%,差异显著(P<0.05)。
2.7 CHA处理对李果实酚类物质含量的影响
酚酸具有抗氧化作用,并充当木质素单体的前体物质和信号分子诱导木质素合成。表2显示,贮藏期间李果实中的总酚含量在贮藏第30天出现峰值,CHA处理组在贮藏期间始终显著高于对照组(P<0.05),平均含量比对照组高13%。不同类型酚酸方面,CHA处理显著提高了CHA、咖啡酸和松柏醇前体阿魏酸的平均含量(P<0.05),其中CHA平均含量上升率最高,`提高23%。反式肉桂酸和对香豆醇前体p-香豆酸平均含量变化不显著(P>0.05),此外,芥子酸平均含量则从0.42 μg/g下降至0.36 μg/g,差异显著(P<0.05)。说明CHA处理提高芥子醇含量可能是通过促进芥子酸向芥子醇转化,但促进了阿魏酸合成,并向松柏醇转化。
表2 0 ℃贮藏期间不同处理‘大紫’李果实木质素及单体含量变化 单位:μg/g
Table 1 Changes of lignin and monomer contents of ‘Dazi’ plum fruit under different treatments during storage at 0 ℃
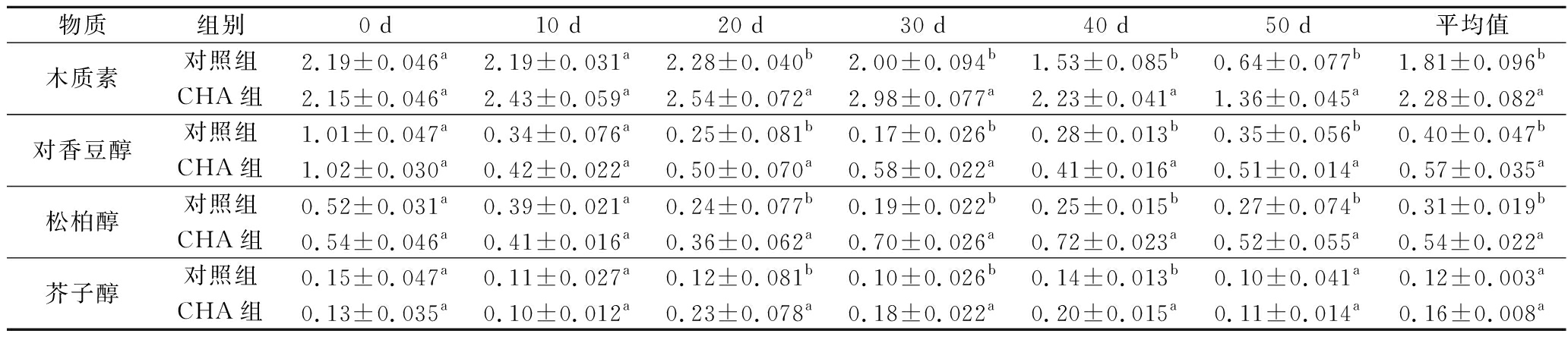
物质组别0 d10 d20 d30 d40 d50 d平均值木质素对照组2.19±0.046a2.19±0.031a2.28±0.040b2.00±0.094b1.53±0.085b0.64±0.077b1.81±0.096bCHA组2.15±0.046a2.43±0.059a2.54±0.072a2.98±0.077a2.23±0.041a1.36±0.045a2.28±0.082a对香豆醇对照组1.01±0.047a0.34±0.076a0.25±0.081b0.17±0.026b0.28±0.013b0.35±0.056b0.40±0.047bCHA组1.02±0.030a0.42±0.022a0.50±0.070a0.58±0.022a0.41±0.016a0.51±0.014a0.57±0.035a松柏醇对照组0.52±0.031a0.39±0.021a0.24±0.077b0.19±0.022b0.25±0.015b0.27±0.074b0.31±0.019bCHA组0.54±0.046a0.41±0.016a0.36±0.062a0.70±0.026a0.72±0.023a0.52±0.055a0.54±0.022a芥子醇对照组0.15±0.047a0.11±0.027a0.12±0.081b0.10±0.026b0.14±0.013b0.10±0.041a0.12±0.003aCHA组0.13±0.035a0.10±0.012a0.23±0.078a0.18±0.022a0.20±0.015a0.11±0.014a0.16±0.008a
注:不同小写字母代表同一时间的组间差异(P<0.05)(下同)。
表3 0 ℃贮藏期间不同处理‘大紫’李果实酚类物质(总酚及酚酸)含量变化 单位:μg/g
Table 3 Changes of phenolic substances (total phenol and phenolic acid) contents of ‘Dazi’ plum fruit under different treatments during storage at 0 ℃

物质组别0 d10 d20 d30 d40 d50 d平均值总酚对照组1.51±0.032a1.91±0.12b2.06±0.074b2.59±0.022b2.20±0.016b2.00±0.094b2.05±0.054bCHA组1.47±0.041a2.18±0.16a2.47±0.080a2.89±0.026a2.65±0.013a2.16±0.070a2.30±0.075aCHA对照组2.26±0.024a1.24±0.32b1.99±0.040a3.25±0.017b3.89±0.066b2.60±0.074b2.54±0.143bCHA组2.31±0.027a2.56±0.26a1.30±0.021b4.21±0.025a4.11±0.080a4.35±0.053a3.14±0.192a咖啡酸对照组1.08±0.019a0.59±0.051a0.38±0.041b0.16±0.022b1.01±0.041a0.11±0.031b0.56±0.063bCHA组1.05±0.024a0.15±0.026b0.64±0.077a0.55±0.023a1.13±0.092a0.47±0.025a0.67±0.056ap-香豆酸对照组0.13±0.077a0.15±0.037a0.042±0.051a0.11±0.070a0.17±0.015a0.053±0.01b0.11±0.008aCHA组0.14±0.016a0.040±0.072b0.066±0.023a0.053±0.042a0.15±0.021a0.21±0.023a0.11±0.010a阿魏酸对照组0.21±0.015a0.13±0.011b0.19±0.014b0.11±0.070a0.13±0.012a0.043±0.031b0.14±0.009bCHA组0.27±0.025a0.22±0.041a0.38±0.021a0.095±0.061a0.10±0.050a0.48±0.011a0.29±0.022a芥子酸对照组0.36±0.031a0.33±0.029a0.26±0.031b0.92±0.041a0.31±0.02a0.32±0.049a0.42±0.038bCHA组0.35±0.021a0.27±0.079b0.72±0.042a0.34±0.017b0.30±0.014b0.18±0.024b0.36±0.028a反式肉桂酸对照组2.15±0.034a1.20±0.061a0.41±0.050b0.49±0.031b0.96±0.015a0.43±0.087b0.94±0.103bCHA组2.10±0.071a0.72±0.081b0.72±0.041a1.41±0.031a0.73±0.027a1.01±0.051a1.12±0.084a
2.8 相关性分析
对全部指标进行正态性检验,满足正态性条件,因此进行皮尔逊相关性分析,结果如图6所示:冷害发生率和冷害指数与a*值、离子渗透率、MDA含量、可溶性果胶含量、PG活性、Cx活性呈显著正相关(P<0.01或P<0.001),与L*值、硬度、原果胶含量、木质素含量、PsCASE相对表达量呈显著负相关(P<0.01或P<0.001)。此外,PsCBF表达量与SOD和CAT活性以及总酚含量呈显著正相关(P<0.05或P<0.001),PsDREB表达量与总酚含量和木质素含量呈显著正相关(P<0.05或P<0.01)。意味这些指标之间可能存在一定的相互影响。
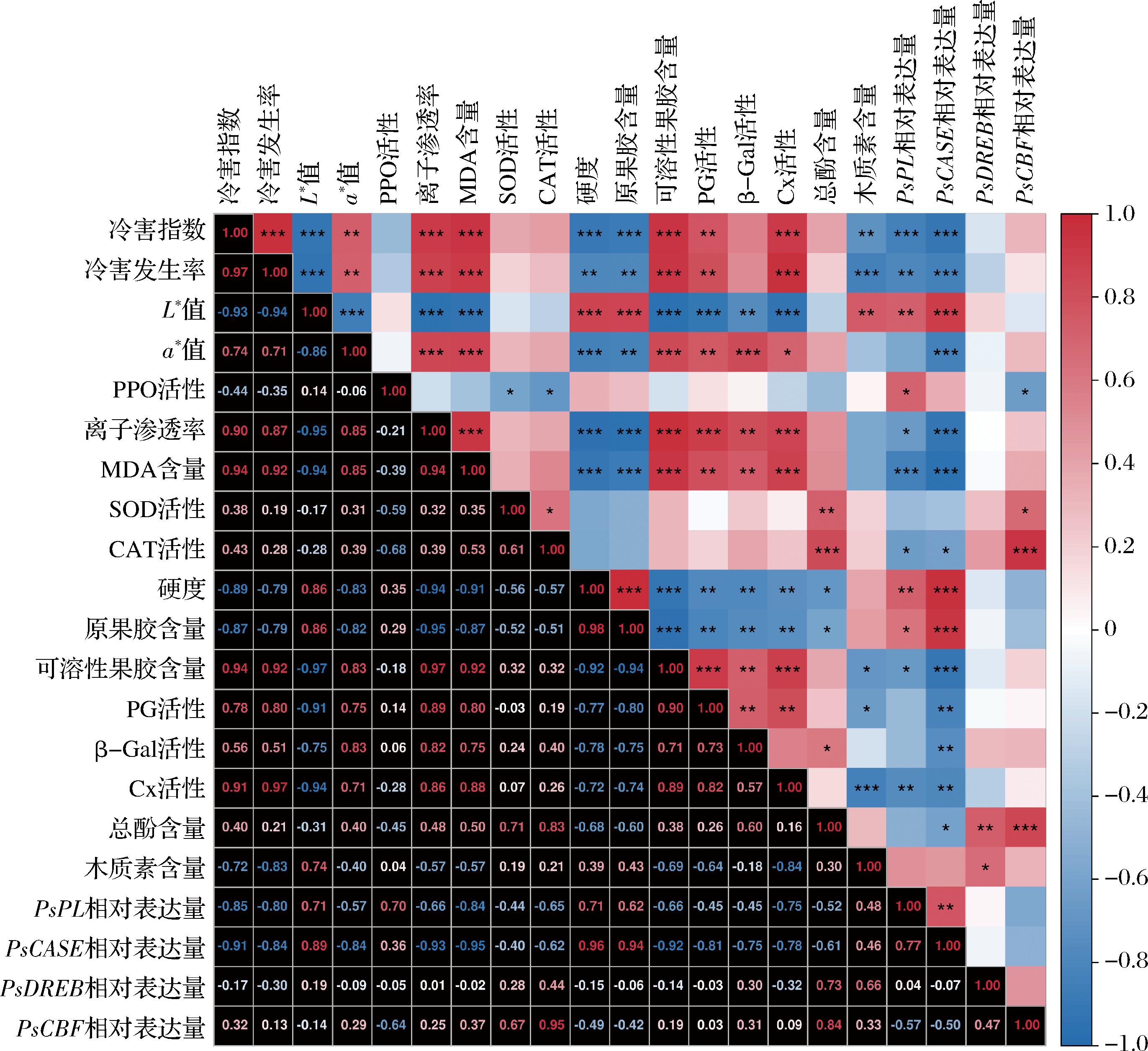
图6 相关性热图
Fig.6 Correlation heatmap
3 结论与讨论
冷害严重影响李果实的低温贮藏品质,主要表现为果肉组织褐变,PPO活性对褐变速率有决定性的作用,此外细胞膜的完整性也影响褐变发生。低温胁迫会刺激呼吸强度增加,即诱发胁迫呼吸,导致电子传递链上的电子渗漏加剧,继而产生大量的活性氧,活性氧积累造成氧化损伤,破坏细胞膜的完整性,PPO和底物接触的机率增加,引发褐变。与此同时,PPO作为重要的胁迫响应因子也会在冷胁迫的诱导下活性上升,褐变加剧。已有研究表明,CHA处理能够抑制PPO活性。CHA处理的鲜切马铃薯PPO活性和MDA积累量均显著降低,褐变受到抑制[16],CHA处理的金冠苹果在采后贮藏期间的PPO活性下降[17],赤褐色形成受到抑制。CHA属于酚酸,是植物活性氧清除体系的一部分,酚酸不仅直接清除活性氧,还能促使SOD、CAT等抗氧化酶活性的上升,该生理作用已经被证明在多种植物和果蔬组织中存在[18]。本研究也关注了CHA对李果实PPO活性和细胞膜氧化损伤的影响,发现CHA处理不仅抑制PPO活性,还维持了细胞膜的离子渗透率处于相对低的水平,降低了氧化损伤产物MDA的含量,并提高了贮藏期间果实SOD和CAT的活性。这些作用是CHA减轻低温胁迫引发的李果实褐变的重要原因。
软化是部分果蔬冷害后的重要次生伤害。对此现象的普遍解释为:低温胁迫刺激内源乙烯合成,乙烯进一步启动了编码果胶酶、纤维素酶的基因表达,加速果胶类物质、纤维素等细胞壁多糖降解,组织硬度随之下降。相应的,在一些植物中,遭遇不适宜低温环境时稳定或加强细胞壁结构,合成木质素,甚至产生次生细胞壁,则是应对低温伤害的策略之一[19]。木质素的合成不仅构成次生细胞壁,还减少了水分散失,维持细胞内水分平衡,避免因膜透性增加而导致的细胞脱水,因此木质素不仅强化细胞壁,也保护细胞膜[20]。木质素是聚合多酚,其单体的合成前体为酚酸(p-香豆酸、阿魏酸、芥子酸)。酚酸类物质响应逆境刺激,促进木质素合成,可直接捕捉活性氧,减轻细胞氧化损伤,充当信号分子激活苯丙烷代谢,参与包括低温逆境在内的非生物胁迫防御代谢[21]。CHA是一种重要的天然植物酚酸,已有研究发现,CHA能够通过调节内源乙烯合成酶的活性抑制苹果运输振动过程中的乙烯合成[22],进而减少包括软化在内的由振动损伤引起的不良生理变化;外源CHA处理金冠苹果果实圆片通过抑制乙烯合成和呼吸作用降低β-GAL的活性[23]。本研究结果表明,在李果实中,CHA抑制β-GAL活性的同时对于PG和Cx等其他受乙烯调节的细胞壁水解酶的活性和果胶裂解酶基因PsPL的表达具有抑制作用。此外CHA也已被证明对苯丙烷代谢和酚类物质的合成具有促进作用,CHA与海藻酸钠包衣复合处理可通过促进苯丙烷的代谢途径来促进梨果实的创面愈合[24],外源CHA还可以通过上调苯丙烷代谢以及香豆酸、肉桂酸等酚类物质的合成增加对苹果灰霉病的抗性[2]。本研究则显示了CHA在增加酚酸和木质素合成以增强李果实低温耐受性的作用,是对前人研究结果的补充和拓展。此外,本研究还观察到了CHA对李果实纤维素合成酶基因PsCASE和编码低温响应关键转录因子DREB/CBF基因PsDREB、PsCBF的上调作用,尽管这些作用还没有在其他研究中观察到,但基于CHA与低温胁迫响应的密切联系,这些作用可为未来深入探究CHA提高抗冷能力机制提供新的角度。
本研究表明,50 mg/L外源CHA浸泡处理显著提高了采后李果实的抗冷能力,处理组果实在0 ℃贮藏条件下的冷害发生率和冷害指数显著降低。CHA缓解冷害的机制包括:1)降低PPO活性,延缓果实褐变进程;2)提高SOD、CAT活性,减轻离子渗透率上升和MDA积累,维持细胞膜完整性;3)降低PG活性、β-GAL活性、Cx活性和PsPL表达,提高PsCASE表达,从而维持果实的硬度;4)促进木质素及其单体的合成,增强细胞壁的稳定性;5)上调冷胁迫应答基因PsDREB和PsCBF的表达,提高果实对低温的适应性。研究为CHA在采后李果实保鲜中的应用提供了理论依据。
[1] REINE JUDESSE SOVIGUIDI D, PAN R, LIU Y, et al.Chlorogenic acid metabolism:The evolution and roles in plant response to abiotic stress[J].Phyton, 2022, 91(2):239-255.
[2] 王大将, 刘洪冲, 张梦宇, 等.外源绿原酸对苹果自身绿原酸合成及灰霉病抗性的影响[J].中国食品学报, 2023, 23(3):309-317.WANG D J, LIU H C, ZHANG M Y, et al.Effects of exogenous chlorogenic acid on resistance to gray mold of apple and its own chlorogenic acid synthesis[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):309-317.
[3] DAI B E, WANG Y X, ZHOU H J, et al.Control efficiency and potential mechanisms of chlorogenic acid against postharvest gray mold caused by Botrytis cinerea on peach fruit[J].Postharvest Biology and Technology, 2024, 218:113134.
[4] KAI K, WANG R, BI W L, et al.Chlorogenic acid induces ROS-dependent apoptosis in Fusarium fujikuroi and decreases the postharvest rot of cherry tomato[J].World Journal of Microbiology and Biotechnology, 2021, 37(6):93.
[5] 焦泽铃, 余义和, 郭大龙, 等.绿原酸处理对‘巨峰’葡萄采后品质的影响[J].北方园艺, 2021(19):114-120.JIAO Z L, YU Y H, GUO D L, et al.Effects of chlorogenic acid immersion on postharvest quality of ‘kyoho’ grape[J].Northern Horticulture, 2021(19):114-120.
[6] XIAO Y, LI L L, HAN C, et al.Chlorogenic acid inhibits Pseudomonas toxin pyocyanin and activates mitochondrial UPR to protect host against pathogen infection[J].Scientific Reports, 2025, 15:5508.
[7] 王雅楠. 乙烯和抗氰呼吸参与水杨酸增强李果实采后抗冷能力机制的研究[D].呼和浩特, 内蒙古农业大学, 2020.WANG Y N.The mechanism of ethylene and cyanide-resistant respiration involved in salicylic acid to cold resistant postharvest plum[D].Hohhot;Inner Mongolia Agricultural University, 2020.
[8] 李艳梅, 姜丽娜, 孙向阳, 等.外源绿原酸对番茄幼苗低温耐性的生理调控效应[J].植物营养与肥料学报, 2024, 30(2):315-330.LI Y M, JIANG L N, SUN X Y, et al.Physiological regulation of exogenous chlorogenic acid on chilling tolerance of tomato seedlings[J].Journal of Plant Nutrition and Fertilizers, 2024, 30(2):315-330.
[9] XIAO P, QU J, WANG Y, et al.Transcriptome and metabolome atlas reveals contributions of sphingosine and chlorogenic acid to cold tolerance in Citrus[J].Plant Physiology, 2024, 196(1):634-650.
[10] YANG Y, GUO N, QIAO T, et al.1-methylcyclopropene reduced the cold resistance induced by salicylic acid in postharvest plum fruits during low-temperature storage[J].Journal of Food Processing and Preservation, 2025, 2025(1):5537961.
[11] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2017:85-90, 97-99.CAO J K, JIANG W B, ZHAO Y M.Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Indusry Ltd., 2017:85-90, 97-99.
[12] 乔婷. 抗氰呼吸调节苯丙烷代谢增强采后李果实低温耐受性机制的研究[D].呼和浩特:内蒙古农业大学, 2024.QIAO T.Cyanide resistant respiration regulates the mechanism of phenylpropane metabolism to enhance low-temperature tolerance in postharvest plum fruits[D].Hohhot:Inner Mongolia Agricultural University, 2024.
[13] REYES-RIVERA J, TERRAZAS T.Lignin analysis by HPLC and FTIR[M].Xylem.New York, NY:Springer New York, 2017:193-211.
[14] NIE Y Q, GUO L Y, CUI F Q, et al.Innovations and stepwise evolution of CBFs/DREB1 s and their regulatory networks in angiosperms[J].Journal of Integrative Plant Biology, 2022, 64(11):2111-2125.
[15] SHI Y T, DING Y L, YANG S H.Molecular regulation of CBF signaling in cold acclimation[J].Trends in Plant Science, 2018, 23(7):623-637.
[16] YOU W L, WANG C F, ZHANG J L, et al.Exogenous chlorogenic acid inhibits quality deterioration in fresh-cut potato slices[J].Food Chemistry, 2024, 446:138866.
[17] WANG L J, LI J H, GAO J J, et al.Inhibitory effect of chlorogenic acid on fruit russeting in ‘Golden Delicious’ apple[J].Scientia Horticulturae, 2014, 178:14-22.
[18] TO OVI
OVI J, MARKOVI
J, MARKOVI S, DIMITRI
S, DIMITRI MARKOVI
MARKOVI J M, et al.Antioxidative mechanisms in chlorogenic acid[J].Food Chemistry, 2017, 237:390-398.
J M, et al.Antioxidative mechanisms in chlorogenic acid[J].Food Chemistry, 2017, 237:390-398.
[19] LIU J, CHEN C J, CHEN L, et al.The banana MaFLA27 confers cold tolerance partially through modulating cell wall remodeling[J].International Journal of Biological Macromolecules, 2025, 290:138748.
[20] 杨帅, 高尚珠, 卢晗, 等.植物细胞壁形成及在非生物胁迫中的作用[J].植物生理学报, 2023, 59(7):1251-1264.YANG S, GAO S Z, LU H, et al.Plant cell wall development and its function in abiotic stress[J].Plant Physiology Journal, 2023, 59(7):1251-1264.
[21] AHLAWAT Y K, SINGH M, MANORAMA K, et al.Plant phenolics:Neglected secondary metabolites in plant stress tolerance[J].Brazilian Journal of Botany, 2024, 47(3):703-721.
[22] SHU C, ZHANG W L, ZHAO H D, et al.Chlorogenic acid treatment alleviates the adverse physiological responses of vibration injury in apple fruit through the regulation of energy metabolism[J].Postharvest Biology and Technology, 2020, 159:110997.
[23] XI Y, CHENG D, ZENG X Q, et al.Evidences for chlorogenic acid:A major endogenous polyphenol involved in regulation of ripening and senescence of apple fruit[J].PLoS One, 2016, 11(1):e0146940.
[24] ZHANG Y Q, ZHANG W L, WANG H X, et al.The combination treatment of chlorogenic acid and sodium alginate coating could accelerate the wound healing of pear fruit by promoting the metabolic pathway of phenylpropane[J].Food Chemistry, 2023, 414:135689.