近年来,微生物-肠-脑轴(microbiota-gut-brain axis,MGBA)逐渐成为神经精神疾病治疗领域的研究热点。MGBA机制揭示了肠道微生物与中枢神经系统(central nervous system,CNS)间复杂的相互作用,以及肠道微生物群影响大脑行为与功能的途径与机制。相关研究表明,神经精神疾病发作时常伴随着MGBA的失调[1],因此,调控MGBA机制可为神经精神疾病的治疗提供新的视角和策略,即利用益生菌、益生元和粪菌移植等方法调节肠道微生物群,重塑MGBA平衡,从而达到改善或治疗神经精神疾病的目的[2]。益生菌由于可定植于宿主体内,参与调节肠道微生物群结构和稳态的特点,引起了研究者们的广泛关注。研究表明,益生菌可以通过多种途径调节MGBA,这些途径主要包括刺激迷走神经[3]、调节免疫系统[4]及调控神经递质浓度[5]等方式,进而影响CNS功能。此外,益生菌还可以通过代谢短链脂肪酸(short-chain fatty acids,SCFAs)[6]和修复血脑屏障[7]等,直接/间接作用于大脑。研究进一步证实,益生菌通过对MGBA的调控,可有效缓解抑郁症(major depressive disorder,MDD)、阿尔兹海默症(Alzheimer’s disease,AD)及帕金森(Parkinson’s disease,PD)等多种神经精神疾病的症状,例如乳杆菌可增加MDD小鼠脑血清素和脑源性神经营养因子浓度[8];阿克曼氏菌可降低AD的关键生物标志物——淀粉样蛋白Aβ含量[9];此外,双歧杆菌可保护多巴胺能神经元并抑制PD小鼠的神经炎症[10]。因此补充益生菌可作为多种神经精神疾病潜在的治疗手段,具备巨大的医用潜力和应用前景。
随着神经精神疾病的发病率逐年增加,对益生菌制剂的市场需求持续攀升。然而,除乳杆菌及双歧杆菌等少数益生菌外,目前大部分益生菌发酵成本高昂、生产效率十分低下,制约了益生菌在神经精神疾病治疗领域的规模化临床应用。目前,在益生菌发酵领域,传统批次发酵工艺成熟,但受发酵周期长、培养基成本高的制约。连续发酵技术虽能提高生产效率,却因操作复杂、对发酵罐稳定性要求高,难以大规模工业化生产[11]。此外,多数益生菌对O2敏感的特性也增加了无氧发酵条件下的设备和能源成本。近年来,开发低成本的培养基(如利用农副产品废弃物)和探究提高益生菌产量的发酵策略(如发酵条件优化和高密度发酵技术)成为研究的热点,但这些研究成果在工业应用中仍需进一步优化。为满足临床研究对益生菌制剂日益增长的需求,开发低成本高效率的益生菌发酵生产工艺变得至关重要。本文首先聚焦益生菌通过MGBA治疗神经精神疾病的机制与潜力。其次,为应对益生菌生产效率低下的挑战,总结了一系列发酵工艺优化策略,为益生菌制剂开发及其在神经精神疾病治疗领域的应用提供重要理论参考。
1 益生菌对MGBA的调控作用
肠道与大脑间存在一条复杂的双向通信系统——MGBA。在这条双向通信系统中,肠道微生物主要通过神经途径、免疫系统以及神经内分泌系统向CNS传递信息,直接/间接作用于大脑。益生菌能够通过调控肠道微生态稳态,参与MGBA多种途径的调节,进而对大脑的情绪处理和认知功能产生积极影响,益生菌对大脑的调控作用如图1所示。
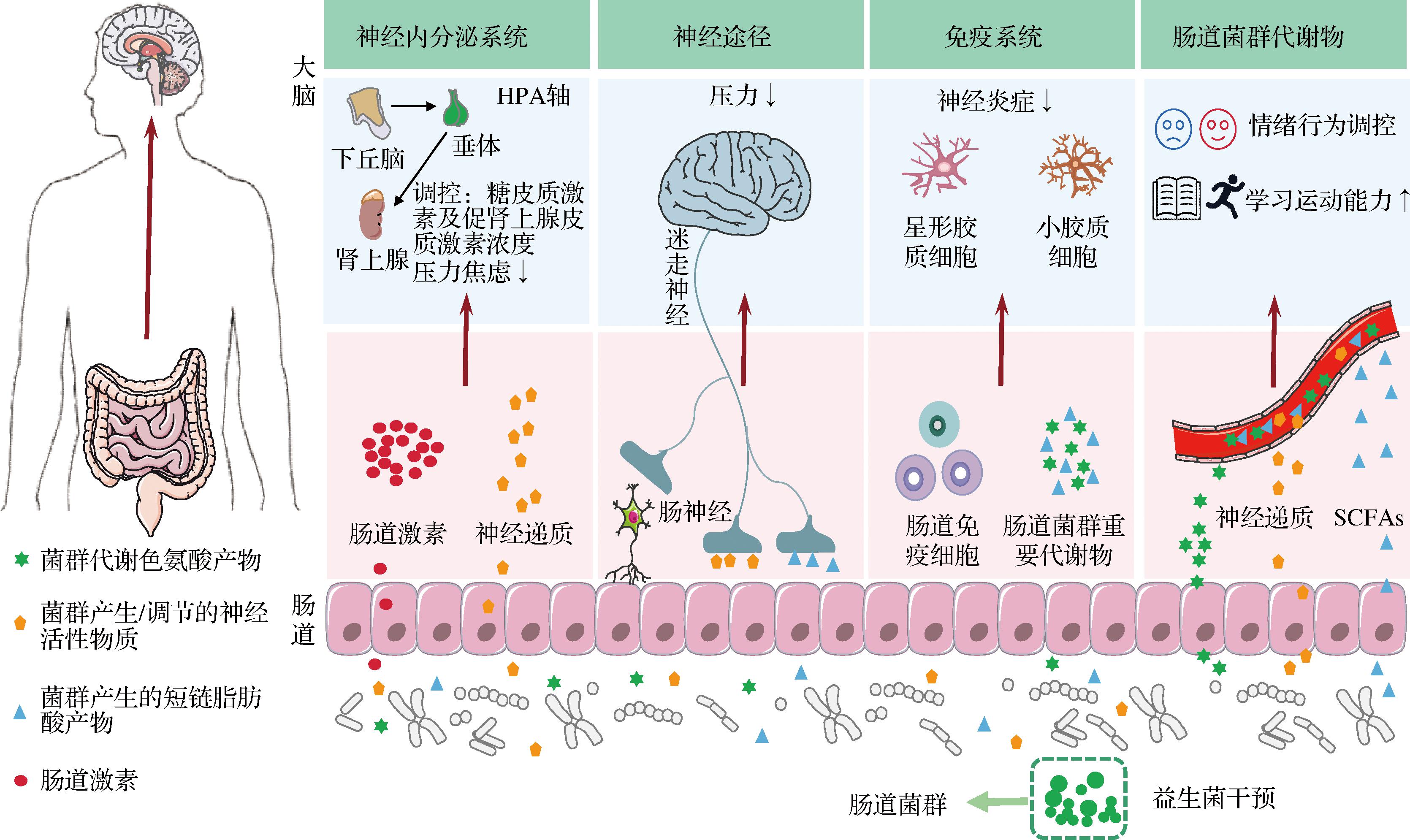
图1 益生菌通过MGBA对大脑的调控作用
Fig.1 Probiotic modulation of brain function via the MGBA
1.1 神经途径
迷走神经是连接肠道和大脑的主要物理途径和神经途径。迷走神经传入神经可以感知肠道的各种物理和化学信息,通过向CNS传递肠道菌群的生化、内分泌信号、神经递质和炎症因子等[12],对大脑产生积极/消极影响,其中消极影响主要体现为可能引发PD和AD等神经退行性疾病。基于迷走神经与肠道微生物和大脑的关系,刺激迷走神经已成为了一种减轻患者压力的有效途径[13],在此作用的基础上,可利用益生菌刺激迷走神经发挥抗焦虑作用,如摄入干酪乳酪杆菌(Lacticaseibacillus casei)通过上调迷走神经传入信号,并防止皮质醇的过度分泌,进而减轻宿主的焦虑行为[3]。
1.2 免疫系统
肠道微生物可通过免疫系统对CNS发挥神经免疫调节功能。小胶质细胞和星形胶质细胞是CNS中主要的免疫细胞,也是神经炎症的关键调节剂。肠道微生物可以通过激活肠道免疫细胞,调控星形胶质细胞的发育,肠道微生物产生的SCFAs和代谢色氨酸的产物也可以分别通过调节小胶质细胞功能和诱导星形胶质细胞中的IFN-I干扰素信号转导,实现对宿主神经炎症的调节[12]。神经精神疾病患者可以通过补充益生菌改善免疫紊乱,缓解抑郁症状,如摄入具有产吲哚-3-乳酸能力的双歧杆菌,可通过代谢色氨酸增加吲哚-3-乳酸含量,减缓抑郁小鼠的神经炎症,表现出一定抗抑郁疗效[4]。
1.3 神经内分泌系统
下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)由下丘脑、垂体以及肾上腺组成,是神经内分泌系统的核心。HPA分泌的糖皮质激素(如皮质醇)是人体用来对抗生理和心理压力的重要激素,激素分泌过低或过多都会影响人体心理状态。肠道微生物可以激活HPA,调节血清糖皮质激素及促肾上腺皮质激素浓度,减轻焦虑[14],而压力引起的肠道菌群失调则会导致HPA功能异常,进而使宿主出现焦虑行为。HPA失调导致的焦虑压抑等行为可以通过施用益生菌改善,研究表明每日摄入乳酸乳球菌(Lactococcus lactis subsp. cremoris)YRC3780可以减轻HPA失调引起的急性心理压力[15]。
1.4 肠道菌群代谢物
肠道菌群产生的重要代谢物SCFAs以及5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(gamma-aminobutyric acid,GABA)和多巴胺等神经递质可通过体液或神经等途径作用于大脑,调控宿主情绪与行为。摄入益生菌可以调控肠道菌群代谢物,影响大脑健康,如可通过促进肠道有益微生物增殖及代谢复杂碳水化合物等途径增加SCFAs含量,影响MGBA和脑功能[6];益生菌还可以调节宿主体内神经递质含量,如摄入植物乳植杆菌(Lactiplantibacillus plantarum)DR7可参与调节GABA、多巴胺、5-HT等重要神经递质,改善患者学习和运动能力的同时,也参与调节情绪、认知及睡眠[5]。
1.5 交互作用
MGBA作用机制复杂且交联密切,各种作用机制间有时还会发生协同作用。迷走神经传入通路可以参与HPA的调节,TAKADA等[3]的研究表明摄入益生菌L.casei促进宿主迷走神经传入信号上调的同时,还防止了皮质醇过度分泌,减轻了医学生的学业压力,证实了迷走神经与HPA共同对人体的精神状态产生影响。神经内分泌系统和免疫系统间也存在相互作用,相关研究证实肠道微生物群可能参与HPA与免疫调节的复杂协同作用,SMITH等[16]证实了免疫功能低下的Rag 1小鼠(缺乏B细胞和T细胞)表现出HPA、肠道微生态失调以及焦虑等不良症状,而摄入鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)R0011和瑞士乳杆菌(Lactobacillus helveticus)R0052的混合益生菌后,免疫功能低下及HPA失调等不良症状得到显著改善。MGBA机制间的交互作用为神经精神疾病的治疗提供了新见解,也为益生菌的治疗策略提供了潜在靶点。
综上,益生菌可通过多种途径作用于大脑,影响患者情绪、记忆、决策和认知等,在神经精神疾病的临床治疗上展现出了巨大治疗潜能。但由于益生菌的作用机制复杂,益生菌治疗可能因年龄和性别差异而对患者的免疫和神经内分泌系统等产生不同影响,进而在不同人群中呈现出不同的治疗效果。因此,未来仍需对益生菌的治疗机制进行更深入的临床研究,以此实现针对不同患者群体给予更精准的益生菌治疗方案,提升神经精神疾病治疗效率。
2 益生菌治疗神经精神疾病的进展
目前,针对不同精神疾病症状的改善,具有治疗潜力的益生菌主要包括乳杆菌、双歧杆菌、新一代益生菌以及混合益生菌(表1)。
表1 益生菌对神经精神疾病的影响
Table 1 Effect of probiotic on neuropsychiatric disorders

疾病种类益生菌功效发挥参考文献焦虑和抑郁乳杆菌双歧杆菌阿克曼氏菌L.plantarum CECT7485和短乳杆菌(L.brevis)CECT7480改善了睡眠障碍患者的焦虑情绪[17]L.casei降低了结肠炎小鼠焦虑行为[18]L.brevis缓解了压力诱导小鼠的抑郁和焦虑行为[19]动物双歧杆菌亚种(B.animalis subsp.lactis)BB-12改善了潜水运动员水下焦虑状态和运动表现[20]短双歧杆菌(B.breve)BB077缓解了女性产后早期产生的焦虑和抑郁等困扰[21]两歧双歧杆菌(B.bifidum)G9-1降低了IBS和克罗恩(Crohn’s disease,CD)病患者的焦虑[22]A.muciniphila的外膜蛋白Amuc_1100改善小鼠慢性压力诱导的焦虑和抑郁样行为[23]A.muciniphila缓解了IBS小鼠焦虑和疼痛[24]神经退行性疾病乳杆菌双歧杆菌L.plantarum DP189改善了PD小鼠α-突触核蛋白的恶化[25]Lactobacillus缓解了AD果蝇眼睛的神经退行性变[26]短双歧杆菌(B.breve)HNXY26M4减轻了AD小鼠的认知缺陷和神经炎症[27]长双歧杆菌(B.longum)促进癫痫小鼠神经保护基因表达[28]
乳杆菌是最常见益生菌,对MDD、自闭症谱系障碍(autism spectrum disorder,ASD)和PD等多种精神性疾病均具备积极干预作用,具有显著的治病潜力和低副作用,因此摄入乳杆菌改善神经精神疾病症状的相关机制研究比其他益生菌更深入。副干酪乳酪杆菌(Lacticaseibacillus paracasei)CCFM1229和L.rhamnosus CCFM1228可通过调节大脑黄嘌呤氧化酶的活性,减少MDD小鼠的焦虑和抑郁相关行为[8]。与服用其他益生菌的患者相比,使用L.plantarum PS128治疗青少年ASD患者的症状改善更明显且副作用更小[29],此外,L.plantarum PS128还被证实可用于预防和辅助治疗PD,以及减轻高压人群的心理问题[30],这些有益作用在动物模型和人体试验中均得到了充分验证。这些发现进一步证实了乳杆菌在改善多种神经精神疾病症状方面的治疗潜力以及其在益生菌临床研究和应用中的领先地位。
双歧杆菌是另一种常见的益生菌,其对身体和心理健康的益处因菌种不同而异。LI等[10]给PD小鼠喂食短双歧杆菌(Bifidobacterium breve)CCFM1067治疗后,短链脂肪酸含量增加,神经炎症减轻,抗氧化能力增强,PD相关病症也得到改善,因此B.breve CCFM1067可作为治疗PD的一种潜在策略。而KONG等[31]指出补充长双歧杆菌(B.longum)CCFM1077可恢复ASD小鼠肠道微生态平衡,调节犬尿氨酸代谢以及调节神经递质水平,有效改善小鼠自闭症行为。双歧杆菌对于神经精神疾病患者是否也能发挥相应功效,还需在临床上进一步验证。
新一代益生菌是指机理研究处于初级阶段,对人体健康具有潜在益处的微生物,并有望成为个性化医疗设计中有前景的预防和治疗药物,新一代益生菌既可以是来源于土壤、水域以及动植物的菌株,也可以是通过基因改造得到的工程菌株[32]。新一代益生菌主要包括阿克曼氏菌属(Akkermansia muciniphila)、肠球菌属(Enterococcus)、拟杆菌属(Bacteroides)以及粪球菌属(Faecalibacterium)等,其中A.muciniphila因其与PD、多发性硬化症(multiple sclerosis,MS)、AD以及癫痫等多种神经退行性疾病相关联而备受关注[33]。OU等[9]证实了接种A.muciniphila可减少AD小鼠大脑中淀粉样蛋白Aβ的积累,同时提高了小鼠大脑的认知功能。OLSON等[34]向癫痫小鼠注射A.muciniphila后不仅可防止癫痫发作,在给药结束21 d内还降低了癫痫发作的易感性。此外,基因改造的工程益生菌可实现特定治疗因子的精准释放,从而增强对神经精神疾病的治疗效果,SANMARCO等[35]设计改造的基因工程益生菌可通过激活树突状细胞中的HIF-1α-NDUFA4L2信号传导来抑制T细胞自身免疫性,具有治疗MS的临床潜力。传统益生菌的功效常局限于日常保健,疗效微弱,而新一代益生菌的开发则有助于突破传统益生菌制剂的作用范围,增强对神经精神疾病的预防和治疗功效。但由于新一代益生菌对多种神经精神疾病作用机制和副作用尚不明确,未来需对新一代益生菌进行更深入的研究。
混合益生菌可以对单一菌株治疗效果进行补充或增强。L.helveticus R0052和B.longum R0175是常用混合益生菌,具有显著的抗抑郁潜力,KAZEMI等[36]评估了L.helveticus R0052和B.longum R0175对MDD患者促炎细胞因子和尿皮质醇含量的影响,结果显示摄入益生菌使尿皮质醇含量和贝克抑郁表评分均显著降低,抑郁症状也被显著改善。此外,邹仁英等[37]的实验结果表明,B.breve CCFM1025、长双歧杆菌婴儿亚种(Bifidobacterium longum subsp. infantis)和乳酸片球菌(Pediococcus acidilactici)CCFM6432组成的混合益生菌可通过MGBA调节抑郁小鼠神经递质水平及炎症因子水平,且混合益生菌相比于单一菌种还展现出了同时缓解抑郁和便秘的潜力。
综上,益生菌制剂有望成为治疗神经精神疾病的新途径,但目前对于益生菌治疗神经精神疾病的机制解析大部分仍停留在动物模型上,患者对于口服活的微生物的生物安全性存疑,因此需对益生菌的疗效进行更深入的临床研究,以确保益生菌治疗的可靠和安全性。同时由于益生菌工业生产效率低下,其在神经精神疾病治疗领域的临床应用发展也相应受到限制。
3 益生菌发酵工艺强化策略
目前,具有神经精神疾病治疗潜力的益生菌产业链生产效率低下,制约了益生菌制剂临床应用的发展。因此,探索低成本、高产率的培养方法和发酵工艺,提升益生菌制剂的生产效率,可为满足临床研究和群众需求提供有力的产业支撑。以下总结了培养优化方法和发酵工艺强化策略,为益生菌的工业生产提供参考。
3.1 培养优化方法
为获得理想高浓度的益生菌产量,需对其培养过程涉及的工艺参数进行严格把控,建立适宜的培养体系。在培养过程中,影响益生菌生长的因素多样,如发酵培养基成分、pH值及发酵温度等,均可能影响菌体的增殖。优化培养基组成和培养条件是提高益生菌发酵效率最重要的方法。
3.1.1 发酵培养基优化
发酵培养基中营养物质的类型及浓度对菌株生长代谢起关键作用。益生菌发酵的培养基营养成分通常多且复杂,极大地增加了益生菌的发酵成本,同时,考虑到培养基成分对后续菌体收集的影响,开发满足益生菌营养需求且复杂蛋白质含量低,便于后续菌体收集的低成本培养基,是实现益生菌生物质工业化生产的关键步骤之一。乳清、玉米淀粉、甘蔗糖蜜、果汁和农工剩菜等低成本底物成为了人们发酵益生菌的绝佳选择,张腾霄等[38]以番茄、马铃薯、黄秋葵、紫薯、胡萝卜5种低廉蔬菜为原料,提取其可溶性营养成分作为培养青春双歧杆菌(B.adolescentis)的液体培养基主要成分,研究结果表明,B.adolescentis在PYG和牛奶这2种工业常用培养基中的最大活菌数分别为1.456×107、1.568×107 CFU/mL,而在黄秋葵、胡萝卜及紫薯培养基中的最大活菌数分别为6.832×107、4.320×107、2.671×107 CFU/mL,B.adolescentis菌株的生物量在这些低成本培养基中显著提高,同时菌体收集的难度也显著降低。常见益生菌的优化培养基成分如表2所示。
表2 常用益生菌的优化培养基配方
Table 2 Optimized media formulations for commonly used probiotic
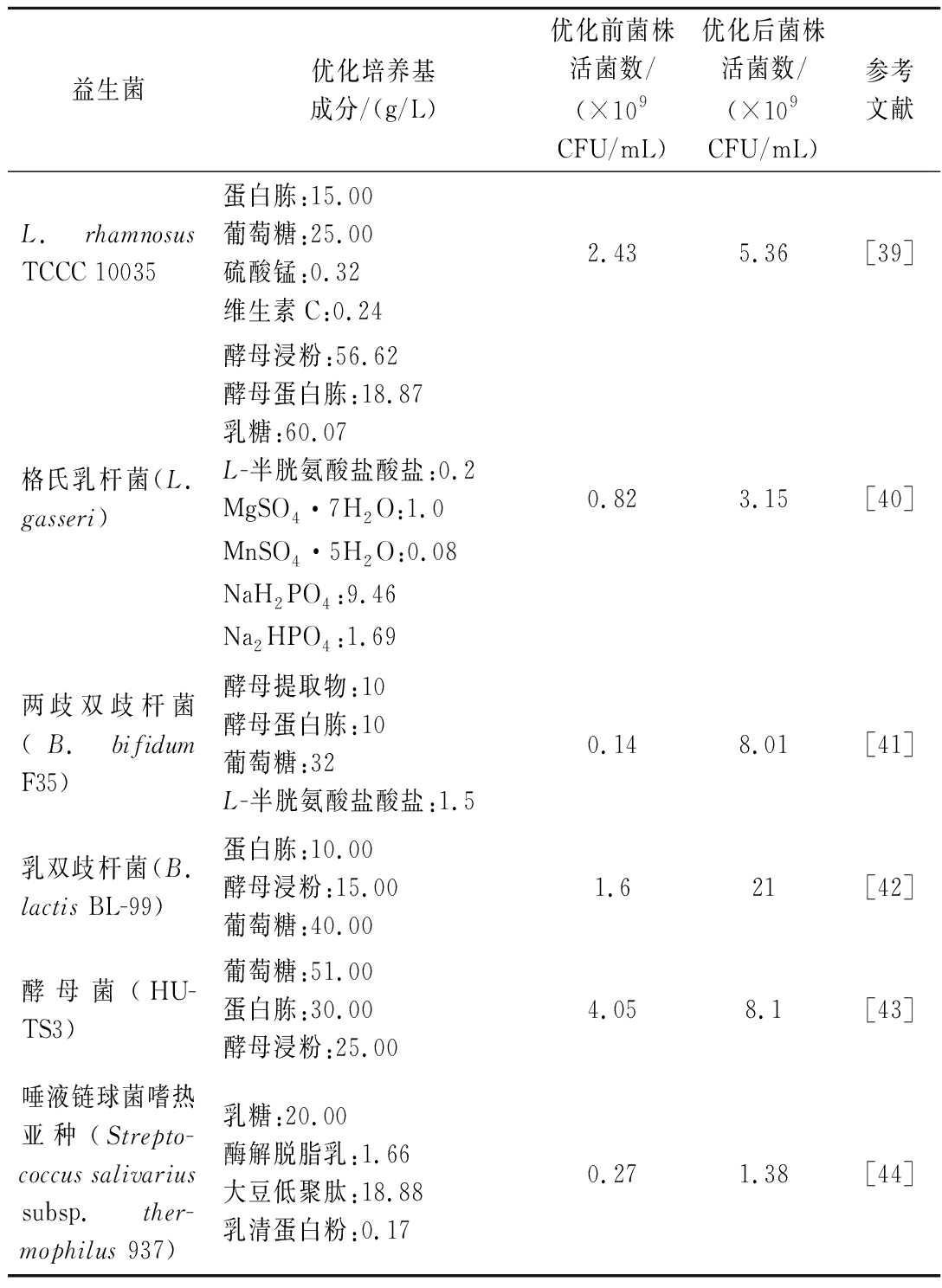
益生菌优化培养基成分/(g/L)优化前菌株活菌数/(×109CFU/mL)优化后菌株活菌数/(×109CFU/mL)参考文献L.rhamnosus TCCC 10035蛋白胨:15.00葡萄糖:25.00硫酸锰:0.32维生素C:0.242.435.36[39]格氏乳杆菌(L.gasseri)酵母浸粉:56.62酵母蛋白胨:18.87乳糖:60.07L-半胱氨酸盐酸盐:0.2MgSO4·7H2O:1.0MnSO4·5H2O:0.08NaH2PO4:9.46Na2HPO4:1.690.823.15[40]两歧双歧杆菌(B.bifidum F35)酵母提取物:10酵母蛋白胨:10葡萄糖:32L-半胱氨酸盐酸盐:1.50.148.01[41]乳双歧杆菌(B.lactis BL-99)蛋白胨:10.00酵母浸粉:15.00葡萄糖:40.001.621[42]酵母菌(HU-TS3)葡萄糖:51.00蛋白胨:30.00酵母浸粉:25.004.058.1[43]唾液链球菌嗜热亚种(Strepto-coccus salivarius subsp.ther-mophilus 937)乳糖:20.00酶解脱脂乳:1.66大豆低聚肽:18.88乳清蛋白粉:0.170.271.38[44]
除常规方法外,还能借助代谢工程手段探究益生菌碳、氮代谢流向,以便精准地为益生菌补充碳、氮源,精简培养基配方,提高益生菌底物利用率,提升益生菌生物质产量。但目前仍缺乏对于益生菌的生理生化特性、代谢网络及调控机制方面的解析,接下来需加强对益生菌碳、氮源代谢等方面的研究。
3.1.2 pH值优化
pH值通过改变微生物细胞膜渗透性和细胞内酶活性影响微生物的生长和代谢。常见益生菌乳杆菌和双歧杆菌生长的最适pH值范围通常为5.5~6.5及6.0~7.0,但在具体发酵过程中,菌株最适生长pH值会有所差异。WANG等[45]对L.rhamnosus LS-8发酵pH进行了优化,为消除有机酸积累导致的pH降低对细菌生长的抑制,研究者们对NaOH、KOH、Ca(OH)2和NH3·H2O等4种发酵工业常用中和剂进行了优化,最终选用3 mol/L NaOH溶液作为中和剂将发酵液pH值稳定控制在4.7,得到最高细胞浓度为4.5×109 CFU/mL,极大地提高了菌体发酵效率。针对益生菌pH的调节,除了直接补加盐酸、氢氧化钠等酸/碱物质外,还常采用补加磷酸盐等缓冲剂、及补加氨水等生理酸/碱性盐基质等策略。
3.1.3 发酵温度优化
发酵温度直接影响益生菌生化反应速率和代谢调控机制。大部分益生菌生长的理想发酵温度在30~43 ℃,在不同发酵温度下,菌株产生有益代谢物的含量也有所不同。SUN等[46]分析比较了37 ℃和42 ℃时干酪乳酪杆菌(Lacticaseibacillus casei)Zhang的生长和代谢情况,结果显示,与42 ℃相比,37 ℃发酵时,L.casei Zhang的活菌数显著提升,同时乙醛、乙偶姻、丁酸、癸酸、己酸和辛酸含量也显著高于42 ℃时,表明37 ℃发酵除了可以提升菌株的存活率外,还可能有助于L.casei Zhang积累风味化合物和短链脂肪酸等重要生物活性物质。因此,适宜的温度范围可以为益生菌提供良好的生化反应条件,促进其生长和代谢,精准优化发酵温度是确保和加速发酵过程、获得高质高产益生菌产品的关键。
3.2 发酵工艺强化
随着益生菌发酵技术的不断发展,研究者们提出了许多新型高效的发酵工艺强化策略,包括设计新颖的生物反应器和高效的补料策略,有助于提高益生菌细胞产量和生产效率。
3.2.1 生物反应器强化
生物反应器可实现对不同需求的微生物发酵过程的有效操控,在成功开发微生物培养和能量转换等生物质技术中发挥关键作用。CUI等[47]基于乳杆菌和双歧杆菌生长过程中细胞增殖、葡萄糖消耗和产酸之间的动力学关系,开发了一种自动反馈补料生物反应器对乳杆菌和双歧杆菌进行高密度培养。该生物反应器通过计算机程序,监测发酵液中葡萄糖的消耗量和酸的生成量,自动补充葡萄糖以及调节酸度。该生物反应器的应用使得L.casei CCFM 30和L.plantarum CCFM 8610的细胞浓度约为批式发酵的3.5倍和4.5倍,B.adolescentis CCFM 626和B.longum CCFM 643的最大生物量也分别增加到批式发酵的2.3倍和4.2倍,显著提高了益生菌的生长效率。该发酵策略遵循了底物消耗规律,保证了发酵液中残余葡萄糖含量的稳定性,可推广应用于其他益生菌的工业发酵。目前多菌株益生菌的培养仍局限于在单个发酵罐中分批培养每个单菌株,生产成本较高,为高效发酵效用丰富的多菌株益生菌,METTU等[48]设计了新型类肠道生物反应器,通过水凝胶维持适宜的pH和氧气含量梯度,模拟人类肠道环境。这种新型类肠道生物反应器为多菌株生长提供了空间和环境,为高效生产多菌株益生菌提供了可能。在工业生产中,依据不同益生菌发酵过程的生化状态变化以及不同发酵目的,设计合理的反应器并调控其状态参数是实现益生菌高密度发酵的有效策略之一。
3.2.2 补料策略强化
传统批式发酵不适用于益生菌的开发,补料分批发酵和连续发酵技术在食品工业中并不常见,但对于改善营养挑剔的益生菌细胞作用方面可能起积极作用。补料分批发酵可以增加营养物质供应量,同时减少底物抑制,从而提高细胞生长效率以及代谢物的产量,JU等[49]采用补料分批发酵策略发酵罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)EC01,使用900.0 g/L的蔗糖溶液进行间歇性补料,确保发酵液中蔗糖浓度保持在40.0 g/L,该策略显著提升了益生菌的活菌数及胞外多糖(exopolysaccharides,EPS)的生产效率,交替糖型EPS产量达54.3 g/L,该结果为现有研究中乳杆菌发酵产生交替糖型EPS的最高产量。与批式发酵和补料分批发酵相比,连续发酵具备进料操作简单及发酵生产效率更高等显著优点,WANG等[50]首先设计了三阶段连续发酵策略用于丁酸梭菌(Clostridium butyricum)消耗甘油生产1,3-丙二醇,其中第一阶段提供了生长旺盛的菌株,第二阶段促进了1,3-丙二醇的积累,第三阶段实现了1,3-丙二醇浓度进一步提高及甘油残留浓度降低,经过三阶段连续发酵,生物质最高产量为6.24 g/L,1,3-丙二醇最高浓度为80.05 g/L。其次根据第一阶段连续发酵的实验结果,研究者们开发了一种基于主要产物(1,3-丙二醇和丁酸盐)、底物消耗和细胞生长之间的动力学模型,设计了一种不进行第三阶段发酵的更简单的新的两阶段连续发酵策略。动力学模型被用于优化和预测第一阶段连续发酵的1,3-丙二醇最大产率及甘油进料浓度和稀释率,基于模型设计的新的两阶段连续发酵的实验结果与模型预测值吻合,因此两阶段连续发酵策略被证明有效。该研究通过应用动力学模型来优化多级连续发酵的策略,也可以为其他益生菌生产高密度菌体及高浓度生物活性物质提供参考。
3.3 菌株改良
随着基因组学和蛋白质组学技术的发展,借助基因改造增强微生物对培养和储存条件的耐受性,提高益生菌存活率变得更加容易。WU等[51]基于对乳酸乳杆菌(L.lactis)F44 9个细胞壁或膜相关基因的转录分析,构建了9组具有细胞壁或膜相关基因的过表达菌株。结果显示过表达DLTD或ERFK基因的菌株在酸胁迫下的存活率显著高于野生菌株,该研究提出的增强L.lactis F44耐酸性的策略不仅有助于提高益生菌菌株的工业产量,还为其他肠道微生态制剂克服酸性环境的相关研究提供重要参考。除使用人工基因编辑工具外,还可以借助适应性实验室进化增强微生物耐受性和存活率。KIM等[52]采用异型休克(热休克和渗透休克)诱导获得了一个冻干耐受性增强的肠膜明串珠菌(Leuconostoc mesenteroids)WiKim33突变菌株。与野生型相比,突变菌株环状脂肪酸与饱和脂肪酸的比率提升,使得益生菌的储存稳定性显著增强,其胞外多糖产量显著增加331%,同时突变型菌株的存活率也显著提升了33%。这些方法赋予了益生菌额外的应激耐受性,降低了益生菌工业化生产的难度,同时在保持益生菌功效方面起到了积极作用。
工程改造益生菌,虽可作为规模化生产益生菌的重要策略,但由于益生菌的营养和健康属性,目前人们对基因改造益生菌添加至食品、保健品和药品中仍持保守态度。在国内,《中华人民共和国食品安全法》和《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》对益生菌的使用安全有严格规定,但目前是否允许基因改造益生菌用于食品中尚未明确[53]。国际上,欧盟颁布了《食品和饲料用遗传改造微生物及其产品风险评估指南》以及《用作饲料添加剂或用作生产生物的微生物特性描述指南》对基因改造益生菌采取了严格的监管模式,针对不同类型基因改造生物产品,分别建立了科学的安全评估标准,且限制经外源基因改造的益生菌的使用[54]。美国食品药物监督管理局(Food and Drug Administration,FDA)尚未制定专门的法规监管基因改造益生菌,且FDA基于“一般公认安全(Generally Recognized As Safe,GRAS)”认证已批准少数转基因益生菌可应用于食品及药品领域,包括布拉迪酵母、动物双歧杆菌BB-12以及短双歧杆菌M-16V[53-54]。尽管监管法规尚不完善,随着研究的深入和技术的进步,基因改造益生菌的生物安全性若能得到充分保障,将为其在食品、保健品和药品中的应用开辟广阔前景。
4 总结与展望
随着神经精神疾病发病率逐年增高,寻找安全且副作用小的治疗方法已成为临床研究的热点。益生菌制剂通过调节MGBA机制,展现出改善神经精神疾病症状的潜力。相较于药物治疗,益生菌治疗具有抗生素积累少、副作用小和环境友好等优势,更符合可持续发展的理念。
虽然益生菌对于神经精神疾病具备较大的治疗潜力,但市面上的益生菌制剂普遍存在稳定性差、存活率低和成本高昂等问题。患者通常需要服用大量益生菌制剂才能达到治疗效果,这使得益生菌制剂的疗效难以与精准治疗的药物相媲美。为了提高益生菌治疗的优势,除了开发预防和治疗效果更强的新一代益生菌外,还可以通过微囊化、细胞固定化和添加保护剂等方法,在益生菌制剂的下游封装和药物递送过程中提高益生菌的存活率,确保足够的活菌剂量能够靶向患者的患病部位,从而最大程度发挥益生菌的疗效。此外,益生菌还可以与药物治疗和免疫疗法等联合使用,以充分发挥其治疗潜力,提高对神经精神疾病的治疗效果,同时减少药物依赖带来的副作用。
综上,益生菌为多种神经精神疾病的治疗提供了新的选择和策略,未来对益生菌治疗机制的临床探索和生产发酵技术的优化,推动益生菌在临床应用和工业生产中多样化及个性化发展。
[1] XIAO W P, SU J B, GAO X J, et al.The microbiota-gut-brain axis participates in chronic cerebral hypoperfusion by disrupting the metabolism of short-chain fatty acids[J].Microbiome, 2022, 10(1):62.
[2] RIBERA C, S NCHEZ-ORT
NCHEZ-ORT J V, CLARKE G, et al.Probiotic, prebiotic, synbiotic and fermented food supplementation in psychiatric disorders:A systematic review of clinical trials[J].Neuroscience & Biobehavioral Reviews, 2024, 158:105561.
J V, CLARKE G, et al.Probiotic, prebiotic, synbiotic and fermented food supplementation in psychiatric disorders:A systematic review of clinical trials[J].Neuroscience & Biobehavioral Reviews, 2024, 158:105561.
[3] TAKADA M, NISHIDA K, KATAOKA-KATO A, et al.Probiotic Lactobacillus casei strain Shirota relieves stress-associated symptoms by modulating the gut-brain interaction in human and animal models[J].Neurogastroenterology and Motility, 2016, 28(7):1027-1036.
[4] QIAN X, LI Q, ZHU H Y, et al.Bifidobacteria with indole-3-lactic acid-producing capacity exhibit psychobiotic potential via reducing neuroinflammation[J].Cell Reports Medicine, 2024, 5(11):101798.
[5] LIU G X, CHONG H X, CHUNG F Y, et al.Lactobacillus plantarum DR7 modulated bowel movement and gut microbiota associated with dopamine and serotonin pathways in stressed adults[J].International Journal of Molecular Sciences, 2020, 21(13):4608.
[6] DALILE B, VAN OUDENHOVE L, VERVLIET B, et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nature Reviews Gastroenterology &Hepatology, 2019, 16(8):461-478.
[7] 董奇奇, 张怡琳, 游春苹.肠道微生物及其代谢产物对血脑屏障的影响及益生菌干预措施研究进展[J].食品工业科技, 2024, 45(22):353-360.DONG Q Q, ZHANG Y L, YOU C P.Research progress in effects of gut microbiota and their metabolites on the blood-brain barrier and interventions by probiotics[J].Science and Technology of Food Industry, 2024, 45(22):353-360.
[8] XU M S, TIAN P J, ZHU H Y, et al.Lactobacillus paracasei CCFM1229 and Lactobacillus rhamnosus CCFM1228 alleviated depression- and anxiety-related symptoms of chronic stress-induced depression in mice by regulating xanthine oxidase activity in the brain[J].Nutrients, 2022, 14(6):1294.
[9] OU Z H, DENG L L, LU Z, et al.Protective effects of Akkermansia muciniphila on cognitive deficits and amyloid pathology in a mouse model of Alzheimer’s disease[J].Nutrition &Diabetes, 2020, 10:12.
[10] LI T T, CHU C Q, YU L L, et al.Neuroprotective effects of Bifidobacterium breve CCFM1067 in MPTP-induced mouse models of Parkinson’s disease[J].Nutrients, 2022, 14(21):4678.
[11] HATHI Z, METTU S, PRIYA A, et al.Methodological advances and challenges in probiotic bacteria production:Ongoing strategies and future perspectives[J].Biochemical Engineering Journal, 2021, 176:108199.
[12] AGIRMAN G, YU K B, HSIAO E Y.Signaling inflammation across the gut-brain axis[J].Science, 2021, 374(6571):1087-1092.
[13] BREIT S, KUPFERBERG A, ROGLER G, et al.Vagus nerve as modulator of the brain-gut axis in psychiatric and inflammatory disorders[J].Frontiers in Psychiatry, 2018, 9:44.
[14] KUIJER E J, STEENBERGEN L.The microbiota-gut-brain axis in hippocampus-dependent learning and memory:Current state and future challenges[J].Neuroscience and Biobehavioral Reviews, 2023, 152:105296.
[15] MATSUURA N, MOTOSHIMA H, UCHIDA K, et al.Effects of Lactococcus lactis subsp.cremoris YRC3780 daily intake on the HPA axis response to acute psychological stress in healthy Japanese men[J].European Journal of Clinical Nutrition, 2022, 76(4):574-580.
[16] SMITH C J, EMGE J R, BERZINS K, et al.Probiotics normalize the gut-brain-microbiota axis in immunodeficient mice[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2014, 307(8):G793-G802.
[17] DENYSOV Y, PUTYATIN G, MOROZ S, et al.Effects of probiotic supplement Lactobacillus plantarum CECT7485 and Lactobacillus Brevis CECT7480 on sleep quality in patients with anxiety and depression comorbidity[J].European Psychiatry, 2023, 66(S1):S454.
[18] 王秋珍, 邓自腾, 兰静, 等.干酪乳杆菌对DSS诱导结肠炎小鼠焦虑样行为的影响及对结肠的保护作用[J].中国农业大学学报, 2023, 28(4):139-146.WANG Q Z, DENG Z T, LAN J, et al.Effects of Lactobacillus casei on anxiety like behavior in mice with colitis induced by DSS and its protective effect on colon[J].Journal of China Agricultural University, 2023, 28(4):139-146.
[19] KIM H, KIM H, SUH H J, et al.Lactobacillus brevis-fermented gamma-aminobutyric acid ameliorates depression- and anxiety-like behaviors by activating the brain-derived neurotrophic factor-tropomyosin receptor kinase B signaling pathway in BALB/C mice[J].Journal of Agricultural and Food Chemistry, 2024, 72(6):2977-2988.
[20] DONG W Z, WANG Y, LIAO S X, et al.Bifidobacterium animalis subsp.lactis BB-12 improves the state anxiety and sports performance of young divers under stress situations:A single-arm, prospective proof-of-concept study[J].Frontiers in Psychology, 2020, 11:570298.
[21] VICARIOTTO F, MALFA P, TORRICELLI M, et al.Beneficial effects of Limosilactobacillus reuteri PBS072 and Bifidobacterium breve BB077 on mood imbalance, self-confidence, and breastfeeding in women during the first trimester postpartum[J].Nutrients, 2023, 15(16):3513.
[22] TOMITA T, FUKUI H, OKUGAWA T, et al.Effect of Bifidobacterium bifidum G9-1 on the intestinal environment and diarrhea-predominant irritable bowel syndrome (IBS-D)-like symptoms in patients with quiescent Crohn’s disease:A prospective pilot study[J].Journal of Clinical Medicine, 2023, 12(10):3368.
[23] CHENG R R, ZHU H Y, SUN Y, et al.The modified outer membrane protein Amuc_1100 of Akkermansia muciniphila improves chronic stress-induced anxiety and depression-like behavior in mice[J].Food &Function, 2022, 13(20):10748-10758.
[24] MEYNIER M, DAUGEY V, MALLARET G, et al.Pasteurized akkermansia muciniphila improves irritable bowel syndrome-like symptoms and related behavioral disorders in mice[J].Gut Microbes, 2024, 16(1):2298026.
[25] WANG L, ZHAO Z J, ZHAO L, et al.Lactobacillus plantarum DP189 reduces α-SYN aggravation in MPTP-induced Parkinson’s disease mice via regulating oxidative damage, inflammation, and gut microbiota disorder[J].Journal of Agricultural and Food Chemistry, 2022, 70(4):1163-1173.
[26] TAN F H P, LIU G, LAU S A, et al.Lactobacillus probiotics improved the gut microbiota profile of a Drosophila melanogaster Alzheimer’s disease model and alleviated neurodegeneration in the eye[J].Beneficial Microbes, 2020, 11(1):79-89.
[27] ZHU G S, ZHAO J X, WANG G, et al.Bifidobacterium breve HNXY26M4 attenuates cognitive deficits and neuroinflammation by regulating the gut-brain axis in APP/PS1 mice[J].Journal of Agricultural and Food Chemistry, 2023, 71(11):4646-4655.
[28] ZUBAREVA O E, DYOMINA A V, KOVALENKO A A, et al.Beneficial effects of probiotic Bifidobacterium longum in a lithium-pilocarpine model of temporal lobe epilepsy in rats[J].International Journal of Molecular Sciences, 2023, 24(9):8451.
[29] MENSI M M, ROGANTINI C, MARCHESI M, et al.Lactobacillus plantarum PS128 and other probiotics in children and adolescents with autism spectrum disorder:A real-world experience[J].Nutrients, 2021, 13(6):2036.
[30] WU S, WU C C, TSAI P J, et al.Psychobiotic supplementation of PS128TM improves stress, anxiety, and insomnia in highly stressed information technology specialists:A pilot study[J].Frontiers in Nutrition, 2021, 8:614105.
[31] KONG Q M, CHEN Q, MAO X H, et al.Bifidobacterium longum CCFM1077 ameliorated neurotransmitter disorder and neuroinflammation closely linked to regulation in the kynurenine pathway of autistic-like rats[J].Nutrients, 2022, 14(8):1615.
[32] 朱铮, 李兰娟, 王保红.新一代益生菌:肠道微生态疗法的新机遇[J].中国医学前沿杂志(电子版), 2024, 16(1):92.ZHU Z, LI L J, WANG B H.New generation probiotics:A new opportunity for gut microecology[J].Therapy Chinese Journal of the Frontiers of Medical Science(Electronic Version), 2024, 16(1):92.
[33] CANI P D, DEPOMMIER C, DERRIEN M, et al.Akkermansia muciniphila:Paradigm for next-generation beneficial microorganisms[J].Nature Reviews Gastroenterology &Hepatology, 2022, 19(10):625-637.
[34] OLSON C A, VUONG H E, YANO J M, et al.The gut microbiota mediates the anti-seizure effects of the ketogenic diet[J].Cell, 2018, 174(2):497.
[35] SANMARCO L M, RONE J M, POLONIO C M, et al.Lactate limits CNS autoimmunity by stabilizing HIF-1α in dendritic cells[J].Nature, 2023, 620(7975):881-889.
[36] KAZEMI A, ALI NOORBALA A, AZAM K, et al.Effect of prebiotic and probiotic supplementation on circulating pro-inflammatory cytokines and urinary Cortisol levels in patients with major depressive disorder:A double-blind, placebo-controlled randomized clinical trial[J].Journal of Functional Foods, 2019, 52:596-602.
[37] 邹仁英, 朱慧越, 许梦舒, 等.“精神益生菌” 对慢性应激诱导的抑郁和便秘症状的缓解及机制研究[J].食品与发酵工业, 2021, 47(3):1-9.ZOU R Y, ZHU H Y, XU M S, et al.Effect and mechanism of psychobiotics in regulating chronic stress induced depression and constipation[J].Food and Fermentation Industries, 2021, 47(3):1-9.
[38] 张腾霄, 王斌, 蔡宏达, 等.蔬菜液体培养基用于发酵培养青春双歧杆菌的研究[J].河南工业大学学报(自然科学版), 2020, 41(6):74-79.ZHANG T X, WANG B, CAI H D, et al.Research on the application of vegetable liquid media in fermentation and culture of Bifidobacterium adolescentis[J].Journal of Henan University of Technology (Natural Science Edition), 2020, 41(6):74-79.
[39] 王超凡, 王慧慧, 胡世伟, 等.鼠李糖乳杆菌TCCC 10035的培养条件优化[J].饲料研究, 2024, 47(22):116-122.WANG C F, WANG H H, HU S W, et al.Optimization of cultivation conditions for Lactobacillus rhamnosus TCCC 10035[J].Feed Research, 2024, 47 (22):116-122.
[40] 郭艳荣. 格氏乳杆菌体外筛选及高密度培养工艺研究[D].呼和浩特:内蒙古农业大学, 2020.GUO Y R.The in vitro sereening of Lactobacillus gasseri and the research of high cell density culture[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[41] 田睿. 两歧双歧杆菌F35高密度发酵培养基的优化及应用[D].无锡:江南大学, 2024.TIAN R.Optimization of high-density fermentation medium for Bifidobacterium bifidum F35 and its application[D].Wuxi:Jiangnan University, 2024.
[42] 刘福东, 桑跃, 葛绍阳.乳双歧杆菌BL-99高密度发酵培养工艺的优化研究[J].中国奶牛, 2023 (12):32-36.LIU F D, SANG Y, GE S Y.Optimization of high cell density fermentation for Bifidobacterium lactis BL-99[J].China Dairy Cattle, 2023 (12):32-36.
[43] 毕长富, 曾思恒, 何娟, 等.产γ-氨基丁酸酵母菌高密度培养条件优化[J].四川轻化工大学学报(自然科学版), 2022, 35(6):26-34.BI C F, ZENG S H, HE J, et al.Optimization of high density culture conditions for γ-GABA producing yeast[J].Journal of Sichuan University of Science &Engineering (Natural Science Edition), 2022, 35(6):26-34.
[44] 彭奎耀, 关成冉, 王伟军, 等.嗜热链球菌937增殖培养基及发酵条件的优化[J].现代食品科技, 2024, 40(5):24-33.PENG K Y, GUAN C R, WANG W J, et al.Optimization of enrichment culture medium and fermentation conditions for Streptococcus thermophilus 937[J].Modern Food Science and Technology, 2024, 40(5):24-33.
[45] WANG T, LU Y Y, YAN H, et al.Fermentation optimization and kinetic model for high cell density culture of a probiotic microorganism:Lactobacillus rhamnosus LS-8[J].Bioprocess and Biosystems Engineering, 2020, 43(3):515-528.
[46] SUN Y R, PENG C T, WANG J C, et al.Mesopic fermentation contributes more to the formation of important flavor compounds and increased growth of Lactobacillus casei Zhang than does high temperature during milk fermentation and storage[J].Journal of Dairy Science, 2022, 105(6):4857-4867.
[47] CUI S M, SADIQ F A, MAO B Y, et al.High-density cultivation of Lactobacillus and Bifidobacterium using an automatic feedback feeding method[J].LWT, 2019, 112:108232.
[48] METTU S, HATHI Z, ATHUKORALALAGE S, et al.Perspective on constructing cellulose-hydrogel-based gut-like bioreactors for growth and delivery of multiple-strain probiotic bacteria[J].Journal of Agricultural and Food Chemistry, 2021, 69(17):4946-4959.
[49] JU J H, JEON S G, HEO S Y, et al.Synbiotics production using Lactobacillus reuteri EC01, a strain that produces alternan-type exopolysaccharide[J].LWT, 2023, 182:114814.
[50] WANG X L, SUN Y Q, PAN D T, et al.Kinetics-based development of two-stage continuous fermentation of 1, 3-propanediol from crude glycerol by Clostridium butyricum[J].Biotechnology for Biofuels and Bioproducts, 2024, 17(1):38.
[51] WU H, ZHANG Y L, LI L, et al.Positive regulation of the DLT operon by TCSR7 enhances acid tolerance of Lactococcus lactis F44[J].Journal of Dairy Science, 2022, 105(10):7940-7950.
[52] KIM Y Y, KIM J C, KIM S, et al.Heterotypic stress-induced adaptive evolution enhances freeze-drying tolerance and storage stability of Leuconostoc mesenteroides WiKim33[J].Food Research International, 2024, 175:113731.
[53] 高娉娉, 刘汉清, 张凤, 等.益生菌遗传育种方法研究进展[J].食品与发酵工业, 2023, 49(22):302-310.GAO P P, LIU H Q, ZHANG F, et al.Research progress in genetic breeding methods for probiotics[J].Food and Fermentation Industries, 2023, 49(22):302-310.
[54] 魏笑莲, 钱智玲, 陈巧巧, 等.遗传改造微生物制造食品和饲料的监管要求及欧盟授权案例分析[J].合成生物学, 2021, 2(1):121-133.WEI X L, QIAN Z L, CHEN Q Q, et al.Regulatory requirements for food and feed produced with genetically modified microorganisms and case studies for EU authorization[J].Synthetic Biology Journal, 2021, 2(1):121-133.