酱香型白酒是中国白酒的重要香型之一,以其独特的香气和复杂的工艺闻名。酱香型白酒具有著名的“12987”工艺[1],即1年为1个生产周期、2次投料、9次蒸煮、8次发酵、7次取酒。其中3~5轮次酒的酒体更醇厚[2],口感更好,末轮次酒醅经多轮次发酵后残余淀粉较少[3],不利于发酵糖化,对酒企带来不可避免的经济损失。
以往提高白酒发酵中糖化效率方法包括大小曲联用技术[4-5],甜酒曲属于小曲中的一种,是米酒酿造的糖化、发酵和生香剂[6]。甜酒曲中存在霉菌、酵母和细菌等数十个种属的微生物[7],其中优势霉菌主要是根霉、曲霉和毛霉属等微生物[8-9]。而甜酒糟是生产甜酒的主要副产物之一,甜酒糟中富含大量活性微生物,可视为甜酒曲中糖化微生物的活化及扩大培养产物。因此,理论上可利用甜酒糟强化高温大曲提高末轮次酱酒醅的糖化效率,然而截止目前,尚未出现甜酒糟在白酒糖化发酵领域的研究报道。因此,本研究利用甜酒糟及甜酒曲分别强化高温大曲,从而提高末轮次酱酒醅的糖化效率。
糖化的本质是淀粉分子的水解[10]。随着现代分析手段的不断发展,各类淀粉分子变化,包括支直链比例、分子粒径、晶体结构、微观形态等,均可直观呈现,可从分子水平揭示糖化效率发生变化的本质[11]。因此,可采用淀粉分子的一系列变化解释甜酒曲或甜酒糟对末轮次酱酒醅糖化效率的影响。
本研究拟以末轮次酱酒醅为研究对象,分别采用甜酒糟及甜酒曲强化传统高温大曲,以提高糖化效率,降低末轮次酱酒醅中残余淀粉含量,并对酒醅淀粉的一系列分子变化进行分析,从分子水平研究甜酒糟促进高温大曲糖化能力的作用机制,为酒企提高经济效益提供科学依据。
1 材料与方法
1.1 材料与试剂
原料:末轮次酱酒醅(第七轮次)、高温大曲,湖南湘窖酒业有限公司;甜酒曲,安琪酵母股份有限公司;甜酒糟,以甜酒曲为糖化剂制成甜酒(醪糟)过滤后的固体物质。
淀粉标准品:直链型淀粉标准品(纯度96%)、支链型淀粉标准品(纯度87.2%)、聚甲基丙烯酸甲酯[poly(methyl methacrylate), PMMA],北京中科质检生物技术有限公司。
试剂:无水葡萄糖,天津市永大化学试剂有限公司;CuSO4,天津希恩思生化科技有限公司;酒石酸钾钠,天津市永大化学试剂有限公司;次甲基蓝,徐州淞誉化工科技有限公司;NaOH,连云港科信化工有限公司;FeSO4,上海阿拉丁生化科技股份有限公司;亚铁氰化钾,广州市金华大化学试剂有限公司;酚酞,上海易恩化学技术有限公司;以上试剂均为分析纯。
1.2 仪器与设备
GH-420隔水培养箱,海雅荣生化设备仪器有限公司;DZKW-4电热恒温水浴锅,北京中科奥博科技有限公司;YH-M100001电子分析天平,五鑫衡器有限公司;GWA-UN1超纯水器,北京普析通用仪器有限责任公司;HR/T16M台式高速冷冻离心机,上海基屹生物科技有限公司;UV-2600紫外可见分光光度计,惠州市华高仪器设备有限责任公司;SSX-550扫描电子显微镜、PIXcel1D型X-射线衍射仪,上海永傲精密仪器有限公司;waters1525凝胶渗透色谱仪、色谱柱Agilent PLgel 5 μm MIXED-C,美国沃特世有限公司。
1.3 实验方法
1.3.1 甜酒糟的制备
称取3 kg糯米(干重),润粮12 h,蒸粮1.5 h至蒸熟,冷却至35 ℃;加入安琪甜酒曲6 g与糯米混合均匀,装入坛中于28 ℃发酵4 d,即为甜酒(醪糟)[12],过滤掉液体,所得的固体物质为甜酒糟。
1.3.2 甜酒糟或甜酒曲强化高温大曲的优选
从湘窖酒业制曲车间取样,样品为待投入酿酒生产的成品高温大曲。将其碾碎,以每50 g曲粉为一份,分别与不同添加量的甜酒糟及甜酒曲混合均匀,甜酒糟组添加量分别为1、2、3、4、5、6、7、8 g,安琪甜酒曲添加量分别为0.5、1、1.5、2、2.5、3、3.5、4 g。与不添加甜酒糟和甜酒曲的空白组共17组样品进行单因素实验,每组设置3个平行样品,于35 ℃发酵5 d。根据曲粉中还原糖生成量(发酵前后差)判断强化甜酒曲或甜酒糟对酒曲糖化能力的影响,并优选出较为理想的甜酒曲或甜酒糟添加量。
1.3.3 强化酒曲模拟发酵实验
从1.3.2节中选出最佳的甜酒曲或甜酒糟添加量后,以每4 kg末轮次酱酒粮醅为一组样品,对照组样品拌入0.5 kg传统高温大曲,试验组样品分别拌入0.5 kg强化甜酒糟大曲和0.5 kg强化甜酒曲大曲。充分混匀后发酵,40 ℃发酵30 d,每组样品设置2个平行样品。
1.3.4 还原糖和残余淀粉含量测定
7 d取一次粮醅样品,记录还原糖生成量及淀粉消耗量的变化[13],参照DB34/T 2264—2014《固态发酵酒醅分析方法》,进而分析强化大曲对末轮次酱酒发酵期间糖化效率的影响。
1.3.5 酒曲和末轮次酱酒醅中残余淀粉的提取
1.3.5.1 酒曲淀粉的提取
将酒曲浸泡2 h后进行打浆处理[14],所得浆液通过80目筛网过滤除去各种杂质,随后加水浸泡以便将淀粉液洗出,静置2 h后去除上清液,用纯水反复洗涤剩余部分直至洗涤液澄清,获得淀粉沉淀。将沉淀物在40 ℃烘干48 h,过200目筛后装袋,置于4 ℃环境中保存备用。
1.3.5.2 末轮次酱酒醅中淀粉的提取
由于末轮次酱酒醅中的高梁经过多轮次发酵后颜色会变得更深,水分含量更高使黏性增大,所以在参照糯米淀粉提取方法基础上作适当修改[15]:
末轮次酒醅浸泡2 h后通过40目筛网过滤除去糠壳等各种杂质,对剩余高粱醅进行进一步的研磨挤压处理,分离出醅中的残余淀粉。加水浸泡以便将淀粉液洗出。静置2 h后去除上清液,用纯水反复洗涤直至洗涤液澄清,获得淀粉沉淀。将沉淀物在40 ℃烘干48 h,过200目筛后装袋,置于4 ℃环境中保存备用。
1.3.6 酒曲淀粉和酒醅淀粉中直链淀粉含量的测定
参照GB/T 15683—2025《粮油检验 大米直链淀粉含量的测定》的方法。以吸光度为纵坐标,直链淀粉含量为横坐标,绘制标准曲线方程,如公式(1)所示:
y=0.013 1x+0.042 2,R2=0.999 2
(1)
1.3.7 酒曲淀粉和酒醅淀粉分子质量分布的测定
采用凝胶渗透色谱法测定酒曲和酒醅残余淀粉分子质量分布[16]。以不同分子质量标准PMMA样品过色谱柱,记录其保留时间,以此做出标准方程。色谱柱温度40 ℃,二甲基亚砜为流动相,流速1 mL/min。将酒曲及酒醅淀粉样品分别配制为2 g/L的淀粉待测液,过色谱柱。进样量10 μL,过柱时间15 min,记录其保留时间,代入标准方程计算分子质量。标准曲线方程为公式(2),保留时间X,分子质量Y:
lg Y=-1.085 5X+13.1
(2)
1.3.8 酒曲淀粉和酒醅淀粉晶体结构的测定
采用X射线衍射仪对酒曲及酱香型白酒末轮次酒醅的残余淀粉晶体结构进行表征[17]。测试参数设定为:扫描范围10°~80°(2θ),扫描步长0.01°,工作电压40 kV,入射光源选用Cu Kα辐射(λ=1.540 56 Å)。通过获取样品的X射线衍射图谱,分析2θ角与衍射强度的对应关系,结合峰强度对比解析淀粉晶体结构特征。
1.3.9 酒曲淀粉和酒醅淀粉微观形态的测定
采用扫描电子显微镜对酒曲与末轮次酱香型白酒酒醅中残留淀粉的微观结构形态进行对比观察[18],放大倍率为4 000倍。
1.3.10 数据分析
采用Origin 2022制作标准曲线、处理单因素实验数据并绘制柱状图、处理X射线衍射数据并绘制X射线衍射图;运用SPSS进行显著性分析、借助Excel软件进行做表与分析,所有实验样本均设置了3个平行并取平均数。
2 结果与分析
2.1 甜酒糟对高温大曲糖化能力的影响
从图1-a可以看出,随着甜酒糟添加量的增加,大曲中还原糖的含量也逐渐增加,当添加剂达到7 g/50 g时,原始还原糖含量为(7.737±0.55)g/100 g,5 d后还原糖含量为(9.59±0.15)g/100 g,相比原始还原糖增加了23.95%,说明甜酒糟中的微生物和酶系能够有效促进淀粉的水解,生成更多的还原糖。对比其他各组,甜酒糟添加量为7 g/50 g时还原糖含量增长最大,所以选择7 g/50 g为最佳的甜酒糟强化组,后续记为样品B。
从图1-b可以看出,随着甜酒曲添加量的增加,大曲中还原糖的含量在3.3~4.9 g/100 g之间浮动,初始还原糖与5 d后的还原糖含量相差不大,这是由于甜酒糟可视为甜酒曲的活化状态,也可视为甜酒曲中糖化微生物的扩大培养产物,而甜酒曲中的微生物如霉菌等处于休眠状态[19],使有些霉菌特别是根霉等不能分泌淀粉酶,从而不能将淀粉分解为可发酵的糖类(葡萄糖、麦芽糖等),所以发酵前后还原糖含量变化不大,为与甜酒糟强化组保持一致便于后续比较,将添加量为3.5 g/50 g的甜酒曲组选为甜酒曲强化组,后续记为样品C。

a-甜酒糟;b-甜酒曲
图1 甜酒糟和甜酒曲对高温大曲还原糖含量的变化
Fig.1 Effects on reducing sugar content by sweet wine lees and sweet wine koji for different Daqu samples
2.2 甜酒糟强化对末轮次酱酒醅残余淀粉含量的影响
以传统高温大曲(样品A)为对照,将甜酒糟强化组(样品B)、甜酒曲强化组(样品C)添加至湘窖酒业有限公司第七轮次发酵并蒸酒后的酱香型酒醅中,按粮曲质量比10∶1添加,在实验室模拟酱香型白酒末轮次发酵。
如图2所示,残余淀粉含量随着发酵时间的延长而减少,对照组酒醅中残余淀粉的含量由(23.4±0.9) g/100 g降至(17.78±0.23) g/100 g,甜酒糟强化组中残余淀粉的含量由(22.05±1.05) g/100 g降至(14.85±0.45) g/100 g,甜酒曲强化组中残余淀粉的含量由(21.7±0.95) g/100 g降至(17.2±0.61) g/100 g,甜酒糟强化组比空白组多消耗了15.38%的淀粉,甜酒曲强化组比空白组多消耗了2.56%的淀粉。由此可见,添加甜酒糟或甜酒曲对末轮次酱酒醅的糖化过程都具有一定促进作用,但添加甜酒糟比添加甜酒曲的效果更好,这可能是由于甜酒曲中的微生物活性较低,未能充分发挥其糖化作用。而甜酒糟中微生物活力更强[20],能将更多的淀粉转化为糖类,糖类在发酵过程中转化为乙醇,同时生成酯类、酸类等风味物质,促进企业的产酒量并为酒样增香。
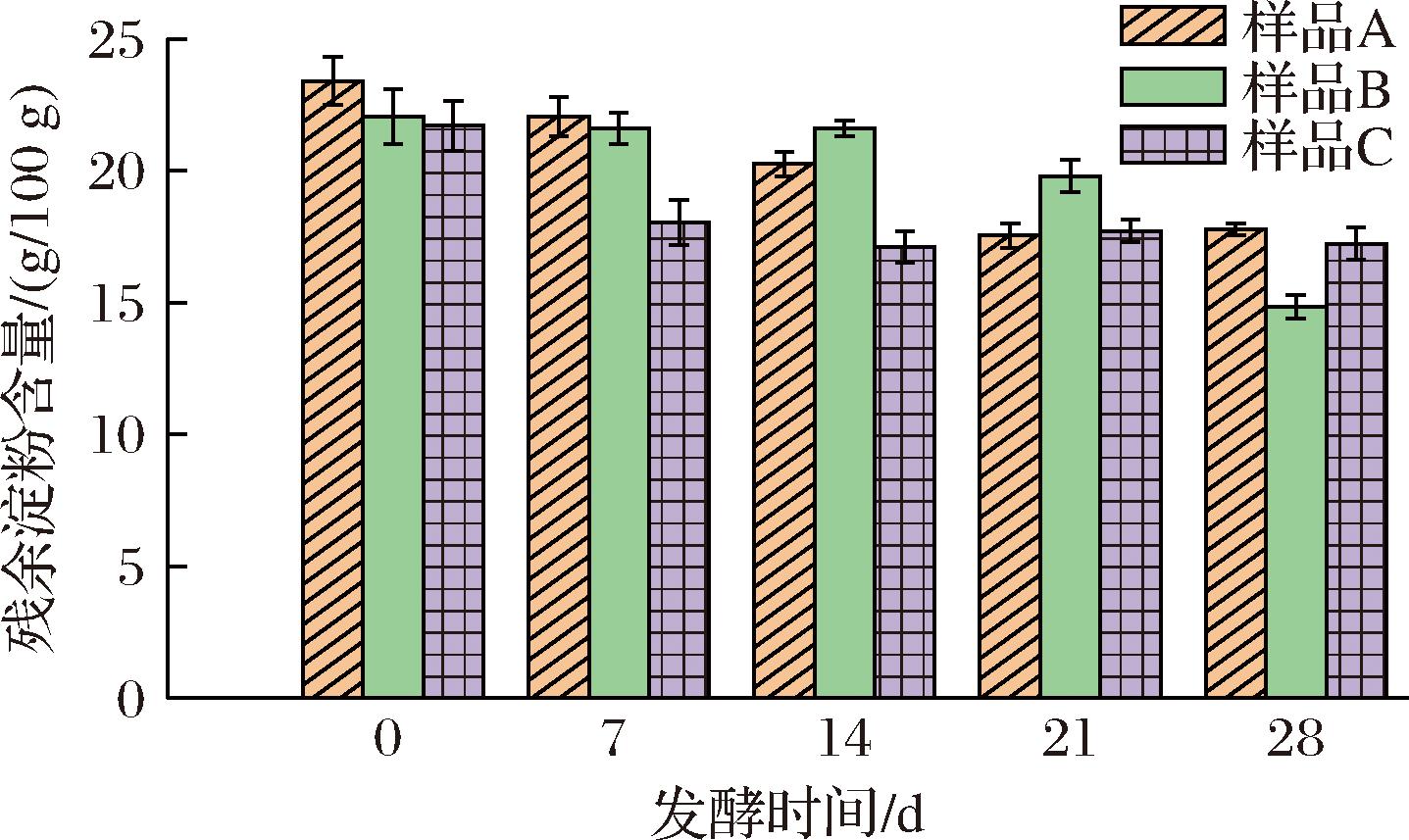
图2 末轮次酱酒发酵过程中酒醅残余淀粉含量变化
Fig.2 Residual starch content for different fermented sorghum samples
2.3 甜酒糟强化对末轮次酱酒醅还原糖含量的影响
如图3所示,还原糖的含量随着发酵时间的延长而增加,对照组中还原糖的含量低于甜酒糟强化组和甜酒曲强化组,在发酵完成后,对照组、甜酒糟强化组、甜酒曲强化组的还原糖含量分别为(2.5±0.05)、(2.8±0.1)、(2.9±0.06)g/100 g,甜酒糟强化组、甜酒曲强化组与比对照组相比,分别多生成了12%、16%的还原糖,由此可见添加甜酒糟或甜酒曲对于酱香型白酒末轮次发酵的糖化过程均有促进作用。甜酒糟与高温大曲的协同作用可以提升糖化效率,减少资源浪费,提升末轮次酱酒的产酒量。
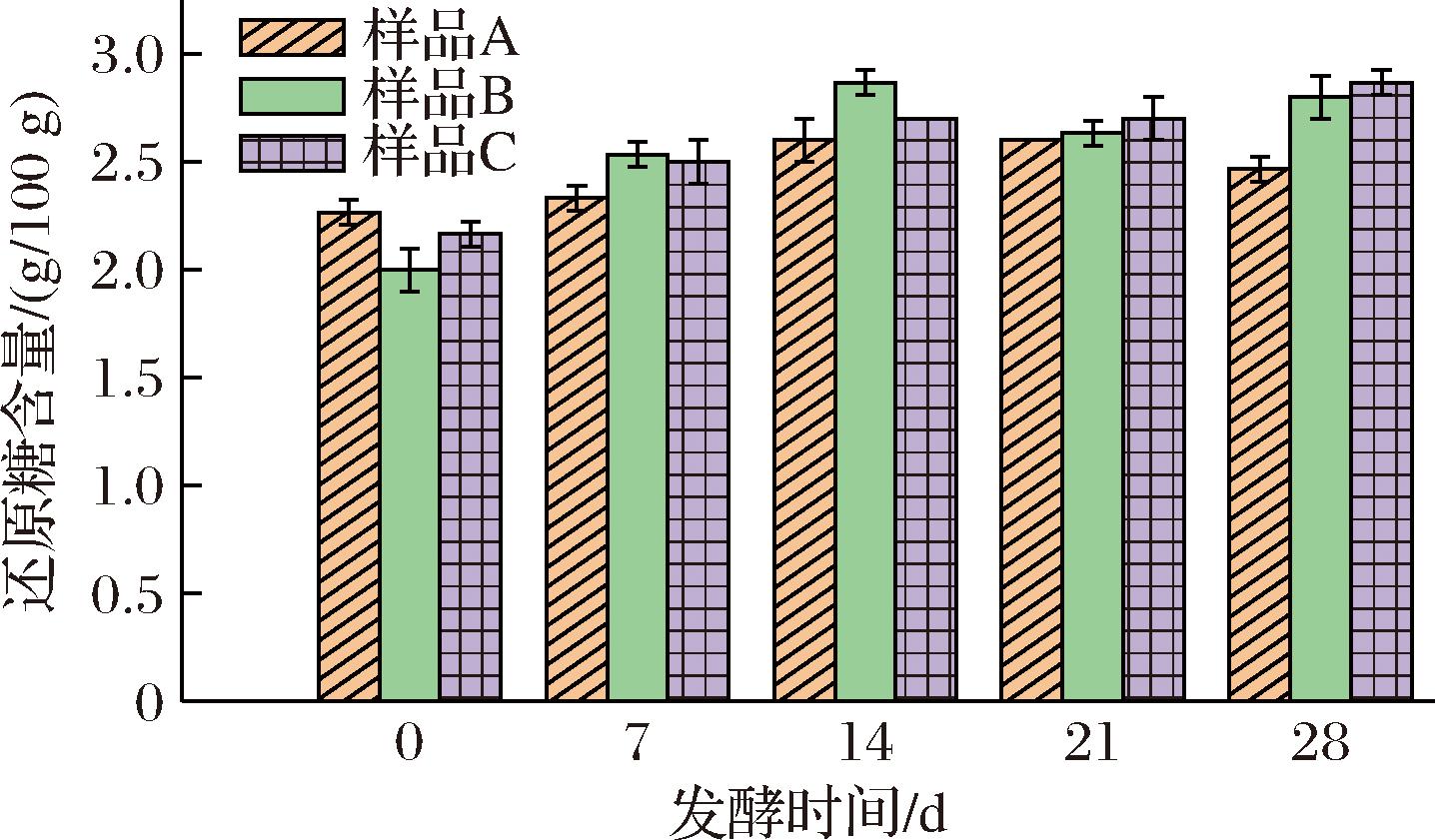
图3 末轮次酱酒发酵过程中酒醅还原糖含量变化
Fig.3 Reducing sugar content for different fermented sorghum samples
以上结果从理化方面证明甜酒糟能促进末轮次酱酒醅糖化效率。在后续实验中分别对酒曲ABC及酒醅ABC的淀粉进行提取,酒曲淀粉ABC分别记为jq A、jq B、jq C,酒醅淀粉ABC分别记为jp A、jp B、jp C,分别对酒曲和酒醅淀粉的直链淀粉含量、晶体结构、分子质量分布以及微观形态进行分析,从分子水平揭示甜酒糟对末轮次酒醅糖化效率的促进作用。
2.4 甜酒糟强化对直链淀粉含量的影响
2.4.1 甜酒糟强化对酒曲直链淀粉含量的影响
采用紫外分光光度法,根据标准曲线计算样品A、样品B、样品C的直链淀粉含量分别为(15.91±1.15)%、(9.91±0.80)%、(13.95±1.19)%。甜酒糟作为甜酒曲发酵后的副产物,含有大量活化的微生物和酶系,能够进一步促进淀粉的分解和糖化;主要通过其中的根霉菌等微生物分泌淀粉酶[21],将淀粉分解为糖类物质。甜酒曲中的α-淀粉酶和β-淀粉酶分别作用于直链淀粉和支链淀粉[22],但对直链淀粉的分解能力有限。
直链淀粉由α-1,4糖苷键连接,分子结构相对简单,易溶于水,糊化后易老化,老化后的淀粉不易被淀粉酶分解[23]。支链淀粉存在大量分支结构,更易吸水糊化,能有效被微生物利用。在酿酒过程中,支链淀粉含量高的原料更有利于发酵和提高出酒率,例如糯玉米、糯高粱等。甜酒糟强化组支链淀粉含量更高,所以更有利于发酵进而提高出酒率。
2.4.2 甜酒糟强化对末轮次酱酒醅直链淀粉含量的影响
末轮次酱酒醅发酵30 d后,提取酒醅淀粉,酒醅样品A(空白组)、酒醅样品B(甜酒糟强化组)、酒醅样品C(甜酒曲强化组)中的直链淀粉含量分别为(26.62±0.47)%、(23.95±1.65)%、(24.13±0.90)%。
甜酒糟强化组中支链淀粉比例升高的原因可能有:甜酒糟中含有大量的糯米,其本身含有较高的支链淀粉[24];甜酒糟中的微生物通过分泌α-淀粉酶和β-淀粉酶,优先水解直链淀粉的α-1,4糖苷键,导致直链淀粉含量降低,间接提高了支链淀粉的相对比例。从食品加工角度看,支链淀粉比例的增加能够提升粮食的热稳定性和糊化稳定性[25-27]。这是由于支链淀粉复杂的分支结构可抑制淀粉的老化,α淀粉不易回生为β淀粉,降低了β淀粉的比例,从而减少酶解阻力,促进淀粉的糖化效率。
甜酒曲中的酶系对直链淀粉的分解能力有限,但可以分解支链淀粉从而间接影响直链淀粉的比例。由于支链淀粉更容易被分解,其含量的降低增加了直链淀粉的相对比例,但实际含量可能仍低于甜酒糟强化组,末轮次酱酒醅中支链淀粉含量的增加有利于微生物的生长和代谢,从而提高出酒率。因此,甜酒糟强化组更适合末轮次酱酒醅的发酵。
由上述结果可知,添加甜酒糟使得酒醅中支链淀粉含量增加,从而增强了淀粉的热稳定性和糊化稳定性,提升了糖化效率,有利于产酒。
2.5 甜酒糟强化对淀粉晶体结构的影响
2.5.1 甜酒糟强化对高温大曲中淀粉晶体结构的影响
如图4所示,3组样品的淀粉晶体结构差异不显著,衍射峰位置及强度基本一致[28],表明淀粉的晶型未发生明显改变。尽管甜酒糟组的衍射峰强度略有减弱,但变化幅度较小(<5%),甜酒曲组变化也不明显,这可能是由于高温大曲中的微生物代谢活性极低,几乎不进行生命活动,所以3种样品的晶体结构类似。
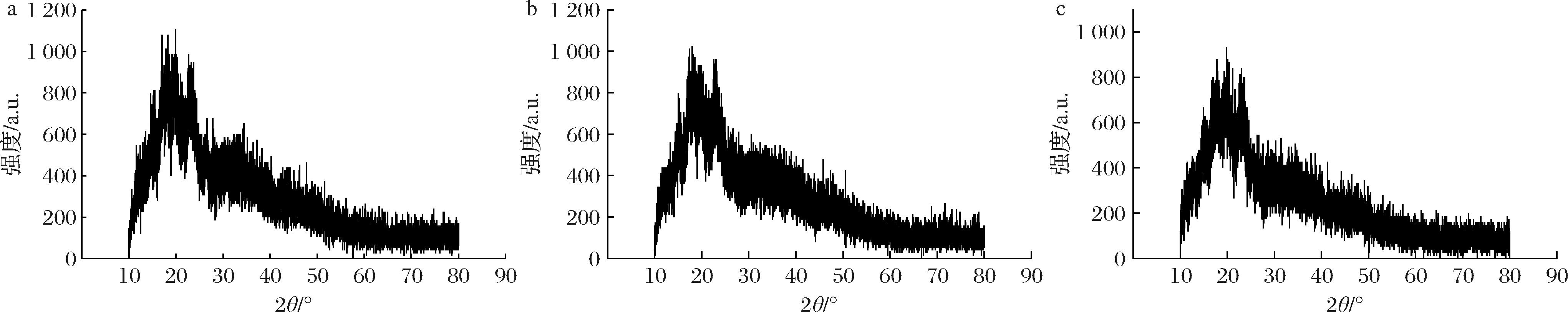
a-jq A;b-jq B;c-jq C
图4 酒曲淀粉样品A、B、C的X-射线衍射图
Fig.4 X-ray diffraction pattern of Daqu starch samples (A, B, C)
2.5.2 甜酒糟强化对末轮次酱酒醅中淀粉晶体结构的影响
如图5所示,3个酒醅样品的峰型都很明显,经历了八轮次的发酵之后,淀粉水解程度较为明显,已经达到淀粉的结晶区。然而,添加甜酒糟或甜酒曲后,这种破坏作用更为显著。甜酒糟强化组的最大衍射峰为1 146,甜酒曲强化组的最大衍射峰为1 293,而空白组的最大衍射峰为1 426,甜酒糟强化组的衍射峰强度明显低于空白组。这表明甜酒糟组能够进一步破坏淀粉的晶体结构,降低其结晶度。相比之下,甜酒曲强化组的晶体结构变化较小,说明甜酒曲组对淀粉晶体结构的破坏能力相对较弱。可见甜酒糟的加入使淀粉分子更容易被分解,进而提高了糖化效率。
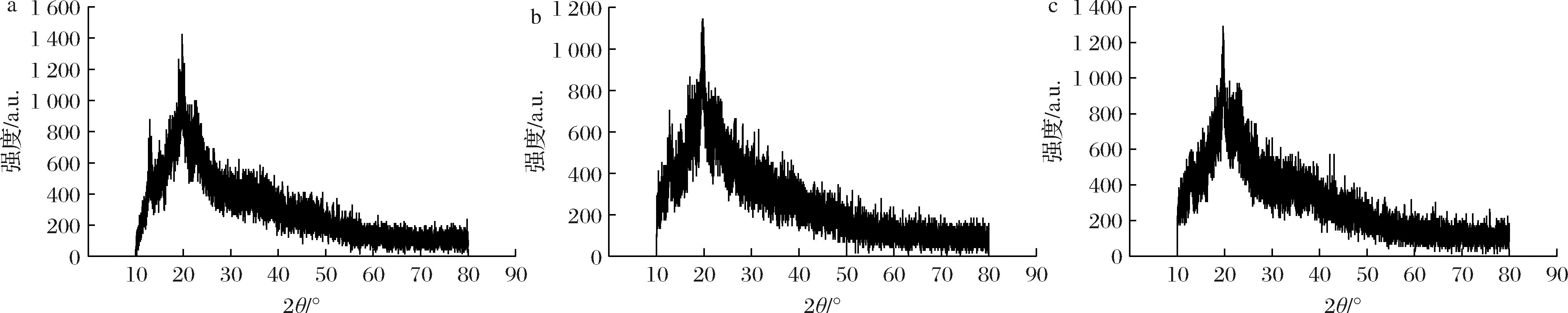
a-jq A;b-jq B;c-jq C
图5 酒醅淀粉样品A、B、C的X-射线衍射图
Fig.5 X-ray diffraction pattern of fermented sorghum starch samples (A, B, C)
由上述结果可知,甜酒糟强化组更容易达到淀粉的结晶区,说明其糖化效果更为明显,进一步印证了甜酒糟在提升糖化效率方面的作用。
2.6 甜酒糟强化对残余淀粉分子质量分布的影响
2.6.1 甜酒糟强化对酒曲淀粉分子质量分布的影响
如表1所示,分子质量在1.0×105 Da及以上,样品A占比为28%,样品B占比24%,样品C占比23%。分子质量在1.0×105以下,样品A占比为72%,样品B则占比76%,样品C占比77%。可以看出样品B和样品C比样品A的小分子质量淀粉更多,从平均分子质量分布来看,样品A为37 714,样品B为31 136,样品C为32 664,样品B和C中小分子淀粉含量更多。甜酒糟强化组中高分子质量淀粉含量降低,低分子质量淀粉含量增加,表明甜酒糟中的微生物能够有效分解淀粉分子,使其分子质量降低,生成更多的可发酵糖[29],从而提高糖化效率。甜酒曲强化组也表现出类似的变化。
表1 对照组与实验组的酒曲淀粉分子质量分布
Table 1 Molecular weights distribution for the control group and the experimental group Daqu starch
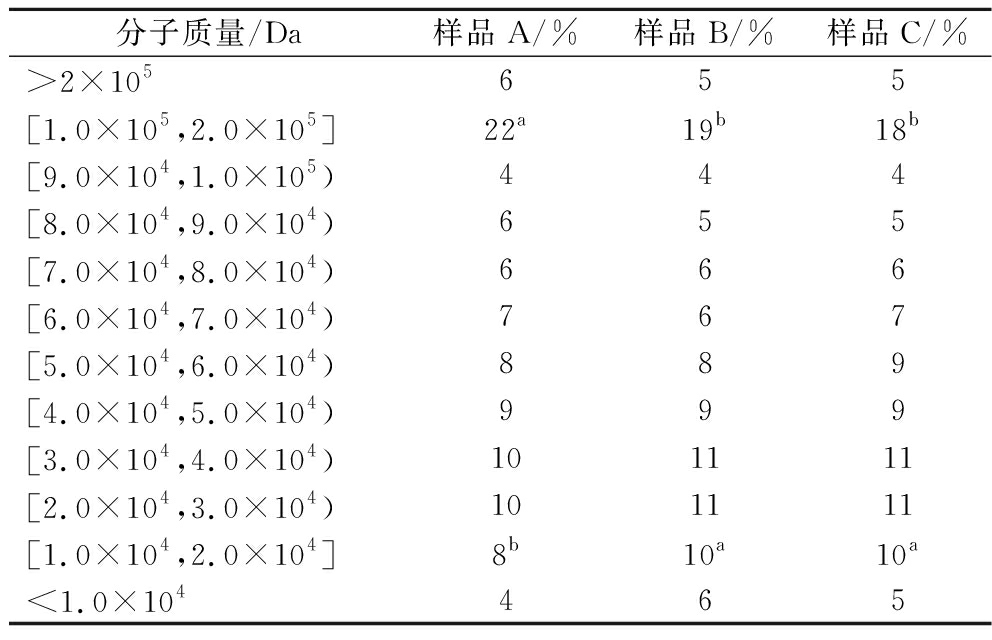
分子质量/Da样品A/%样品B/%样品C/%>2×105655[1.0×105,2.0×105]22a19b18b[9.0×104,1.0×105)444[8.0×104,9.0×104)655[7.0×104,8.0×104)666[6.0×104,7.0×104)767[5.0×104,6.0×104)889[4.0×104,5.0×104)999[3.0×104,4.0×104)101111[2.0×104,3.0×104)101111[1.0×104,2.0×104]8b10a10a<1.0×104465
注:同行不同的小写字母表示差异显著(P<0.05)(下同)。
2.6.2 甜酒糟强化对末轮次酱酒醅淀粉分子质量分布的影响
如表2所示,甜酒糟或甜酒曲的添加显著降低了末轮次酱酒醅淀粉的平均分子质量。相较于空白组,甜酒糟强化组的高分子质量淀粉(>2×105 Da)占比从6%降至4%,中低分子质量区间(4.0×104 Da及以下)占比由35%增至38%,从平均分子质量来看,空白组、甜酒糟强化组、甜酒曲强化组的平均分子质量分别为33 912、31 080、32 886。这表明加入甜酒糟后小分子质量淀粉含量增加,有更多的淀粉转化为还原糖,为后续的酿酒和增香提供一定的物质基础。加入甜酒曲也有同样的变化,但效果不如甜酒糟。可见甜酒糟强化组能降低酒醅淀粉的分子质量,为末轮次酱酒醅中残余淀粉的高效糖化提供了基础,具有减少资源浪费、提升出酒率的实际意义。
表2 对照组与实验组的酒醅淀粉分子质量分布
Table 2 Molecular weight distribution for the control group and the experimental group fermented sorghum starch
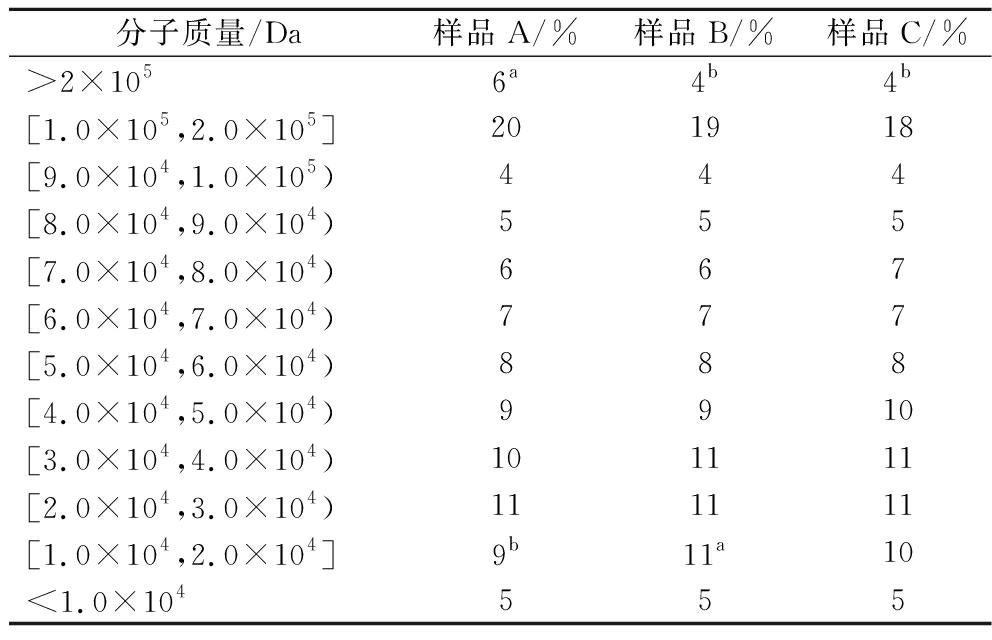
分子质量/Da样品A/%样品B/%样品C/%>2×1056a4b4b[1.0×105,2.0×105]201918[9.0×104,1.0×105)444[8.0×104,9.0×104)555[7.0×104,8.0×104)667[6.0×104,7.0×104)777[5.0×104,6.0×104)888[4.0×104,5.0×104)9910[3.0×104,4.0×104)101111[2.0×104,3.0×104)111111[1.0×104,2.0×104]9b11a10<1.0×104555
强化甜酒糟使得酒醅淀粉的分子质量整体变小,平均分子质量也变小,说明有更多的淀粉转化为还原糖,进一步验证了甜酒糟在提高糖化能力方面的优势。
2.7 甜酒糟强化对淀粉的微观形态的影响
2.7.1 甜酒糟强化对高温大曲中淀粉微观形态的影响
如图6所示,样品A、B和C的淀粉颗粒微观形态差异较小。传统高温大曲中的淀粉颗粒呈现规则的多边形结构,表面光滑且存在一定聚集现象(图6-a)。添加甜酒糟或甜酒曲后,淀粉颗粒的形态未发生显著变化(图6-b、图6-c),仅观察到颗粒表面轻微粗糙化,但整体结构仍保持相对完整。这主要由于高温大曲当中的水分活度较低,绝大多数微生物不进行代谢活动,所以加入甜酒糟及甜酒曲,淀粉微观形态均未发生明显变化。

a-样品A;b-样品B;c-样品C
图6 酒曲淀粉样品的扫描电镜图
Fig.6 SEM images of Daqu starch samples
2.7.2 甜酒糟强化对末轮次酱酒醅中淀粉微观形态的影响
如图7所示,在发酵过程中,空白组的淀粉颗粒逐渐破碎,但颗粒表面部分仍较为光滑,部分颗粒保持完整。相比之下,甜酒糟强化组的淀粉颗粒表面凹凸不平,出现了明显的裂痕和孔洞,颗粒完整性降低,且颗粒之间存在更多的间隙[30],说明甜酒糟强化组中部分淀粉的内层晶体结构遭到了破坏。甜酒曲强化组的淀粉颗粒表面也出现了一些裂痕,但颗粒破碎程度较甜酒糟强化组低。这说明甜酒曲强化组对淀粉颗粒的破坏作用相对较弱。可以看出加入甜酒糟能破坏淀粉颗粒的形态,使其更易于被微生物分解,从而提高糖化效率。

a-样品A;b-样品B;c-样品C
图7 酒醅淀粉样品的扫描电镜图
Fig.7 SEM images of fermented sorghum starch samples
强化甜酒糟组使酒醅淀粉的微观形态发生显著变化,出现明显的孔洞,说明甜酒糟破坏淀粉颗粒的程度更为明显,进一步印证甜酒糟对酒醅糖化能力的促进作用。
对比空白组,甜酒糟强化组和甜酒曲强化组中酒曲淀粉及末轮次酒醅淀粉均出现如下的现象:支链淀粉含量增加;晶体结构更加明显;分子质量趋于降低;淀粉颗粒结构破坏。其中,甜酒糟强化组出现的上述现象比甜酒曲强化组更为明显,说明甜酒糟强化组糖化效率更高,上述研究从淀粉分子的晶体结构、分子质量分布、微观形态的系列变化揭示甜酒糟对糖化效率的促进作用。
3 结论
通过甜酒糟与甜酒曲对高温大曲的强化实验及末轮次酱酒醅的发酵验证,可以得出以下结论:a)糖化效率提升:甜酒糟(7 g/50 g大曲)显著促进高温大曲的糖化能力,末轮次酒醅残余淀粉消耗量较空白组提高15.38%,还原糖生成量增加12%,而甜酒曲(3.5 g/50 g大曲)也能促进高温大曲的糖化能力,末轮次酒醅残余淀粉消耗量较空白组提高2.56%,还原糖生成量增加16%,表明甜酒糟与高温大曲的协同作用更高效。b)淀粉结构改变:添加甜酒糟破坏了淀粉的晶体结构,减弱了最大衍射峰强度,降低结晶度;同时促使淀粉分子质量整体变小,并通过扫描电镜观察到淀粉颗粒表面裂痕增多、孔洞增多。
因此加入甜酒糟能提高末轮次酱酒醅的糖化效率,不仅可以提高粮食利用率,而且可以有效解决末轮次酱酒醅残余淀粉利用率低的问题,减少资源浪费,为酱香型白酒工艺优化提供了新思路。
本文研究了甜酒糟强化对高温大曲糖化能力的促进作用及在末轮次酱酒中的应用,接下来将进一步研究甜酒糟对末轮次酱酒风味的影响,验证其在末轮次酱酒醅中的应用价值。
[1] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5425-5432.
[2] 戴奕杰, 李宗军, 田志强.酱香型白酒酒醅酶活性和轮次酒理化指标分析[J].中国酿造, 2019, 38(2):31-36.DAI Y J, LI Z J, TIAN Z Q.Enzyme activity of fermented grains of sauce-flavor Baijiu and analysis of physical and chemical index of rounds Baijiu[J].China Brewing, 2019, 38(2):31-36.
[3] 付庆凯, 陈帆, 孟廷淋, 等.酱香型白酒不同轮次发酵酒醅差异性研究[J/OL].食品与发酵工业, 2025:1-11.(2025-01-26).DOI:10.13995/j.cnki.11-1802/ts.040940.FU Q K, CHEN F, MENG T L, et al.Study on differences in fermented grains across different fermentation rounds of Jiangxiangxing Baijiu[J/OL].Food and Fermentation Industries, 2025:1-11.(2025-01-26).DOI:10.13995/j.cnki.11-1802/ts.040940.
[4] 张兆丰, 万勇, 余有贵, 等.浓香型白酒生产中小曲堆积糖化的工艺研究[J].酿酒科技, 2022(2):79-86;98.ZHANG Z F, WAN Y, YU Y G, et al.Stacking saccharification with xiaoqu in the production of Nongxiang Baijiu[J].Liquor-Making Science &Technology, 2022(2):79-86;98.
[5] 徐国俊, 张玉, 蔡雄, 等.大小曲混合发酵苦荞酒工艺研究及风味成分分析[J].食品工业科技, 2015, 36(6):225-229;244.XU G J, ZHANG Y, CAI X, et al.Mixed Tartary buckwheat wine fermentation process by Daqu and Xiaoqu and analysis of flavoring component[J].Science and Technology of Food Industry, 2015, 36(6):225-229;244.
[6] 孙祥祥, 石飞, 刘长虹, 等.米酒作为馒头传统发酵剂的生产工艺研究[J].中国酿造, 2019, 38(2):144-147.SUN X X, SHI F, LIU C H, et al.Optimization of production process of rice wine used for steamed bread traditional starter[J].China Brewing, 2019, 38(2):144-147.
[7] 梁雪梅. 甜酒曲中酵母菌筛选及复配发酵提升醪糟品质研究[D].成都:西华大学, 2023.LIANG X M.Screening the yeast from sweet wine koji and improving the quality of Laozao by the cooperative fermentation[D].Chengdu:Xihua University, 2023.
[8] 康宪, 李良红, 林捷.传统桂林甜酒曲中酵母分离鉴定及发酵性能研究[J].食品工业, 2017, 38(1):126-129.KANG X, LI L H, LIN J.Isolation, identification and research of fermentation characteristics of yeast from traditional Guilin rice wine koji[J].The Food Industry, 2017, 38(1):126-129.
[9] LIU F, HE Y, WANG L, et al.Feasibility of the use of visible and near infrared spectroscopy to assess soluble solids content and pH of rice wines[J].Journal of Food Engineering, 2007, 83(3):430-435.
[10] LEE M E, SHIN H Y, BHARDWAJ N, et al.Effective bioconversion of fungal-spoiled starchy food waste into fermentable sugars using fungi-degrading, artificial amylosomes[J].Bioresource Technology, 2023, 388:129760.
[11] QI W J, KONG S Y, LI X Q, et al.Insight into characteristics in rice starch under heat- moisture treatment:Focus on the structure of amylose/amylopectin[J].Food Chemistry:X, 2024, 24:101942.
[12] 闫华文. 甜酒曲中真菌多样性的研究及甜酒酿营养成分分析[D].曲阜:曲阜师范大学, 2015.YAN H W.Fungal diversity in sweet wine koji and nutritional composition analysis of fermented sweet rice[D].Qufu:Qufu Normal University, 2015.
[13] 何璇, 高银涛, 余博文, 等.酱香型白酒发酵过程全周期跟踪分析[J].食品与发酵工业, 2022, 48(10):199-205.HE X, GAO Y T, YU B W, et al.Tracking and analysis of the whole fermentation process of Maotai-flavor Baijiu[J].Food and Fermentation Industries, 2022, 48(10):199-205.
[14] 杨凤英, 秦洋.冠突散囊菌对酒曲糖化能力的影响及其机制研究[J].食品与发酵工业, 2023, 49(5):81-87.YANG F Y, QIN Y.Impact and mechanism of Eurotium critatum on the saccharification ability of Jiuqu[J].Food and Fermentation Industries, 2023, 49(5):81-87.
[15] 赵千慧, 周慧玲, 秦洋.冠突散囊菌对高粱酒酿造过程糖化效率的促进作用与原理[J].食品与发酵工业, 2024, 50(15):72-78.ZHAO Q H, ZHOU H L, QIN Y.Study on saccharification promoting of the sorghum Baijiu by Eurotium cristatum and its mechanism[J].Food and Fermentation Industries, 2024, 50(15):72-78.
[16] SUN X X, SUN Z Z, SALEH A S M, et al.Understanding the granule, growth ring, blocklets, crystalline and molecular structure of normal and waxy wheat A- and B- starch granules[J].Food Hydrocolloids, 2021, 121:107034.
[17] LIAN X J, CHENG K L, WANG D L, et al.Analysis of crystals of retrograded starch with sharp X-ray diffraction peaks made by recrystallization of amylose and amylopectin[J].International Journal of Food Properties, 2017, 20(sup3):S3224-S3236.
[18] ZHANG S J, WANG Z, ZHOU X P, et al.Insights into the regulation mechanisms of dual hydrothermal treatment on the structure and digestive characteristics of A- and B-type wheat starch granules[J].Food Research International, 2025, 200:115448.
[19] 邹玉婷, 贺紫涵, 许碧涛, 等.酒曲中产酶微生物的筛选及其对发酵米酒品质的影响[J].食品科学, 2024, 45(10):108-117.ZOU Y T, HE Z H, XU B T, et al.Selection of enzyme-producing microorganisms from jiuqu and their influence on the quality of fermented rice wine[J].Food Science, 2024, 45(10):108-117.
[20] 任丽霞. 甜酒曲微生物群落结构分析及八二曲的改良研究[D].上海:上海应用技术大学, 2020.REN L X.Microbial community structure analysis of sweet wine koji and improvement of Baer Qu[D].Shanghai:Shanghai Institute of Technology, 2020.
[21] 何小容, 张庆, 唐家环, 等.浓香型白酒大曲发酵过程中主要微生物群系及其作用研究进展[J].中国酿造, 2024, 43(8):1-6.HE X R, ZHANG Q, TANG J H, et al.Research progress of main microflora and their roles during strong-flavor Baijiu Daqu fermentation[J].China Brewing, 2024, 43(8):1-6.
[22] 周金虎, 陈茂彬, 毛志海, 等.甜酒曲中一株高产淀粉酶根霉的筛选与鉴定[J].酿酒科技, 2019(1):37-40.ZHOU J H, CHEN M B, MAO Z H, et al.Screening and identification of a Rhizopus strain with high-yield of amylase from Jiuniang starter[J].Liquor-Making Science &Technology, 2019(1):37-40.
[23] 韩文芳, 林亲录, 赵思明, 等.直链淀粉和支链淀粉分子结构研究进展[J].食品科学, 2020, 41(13):267-275.HAN W F, LIN Q L, ZHAO S M, et al.Recent advances in molecular structures of amylose and amylopectin[J].Food Science, 2020, 41(13):267-275.
[24] CHEN X Y, ZHU L, ZHANG H, et al.Effects of composition, starch structural orders, and kernel structure on starch in vitro digestion of highland barley[J].Carbohydrate Polymers, 2023, 301:120274.
[25] YANG Q H, ZHANG W L, LUO Y, et al.Comparison of structural and physicochemical properties of starches from five coarse grains[J].Food Chemistry, 2019, 288:283-290.
[26] 庞臻, 马凤丽, 程平言, 等.双波长比色法测定高粱中支链淀粉占总淀粉比例[J].食品工业, 2024, 45(7):316-322.PANG Z, MA F L, CHENG P Y, et al.Determination of the proportion of amylopectin to total starch in sorghum by dual-wavelength method[J].The Food Industry, 2024, 45(7):316-322.
[27] ASARE E K, JAISWAL S, MALEY J, et al.Barley grain constituents, starch composition, and structure affect starch in vitro enzymatic hydrolysis[J].Journal of Agricultural and Food Chemistry, 2011, 59(9):4743-4754.
[28] 史盈盈, 谈宇婷, 张倩, 等.小麦淀粉结构、特性及改性和应用研究进展[J].食品科技, 2025, 50(1):240-247.SHI Y Y, TAN Y T, ZHANG Q, et al.Research progress on structure, characterization, modification and applications of wheat starch[J].Food Science and Technology, 2025, 50(1):240-247.
[29] SUN X X, SUN Z Z, SALEH A S M, et al.Understanding the granule, growth ring, blocklets, crystalline and molecular structure of normal and waxy wheat A- and B- starch granules[J].Food Hydrocolloids, 2021, 121:107034.
[30] WANG Y J, XIE Z F, WU Q, et al.Preparation and characterization of carboxymethyl starch from cadmium-contaminated rice[J].Food Chemistry, 2020, 308:125674.