麒麟菜,又称鸡脚菜,根据所含卡拉胶类型的不同,可分为麒麟菜属(Eucheuma)、卡帕藻属(Kappaphycus)和琼枝藻属(Betaphycus)[1],这种热带和亚热带大型经济藻类主要分布于我国海南省和东南亚国家的沿海地区,富含多糖、藻色素、不饱和脂肪酸和矿物质等多种营养成分[2]。据统计,2022年麒麟菜的全球年产量高达984.2万t(鲜重),仅次于海带,占藻类养殖总产量的26.9%(联合国粮农组织,2025年)。麒麟菜性苦、味平,鲜藻可食用,干藻则可入药,研究表明,从麒麟菜中提取的藻多糖在抗过敏[3]、降血糖[4]和抗氧化[5]等方面均表现出显著的生物活性。特别地,琼枝麒麟菜(Betaphycus gelatinum)作为海南特有的品种,其藻胶体中κ-卡拉胶含量高达50%[6]。然而,由于麒麟菜含胶量大且藻腥味重,这在一定程度上限制了其开发和应用的范围。目前,麒麟菜主要用于工业提取生产卡拉胶,仅有少部分用于即食食品的开发。
研究表明,降解处理能够促进海藻中营养物质的释放,将难以利用的大分子物质分解成易于吸收的小分子物质,利于海藻活性成分的提取,从而提高海藻的利用价值和扩大应用范围[7]。麒麟菜富含多糖和矿物质,经降解处理,可以提高藻多糖、寡糖等活性成分的提取率,获得更易于吸收的低分子质量物质[8-9]。目前海藻降解的方法主要包括物理降解法、化学降解法和生物降解法,其中生物降解法因反应条件温和、易于控制、底物专一性强、毒副产物少等优点而备受关注。生物降解法包括酶解和微生物发酵,主要通过褐藻胶酶和纤维素酶等酶作用于构成海藻细胞壁的结构多糖[10]。有研究表明,微生物发酵不仅能产生多种酶来协同降解海藻,还能增加海藻的营养价值、提升消化率、增强生物活性和增加适口性,因此海藻微生物发酵及其产物活性研究成为近年来国内外的研究热点[11-12]。
天然海藻成分复杂,其中多糖结构因物种、生长阶段和收获季节不同而异,如红藻中的卡拉胶在不同生长阶段其组成会发生变化[13],这使得海藻的微生物降解难度增大。然而目前国内外用于海藻降解的微生物主要包括商业益生菌和从海洋环境、软体动物、藻类中分离的产特定海藻多糖降解酶菌株[14],而且这2类菌株的筛选和应用研究多集中在海带等褐藻上[15-16],而对于麒麟菜微生物降解发酵方面的研究鲜有报道。因此,本研究以卡拉胶为唯一碳源,通过透明圈法、卡拉胶酶活力测定和麒麟菜降解率测定分别进行初筛和复筛,获得能够高效降解麒麟菜的菌株,并对其发酵条件进行优化,以期为麒麟菜的绿色加工和高值化利用提供方法思路和理论参考。
1 材料与方法
1.1 材料与试剂
新鲜琼枝麒麟菜采自海南省琼海市麒麟菜养殖基地,经清洗、60 ℃烘干、粉碎、过60目筛得到麒麟菜粉。陈海水取自湛江附近海域,装入桶中并放置暗处数星期后,过0.22 μm滤膜备用。
筛菌样品:硬江蓠(Gracilaria firma)采自广东省雷州市某海域;海藻粉购自广东省湛江市赤坎区某市场;滩涂泥采自江苏省盐城市响水县;活藻石分别采自南海某海域和山东省日照市某海域。
D-半乳糖、(NH4)2SO4,西陇科学股份有限公司;碘、碘化钾,上海麦克林生化科技股份有限公司;DNS,上海源叶有限公司;博检革兰氏阴性细菌鉴定系统试剂盒,青岛高科技工业园海博生物技术有限公司;1×PBS,北京兰杰柯科技有限公司;蛋白胨,北京陆桥技术股份有限公司;酵母提取物,南京厚信生物技术有限公司;κ-卡拉胶,青岛海大海洋寡糖科技有限公司;2×MightyAmp Buffer Ver.2 (Mg2+,dNTP plus)、MightyAmp DNA Polymerase Ver.2、DL 2000 DNA Marker,宝生物工程(大连)有限公司;50×TAE缓冲液,生工生物工程(上海)股份有限公司;Ultra GelRed (10 000×),南京诺唯赞生物科技股份有限公司。
卡拉胶固体培养基(g/L):κ-卡拉胶 20,酵母提取物 1,(NH4)2SO4 5,陈海水(自然pH值),121 ℃,灭菌20 min;2216E液体培养基(g/L):酵母提取物 1,蛋白胨 5,陈海水(自然pH值),121 ℃,灭菌20 min;2216E固体培养基(g/L):液体培养基中加入琼脂粉 15;麒麟菜发酵培养基(g/L):麒麟菜粉 20、(NH4)2SO4 5,酵母提取物 1、陈海水(自然pH值),121 ℃,灭菌20 min。
1.2 仪器与设备
SPX-250B-Z生化培养箱,上海博迅医疗生物仪器股份有限公司;HZQ-F160振荡培养箱,金坛万华实验仪器厂;1ML拍击式均质机,上海之信仪器有限公司;JIDI-20R台式高速冷冻离心机,广州吉迪仪器有限公司;LS-B50L立式压力蒸汽灭菌器,上海华线医用核子仪器有限公司;JY96-IIN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;A300梯度PCR仪,杭州朗基科学仪器有限公司;Varioskan LUX 多功能酶标仪,Thermo Scientific公司;JSM-7610F扫描电子显微镜(scanning electron microscopy,SEM),日本电子株式会社。
1.3 实验方法
1.3.1 麒麟菜降解菌株的分离
称取1 g硬江蓠、海藻粉、滩涂泥等样品置于装有10 mL无菌海水的无菌袋中,于均质机均质5 min,取均质样品液梯度稀释并涂布于卡拉胶固体培养基上,于30 ℃恒温培养72 h,选取合适稀释梯度的平板,观察菌落形态,挑取形态不同且周围出现凹陷或透明圈的菌落,在卡拉胶固体培养基上多次划线纯化,挑取单菌落转接至2216E固体培养基斜面保菌。
1.3.2 麒麟菜降解菌株的筛选
将纯化后的菌株点种至卡拉胶固体培养基上,于30 ℃恒温培养48 h,并用卢戈氏碘液浸染观察,采用十字交叉法测量透明圈(D)和菌落(d)直径并计算其比值(D/d),选取D/d≥2的菌株于25%(体积分数)甘油管中保存,用于下一步实验。
将初筛得到的菌株于卡拉胶固体培养基划线活化,30 ℃恒温培养48 h,挑取活化后单菌落接种至卡拉胶固体培养基上,于30 ℃培养72 h,将菌落用2 mL 1×PBS(pH=7.4)洗脱,经细胞超声破碎仪(200 W,破碎3 s,停3 s,总时长3 min,冰浴)破碎,菌液于4 ℃,10 000 r/min,离心10 min,取上清液作为粗酶液,测定卡拉胶酶活力。选取卡拉胶酶活力较高的菌株接种至2216E液体培养基,180 r/min,30 ℃培养24 h,活化2次,菌液于4 ℃,8 000 r/min,离心10 min,弃上清液,菌体沉淀以pH 7.0的PBS重悬,调节OD600=1.0并接种于麒麟菜发酵培养基中,180 r/min,30 ℃发酵5 d,测定麒麟菜降解率及发酵上清液还原糖质量浓度,选取酶活力和降解率较高的菌株用于麒麟菜发酵。
1.3.3 卡拉胶酶活力的测定
酶活力测定采用DNS法,取200 μL粗酶液加入到800 μL体积分数为0.2%的κ-卡拉胶溶液中混匀,以发酵上清液和底物分别为对照组,40 ℃水浴反应30 min,加入1 mL DNS溶液混匀终止反应,沸水浴5 min,冷却至室温,于酶标仪540 nm波长处测定吸光度值。以D-半乳糖作标准曲线,利用实验组和对照组吸光度的差值计算还原糖的产生量。1个酶活力单位(U)定义为:在上述条件下,每分钟产生1 μg还原糖的酶量。按公式(1)计算:
酶活力![]()
(1)
式中:m,还原糖量,mg;N,稀释倍数;V,酶液体积,mL;t,反应时间,min。
1.3.4 麒麟菜降解率的测定
发酵结束,发酵液经10 000 r/min,离心10 min,取上清液于4 ℃保存备用,沉淀于60 ℃烘干至恒重,称取质量,以未接菌的麒麟菜发酵培养基为对照。按公式(2)计算:
(2)
式中:W,麒麟菜降解率,%;m0,初始麒麟菜发酵培养基中麒麟菜的干重,g;m1,未降解麒麟菜干重,g。
1.3.5 麒麟菜降解菌的鉴定
采用平板划线法将待测菌株接种至2216E固体培养基上,30 ℃恒温培养1~2 d。待平板上长出明显菌落后,观察菌落的形状和大小、透明度、边缘、表面光泽、隆起形状、菌落及培养基的颜色等特征,使用光学显微镜和透射式电子显微镜观察菌体形态及大小。采用博检革兰氏阴性细菌鉴定系统试剂盒进行生理生化特性测定。
将目的菌株接种于2216E固体培养基划线活化2代,挑取单菌落,使用细菌16S rDNA的通用引物(27F,1492R)进行菌落PCR扩增。总反应体系为30 μL:15 μL 2×MightyAmp Buffer,0.75 μL MightyAmp DNA Poly-merase,上下游引物各0.75 μL,12.75 μL ddH2O。反应程序:94 ℃ 4 min;94 ℃ 30 s,55 ℃ 20 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min,4 ℃下保存。将PCR产物送至生工生物工程(上海)有限公司测序。将测序结果与EZBioCloud和NCBI数据库中的序列进行BLAST比对分析,并用MEGA5.0构建系统发育树,建树方法设置为NJ法(neighbor-joining method)。
1.3.6 麒麟菜发酵液还原糖的测定
发酵结束后,于10 000 r/min,离心10 min,取1 mL上清液于试管中,加入1 mL DNS试剂,于沸水浴煮沸5 min,待冷却至室温,取200 μL于96孔板,使用酶标仪于540 nm波长处测定吸光度值,代入D-半乳糖标准曲线,经换算得到发酵上清液还原糖质量浓度。
1.3.7 麒麟菜发酵条件优化
1.3.7.1 单因素试验
分析接种量(5%、10%、20%、30%、40%)、料液比(5、10、20、30、40,g∶L)、补充氮源种类[蛋白胨、牛肉膏、酵母浸粉、(NH4)2SO4、NH4Cl]、(NH4)2SO4添加量(0、2.5、5、7.5、10 g/L)、发酵时间(1、3、5、7、9 d);发酵温度(20、25、30、35、40 ℃)、发酵初始pH值(5、6、7、8、9)对麒麟菜降解率和发酵上清液还原糖质量浓度的影响。
1.3.7.2 Plackett-Burman试验设计
以单因素试验为基础,利用Design-Expert 13软件设计Plackett-Burman试验,探究接种量、(NH4)2SO4添加量、料液比、发酵温度、发酵时间、发酵初始pH值各个因素对麒麟菜降解率的影响,试验设计见表1。
表1 Plackett-Burman试验设计因素水平表
Table 1 Plackett-Burman experimental design factor level

代码因素水平-1+1A接种量/%515B(NH4)2SO4添加量/(g/L)0 5C料液比(g∶L)2040D发酵温度/℃30 40 E发酵时间/d3 7 F发酵初始pH值79
1.3.7.3 最陡爬坡试验设计
在Plackett-Burman试验结果的基础上,对显著因素做最陡爬坡试验。最陡爬坡试验以麒麟菜降解率作为响应值,以Plackett-Burman试验各因素的正负效应为基础,确定爬坡的方向和步差,得到响应面的中心点。
1.3.7.4 响应面试验设计
在上述试验的基础上,利用Design-Expert13软件设计响应面优化试验,以麒麟菜降解率(Y)为响应值,发酵温度(A)、(NH4)2SO4添加量(B)和发酵时间(C)为主要因素,设计三因素三水平的试验,对菌株ZN-8发酵麒麟菜条件进行优化,每组试验重复3次,确保试验的准确性,试验设计见表2。
表2 Box-Behnken 试验设计因素水平
Table 2 Factors and levels of response surface design

因素水平-101A(发酵温度)/℃202530B[(NH4)2SO4添加量]/(g/L)01.252.5C(发酵时间)/d567
1.4 数据处理
所有试验均重复3次,结果使用Design-Expert13响应面设计软件、Origin 2021和SPSS 27进行数据处理。
2 结果与分析
2.1 麒麟菜降解菌株的筛选
从来自盐城、南海、日照地区的滩涂泥、活藻石及江蓠等样品中分离纯化得到能在以κ-卡拉胶为唯一碳源的固体培养基上生长的菌株共88株。通过透明圈法初筛得到菌落周围有透明圈且(D/d)≥2的菌株共41株。然后对初筛得到的菌株进行复筛。如图1-a所示,通过DNS法测定菌株酶活力,得到6株κ-卡拉胶酶活力较高的菌株,分别为ZR-1、ZN-12、ZN-8、ZR-12、ZN-10、ZR-9(ZN-10与ZR-9为同株菌),且发现ZN-12、ZR-12和ZN-10具有较好的产琼脂酶能力,ZR-1和ZN-8具有产纤维素酶能力,其中菌株ZN-8的κ-卡拉胶酶活力最高,为(19.69±0.58) U/mL。如图1-b所示,按一定接种量将5株酶活力较高的菌株接种到麒麟菜发酵培养基中,测定麒麟菜降解率和发酵上清液还原糖质量浓度,结果显示,ZN-8的麒麟菜降解效果最好,降解率达(35.77±1.90)%,发酵上清液还原糖质量浓度为(0.71±0.03) mg/mL,因此选取ZN-8作为发酵菌株,并利用甘油管进行保菌,进行下一步实验。

a-菌株的卡拉胶酶活力;b-菌株发酵麒麟菜效果
图1 筛选菌株的性质比较
Fig.1 Comparison of the nature of the screened strains
2.2 麒麟菜降解菌株的鉴定
2.2.1 形态学及生理生化鉴定
菌株ZN-8在2216E平板上30 ℃下培养48 h后菌落形态如图2-a所示,菌落呈圆形,表面光滑,边缘不规则,颜色为金黄色。电子扫描显微镜观察菌体为长杆状,直径约0.2 μm,长度约1~4 μm,不产孢子。菌株ZN-8的生理生化鉴定结果如表3所示,革兰氏染色结果为阴性。

a-ZN-8 菌落形态图;b-ZN-8透明圈图;c-ZN-8革兰氏染色图;d-ZN-8扫描电子显微镜图
图2 菌株ZN-8的性质
Fig.2 Characterization of strains ZN-8
表3 菌株ZN-8生理生化鉴定结果
Table 3 Physiological and biochemical identification results of strain ZN-8

参数结果参数结果革兰氏染色-明胶+β-半乳糖苷酶+葡萄糖+精氨酸-甘露醇+赖氨酸-肌醇-鸟氨酸-山梨醇-柠檬酸-鼠李糖-产H2S-蔗糖+脲酶-蜜二糖+乳糖-苦杏仁甙-吲哚-阿拉伯糖-乙酰甲基甲醇-氧化酶+
注:“+”表明试验结果为阳性,“-”表明试验结果为阴性。
2.2.2 菌株16S rDNA鉴定结果分析
经16S rDNA测序得到菌株ZN-8的16S rDNA基因序列,通过BLAST比对发现菌株ZN-8与模式菌株Cellulophaga geojensis M-M6同源性最高,其相似度达到99%,且由图3可知两者处于系统发育树同一支,亲缘关系最近。结合菌株的形态学及生理生化鉴定结果,将菌株ZN-8初步鉴定为海洋嗜纤维菌属(Cellulophaga),并命名为Cellulophaga geojensis ZN-8[17-18]。
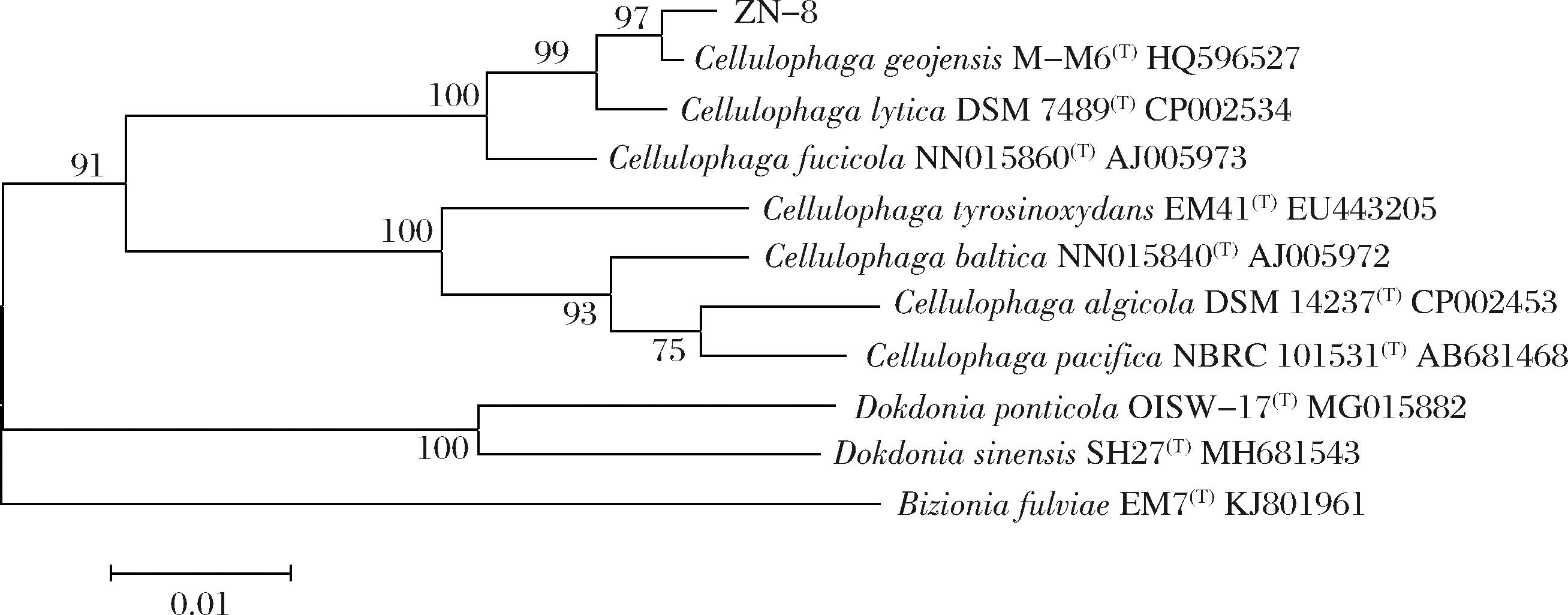
图3 菌株ZN-8的系统进化树
Fig.3 The phylogenetic tree of ZN-8
2.3 单因素试验
2.3.1 接种量对降解率和还原糖质量浓度的影响
如图4-a所示,接种量在5%~40%时,麒麟菜降解率随接种量的增大呈先增大后平缓的趋势,接种量为20%时,麒麟菜降解率达到最大为43.61%,继续增大接种量对麒麟菜降解率的影响不显著;发酵液还原糖质量浓度随接种量的增大呈先增大后降低的趋势,接种量为20%时,发酵液还原糖质量浓度达到最大为1.03 mg/mL,继续增大接种量,发酵液还原糖质量浓度显著降低。分析可能是培养基中的营养物质有限,当接种量过大,只能满足菌株的自身生长所需,不利于其产酶,且还原糖结构相对简单,更易被微生物吸收利用,使得发酵液中的还原糖被大量消耗[19]。考虑到降解效率,且接种量分别为10%和20%时,接种量对于麒麟菜降解率和发酵液还原糖质量浓度的影响差异不显著,因此初步确定接种量为10%。
2.3.2 料液比对降解率和还原糖质量浓度的影响
如图4-b所示,料液比在5~40(g∶L)时,麒麟菜降解率随料液比增大呈先增大后降低的趋势,当料液比为10(g∶L)时,麒麟菜降解率达到最大为43.65%,继续增大料液比,麒麟菜降解率逐渐降低,分析可能原因是加入麒麟菜粉过多,会吸收培养基中大量液体,同时由于麒麟菜粉中的胶质溶出使溶液黏度增大,使培养基中溶氧量降低,不利于菌株的生长和产酶[20]。发酵液还原糖质量浓度随料液比增大呈先平缓后增大的趋势,料液比在5~10(g∶L)时,增大料液比对发酵液还原糖质量浓度影响不显著,继续增大料液比,发酵液还原糖质量浓度显著增大,当料液比为30(g∶L)时,麒麟菜降解率和发酵液还原糖质量浓度均达到较高水平,分别为38.44%和1.44 mg/mL。基于此,初步确定料液比为30(g∶L)。
2.3.3 氮源种类及浓度对降解率和还原糖质量浓度的影响
如图4-c所示,当氮源为(NH4)2SO4时,麒麟菜降解率和发酵液还原糖质量浓度最高,分别达到35.82%和0.70 mg/mL,因此选取(NH4)2SO4作为氮源。进一步研究(NH4)2SO4添加量对麒麟菜降解率和还原糖质量浓度的影响,结果如图4-d所示,(NH4)2SO4添加量在0~10 g/L时,麒麟菜降解率和发酵液还原糖质量浓度随添加量的增加呈先增大后降低的趋势,推测是NH4+能与卡拉胶酶催化位点结合,在一定浓度范围内能增强其酶活力,当(NH4)2SO4浓度过高时,菌体按比例吸收营养,会对其产酶产生抑制作用,从而影响菌株对麒麟菜的降解,使得发酵液还原糖质量浓度降低[21]。其中,当(NH4)2SO4添加量为2.5 g/L时,麒麟菜降解率和发酵液还原糖质量浓度达到最高,分别为42.55%和0.92 mg/mL,因此初步确定(NH4)2SO4添加量为2.5 g/L。
2.3.4 发酵温度对降解率和还原糖浓度的影响
如图4-e所示,发酵温度在20~40 ℃时,麒麟菜降解率和发酵液还原糖质量浓度呈先增加、趋于平缓后降低的趋势,当发酵温度为35 ℃时,麒麟菜降解率和发酵液还原糖质量浓度达到最高,分别为38.88%和0.89 mg/mL,分析可能原因是温度会影响微生物细胞膜的流动性和选择透过性,进而影响细胞膜内外物质的交换和吸收。一定范围内提高发酵温度,可加快物质转化和提高卡拉胶酶催化效率,从而促进菌株的生长繁殖和代谢,使麒麟菜降解率和还原糖质量浓度升高;而当超过35 ℃,菌株细胞内酶的合成受到抑制或使卡拉胶酶等酶的蛋白结构遭到破坏,影响其生长代谢[22]。因此初步确定发酵温度为35 ℃。
2.3.5 发酵时间对降解率和还原糖质量浓度的影响
如图4-f所示,发酵时间在1~9 d时,麒麟菜降解率随发酵时间的延长呈先上升后降低的趋势,当发酵时间为5 d时,麒麟菜降解率达到最大为40.42%;发酵液还原糖质量浓度随发酵时间的延长呈先上升后趋于平缓的趋势,当发酵时间为9 d时,发酵液还原糖质量浓度达到最高为0.78 mg/mL。可能是在发酵前期,菌株处于生长迟缓期,生长和产酶能力较弱,对于麒麟菜细胞壁破坏不完全,多糖等成分溶出量少;随着时间延长,菌株生长进入对数期,生长代谢能力和酶活力增强,麒麟菜细胞壁被基本破坏,胞内成分溢出,使得降解率和还原糖质量浓度急剧增加,当发酵5 d后,菌株逐渐进入衰亡期,酶活力降低,还原糖质量浓度随之呈平缓趋势[20,23]。所以初步确定发酵时间为5 d。

a-接种量;b-料液比;c-不同氮源;d-(NH4)2SO4添加量;e-发酵温度;f-发酵时间;g-发酵初始pH值
图4 不同因素对麒麟菜降解率、还原糖质量浓度的影响
Fig.4 Effects of different factors on degradation rate and reducing sugar concentration of Eucheuma
注:不同小写字母表示组间存在显著性差异(P<0.05)。
2.3.6 发酵初始pH值对降解率和还原糖质量浓度的影响
如图4-g所示,发酵初始pH值在5~9时,麒麟菜降解率随pH值的增大逐渐增大,当pH值为9时,麒麟菜降解率达到最大为45.24%,分析可能是碱性环境破坏了海藻细胞壁,促进了其中藻多糖的水解;发酵液还原糖质量浓度随pH值的增大呈先增大后降低的趋势,当pH值为8时,发酵液还原糖质量浓度达到最大为0.82 mg/mL,推测当培养基pH值为8时利于菌株的生长,实验过程中,当pH值增大到9时,培养基中产生少量白色沉淀,可能是海水中存在的Mg+和Ca+在过碱性环境中沉淀,而Mg+对于菌株的生长和产酶具有促进作用,Mg+缺失影响了菌株的生长[24-25]。基于此,初步确定发酵初始pH值为8。
2.4 Plackett-Burman试验
通过单因素试验确定接种量(A)、(NH4)2SO4添加量(B)、料液比(C)、发酵温度(D)、发酵时间(E)、发酵初始pH值(F)共6个因素的合适水平,进行N=6的Plackett-Burman试验设计,结果见表4。
表4 Plackett-Burman试验设计及结果
Table 4 Plackett-Burman experimental design and results

试验号ABCDEF降解率/%1 1-1 1 1-1 111.022-11-111-111.1431-1-1-11-147.574-1-1-1-1-1-137.795111-1-1-131.436-1-1-11-1110.56711-111110.968-111-11134.1791-1111-113.6410-1-11-11143.4011-1111-1-16.011211-1-1-1138.89
由表5可知,模型P=0.000 2<0.05,表明模型显著,R2=0.985 9,表明实测值与预测值之间相关性较好。其中发酵温度(D)、(NH4)2SO4添加量(B)和发酵时间(E)对降解率影响显著,其余3个因素为非显著性因素,其中发酵温度和(NH4)2SO4添加量对麒麟菜降解率的影响是负效应,发酵时间是正效应,各显著因素对降解率的影响大小为:发酵温度>(NH4)2SO4添加量>发酵时间;对PB试验数据进行线性拟合,得到拟合方程:Y(降解率)=24.71+0.87A-2.62B-1.44C-14.16D+2.10E+0.118 3F。
表5 Plackett-Burman 设计试验结果分析
Table 5 Analysis of the results of the Plackett-Burman design test
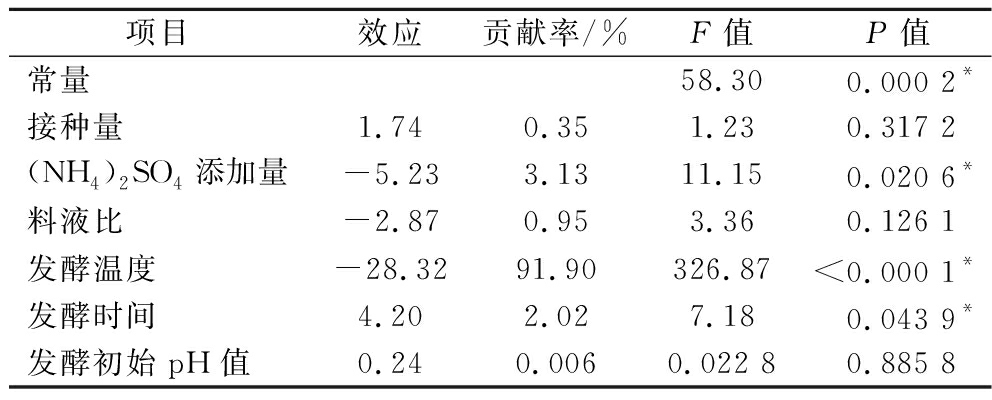
项目效应贡献率/%F值P值常量58.30 0.000 2*接种量1.740.351.230.317 2(NH4)2SO4添加量-5.233.1311.150.020 6*料液比-2.870.953.360.126 1发酵温度-28.3291.90326.87<0.000 1*发酵时间4.202.027.180.043 9*发酵初始pH值0.240.0060.022 80.885 8
注:α=0.05;P<0.05显著;*代表显著因素(下同)。
2.5 最陡爬坡试验
根据Plackett-Burman试验结果,选择(NH4)2SO4添加量、发酵温度和发酵时间3个显著因素设计最陡爬坡试验。由表6可以看出第4组降解率最高为47.28%,因此选择第4组((NH4)2SO4添加量1.25 g/L、发酵温度25 ℃、发酵时间6 d)作为响应面的中心点,进行Box-Behnken试验。
表6 最陡爬坡试验设计及结果
Table 6 Steepest climb test design and results
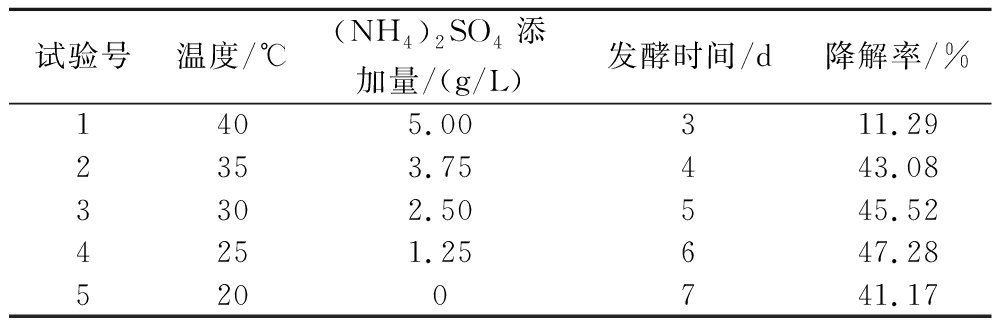
试验号温度/℃(NH4)2SO4添加量/(g/L)发酵时间/d降解率/%1405.00311.292353.75443.083302.50545.524251.25647.285200741.17
2.6 响应面分析
以(NH4)2SO4添加量、发酵温度、发酵时间为因素,降解率为响应值进行优化试验,响应面Box-Behnken试验设计及结果见表7,回归模型和方差分析结果见表8。模型显著,失拟项不显著,表明模型能合理描述(NH4)2SO4添加量、发酵温度、发酵时间与麒麟菜降解率之间的关系。降解率的回归方程相关系数为R2=0.972 3,表明降解率的实测值与预测值之间相关度良好,由试验数据得到二次多元回归方程为:Y(降解率)=48.28+1.12A-1.91B+C-1.24AB-0.07AC-0.682 5BC-2.62A2-2.46B2-1.96C2;3个因素对麒麟菜降解率的影响大小为:B>A>C。
表7 响应面试验设计及结果
Table 7 Response surface experimental design and results
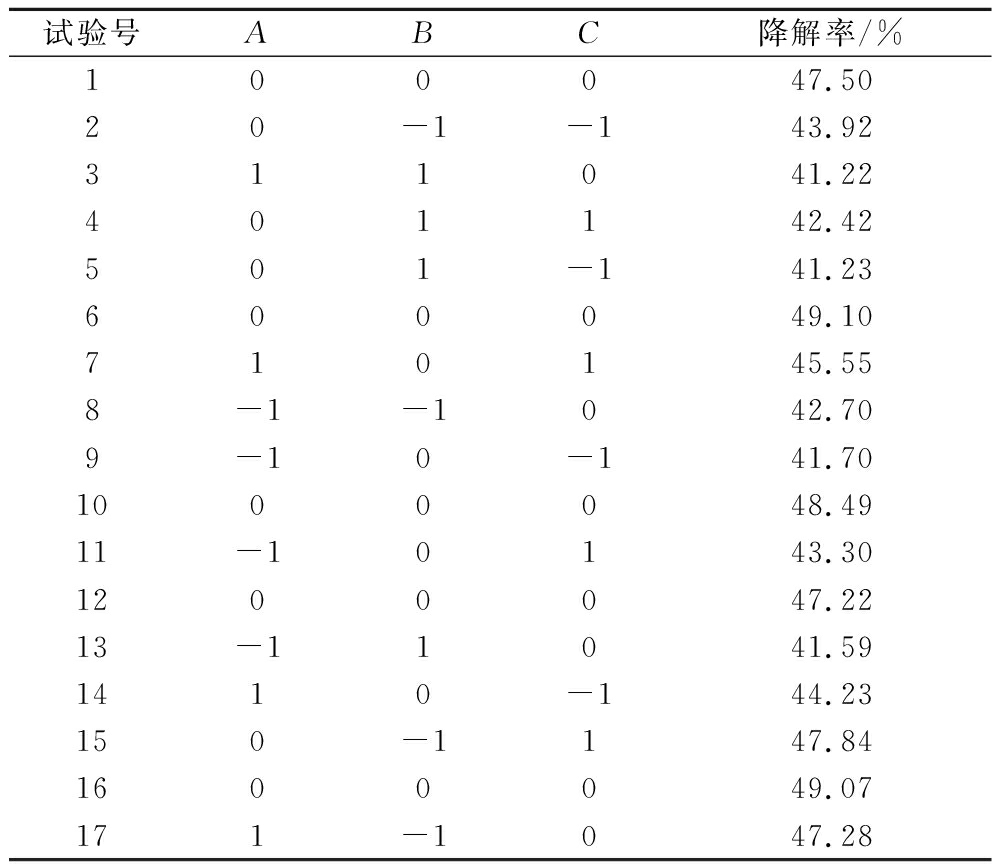
试验号ABC降解率/%100047.5020-1-143.92311041.22401142.42501-141.23600049.10710145.558-1-1042.709-10-141.701000048.4911-10143.301200047.2213-11041.591410-144.23150-1147.841600049.07171-1047.28
表8 回归模型方差分析
Table 8 Variance analysis of regression model
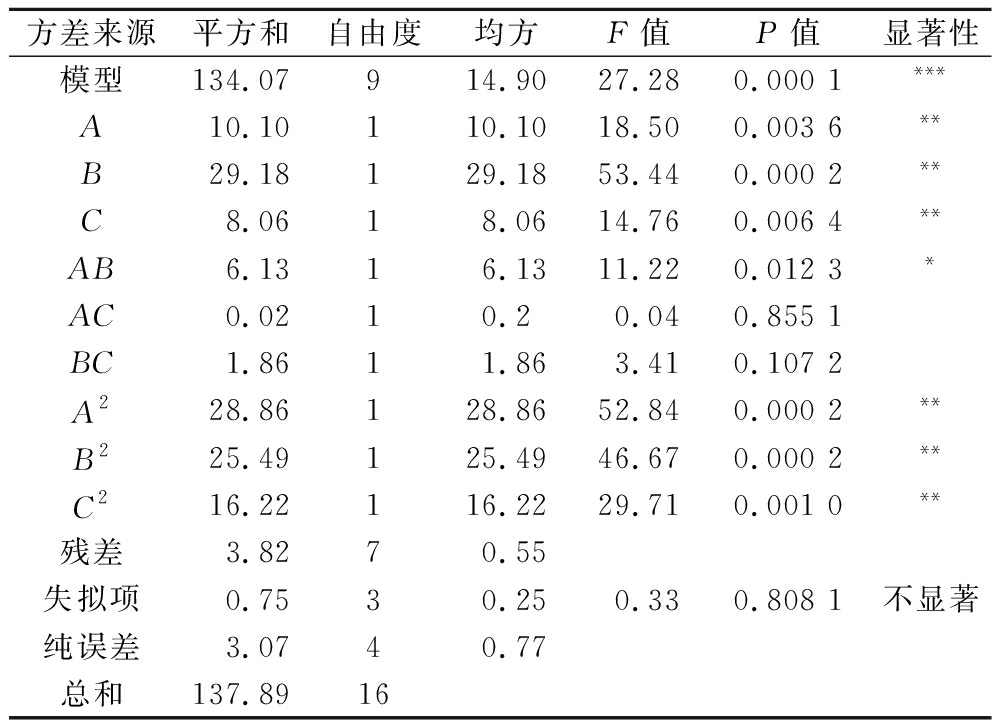
方差来源平方和自由度均方F值P值显著性模型134.07914.9027.280.000 1***A10.10110.1018.500.003 6**B29.18129.1853.440.000 2**C8.0618.0614.760.006 4**AB6.1316.1311.220.012 3*AC0.0210.20.040.855 1BC1.8611.863.410.107 2A228.86128.8652.840.000 2**B225.49125.4946.670.000 2**C216.22116.2229.710.001 0**残差3.8270.55失拟项0.7530.250.330.808 1不显著纯误差3.0740.77总和137.8916
注:*P<0.05为有差异,**P<0.01为差异显著,***P<0.001为差异极显著。
根据图5可知,发酵温度与(NH4)2SO4添加量的交互作用对降解率有显著影响,发酵温度与发酵时间和(NH4)2SO4添加量与发酵时间的交互作用对降解率影响不显著,可能是在发酵温度20~30 ℃、(NH4)2SO4添加量0~2.5 g/L、发酵时间5~7 d时,温度和(NH4)2SO4对于菌株的生长繁殖和产酶等代谢活动影响作用更大,而此时菌株生长阶段已处于平稳逐渐过渡到衰亡期状态,使得时间对于麒麟菜降解率和还原糖浓度的影响降低,因此发酵温度与(NH4)2SO4添加量的交互作用对降解率的影响较其他2种组合更加显著。进一步利用软件计算分析,预测降解率最高值为49.12%,此时发酵温度为26.74 ℃,(NH4)2SO4添加量为0.54 g/L,发酵时间为6.29 d。

a-发酵温度与(NH4)2SO4添加量;b-发酵温度与发酵时间;c-(NH4)2SO4添加量与发酵时间
图5 不同因素交互作用对麒麟菜降解率的影响响应面图
Fig.5 Response surface diagram of the interaction of different factors on the degradation rate of Eucheuma
2.7 模型验证试验
为验证模型的准确性和有效性,同时考虑到实际操作的可行性,调整发酵条件为:发酵温度27 ℃,(NH4)2SO4添加量0.5 g/L,发酵时间6.5 d,在此条件下测定的麒麟菜降解率为48.93%,较优化前麒麟菜降解率提高约36.79%,且与模型预测值接近,进一步证明了该模型的可行性。宋鑫[26]筛选出一株光轮层炭壳菌(Daldinnia)和一株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)分别发酵马尾藻15 d,固形物失重率和发酵液还原糖增量分别为25.19%和11.84 μg/mL、11.02%和13.12 μg/mL;蒋文俊[27]筛选出一株芽孢杆菌(Bacillus),以8%初始接种量发酵马尾藻3 d制得发酵液在50 ℃下降解马尾藻24 h产生直径为2.8 cm的透明圈。而本研究中菌株ZN-8所产卡拉胶酶活力较现已获得的产酶菌株不是最高,但其能单独降解麒麟菜,且降解效果高于现有多数海藻降解菌。但根据最优条件下测得降解率显示,麒麟菜中还可能存在着难以被降解的部分,推测是纤维素等多糖,因此下一步可利用菌株协同纤维素等酶降解麒麟菜,从而进一步提升麒麟菜生物利用度。
3 结论
本研究从南海活藻石上筛选得到一株卡拉胶酶活力较高和麒麟菜降解效果较好的菌株ZN-8,通过形态学、生理生化和16S rDNA序列分析,初步鉴定菌株ZN-8为海洋嗜纤维菌属(Cellulophaga sp.)。通过单因素试验、Plackett-Burman试验和响应面试验,确定ZN-8发酵麒麟菜的最佳条件为:接种量10%,(NH4)2SO4添加量0.5 g/L,料液比20(g∶L),发酵温度27 ℃,发酵时间6.5 d,发酵初始pH值为8,在此条件下麒麟菜降解率为48.93%,比优化前提高了36.79%。本研究不仅揭示了菌株ZN-8在麒麟菜降解中的潜力,而且通过优化发酵条件显著提高了其降解效率。麒麟菜中富含多糖和矿物质,降解发酵可有效促进其中多糖、氨基酸等生物活性物质的溶出,且这些物质对人体健康和水产生物生长发育具有潜在益处,可作为添加剂应用于食品和水产饲料中,增加食品和水产饲料的营养价值和功能性。因此,接下来将进一步对麒麟菜发酵产物的成分进行分析鉴定,研究发酵对其营养成分及活性的影响,为麒麟菜的微生物降解和高值化利用提供思路和理论参考。
[1] 匡梅, 曾呈奎, 夏邦美.中国麒麟菜族的分类研究[J].海洋科学集刊, 1999(1):168.KUANG M, ZENG C K, XIA B M.A taxonomic study on Eucheuma in China[J].Studia Marina Sinica, 1999(1):168.
[2] 李继伟, 杨贤庆, 潘创, 等.琼枝麒麟菜的营养成分分析与评价[J].食品与发酵工业, 2020, 46(15):265-269.LI J W, YANG X Q, PAN C, et al.Nutritional analysis and evaluation of Eucheuma gelatinae[J].Food and Fermentation Industries, 2020, 46(15):265-269.
[3] LIU Y X, MA Y, CHEN Z H, et al.Depolymerized sulfated galactans from Eucheuma serra ameliorate allergic response and intestinal flora in food allergic mouse model[J].International Journal of Biological Macromolecules, 2021, 166:977-985.
[4] 石硕, 孙康婷, 李继伟, 等.琼枝麒麟菜多糖的分离纯化、结构表征及降血糖活性[J].大连海洋大学学报, 2023, 38(5):866-873.SHI S, SUN K T, LI J W, et al.Isolation, purification and hypoglycemic activity of polysaccharides derived from brown seaweed (Eucheuma gelatinae)[J].Journal of Dalian Ocean University, 2023, 38(5):866-873.
[5] PREMARATHNA A D, SOO
 R A, AHMED T A E, et al.Isolation, structural characterization and biological activities of polysaccharides from Chondrus crispus[J].Food Hydrocolloids, 2024, 154:110131.
R A, AHMED T A E, et al.Isolation, structural characterization and biological activities of polysaccharides from Chondrus crispus[J].Food Hydrocolloids, 2024, 154:110131.
[6] PEREIRA L, AMADO A M, CRITCHLEY A T, et al.Identification of selected seaweed polysaccharides (phycocolloids) by vibrational spectroscopy (FTIR-ATR and FT-Raman)[J].Food Hydrocolloids, 2009, 23(7):1903-1909.
[7] UMMAT V, SIVAGNANAM S P, RAJAURIA G, et al.Advances in pre-treatment techniques and green extraction technologies for bioactives from seaweeds[J].Trends in Food Science &Technology, 2021, 110:90-106.
[8] BOUANATI T, COLSON E, MOINS S, et al.Microwave-assisted depolymerization of carrageenans from Kappaphycus alvarezii and Eucheuma spinosum: Controlled and green production of oligosaccharides from the algae biomass[J].Algal Research, 2020, 51:102054.
[9] ZHANG J, LIU Q M, GU F D, et al.Effects of Lactobacillus fermentation on Eucheuma spinosum polysaccharides:Characterization and mast cell membrane stabilizing activity[J].Carbohydrate Polymers, 2023, 310:120742.
[10] KRISHNA PERUMAL P, DONG C D, CHAUHAN A S, et al.Advances in oligosaccharides production from algal sources and potential applications[J].Biotechnology Advances, 2023, 67:108195.
[11] 戚伟鹏, 梁羽彤, 童星, 等.地衣芽孢杆菌发酵海带的脱腥效果与机理研究[J].食品与发酵工业, 2024, 50(23):77-86.QI W P, LIANG Y T, TONG X, et al.Effect of Bacillus licheniformis fermentation on deodorization of kelp (Laminaria japonica) and underlying mechanism[J].Food and Fermentation Industries, 2024, 50(23):77-86.
[12] LI Z P, DONG Y T, ZHANG Y F, et al.Lactobacillus-fermentation enhances nutritional value and improves the inhibition on pancreatic lipase and oral pathogens of edible red seaweed Bangia fusco-purpurea[J].LWT, 2023, 179:114643.
[13] CHEVENIER A, JOUANNEAU D, FICKO-BLEAN E.Carrageenan biosynthesis in red algae:A review[J].The Cell Surface, 2023, 9:100097.
[14] GHATTAVI S, HOMAEI A.Marine enzymes:Classification and application in various industries[J].International Journal of Biological Macromolecules, 2023, 230:123136.
[15] 孙驰翔. 褐藻胶裂解酶产生菌的筛选与异源表达[D].无锡:江南大学, 2021.SUN C X.Screening and identification of alginate lyase producing bacteria and its heterologous expression[D].Wuxi:Jiangnan University, 2021.
[16] 于淼. 海带降解菌的筛选、酶解优化和发酵液在植物组培中的应用研究[D].烟台:烟台大学, 2023.YU M.Study on screening of kelp-degrading bacteria and enzymolysis optimization and application offermentation broth in plant tissue cult[D].Yantai:Yantai University, 2023.
[17] PARK S, OH K H, LEE S Y, et al.Cellulophaga geojensis sp.nov., a member of the family Flavobacteriaceae isolated from marine sand[J].International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt 6):1354-1358.
[18] 古铮. 海洋卡拉胶降解菌Cellulophaga sp.KL-A的筛选优化及卡拉胶酶研究[D].厦门:厦门大学, 2014.GU Z.Screening of the carrageenan hydrolyzing marine bacterium Cellulophaga sp.KL-A, carrageenan characterization and production optimization[D].Xiamen:Xiamen University, 2014.
[19] 王玉岩. 褐藻胶降解菌的筛选鉴定及发酵条件优化[D].大连:大连理工大学, 2021.WANG Y Y.Screening and identification of alginate degrading bacteriaand optimization of fermentation conditions[D].Dalian:Dalian University of Technology, 2021.
[20] 尚丹丹. 白色噬琼胶菌(Agarivorans albus)B2Z047降解海带能力及其机制探究[D].济南:山东大学, 2022.SHANG D D.Study on the ability and mechanism of Agarivorans albus B2Z047 to degrade kelp[D].Jinan:Shandong University, 2022.
[21] MUZYED S, HOWLADER M M, TUVIKENE R.Fermentation optimization, purification and biochemical characterization of ι-carrageenase from marine bacterium Cellulophaga baltica[J].International Journal of Biological Macromolecules, 2021, 166:789-797.
[22] 赵东莹. 假交替单胞菌ZDY3产κ-卡拉胶酶特性及酶的自组装固定化研究[D].大连:大连理工大学, 2021.ZHAO D Y.Characterization and self-assembly immobilization of κ-carrageenase from Pseudoalteromonas sp.ZDY3[D].Dalian:Dalian University of Technology, 2021.
[23] 王熙涛. 微生物处理海带饲料对刺参生长和免疫的影响[D].大连:大连理工大学, 2015.WANG X T.The effect of microorganism-treated Laminaria japonica feedstuff on the growth and immunity of Apostichopus japonicus[D].Dalian:Dalian University of Technology, 2015.
[24] KANG S, KIM J K.Reuse of red seaweed waste by a novel bacterium, Bacillus sp.SYR4 isolated from a sandbar[J].World Journal of Microbiology and Biotechnology, 2015, 31(1):209-217.
[25] GUO J J, ZHANG L T, LU X, et al.Medium optimization and fermentation kinetics for κ-carrageenase production by Thalassospira sp.fjfst-332[J].Molecules, 2016, 21(11):1479.
[26] 宋鑫. 马尾藻降解微生物的筛选、鉴定及其降解效果初步评价[D].海口:海南大学, 2016.SONG X.Screening and identification of Sargassumm spp.-degrading microbe and the initial evaluation of degradation[D].Haikou:Hainan University, 2016.
[27] 蒋文俊. 产褐藻胶裂解酶深海细菌的筛选与马尾藻发酵研究[D].哈尔滨:哈尔滨工业大学, 2023.JIANG W J.Screening of deep-sea bacteria producing alginate lyase and study on fermentation of Sargassum[D].Harbin:Harbin Institute of Technology, 2023.