近年来,随着消费者对健康、环境可持续性和动物福利关注度的不断提升,植物基产品的需求日益增加,尤其是植物奶酪市场正经历快速发展。然而,市售植物奶酪通常缺乏传统奶酪所具有的理想黏弹特性与丰富的营养价值,这为植物奶酪的结构调控和营养成分的研究提供了重要的动力。目前,大部分研究集中在大豆蛋白和豌豆蛋白的应用上,以模拟传统奶酪中的酪蛋白结构,但这些蛋白质的物理特性仍未能完全达到预期。因此,玉米醇溶蛋白作为一种新的蛋白来源,因其在加热过程中的黏性增强和软化特性,展现出可应用于植物奶酪的潜力[1]。研究表明,当玉米醇溶蛋白与淀粉和水混合并加热至40 ℃时,可以形成具有较高黏性和延展性的凝胶,部分模拟了传统奶酪中酪蛋白胶束的行为[2]。然而,玉米醇溶蛋白在植物奶酪中的应用仍然受到一定限制,主要是其仅在接近玻璃转化温度(Tg)时,才能形成稳定的蛋白网络。为克服这一限制,添加亲水胶体成为改善玉米醇溶蛋白网络结构的有效途径。β-葡聚糖,作为一种具有良好胶凝、增稠、稳定和乳化特性的天然高分子,已被广泛应用于乳品加工中[3]。研究表明,燕麦β-葡聚糖能够显著增强玉米醇溶蛋白的网络结构,从而提高玉米醇溶蛋白-淀粉体系的稳定性[4]。此外,作为脂肪替代物的谷类β-葡聚糖,已被证明能够改善低脂奶酪的质构特性[5-7]。近年来,青稞β-葡聚糖(highland barley β-glucan,HBG)作为一种新的功能性成分,已被证实具有降胆固醇、减轻餐后血糖和胰岛素反应等多重健康益处[3]。
食物在胃肠道中的消化特性与多种涉及饮食的慢性疾病(如2型糖尿病、心血管疾病和高血压)的发生密切相关[8-9]。近年来,研究表明,谷类β-葡聚糖不仅能显著影响奶酪的品质和质构特性,还可能影响奶酪中蛋白质、脂肪等营养成分的消化特性[3]。然而,目前关于HBG在植物奶酪中对营养成分消化特性的影响研究仍较少。本课题组此前成功制备了HBG/玉米醇溶蛋白植物基奶酪,并对其微观结构及理化特性进行了深入探讨[10]。在此基础上,本研究进一步探讨HBG/玉米醇溶蛋白植物基奶酪在体外模拟胃肠消化和发酵过程中的消化行为与益生特性,旨在为HBG/玉米醇溶蛋白植物基奶酪的开发提供理论支持与科学依据。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(纯度≥95%,含75%~85% α-玉米醇溶蛋白、10% β-玉米醇溶蛋白、5% γ-玉米醇溶蛋白,分子质量2.0×105 Da),陕西飞米生物科技有限公司;HBG(纯度≥85%,分子质量2.0×105 Da),陕西源生特生物有限公司;椰子油、高油酸葵花籽油(油酸≥80%)、玉米淀粉、木薯淀粉,重庆市北碚永辉超市;传统的Cheddar奶酪(脂肪含量31%,碳水化合物含量0%,蛋白质含量29%)、Violife植物奶酪(脂肪含量24%,碳水化合物含量20%,蛋白质含量23%),市售;尼罗红、固绿、荧光增白剂28、P7125胃蛋白酶(≥400 U/mg)、S10031胰酶(胰蛋白酶≥4 000 U/mg,胰α-淀粉酶≥7 000 U/mg,胰脂肪酶≥4 000 U/mg),美国Sigma公司;NEFA A042非酯化脂肪酸检测试剂盒,南京建成生物工程研究所;E.Z.N.A.TMMag-Bind soil DNA 试剂盒, Omega Biotek公司;二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LSM 800 激光共聚焦显微镜,德国卡尔蔡司公司;2008-366R冰冻切片机,德国徕卡公司;DHS-IV 动态体外消化仿生系统,晓东宜健(苏州)仪器设备有限公司;Mastersizer3000 激光粒度仪,英国马尔文公司;TU-1950 双光束紫外分光光度计,北京普析通用仪器有限责任公司;Scientz-10ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;LBI-l50恒温培养箱,上海龙跃仪器设备有限公司;GIPP-DCY-36Y氮吹仪,上海继谱电子科技有限公司;GC-2010气相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 玉米醇溶蛋白基奶酪制备
参考MATTICE等[11]的方法并进行适当调整,采用25%(质量分数,下同)的玉米醇溶蛋白和不同添加量的HBG分别制备植物基奶酪样品。HBG的添加量分别为0%(对照组)、10%、20%和30%,样品依次命名为HBG0、HBG10、HBG20和HBG30。为确保奶酪的结构与质构特性,淀粉(玉米淀粉和木薯淀粉的混合物,33%和67%)及油的含量随着HBG浓度的增加而减少,淀粉与油的比例设定为2∶1(表1)。为模拟Cheddar奶酪中的饱和与不饱和脂肪含量,所用油混合物含25%的高油酸葵花籽油与75%的椰子油。充分混合所有粉末状物质(玉米醇溶蛋白、淀粉和HBG)后加入45%蒸馏水并搅拌均匀,最后加入油混合物,该混合物在85 ℃下剧烈搅拌5 min,以确保均匀分散。将样品倒入容器模具,冷却至室温,4 ℃下储藏备用。
表1 玉米醇溶蛋白植物基奶酪的组成
Table 1 Compositions of zein-based cheeses
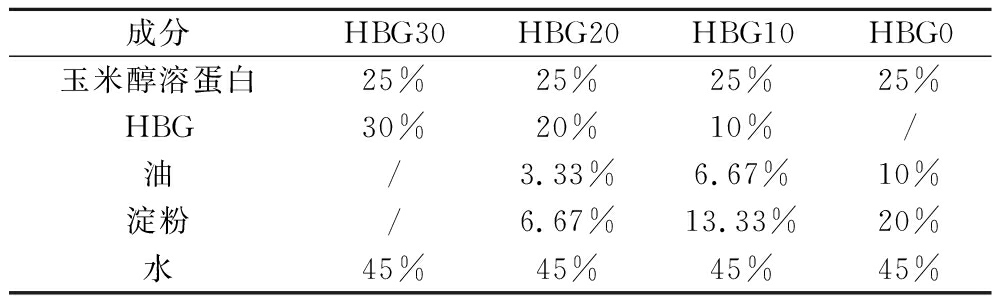
成分HBG30HBG20HBG10HBG0玉米醇溶蛋白25%25%25%25%HBG30%20%10%/油/3.33%6.67%10%淀粉/6.67%13.33%20%水45%45%45%45%
注:/表示未添加该成分。
1.3.2 玉米醇溶蛋白基奶酪微观结构
参考GRASSO等[12]的方法,并进行适当调整,使用激光共聚焦显微镜观察样品网络结构。首先,使用冷冻切片机将植物奶酪切割成40 μm厚的薄片。然后,采用50 μL混合染料溶液(尼罗红∶固绿=1∶3,体积比,质量浓度均为0.1 mg/mL)染色15 min,之后加入40 μL荧光增白剂28(0.2%),继续染色15 min,随后用蒸馏水洗涤3次去除多余染料。尼罗红、固绿和荧光增白剂28分别在488、633、405 nm的激发波长下成像,采用Imaris Viewer(9.5.1版,Bitplane AG)对获得的图像进行分析。
1.3.3 动态体外人胃肠模拟消化
参考MINEKUS等[13]的方法,配制体外消化模拟液。动态体外消化模拟参考PENG等[14]的方法并适当调整。实验前,开启加热开关,将设备及模拟消化液加热至37 ℃。取100 g样品,切割成1 cm3的立方体,加入50 mL模拟唾液(含12.5 mg/mL α-淀粉酶)。使用多功能研磨机在3 000 r/min下剪切1 min后,将样品转移至37 ℃恒温水浴摇床(120 r/min),并在水浴中消化5 min。随后,将食糜在5 min内通过食管进样漏斗注入动态体外消化仿生设备中。消化液的分泌速率、胃蠕动频率、幽门开口大小等实验运行参数按照表2设置。
表2 人体外动态胃肠连续消化模拟的运行参数
Table 2 Operational parameters of in vitro dynamic gastrointestinal digestion simulation in humans

消化环境运行参数胃进样量100 g进样时间5 min空腹胃液体积10 mL胃液分泌速率0~10 min:0.8 mL/min;10~20 min:1.1 mL/min;20~30 min:1.3 mL/min;30~40 min:1.5 mL/min;40~50 min:1.3 mL/min;50~60 min:1.1 mL/min;60~180 min:1.0 mL/min0.5 mol/L HCl分泌速率0~20 min:1 mL/min胃蠕动频率3 次/min幽门装置开合速度:100 mm/min;幽门开口大小:0~2 mm;通过时间:0.4 min;紧闭时间:0.6 min胃倾角0~1 min:-10 °/min;1~30 min:1 °/ min;30~60 min:0.5 °/min;60~120 min:-0.3 °/min;120~180 min:-13 °/min小肠肠液分泌速率0~180 min:1 mL/min十二指肠挤压速率12 r/min
1.3.3.1 胃排空特性测定
系统启动后,每隔30 min收集一次胃排出消化物,并称重记录。胃排空率通过计算胃滞留剩余物质量与总消化物质量的比值来得出。采用优化的Elashoff幂指数模型(式1)对胃排空数据进行拟合,以分析胃排空过程的动力学特性。
y(t)=1-(1-e-kt)β
(1)
式中:y(t),t时刻胃内容物残留率;k,每分钟胃排空率,min-1;β,拟合曲线y轴截距,%。
将y(t)=0.5代入公式(2)计算胃半排空时间t1/2:
(2)
1.3.3.2 胃淀粉水解率测定
参考郭晨[15]的方法并进行适当调整,动态体外人胃消化在0、30、60、90、120、150、180 min后收集消化产物。收集的样品与2 mL无水乙醇混合,用于灭酶。涡旋混合均匀后,将灭酶后的消化产物在1 800×g下离心10 min。取0.1 mL灭酶上清液,加入0.5 mL淀粉葡萄糖苷酶和转化酶醋酸盐缓冲液,调整溶液pH值至5.2,并在37 ℃下孵育10 min。使用DNS法测定释放出的葡萄糖含量。白面包作为对照进行比较。淀粉水解率按公式(3)计算:
(3)
式中:SH,淀粉水解率,%;Sh,水解的淀粉质量,g;Si,初始的淀粉质量,g;Gp,释放的葡萄糖质量,g;0.9,葡萄糖与淀粉的转化系数。
1.3.3.3 游离氨基酸含量测定
采用邻苯二甲醛法[16]测定胃肠消化过程中不同时间点(30、60、90、120、150、180 min)样品的游离氨基酸含量。将灭酶后的消化产物在1 800×g下离心10 min。上清液经0.45 μm 离心尼龙膜过滤器过滤,使用紫外分光光度计于340 nm处测定吸光度值,并以L-亮氨酸为标准品绘制标准曲线,计算游离氨基酸含量。
1.3.3.4 游离脂肪酸含量测定
将灭酶后的消化产物在1 800×g下离心10 min,取上清液备用。按照脂肪酸检测试剂盒说明书测定胃肠消化过程中不同时间点(30、60、90、120、150、180 min)样品的游离脂肪酸含量。
1.3.3.5 粒径测定
采用激光粒度仪测定体外胃肠连续消化过程中不同时间点(30、60、90、120、150、180 min)的样品粒径。粒径大小以D50值表示。测试条件设置为遮光度上限20%、下限8%,搅拌速度为2 400 r/min。
1.3.4 体外发酵
实验使用的粪便样本由3名健康志愿者提供(2女1男,年龄22~24岁)。志愿者在实验前至少3个月内未使用抗生素药物,且无消化道系统疾病。所有志愿者自愿参与研究,并在实验前签署书面知情同意书,实验内容遵守相关法律法规及伦理准则。
实验前,统一清晨收集各志愿者空腹新鲜粪便样本并混合,取10 g粪便与100 mL无菌磷酸盐缓冲液(0.1 mol/L)混匀,均质后用八层灭菌纱布过滤,收集滤液供体外发酵实验使用。基础培养基参考 WU 等[17]的方法配制。取100 mg冷冻干燥后的样品,加入50 mL灭菌离心管中,加入9 mL基础生长培养基和1 mL体外发酵液,混合均匀,充N2 30 s后密封,放置于37 ℃、150 r/min恒温摇床中培养。分别在0、6、12、24、48 h取样,每次取样后将样品在4 000 r/min下离心10 min,收集上清液用于测定总短链脂肪酸(short chain fatty acids,SCFAs)。沉淀(含肠道菌群)立即保存于-80 ℃冰箱,用于16S rDNA测序分析。未加入样品的离心管作为空白组(BLANK)对照。
1.3.5 SCFAs测定
采用 GC 对发酵上清液 SCFAs 进行测定[18],以内标法(2-乙基丁酸)定量。
1.3.6 微生物多样性分析
使用E.Z.N.A.TMMag-Bind soil DNA 试剂盒对 1.3.4 节中发酵 48 h 获得的肠道菌群沉淀进行 DNA抽提,以338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGT-WTCTAAT-3′)为引物扩增16S rRNA基因V3~V4的高变异区域,由上海美吉生物医药科技有限公司分析,在其生物信息平台上进行IlluminaMiseq PE300测序数据分析,定量分析肠道菌群的结构和相对丰度。使用QIIME(version1.9.1)软件将有效序列按照97%的相似性进行操作分类单元(operational taxonomic units,OTUs)聚类。利用Mothur(version1.30.2)对样品的α多样性指数(Ace、Chao、Shannon、Sobs、和Simpson指数)进行计算。β多样性基于Bray-Curtis距离进行主坐标分析。通过线性判别分析效应大小在7组的肠道菌群中筛选出33个科水平上的差异。
1.4 数据统计与分析
采用 Origin 8.0 和 GraphPad Prism 8软件,进行数据处理和分析。通过单因素方差分析(one-way AVONA)和Turkey’ multiple-range检验对数据进行显著性差异分析(P<0.05),结果以“平均值±标准差”(n=3)表示。微生物多样性分析采用配对样本t检验方法对α多样性指数、SCFAs及科水平相对丰度进行显著性差异统计。利用环境因子关联分析评估(Spearman相关性分析)33个科水平上的菌变化与SCFAs的相关性。P<0.05认为差异有统计学意义。
2 结果与分析
2.1 HBG对玉米醇溶蛋白植物基奶酪表面和微观结构的影响
如图1-a所示,Cheddar奶酪表面均匀光滑,Violife植物奶酪表面有明显的黄色油脂析出,表明淀粉未能完全乳化Violife中的油脂[19]。HBG0表面粗糙,且油脂析出较多,表明乳化效果较差。10%HBG(HBG10)使样品表面油脂析出明显减少,表面变得更均匀和光滑,表明HBG在提高油脂乳化稳定性方面具有潜在效果。随着HBG含量增加至20%(HBG20)和30%(HBG30),油脂添加量减少,样品表面变得更粗糙和干燥。
如图1-b所示,Cheddar奶酪微观结构紧密,乳脂(绿色)均匀分布在蛋白网络中(红色)[12];而Violife植物奶酪中的油滴(绿色)较大[19],表明淀粉对油脂的乳化能力较差。HBG0的油滴较大且分布不均。随着HBG添加量增加至10%(HBG10)和20%(HBG20),油滴尺寸逐渐变小,分布也变得更均匀。HBG是一种中性多糖,可通过增加体系黏度并形成网状结构,有利于将蛋白质、油脂和淀粉包裹在一起形成较紧密的结构,从而防止油脂滴聚集[20-21]。然而,当HBG添加量增加至30%时(HBG30),β-葡聚糖链聚集成簇,破坏玉米醇溶蛋白基质的连续性[19]。结果表明,在设计含HBG的植物基奶酪配方时,需要优化HBG的添加量,以避免其过度聚集,保持乳化体系的均匀性和稳定性。
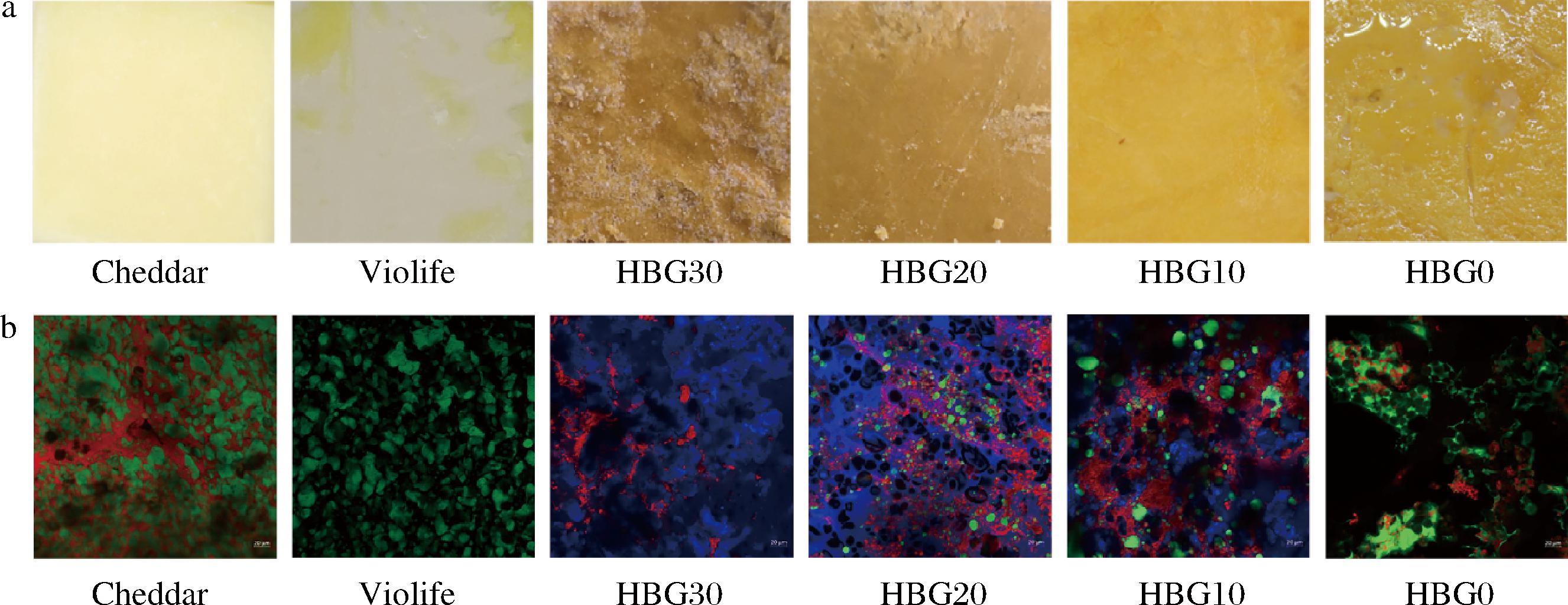
a-表面图;b-激光共聚焦显微镜图
图1 不同奶酪的表面和微观结构
Fig.1 The surface and microstructure of different cheeses
2.2 HBG对玉米醇溶蛋白植物基奶酪的胃排空率和体外淀粉水解率的影响
胃半排空时间(t1/2)是衡量食物在胃中停留时间的重要指标,t1/2值越大,表示胃滞留时间越长。β值则用于表示食物在胃内的最终残留量。如表3所示,所有样品在180 min的胃消化过程中均能排出95%以上的内容物(β=0.96%~1.83%)。Cheddar动物奶酪的胃排空时间较短(t1/2=59.04 min),而Violife植物奶酪胃排空时间最长(t1/2=101.06 min),这可能是因为Violife淀粉含量高,食糜黏度增加,从而延缓胃排空[22]。HBG0样品的胃排空时间(t1/2=73.25 min)仅次于Violife植物奶酪[23]。随着HBG添加量增加(从HBG10至HBG30),食糜黏度增加,因此胃排空时间也有所延长(t1/2=50.15~65.87 min)[24]。由图2-a可知,随着消化时间延长,所有样品的淀粉水解率均呈增加趋势。由于Violife植物奶酪和HBG0的淀粉含量较高(表1),其淀粉水解率增加趋势尤为明显。
表3 不同奶酪的胃排空拟合参数
Table 3 Gastric emptying fitting parameters of different cheeses
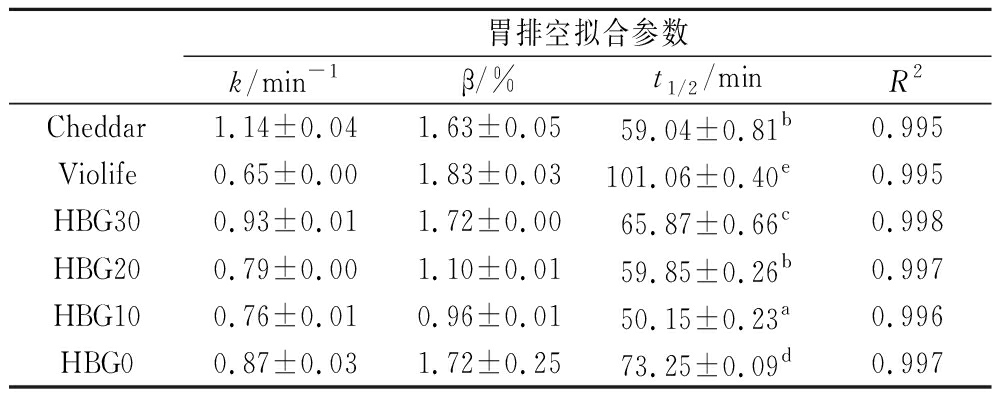
胃排空拟合参数k/min-1β/%t1/2/minR2Cheddar1.14±0.041.63±0.0559.04±0.81b0.995Violife0.65±0.001.83±0.03101.06±0.40e0.995HBG300.93±0.011.72±0.0065.87±0.66c0.998HBG200.79±0.001.10±0.0159.85±0.26b0.997HBG100.76±0.010.96±0.0150.15±0.23a0.996HBG00.87±0.031.72±0.2573.25±0.09d0.997
注:不同小写上标字母表示不同样品具有显著性差异(P<0.05)。
2.3 HBG对玉米醇溶蛋白植物基奶酪蛋白质及脂肪体外消化的影响
游离氨基酸含量常用于评估奶酪中蛋白质在胃肠消化过程中的水解程度。图2-b显示,在体外胃肠连续消化过程中,所有样品的游离氨基酸含量均呈显著增加趋势。其中,Cheddar奶酪和Violife植物奶酪的游离氨基酸含量分别增加了147.81%和36.89%。HBG/玉米醇溶蛋白植物基奶酪的游离氨基酸含量增加增加了77.89%~112.37%,且随着HBG含量增加,游离氨基酸的增加幅度逐渐减小。这表明,HBG通过降低蛋白酶的可及性,抑制了玉米醇溶蛋白的消化。
此外,游离脂肪酸的释放有助于确定奶酪在消化过程中脂质的消化速度。如图2-c所示,Cheddar奶酪中的游离脂肪酸含量最高,为42.01 μmol/L;而Violife植物奶酪和HBG0样品的游离脂肪酸含量较为接近,位居其后。这表明,淀粉可降低脂肪酶的可及性,抑制脂肪的消化。随着HBG含量的增加,游离脂肪酸的含量逐渐降低,进一步表明HBG能通过减少脂肪酶的可及性来抑制脂肪的消化[25]。
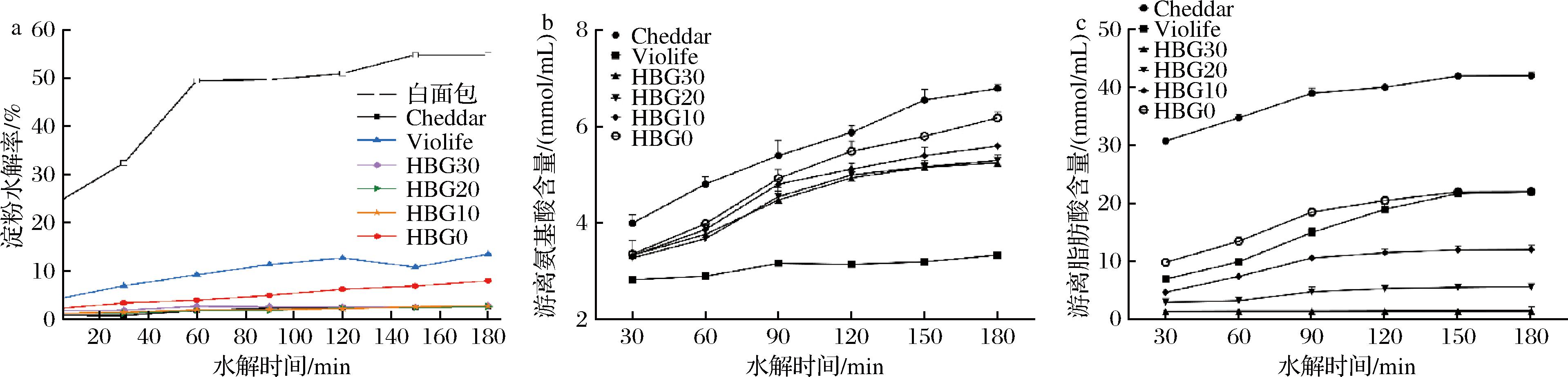
a-淀粉水解曲线;b-游离氨基酸释放规律;c-游离脂肪酸释放规律
图2 不同奶酪的营养成分在体外胃肠消化过程的释放规律
Fig.2 Release profiles of major nutrients in different cheeses during in vitro dynamic gastrointestinal digestion
2.4 HBG对玉米醇溶蛋白植物基奶酪体外消化过程中粒径的影响
样品在体外胃肠连续消化180 min内的粒径变化如表4所示,Cheddar奶酪的粒径从64.17 nm降至3.45 nm,下降幅度达95%。Viollife植物奶酪的粒径从21.23 nm降至13.10 nm,下降幅度为38%。HBG/玉米醇溶蛋白植物基奶酪的粒径从17.73~34.37 nm降至6.40~10.67 nm,下降幅度为64%~71%。这一结果与体外蛋白质和脂肪消化的趋势一致,表明样品的粒径变化与其消化过程中蛋白质和脂质水解相关。
表4 不同奶酪在人体外动态胃肠连续消化过程中的粒径变化 单位:nm
Table 4 Changes in particle sizes during in vitro dynamic gastrointestinal digestion of different cheeses

消化时间CheddarViolifeHBG30HBG20HBG10HBG030 min64.17±0.95a21.23±0.95a28.33±0.12a24.97±0.25a34.37±0.12a17.73±0.06a60 min46.63±0.42b17.10±0.46b17.53±0.23b20.53±0.21b25.83±0.35b13.70±0.10b90 min34.87±0.64c16.27±0.67b8.16±0.04c19.70±0.00b22.87±0.06c13.60±0.20b120 min32.53±0.31d14.63±0.35b6.65±0.03c17.90±0.00c21.03±0.06d12.47±0.06c150 min12.87±0.67e13.33±0.40d6.64±0.03c10.08±0.14d19.80±0.50e11.28±0.30d180 min3.45±0.49f13.10±0.40d6.40±0.02c9.61±0.19d10.67±0.06f9.91±0.62e
注:不同小写字母表示同一样品不同测定时间具有显著性差异(P<0.05)。
2.5 HBG对玉米醇溶蛋白植物基奶酪体外发酵产SCFAs的影响
由图3可知,随着发酵时间延长,所有样品的乙酸、丙酸、丁酸及总SCFAs含量均显著增加。丁酸具有提高免疫力、改善肠道环境及缓解结肠炎、糖尿病和肥胖等疾病的作用[26]。Cheddar奶酪富含乳糖,可促进肠道益生菌产生乳酸和丁酸[27-28],与图3-c中丁酸含量变化一致。与Violife植物奶酪相比,HBG/玉米醇溶蛋白植物基奶酪可显著增加丁酸的含量(图3-c,48 h)。此外,发酵48 h后,10%HBG产生的乙酸、丙酸及总SCFAs含量最高(图3-a, 图3-b, 图3-e)。综上,HBG10在促进肠道菌群产生SCFAs的能力上表现最佳(图3-e)。
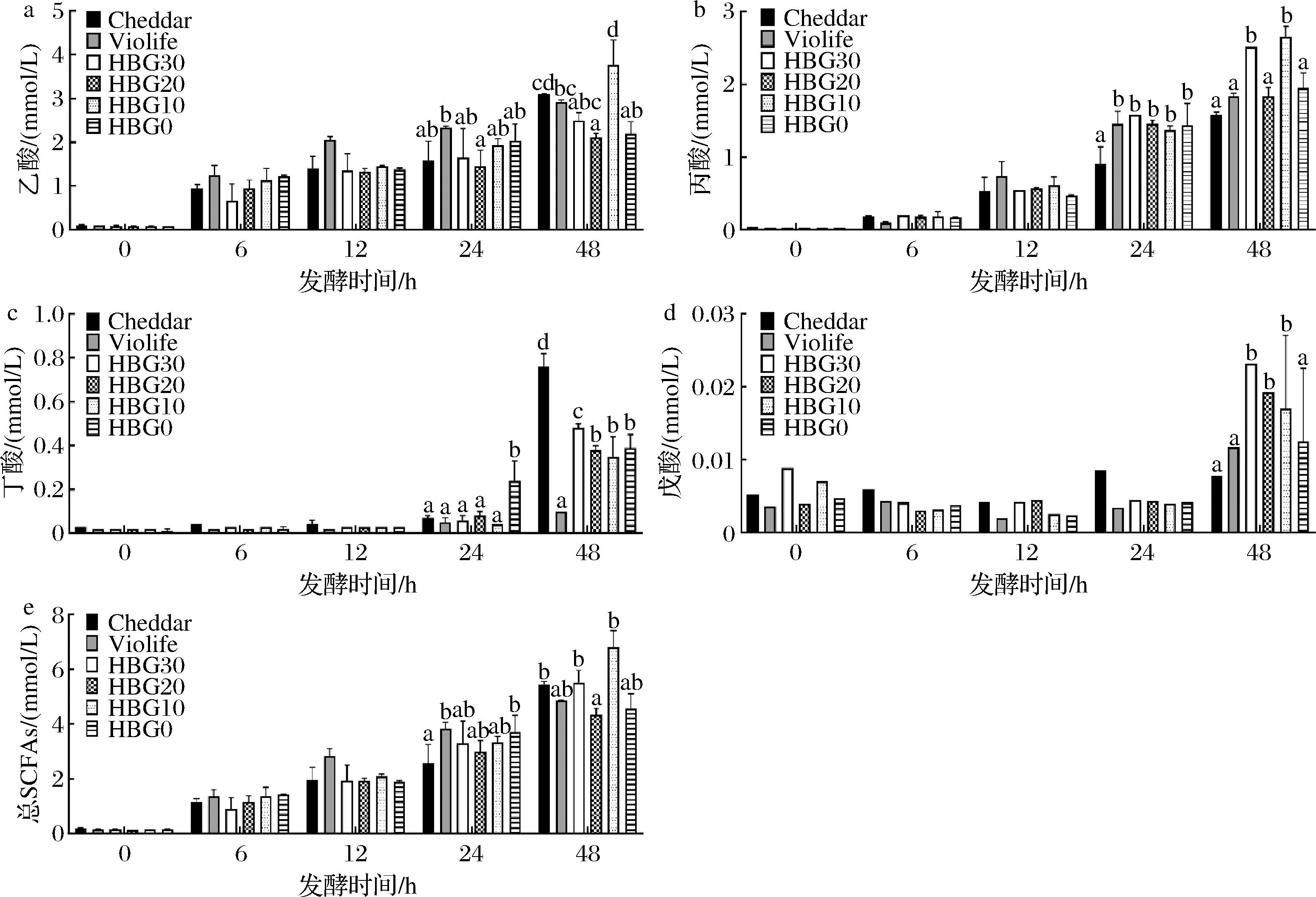
a-乙酸;b-丙酸;c-丁酸;d-戊酸;e-总SCFAs
图3 不同奶酪在体外发酵过程中SCFAs的变化
Fig.3 Effect of different cheeses on SCFAs changes during in vitro fermentation
注:不同小写字母表示同一测定时间不同样品有显著性差异(P<0.05)。
2.6 玉米醇溶蛋白植物奶酪对肠道菌群的影响
2.6.1 肠道菌群多样性分析
肠道菌群高通量测序分析得到656 908条优化序列,经97%相似度归并后得到162个OTUs。α稀释曲线趋于平缓,表明测序数量和深度足够,基本覆盖了样品中的所有物种,确保了测序的准确性。α多样性指数越大,代表样本中微生物的多样性和丰度越高。与Cheddar奶酪相比,Violife植物奶酪显著降低了肠道菌群的Ace和Chao指数(图4-a、图4-b),表明Violife肠道菌群的多样性低于动物奶酪,丰度减少。相反,HBG/玉米醇溶蛋白植物基奶酪的Ace和Chao指数与Cheddar奶酪相似,表明其对肠道菌群的影响与Cheddar奶酪相近(图4-a、图4-b)。β多样性分析的主坐标分析结果显示,Cheddar奶酪与Violife植物奶酪的群落结构存在显著差异,而与HBG/玉米醇溶蛋白植物基奶酪的群落结构较为相似,尤其是与HBG0和HBG20样品的群落结构有重叠(图4-f)。

a-Ace;b-Chao;c-Shannon;d-Sobs;e-Simpson;f-主坐标分析
图4 体外发酵48 h肠道菌群α-多样性和β-多样性分析
Fig.4 Changes of α-diversity and β-diversity of the gut microbiota during 48 h in vitro fermentation
注:不同小写字母表示不同样品有显著性差异(P<0.05)(下同)。
2.6.2 肠道菌群物种组成分析
如图5-a所示,肠道菌群在科水平上主要组成包括肠杆菌科(Enterobacteriaceae)、氨基酸球菌科(Acidaminococcaceae)、摩根菌科(Morganellaceae)、梭杆菌科(Fusobacteriaceae)和拟杆菌科(Bacteroidaceae)。与Cheddar奶酪相比,Violife植物奶酪显著增加了Enterobacteriaceae的相对丰度,而HBG/玉米醇溶蛋白植物基奶酪则有效抑制了该科相对丰度的增加(图5-b)。此外,相较于Cheddar奶酪,HBG/玉米醇溶蛋白植物基奶酪使Bifidobacteriaceae的相对丰度增加了2.5~4倍(图5-c)。研究表明,膳食纤维可增加肠道菌群Bifidobacteriaceae的丰度,同时抑制Enterobacteriaceae增殖[29]。Enterobacteriaceae中的某些致病菌通过多种机制促进肠道炎症反应,进而加剧炎症性肠病的病理过程[30]。作为一种益生菌,Bifidobacteriaceae不仅具有抗肿瘤、增强免疫和改善胃肠道功能的作用,还能调节肠道健康[31]。此外,在糖尿病小鼠的研究中,肠道菌群显示出明显的紊乱,Enterobacteriaceae的相对丰度显著升高,而Bifidobacteriaceae的相对丰度显著降低[32]。

a-群落组成及丰度分布(科);b-Enterobacteriaceae;c-Bifidobacteriaceae
图5 体外发酵48 h肠道菌群的变化
Fig.5 Changes at family level during 48 h in vitro fermentation
2.6.3 肠道优势菌组成与生化指标的相关性分析
进一步探究肠道菌群在科水平上与SCFAs的相关性。如图6所示,在33个科中有17种微生物至少和一项指标具有相关性。互养菌科(Synergistaceae)与乙酸、丙酸和总SCFAs呈极显著正相关(P<0.01);脱硫弧菌科(Desulfovibrionaceae)与丙酸呈极显著正相关(P<0.01);琥珀酸弧菌科(Succinivibrionaceae)与丙酸、戊酸和总SCFAs呈极显著正相关(P<0.01);硒单胞菌科(Selenomonadaceae)与戊酸呈极显著正相关(P<0.01);链球菌科(Streptococcaceae)与丙酸呈极显著正相关(P<0.01);摩根菌科(Morganellaceae)与丁酸呈极显著正相关(P<0.01)。结果表明,与市售Violife植物奶酪相比,HBG/玉米醇溶蛋白植物基奶酪对肠道菌群结构组成影响与Cheddar奶酪相似,同时HBG可被肠道菌群利用,尤其是HBG10能大幅度提高总SCFAs含量。
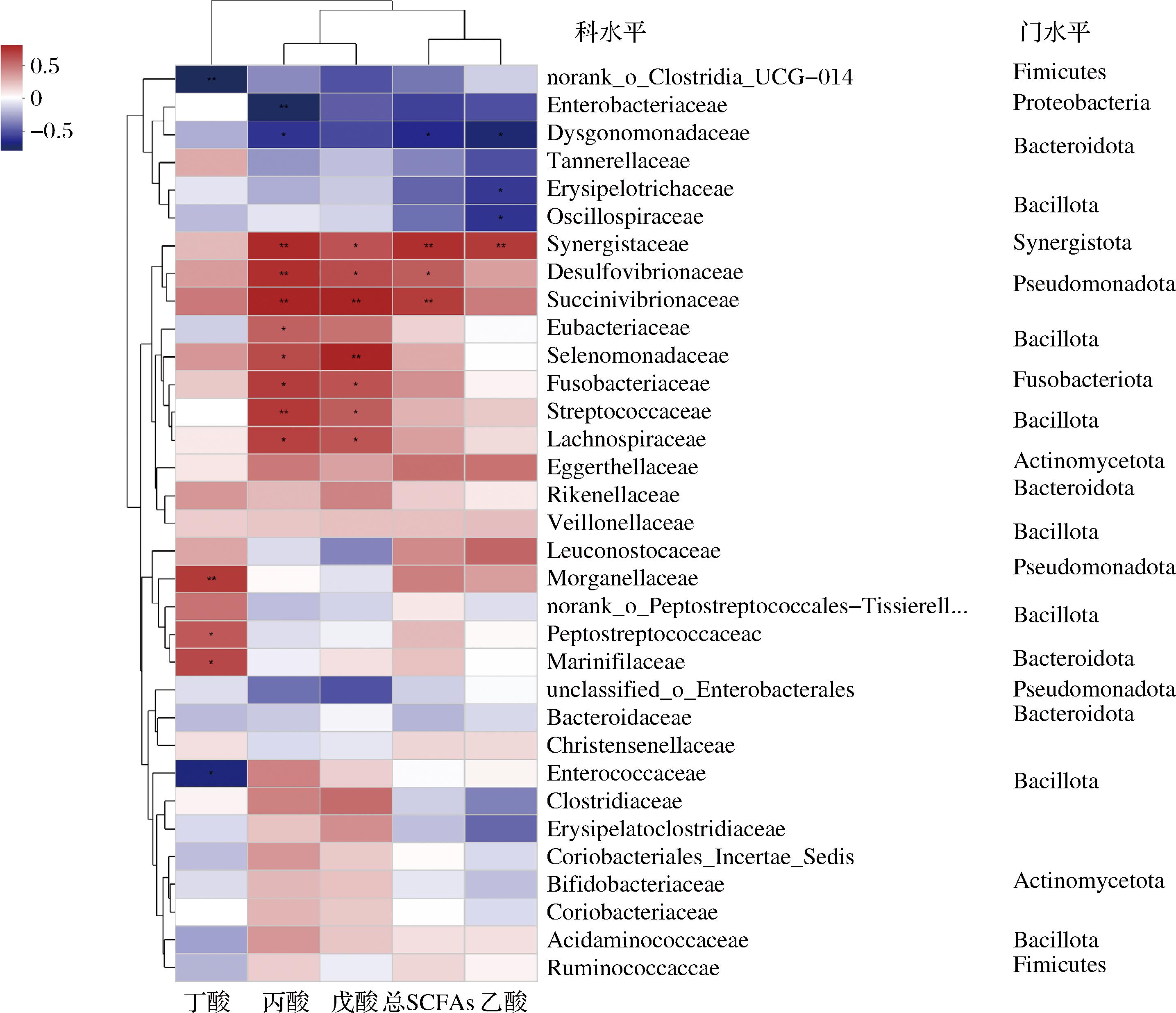
图6 体外发酵48 h微生物组成与SCFAs的相关性分析
Fig.6 Correlation analysis of microbial composition and SCFAs during 48 h in vitro fermentation
3 结论与讨论
与未添加HBG的植物基奶酪相比,HBG10表现出更优的质地和更紧密均匀的微观结构,表明HBG可作为脂肪替代物,与玉米醇溶蛋白共同制备低脂植物奶酪。进一步研究表明,在体外模拟动态胃肠道消化过程中,随着HBG含量增加,植物基奶酪的胃排空时间逐渐延长,氨基酸和脂肪酸的释放率逐渐降低。体外发酵实验结果表明,HBG10能显著提高乙酸、丙酸、戊酸及总SCFAs的含量。微生物多样性分析结果显示,HBG对肠道菌群的多样性和丰度的影响与Cheddar奶酪相似。综上所述,本研究为低脂植物奶酪的开发提供了理论依据,并为未来功能性食品原料的开发,特别是在食品加工和营养改善方面,提供了新的思路。
[1] SCHOBER T J, BEAN S R, BOYLE D L, et al.Improved viscoelastic zein-starch doughs for leavened gluten-free breads:Their rheology and microstructure[J].Journal of Cereal Science, 2008, 48(3):755-767.
[2] MATTICE K D, MARANGONI A G.Evaluating the use of zein in structuring plant-based products[J].Current Research in Food Science, 2020, 3:59-66.
[3] KHORSHIDIAN N, YOUSEFI M, SHADNOUSH M, et al.An overview of β-glucan functionality in dairy products[J].Current Nutrition &Food Science, 2018, 14(4):280-292.
[4] ANDERSSON H, ÖHGREN C, JOHANSSON D, et al.Extensional flow, viscoelasticity and baking performance of gluten-free zein-starch doughs supplemented with hydrocolloids[J].Food Hydrocolloids, 2011, 25(6):1587-1595.
[5] AYDINOL P, OZCAN T.Production of reduced-fat Labneh cheese with inulin and β-glucan fibre-based fat replacer[J].International Journal of Dairy Technology, 2018, 71(2):362-371.
[6] KONUKLAR G, INGLETT G E, WARNER K, et al.Use of a β-glucan hydrocolloidal suspension in the manufacture of low-fat Cheddar cheeses:Textural properties by instrumental methods and sensory panels[J].Food Hydrocolloids, 2004, 18(4):535-545.
[7] VOLIKAKIS P, BILIADERIS C G, VAMVAKAS C, et al.Effects of a commercial oat-β-glucan concentrate on the chemical, physico-chemical and sensory attributes of a low-fat white-brined cheese product[J].Food Research International, 2004, 37(1):83-94.
[8] MACKIE A, MULET-CABERO A I, TORCELLO-G MEZ A.Simulating human digestion:Developing our knowledge to create healthier and more sustainable foods[J].Food &Function, 2020, 11(11):9397-9431.
MEZ A.Simulating human digestion:Developing our knowledge to create healthier and more sustainable foods[J].Food &Function, 2020, 11(11):9397-9431.
[9] GUERRA A, ETIENNE-MESMIN L, LIVRELLI V, et al.Relevance and challenges in modeling human gastric and small intestinal digestion[J].Trends in Biotechnology, 2012, 30(11):591-600.
[10] LIU L J, HUANG G B, LI S Y, et al.Replacement of fat with highland barley β-glucan in zein-based cheese:Structural, rheological, and textual properties[J].Food Chemistry:X, 2023, 20:100907.
[11] MATTICE K D, MARANGONI A G.Physical properties of plant-based cheese products produced with zein[J].Food Hydrocolloids, 2020, 105:105746.
[12] GRASSO N, ROOS Y H, CROWLEY S V, et al.Composition and physicochemical properties of commercial plant-based block-style products as alternatives to cheese[J].Future Foods, 2021, 4:100048.
[13] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[14] PENG Z, WU P, WANG J J, et al.Achieving realistic gastric emptying curve in an advanced dynamic in vitro human digestion system:Experiences with cheese:A difficult to empty material[J].Food &Function, 2021, 12(9):3965-3977.
[15] 郭晨. 面粉面筋和直链淀粉含量对面条消化特性的影响[D].杭州:浙江工商大学, 2022.GUO C.The influence of gluten and straight-chain starch content of flour on the digestive properties of noodles[D].Hangzhou:Zhejiang Gongshang University, 2022.
[16] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5):642-646.
[17] WU D T, NIE X R, GAN R Y, et al.In vitro digestion and fecal fermentation behaviors of a pectic polysaccharide from okra (Abelmoschus esculentus) and its impacts on human gut microbiota[J].Food Hydrocolloids, 2021, 114:106577.
[18] ZHAO G H, NYMAN M, JÖNSSON J A.Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J].Biomedical Chromatography, 2006, 20(8):674-682.
[19] YE A Q, HEWITT S, TAYLOR S.Characteristics of rennet-casein-based model processed cheese containing maize starch:Rheological properties, meltabilities and microstructures[J].Food Hydrocolloids, 2009, 23(4):1220-1227.
[20] WIJAYA W, PATEL A R, SETIOWATI A D, et al.Functional colloids from proteins and polysaccharides for food applications[J].Trends in Food Science &Technology, 2017, 68:56-69.
[21] FLORCZUK A, ZA
![]() CKI M, ALJEWICZ M.The applicability of Calcofluor White (CWS) and Fluorescent Brightener (CFB) dyes for confocal laser microscopic analysis (CLSM) of various β-glucans in selected dairy products and water[J].Food Chemistry, 2023, 404:134508.
CKI M, ALJEWICZ M.The applicability of Calcofluor White (CWS) and Fluorescent Brightener (CFB) dyes for confocal laser microscopic analysis (CLSM) of various β-glucans in selected dairy products and water[J].Food Chemistry, 2023, 404:134508.
[22] CLEGG M E, PRATT M, MARKEY O, et al.Addition of different fats to a carbohydrate food:Impact on gastric emptying, glycaemic and satiety responses and comparison with in vitro digestion[J].Food Research International, 2012, 48(1):91-97.
[23] CARANDANG E V.Health benefits of virgin coconut oil[J].Indian Coconut Journal, 2008, 38, 8-15.
[24] LU C, ZHAO Z X, HUANG G B, et al.The contribution of cell wall integrity to gastric emptying and in vitro starch digestibility and fermentation performance of highland barley foods[J].Food Research International, 2023, 169:112912.
[25] DONG J L, ZHANG W L, LIN J, et al.The gastrointestinal metabolic effects of oat product based-β-glucan in mice[J].Food Science and Biotechnology, 2014, 23(3):917-924.
[26] XU Y Q, ZHU Y, LI X T, et al.Dynamic balancing of intestinal short-chain fatty acids:The crucial role of bacterial metabolism[J].Trends in Food Science &Technology, 2020, 100:118-130.
[27] RUIZ-MOYANO S, GONÇALVES DOS SANTOS M T P, GALV N A I, et al.Screening of autochthonous lactic acid bacteria strains from artisanal soft cheese:Probiotic characteristics and prebiotic metabolism[J].LWT, 2019, 114:108388.
N A I, et al.Screening of autochthonous lactic acid bacteria strains from artisanal soft cheese:Probiotic characteristics and prebiotic metabolism[J].LWT, 2019, 114:108388.
[28] BOURRIAUD C, ROBINS R J, MARTIN L, et al.Lactate is mainly fermented to butyrate by human intestinal microfloras but inter-individual variation is evident[J].Journal of Applied Microbiology, 2005, 99(1):201-212.
[29] SU A X, MA G X, XIE M H, et al.Characteristic of polysaccharides from Flammulina velutipes in vitro digestion under salivary, simulated gastric and small intestinal conditions and fermentation by human gut microbiota[J].International Journal of Food Science &Technology, 2019, 54(6):2277-2287.
[30] BALDELLI V, SCALDAFERRI F, PUTIGNANI L, et al.The role of Enterobacteriaceae in gut microbiota dysbiosis in inflammatory bowel diseases[J].Microorganisms, 2021, 9(4):697.
[31] AZUMA N, MAWATARI T, SAITO Y, et al.Effect of continuous ingestion of bifidobacteria and dietary fiber on improvement in cognitive function:A randomized, double-blind, placebo-controlled trial[J].Nutrients, 2023, 15(19):4175.
[32] LIU J, LYU Y J, PAN J X, et al.Effects of tea polyphenols and EGCG on glucose metabolism and intestinal flora in diabetic mice fed a cornstarch-based functional diet[J].Food Science and Technology, 2022, 42:e50821.