益生菌在维持肠道健康及缓解胃肠道疾病方面的潜力得到了广泛关注,尤其是在缓解便秘方面。现有的研究大多侧重于益生菌对肠道微环境和菌群结构的影响,而对其如何通过神经途径,尤其是通过调控神经递质以调节肠道功能的研究仍然较少[1]。因此,进一步研究益生菌在调节神经递质水平上的作用,对于深入探寻其缓解便秘的潜力具有重要意义。
近年来的研究表明,特定益生菌能够通过合成神经递质或调控其前体物质,直接或间接地调节肠道神经系统功能[2-4]。自上世纪50年代以来,已有多项研究指出植物乳植杆菌(Lactiplantibacillus plantarum)具备合成神经递质乙酰胆碱的能力[5-6]。乙酰胆碱作为一种关键的胃肠道神经递质,通过与肠道平滑肌细胞受体结合,能够激活与之耦联的G蛋白信号通路,进而调节平滑肌的收缩与松弛,促进肠道蠕动并推动食物和废物的排出,从而预防便秘等消化系统疾病[7-9]。因此,本研究旨在探究植物乳植杆菌CCFM1291对小鼠便秘症状的缓解作用及其作用机制,重点揭示其通过合成并分泌乙酰胆碱,显著增强肠道蠕动功能的效果。该研究将为益生菌在肠道健康管理,尤其是便秘症状的辅助治疗提供新的理论依据。
1 材料与方法
1.1 实验试剂
氯化乙酰胆碱,美国Sigma公司;洛哌丁胺,西安杨森制药有限公司;引物,生工生物工程(上海)股份有限公司;乙酰胆碱酶联免疫吸附测定试剂盒,上海酶联生物有限公司;实时荧光定量PCR预混试剂,美国伯乐生命医学有限公司;活性炭及其他试剂,国药集团化学试剂公司。
1.2 实验仪器
真空冷冻干燥机,美国LABCONCO公司;多功能酶标仪、超高速离心机,美国Thermo公司;实时荧光定量基因扩增仪,美国伯乐生命医学有限公司。
1.3 实验菌株
植物乳植杆菌CCFM1291,由江南大学食品生物技术中心菌种库提供。植物乳植杆菌CCFM1291最初从湖南麻阳的传统泡菜中分离,原始分离编号为DHuNHHMY9L1,保藏编号为CCFM1291,以确保菌株的标准化管理。在菌株培养过程中,严格控制培养条件,包括培养时间(12 h)、温度(37 ℃)和培养基成分(MRS培养基),以确保菌株的活性和稳定性。为保证每批次菌株在实验中的生长状态一致,采用统一的发酵培养条件,并在活菌接种前监测菌液的OD600,以确保活菌数量的一致性。
从-80 ℃冰箱中取出保存的植物乳植杆菌CCFM1291,在MRS固体培养基上连续划线活化2次。随后,将单菌落转接至MRS液体培养基,置于37 ℃培养箱中培养12 h。接着,以1%(体积分数)的接种量转接至900 mL MRS液体培养基进行扩增培养,12 h后,以6 000×g离心15 min。弃去上清液,得到菌体。用预冷的生理盐水洗涤菌体2次后,使用30%(体积分数)甘油重悬,并分装贮存于-80 ℃冰箱中备用。每隔7 d对冻存菌液进行活菌计数,确保动物试验期间的菌株活性,实验当天取出冻存菌液,离心后使用生理盐水洗涤2次重悬后灌胃。
1.4 动物实验方案
本实验使用36只5周龄雄性BALB/c小鼠,购自北京维通利华实验动物技术有限公司。在适应性饲养7 d后,小鼠被随机分为3组进行实验:空白组、模型组和CCFM1291组,随后连续干预14 d。在干预期内,小鼠每天上午10点按耳标序号顺序依次灌胃10 mg/kg·BW的盐酸洛哌丁胺,1 h后灌胃CCFM1291菌悬液(1×109 CFU/d,CCFM1291组)或生理盐水(模型组),空白组小鼠全程使用生理盐水代替灌胃试剂。所有小鼠均自由进食标准饲料,饲养在IVC笼盒中,环境条件控制在(25±2) ℃、湿度(50±5)%,实验采用12 h光照/12 h黑暗的周期进行(图1)。本动物实验方案已获得江南大学动物福利伦理委员会的批准(JN.NO.20240515c0840630[225])。
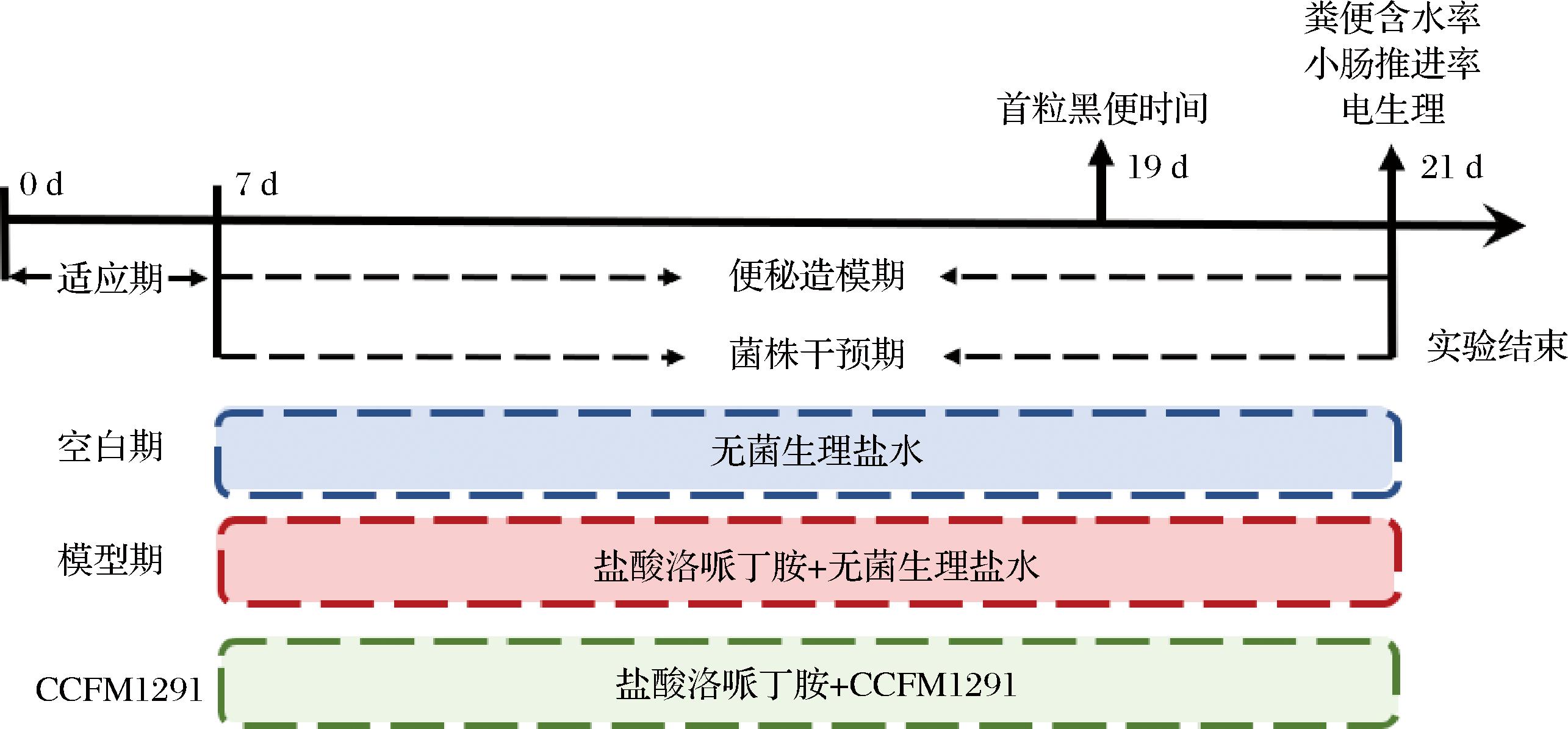
图1 动物实验流程图
Fig.1 Animal experiment scheme
1.5 便秘相关指标测定
1.5.1 首粒黑便时间
实验第19天,灌胃盐酸洛哌丁胺和“炭黑悬浮液”的混合溶液,记录每只小鼠灌胃混合溶液后到排出第一粒黑便的时长为首粒黑便时间。“炭黑悬浮液”制备:将100 g阿拉伯胶与800 mL水混合,加热至透明,加入50 g活性炭,持续搅拌并煮沸3次,以确保均匀混合,冷却后稀释至1 000 mL,并贮存于4 ℃冰箱备用[10]。
1.5.2 小肠推进率
实验动物的饲料类型均为标准固态配合饲料,小鼠初始年龄均为5周、初始体重均在(16±2) g的范围内,安乐死前对小鼠进行12 h严格禁食不禁水处理,安乐死当天所有小鼠均灌胃0.2 mL“炭黑悬浮液”,悬浮液的注射方式和剂量在各组保持一致,灌胃结束30 min后处死小鼠,打开小鼠腹腔后剪取幽门至盲肠的肠管,并将肠管拉直,测量其总长度作为“小肠总长度”,并记录从幽门到炭黑悬浮液前沿的距离为“炭黑悬浮液前端推进长度”。小肠推进率[10]的计算如公式(1)所示:
小肠推进率![]()
(1)
1.5.3 粪便含水量
将小鼠单独放入垫有滤纸的洁净笼盒中,收集新鲜粪便并记录原始质量为“粪便湿重”,进行冷冻干燥后,记录最终质量为“粪便干重”。粪便含水率[11]的计算如公式(2)所示:
粪便含水率![]()
(2)
1.6 乙酰胆碱含量测定
使用乙酰胆碱ELISA试剂盒测定小鼠结肠组织及结肠内容物中乙酰胆碱的含量。样品制备方法如下:每100 mg结肠/结肠内容物加入500 μL 4 ℃预冷的生理盐水进行匀浆,随后在4 ℃下以12 000×g离心10 min,取上清液进行测定。
1.7 实时定量qPCR
采用实时荧光定量PCR测定乙酰胆碱受体(Chrm3)、水通道蛋白(Aqp4、Aqp8)、离子通道蛋白(CFTR、ENaC、CACNA1D、C-kit)和胆碱乙酰转移酶(ChAT)相关基因的表达量。按照RNA提取试剂盒的说明,取约50 mg结肠组织,提取其中的总RNA,并测定其浓度和纯度。利用反转录试剂盒获得cDNA,在荧光定量扩增仪器上进行检测。所有引物均由生工生物工程(上海)股份有限公司合成,引物序列如表1所示。
表1 引物序列
Table 1 Primers sequence

目的基因引物序列(5'-3')正向反向GapdhF:AGGTCGGTGTGAACGGATTTGR:TGTAGACCATGTAGTTGAGGTCAChrm3F:CAGGATGCGTGCTTTACTGGR:AGTGTTGGGCAATGCTCTCTAqp4F:CCGTGGGTGGAAGTGATAGAR:CCATCTGACCCAGGTTGAGAAqp8F:ATGGAGACAGTGCTGGTGCTR:TGTGGACTCCGGTGACTGATCFTRF:CTGTGTTGGACAGCAACCACR:CGAGTTGAGCAAGGGCATAAENaCF:GTCACGCTTCTCCATTGTTGR:AGGAAGTTCGTAGGCGTCTGCACNA1DF:GCTGACCTGCTGTTCTGGTTR:GACTGGGTGAGTGGGTGTCTC-kitF:TGACCGAGTGAGGAACACAGR:TCGTGTCCAGGTCCTGATCTChatF:AGGACTCGAGGCTCTGCTATR:GCTTCTGCCTGAGGAGGATT
1.8 电生理检测
使用微电极阵列(microelectrode array,MEA)技术测量小鼠肠道的神经电活动。实验设备为Alpha MED Scientific公司的8×8 MEA记录系统(每个电极之间距离为150 μm),配备14-bit A/D转换器以将神经电信号转换为数字信号,以确保信号采集范围均匀覆盖肠道平滑肌的电活动,为了维持稳定的实验环境,使用改良的Krebs溶液作为灌流液,控制温度在34 ℃,流速为1~2 mL/min[12]。
从小鼠中获取结肠组织,去除黏膜层,以暴露平滑肌层,并将组织样本固定于MEA电极上,确保平滑肌层朝下。按照解剖定位标准化放置,使用膜片钳将组织进一步固定,确保每次结肠组织的摆放深度和角度相对于电极位置保持一致,控制MEA液面与肠道组织表面平齐,以避免实验期间的微小位移对数据造成干扰,实验在无菌条件下进行,以无菌PBS浸润电极以防止微生物污染干扰电极性能。每次实验前,样本在灌流液中平衡30 min,随后停止灌流,以减少电噪音干扰。实验记录时,采用多通道交流放大器对每个电极进行信号采集,记录阵列中各电极的场电位。信号经过低通滤波(截止频率为10 kHz)后,采样频率设定为20 kHz[12]。实验过程中实时监测并记录电信号,以捕捉肠道的神经电活动[10]。此外,每次实验前后对电极表面进行彻底清洁和校准,以确保信号质量稳定、可靠。
1.9 数据统计与分析
实验数据以“平均值±标准差”表示,使用SPSS软件进行单因素方差分析,P<0.05时视为差异具有统计学显著性。以符号数目区分显著性等级,其中*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。分析肠道神经电活动时,采用Kaiseki Excel附加软件对场电位数据进行处理。
2 结果与分析
2.1 植物乳植杆菌CCFM1291促进便秘小鼠肠道蠕动
实验结果显示,相较于模型组,CCFM1291处理小鼠的肠道推进率显著增加(图2-a),表明该菌株能够有效改善小鼠的肠道蠕动功能。此外,CCFM1291组小鼠首次排黑便的时间显著减少(图2-b),进一步证实其对肠道运动的积极调控作用。此外,测定结果表明,植物乳植杆菌CCFM1291的干预显著提升了便秘模型小鼠肠腔内容物中乙酰胆碱的含量(图2-c)。已有研究证明,植物乳植杆菌自身能够合成乙酰胆碱[5,13],因此推测植物乳植杆菌CCFM1291可能通过分泌乙酰胆碱来调节肠道神经功能。
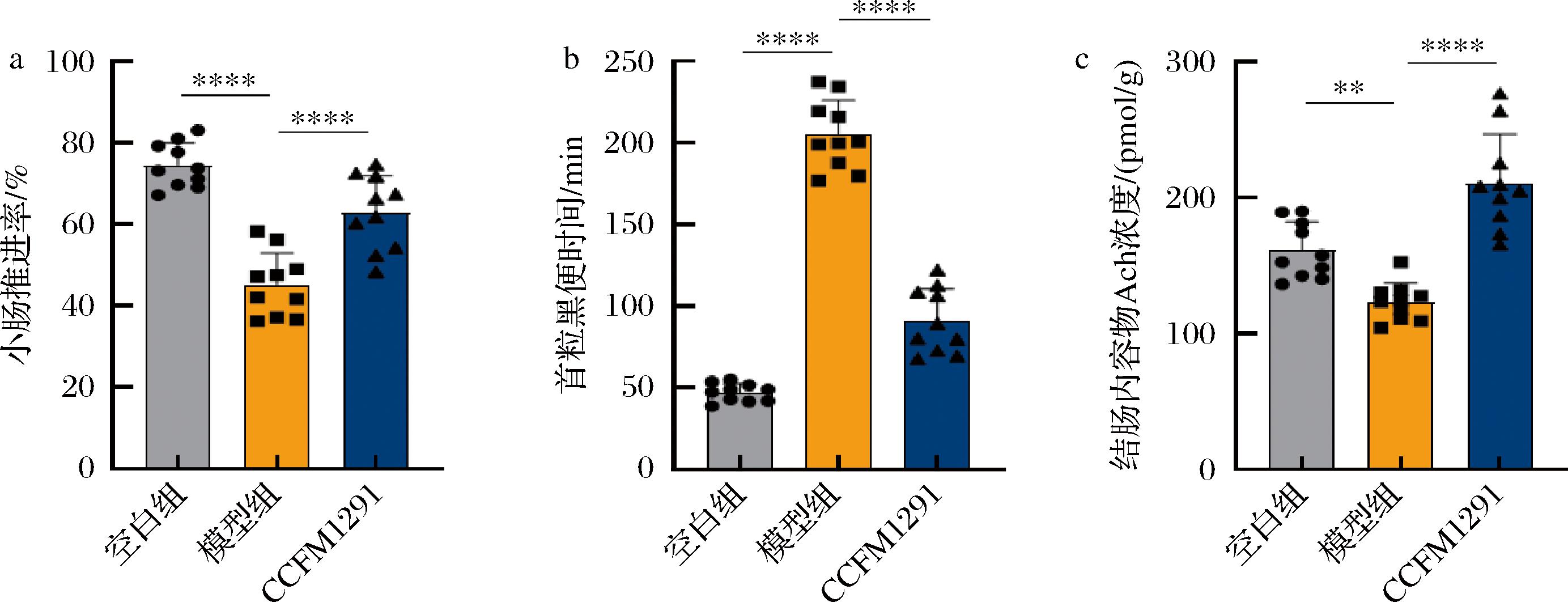
a-小肠推进率;b-首粒黑便时间;c-结肠内容物Ach浓度
图2 小鼠便秘相关指标
Fig.2 Constipation-related indicators in mice
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1(与模型组比较,下同)。
2.2 植物乳植杆菌CCFM1291通过产生乙酰胆碱调节小鼠肠道水分转运
乙酰胆碱是肠道神经系统中重要的神经递质之一,通过与毒蕈碱型受体结合,调控肠道平滑肌的收缩和蠕动[14]。经盐酸洛哌丁胺干预14 d后,模型组小鼠结肠组织中乙酰胆碱受体CHRM3基因(Chrm3)的表达显著下调(图3-a),CHRM3是调节肠道运动功能的关键毒蕈碱型受体亚型[15]。与模型组小鼠相比,经过植物乳植杆菌CCFM1291干预的小鼠结肠Chrm3基因表达显著提升(图3-a),可能与肠腔乙酰胆碱含量的增加有关。有研究表明,CHRM3受体的激活影响水通道蛋白(aquaporins, AQP)的基因表达,进而调节肠道水分的转运和吸收[16]。在本研究中,盐酸洛哌丁胺的干预导致小鼠水通道蛋白AQP4和AQP8的基因表达量异常降低,粪便含水率显著降低(图3-d)。在水通道蛋白家族中,AQP4和AQP8是调控水分平衡的重要成员。AQP4主要分布于肠道上皮细胞,负责水分跨细胞的转运,其表达增加将提升结肠对肠腔内水分的吸收,从而降低粪便含水率;AQP8则参与细胞内外的水分调节,主要存在于肠道分泌细胞和肝脏等组织中,对维持细胞渗透压和平衡水代谢至关重要[17]。植物乳植杆菌CCFM1291干预后,显著抑制了小鼠结肠因洛哌丁胺导致的Aqp8基因表达异常降低,并最终提升了粪便含水率(图3-b~图3-d)。这些结果表明,植物乳植杆菌CCFM1291可能通过提升肠腔乙酰胆碱含量,激活毒蕈碱型乙酰胆碱受体并调节水通道蛋白表达,从而缓解洛哌丁胺导致的小鼠肠道水分转运异常,最终恢复粪便水分含量。
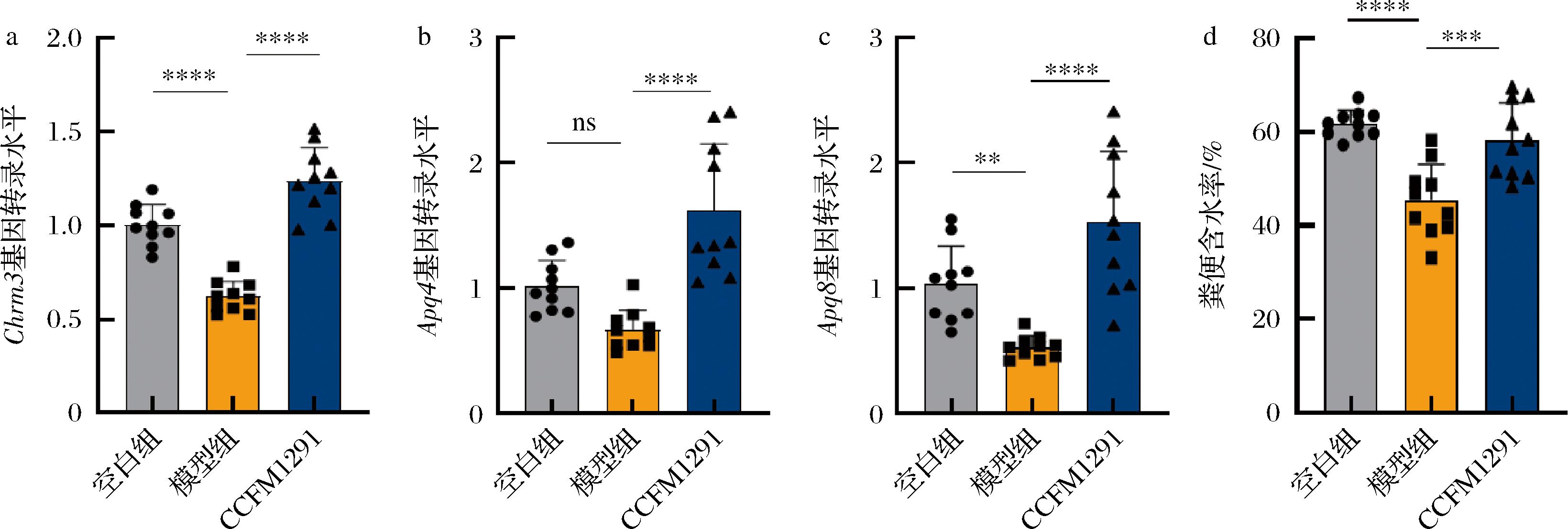
a-Chrm3基因转录水平;b-Aqp4基因转录水平;c-Aqp8基因转录水平;d-粪便含水率
图3 植物乳植杆菌CCFM1291对小鼠肠道水分转运的影响
Fig.3 The effect of L. plantarum CCFM1291 on water transport in the mouse intestine
2.3 微电极阵列记录植物乳植杆菌CCFM1291调控小鼠结肠组织电生理活动
实验通过记录小鼠肠神经电活动的慢波频率及功率谱总密度,观察不同处理组肠神经系统的活性变化。结果显示,空白组的小鼠展示了较强的电信号波动,相较之下,在模型组的电信号图谱中,小鼠肠神经电活动信号明显(图4-a和图4-b),表明便秘导致肠神经活动受损,神经调节功能减弱,肠道运动显著下降。此外,从图4-d和图4-e中的统计分析结果可以看出,相较于空白组小鼠,模型组小鼠结肠组织慢波频率下降了约82%(~0.01 HZ)且功率谱总密度也降低了约98%(~0.3 μV2/Hz),显示出较弱的肠神经系统电生理信号。经过植物乳植杆菌CCFM1291干预后,小鼠的慢波频率和功率谱总密度显著恢复,且均超过正常水平。特别是功率谱总密度在干预组中显著上调,慢波频率的恢复也具有统计学显著性(图4-d和图4-e)。这些数据表明,植物乳植杆菌CCFM1291干预能够有效改善便秘小鼠的肠神经系统活性,恢复其正常的电生理活动,进而提升肠动力。
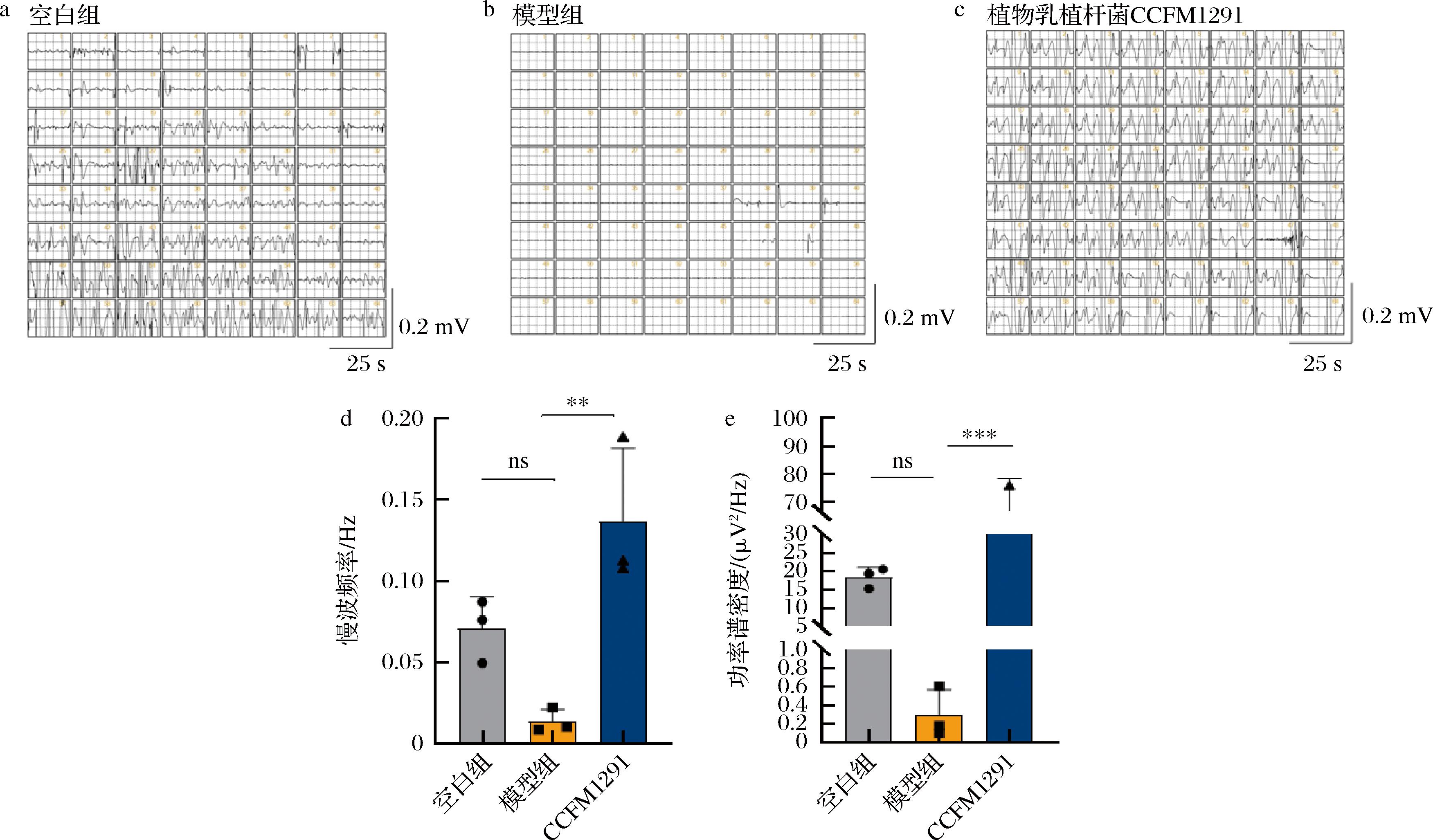
a-空白组电极阵列记录的电信号及电信号在不同时间点的空间分布;b-模型组电极阵列记录的电信号及电信号在不同时间点的空间分布;c-植物乳植杆菌CCFM1291干预组电极阵列记录的电信号及电信号在不同时间点的空间分布;d-植物乳植杆菌CCFM1291干预对小鼠结肠组织慢波频率的影响;e-植物乳植杆菌CCFM1291干预对小鼠结肠组织功率谱总密度的影响
图4 植物乳植杆菌CCFM1291对小鼠结肠电生理活性的影响
Fig.4 The effect of L.plantarum CCFM1291 on the electrophysiological activity of the mouse colon
2.4 植物乳植杆菌CCFM1291通过产生乙酰胆碱调控小鼠结肠组织电生理活动
乙酰胆碱与毒蕈碱型乙酰胆碱受体结合后,还可以直接或间接调控离子通道蛋白的活性,从而调控离子的跨膜运输,离子通道蛋白在维持细胞内外离子平衡和调节肠道电生理活动中发挥着关键作用,尤其是在肠道蠕动和液体平衡的维持中具有关键意义[18]。
本研究发现植物乳植杆菌CCFM1291对洛哌丁胺诱导的便秘模型小鼠结肠电生理活性的促进作用可能与其调节离子通道蛋白的表达能力有关。具体表现为,在植物乳植杆菌CCFM1291干预14 d后,小鼠结肠中上皮Na+通道(epithelial sodium channel, ENaC)、囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator, CFTR)和L-型电压依赖性Ca2+通道α1D亚基(calcium voltage-gated channel subunit alpha1 D, CACNA1D)等主要离子通道蛋白基因的转录水平显著上升(图5-a~图5-c)。ENaC、CACNA1D和CFTR是结肠上皮细胞中负责Na+、Ca2+和电解质运输的主要通道蛋白,其表达水平的变化直接影响肠道电生理状态和液体分泌功能。结肠中这些离子通道蛋白的表达上调往往与宿主便秘症状密切相关[19]。通过提高这些离子通道蛋白的表达,实验结果表明,植物乳植杆菌CCFM1291的干预有效改善了小鼠的肠道功能,进而缓解了便秘症状。
此外,编码酪氨酸激酶受体的基因C-kit与肠道起搏细胞的节律性活动密切相关,对维持肠道蠕动节律至关重要[20]。模型组小鼠中C-kit基因的过度表达而这通常指示着结肠内的某种病理状态,如肠道动力障碍或肠道肿瘤[21-22]。干预组小鼠结肠中的表达则恢复到正常水平,从而恢复了肠道起搏细胞的功能(图5-d)。值得注意的是,尽管模型组小鼠肠道组织中的乙酰胆碱浓度显著下降(图5-e),植物乳植杆菌CCFM1291的干预未能显著提升结肠组织中乙酰胆碱水平和乙酰胆碱合成酶的基因表达(图5-f)。这表明其对毒蕈碱型乙酰胆碱受体的激活可能依赖于其对肠腔内乙酰胆碱含量的提升。
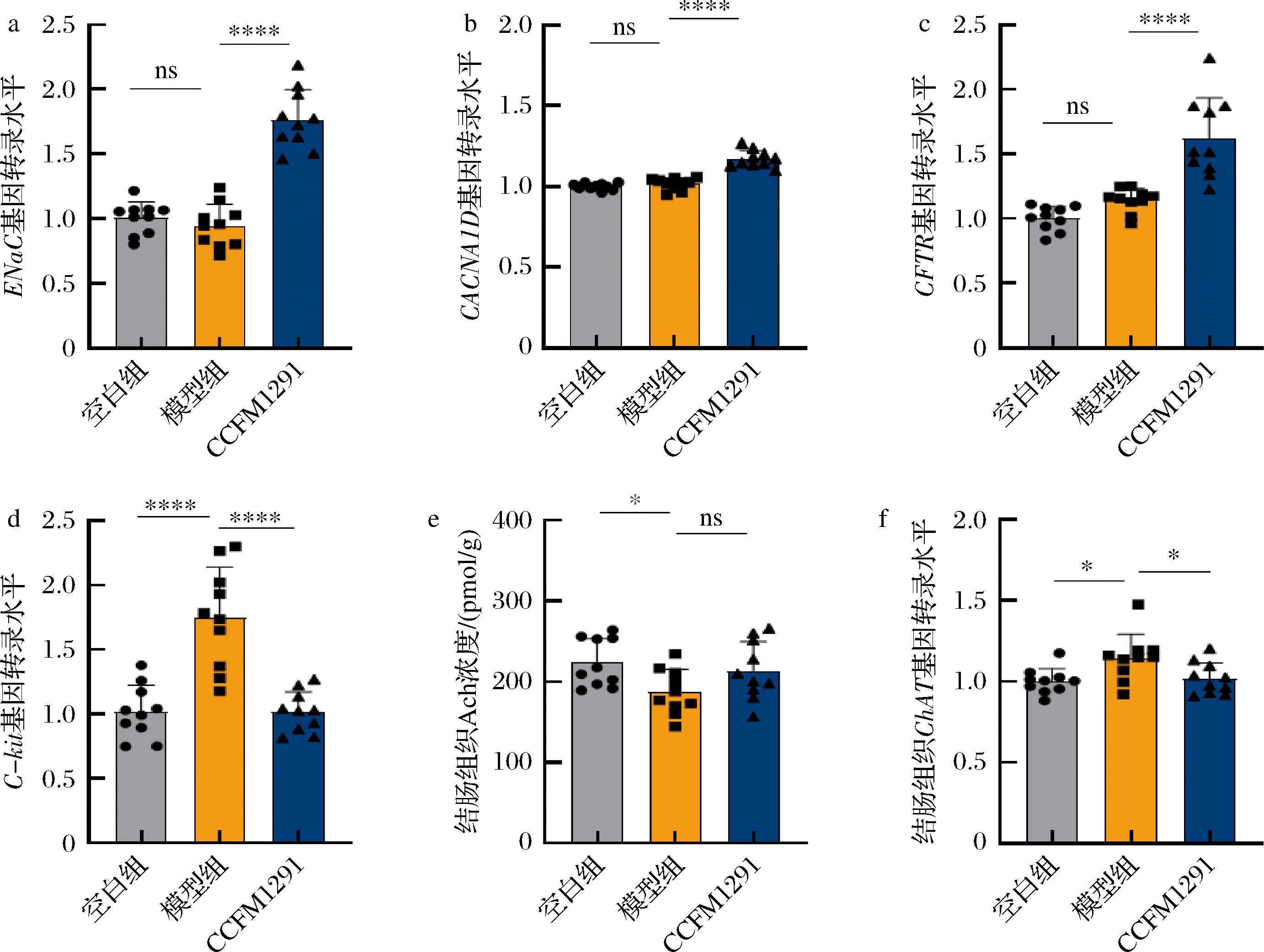
a-ENaC基因转录水平;b-CACN1AD基因转录水平;c-CFTR基因转录水平;d-C-kit基因转录水平;e-结肠组织Ach质量浓度结肠组织;f-ChAT基因转录水平
图5 植物乳植杆菌CCFM1291对小鼠结肠离子通道蛋白的影响
Fig.5 The effect of L.plantarum CCFM1291 on ion channel proteins in the mouse colon
3 讨论
便秘是一种复杂的肠道功能障碍,其发病机制涉及肠道蠕动、神经调控和水分吸收等多个方面。主要病理机制包括肠道蠕动异常和粪便水分减少,这些因素导致粪便在结肠内停留时间延长,造成排便困难。肠道平滑肌的协调收缩由肠神经系统调控,当其功能异常时,会削弱蠕动,影响粪便推进。同时,过度的水分再吸收使粪便干燥,进一步加剧便秘[23]。水通道蛋白(如AQP4和AQP8)在肠道水分吸收中发挥关键作用,其表达异常与便秘相关[24]。此外,乙酰胆碱作为肠神经系统的重要神经递质,通过激活毒蕈碱型受体(M受体)促进平滑肌收缩,从而维持蠕动节律[25]。研究表明,便秘患者的乙酰胆碱水平显著下降[26-28],表明乙酰胆碱合成或释放不足可能导致蠕动功能减弱。因此,调节乙酰胆碱水平是缓解便秘的重要策略。
近年来,益生菌在便秘治疗中的应用取得了显著进展。尤其是植物乳植杆菌,通过调节肠道微生态、促进肠道蠕动及水分代谢等机制,表现出改善便秘的潜力[29]。例如,植物乳植杆菌KFY02在低纤维饮食引起的便秘小鼠模型中,通过调节肠道微生物群落,促进有益菌的生长并抑制有害菌的扩增,从而有效改善了肠道的蠕动功能[1]。植物乳植杆菌Lp3a在临床和动物模型中也显示出改善功能性便秘的显著效果,其机制与短链脂肪酸(如丁酸)的生成密切相关,丁酸通过提供能量增强肠道平滑肌的收缩,进而促进肠道蠕动[30]。值得注意的是,植物乳植杆菌YS-3和KSFY06通过调节水通道蛋白AQP3和AQP4的表达,促进肠道水分转运,改善了便秘小鼠的肠道推进力[4, 31]。此外,研究表明,植物乳植植杆菌能够通过免疫调节作用,激活巨噬细胞的记忆样免疫反应,进一步增强肠道蠕动和水合作用[32]。这些研究表明,植物乳植杆菌不仅通过改善肠道微生物群来缓解便秘,还通过多种途径调节肠道功能,具有潜在的临床应用价值。
与传统益生菌研究不同,本研究重点探讨了植物乳植杆菌CCFM1291通过乙酰胆碱信号通路调节肠道功能的机制。研究发现,植物乳植杆菌CCFM1291能够通过合成乙酰胆碱,激活肠道内的毒蕈碱型受体,进而调节关键离子通道蛋白(如ENaC、CFTR和CACNA1D)的表达,恢复便秘小鼠的肠道蠕动功能。这一发现为益生菌在肠道蠕动调节中的作用提供了新的分子机制解释。此外,与传统益生菌主要通过调节水通道蛋白的作用不同[33],植物乳植杆菌CCFM1291能够通过乙酰胆碱信号通路调节AQP4和AQP8的表达,直接影响肠道水分转运。这一发现为益生菌在水分代谢调控方面的研究开辟了新的视角。在实验方法上,本研究采用了MEA技术,体外记录肠道蠕动的电生理数据。与传统的方法相比,MEA技术能够实时、精确地捕捉肠道蠕动的电信号变化,提供了更为动态和细致的肠道功能调控数据[12]。IWATA 等[34]的研究也应用MEA技术记录肠道神经元的活动,记录了小鼠肠道各部分电活动的状态。通过MEA技术,能够更深入地理解植物乳植杆菌CCFM1291如何调节肠道神经活动和离子通道蛋白的表达。
4 结论
本研究深入探讨了植物乳植杆菌CCFM1291对便秘小鼠肠道功能的影响及其可能的分子机制。实验结果显示,CCFM1291能够促进乙酰胆碱的合成和分泌,从而有效增强小鼠的肠道蠕动。在接受CCFM1291干预后,小鼠的肠道推进率得到了显著改善。首次黑便排出时间缩短,显示出该菌株在缓解便秘方面的显著效果。此外,CCFM1291通过提升结肠内乙酰胆碱含量,激活毒蕈碱型乙酰胆碱受体,进而调节水通道蛋白AQP4和AQP8的基因表达,改善了小鼠肠道的水分转运功能,显著提高了粪便的含水率。值得注意的是,CCFM1291能够通过调节乙酰胆碱相关途径,促进离子通道蛋白CFTR、ENaC和CACNA1D的表达,进而恢复结肠的电生理活性。综上,植物乳植杆菌CCFM1291具有显著的调节肠道蠕动、电生理活性和水分转运的功能,为其在改善便秘和维护肠道健康中的应用提供了坚实的理论基础。然而,本研究也存在局限性。首先,本研究的实验对象是小鼠模型,尚未在人体中验证其效果。因此,未来的研究应包括临床试验,以评估植物乳植杆菌CCFM1291在人体中的安全性和有效性。其次,虽然本研究探讨了乙酰胆碱在缓解便秘中的作用,但其他可能的神经递质或信号通路的作用尚未完全揭示。例如,γ-氨基丁酸和多巴胺等神经递质可能也在肠道调节中发挥作用,未来的研究可以进一步探讨植物乳植杆菌是否还可以通过这些途径发挥作用。此外,尽管本研究推测植物乳植杆菌CCFM1291缓解便秘的作用可能与其乙酰胆碱合成能力相关,但这一假设仍需进一步验证。未来的研究应重点挖掘与乙酰胆碱合成相关的关键基因,并通过基因敲除、回补等分子生物学技术手段,明确这些基因在菌株调控肠道功能中的具体作用。
[1] YI R K, ZHOU X, LIU T J, et al.Amelioration effect of Lactobacillus plantarum KFY02 on low-fiber diet-induced constipation in mice by regulating gut microbiota[J].Frontiers in Nutrition, 2022, 9:938869.
[2] AGUS A, PLANCHAIS J, SOKOL H.Gut microbiota regulation of tryptophan metabolism in health and disease[J].Cell Host &Microbe, 2018, 23(6):716-724.
[3] DINAN T G, CRYAN J F.Brain-gut-microbiota axis:Mood, metabolism and behaviour[J].Nature Reviews Gastroenterology &Hepatology, 2017, 14(2):69-70.
[4] GAN Y, LIANG J, DIAO W J, et al.Lactobacillus plantarum KSFY06 and geniposide counteract montmorillonite-induced constipation in Kunming mice[J].Food Science &Nutrition, 2020, 8(9):5128-5137.
[5] STANASZEK P M, SNELL J F, O’NEILL J J.Isolation, extraction, and measurement of acetylcholine from Lactobacillus plantarum[J].Applied and Environmental Microbiology, 1977, 34(2):237-239.
[6] SHARKEY K A, WILEY J W.The role of the endocannabinoid system in the brain-gut axis[J].Gastroenterology, 2016, 151(2):252-266.
[7] ZHENG L, KELLY C J, COLGAN S P.Physiologic hypoxia and oxygen homeostasis in the healthy intestine.A Review in the Theme:Cellular Responses to Hypoxia[J].American Journal of Physiology.Cell Physiology, 2015, 309(6):C350-C360.
[8] FOROOTAN M, BAGHERI N, DARVISHI M.Chronic constipation:A review of literature[J].Medicine, 2018, 97(20):e10631.
[9] 罗欣. 海藻酸钠—果胶—乳清分离蛋白复合物构建及对植物乳植杆菌和EGCG的共包埋研究[D].杭州:浙江工商大学, 2023.LUO X.Study on the co-encapsulation of Lactobacillus plantarum and EGCG by alginate-pectin-whey protein isolate composite[D].Hangzhou:Zhejiang Gongshang University, 2023.
[10] WU L, NIU Y, REN B Y, et al.Naringenin promotes gastrointestinal motility in mice by impacting the SCF/c-kit pathway and gut microbiota[J].Foods, 2024, 13(16):2520.
[11] ZOU H, GAO H J, LIU Y H, et al.Dietary inulin alleviated constipation induced depression and anxiety-like behaviors:Involvement of gut microbiota and microbial metabolite short-chain fatty acid[J].International Journal of Biological Macromolecules, 2024, 259:129420.
[12] YOSHIMARU K, YAMAZA T, KAJIOKA S, et al.Dental pulp stem cells as a therapy for congenital entero-neuropathy[J].Scientific Reports, 2022, 12:6990.
[13] CASERTANO M, FRYGANAS C, VALENTINO V, et al.Gut production of GABA by a probiotic formula:An in vitro study[J].Beneficial Microbes, 2024, 15(1):67-81.
[14] TAKAHASHI T.Multiple roles for cholinergic signaling from the perspective of stem cell function[J].International Journal of Molecular Sciences, 2021, 22(2):666.
[15] WANG Y Y, SCHEFFEL J, VERA C A, et al.Impaired sweating in patients with cholinergic urticaria is linked to low expression of acetylcholine receptor CHRM3 and acetylcholine esterase in sweat glands[J].Frontiers in Immunology, 2022, 13:955161.
[16] KLAKA P, GRÜDL S, BANOWSKI B, et al.A novel organotypic 3D sweat gland model with physiological functionality[J].PLoS One, 2017, 12(8):e0182752.
[17] LUO M, XIE P W, DENG X H, et al.Rifaximin ameliorates loperamide-induced constipation in rats through the regulation of gut microbiota and serum metabolites[J].Nutrients, 2023, 15(21):4502.
[18] CAI T, DONG Y, FENG Z Y, et al.Ameliorative effects of the mixed aqueous extract of Aurantii Fructus Immaturus and Magnoliae officinalis Cortex on loperamide-induced STC mice[J].Heliyon, 2024, 10(13):e33705.
[19] ZHI H, YUAN W T.Expression of aquaporin 3, 4, and 8 in colonic mucosa of rat models with slow transit constipation[J].Chinese Journal of Gastrointestinal Surgery, 2011, 14(6):459-461.
[20] CUI L, ZHANG B, ZOU S T, et al.Fenchone ameliorates constipation-predominant irritable bowel syndrome via modulation of SCF/c-kit pathway and gut microbiota[J].Journal of Microbiology and Biotechnology, 2024, 34(2):367-378.
[21] SHEIKH E, TRAN T, VRANIC S, et al.Role and significance of c-KIT receptor tyrosine kinase in cancer:A review[J].Bosnian Journal of Basic Medical Sciences, 2022, 22(5):683-698.
[22] MAZZOLDI E L, PAVAN S, PILOTTO G, et al.A juxtacrine/paracrine loop between C-Kit and stem cell factor promotes cancer stem cell survival in epithelial ovarian cancer[J].Cell Death &Disease, 2019, 10:412.
[23] BHARUCHA A E.Constipation[J].Best Practice &Research Clinical Gastroenterology, 2007, 21(4):709-731.
[24] LIU M, CHEN J Y, ZHAN C E, et al.Study on regulating AQP1, AQP3, AQP4, 5-HT, NOS1 in slow transit constipation rats by Liqi Tongbian mixture[J].Advances in Clinical and Experimental Medicine, 2024, 33(11):1209-1215.
[25] TAKAHASHI T, OHNISHI H, SUGIURA Y, et al.Non-neuronal acetylcholine as an endogenous regulator of proliferation and differentiation of Lgr5-positive stem cells in mice[J].The FEBS Journal, 2014, 281(20):4672-4690.
[26] ZHOU P F, WANG X P, SUN M M, et al.Effects of natural products on functional constipation:Analysis of active ingredient and mechanism[J].Naunyn-Schmiedeberg’s Archives of Pharmacology, 2024, 397(4):2083-2103.
[27] WU H, CHEN Y J, HUANG B B, et al.Aster tataricus alleviates constipation by antagonizing the binding of acetylcholine to muscarinic receptor and inhibiting Ca2+ influx[J].Biomedecine &Pharmacotherapie, 2021, 133:111005.
[28] GALLIGAN J J, AKBARALI H I.Molecular physiology of enteric opioid receptors[J].American Journal of Gastroenterology Supplements, 2014, 2(1):17-21.
[29] LAI H, LI Y F, HE Y F, et al.Effects of dietary fibers or probiotics on functional constipation symptoms and roles of gut microbiota:A double-blinded randomized placebo trial[J].Gut Microbes, 2023, 15(1):2197837.
[30] ZHANG C L, ZHANG Y, MA K, et al.Lactobacillus plantarum Lp3a improves functional constipation:Evidence from a human randomized clinical trial and animal model[J].Annals of Translational Medicine, 2022, 10(6):316.
[31] ZHAO X, YI R K, QIAN Y, et al.Lactobacillus plantarum YS-3 prevents activated carbon-induced constipation in mice[J].Journal of Medicinal Food, 2018, 21(6):575-584.
[32] PELLON A, BARRIALES D, PE A-CEARRA A, et al.The commensal bacterium Lactiplantibacillus plantarum imprints innate memory-like responses in mononuclear phagocytes[J].Gut Microbes, 2021, 13(1):1939598.
A-CEARRA A, et al.The commensal bacterium Lactiplantibacillus plantarum imprints innate memory-like responses in mononuclear phagocytes[J].Gut Microbes, 2021, 13(1):1939598.
[33] XU R, BI Y P, HE X T, et al.Kidney-tonifying blood-activating decoction delays ventricular remodeling in rats with chronic heart failure by regulating gut microbiota and metabolites and p38 mitogen-activated protein kinase/p65 nuclear factor kappa-B/aquaporin-4 signaling pathway[J].Journal of Ethnopharmacology, 2024, 330:118110.
[34] IWATA N, FUJIMURA T, TAKAI C, et al.Dialysis membrane-enforced microelectrode array measurement of diverse gut electrical activity[J].Biosensors and Bioelectronics, 2017, 94:312-320.