鱼椒酸(Yu jiaosuan,YJS)是中国西南地区一款传统的发酵调味品,因营养丰富、风味独特、具有民族特色而闻名。鱼椒酸以红辣椒和泥鳅为主要原料,经微生物发酵半个月制成,富含辣椒中的维生素、纤维素、矿物质和泥鳅中的蛋白质和不饱和脂肪酸。已有研究表明,鱼椒酸含有多种对人体健康有益的代谢产物[1]。然而,以自然发酵方式制成的鱼椒酸通常存在发酵周期长、生产条件一致性差等缺点,导致不同批次的产品之间存在明显的风味差异,不利于鱼椒酸的规模化生产及跨区域推广。
本土发酵剂是从发酵食品中分离和筛选出的微生物,能更好地适应发酵环境,有利于缩短产品发酵周期,提高产品的稳定性和安全性,同时有助于保持甚至改善产品的颜色、味道和香气[2]。乳酸菌是广泛存在于各种发酵食品的重要微生物,在发酵过程中能产生有机酸和细菌素等物质,抑制产品中腐败菌和致病菌的生长[3]。同时,乳酸菌能够通过脂肪代谢、蛋白质代谢等过程产生重要的风味化合物,从而影响产品的风味品质。因此,乳酸菌常被用作发酵剂以提高发酵食品的品质。微生物群落的演替和代谢对发酵食品的风味有重要影响。研究发酵过程中微生物群落和风味物质的变化及其关联性,可以揭示微生物群落演替在关键风味物质形成中的作用[4]。乳酸菌已被广泛应用于辣椒酱[5]、酸菜[6]、葡萄酒[7]等发酵产品,并促进了产品中多种挥发性风味化合物的生成。
基于此,本研究以实验室前期从鱼椒酸样品中分离筛选出的2株优势乳酸菌——植物乳植杆菌(Lactiplantibacillus plantarum)Y279和食窦魏斯氏菌(Weissella cibaria)Y113为本土发酵剂[8],对鱼椒酸进行强化接种发酵。以自然发酵为对照组,接种发酵为实验组,对样品发酵过程中细菌群落结构、理化性质、非挥发性代谢产物和挥发性风味化合物进行分析,并探讨细菌群落变化与特征风味物质之间的相关性,旨在揭示乳酸菌在优质鱼椒酸形成中的作用。研究结果将为乳酸菌对发酵食品风味形成的贡献提供新见解,并为鱼椒酸风味的靶向调控和发酵工艺的优化提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜辣椒、新鲜泥鳅、食盐、生姜、白酒均购自贵州省贵阳市花溪区本地市场。植物乳植杆菌(L.plantarum)Y279和食窦魏斯氏菌(W.cibaria)Y113分离于自然发酵的鱼椒酸样品。
MRS液体培养基,上海博微生物科技有限公司;NaOH、盐酸(均为分析纯),重庆万盛川东化工有限公司;磺基水杨酸(分析纯),上海麦克林生化科技有限公司;3-己酮标准品,德国默克公司;DNA纯化回收试剂盒,北京天根生化科技有限公司;NEBNext® Ultra DNA文库构建试剂盒,北京纽英伦生物技术有限公司。
1.2 仪器与设备
DYCP-32C核酸电泳仪,北京市六一仪器厂;Qubit 2.0荧光定量仪,美国赛默飞世尔科技公司;Agilent 5400生物分析仪、8890-7000D气相色谱-质谱联用仪、Agilent 1100高效液相色谱仪,美国安捷伦科技有限公司;T100聚合酶链反应核酸扩增仪,美国Bio-Rad公司;Illumina NovaSeq 6000高通量测序仪,美国Illumina公司;FSH-2A均质机,常州市国旺仪器制造有限公司;PHSJ-3F pH计,上海仪电科学仪器股份有限公司;XMTD-204水浴磁力搅拌器,天津市欧诺仪器仪表有限公司;GL-20G-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;S-433D氨基酸自动分析仪,德国Sykam公司。
1.3 实验方法
1.3.1 发酵剂制备
将W.cibaria Y113和L.plantarum Y279分别接种到MRS液体培养基中,在37 ℃下活化2次,每次孵育18 h。活化好的菌液倒入无菌离心管中,在4 ℃,6 000 r/min离心1 min,收集细菌细胞沉淀。菌体沉淀用质量分数为0.9%的无菌生理盐水洗涤3次,并稀释成浓度为107 CFU/mL的悬浮液作为发酵剂。
1.3.2 鱼椒酸制备
新鲜辣椒去把洗净,晾干水分后切碎。新鲜泥鳅去头尾和内脏,洗净切成小块。将辣椒和泥鳅按10∶1的质量比混合,并称重。随后加入质量分数分别为4%、7%、3%的生姜、食盐、白酒。自然发酵组不加入发酵剂,作为对照组。按2%的接种量在发酵组中加入发酵剂(Y279∶Y113=2∶1,体积比),作为实验组。混合均匀后放入玻璃罐中,在25 ℃下密封发酵。收集发酵第0、4、8、12天的样品,分别用CK0、CK4、CK8、CK12和FE0、FE4、FE8、FE12代表自然发酵组和接种发酵组不同发酵阶段的样品。每组制备3个生物学重复。
1.3.3 微生物群落分析
采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CATB)法对样本的基因组DNA进行提取,利用10 g/L琼脂糖凝胶电泳检测DNA的纯度和浓度。取适量样品于离心管中,使用无菌水稀释样品至质量浓度为1 ng/μL。使用正向引物341F(5′-CCTAYGGGRBGCASCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA的V3-V4区进行PCR扩增。PCR反应体系:Phusion Master Mix (2×),15 μL;341F(1 μmol/μL),1 μL;806R(1 μmol/μL),1 μL;gDNA(1 ng/μL),10 μL;H2O,2 μL。PCR反应程序:98 ℃预变性1 min;30个循环包括(98 ℃,10 s;50 ℃,30 s;72 ℃,30 s);72 ℃,5 min。根据PCR产物的浓度,等量混合样品后,用20 g/L的琼脂糖凝胶电泳进行PCR产物纯化。对目的条带进行纯化回收和文库构建,并通过Agilent 5400进行质量检测和Q-PCR定量分析。确认文库合格后,使用Illumina NovaSeq 6000进行测序。获得的原始序列reads经过过滤、拼接、嵌合体去除后,使用QIIME 2降噪生成扩增子序列变体(ASV)。使用SILVA数据库(v138.1,http://www.arb-silva.de/)进行物种注释分析。
1.3.4 总酸和pH的测定
取2 g样品,加入18 mL去离子水均质1 min,用pH计测量pH值。样品的总酸含量按照GB 12456—2021 《食品安全国家标准 食品中总酸的测定(含第1号修改单)》进行测定。称取25 g样品,加入50 mL无CO2的水,充分混合后将混合液煮沸30 min。待溶液冷却至室温后,用无CO2的水定容至250 mL,并收集滤液。每个样品的试液用0.1 mol/L NaOH溶液滴定至pH值为8.2,总酸含量按乳酸质量(g/kg)计。
1.3.5 有机酸和游离氨基酸的测定
取5 g样品,加入45 mL去离子水,置于75 ℃水浴锅中振荡30 min。混合物以10 000 r/min离心10 min,收集上清液,经0.22 μm滤膜过滤后,利用高效液相色谱进行分析。有机酸结果以mg/g表示。
取1 g样品,加入50 mL盐酸(0.01 mol/L)混合均匀,并在室温下静置30 min。随后,将样品摇匀并用滤纸过滤,取2 mL滤液于干净离心管中,加入2 mL 8%(质量分数)的磺基水杨酸混合均匀,并在室温下静置15 min。将试液在4 ℃、10 000 r/min下离心10 min,取上清液并用0.22 μm滤膜过滤后通过氨基酸自动分析仪进行测定。游离氨基酸结果以mg/100 g表示。
1.3.6 挥发性风味化合物的测定
参考蒙小玉等[9]的方法对挥发性风味化合物进行测定。称取0.2 g液氮研磨后的样品粉末于20 mL顶空瓶中,加入0.2 g NaCl和20 μL内标溶液(10 μg/mL的3-己酮),在60 ℃下充分振荡5 min。将120 μm DVB/CWR/PDMS萃取头插入样品顶空瓶,顶空萃取15 min,于250 ℃下解析5 min。使用配有DB-5MS色谱柱(30 m×0.25 mm×0.25 μm)的GC-MS进行分离鉴定。载气为He(纯度>99.999%),流速为1.2 mL/min。程序升温设置为:40 ℃保持3.5 min,以10 ℃/min升高至100 ℃,再以7 ℃/min升高至180 ℃,最后以25 ℃/min升高至280 ℃,保持5 min。质谱采用电子电离模式,电子能量为70 eV,离子源、四极杆、传输线温度分别设置为230、150、280 ℃,扫描方式为选择离子检测模式(SIM)。通过NIST质谱数据库比对进行定性分析,采用内标(3-己酮)半定量法进行定量分析。相对气味活度值(relative odor activity value,ROAV)用于阐明每种香气化合物对样品整体香气特征的贡献。参考HUANG等[10]的方法进行ROAV分析。
1.3.7 感官评价
感官评价实验经贵州大学人类医学实验伦理委员会批准(HMEE-GZU-2024-T031),10名经培训的评价员参与感官评价,并已征得其知情同意。2组不同发酵阶段的鱼椒酸样品以数字编码,随机发放,根据GB/T 29604—2013 《感官分析 建立感官特性参比样的一般导则》对样品的口感、香气、色泽和可接受性进行评价。每个评价指标采用五分制评分(1=非常不喜欢,2=不喜欢,3=中等可接受,4=喜欢,5=非常喜欢),总分计算为4个评价指标分数的平均值。
1.4 数据处理与分析
使用Excel和SPSS Statistics 27.0软件对数据进行整理和统计分析,以P<0.05判定数据的差异显著性。使用SIMCA 14.1软件进行主成分分析和正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)。使用Graphpad Prism 9和Origin 2021软件进行绘图。试验进行3次重复,结果表示为“平均值±标准差”。
2 结果与分析
2.1 细菌群落动态变化
食品发酵过程中微生物群落变化受营养物质消耗和微生物相互作用的影响[11]。对自然发酵组和接种发酵组鱼椒酸样品的细菌菌群进行测序分析,通过16S rRNA基因测序获得4 560 190条原始序列,经过拼接、过滤、去除嵌合体等步骤得到2 207 305条有效序列。序列长度在171~435 bp之间,平均序列长度为252.83 bp,Q20均高于99%,Q30均高于98%。不同发酵阶段的CK组和FE组样品在属、种水平上细菌群落结构的动态变化如图1所示。在属水平上,Weissella的相对丰度在2组中均呈下降趋势,Lactiplantibacillus的相对丰度呈现出上升趋势。发酵第12天,FE组中Weissella和Lactiplantibacillus的相对丰度略高于CK组。这表明乳酸菌强化发酵促进了Lactiplantibacillus和Weissella的优势,这与AN等[12]对泡菜的研究一致。在种水平上,L.plantarum和W.cibaria占主导地位。随着发酵进行,W.cibaria的相对丰度降低,L.plantarum的相对丰度增加,且其在接种发酵组中的优势生长抑制了野油菜黄单胞菌(Xanthomonas campestris)和菠萝泛菌(Pantoea ananatis)等病原菌的生长。Weissella具有产乳酸和醋酸的能力[13],在发酵初期可以快速降低pH,然而,Weissella耐酸性差,只能在较温和的pH下得到良好生长[14]。Lactiplantibacillus通常具有较强的耐酸能力,在较低的酸性环境中也能保持较好的活力,发展为优势菌群。Lactiplantibacillu和Weissella都能产生有机酸、细菌素和其他抑制病原菌生长的物质,确保产品安全[15]。
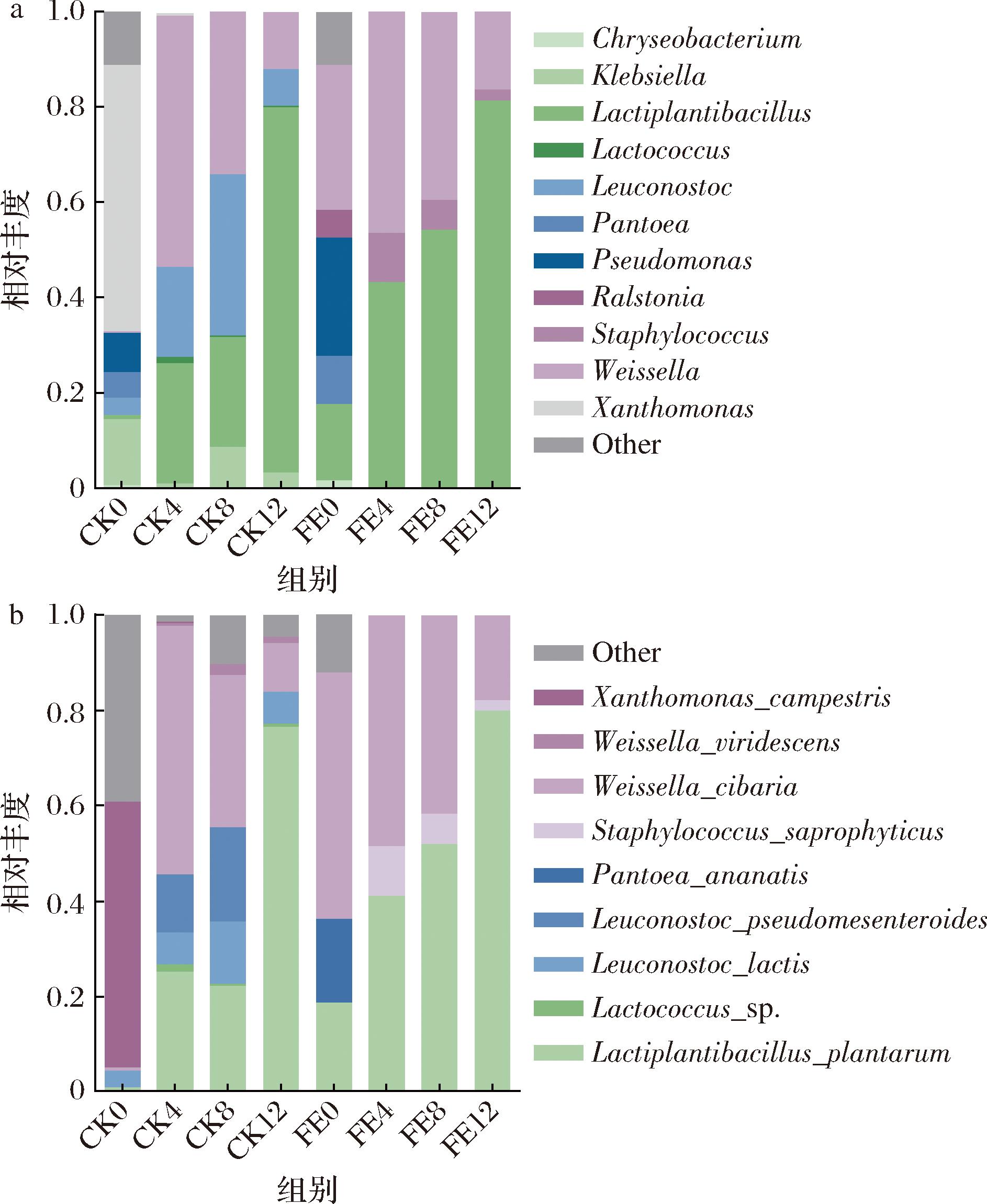
a-细菌属水平;b-细菌种水平
图1 CK组和FE组鱼椒酸发酵过程中细菌在属水平和种水平上相对丰度的动态变化
Fig.1 Dynamic changes in the relative abundance of bacteria at the genus and species levels during fermentation of YJS in the CK and FE groups
2.2 总酸和pH值的分析
鱼椒酸发酵过程中总酸和pH值的变化如图2所示。随着发酵进行,2组总酸(total acid,TA)含量均有所上升,pH值相应下降,区别在于发酵初期FE组的产酸速率显著高于CK组。发酵第4天,CK组的pH值为4.08±0.10,总酸含量为(2.35±0.13) g/kg,而FE组的pH值为3.85±0.06,总酸含量为(2.97±0.13) g/kg。发酵第12天,CK组和FE组的总酸含量分别为(4.99±0.13) g/kg和(4.82±0.12) g/kg。这是由于FE组中L.plantarum和W.cibaria的生长和代谢活动占据优势地位,因此产酸的速度也更快。到了发酵后期,由于O2的减少和营养物质的消耗,优势乳酸菌L.plantarum和W.cibaria的生长逐渐变慢,产酸速率逐渐变缓。与单独接种Y279发酵的鱼椒酸相比,混合接种Y279和Y113发酵的样品具有更高的总酸含量[16]。这表明混菌发酵时,有机酸的产生可能受到菌株协同作用或代谢途径差异表达的影响。
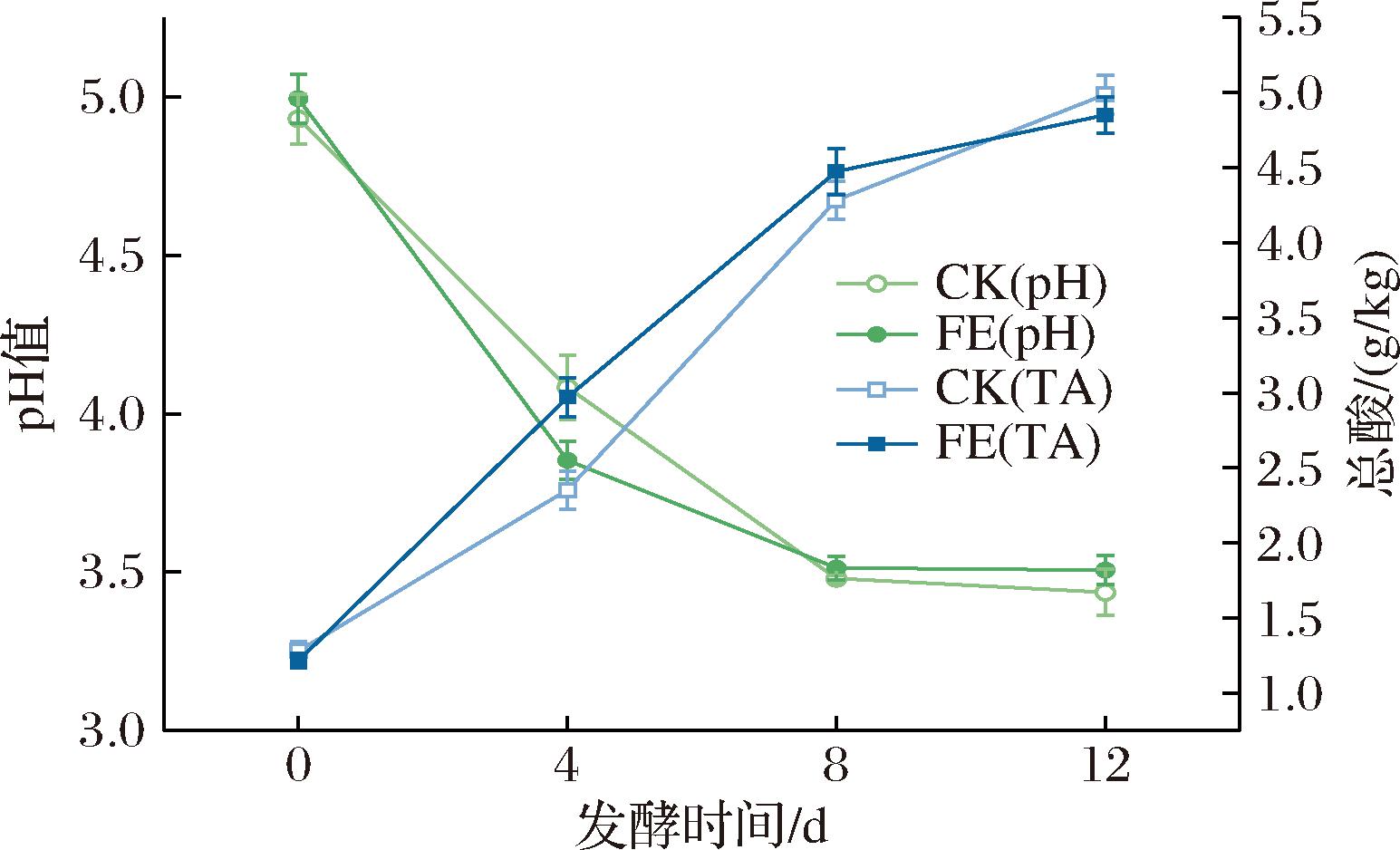
图2 CK组和FE组鱼椒酸发酵过程中总酸含量和pH值的动态变化
Fig.2 Dynamic changes in total acid content and pH value during fermentation of YJS in the CK and FE groups
2.3 有机酸的分析
有机酸是发酵食品中的微生物经过代谢活动产生的重要成分之一,不仅可以抑制有害微生物,还可以大大增强发酵食品中的酸味[17]。此外,有机酸可以与乙醇结合形成酯,从而增强食品风味[18]。在所有样品中共检测到8种有机酸,如图3所示,CK组和FE组总有机酸含量均呈上升趋势,与总酸含量的变化趋势一致。在发酵第4、8、12天,FE组的总有机酸含量分别比CK组高了0.46、0.86、0.97 mg/mL。在整个发酵过程中,乳酸和乙酸的含量较高,是主要的有机酸。CK12中乳酸、乙酸含量分别是CK0的1.23、9.46倍,而FE12中乳酸、乙酸含量分别是FE0的1.47、20.76倍。此外,苹果酸和柠檬酸的含量均在CK8和FE12时达到峰值。丁酸在CK8时降至0,而在FE组中持续存在。根据每种有机酸的味觉阈值[19],乙酸和琥珀酸的味觉活性值(taste activity value,TAV)> 1,被鉴定为味觉活性物质,对鱼椒酸的酸味具有重要贡献。FE组中乳酸在发酵后期的TAV值接近1,这可能是由于乳酸的阈值较高。由此可见,乳酸菌强化发酵过程中积累了更多的有机酸,导致了总酸含量的升高和pH值的降低,这不仅增强了鱼椒酸的酸味,还有利于鱼椒酸的保存。
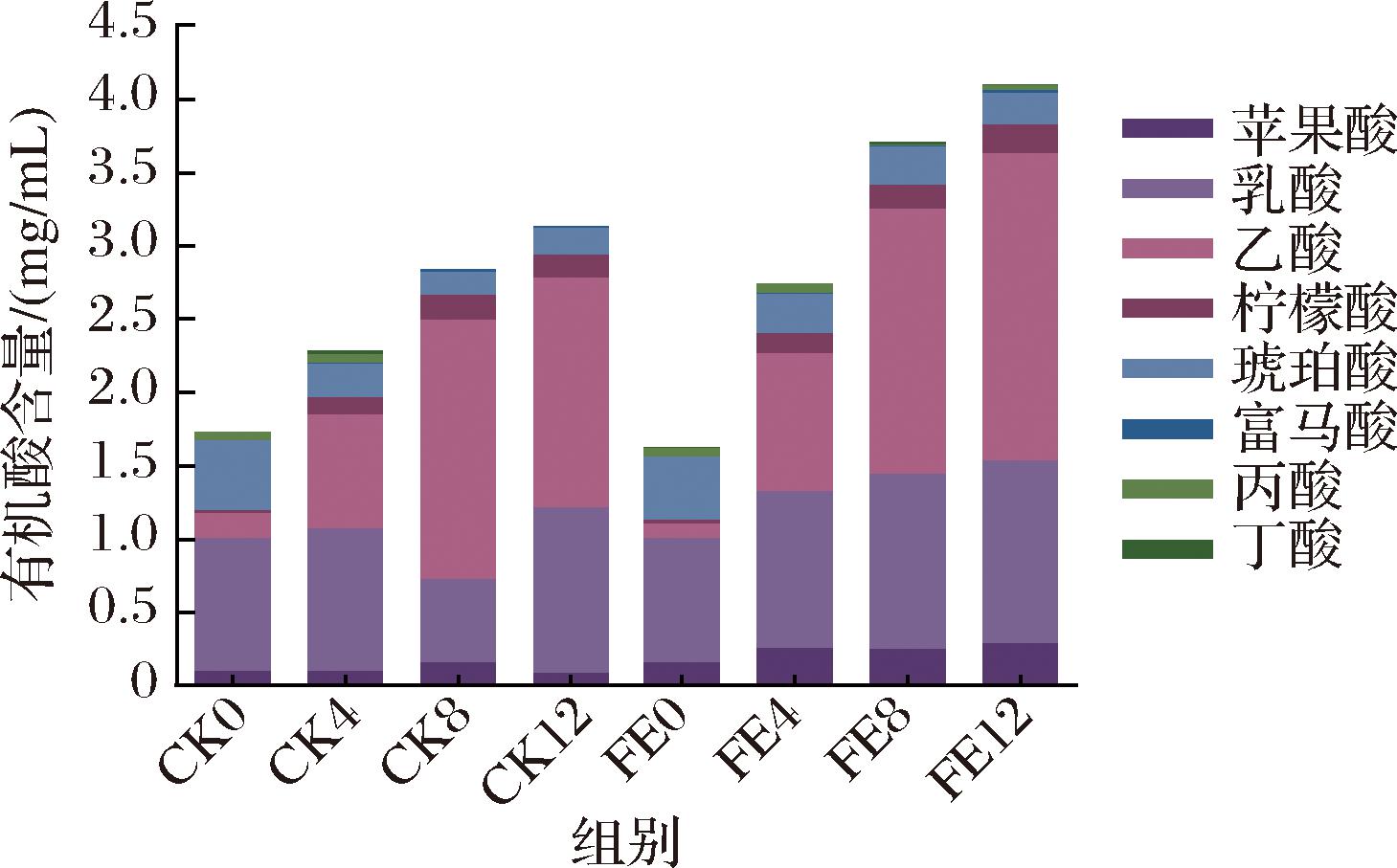
图3 CK组和FE组鱼椒酸发酵过程中8种有机酸含量的动态变化
Fig.3 Dynamic changes in the content of 8 organic acids during fermentation of YJS in the CK and FE groups
2.4 游离氨基酸的分析
氨基酸是构成蛋白质的基本单位,也是形成芳香化合物的重要前体,对发酵食品的风味形成起着重要作用[20]。氨基酸的形成与发酵环境中的微生物密切相关[21]。在所有样品中共检测出17种游离氨基酸,如图4所示,CK组中总游离氨基酸含量呈现上升趋势,而FE组总游离氨基酸含量在第8天达到峰值,而后下降,但仍比CK12时的含量高。FE8和FE12中总游离氨基酸含量分别为(684.84±33.60) mg/100 g和(654.41±19.80) mg/100 g,分别比CK8和CK12高141.12 mg/100 g和45.79 mg/100 g。在整个发酵过程中,谷氨酸的含量较高,是主要的游离氨基酸。发酵第12天,FE组中谷氨酸、天冬氨酸、甘氨酸等游离氨基酸的含量均高于CK组,这可能与接种发酵过程中酶活性增加、原料分解和氨基酸代谢过程增强等因素有关。与接种本土琥珀葡萄球菌发酵的辣椒相比[22],接种乳酸菌发酵的鱼椒酸表现出更高的游离氨基酸含量。此外,发酵第8天,FE组中鲜味氨基酸、苦味氨基酸和甜味氨基酸的含量分别比CK组高43.82、59.32 mg/100 g和37.98 mg/100 g。根据每种游离氨基酸的味觉阈值[23],天冬氨酸和谷氨酸的TAV>1,被鉴定为味觉活性物质,对鱼椒酸的鲜味具有重要贡献。由此可见,乳酸菌强化发酵过程中积累了更多的游离氨基酸,有助于增强鱼椒酸的鲜味。
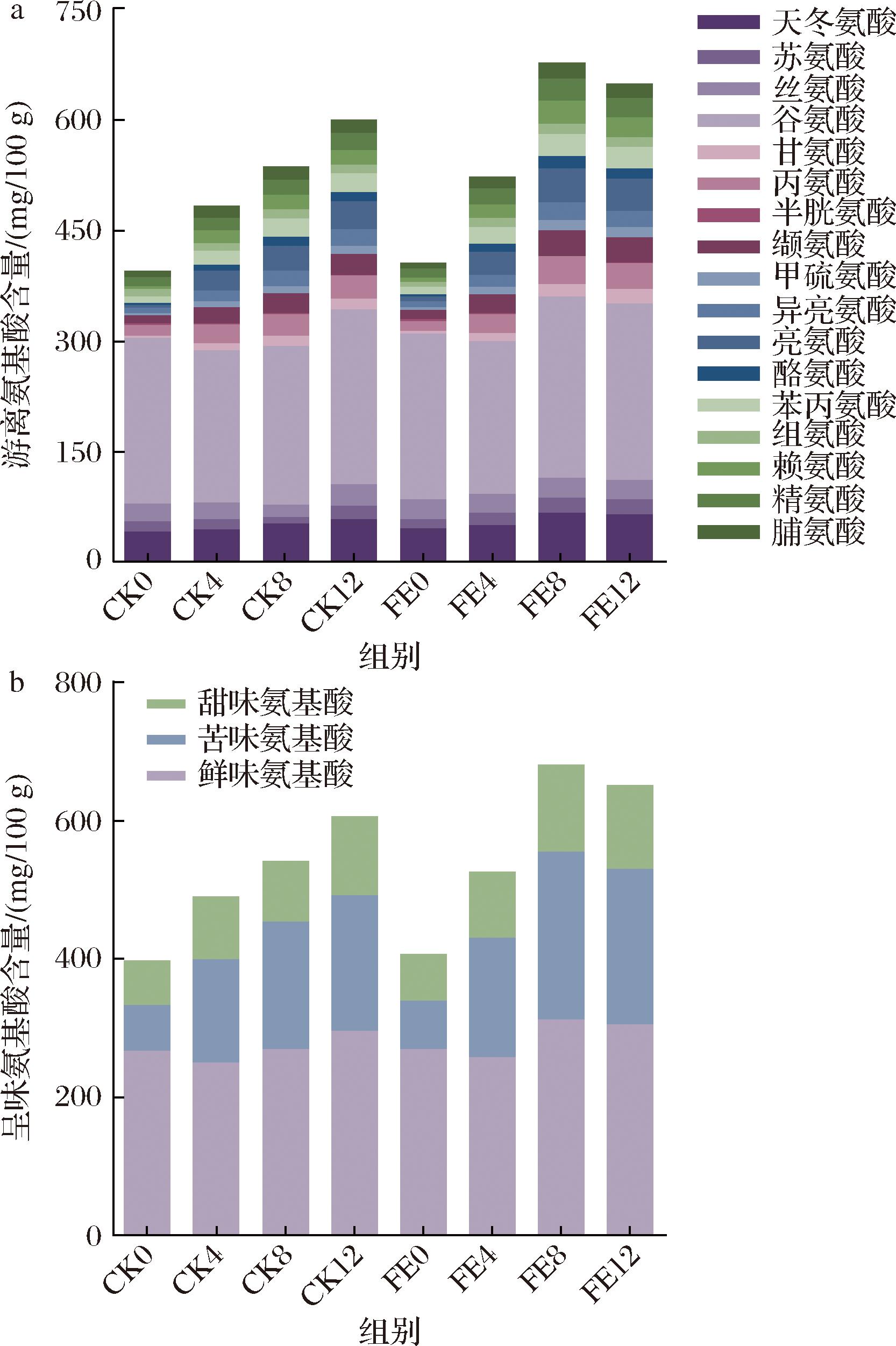
a-游离氨基酸;b-呈味氨基酸
图4 CK组和FE组鱼椒酸发酵过程中17种游离氨基酸含量的动态变化
Fig.4 Dynamic changes in the content of 17 free amino acids during fermentation of YJS in the CK and FE groups
2.5 挥发性风味化合物的分析
2.5.1 挥发性风味化合物的整体概况
挥发性风味化合物是发酵食品特色风味形成的关键。采用顶空固相微萃取结合气相色谱质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术分析了CK组和FE组处于不同发酵阶段的挥发性风味化合物。如图5-a所示,从8个样品中共检测出645种挥发性物质,包括烃类118种、杂环化合物106种、酯类73种、酮类60种、醇类55种、萜类49种、芳烃类46种、醛类40种、胺类30种、酸类22种、卤代烃12种、酚类10种、含硫化合物9种、含氮化合物7种、其他7种、醚类1种。主成分分析图如图5-b所示,第1主成分解释了方差的47.8%,第2主成分解释了17.9%,由图可知,与CK组相比,FE组中FE4、FE8、FE12的样品之间间距更短。这表明接种乳酸菌强化发酵的鱼椒酸样品间挥发性风味化合物差异小,更稳定。
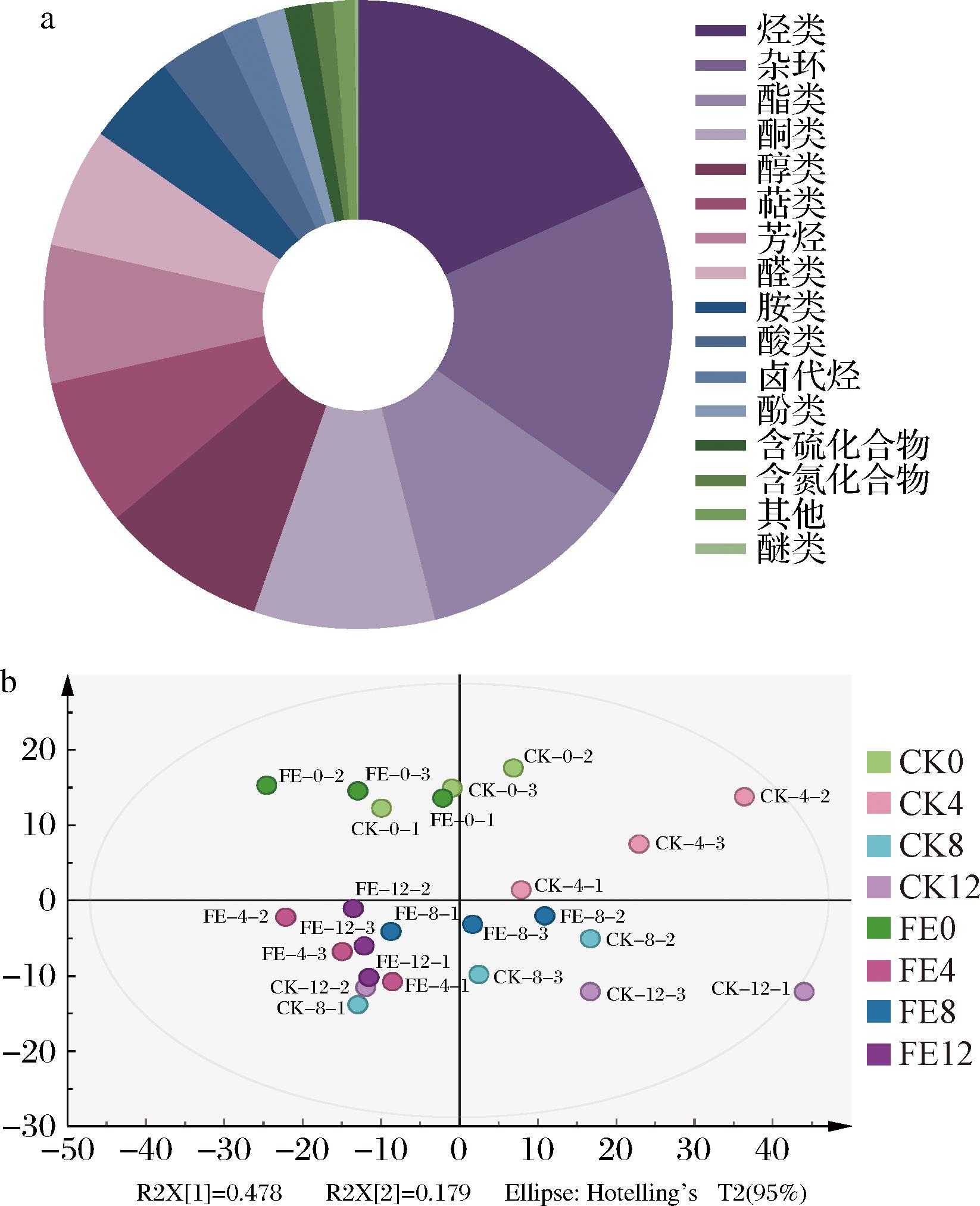
a-挥发性风味化合物种类占比;b-挥发性风味化合物主成分分析
图5 CK组和FE组鱼椒酸发酵过程中挥发性风味化合物分析
Fig.5 Analysis of volatile flavor compounds during fermentation of YJS in the CK and FE groups
鱼椒酸发酵过程中,萜类物质虽然仅占7.6%,但其相对含量最高。部分阈值较低的萜类物质能增强鱼椒酸的风味,如芳樟醇具有花香和青草香气,香叶醇具有玫瑰香和柑橘香。具有草药味的对薄荷三烯在FE12的相对含量高于CK12。烃类物质的阈值较高,对样品气味产生的影响较小,通常会产生淡淡的甜味。醛类、酮类、醇类主要来自不饱和脂肪酸的氧化降解[24]。2,4-辛二烯醛是最主要的醛类物质,具有甜瓜的香味。正辛醛具有柠檬和柑橘香气,2-甲基四氢呋喃-3-酮具有黄油和坚果香味,它们在FE12的相对含量均高于CK12。醇类与酸类可以发生酯化反应形成具有水果香味的酯类物质,增强了鱼椒酸的整体可接受性和特征风味。具有水果香味的乙酸丁酯和具有焦糖香味的葫芦巴内酯在FE12相对含量均高于CK12。与普通的发酵辣椒末相比[25],鱼椒酸含有更多含量和种类的挥发性风味化合物,这是由于原材料的差异和发酵剂的使用,使鱼椒酸形成更丰富的风味。
2.5.2 关键风味化合物的筛选和分析
筛选关键风味化合物有助于评估这些物质对鱼椒酸风味形成的贡献。对CK组和FE组处于不同发酵阶段的挥发性风味化合物进行OPLS-DA,并计算各化合物的投影中变量重要性(VIP)。ROAV定义为单个挥发性化合物的相对浓度与其在水中阈值的比值。通常,ROAV>1的化合物被视为活性风味化合物。以P<0.05、|Log2FC|(|Log2Fold change|)>1、VIP>1、ROAV>1为条件从各发酵阶段FE组中筛选出14种差异表达的关键风味化合物,如表1所示,包括5种萜类、3种酮类、2种醇类、2种醛类、1种杂环化合物和1种其他类。β-蒎烯和对薄荷三烯的VIP值较高,具有木质、松香的味道;β-罗勒烯和香叶醇提供花香和果香。乙酸酐具有刺激性酸味,可以与乙醇生成具有果香味的乙酸乙酯。苯乙醛和2,4-辛二醛提供丰富的果香。2-甲基四氢呋喃-3-酮具有低阈值,并提供黄油香气。综上所述,接种乳酸菌强化发酵影响了多种挥发性风味化合物的生成,从而影响酸味、松香、花香、果香等风味的形成。
表1 不同发酵阶段下接种发酵组的关键风味化合物
Table 1 Key flavor compounds in the inoculated fermentation groups at different fermentation stages

挥发性物质分类阈值/(μg/g)气味描述FE4 vs CK4PLog2FCVIPROAV乙酸酐其他0.6刺激、醋酸味<0.0123.381.294.08萜品油烯萜类0.2柑橘、松树<0.05-1.041.098.02β-罗勒烯萜类0.034苹果、梨<0.05-2.002.1263.79β-蒎烯萜类0.14木质、松香<0.05-1.375.45191.18香叶醇萜类0.006 6花香、果香<0.05-1.382.03562.83对薄荷三烯萜类0.015草本、木质<0.05-1.444.881 330.23正癸醇醇类0.023花香、橙<0.05-1.911.0726.12苯乙醛醛类0.006 3花香、蜂蜜<0.05-1.432.34738.012,4-辛二烯醛醛类0.14梨、甜瓜<0.05-1.153.2789.983-甲基环己酮酮类0.46薄荷、樟脑<0.05-1.401.001.912-甲基四氢呋喃-3-酮酮类0.000 005黄油、坚果<0.01-1.801.29190 740.91苯并呋喃杂环0.048芳香<0.05-1.371.0721.47挥发性物质分类阈值/(μg/g)气味描述FE8 vs CK8PLog2FCVIPROAV乙酸酐其他0.6刺激、醋酸味<0.0123.702.604.681-庚烯-3-醇醇类0.01油性、辛辣<0.01-1.021.56100.112,2,6-三甲基环己酮酮类0.000 1辛辣、蜂蜜<0.011.231.5718 246.28挥发性物质分类阈值/(μg/g)气味描述FE12 vs CK12PLog2FCVIPROAV乙酸酐其他0.6刺激、醋酸味<0.0124.192.097.58对薄荷三烯萜类0.015草本、木质<0.0126.775.171 835.71
2.6 优势细菌与特征风味物质的相关性分析
对优势细菌(L.plantarum和W.cibaria)和特征风味物质(乳酸、乙酸、琥珀酸、谷氨酸、天冬氨酸及14种关键风味化合物)之间进行Spearman相关性分析(以P<0.05、r>|0.6|为显著相关),有助于了解优势细菌在鱼椒酸的特色风味形成中的作用。如图6所示,L.plantarum与乳酸、乙酸、天冬氨酸呈现显著正相关,与琥珀酸、1-庚烯-3-醇呈现显著负相关;W.cibaria仅与2-甲基四氢呋喃-3-酮呈现显著正相关,与1-庚烯-3-醇呈现显著负相关。由此可知,优势细菌的生长变化可能会对部分风味物质的生成和积累产生显著影响,并且L.plantarum影响非挥发性风味物质,而W.cibaria影响挥发性风味物质。综上所述,接种乳酸菌强化发酵鱼椒酸可以影响发酵过程中酸味、鲜味、黄油香气的产生。

图6 优势细菌与特征风味物质间的相关性热图
Fig.6 Heatmap of the correlation between dominant bacteria and characteristic flavor substances
注:**表示P<0.01,***表示P<0.001。
2.7 感官评价分析
为探究不同发酵方式对鱼椒酸感官品质的影响,对自然发酵组(CK)和乳酸菌发酵组(FE)样品进行了感官评价分析,结果如图7所示。在总分指标下,乳酸菌发酵组的样品得分高于自然发酵组,表现出接种乳酸菌强化发酵的鱼椒酸得到更高的感官评分。对于颜色方面,评价分数随着发酵时间的增加而逐渐下降,这可能是由于色素变化或氧化导致光泽度降低。在口感方面,乳酸菌发酵组样品在发酵后期得分相对较高,这可能与有机酸和氨基酸的积累有关。在香气方面,发酵时间长的样品得分更高,可能是由于发酵后期多种挥发性风味物质的积累。在可接受性上,FE8组样品的得分略高于FE12组。总体而言,乳酸菌发酵组样品在大多数指标上的得分优于自然发酵组样品,在味道和香气方面略有优势,表明接种乳酸菌发酵不仅可以提高鱼椒酸的质量,而且可以提高其市场接受度。
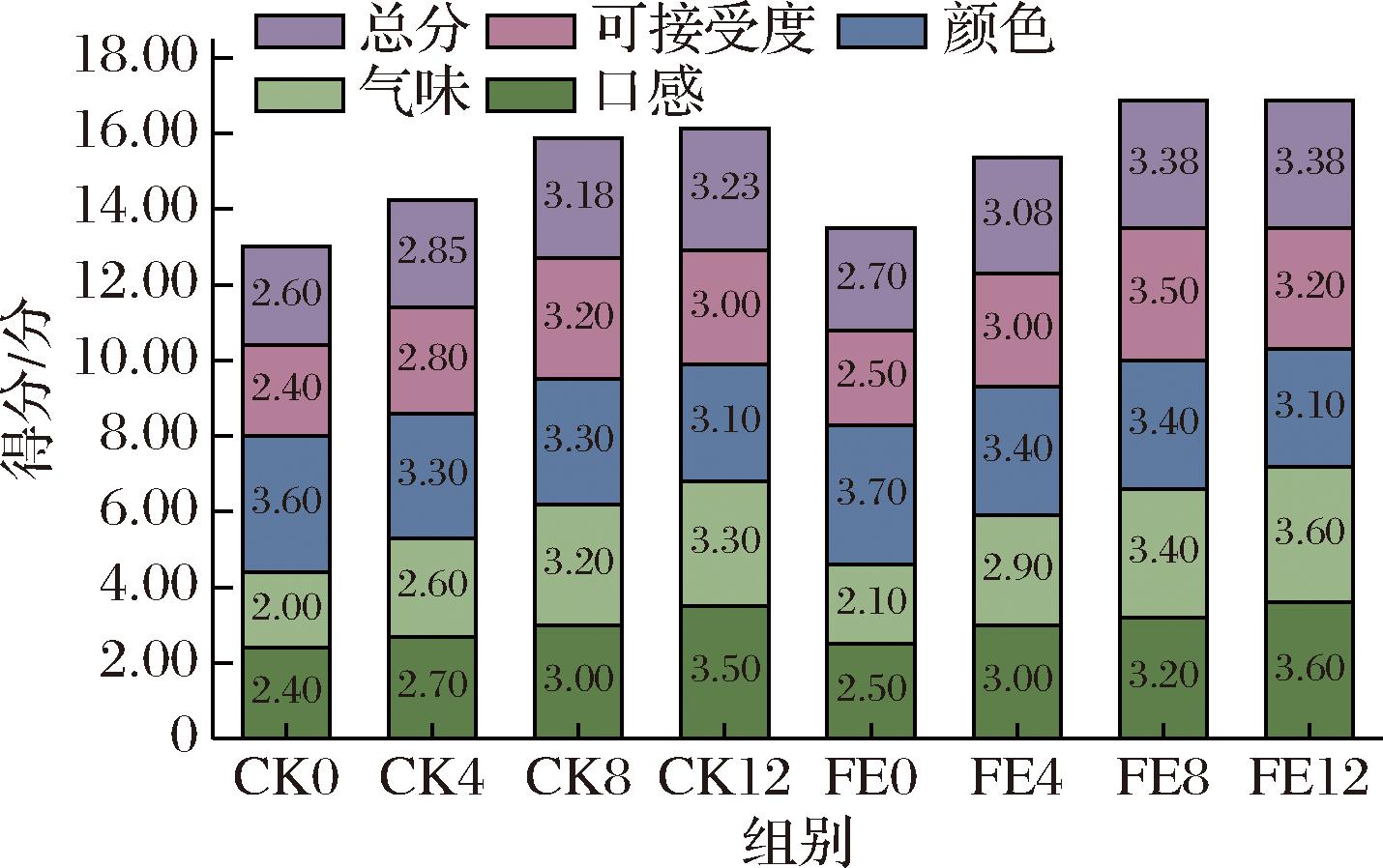
图7 CK组和FE组鱼椒酸样品的感官评价得分
Fig.7 Sensory evaluation scores of YJS samples in the CK and FE groups
3 结论
本研究利用2株乳酸菌(L.plantarum Y279和W.cibaria Y113)对鱼椒酸进行混合强化发酵,分析自然发酵组和接种发酵组样品在不同发酵阶段中细菌群落、理化指标、有机酸、游离氨基酸、挥发性风味化合物的动态变化,对优势细菌和特征风味物质进行相关性分析,并对2组样品进行感官评价。结果表明,乳酸菌(L.plantarum Y279和W.cibaria Y113)可以用作高品质鱼椒酸工业化生产的发酵剂。具体来说,接种乳酸菌强化发酵可提升L.plantarum和W.cibaria的优势地位。优势细菌在生长和代谢过程中能够产生和积累更多的有机酸和游离氨基酸,提高乙酸、琥珀酸、乳酸、谷氨酸、天冬氨酸等非挥发性风味物质的含量,进而增强鱼椒酸的酸味和鲜味。同时,接种乳酸菌强化发酵可显著影响乙酸酐、对薄荷三烯等挥发性风味物质的生成,进而影响鱼椒酸的酸味、松香风味。此外,接种发酵使鱼椒酸具有更好的感官性状。研究为高品质鱼椒酸的工业化生产提供了技术支撑和理论依据。
[1] JIANG L, LIU L, CHEN H Y, et al.Effects of autochthonous starter cultures on bacterial communities and metabolites during fermentation of Yu Jiangsuan, a Chinese traditional fermented condiment[J].LWT, 2022, 168:113874.
[2] ZENG X F, XIA W S, YANG F, et al.Changes of biogenic amines in Chinese low-salt fermented fish pieces (Suan Yu) inoculated with mixed starter cultures[J].International Journal of Food Science &Technology, 2013, 48(4):685-692.
[3] PEREZ R H, ZENDO T, SONOMOTO K.Multiple bacteriocin production in lactic acid bacteria[J].Journal of Bioscience and Bioengineering, 2022, 134(4):277-287.
[4] ZHANG K, ZHANG T T, GUO R R, et al.The regulation of key flavor of traditional fermented food by microbial metabolism:A review[J].Food Chemistry:X, 2023, 19:100871.
[5] GALLI V, VENTURI M, PINI N, et al.Influence of pepper and blueberry purees fermented by an autochthonous microbial consortium on the aroma and technological properties of bread[J].Food and Bioprocess Technology, 2025, 18(5):4410-4424.
[6] ZHAO Y J, ZHAO Z J, GAO Y S, et al.Assessment of autochthonous lactic acid bacteria as starter culture for improving traditional Chinese Dongbei Suancai fermentation[J].LWT, 2023, 178:114615.
[7] 张嘉璇, 张萃异, 刘辉, 等.本土乳酸菌苹果酸-乳酸发酵对“户太十一号” 葡萄酒品质的影响[J].中国酿造, 2024, 43(9):29-37.ZHANG J X, ZHANG C Y, LIU H, et al.Effect of malic-lactic fermentation by indigenous lactic acid bacteria on the quality of ‘Hu Tai No.11’ wine[J].China Brewing, 2024, 43(9):29-37.
[8] 刘璐, 吴江丽, 杨金桃, 等.发酵鱼酱酸产GABA乳酸菌的分离筛选及发酵特性[J].食品科学, 2021, 42(18):73-79.LIU L, WU J L, YANG J T, et al.Isolation and fermentation characteristics of γ-aminobutyric acid-producing lactic acid bacteria from Yujiangsuan, a traditional Miao ethnic fermented condiment[J].Food Science, 2021, 42(18):73-79.
[9] 蒙小玉, 冯建文, 黄欣艳, 等.“糖心” 苹果香气物质生物合成的转录代谢联合分析[J].核农学报, 2025, 39(4):696-706.MENG X Y, FENG J W, HUANG X Y, et al.Combined transcriptional and metabolic analysis of aroma substances in watercore apples[J].Journal of Nuclear Agricultural Sciences, 2025, 39(4):696-706.
[10] HUANG W J, FANG S M, WANG J, et al.Sensomics analysis of the effect of the withering method on the aroma components of Keemun black tea[J].Food Chemistry, 2022, 395:133549.
[11] CHEN L Q, WANG G Z, TENG M J, et al.Non-gene-editing microbiome engineering of spontaneous food fermentation microbiota:Limitation control, design control, and integration[J].Comprehensive Reviews in Food Science and Food Safety, 2023, 22(3):1902-1932.
[12] AN F Y, SUN H J, WU J R, et al.Investigating the core microbiota and its influencing factors in traditional Chinese pickles[J].Food Research International, 2021, 147:110543.
[13] WANG C, CUI Y H, QU X J.Mechanisms and improvement of acid resistance in lactic acid bacteria[J].Archives of Microbiology, 2018, 200(2):195-201.
[14] LUO F P, YANG Z Y, ZHONG K, et al.Effects of Bacillus megaterium L222 on quality and bacterial diversity of Sichuan Paocai[J].Food Research International, 2021, 140:109994.
[15] ZHONG Y X, ZOU Y K, ZHENG Z M, et al.Impact of inoculating with indigenous Bacillus marcorestinctum YC-1 on quality and microbial communities of Yibin yacai (fermented mustard) during the fermentation process[J].Foods, 2022, 11(22):3593.
[16] HUI F Y, HU W K, YU S, et al.Effect of inoculating Lactiplantibacillus plantarum Y279 on bacterial community structure and quality of fermented Yujiaosuan[J].LWT, 2024, 206:116602.
[17] YE X T, YU Y J, LIU J X, et al.Inoculation strategies affect the physicochemical properties and flavor of Zhenjiang aromatic vinegar[J].Frontiers in Microbiology, 2023, 14:1126238.
[18] ZHAO Y J, WU Z Y, MIYAO S, et al.Unraveling the flavor profile and microbial roles during industrial Sichuan radish Paocai fermentation by molecular sensory science and metatranscriptomics[J].Food Bioscience, 2022, 48:101815.
[19] XIONG S J, XU X Y, ZHANG L L, et al.Integrated metatranscriptomics and metabolomics reveal microbial succession and flavor formation mechanisms during the spontaneous fermentation of Laotan Suancai[J].Food Research International, 2024, 177:113865.
[20] YIN M Y, MATSUOKA R, YANAGISAWA T, et al.Effect of different drying methods on free amino acid and flavor nucleotides of scallop (Patinopecten yessoensis) adductor muscle[J].Food Chemistry, 2022, 396:133620.
[21] LIANG Z C, SU H, LIN X Z, et al.Microbial communities and amino acids during the fermentation of Wuyi Hong Qu Huangjiu[J].LWT, 2020, 130:109743.
[22] LI Y M, LUO X Q, GUO H, et al.Metabolomics and metatranscriptomics reveal the influence mechanism of endogenous microbe (Staphylococcus succinus) inoculation on the flavor of fermented chili pepper[J].International Journal of Food Microbiology, 2023, 406:110371.
[23] LIU M, DENG N, HOU X Y, et al.Characterisation of flavour profiles and microbial communities of fermented peppers with different fermentation years by combining flavouromics and metagenomics[J].Food Chemistry, 2024, 443:138550.
[24] XIA L Y, QIAN M, CHENG F, et al.The effect of lactic acid bacteria on lipid metabolism and flavor of fermented sausages[J].Food Bioscience, 2023, 56:103172.
[25] MA D, LI Y, CHEN C C, et al.Microbial succession and its correlation with the dynamics of volatile compounds involved in fermented minced peppers[J].Frontiers in Nutrition, 2022, 9:1041608.