近年来,各大香型白酒中乳酸偏高的现象均有出现[1-2],作为乳酸乙酯的前提物质,主要表现为乳酸乙酯含量偏高。乳酸及其衍生物是白酒中重要的风味物质,对酒体的呈香呈味具有不可替代的作用[3]。它是白酒中重要的非挥发性有机酸,为白酒提供醇厚的口感[4]。发酵体系中乳酸的失衡,如乳酸含量偏低会导致白酒口感寡淡,偏高会抑制酒醅中功能菌群的生长[5],影响白酒的生产[6]。酿造过程中,乳酸菌是乳酸的主要生产菌群,也是白酒酿造中的主要菌群[7],在发酵过程中乳酸脱氢酶将丙酮酸转换为左旋乳酸[8]。乳酸菌可以利用葡萄糖、木糖等单糖,或乳糖、蔗糖等双糖通过糖酵解途径生成丙酮酸,丙酮酸在乳酸脱氢酶的催化下生成乳酸和乙酸[9]。酒中某些乳酸菌如植物乳杆菌具有一定的耐酸性,乙醇耐受性[10],大约90%的乳酸菌菌株能够产生α-淀粉酶,但淀粉酶产率较低,α-淀粉酶产量最高的菌株为短乳杆菌,60%以上的乳酸菌菌株能够产生酯酶[11]。基于乳酸菌的这些特性,并随着入窖后环境条件变得适宜,从有氧变为无氧,乳酸菌逐渐占据主要地位[12],最终导致了酒醅中微生物菌群多样性下降[13]。乳酸菌在发酵整个过程中都占据一定优势地位,因而会产生大量乳酸。但乳酸含量过高,则会破坏微生物细胞内外质子平衡,破坏细胞膜,从而损伤细胞[14],进而影响酵母的生长与产酒,因此控制乳酸含量非常重要。为了研究实际生产中乳酸含量与发酵中乳酸菌的关系,本研究采用了宏基因组学。相较高通量测序只能确定微生物到属水平,宏基因组学可以确定乳酸菌具体的菌种,并提供更多功能方面的信息[15]。
为了控制白酒中乳酸的含量,本研究对已有控制手段做了研究。在微生物控制乳酸方面的已有研究主要为提高微生物乳酸耐受性[5]和耐酸菌的筛选[6]等方面。而这些手段治标不治本,本研究提出干预乳酸菌群的演替,使低产乳酸的乳酸菌代替高产乳酸的乳酸菌可能是一个有效的乳酸含量控制手段。
为了干预菌群演替,抑制高产乳酸菌在初始的增长,本研究采用乳酸乳球菌所产的乳酸链球菌素(nisin)作为抑制剂。乳酸乳球菌与乳酸菌一样可以产生乳酸,具有相似的生态位[16]。乳酸链球菌素是被食品药品监督管理局(Food and Drug Administration, FDA)/世界卫生组织(World Health Organization, WHO)允许作为食品添加剂有抑菌活性的多肽[16],具有无臭、无色、无味、低毒的特点,因此被广泛应用于乳制品等食品产业中[17]。其主要缺点是酶促降解快,对细胞膜的渗透性有限[18],因此符合白酒中对乳酸菌抑制但又需要乳酸提供口感的需求。不仅如此,乳酸链球菌素在pH<4的情况下还具有良好的稳定性[19],适用于白酒生产时酒醅的环境。针对白酒中乳酸含量升高的现象,本研究采用宏基因组测序解析堆积和发酵时期乳酸菌群的变化情况,并使用乳酸链球菌素抑制高产乳酸的乳酸菌,通过干扰乳酸菌菌群演替,以低产乳酸乳酸菌代替高产乳酸乳酸菌来控制乳酸含量,为调控白酒生产过程中降酸提供了理论指导。
1 材料与方法
1.1 试剂与仪器
红缨子高粱,产自贵州;MRS培养基,Oxoid公司;乳酸(分析纯)、氯化钠、酵母膏、蛋白胨、琼脂粉、葡萄糖,国药集团化学试剂有限公司;乳酸链球菌素1,上海阿拉丁生化科技股份有限公司;乳酸链球菌素2,洛阳奇泓生物科技有限公司;FastDNA® Spin Kit for Soil试剂盒,Mpbio公司。
Avanti J-E冷冻离心机,Beckman Coulter公司;固相微萃取头50/30 μm DVB/CAR/PDMS,美国Supelco公司;超声波清洗仪,宁波新芝生物科技股份有限公司;Milli-Q超纯水机,美国Millipore公司;电子分析天平,Mettler Toledo公司;Agilent 1200高效液相色谱仪,Agilent公司;酶标仪,BioTek公司;Transwell,康宁公司。
1.2 样品采集、核酸提取、测序及生物信息分析
本研究所使用样品均采集于贵州某酱香型酒厂,样品总DNA的提取使用FastDNA® Spin Kit for Soil试剂盒,方法参照说明书。
对测序得到的原始数据(raw data)进行质控及宿主过滤,得到有效数据(clean data);从各样品质控后的clean data出发,进行metagenome组装;从组装后的scaftigs出发,采用prodigal进行基因预测,进行去冗余;综合各样品的clean data,可获得基因在各样品中的丰度信息。
1.3 乳酸多样性对乳酸产量的作用
高粱汁液态培养基:破碎后的高粱为原料,高粱与水1∶4(质量比)浸泡过夜,按200 U/g原料加淀粉酶,搅拌均匀,高温灭菌锅105 ℃,1 h。灭菌后的高粱汁继续蒸煮,再次加入等量淀粉酶和1倍体积去离子水,蒸煮到糖度为10 °Bx,冷却到60 ℃,加200 U/g原料加糖化酶,60 ℃糖化4 h后过滤,8 000×g离心10 min取上清液,即得到高粱汁液态培养基。
本研究用实验室已有菌株,耐酸乳杆菌、戊糖片球菌、食果糖乳杆菌、发酵乳杆菌、植物乳杆菌培养至对数生长期(1×108 CFU/mL),根据控制接种量接种于高粱汁液态培养基中,来模拟乳酸多样性。具体接种见表1。接种后37 ℃培养48 h,-20 ℃保存发酵液,用作测乳酸含量样品。乳酸依据T/CBJ 004—2018《固态发酵酒醅通用分析方法》测定。
表1 乳酸菌接种量 单位:μL
Table 1 Inoculation level of lactic acid bacteria

组别植物乳杆菌发酵乳杆菌戊糖片球菌耐酸乳杆菌食果糖乳杆菌A71471717171B71714717171C71717147171D71717171471E71717171714F200200200200200G//333333333植物乳杆菌1 000////发酵乳杆菌/1 000///戊糖片球菌//1 000//耐酸乳杆菌///1 000/食果糖乳杆菌////1 000
1.4 发酵乳杆菌与高产乳酸的乳酸菌的共培养
保持接种量50 μL不变,改变发酵乳杆菌的接种比例为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,分别与高产乳酸的戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌在Transwell中共培养,发酵乳杆菌接种于上室,高产乳酸的乳酸菌接种于下室。
1.5 乳酸链球菌素对乳酸菌的作用
采用改良琼脂扩散法[20],测定乳酸链球菌素对乳酸菌的作用。具体方法为,固体MRS培养基冷却至60 ℃后,接种1%培养至对数生长期的乳酸菌倒板;固体培养基凝固后使用黄枪头打孔,每孔分别注射50 μL蒸馏水,1 mg/mL乳酸链球菌素1,1 mg/mL乳酸链球菌素2,1 mg/mL氯霉素,37 ℃培养24 h后观察抑菌圈。
1.6 生长曲线的测量
将3株乳酸菌分别接种于MRS培养基,0.1 mg/mL乳酸链球菌素2 MRS培养基,0.1 mg/mL氯霉素MRS培养基中,每隔4 h取样1次,并于600 nm处测其OD值。
1.7 乳酸链球菌素对酿造功能菌的作用
采用琼脂扩散法,测定乳酸链球菌素对乳酸菌的作用。固体LB培养基冷却至60 ℃后,接种1%培养至对数生长期的芽孢杆菌倒板,固体YPD培养基冷却至60 ℃后,接种1%培养至对数生长期的酿酒酵母倒板;固体培养基凝固后使用黄枪头打孔,每孔分别注射50 μL蒸馏水,1 mg/mL乳酸链球菌素1,1 mg/mL乳酸链球菌素2,1 mg/mL氯霉素,芽孢杆菌37 ℃培养24 h后观察抑菌圈,酿酒酵母30 ℃培养24 h后观察抑菌圈。
1.8 统计学分析及绘图
使用Microsoft Office Excel 2016(Microsoft, Redmond, WA)、Origin 2023(OriginLab, Northampton, MA)进行图表绘制及统计学分析。
2 结果与分析
2.1 发酵过程中乳酸的积累变化
本研究跟踪了发酵过程中2个班组乳酸的变化规律,如图1所示,2号班组乳酸本轮发酵在初始阶段就高于1号班组,因为乳酸是非挥发有机酸,可能来自于上一轮次发酵的乳酸积累。1号班组乳酸的积累整体滞后于2号班组,可能与2个班组不同的菌群结构有关。进入窖内发酵后,乳酸菌在无氧环境中产乳酸,2个班组乳酸菌呈指数增加,2号班组增幅大于1号班组。发酵后期推测酒醅环境中的菌株受到酸胁迫等原因[21],乳酸含量增速降缓。
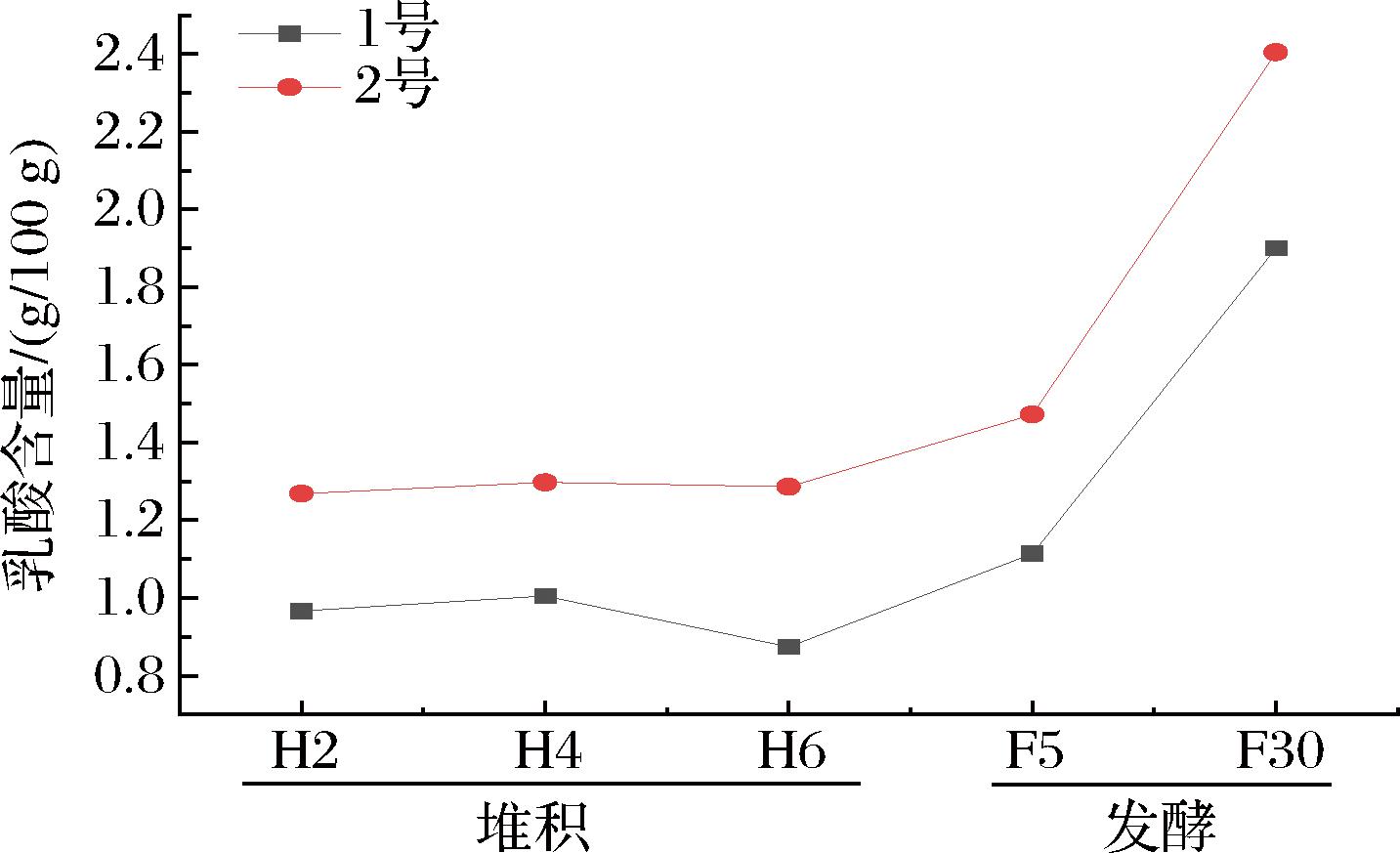
图1 1号班组与2号班组堆积发酵过程中乳酸变化
Fig.1 Changes of lactic acid during accumulation fermentation of group 1 and group 2
2.2 酒醅中优势产乳酸菌群的影响及验证
本研究对产乳酸能力不同的2个班组做了比较研究。如图2所示。1号班组与2号班在属水平上菌群相对丰度差异不明显,堆积阶段芽孢杆菌属(Bacillus)占优势,相对丰度占比均大于20%,在1号班组的堆积初始,甚至高达32%;其次是芽孢链菌属(Desmospora),在堆积阶段均超过10%。而入窖后,属水平的菌群演替相较堆积阶段发生了较大的变化,蜂蜜乳杆菌属逐渐代替芽孢杆菌属成为优势菌属,相对丰度从0.02%迅速上升至18%,已有研究表明其为乳酸主要产生菌的乳酸杆菌属[1],也从堆积阶段的0.2%上升至11%。这种菌群的演变主要原因可能是堆积到入窖后的转变,也是有氧到无氧的转变,优势菌群也从好氧的芽孢杆菌转为兼性厌氧的乳酸菌[13]。
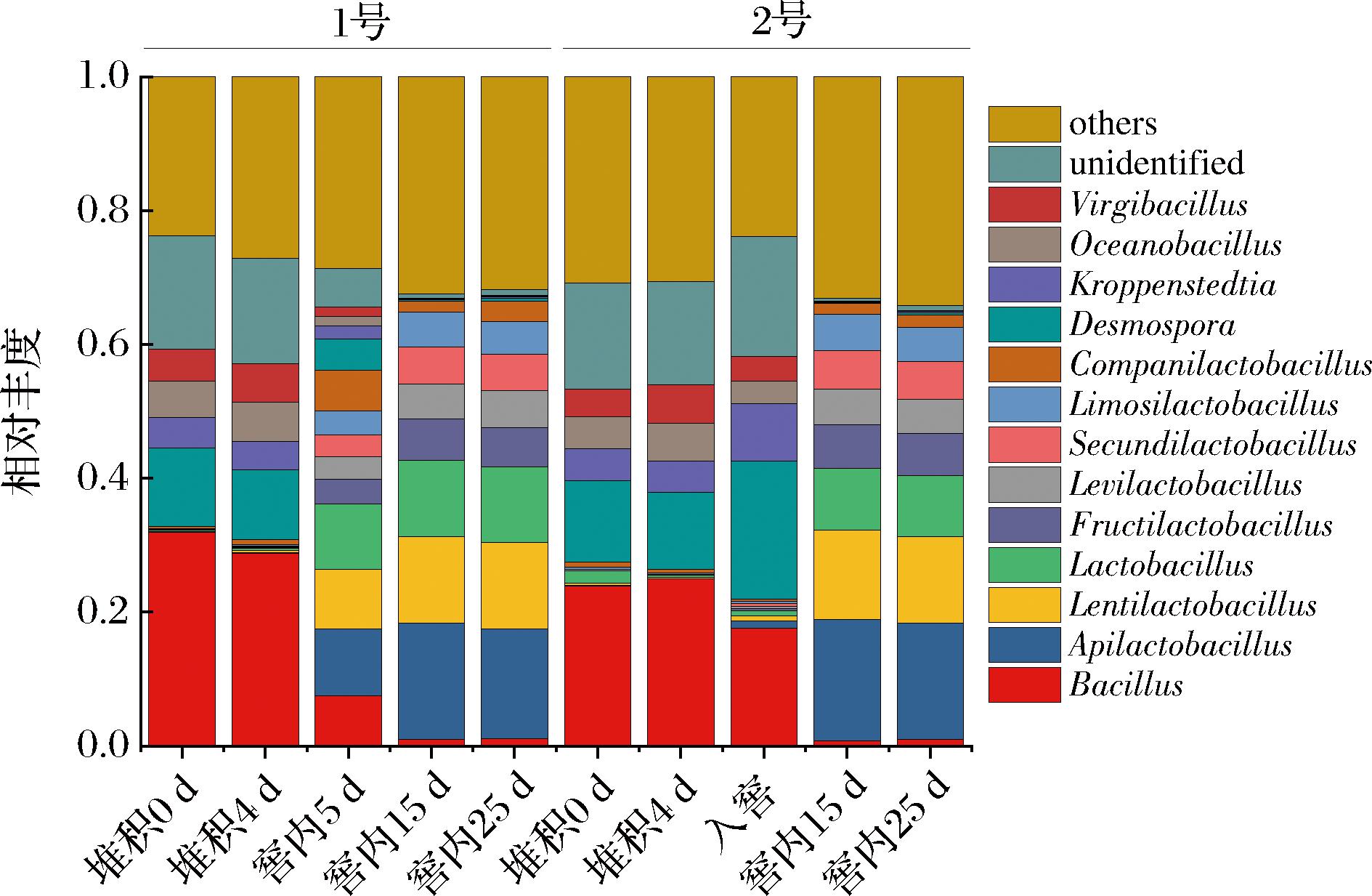
图2 细菌属水平相对丰度
Fig.2 Relative abundance at the bacterial genus level
乳杆菌的种水平相对丰度数据表明(图2),耐酸乳杆菌在堆积和窖内占据了主要地位,最高丰度高达76%,在含量最少的2号班组窖内后期,占比>2%,仍然是窖内核心微生物。乳酸菌在窖内的高丰度与HAO等[22]的研究一致,虽然堆积发酵阶段细菌与真菌呈现相反的趋势,真菌多样性逐渐增加,细菌多样性减少,但对乳酸菌而言,反而成为了优势微生物。乳酸菌生物量的增加导致了乳酸含量的显著上升,造成了窖内的极端环境,细菌多样性减少。但相比HAO等[22]所使用的高通量测序,本研究使用宏基因组学,能够更加具体地反映乳酸菌群种属水平的变化,并观察乳酸菌属在种水平的演替。与产乳酸能力较强的2号班组相比,1号班组耐酸乳杆菌占比始终维持在一定水平,与其他乳杆菌形成乳酸菌多样性的关系,而2号班组的耐酸乳杆菌则在前期占比显著高。因此猜测耐酸乳杆菌的堆积阶段即占据主导地位,导致了2号班组乳酸含量呈指数增长;产乳酸能力优异的耐酸乳杆菌与其他乳杆菌维持多样性,可能是1号班组乳酸积累滞后的原因之一。
对菌群相对含量的分析表面,乳酸菌的演替过程中导向的多样性可能是乳酸含量相对较低的原因,而单一乳酸占在窖内长时间占据优势,导致了乳酸含量高。为了验证这一猜想是否准确,本研究通过控制乳酸菌接种量,模拟了乳酸菌多样性发酵。实验结果表明(图3),单菌种培养普遍比多菌种培养产乳酸含量高。植物乳杆菌、发酵乳杆菌、戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌单培养时乳酸含量分别为34.78、22.95、38.77、38.90、37.83 g/L,其中耐酸乳杆菌产乳酸最高,发酵乳杆菌产乳酸最少,与等量接种多种乳酸菌的F组产乳酸37.64 g/L对比,除自身产乳酸较少的植物乳杆菌与发酵乳杆菌外,戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌分别增长了3.00%、3.35%、0.5%。为了进一步证实猜想,选取乳酸产量高的戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌等量接种,最终乳酸产量为34.96 g/L,单培养下戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌分别增长了10.90%、11.27%、8.21%。且高产乳酸的乳酸菌等量接种比5种乳酸菌等量接种,乳酸反而含量降低了7.14%。单一增强接种植物乳杆菌、发酵乳杆菌、戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌的A、B、C、D、E 5个组,乳酸含量分别为36.76、31.81、40.86、41.17、39.42 g/L,相比等量接种的F组,增长率分别为-2.34%、-15.49%、8.55%、9.38%、4.73%(图4)。虽然A组与B组乳酸含量相比降低,但与自身单培养相比,均有所增加,显然在多种乳酸菌存在下,单一乳酸菌含量高,这可能是导致乳酸含量高的诱因之一。结果表明,乳酸菌菌群的多样性,相比单培养及单一乳酸菌的高丰度,能在一定程度上减少乳酸的产量。FIJAN等[23]关于多菌株益生菌比单株益生菌对大肠杆菌的体外拮抗更有效的研究也表明,菌株的单培养与共培养在产生代谢物时有所差异;单菌和多菌对蛋鸡的喂养导致生产性能和鸡蛋品质指标不同,也证明了单菌和多菌的差异性[24]。而本研究单培养与共培养的差异表现在乳酸代谢水平上。此外,发现一株产乳酸较少的发酵乳杆菌,在其增强参与共培的B组,乳酸含量显著下降,有待进一步研究。
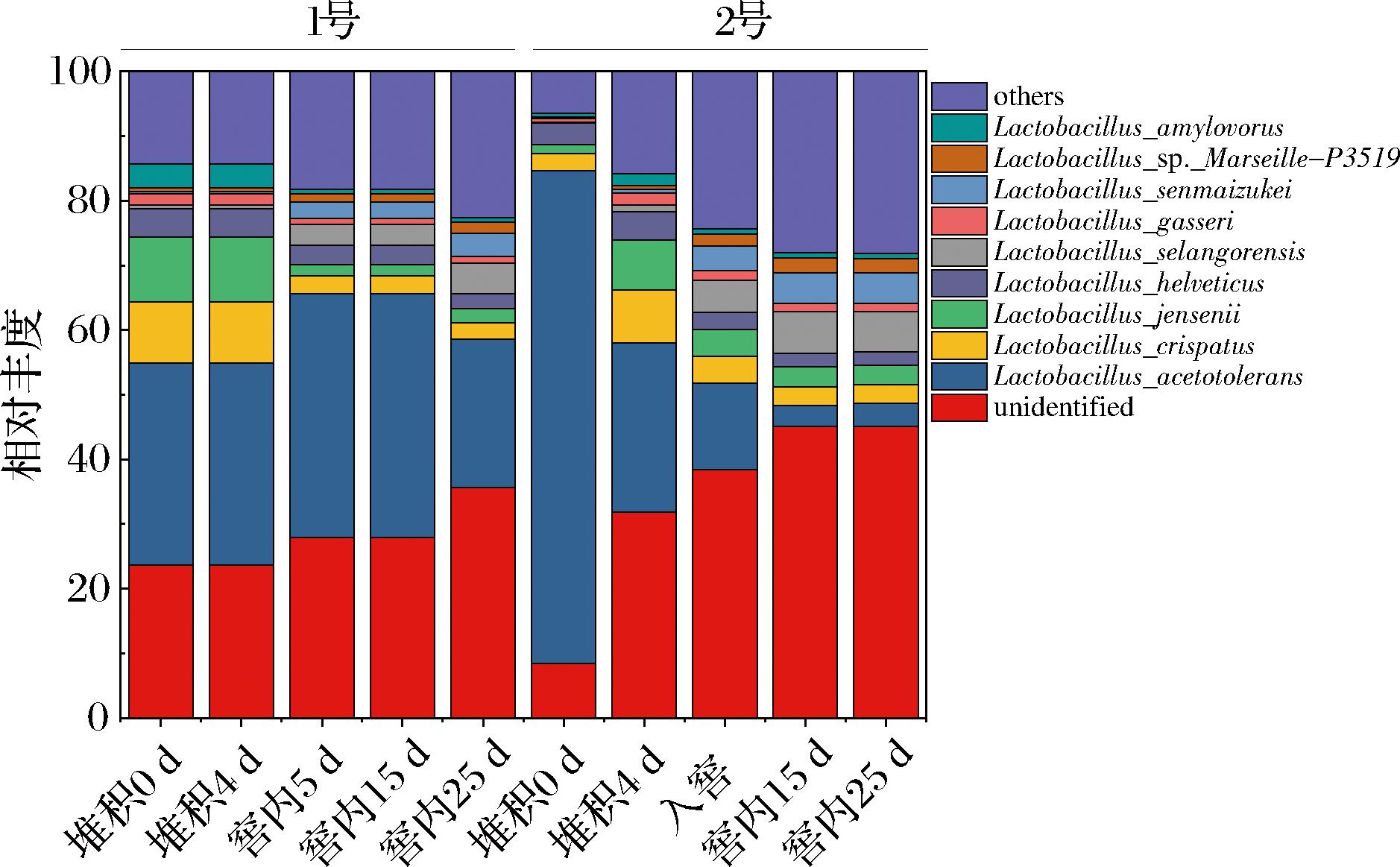
图3 乳杆菌种水平相对丰度
Fig.3 Relative abundance at the Lactobacillus species level

图4 不同乳酸菌接种比例产乳酸情况
Fig.4 Lactic acid production under different lactic acid bacteria inoculation ratios
注:不同小写字母表示差异显著(P<0.05)。
2.3 发酵乳杆菌对高产乳酸菌的影响
有研究表明,与单培养相比,菌株在共培养时,会出现培养生物量增加,达到峰值生物量时间滞后的现象[25]。并且在共培养时,不同接种比例也会影响菌株的生物量进而影响代谢产物。TANG等[24]的研究还说明共培养会影响菌株代谢产物的含量。因此,为了探究产乳酸较少的发酵乳杆菌作为控制乳酸策略的可能性,将发酵乳杆菌分别与高产乳酸的耐酸乳杆菌、戊糖片球菌、食果糖乳杆菌,在不同发酵乳杆菌的接种比例下共培养(图5)。研究表明,与耐酸乳杆菌、戊糖片球菌、食果糖乳杆菌共培养,当发酵乳杆菌接种量分别为30%和50%时,发酵乳杆菌均获得生长优势,OD600超过与它共培养的菌株。且共培养时,相比发酵乳杆菌与其他乳杆菌接种比例都为10%时,发酵乳杆菌OD600分别比耐酸乳杆菌、戊糖片球菌、食果糖乳杆菌高203.07%、67.81%、49.69%。结果表明,相比高产乳酸的3株乳杆菌,在少接种比例的情况下,共培养时发酵乳杆菌皆表现出生长得更良好的趋势。

A-发酵乳杆菌与耐酸乳杆菌Transwell共培养;B-发酵乳杆菌与戊糖片球菌Transwell共培养;C-发酵乳杆菌与食果糖乳杆菌Transwell共培养
图5 发酵乳杆菌与高产乳酸的乳酸菌共培养
Fig.5 The co-cultivation of Lactobacillus fermentum and high lactic acid-producing lactic acid bacteria
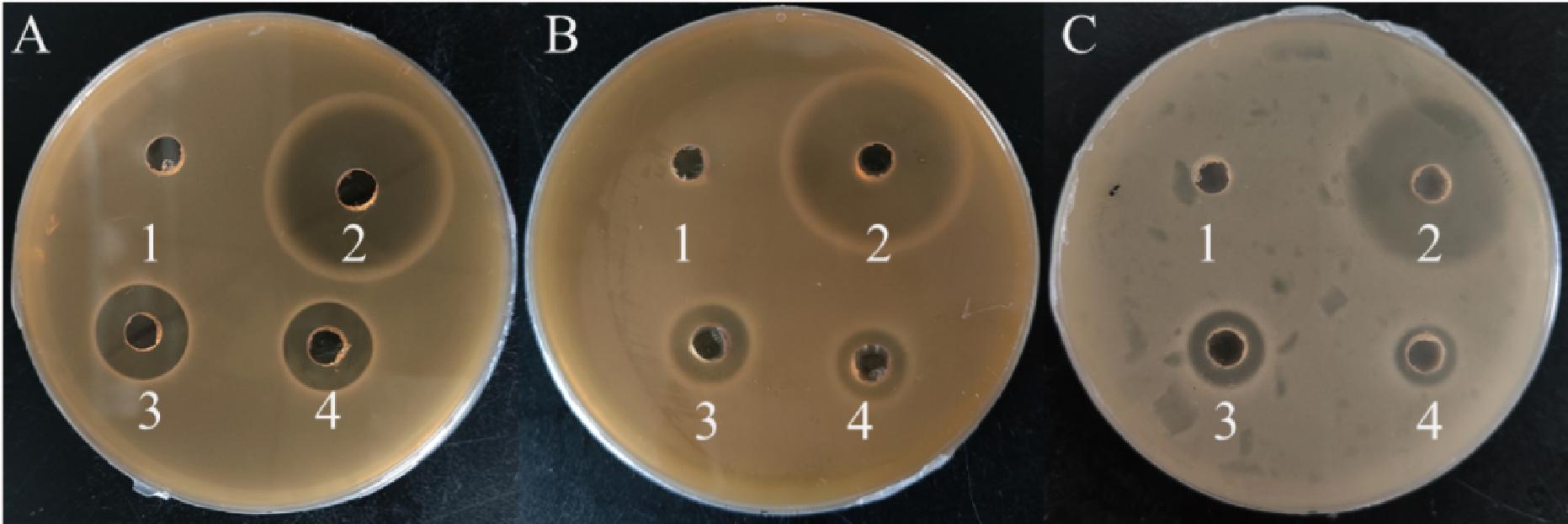
A-乳酸链球菌素对耐酸乳杆菌的作用;B-乳酸链球菌素对戊糖片球菌的作用;C-乳酸链球菌素对植物乳杆菌的作用
图6 乳酸链球菌素对乳酸菌的作用
Fig.6 Effect of nisin on lactic acid bacteria
注:1:蒸馏水;2:1 mg/mL氯霉素;3:1 mg/mL乳酸链球菌素1;4:1 mg/mL乳酸链球菌素2。

A-乳酸链球菌素作用后戊糖片球菌的生长曲线变化;B-乳酸链球菌素作用后耐酸乳杆菌的生长曲线变化;C-乳酸链球菌素作用后植物乳杆菌的生长曲线变化
图7 乳酸链球菌素作用后乳酸菌的生长曲线
Fig.7 Growth curve of lactic acid bacteria after nisin treatment
2.4 乳酸链球菌素对高产乳酸的乳酸菌的影响
蒸馏水为空白对照,氯霉素为阳性对照,本研究购买了市面上2种作为食品添加剂用的乳酸链球菌素,研究其对乳酸菌的作用。如图6所示,1 mg/mL乳酸链球菌素1和1 mg/mL乳酸链球菌素2对3株乳酸菌均具有明显的抑制作用。相比乳酸链球菌素1,乳酸链球菌素2对3种乳酸菌的抑菌效果稍弱,更符合本研究对乳酸菌进行抑制而非杀菌的目的,因此后续实验着重于乳酸链球菌素2的使用。
为了明晰乳酸链球菌素2对乳酸菌生长过程的影响,对比了3株高产乳酸菌在添加与否乳酸链球菌素2的情况下,0.1 mg/mL氯霉素作为对照的生长曲线。如图7所示,戊糖片球菌、耐酸乳杆菌和植物乳杆菌的生长都一定程度遭受了延后,其中受影响最严重的是戊糖片球菌,在0.1 mg/mL乳酸链球菌素2的影响下,生长延后了17 h。其次是耐酸乳杆菌,生长滞后了10 h。植物乳杆菌受乳酸链球菌素影响则较小,可能与其滞留期过长,乳酸链球菌素2长期在较高温度下有所失活有关。研究发现乳酸链球菌素2对3株乳酸菌都存在一定程度的抑制作用,是抑制高产乳酸的乳酸菌生物量的潜在作用物。
2.5 乳酸链球菌素对酿造功能菌的影响
白酒发酵是一个开放的体系[26],酒醅中除了乳酸菌,还存在其他酿造菌群,如产酒和产香的酵母,作为提供糖化液化酶和产香的芽孢杆菌等[27]。为了验证乳酸链球菌素对这些酿造过程其他功能菌是否有影响,本研究采用抑菌圈实验(图8)。与氯霉素作为阳性对照的对照组相比,乳酸链球菌素对大曲中筛选到的2株芽孢杆菌均未表现出抑制作用,并且对酿酒酵母也没有抑菌效果,初步表明了乳酸链球菌素对酿造体系中的功能菌群没有抑制作用,不会因为乳酸链球菌素可控制乳酸而过度影响发酵体系中其他菌株,可以作为控制乳酸菌的措施进行生产尝试。

A-乳酸链球菌素对Saccharomyces cerevisiae A5的抑菌圈;B-乳酸链球菌素对Bacillus amyloliquefaciens A22的抑菌圈;C-乳酸链球菌素对Bacillus licheniformis A8的抑菌圈
图8 乳酸链球菌素对酿造功能菌群的抑菌圈
Fig.8 Inhibitory zones of nisin against brewing functional microbial communities
注:1:蒸馏水;2:1 mg/mL氯霉素;3:1 mg/mL 乳酸链球菌素2;4:1 mg/mL 乳酸链球菌素1。
3 结论
本研究通过对堆积和发酵阶段产乳酸和酒醅菌群结构变化研究,分析对比了2个产乳酸能力不一的班组,前期产酸能力较强的2号班组乳酸菌多样性低,产乳酸能力强的耐酸乳杆菌在乳酸菌中占据优势地位,一度高达76%。因此推测乳酸菌的多样性与乳酸含量有关。通过控制菌种添加量模拟乳酸的多样性发现,与戊糖片球菌、耐酸乳杆菌、食果糖乳杆菌等量接种培养相比,各单培养乳酸含量分别增加了10.90%、11.29%、8.21%,这表明乳酸菌的多样性一定程度上确实能导致乳酸含量降低,而乳酸的过快积累,可能与乳酸菌的多样性呈负相关。利用一株低产乳酸的发酵乳杆菌与高产乳酸的乳酸菌Transwell共培养,发现相比高产乳酸的菌株,发酵乳杆菌更具生长优势,具有替代高产乳酸菌成为酒醅中优势乳酸菌的潜能。研究表明,乳酸链球菌素能抑制多数乳酸菌的生长,而对酿酒酵母、芽孢杆菌等酿造功能菌没有抑制作用,且适量乳酸链球菌素对乳酸菌的抑制作用表现为延迟乳酸菌的生长而非杀菌,因此控制乳酸链球菌素的添加量可以实现对乳酸菌生物量的控制。本研究表明,通过堆积期使用乳酸链球菌素控制产乳酸的优势乳杆菌的占比,后期添加低产乳酸的发酵乳杆菌成为新的优势菌株,可能是一种有效控制乳酸含量的措施。
[1] 谈冲, 艾梅, 陈良强, 等.影响酱香型白酒一轮次发酵乳酸积累的因素[J].食品与发酵工业, 2023, 49(20):9-16.TAN C, AI M, CHEN L Q, et al.Influencing factors of lactic acid accumulation during the first round of sauce-aroma Baijiu[J].Food and Fermentation Industries, 2023, 49(20):9-16.
[2] 罗寒, 曾祥炼, 陈良强, 等.微生物干预降低酱香型白酒酿造中的乳酸[J].食品与发酵工业, 2023, 49(15):63-68.LUO H, ZENG X L, CHEN L Q, et al.Microbial intervention to reduce lactic acid in Moutai-flavor liquor brewing[J].Food and Fermentation Industries, 2023, 49(15):63-68.
[3] PANG X N, CHEN C, HUANG X N, et al.Influence of indigenous lactic acid bacteria on the volatile flavor profile of light-flavor Baijiu[J].LWT, 2021, 147:111540.
[4] XU H, QIU S Y, DAI Y F, et al.Distribution and quantification of lactic acid enantiomers in Baijiu[J].Foods, 2022, 11(17):2607.
[5] WEI J L, NIE Y, DU H, et al.Serine improves lactic acid stress tolerance and ethanol production in Zygosaccharomyces bailii in Baijiu fermentation[J].Journal of Agricultural and Food Chemistry, 2023, 71(50):20295-20303.
[6] DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].Journal of Agricultural and Food Chemistry, 2020, 68(17):4903-4911.
[7] HU Y N, HUANG X N, YANG B, et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Bioscience, 2021, 44:101395.
[8] 杨帆. 酱香型白酒中乳酸代谢机理及调控策略的研究[D].无锡:江南大学, 2020.YANG F.Study on metabolic mechanism and regulation strategy of lactic acid in Maotai-flavor liquor[D].Wuxi:Jiangnan University, 2020.
[9] PUNIA BANGAR S, SURI S, TRIF M, et al.Organic acids production from lactic acid bacteria:A preservation approach[J].Food Bioscience, 2022, 46:101615.
[10] 张霖, 夏程程, 王文悦, 等.乳酸菌的乙醇耐受机制及其在食醋生产中的应用[J/OL].现代食品科技, 2024.DOI:10.13982/j.mfst.1673-9078.2024.3.0322.ZHANG L, XIA C C, WANG W Y, et al.Research on ethanol tolerance mechanism of lactic acid bacteria and its application in vinegar fermentation[J].Modern Food Science and Technology, 2024.DOI:10.13982/j.mfst.1673-9078.2024.3.0322.
[11] MA R F, SUI L, ZHANG J S, et al.Polyphasic characterization of yeasts and lactic acid bacteria metabolic contribution in semi-solid fermentation of Chinese Baijiu (traditional fermented alcoholic drink):Towards the design of a tailored starter culture[J].Microorganisms, 2019, 7(5):147.
[12] WANG J L, LU C S, XU Q, et al.Bacterial diversity and lactic acid bacteria with high alcohol tolerance in the fermented grains of soy sauce aroma type Baijiu in north China[J].Foods, 2022, 11(12):1794.
[13] CHEN C, XIONG Y, XIE Y H, et al.Metabolic characteristics of lactic acid bacteria and interaction with yeast isolated from light-flavor Baijiu fermentation[J].Food Bioscience, 2022, 50(Part A):102102.
[14] 郝小明, 陈博, 安泰.工业微生物酸胁迫的耐受机制及改造途径[J].生物工程学报, 2015, 31(8):1151-1161.HAO X M, CHEN B, AN T.Pathway modification of industrial microorganisms to inprove acid-stress tolerance[J].Chinese Journal of Biotechnology, 2015, 31(8):1 151-1 161.
[15] NANDY S, KAPLEY A.Unraveling the potential of microbial communities for lake bioremediation via the metagenomics tool:A review[J].AQUA-Water Infrastructure Ecosystems and Society, 2024, 73(1):11-33.
[16] CHAN K T, SONG X, SHEN L Y, et al.Nisin and its application in oral diseases[J].Journal of Functional Foods, 2023, 105:105559.
[17] LEE H J, HEO Y, KIM H J, et al.Bactericidal effect of combination of atmospheric pressure plasma and nisin on meat products inoculated with Escherichia coli O157:H7[J].Food Science of Animal Resources, 2023, 43(3):402-411.
[18] HAIDER T, PANDEY V, BEHERA C, et al.Nisin and nisin-loaded nanoparticles:A cytotoxicity investigation[J].Drug Development and Industrial Pharmacy, 2022, 48(7):310-321.
[19] 王兆兰, 李海军, 王超, 等.乳酸链球菌素工业生产过程的稳定性研究[J].食品与药品, 2022, 24(1):48-52.WANG Z L, LI H J, WANG C, et al.Stability study on nisin in industrial production[J].Food and Drug, 2022, 24(1):48-52.
[20] IVANKOVIC T, RAJIC A, ERCEGOVIC RAZIC S, et al.Antibacterial properties of non-modified wool, determined and discussed in relation to ISO 20645:2004 standard[J].Molecules, 2022, 27(6):1876.
[21] YANG H, WANG D K, JIN Y, et al.Arginine deiminase pathway of Tetragenococcus halophilus contributes to improve the acid tolerance of lactic acid bacteria[J].Food Microbiology, 2023, 113:104281.
[22] HAO F, TAN Y W, LV X B, et al.Microbial community succession and its environment driving factors during initial fermentation of Maotai-flavor Baijiu[J].Frontiers in Microbiology, 2021, 12:669201.
[23] FIJAN S,  ULC D, STEYER A.Study of the in vitro antagonistic activity of various single-strain and multi-strain probiotics against Escherichia coli[J].International Journal of Environmental Research and Public Health, 2018, 15(7):1539.
ULC D, STEYER A.Study of the in vitro antagonistic activity of various single-strain and multi-strain probiotics against Escherichia coli[J].International Journal of Environmental Research and Public Health, 2018, 15(7):1539.
[24] TANG J, HU Q, LEI D, et al.Characterization of deltamethrin degradation and metabolic pathway by co-culture of Acinetobacter junii LH-1-1 and Klebsiella pneumoniae BPBA052[J].AMB Express, 2020, 10(1):106.
[25] KIM H W, KIM J K, PARK I, et al.Establishing in vitro and in vivo co-culture models of Staphylococcus epidermidis and Enterococcus faecalis to evaluate the effect of topical fluoroquinolone on ocular microbes[J].Frontiers in Medicine, 2021, 8:670199.
[26] PAN F S, QIU S Y, LYU Y Y, et al.Exploring the controllability of the Baijiu fermentation process with microbiota orientation[J].Food Research International, 2023, 173(Pt1):113249.
[27] XUE Y A, TANG F X, CAI W C, et al.Bacterial diversity, organic acid, and flavor analysis of dacha and ercha fermented grains of Fen flavor Baijiu[J].Frontiers in Microbiology, 2022, 12:769290.