冷榨花生饼是花生低温压榨制油后的主要副产物,含有47%~55%的蛋白质,此外还含有碳水化合物、矿物质、维生素以及少量的多酚类物质和纤维等丰富的营养物质,是植物性蛋白质的极好来源。据美国农业部统计,2023—2024年度花生饼粕全球生产共计777万t,其中,中国生产约461万t,居世界首位[1]。然而冷榨花生饼由于溶解性、乳化特性等功能特性的局限性,限制了其在食品领域的应用[2],长期以来一直被用作家禽和畜牧业的饲料,造成了蛋白质资源的极大浪费[3]。
研究表明,蛋白质修饰可以改善其溶解性、乳化特性、持油性、起泡性及泡沫稳定性等功能特性[4]。物理、化学、酶法和基因工程是蛋白质修饰的主要方式。其中蛋白质物理修饰以绿色、安全、环保、设备低廉、对食品营养影响较小等优点深受科研人员及生产商的关注[5]。在物理修饰方式中超声修饰被认为是比热处理更加高效、安全和环保的方法。近年来有研究发现,超声修饰可以提高蛋白质的溶解性,超声强有力的空化、搅拌和崩溃作用使蛋白质聚集体分散,蛋白颗粒发生破裂,粒径变小,表面积增大,更易与水发生相互作用[6],此外,空化效应使蛋白质的三维结构改变,分子间静电作用增强,亲水性氨基酸暴露增多,蛋白质与水的相互作用增强,从而提高其溶解度[7]。超声修饰同时可以改善蛋白质的乳化活性、乳化稳定性、起泡性和泡沫稳定性。超声产生的湍流破坏了蛋白质的二级结构,亲油基团充分展开,疏水基团暴露增多,表面张力降低,平均粒径减小并且蛋白质表面电荷发生重排,提高了蛋白质的界面特性[8-9]。
蛋白结构的改变直接影响其功能特性,目前,鲜有对冷榨花生饼蛋白直接修饰以提高其功能特性的研究报道,且蛋白结构与功能关系的确立对特定功能特性蛋白配料的开发具有重要意义。因此,本研究以冷榨花生饼为原料,研究了超声对冷榨花生饼蛋白功能特性的影响,同时通过傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)、内源荧光光谱、紫外光谱等方法研究了超声对冷榨花生饼蛋白结构特性的影响规律,阐明了超声作用下冷榨花生饼蛋白的功能特性与结构的关系。研究结果为开发高效绿色的超声修饰冷榨花生饼蛋白技术提供理论依据,并为冷榨花生饼的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
冷榨花生饼,青岛长寿食品有限公司;大豆油,益海嘉里(周口)粮油工业有限公司;磷酸二氢钠(分析纯)、十二水磷酸氢二钠(分析纯)、溴化钾(光谱纯),天津市科密欧化学试剂有限公司;十二烷基硫酸钠(分析纯),洛阳市化学试剂厂。
1.2 仪器与设备
K1100全自动凯式定氮仪,海能仪器;PHS-3E pH计,上海仪电科学仪器股份有限公司;SCIENTZ-Ⅱ D超声波细胞粉碎机、DC-2006节能型智能恒温槽,宁波新芝生物科技股份有限公司;FM200高剪切分散乳化机,上海弗鲁克科技发展有限公司;TDL-5-A高速离心机,上海安亭科学仪器;722S可见分光光度计,上海仪电分析仪器有限公司;BeNano 90 Zeta纳米粒度及zeta电位分析仪,丹东百特仪器有限公司;WQF-510傅里叶红外光谱扫描仪,北京瑞利分析仪器有限公司。
1.3 实验方法
1.3.1 原料基本成分测定
蛋白质含量测定参照GB/T 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯式定氮法;
粗脂肪含量测定参照GB/T 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的索氏抽提法;
水分含量测定参照GB/T 5009.3—2016《食品安全国家标准食品中水分的测定》中的直接干燥法;
灰分含量测定参照GB/T 5009.4—2016《食品安全国家标准食品中灰分的测定》灼烧重量法。
1.3.2 冷榨花生饼的超声处理
冷榨花生饼,通过100目筛,按1∶10(g∶mL)的料液比溶解在0.05 mol/L磷酸盐缓冲溶液中(pH 8.0),室温下磁力搅拌1 h使其充分溶解,制得10%的冷榨花生饼悬浮液。
将超声探头置于悬浮液(70 mL)液面下方3 cm处,占空比均设置为50%,固定超声温度35 ℃,功率密度2.67 W/cm3,将超声时间设置为0、10、20、30、40、50 min;固定超声时间40 min,功率密度2.67 W/cm3,将超声温度设置为 5、15、25、35、45 ℃;固定超声时间40 min,超声温度25 ℃,将超声波功率密度设置分别为1.33、2.67、4.00、5.33、6.67 W/cm3;超声处理后的样品冷冻干燥48 h后备用。
1.3.3 冷榨花生饼蛋白功能特性的测定
1.3.3.1 溶解性
参考刘昕等[10]的方法稍作修改。取0.5 g超声处理过的样品,加入20 mL蒸馏水使其充分溶解,控制溶液的pH为7.0,磁力搅拌1 h,然后在转速5 000 r/min的条件下离心15 min,取上清液,以凯式定氮法测定上清液的蛋白含量,计算方法如公式(1)所示。
溶解性![]()
(1)
式中:m1,样品离心后取的上清液质量,g;C1,上清液中的蛋白含量,%;m2,样品质量,g;C2,样品中蛋白含量,%。
1.3.3.2 乳化活性及乳化稳定性
乳化活性(emulsifying ability,EAI)和乳化稳定性(emulsifying stability,ESI)均代表了冷榨花生饼蛋白的乳化性能。参照HAN等[11]的方法并稍作修改。取9 mL冷榨花生饼悬浮液,加入1 mL大豆油,使用高速剪切机(15 000 r/min)均质2 min,迅速从底部吸取25 μL乳化液移入5 mL 1 g/L的SDS溶液中,以SDS溶液为对照,测定500 nm波长处的吸光度,记为A0。将乳液在室温下放置10 min再次测定吸光度,记为A10。计算方法如公式(2)、公式(3)所示:
(2)
(3)
式中:2为固定系数;2.303为阿伦尼乌斯常数;A0,0 min 时的吸光度;DF,稀释倍数;ρ,蛋白质的质量浓度,g/mL;F,乳状液中油的体积分数,%;L,比色皿的厚度,1 cm,A10,10 min时的吸光度;Δt,乳液静止的时间,min。
1.3.3.3 持水性和持油性
参考张艳艳等[12]的方法稍作修改。称取0.5 g 冷榨花生饼,称量样品和离心管的总质量m1,向离心管中加入10 mL蒸馏水,涡旋5 min,室温放置30 min,5 000 r/min离心20 min,除去上清液,称量沉淀和离心管的总质量m2。
准确称取0.5 g冷榨花生饼,称样品和离心管的总质量m3,加入5 mL大豆油,涡旋5 min,5 000 r/min离心20 min,弃去上层未吸附油,称沉淀和离心管的总质量m4。相关计算如公式(4)、公式(5)所示:
持水性![]()
(4)
持油性![]()
(5)
式中:m0,样品质量,g;m1,样品和离心管的总质量,g;m2,弃去上清液后沉淀和离心管的总质量,g;m3,样品和离心管的总质量,g;m4,弃去上清液后沉淀和离心管的质量,g。
1.3.3.4 起泡性和泡沫稳定性
参考耿军凤等[13]的方法稍作修改。准确称取0.5 g样品,加入25 mL去离子水混匀,测量初始高度(H0),室温下搅拌1 h,用高速剪切机以15 000 r/min 高速剪切2 min后,记录其在0 min时的泡沫的高度(H1)和下层液体(H2)高度。静置30 min后,再次记录剩余泡沫高度(H3)。相关计算如公式(6)、公式(7)所示:
起泡性![]()
(6)
泡沫稳定性![]()
(7)
式中:H0,蛋白溶液的初始高度,cm;H1,高速剪切后0 min 时的泡沫的高度,cm;H2,高速剪切后0 min时的下层液体的高度,cm;H3,高速剪切后静置30 min时泡沫的高度,cm。
1.3.4 超声冷榨花生饼蛋白的结构的测定
1.3.4.1 粒径
取0.2 g冷榨花生饼加入20 mL PBS(0.05 mol/L,pH值为7.0),离心10 min,取出后弃去沉淀,取上清液,用纳米粒度仪进行粒径的测定。
1.3.4.2 傅里叶红外光谱
称量2 mg冷榨花生饼,加入KBr 200 mg,混匀后用研钵研磨成粉末,用压片机压制成薄片。用傅里叶红外光谱扫描仪对薄片进行扫描,扫描参数设定为:4 000~400 cm-1,次数为32[12]。
1.3.4.3 紫外光谱
用PBS缓冲液(0.05 mol/L,pH值为7.0)将冷榨花生饼配制成蛋白质量浓度为1.0 mg/mL的悬浮液,离心10 min,取上清液稀释合适的倍数,用紫外分光光度计对其进行光谱扫描。扫描参数为:400~200 nm,速度60 nm/min,光程1.0 cm,狭缝宽度0.2 nm。
1.3.4.4 内源荧光光谱
用磷酸盐缓冲液(0.01 mol/L, pH 8.0)将冷榨花生饼悬浮液稀释为蛋白质量浓度1.0 mg/mL,在290 nm激发波长,300~400 nm扫描范围下,记录内源荧光光谱的最大荧光发射波长(λmax) 用于分析[13]。
1.4 数据处理
每组数据取平均值,用Origin 2021绘图,并使用SPSS对数据进行显著性分析。
2 结果与分析
2.1 冷榨花生饼基本成分分析
表1显示了冷榨花生饼的基本组成,由表可以看出,冷榨花生饼中蛋白含量为46.17%,粗脂肪、灰分、水分以及碳水化合物分别占冷榨花生饼的6.30%、4.42%、5.36%和37.75%。冷榨花生饼中含有丰富的蛋白质,超声冻干后测得样品中蛋白含量为49.67%。
表1 冷榨花生饼的基本成分
Table 1 The basic ingredients of cold-pressed peanut cake
成分蛋白质/%粗脂肪/%灰分/%水分/%碳水化合物/%含量46.17±0.666.30±0.104.42±0.145.36±0.0537.75±0.50
2.2 超声对冷榨花生饼蛋白功能特性的影响
2.2.1 溶解性
花生饼蛋白的溶解性与其他功能性质密切相关,受蛋白质变性程度、聚集状态等的影响[14]。超声对花生饼蛋白溶解性的影响见图1。由图1可知,超声处理后花生饼蛋白的溶解性显著提高,随着超声时间的延长,花生饼蛋白的溶解性逐渐增加,并在40 min 时达到最大;随超声温度的升高,花生饼蛋白溶解性呈现先增加后减小的趋势,并在25 ℃时达到最大;花生饼蛋白的溶解性随超声功率密度的增加呈现先增加后减小的趋势。超声后花生饼蛋白的溶解性由初始的40.90%增加到61.32%,提高了49.93%。超声处理可以提高花生饼蛋白的溶解性,这是由于超声的空化作用使其内部的二硫键断裂, 蛋白分子展开,二级结构改变,花生饼蛋白分子间静电斥力增强,破坏了蛋白质-蛋白质相互作用[15],疏松的蛋白结构增大了蛋白质表面与水分子的接触面积进而增加花生饼蛋白的表面亲水性。同时,蛋白分子内部暴露出的亲水基团有利于蛋白的水合,从而有效提高溶解性。当继续延长超声时间和增加功率密度,花生饼蛋白的溶解性降低,这是由于过高超声强度促使蛋白质变性程度加剧,蛋白凝聚,分子表面亲水基团减少,溶解性降低[16]。

A-时间;B-温度;C-功率密度
图1 超声对冷榨花生饼蛋白溶解性的影响
Fig.1 Effect of ultrasound on the protein solubility of cold-pressed peanut cake protein
注:不同小写字母代表差异显著,P<0.05(下同)。
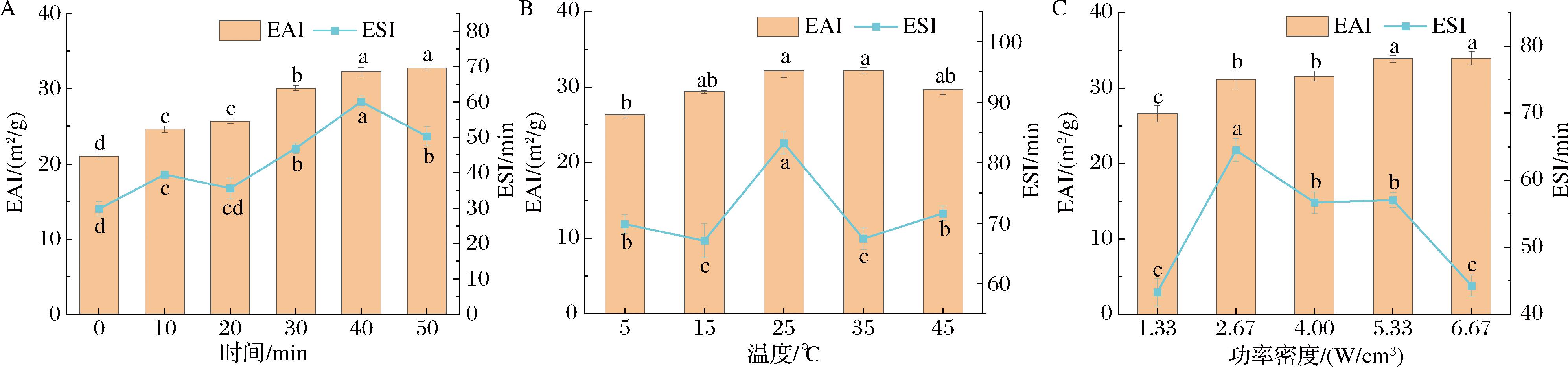
A-时间;B-温度;C-功率密度
图2 超声对冷榨花生饼蛋白乳化活性及乳化稳定性的影响
Fig.2 Effect of ultrasound on the emulsifying activity and emulsifying stability of cold-pressed peanut cake protein
2.2.2 乳化特性
乳化性质代表了其在油水界面的吸附能力,反映了其形成油水界面膜的能力及其抗变形性[15],超声对冷榨花生饼蛋白乳化活性及乳化稳定性的影响见图2,超声处理显著提高了冷榨花生饼蛋白的乳化活性和乳化稳定性。随着超声时间延长,温度和功率密度的增加,冷榨花生饼蛋白的乳化活性逐渐增加,在超声40 min、25 ℃、5.33 W/cm3时乳化活性达到最高,由初始的21.04 m2/g增加到33.88 m2/g,提高了61.05%。经超声处理后由于空化作用颗粒崩解,蛋白质三级结构被破坏,蛋白充分溶解,溶解性的提高加速了蛋白向油水界面迁移和扩散,超声处理后蛋白质亲油基团充分展开,增强了蛋白质-油界面的相互作用,乳化活性得到改善[16]。
冷榨花生饼蛋白的乳化稳定性在超声40 min、25 ℃、2.67 W/cm3时最高,由初始的21.04 min增加到83.24 min。超声作用使蛋白质的溶解性提高,进而更容易在油水界面稳定油滴。但随着超声时间的延长和功率密度的进一步增加,花生饼蛋白乳化稳定性降低,超声可使花生饼蛋白暴露出更多的疏水性基团,疏水相互作用增强,导致不溶性小聚集体的产生[13],进而导致花生饼蛋白乳化稳定性降低。
2.2.3 持水性和持油性
持水性表示蛋白质吸收水并将水保留在蛋白质组织中的能力。持油性表示蛋白质吸附脂质的能力,持油性越强,蛋白质与脂质结合能力越强[10]。超声对冷榨花生饼蛋白持水性和持油性的影响见图3。超声处理后花生饼蛋白的持水性显著下降,随着超声时间的延长和功率密度的增加,花生饼蛋白的持水性呈现减小的趋势,并在超声30 min、25 ℃、5.33 W/cm3时最低,由初始的1.77%下降到1.18%,减少了33.3%。持水性下降是由于超声处理使蛋白质变性,空间构型解体,蛋白质分子内部的非共价键使其疏水性基团暴露于分子表面,降低蛋白质与水的结合程度。超声处理后花生饼蛋白的持油性显著增加,并在40 min、25 ℃、6.67 W/cm3时最高,由初始的1.69%增加到4.08%,提高了141.4%,这是由于超声作用使花生饼蛋白的空间结构被破坏,内部的非极性氨基酸暴露,非极性氨基酸侧链会与更多的脂肪烃侧链相结合[17],并且超声使蛋白质部分变性,蛋白分子结构的次级键破坏,分子结构展开,增加了蛋白质表面活性,结构变得紧密,更有利于油相的物理保留[18],从而增强了冷榨花生饼蛋白的持油性。

A-时间;B-温度;C-功率密度
图3 超声对冷榨花生饼蛋白持水性和持油性的影响
Fig.3 Effect of ultrasound on the water and oil holding capacity of cold-pressed peanut cake protein
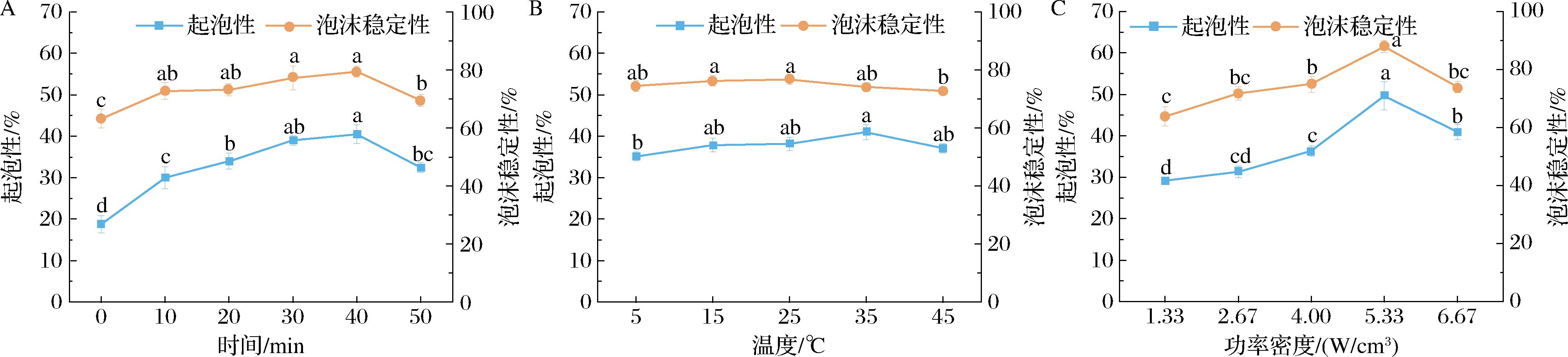
A-时间;B-温度;C-功率密度
图4 超声对冷榨花生饼蛋白起泡性和泡沫稳定性的影响
Fig.4 Effect of ultrasound on foaming capacity and foam stability of cold-pressed peanut cake protein
2.2.4 起泡性和泡沫稳定性
蛋白的起泡性指蛋白质分子在空气-水界面形成一层坚韧膜以使气泡进入的能力,在食品工业中起着重要作用。泡沫稳定性是泡沫形成后保持稳定而不破裂的能力[19]。超声对冷榨花生饼蛋白的起泡性和泡沫稳定性的影响见图4,超声处理显著提高了花生饼蛋白的起泡性及泡沫稳定性。随着超声时间的延长、温度和功率密度的增加,冷榨花生饼蛋白的起泡性先增加后减小,并且在超声时间40 min、温度35 ℃、功率密度5.33 W/cm3时起泡性最好,由初始的18.75%增加到49.65%。蛋白经超声作用后分子中更多的亲疏水性基团暴露,具有更大表面活性,能够充分展开于气-液界面处,高速剪切时液态连续相包裹空气分散相形成大量泡沫[6]。随着超声时间的延长、温度的升高和功率密度的增加,花生饼蛋白的泡沫稳定性先增加后减小,在超声时间40 min、温度25 ℃、功率密度5.33 W/cm3时泡沫稳定性最好为87.86%。超声处理后蛋白质迅速被空气和水界面吸附在表面上,然后经由分子重排,极性基团展开朝向水中,疏水基团伸向空气,在界面形成具有黏弹性的薄膜,水的表面张力迅速降低,泡沫稳定性增加[9]。
2.3 超声对冷榨花生饼蛋白结构特性的影响
2.3.1 粒径
蛋白质的颗粒大小是影响蛋白功能特性的重要因素之一[17]。超声对冷榨花生饼蛋白粒径的影响见图5。随着超声时间延长和超声功率密度的增加,花生饼蛋白的粒径逐渐减小;随着超声温度的升高,花生饼蛋白的粒径先增加后减小,这是由于超声的局部极端温度、压力和高剪切能波及空化现象引起的湍流导致蛋白颗粒破裂,从而粒径变小。并且高强度超声处理过程中,蛋白分子间或分子内的相互作用被破坏,导致蛋白质分解和颗粒大小减小[20]。粒径大小是影响蛋白质溶解性的主要原因,超声处理减小了花生饼蛋白的平均粒径,使其表面积增大,分子结构变得疏松,使转入分子内部的亲水基团转移到分子表面,从而恢复表面亲水基团的水化层,溶解性提高[21]。
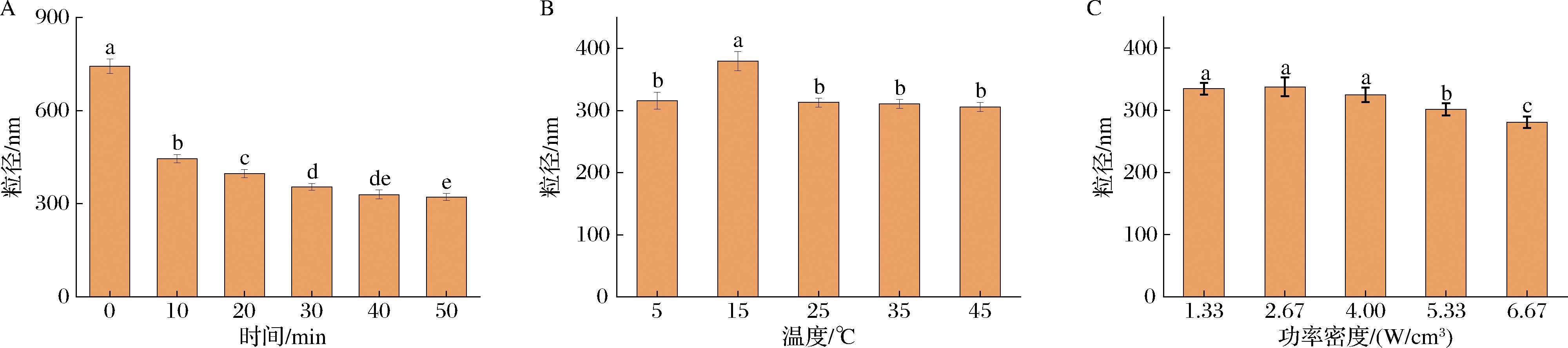
A-时间;B-温度;C-功率密度
图5 超声对冷榨花生饼蛋白粒径的影响
Fig.5 Effect of ultrasound on the particle size of cold-pressed peanut cake protein

A-时间;B-温度;C-功率密度
图6 超声对冷榨花生饼蛋白FTIR的影响
Fig.6 Effect of ultrasound on FTIR of cold-pressed peanut cake protein
2.3.2 二级结构
超声对冷榨花生饼蛋白二级结构的影响见图6和表2。蛋白质主链结构的变化主要由酰胺Ⅰ带表明。由表2结果可知,与空白组相比,超声处理后花生饼蛋白的α-螺旋和β-转角的相对含量增加,β-折叠和无规卷曲相对含量降低。超声的空化作用对蛋白质二级结构的破坏比较明显,易造成二级结构的相互转化,不同程度地将β-折叠和无规卷曲转变为稳定的α-螺旋结构[22]。随超声时间的延长,花生饼蛋白α-螺旋相对含量先增加后减小,随时间的持续延长,蛋白质变性暴露出更多的疏水集团使蛋白质产生聚集,进而使α-螺旋比例减少。花生饼蛋白α-螺旋结构随超声温度的变化无显著差异(P>0.05)。超声功率密度对花生饼蛋白的二级结构无显著影响(P>0.05)。HU等[23]发现,较高超声功率处理大豆分离蛋白,导致大豆分离蛋白α-螺旋含量增加,β-折叠含量降低,与本研究结果一致。β-折叠的含量也与蛋白质的疏水相互作用有关,β-折叠含量减少表明分子内部的疏水部位暴露出来,表面疏水性增强[24],疏水部位暴露增多使得蛋白质容易吸附在气-水界面上,增加了蛋白质的表面活性能够裹入更多的空气,因此提高了花生饼蛋白的起泡性。无规卷曲含量降低说明超声处理显著增加了冷榨花生饼蛋白的结构有序性,规整的结构有利于蛋白在油滴表面有序排列,形成完整而富有粘弹性的膜包裹油滴[25],因此花生饼蛋白的乳化性提高。
表2 超声对冷榨花生饼蛋白二级结构相对含量的影响
Table 2 Effect of ultrasound on the secondary structure content of cold-pressed peanut cake protein

注:不同小写字母代表差异显著,P<0.05。
样品二级结构相对含量/%α-螺旋β-折叠β-转角无规卷曲0 min23.53±0.09d26.23±0.16a32.77±0.32c17.47±0.13a10 min25.23±0.21c25.46±0.19b33.31±0.27b16.01±0.42b超声时间20 min25.45±0.11c25.13±0.24b33.75±0.08ab15.67±0.35c30 min25.96±0.30b24.76±0.12bc33.92±0.31a15.36±0.17c40 min26.53±0.09a24.23±0.16c34.34±0.32a14.90±0.13c50 min25.78±0.16bc24.93±0.58b33.84±0.42ab14.45±0.30d5 ℃26.93±0.12a23.96±0.09c33.42±0.22b15.69±0.16c15 ℃26.65±0.07a24.17±0.34c33.35±0.11b15.83±0.25bc温度 25 ℃26.56±0.08a24.26±0.14c33.31±0.20b15.87±0.19bc35 ℃26.36±0.14ab24.38±0.23c33.44±0.22b15.82±0.10bc45 ℃26.18±0.18ab24.82±0.27bc33.47±0.04b15.53±0.24c1.33 W/cm326.22±0.32ab24.47±0.14c34.03±0.22a15.28±0.10c2.67 W/cm326.34±0.09ab24.32±0.12c34.15±0.08a15.19±0.21c功率密度4.00 W/cm326.49±0.20a24.26±0.11c34.21±0.23a15.04±0.16c5.33 W/cm326.57±0.15a24.21±0.08c34.32±0.12a14.90±0.20c6.67 W/cm326.31±0.10ab24.39±0.16c34.24±0.09a15.06±0.25c
2.3.3 三级结构
超声对冷榨花生饼蛋白紫外吸收光谱的影响见图7。未经超声处理的花生饼蛋白的最大吸收波长在290 nm,而超声处理后花生饼蛋白的最大吸收峰出现轻微蓝移,在超声50 min时最大吸收峰位置移至287 nm。超声处理后花生饼蛋白的最大紫外吸收峰强度增加,在超声50 min,温度25 ℃,功率密度5.33 W/cm3时达到最高。经超声处理后,蛋白质的分子构象发生改变,蛋白的三级结构伸展。长时间和高强度超声处理增大了花生饼蛋白分子的展开程度,分子表面具有紫外吸收的残基增多。最大吸收峰出现蓝移是由于花生饼蛋白在超声波处理后结构舒展,蛋白内部氨基酸侧链基团暴露于水溶液中,环境极性增大所致[26],使花生饼蛋白的溶解性增加。
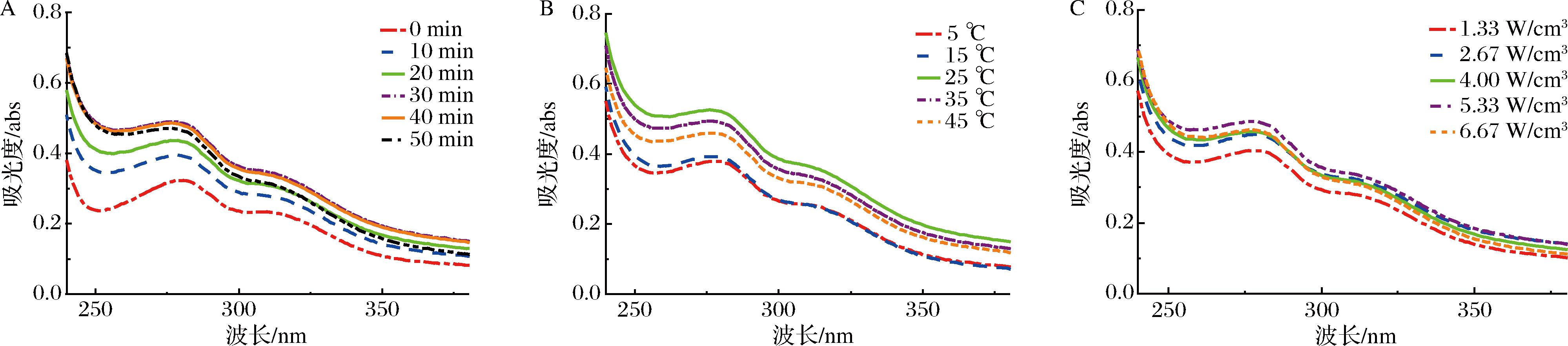
A-时间;B-温度;C-功率密度
图7 超声对冷榨花生饼蛋白紫外光谱的影响
Fig.7 Effect of ultrasound on the ultraviolet spectrum of cold-pressed peanut cake protein
内源荧光光谱可以反映蛋白质三级结构的变化[27]。超声对冷榨花生饼蛋白内源荧光光谱的影响见图8。超声处理后花生饼蛋白的荧光强度发生了明显变化,荧光最大吸收峰蓝移。随超声时间的延长,花生饼蛋白荧光强度逐渐增加,在超声 50 min 时荧光强度最高。超声处理使蛋白质发生伸展,内部的色氨酸残基暴露,从而表现出了更强的荧光强度,这与超声修饰扇贝蛋白的结果相吻合[28]。超声过程中气泡的产生和破裂使蛋白质三级结构拉伸松动,原本嵌入在疏水环境中的Trp残基逐渐暴露至蛋白表面,蛋白表面的作用位点增多,有助于蛋白吸附在油水界面,从而形成黏弹性更强的界面膜包裹油滴[25],因此提高了蛋白的乳化稳定性。在超声温度35 ℃时花生饼蛋白荧光强度最高。随着超声功率密度的增加,花生饼蛋白的荧光强度先增加后降低并在4.00和5.33 W/cm3时荧光强度最大。随着超声功率密度的继续增加,花生饼蛋白荧光强度下降。较高强度的超声处理会使蛋白质分子发生交联、聚集,已经暴露的色氨酸基团重新包埋于蛋白质内部,引起蛋白质空间位阻增加,导致蛋白发生荧光猝灭现象[29-30]。
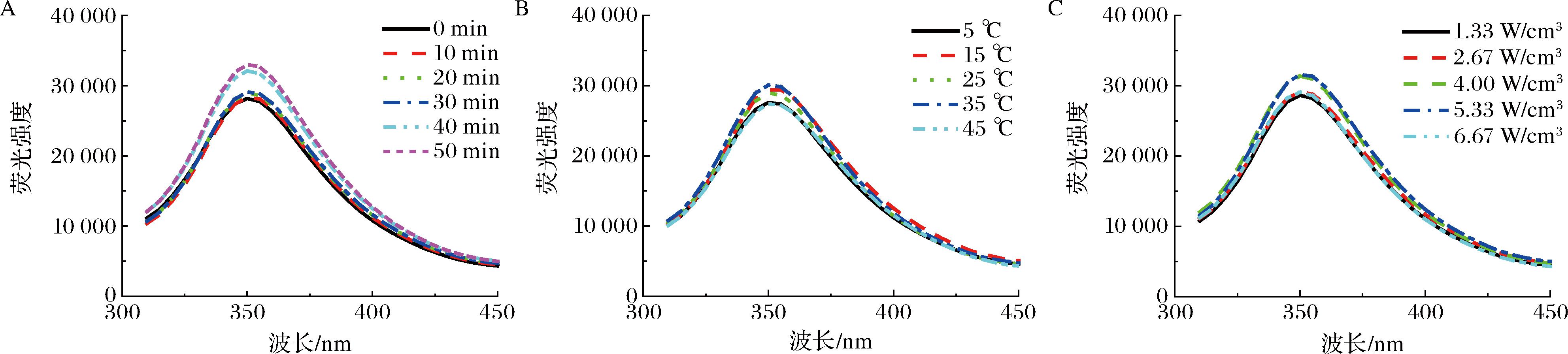
A-时间;B-温度;C-功率密度
图8 超声对冷榨花生饼蛋白内源荧光光谱的影响
Fig.8 Effect of ultrasound on the endogenous fluorescence spectrum of cold-pressed peanut cake protein
3 结论
本文通过考察超声时间、温度和功率密度对冷榨花生饼蛋白功能特性的影响,结合超声修饰后花生饼蛋白结构的变化,阐明超声作用下花生饼蛋白结构与功能特性的关系。结果表明,经过超声修饰,花生饼蛋白的溶解性、乳化活性、乳化稳定性、持油性、起泡性和泡沫稳定性均得到一定的改善,花生饼蛋白的溶解性提高到 61.32%,乳化活性达到33.88 m2/g,乳化稳定性达到83.24 min,持油性提高了2.4倍,起泡性和泡沫稳定性分别提高了2.65倍和1.4倍。结构结果显示,超声修饰后花生饼蛋白的平均粒径减小,花生饼蛋白α-螺旋增加,无规卷曲减少,蛋白结构变得更加松散有序;超声后花生饼蛋白紫外和荧光最大吸收峰均发生蓝移,荧光强度增加,内部的基团暴露,表面疏水性降低。花生饼蛋白结构的变化有利于其功能特性的提升,超声后花生饼蛋白结构有序性增强,疏水基团暴露,有助于蛋白在油-水界面的吸附,乳化活性增强;紫外最大吸收峰蓝移说明超声后花生饼蛋白在水溶液环境极性增大,以及花生饼蛋白平均粒径的减小,使其溶解性增加。本研究结果为超声修饰冷榨花生饼蛋白技术的开发和功能性蛋白产品的应用提供了理论依据。
[1] 郭曼莉, 李晓彤, 吴澎, 等.花生加工副产物的综合利用及精深加工[J].粮油食品科技, 2018, 26(3):27-31.GUO M L, LI X T, WU P, et al.Comprehensive utilization and intensive processing of by-products during peanut processing[J].Science and Technology of Cereals, Oils and Foods, 2018, 26(3):27-31.
[2] HARIHARAN S, PATTI A, ARORA A.Functional proteins from biovalorization of peanut meal:Advances in process technology and applications[J].Plant Foods for Human Nutrition, 2023, 78(1):13-24.
[3] ZHAO T, YING P F, ZHANG Y H, et al.Research advances in the high-value utilization of peanut meal resources and its hydrolysates:A review[J].Molecules, 2023, 28(19):6862.
[4] JIAO B, SHI A M, LIU H Z, et al.Effect of electrostatically charged and neutral polysaccharides on the rheological characteristics of peanut protein isolate after high-pressure homogenization[J].Food Hydrocolloids, 2018, 77:329-335.
[5] ZHANG X X, ZUO Z Y, YU P B, et al.Rice peptide nanoparticle as a bifunctional food-grade Pickering stabilizer prepared by ultrasonication:Structural characteristics, antioxidant activity, and emulsifying properties[J].Food Chemistry, 2021, 343:128545.
[6] 邵悦, 张琪, 张程, 等.超声波对花生蛋白功能特性的影响[J].食品工业科技, 2012, 33(24):130-133.SHAO Y, ZHANG Q, ZHANG C, et al.Effects of ultrasonic technology on functional properties of peanut proteins[J].Science and Technology of Food Industry, 2012, 33(24):130-133.
[7] O’SULLIVAN J, PARK M, BEEVERS J.The effect of ultrasound upon the physicochemical and emulsifying properties of wheat and soy protein isolates[J].Journal of Cereal Science, 2016, 69:77-84.
[8] 荆卉, 孙俊, 牟瑶瑶, 等.超声波物化效应及其对蛋白质改性的应用研究进展[J].中国食品学报, 2021, 21(6):321-330.JING H, SUN J, MU Y Y, et al.Research advance in physicochemical effect of ultrasonic and its application in protein modification[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(6):321-330.
[9] 胡爱军, 郑捷.食品超声技术[M].北京:化学工业出版社, 2013.HU A J, ZHENG J.Food Ultrasound Technology[M].Beijing: Chemical Industry Press, 2013.
[10] 刘昕, 金明良, 覃小丽, 等.超声处理对鹰嘴豆蛋白乳化性的影响[J].食品与发酵工业, 2018, 44(5):142-147.LIU X, JIN M L, QIN X L, et al.Effects of ultrasonic treatment on emulsifying properties of chickpea protein[J].Food and Fermentation Industries, 2018, 44(5):142-147.
[11] HAN T L, WANG M Y, WANG Y, et al.Effects of high-pressure homogenization and ultrasonic treatment on the structure and characteristics of casein[J].LWT, 2020, 130:109560.
[12] 张艳艳, 王冰蕊, 张少可, 等.超声波对花生粕蛋白功能特性及结构特性的影响[J].中国粮油学报, 2019, 34(8):48-53.ZHANG Y Y, WANG B R, ZHANG S K, et al.Effect of ultrasonic on the functional and structural characteristics of peanut meal protein[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):48-53.
[13] 耿军凤, 张丽芬, 陈复生.超声波辅助提取对花生蛋白结构与功能特性的影响[J].食品研究与开发, 2020, 41(9):61-69.GENG J F, ZHANG L F, CHEN F M.Effect of ultrasound-assisted extraction on the structure and functional properties of peanut protein[J].Food Research and Development, 2020, 41(9):61-69.
[14] 孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D].哈尔滨:东北农业大学, 2014.SUN Y J. Study on the effect of ultrasonic treatment on the structure and functional properties of soybean protein isolate[D]. Harbin: Northeast Agricultural University, 2014.
[15] WU Y Y, XIANG X L, LIU L, et al.Ultrasound-assisted succinylation comprehensively improved functional properties of egg white protein[J].LWT-Food Science and Technology, 2022, 171:114155.
[16] 梁晗妮. 豆类蛋白质的乳化性质及其结构—功能相关性研究[D].广州:华南理工大学, 2014.LIANG H N. Study on emulsifying properties and structure-function correlation of bean protein[D]. Guangzhou: South China University of Technology, 2014.
[17] RESENDIZ-VAZQUEZ J A, ULLOA J A, UR AS-SILVAS J E, et al.Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J].Ultrasonics Sonochemistry, 2017, 37:436-444.
AS-SILVAS J E, et al.Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit (Artocarpus heterophyllus) seed protein isolate[J].Ultrasonics Sonochemistry, 2017, 37:436-444.
[18] KARBASI M, ASKARI G, MADADLOU A.Effects of acetyl grafting on the structural and functional properties of whey protein microgels[J].Food Hydrocolloids, 2021, 112(9):106443.
[19] SREERAMA Y N, SASIKALA V B, PRATAPE V M.Nutritional implications and flour functionality of popped/expanded horse gram[J].Food Chemistry, 2008, 108(3):891-899.
[20] CHEN L, ZHANG S B.Structural and functional properties of self-assembled peanut protein nanoparticles prepared by ultrasonic treatment:Effects of ultrasound intensity and protein concentration[J].Food Chemistry, 2023, 413:135626.
[21] WANG Y C, LI B L, GUO Y N, et al.Effects of ultrasound on the structural and emulsifying properties and interfacial properties of oxidized soybean protein aggregates[J].Ultrasonics Sonochemistry, 2022, 87:106046.
[22] SEBII H, KARRA S, BLECKER C, et al.Effect of sonication and succinylation on rheological properties and secondary structures of date palm pollen protein concentrate[J].Rheologica Acta, 2021, 60(9):543-551.
[23] HU H, WU J H, LI-CHAN E C Y, et al.Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J].Food Hydrocolloids, 2013, 30(2):647-655.
[24] WANG S N, YANG J J, SHAO G Q, et al.pH-induced conformational changes and interfacial dilatational rheology of soy protein isolated/soy hull polysaccharide complex and its effects on emulsion stabilization[J].Food Hydrocolloids, 2020, 109:106075.
[25] 李滢溪. 超声构建花生分离蛋白-果胶乳液体系及其稳定机制研究[D].郑州:河南工业大学, 2023.LI Y X.Study on ultrasound construction of peanut protein isolate-pectin emulsion system and its stabilization mechanism[D].Zhengzhou:Henan University of Technology, 2023.
[26] 王艳珍, 张园园, 纵伟.超声处理对杜仲翅果蛋白结构及功能特性的影响[J].中国油脂, 2024,49(5):66-70.WANG Y Z, ZHANG Y Y, ZONG W.Effect of ultrasonic on the structure and functional properties of protein from Eucommia key-fruit seed[J].China Oils and Fats, 2024,49(5):66-70.
[27] WANG W, LI J S, YAN L J, et al.Effect of oxidization and chitosan on the surface activity of soy protein isolate[J].Carbohydrate Polymers, 2016, 151:700-706.
[28] DING Q Y, TIAN G F, WANG X H, et al.Effect of ultrasonic treatment on the structure and functional properties of mantle proteins from scallops (Patinopecten yessoensis)[J].Ultrasonics Sonochemistry, 2021, 79:105770.
[29] 张熙. 扫频超声波预处理对β-乳球蛋白酶解特性及聚集行为的影响机理研究 [D].镇江:江苏大学, 2019.ZHANG X. Study on the influence mechanism of swept-frequency ultrasonic pretreatment on the proteolytic characteristics and aggregation behavior of β-globule[D]. Zhenjiang: Jiangsu University, 2019.
[30] 许英一, 张微, 王宇, 等.超声对小麦麸皮蛋白结构和功能性质的影响[J].中国粮油学报, 2023, 38(10):53-61.XU Y Y, ZHANG W, WANG Y, et al.Effect of ultrasonic on structure and functional properties of wheat bran protein[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(10):53-61.