近年来,中国葡萄酒在全球酒类消费市场的份额不断增加,成为全球增长最快的葡萄酒消费市场之一。但目前国内外葡萄酒普遍存在的一个质量问题是酸度过高,会使葡萄酒口感酸涩粗糙(口感平淡,影响酒体稳定性并易滋生有害菌)[1-4]。为了解决这个问题,出现了物理降酸、化学降酸和生物降酸等方法[5-6]。其中,物理方法和化学方法效果不稳定,而生物降酸效果更好,且能够增加葡萄酒稳定性和提升酒的品质[7]。乳酸菌通过进行苹果酸-乳酸发酵(malolactic fermentation, MLF),可以有效地降低葡萄酒的酸度,增强其稳定性,并提升其口感[8-11],这也是生物降酸主要的方法之一。目前已有大量研究报道,乳酸菌引导的MLF可以降低葡萄酒酸度,同时保留葡萄香味,并且可以更好地控制发酵过程,确保葡萄酒的安全性和特殊风味[12]。
在苹乳发酵的过程中,众多类型的微生物发挥了降酸作用,主要涵盖4个属的菌种,包括乳杆菌属、明串珠球菌属、片球菌属以及酒球菌属[13-15]。利用微生物降酸的主要研究方向包括发酵菌种筛选、降酸菌株筛选、以及葡萄酒降酸菌株的应用等[10,16-17]。曹颖等[18]在葡萄酒中筛选出2株耐酸、耐乙醇且降酸能力优良的酒酒球菌;白玉峰等[19]筛选出13株具有强降解L-苹果酸能力的酵母菌,降酸率达到90%以上,但均为非酿酒酵母,发酵能力较弱;钟映雪等[20]利用帝伯仕乳酸菌进行MLF,在MLF开始前添加10 mg/L的乳酸菌降酸效果最好,能够最完整的保留葡萄酒的色度,并达到稳定的pH值。因此,降酸乳酸菌的筛选及其在葡萄酒MLF中的应用对葡萄酒的品质提升具有重要意义。
本研究从自制赤霞珠葡萄醪和自然发酵的葡萄酒中筛选乳酸菌。检验分析所筛菌株的生理和生化特性、进行分子生物学鉴定、分析苹果酸分解能力并测试菌株酿酒耐受性等特性,以期能获得一株具有良好MLF能力的酿酒乳酸菌,为新疆区域优质乳酸菌在MLF中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
试验选用以赤霞珠(于2022年8月27日在新疆昌吉葡萄园区采样)为原料制成的葡萄醪中的葡萄汁作为菌种筛选样品(新疆农业大学食品生物发酵与质量安全实验室)。进行酿造试验时,选取了实验室完成酒精发酵过程的葡萄酒,其基本理化指标为:酒精度13.4%vol;残糖3.6 g/L;总酸5.92 g/L。
1.1.2 试剂
商用乳酸菌FM1,法国SAS SOFRALAB OENOFRANCE公司;L-苹果酸含量检测试剂盒,上海雅吉生物科技有限公司;L-乳酸含量检测试剂盒,齐一生物科技(上海)有限公司;MRS肉汤、琼脂培养基,海博生物技术有限公司;琼脂粉,奥博星生物技术有限公司;酚酞指示剂、NaOH标准液等试剂均按照GB/T 603—2023《化学试剂 试验方法中所用制剂及制品的制备》进行制备;革兰氏染色液试剂盒,青岛高科技工业园海波生物技术有限公司;梅里埃碳水化合物鉴定试剂盒API 50 CH,上海华微泰达生物科技有限公司。
1.1.3 仪器与设备
DHP-e082电热恒温培养箱,上海一恒科学仪器有限公司;MJX-100B-Z型霉菌培养箱,上海博迅实业有限公司医疗设备厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;PTX-FA210电子天平,福州华志科学仪器有限公司;LDZX-50KBS型立式高压灭菌锅,上海申安医疗器械厂;ECLIPSE E200MV R光学显微镜,日本尼康公司。
1.2 实验方法
1.2.1 培养基与乳酸菌的分离纯化
MRS肉汤培养基(g/L):蛋白胨,10.0;牛肉浸粉,8.0;酵母浸粉,4.0;葡萄糖,20.0;磷酸氢二钾,2.0;柠檬酸氢二铵,2.0;乙酸钠,5.0;硫酸镁,0.2;硫酸锰,0.04;吐温80,1.0。
MRS琼脂培养基(g/L):蛋白胨,10.0;牛肉浸粉,8.0;酵母浸粉,4.0;葡萄糖,20.0;磷酸氢二钾,2.0;柠檬酸氢二铵,2.0;乙酸钠,5.0;硫酸镁,0.2;硫酸锰,0.04;琼脂,14.0;吐温80,1.0。
模拟葡萄酒的配制以浩楠等[9]和任晓宁[21]所使用的配比并进行调整(g/L):苹果酸,2.4;酒石酸,2.4;柠檬酸,0.4;无水葡萄糖,3.6;NaCl,0.2;H2SO4,1.0;KHPO4,2.0;MgSO4·7H2O,0.2;MnSO4,0.05;酵母浸粉,4;用1 mol/L NaOH调节模拟酒pH值至3.8。SO2(以偏重亚硫酸钾计)20 mg/L,灭菌后加入体积分数为10%的乙醇。
上述培养基均121 ℃灭菌20 min。
乳酸菌的纯化:对样品进行10倍梯度(10-1~10-6)稀释处理,稀释后,吸取0.1 mL的样品稀释液涂于MRS琼脂培养基上对菌株进行培养分离。37 ℃恒温培养箱中培养24~28 h,挑取分离培养基上菌落形态符合国标GB/T 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》中描述的乳白色、光滑、菌落直径<1 mm的单菌落,进行反复划线分离直至纯化。
1.2.2 菌株的鉴定
菌落、细胞形态学特征鉴定:观察筛选菌株颜色、边缘及表面光滑度;用平板划线法将筛选菌株接种至含有碳酸钙的MRS培养基,观察培养基溶钙圈的大小;按照GB/T 4789.28—2013《食品微生物学检验 培养基和试剂的质量要求》中革兰氏染色法进行菌种细胞的镜检观察。
过氧化氢酶实验和氧化酶试验:参照朱军莉[22]撰写的《食品安全微生物检验技术》书籍进行菌种的过氧化氢酶实验和氧化酶试验鉴定。
1.2.3 苹果酸分解能力测定
苹果酸分解能力[23]:在超净工作台中,将初筛菌株接种到含有L-苹果酸(质量浓度为3.0 g/L)的MRS液体培养基中。提前将层析滤纸进行酸化处理(1 mol/L醋酸溶液浸泡7 d,1∶1丙酮乙酸溶液浸泡10 d后进行干燥),进行纸层析监测(1 d/次)观察苹果酸、酒石酸和乳酸斑点变化。
1.2.4 遗传稳定试验
将初筛得到的菌株进行遗传稳定性试验(4次连续传代培养),菌株以107 CFU/mL接种量接种。
1.2.5 API 50CH鉴定与分子生物学鉴定
筛选的菌种使用API 50CH碳水化合物鉴定试剂盒进行种属鉴定,并进行16S rDNA基因分析鉴定。
1.2.6 菌株耐受性筛选
对pH值、SO2质量浓度、乙醇浓度和发酵温度适应性筛选:将筛选出的菌株以107 CFU/mL接种量[10]接种至pH值、SO2质量浓度、乙醇体积分数和发酵温度不同的模拟葡萄酒中进行培养,观察菌株生长情况,并使用紫外可见分光光度计对OD600值进行测定。每个试验重复3次。
1.2.7 菌株降酸能力测定
降酸能力测定:在模拟酒中接种107 CFU/mL的浓度的待检测菌株,于22 ℃下恒温培养。采用酸碱滴定法进行监测,于50 mL蒸馏水和100 μL酚酞指示剂中加入2 mL样品(每24 h取1次发酵样品),用0.05 mol/L NaOH标准溶液进行滴定计算。结果以酒石酸计(g/L),每个试验重复3次。
1.2.8 菌株酿造验证试验
在酒精发酵结束的葡萄酒中分别接种已筛选出的菌株和商用乳酸菌(接种量为107 CFU/mL),启动MLF发酵,并进行22 ℃恒温发酵,MLF结束后使用L-苹果酸试剂盒和L-乳酸试剂盒测定相关含量。每个试验重复3次。
2 结果与分析
2.1 菌株分离纯化与鉴定
通过分离纯化,初步得到各类菌株30株,通过对其革兰氏染色(gram staining, GS)和镜检(表1)可知,有14株菌株其革兰氏染色呈阳性,氧化氢酶试验(catalase text, CAT)和氧化酶试验(oxidase text, OXT)均表现为阴性,符合对乳酸菌过氧化氢酶试验和氧化酶试验的描述。所得10株菌株菌落形态见图1。

图1 菌落形态
Fig.1 Colonial morphology
表1 菌株生化试验结果
Table 1 Biochemical test results of strain

注:+表示阳性;-表示阴性;空值表示因菌株革兰氏染色为阴性,故不进行后续过氧化氢酶试验和氧化酶试验。
编号GS及镜检CATOXT编号GS及镜检CATOXTSR-1G-,长杆,成对N37-1G+,短杆,单个,成对短链--TR-1G+,椭圆,成短链+-N37-2G-,短杆,成对TR-2G+,椭圆,成短链+-N37-3G-,短杆,单个,偶成对TR-3G+,球形,成链--N41-1G+,短杆,单个,成对短链+-TR-4G+,球形,成链--N41-2G-,短杆,成对NR-1G+,球形,单个--N41-3G-,细长杆,单个NR-3G-,长杆,单个N41-4G-,细长杆,单个NR-4G-,短杆,成对M37-1G-,短杆,单个,偶成对MR-1G+,细长杆,单个,偶成对--M37-2G-,杆状,单个,偶成对MR-3G-,球形,成链M37-3G-,短杆,成对MR-4G-,短杆,成对或短链M37-4G-,短杆,单个,偶成对T37-1G-,弯杆,成对或短链T41-1G+,细长杆,单个,偶成对+-T37-2G+,短杆,单个,成对短链--T41-2G+,短杆,单个,成对短链--T37-3G+,短杆,单个,成对短链--T41-3G+,短杆,单个,成对短链--T37-4G+,短杆,单个,成对短链--T41-4G-,短杆,单个,偶成对
2.2 分子生物学鉴定
2.2.1 菌株糖发酵利用检验
参考李奇[24]的方法,利用API 50CH梅里埃碳水化合物鉴定试剂盒对上述10株菌株进行碳源利用试验[25],结果如表2所示。根据API CH50试剂盒检测判读结果,试验菌株归属于3个种,即菌株TR-3、TR-4和MR-1可能为植物乳杆菌;菌株NR-1可能为乳酸乳球菌;菌株T37-2、T37-3、T37-4、N37-1、T41-2和T41-3为唾液利乳杆菌。同时,根据其碳源利用情况进行聚类分析(图2),判定其分为7个聚类单元,略与API 50结果有差异,具体种属与亲缘关系还需根据16S rDNA序列鉴定情况进行判定。
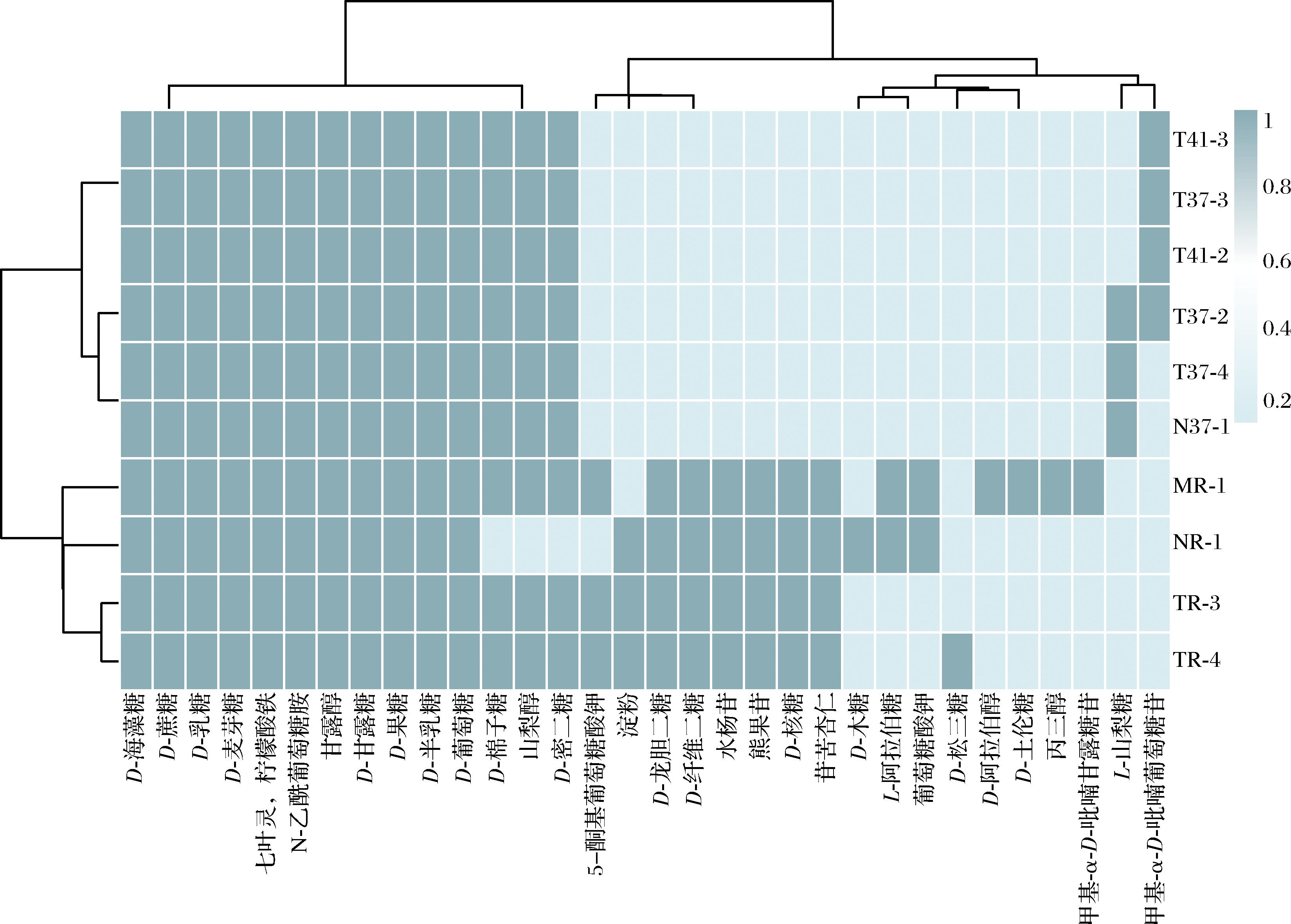
图2 菌株碳源利用聚类热图
Fig.2 Cluster heat map of carbon source utilization of strains
表2 菌株碳水化合物发酵试验结果
Table 2 The results of carbohydrate fermentation test of strain

注:+:阳性,可利用该碳源;-:阴性,不可利用该碳源。
碳源TR-3TR-4NR-1MR-1T37-2T37-3T37-4N37-1T41-2T41-3丙三醇---+------L-阿拉伯糖--++------D-核糖++++------D-木糖--+-------D-半乳糖+++++++++-D-葡萄糖++++++++++D-果糖++++++++++D-甘露糖++++++++++L-山梨糖----+-++-+甘露醇+++++++++-山梨醇++-+++++++葡萄糖酸钾--++------D-土伦糖---+------N-乙酰葡萄糖胺++++++++++甲基-α-D-吡喃甘露糖苷---+-----+甲基-α-D-吡喃葡萄糖苷----++--+-熊果苷++++-----+水杨苷++++------苦杏仁苷++++-----D-麦芽糖++++++++++D-乳糖++++++++++D-密二糖++-+++++++D-蔗糖++++++++++D-海藻糖++++++++++D-松三糖-+--------D-棉子糖++-+++++++淀粉+++-------D-龙胆二糖++++------D-纤维二糖++++------D-阿拉伯醇---+------七叶灵、柠檬酸铁++++++++++5-酮基葡萄糖酸钾++-+------
2.2.2 菌株分子生物学鉴定
将所获得菌株16S rDNA序列在NCBI中用BLAST进行比对,用MEGA 7软件构建系统发育树(图3)。菌株结果如下:菌株TR-3和TR-4为巴氏链球菌(Streptococcus gallolyticus);NR-1菌株为乳酸乳球菌(Lactococcus lactis);MR-1菌株为植物乳杆菌(Lactiplantibacillus plantarum);菌株T37-2、T37-3、T37-4、N37-1、T41-2、T41-3为唾液联合乳杆菌(Ligilactobacillus salivarius)。同时,结合菌株碳源利用情况分析,表明试验获得的巴氏链球菌和唾液利乳杆菌存在分离株间碳源利用差异。

图3 初筛菌株的基因系统进化发育树图谱
Fig.3 Genetic phylogenetic developmental tree of initial screening strains
MA等[26]和PEREIRA等[27]研究表明,巴氏链球菌是一种人畜共患病原菌,可引起人和动物的脑膜炎、心内膜炎和菌血症等疾病。因此,筛去TR-3和TR-4菌株,选用其余8株菌株进行深一步研究。
2.3 苹果酸分解能力测定
用纸层析法[28]进行菌株苹果酸分解能力检测,得出菌株发酵至48 h和96 h时苹果酸斑点大小。由表3可知,共有5株菌株具有苹果酸分解能力,分别为NR-1、MR-1、T37-2、N37-1和T41-2。在48 h时,菌株NR-1、MR-1、T37-2、N37-1和T41-2的纸层析苹果酸斑点面积与对照纸层析结果相比减少50%;96 h时,菌株NR-1和MR-1的苹果酸斑点基本消失;在发酵时长48 h和96 h时,菌株T37-3、T37-4和T41-3均未观测到苹果酸斑点减小。
表3 菌株对苹果酸降解能力
Table 3 The ability of the strain to degrade Malic acid

注:++表示苹果酸斑点面积与对照相比减少相当;+表示苹果酸斑点面积与对照相比减少50%;-表示纸层析未观测到苹果酸斑点。
编号48 h96 h编号48 h96 hNR-1+-T37-4++++MR-1+-N37-1++T37-2++T41-2++T37-3++++T41-3++++
综上所述,菌株NR-1和MR-1表现出较强的苹果酸分解能力,菌株T37-2、N37-1和T41-2具有苹果酸分解能力,而菌株T37-3、T37-4和T41-3在所观察的时间段内未表现出苹果酸降解能力,故选取5株具有苹果酸分解能力的菌株进行深一步研究。
2.4 菌株耐受性分析
对前述确定的5株菌进行pH值、SO2质量浓度、无水乙醇的体积分数以及发酵温度的菌株耐受度研究。
2.4.1 菌株pH耐受性
干红葡萄酒的pH值多为3.4~3.6,配制pH值为3.0~4.0的模拟酒,从而判定菌株的pH耐受性。由图4可知,随pH值提高,菌株的OD600值呈上升趋势。当pH值为3.0~4.0时,菌株MR-1和NR-1表现出与商品菌株FM1相似的生长活性。值得注意的是,在pH值为3.2和3.4时,菌株MR-1(OD600值分别为0.015和0.034)表现出较FM1(OD600值分别为0.013和0.033)更好的pH耐受性;在pH值为3.2时,菌株NR-1表现出与商业菌株FM1相似的耐受性;在pH值为3.4时,菌株N37-1表现出与商业菌株FM1相似的耐受性。其余3株菌株(T37-2、N37-1和T41-2)OD600值与商品菌株FM1表现出显著差异性,表现出较弱的菌株pH耐受性。

图4 菌株pH耐受性
Fig.4 pH tolerance of the strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4.2 菌株对SO2质量浓度的耐受性
由图5可得,随SO2质量浓度的增加,测试菌株的OD600值逐渐降低,说明菌株的生长繁殖能力会因SO2质量浓度的增加而衰减。菌株MR-1较商品菌株FM1的耐受性较为相似,SO2质量浓度为20~70 mg/L时,均表现出较FM1更好的耐受性,其OD600值为0.821~0.585。在SO2质量浓度为20 mg/L时,菌株NR-1所展现出的SO2耐受性(OD600值为0.789)比商品菌株FM1更强;当SO2质量浓度>30 mg/L时,菌株NR-1表现出较MR-1与FM1弱的SO2耐受性,但其生长活性高于其余3株筛选菌株;表明菌株NR-1在含有较少SO2含量下的葡萄酒中具有较强的耐受性。其余菌株T37-2、N37-1和T41-2相较于菌株FM1在一定SO2浓度下均表现出较差的耐受性。
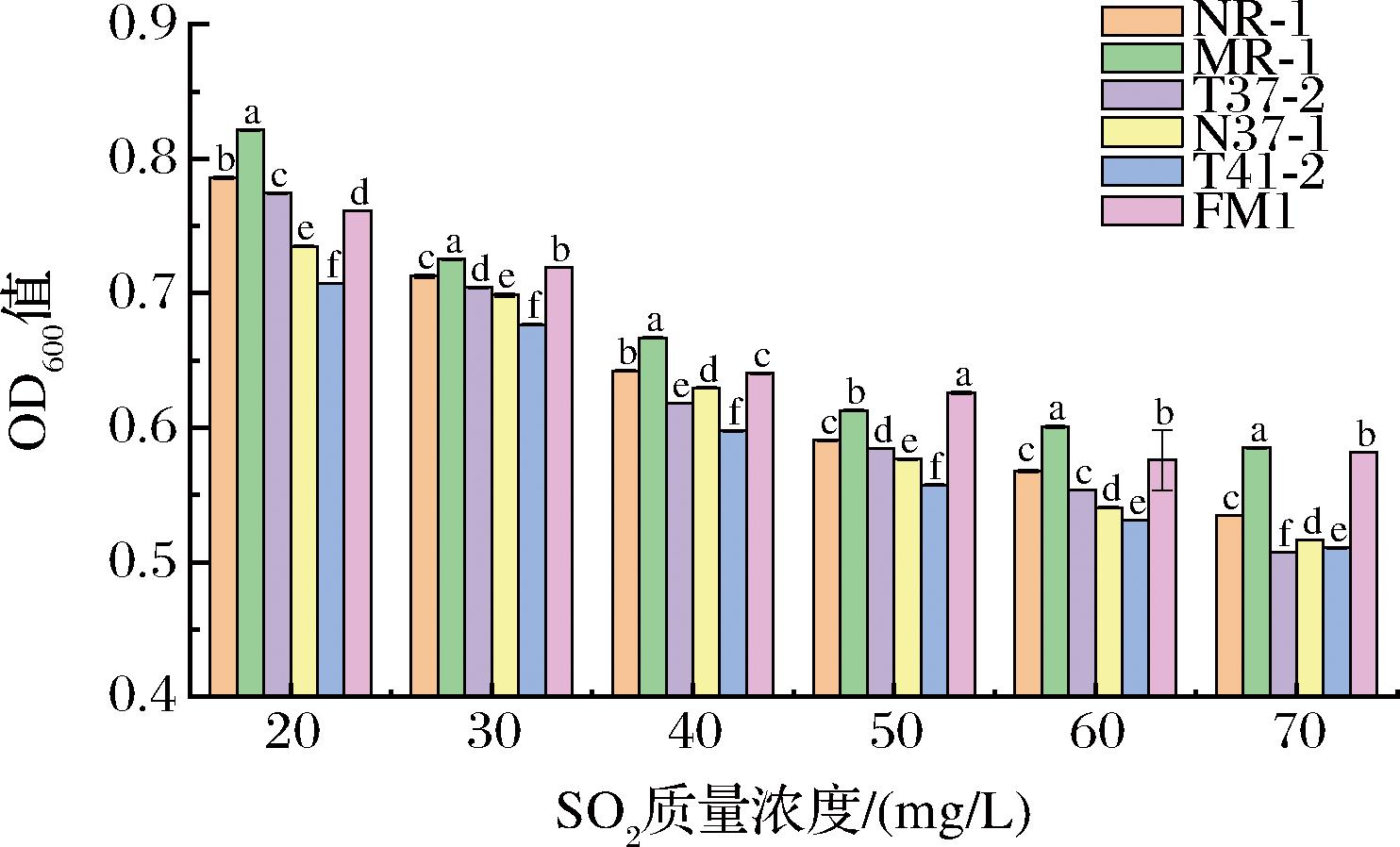
图5 菌株SO2浓度的耐受能力
Fig.5 The tolerance of strain to SO2 concentration
2.4.3 菌株对乙醇体积分数的耐受性
在葡萄酒的苹乳发酵过程中,乙醇的体积比例是影响乳酸菌生长的关键因素。通常,葡萄酒的酒精度为12%vol~14%vol。当乙醇体积分数达到10%时,就会抑制菌种的生长。如图6所示,乙醇体积分数的增加会削弱菌株的繁殖能力。当乙醇体积分数为6%~12%时,菌株MR-1表现出较菌株FM1更好的耐受性,其OD600值为0.058~0.029,在乙醇体积为14%~16%时,MR-1菌株与商业菌FM1有相似的耐受性,MR-1菌株的OD600值为0.021~0.014。N37-1菌株在酒精度为6%时(OD600值为0.057),表现出较FM1菌株更好的耐受性,但当乙醇体积为8%~16%时,其耐受力较FM1菌株低。当乙醇体积分数>12%时,所有菌株活性均受到强烈抑制,除MR-1和N37-1菌株外,其他3株筛选菌株的OD600值与商品菌株差异明显。

图6 菌株的乙醇耐受能力
Fig.6 Ethanol tolerance of the strains
2.4.4 菌株对发酵温度的耐受性
干红葡萄酒的苹乳发酵温度为18~20 ℃。如图7 所示,在所选限度内,发酵温度与菌株的OD600值存在正相关关系(菌株的生长能力随着发酵温度升高而增强)。MR-1菌株与商业菌株FM1在不同的发酵温度条件下生长能力基本持平(OD600值为0.023~0.073)。当发酵温度为20~22 ℃时,NR-1菌株与FM1菌株的生长能力相近(OD600值分别为0.044、0.064、0.070),但当温度下降至17~19 ℃,其OD600值与FM1菌株差异显著,其在较低温环境下生长能力相对较弱。其余3株菌株(T37-2、N37-1、T41-2菌株)在不同的温度下,其OD600值都表现出较商业菌株FM1更大的差异性,表明其在低温条件下生长能力弱。

图7 菌株的温度耐受能力
Fig.7 Temperature tolerance of the strains
2.4.5 菌株降酸能力试验
对上述5株菌株(NR-1、MR-1、T37-2、N37-1和T41-2)进行降酸能力测定,并与商业菌株FM1测定结果做对比,结果见图8。由图8可知,发酵总过程中的总酸含量随发酵时间的延长呈逐步减小的趋势。当发酵时间处于第2~3天时,菌株NR-1和MR-1的总酸含量均降低了0.82 g/L,菌株N37-1的总酸含量降低了0.59 g/L,其余菌株总酸含量下降缓慢。发酵至第8天时,菌株MR-1较所有菌株的发酵液中总酸含量更低,其总酸含量为3.51 g/L;菌株NR-1(3.75 g/L)的发酵液总酸含量略高于商业菌株FM1(3.63 g/L);菌株N37-1的发酵液总酸含量为3.86 g/L,高于商业菌株FM1。从整体看,商业菌株FM1降酸速率较稳定,菌株MR-1和NR-1降酸效果良好,虽然菌株N37-1降酸速率较快,但是过程不稳定,且于第8天时总酸含量略高于菌株NR-1。

图8 菌株的降酸能力
Fig.8 Acid-reducing ability of strains
2.4.6 菌株酿造试验
由上述耐受性试验选出菌株NR-1和MR-1进行葡萄酒MLF发酵,与未进行MLF发酵及商业菌株FM1发酵葡萄酒的样品进行对比。由表4可知,进行MLF过程的葡萄酒与未进行MLF发酵的葡萄酒中L-苹果酸和L-乳酸含量具有显著差异。与商品菌株FM1发酵酒样相比,菌株NR-1、MR-1发酵葡萄酒样中L-苹果酸和L-乳酸含量具有差异。菌株MR-1发酵酒样中L-苹果酸含量下降了2.368 g/L,L-乳酸含量上升了1.08 g/L;菌株NR-1发酵酒样中L-苹果酸含量下降了2.298 g/L,L-乳酸含量上升了1.044 g/L;商业菌株FM1发酵酒样中L-苹果酸含量下降了2.348 g/L,L-乳酸含量上升了0.999 g/L。由表4可知,菌株MR-1能够很好地参与L-苹果酸与L-乳酸的碳源循环。
表4 葡萄酒中L-苹果酸和L-乳酸含量
Table 4 L-malic acid and L-lactic acid content in wine

酒样L-苹果酸/(g/L)L-乳酸/(g/L)未MLF2.430±0.052a0.501±0.041cNR-10.132±0.061b1.545±0.064aMR-10.062±0.051d1.581±0.067aFM10.082±0.023c1.500±0.038b
3 结论
葡萄酒MLF阶段对葡萄酒质量起着重要的作用,有效的MLF能使葡萄酒更稳定,降低葡萄酒酸度,从而提高葡萄酒品质[29]。目前,对于葡萄酒MLF发酵中菌株的应用研究集中在酒酒球菌与酿酒酵母共发酵体系中菌种之间的相互作用,以及通过改变酒酒球菌的接种方式和比例探究最佳发酵工艺来提高葡萄酒的品质等方面。在MLF过程中,酒酒球菌[30]必然会受到低pH值和高酒精度等胁迫因素的影响,导致MLF进程不完全,从而影响葡萄酒品质。因此,为了在MLF发酵过程顺利进行并降低葡萄酒的酸度,需要选择适应性较强且具备良好降酸能力的野生菌株。目前国内外在MLF阶段菌株的筛选仍集中在野生优良酒酒球菌的筛选和酒酒球菌的诱变,而对于其他野生优良乳酸菌的研究较少。浩楠等[31]通过筛选得到8株具有优良抗逆性的酒酒球菌,该研究中8株菌株均在14%乙醇体积分数、pH值为3.2的环境下具有良好耐受性。吴晓秋等[32]采用紫外诱变筛选出3株具有乙醇和酸耐受性良好的酒酒球菌,经过模拟酒MLF试验发现,诱变菌株中苹果酸含量是出发菌株的84.9%。
葡萄酒MLF阶段下,乳酸菌会受到低pH、高SO2质量浓度、高乙醇含量等环境的胁迫,在胁迫条件下,乳酸菌表现出细胞膜完整性受损、关键酶活力降低和正常生理代谢调控异常等现象,从而致使葡萄酒无法正常进行MLF发酵[33-35]。本研究成功地从葡萄醪和葡萄酒中分离出5株具有降酸苹果酸能力的菌株,分别为1株乳酸乳球菌、1株植物乳杆菌和3株唾液利乳杆菌,对其在低pH、高SO2质量浓度、高乙醇含量和低发酵温度等胁迫条件下的生长性能进行分析。研究结果表明,5株乳酸菌在低pH值(3.4)、高SO2含量(70 mg/L)、高乙醇含量(12%)和低发酵温度(18 ℃)下均具有良好的生长性能,最低可耐受pH 3.0的胁迫环境,并且表现出较强的乙醇耐受性(16%)。与吴晓秋等[31]筛选出的诱变菌株相比,本研究通过筛选所得的乳酸菌能够在更低的pH和高乙醇含量中表现出良好的生长性能,通过对5株乳酸菌进行降酸能力测定分析,发现5株乳酸菌均具有良好的降酸能力,其中菌株MR-1累计总酸含量降低最多,为2.34 g/L,是商业菌株FM1的1.05倍,菌株NR-1累计总酸含量降低较商业菌株FM1次之,为2.11 g/L,是商业菌株的94.73%。此外,本研究通过胁迫条件下5株菌株的生长性能比较筛选得到植物乳杆菌MR-1和乳酸乳球菌NR-1,针对2株菌株进行菌株MLF酿造试验。从研究结果发现,菌株MR-1和NR-1对L-苹果酸具有较强的降解能力,分别达到97.44%和94.56%,邵睿等[36]采用紫外诱变筛选出3株耐受14%乙醇含量的酒酒球菌,其中突变菌株Uve2在经模拟酒MLF后,苹果酸含量是出发菌株的46%,与其研究结果相较,本试验所筛选菌株MR-1和NR-1的降酸能力分别提高了43.44%和40.56%。
综上所述,本试验所筛菌株乳酸乳球菌NR-1和植物乳杆菌MR-1表现出较好的发酵耐受性。其中,菌株MR-1在处于低发酵温度(17 ℃)、高SO2含量(70 mg/L)和高酒精度(16%vol)的条件下,表现出较商业菌株略强的苹果酸-乳酸发酵特性,在葡萄酒MLF发酵过程中对L-苹果酸降解达到97.44%,该菌株在一定程度上解决了新疆葡萄酒苹果酸含量较高的现状,为后期研究相关菌株提升葡萄酒风味品质能力提供一定的理论依据,为提升新疆天山北麓葡萄酒产区的影响力奠定一定的技术支撑。
[1] 何丹, 马欣娟, 康强, 等. 有机酸含量对葡萄酒发酵的影响[J]. 中国酿造, 2022, 41(10):62-67.HE D, MA X J, KANG Q, et al. Effects of organic acids content on the fermentation of wine[J]. China Brewing, 2022, 41(10):62-67.
[2] 雷蕾, 郑海武, 李正英, 等. 不同酿酒酵母发酵对干红葡萄酒品质的影响[J]. 中国酿造, 2021, 40(6): 41-45.LEI L, ZHENG H W, LI Z Y, et al. Effects on quality of dry red wine fermented by different Saccharomyces cerevisiae strains[J]. China Brewing, 2021, 40(6): 41-45.
[3] 马旭艺. 化学协同生物法山葡萄酒降酸工艺的研究[D]. 哈尔滨: 东北农业大学, 2018.MA X Y. Study on deacidification technology of mountain wine by chemical synergistic biological method[D]. Harbin: Northeast Agricultural University, 2018.
[4] 高鹏飞. 东北山葡萄酒优良MLF菌种筛选及降酸工艺研究[D]. 佳木斯: 佳木斯大学, 2018.GAO P F. Screening of excellent MLF strains from Northeast Mountain wine and study on deacidification technology[D]. Jiamusi: Jiamusi University, 2018.
[5] 于潇淳, 徐晶, 李明, 等. 葡萄酒生物降酸机制及发酵策略研究进展[J]. 中国酿造, 2023, 42(8):28-32.YU X C, XU J, LI M, et al. Advances on mechanism and fermentation strategy of biological deacidification in wine[J]. China Brewing, 2023, 42(8):28-32.
[6] 刘鸿, 陈静, 李雅善, 等. 不同降酸剂处理对葡萄酒中赭曲霉毒素A含量的影响[J]. 中国果菜, 2021, 41(6):126-131.LIU H, CHEN J, LI Y S, et al. Effects of different acid-reducing agents on ochratoxin A content in wine[J]. China Fruit &Vegetable, 2021, 41(6):126-131.
[7] 冯倩, 张燕, 赵轶男. 发酵果酒降酸工艺优化[J]. 酿酒科技, 2021(2):27-31.FENG Q, ZHANG Y, ZHAO Y N. Optimization of acid-reducing process of fermented fruit wine[J]. Liquor-Making Science &Technology, 2021(2):27-31.
[8] 甄会英, 王颉, 李长文, 等. 苹果酸-乳酸发酵在葡萄酒酿造中的应用[J]. 酿酒科技, 2005(3):75-77; 79.ZHEN H Y, WANG J, LI C W, et al. Application of malolactic fermentation in wine production[J]. Liquor-making Science &Technology, 2005(3):75-77;79.
[9] 浩楠, 马腾臻, 贠建民, 等. 甘肃河西走廊产区野生乳酸菌筛选及酿酒特性研究[J]. 食品与发酵工业, 2019, 45(10):142-148.HAO N, MA T Z, YUN J M, et al. Isolation and brewing characteristics of wild-type lactic acid bacteria from Gansu Hexi Corridor[J]. Food and Fermentation Industries, 2019, 45(10):142-148.
[10] 张煜晨, 张丹丹, 林可, 等. 苹果酸-乳酸发酵中乳酸菌的分离及其对葡萄酒香气成分的影响[J]. 食品与发酵工业, 2020, 46(15):84-92.ZHANG Y C, ZHANG D D, LIN K, et al. Isolation of lactic acid bacteria from malolactic fermentation and their effect on the aroma compounds of wine[J]. Food and Fermentation Industries, 2020, 46(15):84-92.
[11] 侯冬冬, 刘朋, 赵祥忠, 等. 酒酒球菌在葡萄酒中的应用研究进展[J]. 食品研究与开发, 2021, 42(24):213-217.HOU D D, LIU P, ZHAO X Z, et al. Research progress on application of Oenococcus oeni in wine[J]. Food Research and Development, 2021, 42(24):213-217.
[12] 姜欢笑, 郭建华, 时小棠, 等. 果酒中有机酸成分分析及降酸技术研究现状[J]. 现代食品, 2020, 26(9):10-14.JIANG H X, GUO J H, SHI X T, et al. The research status of organic acids composition analysis and acid reduction technology in fruit wine[J]. Modern Food, 2020, 26(9):10-14.
[13] WEI R T, WANG L, DING Y T, et al. Natural and sustainable wine: A review[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(26):8249-8260.
[14] 孙晓璐, 杨永学, 郭斌, 等. 发酵葡萄酒中菌种的分离鉴定及糖类耐受性的探究[J]. 阜阳师范大学学报(自然科学版), 2021, 38(2):79-84.SUN X L, YANG Y X, GUO B, et al. Isolation and identification of yeasts from naturally fermented wine and their sugar toleranc[J]. Journal of Fuyang Normal University (Natural Science), 2021, 38(2):79-84.
[15] 徐佳敏, 周桂珍, 田晓菊. 葡萄酒酿造中降解生物胺乳酸菌的筛选、鉴定及其特性[J]. 食品与发酵工业, 2022, 48(21):48-53.XU J M, ZHOU G Z, TIAN X J. Screening, identification, and characteristics of lactic acid bacteria with biogenic amines degrading activity in wine brewery[J]. Food and Fermentation Industries, 2022, 48(21):48-53.
[16] 邹静, 孟军, 张建才, 等. 葡萄酒用乳酸菌的分离筛选及应用性能初探[J]. 酿酒科技, 2018(12):45-51; 56.ZOU J, MENG J, ZHANG J C, et al. Isolation of lactic acid bacteria strains for wine production &study of their properties[J]. Liquor-Making Science &Technology, 2018(12):45-51; 56.
[17] 陆文轩, 张碧颖, 巴旦加布, 等. 植物乳杆菌在不同品种葡萄酒中苹果酸乳酸发酵性能的评价[J]. 食品与发酵工业, 2022, 48(12):82-89;96.LU W X, ZHANG B Y, BA D, et al. Evaluation on malolactic fermentation performance of Lactobacillus plantarum in wine fermentation with different grape varieties[J]. Food and Fermentation Industries, 2022, 48(12):82-89; 96.
[18] 曹颖, 郑玉娟, 刘龙祥, 等. 葡萄酒苹果酸-乳酸发酵优良菌株的筛选与发酵性能分析[J]. 食品研究与开发, 2021, 42(11):138-144.CAO Y, ZHENG Y J, LIU L X, et al. Isolation and characterization of autochthonous Oenococcus oeni from a Chinese native grape variety[J]. Food Research and Development, 2021, 42(11):138-144.
[19] 白玉峰, 张文霞, 田亚楠, 等. 宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J]. 中国酿造, 2021, 40(1):49-54.BAI Y F, ZHANG W X, TIAN Y N, et al. Screening of yeast strains with L-malic acid degradation ability from Eastern Foothills of Helan in Ningxia[J]. China Brewing, 2021, 40(1):49-54.
[20] 钟映雪, 张晓芳, 杨瑞群, 等. 降酸酵母结合乳酸菌对‘黑虎香’葡萄酒酸度的影响[J]. 中外葡萄与葡萄酒, 2019(6):26-33.ZHONG Y X, ZHANG X F, YANG R Q, et al. Effect of acid-reducing yeast combining Lactobacillus on acid of ‘Fox’ wine[J]. Sino-Overseas Grapevine &Wine, 2019(6):26-33.
[21] 任晓宁. 不同发酵条件对酒酒球菌柠檬酸代谢产物的影响[D]. 杨凌: 西北农林科技大学, 2016.REN X N. Effects of different fermentation conditions on citric acid metabolites of Oenococcus oeni[D]. Yangling: Northwest A &F University, 2016.
[22] 朱军莉. 食品安全微生物检验技术[M]. 杭州: 浙江工商大学出版社, 2020.
[23] 张诗玲, 徐瑞敏. 红葡萄酒苹果酸-乳酸发酵控制与检验方法[J]. 酿酒, 2007, 34(6):84-85.ZHANG S L, XU R M. Control and inspection method of malic acid-lactic acid fermentation of red wine[J]. Liquor Making, 2007, 34(6):84-85.
[24] 李奇. 20株乳酪杆菌的鉴定及生长性能评价[D]. 哈尔滨: 东北农业大学, 2023.LI Q. Identification and growth performance evaluation of 20 strains of Lactobacillus casei[D]. Harbin: Northeast Agricultural University, 2023.
[25] 姚纲, 张健鹏, 胡红焱, 等. 用API50CH系统鉴定9株产高光学纯度D-乳酸野生菌株[J]. 中国实用医药, 2014, 9(8):263-265.YAO G, ZHANG J P, HU H Y, et al. Identification of 9 wild strains producing high optical purity D-lactic acid by API50CH system[J]. China Practical Medicine, 2014, 9(8):263-265.
[26] MA M H, WANG S Y, ZHU X C, et al. The identification of Streptococcus pasteurianus obtained from six regions in China by multiplex PCR assay and the characteristics of pathogenicity and antimicrobial resistance of this zoonotic pathogen[J]. Pathogens, 2023, 12(4):615.
[27] PEREIRA C, NOGUEIRA F, CUNHA MARQUES J, et al. Endocarditis by Streptococcus pasteurianus[J]. Cureus, 2023: 15(2): e34529.
[28] 赵永春, 袁猛, 袁晓林, 等. 红葡萄酒中苹果酸测定方法的比较[J]. 中外葡萄与葡萄酒, 2019(6):47-50.ZHAO Y C, YUAN M, YUAN X L, et al. Comparison of determination methods of malic acid in red wine[J]. Sino-Overseas Grapevine &Wine, 2019(6):47-50.
[29] 盖昱梓. 宁夏贺兰山东麓产区优良苹果酸-乳酸发酵细菌筛选及其酿酒特性研究[D]. 银川: 宁夏大学, 2021.GAI Y Z. Screening of excellent malolactic fermentation bacteria and study on their wine-making characteristics in the eastern foot of Helan Mountain in Ningxia[D]. Yinchuan: Ningxia University, 2021.
[30] 张莉方, 徐宁莉, 陶瑾, 等. 高耐酸酒酒球菌常压室温等离子体诱变选育及其苹果酸-乳酸发酵研究[J]. 微生物学报, 2023, 63(10):4000-4015.ZHANG L F, XU N L, TAO J, et al. Atmospheric and room temperature plasma mutagenesis and malolactic fermentation of highly acid-tolerant Oenococcus oeni[J]. Acta Microbiologica Sinica, 2023, 63(10):4000-4015.
[31] 浩楠, 唐雅利, 邱子轩, 等. 贺兰山东麓中部产区优良抗逆葡萄酒乳酸菌的分离筛选及酿酒特性研究[J]. 食品与发酵工业, 2023, 49(16):9-18.HAO N, TANG Y L, QIU Z X, et al. Screening and fermentation characteristic of lactic acid bacteria from the wine region of central East Foot of Helan Mountain[J]. Food and Fermentation Industries, 2023, 49(16):9-18.
[32] 吴晓秋, 刘龙祥, 邵睿, 等. 紫外诱变法选育酒酒球菌酸-乙醇胁迫耐受菌株[J]. 食品科技, 2022, 47(4):14-19. WU X Q, LIU L X, SHAO R, et al. Breeding of acid-ethanol stress tolerance Oenococcus oeni by UV mutagenesis[J]. Food Science and Technology, 2022, 47(4):14-19.
[33] 盖昱梓, 孙静娴, 黄刚, 等. 苹果酸-乳酸发酵细菌乙醇胁迫应答机制研究进展[J]. 食品与发酵工业, 2021, 47(3):288-293. GAI Y Z, SUN J X, HUANG G, et al. The response mechanism of bacteria to ethanol stress in malolactic fermentation[J]. Food and Fermentation Industries, 2021, 47(3):288-293.
[34] 谢昉书. 诱变酒酒球菌菌株苹果酸—乳酸发酵及其对葡萄酒香气的影响[D]. 杨凌: 西北农林科技大学, 2018.XIE F S. Malic acid-lactic acid fermentation of mutant alcoholicus strain and its effect on wine aroma[D]. Yangling: Northwest A &F University, 2018.
[35] 谢昉书, 文向圆, 刘树文. 酒酒球菌(Oenococcus oeni)耐酸突变株苹果酸-乳酸发酵能力分析[J]. 食品科学, 2019, 40(2):93-101.XIE F S, WEN X Y, LIU S W. Malolactic fermentation ability of acid-tolerant mutant strain of Oenococcus oeni[J]. Food Science, 2019, 40(2):93-101.
[36] 邵睿, 张倩, 宋炜钰, 等. 紫外诱变法选育酒酒球菌乙醇胁迫耐受菌株及其发酵性能研究[J]. 中国酿造, 2022, 41(7):71-75.SHAO R, ZHANG Q, SONG W Y, et al. Breeding of Oenococcus oeni strain with ethanol tolerance by UV mutagenesis and its fermentation performance[J]. China Brewing, 2022, 41(7):71-75.