口腔中栖居的微生物群落,对宿主健康起着重要的作用。口腔菌群失衡,不仅会造成口腔感染,如咽炎、口臭、龋齿、牙周炎和外源性感染,还可能增大身体其他部位疾病的发生率,如肠道疾病、感染性心内膜炎、菌血症和过敏性疾病等[1-3]。目前,口腔感染主要采用抗生素治疗,但考虑到抗生素滥用的现象,需要开发出超窄谱或物种特异性的抗菌物质,以提高治疗效果,同时降低药物诱导耐药细菌和菌群失调的风险[4]。
细菌素是由核糖体合成的多肽或蛋白质,对与它们亲缘关系较近的微生物具有抗菌活性,因其低毒副作用、易被人体消化和不产生耐药性等特点而受到关注[5]。乳酸菌产生的细菌素被认为是减少抗生素耐药菌产生的潜在方案。其中,作为肠道共生菌群的肠球菌被广泛用作食品添加剂或益生菌,例如,“妈咪爱”、Symbioflor 1和Bioflorin用于治疗肠道疾病[6-7];粪肠球菌L2B21K3因其产细菌素而被用于控制奶酪成熟过程中单核细胞增生李斯特菌的污染[8]。细菌素主要分为三大类,即Ⅰ类羊毛硫细菌素(属于修饰多肽,分子质量<5 kDa)、Ⅱ类非羊毛硫细菌素(属于非修饰多肽,分子质量<10 kDa)和Ⅲ类大分子类细菌素(分子质量>30 kDa)[9]。已报道的肠球菌素主要为Ⅱ类细菌素,如肠球菌素P、肠球菌素B和肠球菌素L50等[10]。
本研究从健康志愿者唾液中分离到一株屎肠球菌ID4,其产生的细菌素能杀灭部分引起口腔感染的致病菌,对该菌株细菌素的性质、作用机制以及安全性进行了初步研究,为进一步开发其细菌素作为口腔治疗剂提供依据。
1 材料与方法
1.1 菌株、材料与试剂
菌株:屎肠球菌(Enterococcus faecium)ID4(CGMCC 28567)分离自健康志愿者唾液样本;空腔诺卡氏菌(Nocardia coeliaca)BD 7184、金黄色葡萄球菌(Staphylococcus aureus)BDSA 041、单增李斯特菌(Listeria monocytogenes)SJTUF 40105、婴儿链球菌(Streptococcus infantis)、缓症链球菌(Streptococcus mitis)、东京链球菌(Streptococcus toyakuensis)等由光明乳业研究院提供;耐万古霉素屎肠球菌(Enterococcus faecium)ATCC 51559购于中国工业微生物菌种保藏管理中心。
TPY液体培养基(g/L):水解酪蛋白10.0、植物胨5.0、酵母粉2.0、葡萄糖5.0、L-半胱氨酸0.5、K2HPO4·7H2O 2.0、MgCl2·6H2O 0.5、ZnSO4·7H2O 0.25、CaCl2 0.15、FeCl3 0.000 1、Tween 80 1.0 mL,调节pH 6.5,于115 ℃灭菌20 min。
TPY固体培养基:与TPY液体培养基配方相同,另加15 g/L的琼脂粉。
菌株培养与保存:ID4日常传代在TPY琼脂上进行,划线后的平板在36 ℃厌氧培养48 h(CO2∶H2∶N2=5∶10∶85),长期保存采用添加20%(体积分数)甘油的TPY肉汤,-80 ℃存放;除特别标注外,乳杆菌采用MRS平板36 ℃厌氧培养,空腔诺卡氏菌BD 7184与金黄色葡萄球菌BDSA 041采用TPY琼脂在30 ℃好氧培养24 h,其他球菌采用TPY琼脂在36 ℃厌氧培养72 h。
材料与试剂:3 kDa超滤离心管,美国默克公司;蛋白酶K(≥30 U/mg)、木瓜蛋白酶(≥2 000 U/mg)、胃蛋白酶(≥2 500 U/mg)、胰蛋白酶(≥3 000 U/mg)、过氧化氢酶(≥3 000 U/mg),美国Sigam公司;Bradford蛋白浓度测定试剂盒,碧云天生物技术有限公司;ATP含量测定试剂盒(A095),南京建成生物工程研究所。
1.2 仪器与设备
Avanti JXN-30高速冷冻离心机,美国贝克曼库尔特有限公司;Bugbox厌氧工作站,英国Ruskinn公司;Bioscreen C全自动生长曲线分析仪,芬兰Oy Growth Curves公司;高分辨冷场扫描电镜SU8010,日本日立公司。
1.3 实验方法
1.3.1 生物合成基因簇的预测
屎肠球菌ID4的全基因组序列使用Illumina NovaSeq 6000和PacBio Sequel Ⅱ平台进行,使用BAGEL4[11]和antiSMASH[12]预测屎肠球菌ID4染色体和质粒上的细菌素合成基因簇。BAGEL4在线数据库(http://bagel.molgenrug.nl/)能够挖掘并可视化原核生物基因组中参与核糖体合成的和翻译后修饰的多肽(RiPPs)以及产细菌素的基因簇。antiSMASH在线数据库(https://antismash.secondarymetabolites.org/#!/start)使用基于规则聚类检测,通过核心生物合成酶来鉴定45种不同类型的次级代谢产物生物合成途径。
1.3.2 细菌素粗提物的制备
将屎肠球菌ID4在TPY肉汤中培养22 h后,离心(4 ℃,9 000 r/min,30 min),取上清液,获得无细胞上清液(cell-free supernatant,CFS)。向CFS中缓慢加入固体硫酸铵,使饱和度达到40%,搅拌2 h(冰浴),离心(4 ℃,9 000 r/min,30 min),弃掉沉淀。继续加入硫酸铵,使硫酸铵饱和度达到70%,离心收集沉淀。沉淀用20 mmol/L的PBS(pH 7.0)重悬后,用3 kDa的超滤管脱盐和浓缩后,冻干,即得到细菌素粗提物。将细菌素粗提物用去离子水溶解,经0.22 μm微膜过滤,以ddH2O为流动相上样于葡聚糖凝胶Sephadex G-25层析柱(直径1.0 cm×柱高50 cm)中,自动收集各馏分,以空腔诺卡氏菌BD 7184为指示菌测定抑菌活性,所得具有活性的馏分冷冻干燥后进行凝胶电泳。
1.3.3 三(羟甲基)甲基甘氨酸(N-(tris(hydroxymethyl)methyl)glycine,tricine)-SDS-PAGE
采用tricine-SDS-PAGE测定细菌素粗提物分子质量。准备一块4%~20%的梯度电泳凝胶,电泳结束后,将凝胶切成两半,一半进行考马斯亮蓝染色,另一半用无菌去离子水漂洗2 h,将制备好的含有指示菌BD 7184(106 CFU/mL)的固体培养基倾注在凝胶上,30 ℃培养12 h后,将两块凝胶进行比对,通过原位抑菌结果来确定细菌素分子质量。
1.3.4 细菌素稳定性研究
1.3.4.1 抑菌活性的测定
调节空腔诺卡氏菌BD 7184菌液浓度为108 CFU/mL,按2%(体积分数)接种于熔化后冷却至48~50 ℃的TPY琼脂中,混匀后倒平板。待平板凝固后采用牛津杯法测定抑菌活性,每个牛津杯内加入100 μL样品,30 ℃培养16~18 h,测量抑菌圈直径。采用相同的方法,测定ID4细菌素粗提物的抑菌谱。
1.3.4.2 pH值的影响
将细菌素粗提物分别调节到pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,室温放置3 h,再回调到pH 6.0,测定抑菌活性,选用pH 6.0的细菌素粗提物为对照。
1.3.4.3 对热处理的耐受性
将细菌素粗提物分别在60、80、100 ℃水浴30 min,或121 ℃加热15 min,冷却至室温,测定抑菌活性,对照为室温放置的细菌素粗提物。
1.3.4.4 对蛋白酶的敏感性
将细菌素粗提物分别用木瓜蛋白酶、胰蛋白酶、蛋白酶K和胃蛋白酶在37 ℃下水浴3 h,冷却至室温,将pH值调节到6.0,测定抑菌活性,对照为未经蛋白酶处理的细菌素粗提物(pH 6.0)。
1.3.5 细菌素抗菌特性研究
1.3.5.1 最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)的测定
ID4细菌素的MIC测定方法参照CAO等[13]的微量肉汤稀释法,并稍作修改。用PBS缓冲液将冻干后的ID4细菌素粉末溶解,采用改良型Bradford蛋白浓度测定试剂盒测定ID4细菌素溶液的蛋白浓度,具体测定方法见试剂盒说明书。将细菌素溶液进行两倍梯度稀释备用,将培养到对数期的指示菌BD 7184 液稀释至浓度为106 CFU/mL备用。按顺序分别在96孔板中加入20 μL梯度稀释后的细菌素,每孔加入180 μL指示菌菌液。设置两个对照组,阳性对照为仅含指示菌BD 7184的培养液;阴性对照为不含指示菌仅含有20 μL PBS缓冲液的培养液,30 ℃培养18 h,通过酶标仪检测OD600nm值,每个实验设置3个平行。能完全抑制指示菌BD 7184生长的最大稀释倍数的细菌素蛋白浓度记为MIC,单位用mg/mL表示。培养结束后,选取96孔板中与阴性对照组OD值最接近的所有实验组,吸取100 μL菌液涂布于固体平板上,30 ℃培养24 h,没有菌落生长的最大稀释倍数的细菌素蛋白浓度记为MBC,单位用mg/mL表示。
1.3.5.2 时间-杀菌曲线
ID4细菌素对指示菌BD 7184生长的影响:将培养至对数生长期的指示菌BD 7184按2%的接种量加入到TPY液体培养基中,调整菌浓度为106 CFU/mL左右,然后分别加入细菌素,使细菌素浓度达到1/4×MIC、1/2×MIC、1×MIC、2×MIC、4×MIC,空白对照为不加细菌素的指示菌液。将96孔板放置在自动生长曲线测定仪中,30 ℃培养,每隔1 h测定OD600 nm值,重复3次实验,以时间为横坐标,以菌悬液的OD600 nm值为纵坐标,绘制生长曲线,观察指示菌BD 7184的生长变化。
时间-杀菌曲线的测定:将培养至对数生长期的指示菌BD 7184,调整菌浓度约为108 CFU/mL,分别加入细菌素,使细菌素浓度达到1×MIC、2×MIC、4×MIC,30 ℃培养6 h,空白对照组为不加细菌素的指示菌。每隔1 h用倒平板法进行活菌计数,以时间为横坐标,以活菌数(lg CFU/mL)为纵坐标,绘制生长曲线,观察ID4细菌素对指示菌BD 7184的时间-杀菌曲线。
1.3.6 细菌素杀菌机制研究
1.3.6.1 胞内ATP的泄漏
将培养至对数生长期的指示菌BD 7184,调整菌浓度约为108 CFU/mL,分别加入细菌素,使细菌素浓度达到1×MIC、2×MIC,对照组不加细菌素,30 ℃培养60 min,每隔10 min取样1次,离心取菌体,超声破碎后根据南京建成生工研究所的ATP含量测定试剂盒说明书进行胞内ATP含量测定。
1.3.6.2 紫外吸收物质的泄露
指示菌处理方法同1.3.6.1节,在30 ℃培养3 h,每隔30 min取样1次,菌悬液经12 000 r/min离心2 min,上清液用0.22 μm的微孔滤膜过滤。过滤后的上清液用紫外分光光度计测定OD260nm值(核酸吸光度)和OD280nm值(蛋白质吸光度)。
1.3.6.3 细胞形态的观察
将指示菌BD 7184培养至对数生长期中期,添加细菌素形成2×MIC浓度,同时以不含细菌素的相同培养液为对照,于30 ℃处理2 h。将处理后菌液离心(4 ℃,4 000 r/min,10 min),取菌泥,用PBS洗涤菌体,离心加入5 mL的2.5%戊二醛固定,混匀后放到4 ℃冰箱中过夜。随后将样品送往e测试公司进行生物扫描电镜(scanning electron microscope, SEM)和生物透射电镜(transmission electron microscope, TEM)观察。
1.3.7 细菌素安全性实验
1.3.7.1 溶血性实验
参考郭行[14]的方法进行溶血性实验。将ID4细菌素溶液进行两倍梯度稀释,使细菌素质量浓度达到94.3、47.2、23.6、11.8、5.9、2.9、1.5、0.7 μg/mL,在每孔中分别添加50 μL样品,37 ℃下孵育48 h,观察溶血圈,以8次倍半稀释的TritonX-100(1%)作为阳性对照。
1.3.7.2 细胞毒性实验
参考FU等[15]的方法进行细胞毒性实验。使用Cell Counting Kit-8检测人结直肠腺癌细胞(CaCo-2)与不同浓度的细菌素孵育后的存活率,在450 nm处测定吸光度,计算细胞存活率百分比。
1.4 数据分析和处理
使用GraphPad Prism 9软件进行数据分析和作图。采用One-Way ANOVA进行单因素方差分析检验差异显著性,显著性水平阈值P<0.05。
2 结果与分析
2.1 细菌素合成基因簇的预测
通过BAGEL4和antiSMASH在屎肠球菌ID4的质粒A上鉴定到一个细菌素合成基因簇,该簇包含一个细菌素免疫基因和肠球菌素P编码基因entP,如图1所示。该基因编码一个由71个氨基酸组成的前肽,包含44个氨基酸组成的成熟细菌素(RSYGNGVYCNNSKCWVNWGEAKENIAGIVISGWASGLAGM GH)和27个氨基酸组成的信号肽(MRKKLFSLTLIGKFGLVVTNFGTKVDAAT)。肠球菌素P的编码基因entp普遍存在于肠球菌中,但不一定实际表达,如屎肠球菌OV3-6细菌素纯化鉴定结果与前期预测结果不符,细菌素基因扩增显示其仅含有entp基因,但实际纯化产物鉴定为另一种新型细菌素[16]。

图1 屎肠球菌ID4质粒A上的细菌素合成基因簇
Fig.1 Bacteriocin synthesis gene cluster on plasmid A of E.faecium ID4
注:开放阅读框(open read frame,ORF)。
2.2 细菌素的分子质量及原位活性检测
细菌素粗品经过Sephadex G-25柱层析,在λ=280 nm出现2个吸收峰,其中峰1对指示菌BD 7184有抑菌活性(图2)。将峰1收集后冻干、复溶后进行Tricine-SDS-PAGE电泳,结果如图3所示,原位抑菌实验显示在6.5 kDa附近有一条抑菌条带。据此判断,该细菌素的分子质量在6.5 kDa左右。与已知肠球菌素的分子质量不同,如肠球菌素A的分子质量为4 829 Da,肠球菌素B的分子质量为5 463 Da,肠球菌素P的分子质量为4 493 Da[17],屎肠球菌OV3-6产生的细菌素分子质量为7.3 kDa[16],ID4细菌素的分子质量与肠球菌素LR/6的分子质量6.1 kDa接近[18]。
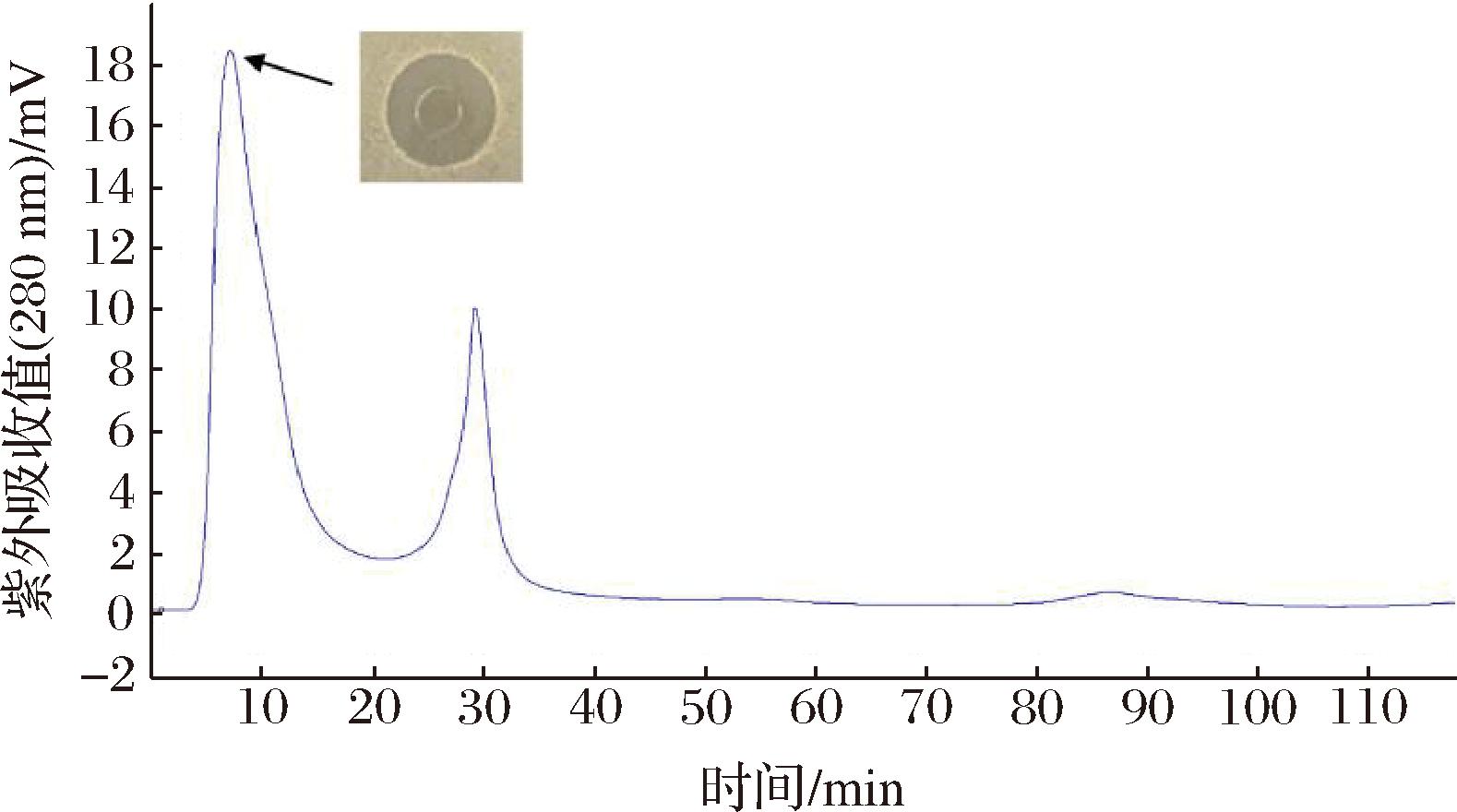
图2 ID4细菌素的Sephadex G-25层析图及活性跟踪
Fig.2 Gel filtration chromatography of ID4 bacteriocins on Sephadex G-25 and the antibacterial activity of the eluted fractions
注:光信号被转化为电压信号,因此单位为mV。
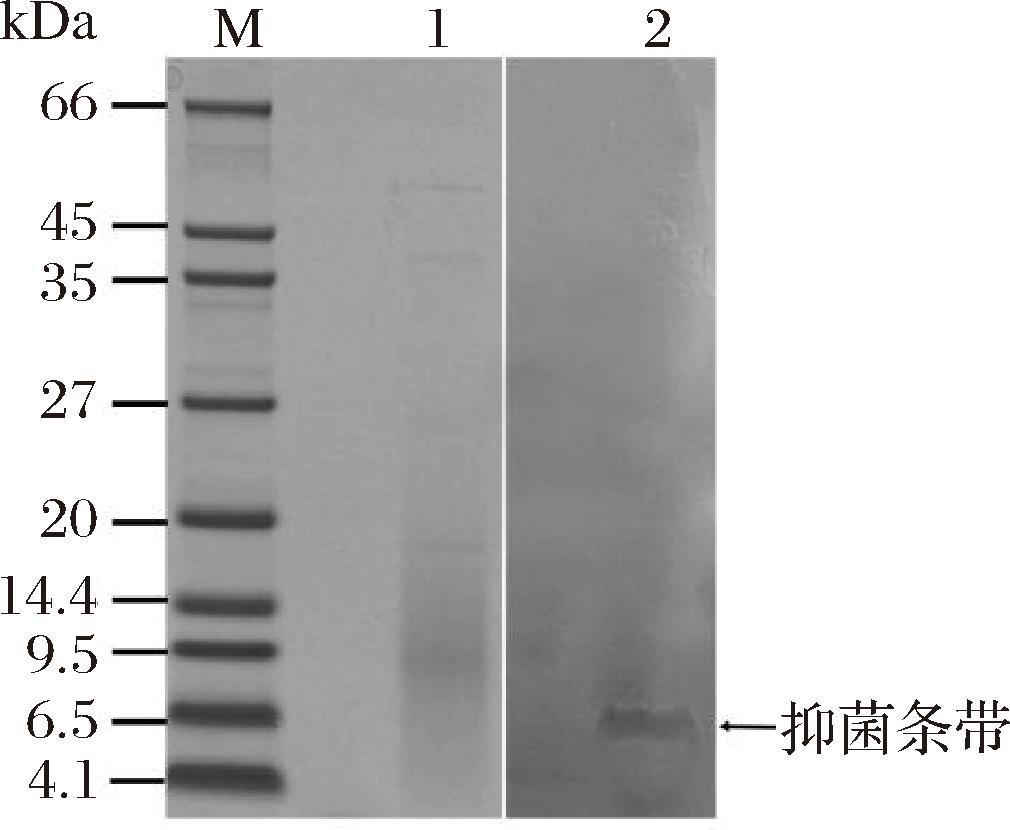
M-蛋白分子质量标准;1- 经染色的蛋白分子条带;2-在空腔诺卡氏菌BD 7184平板上的抑菌活性条带
图3 ID4细菌素的Tricine-SDS-PAGE电泳图和生物自显影图
Fig.3 Profiles of the Tricine-SDS-PAGE electrophoresis of ID4 bacteriocins and bioautography
2.3 细菌素稳定性研究
如图4-a所示,屎肠球菌ID4产生的细菌素经蛋白酶K、胰蛋白酶和胃蛋白酶处理后抑菌效果显著下降(P<0.05)。抑菌效果没有完全消失可能是因为该细菌素对蛋白酶具有一定耐受性或酶作用不够充分,如LIU等[19]的研究,当作用时间增加后,抑菌效果较2 h时显著降低。该细菌素粗提物在酸性条件下抑菌活性没有显著性变化(P>0.05)(图4-b)。当pH值大于7时,抑菌活性逐级下降,但pH 10处理后仍保持了74%以上的抑菌活性(与对照pH 6比较)。说明该菌株所产的抑菌物质在碱性条件下较不稳定。ID4细菌素粗提物在121 ℃处理15 min后对指示菌的抑菌效果仍然没有显著下降(P>0.05),说明其有良好的耐热性(图4-c)。

a-蛋白酶对细菌素活性的影响;b-pH值对细菌素活性的影响;c-温度对细菌素活性的影响
图4 ID4细菌素在蛋白酶、热处理和不同pH值处理下的稳定性
Fig.4 Stability of ID4 Bacteriocin under treatment of proteinases, pH or heat
注:*(P<0.05),**(P<0.005),***(P<0.001),****(P<0.0001)(下同)。
不同的细菌素具有不同的稳定性,如细菌素LR/6对多种蛋白酶敏感(蛋白酶K、胃蛋白酶、木瓜蛋白酶、α-胰蛋白酶),在pH值2~6保持抑菌活性,具有极好的热稳定性[18];肠菌素A和肠菌素B在121 ℃处理15 min后抑菌活性丧失,对蛋白酶K和胰蛋白酶敏感[10];肠菌素P经α-胰蛋白酶、木瓜蛋白酶和蛋白酶K处理后活性丧失,在121 ℃处理15 min后丧失部分活性[20]。
2.4 细菌素抑菌特性研究
2.4.1 抑菌谱
如表1所示,屎肠球菌ID4产生的细菌素对口腔中部分革兰氏阳性致病菌,如空腔诺卡氏菌和缓症链球菌组的链球菌有较好的抑菌效果,对金黄色葡萄球菌、单增李斯特菌、植物乳杆菌、副干酪乳杆菌和发酵乳杆菌没有抑制效果。而肠球菌素P显示具有广谱抑菌性,能抑制单增李斯特菌等食源性致病菌、植物乳杆菌和副干酪乳杆菌[20]。屎肠球菌ID4产生的细菌素对金黄色葡萄球菌和单增李斯特菌未显示抑制效果,可能是在本研究中选用的金黄色葡萄球菌BDSA 041和单增李斯特菌SJTUF 40105敏感性与其他已报道的敏感菌株存在差异,正好符合细菌素抗菌作用具有针对性的特点;也可能是ID4细菌素并非预测的肠球菌素P。
表1 屎肠球菌ID4所产细菌素粗提物的抑菌谱
Table 1 Antibacterial spectrum of the crude bacteriocins produced by E.faecium ID4
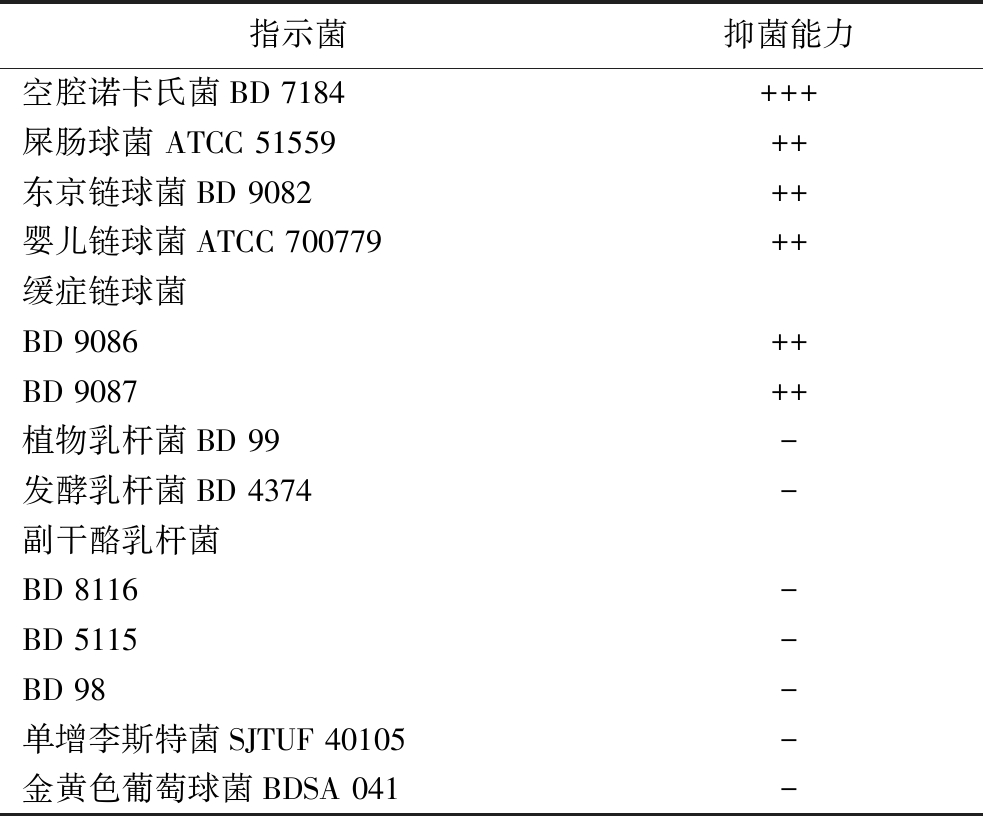
注:用抑菌圈直径表示抑菌能力,+++:15~20 mm;++:10~15 mm;+:8~10 mm;-:无抑菌效果。
指示菌抑菌能力空腔诺卡氏菌BD 7184+++屎肠球菌 ATCC 51559++东京链球菌BD 9082++婴儿链球菌ATCC 700779++缓症链球菌BD 9086++BD 9087++植物乳杆菌BD 99-发酵乳杆菌BD 4374-副干酪乳杆菌BD 8116-BD 5115-BD 98-单增李斯特菌SJTUF 40105-金黄色葡萄球菌BDSA 041-
诺卡氏菌的致病性近来引起高度关注,该菌虽然主要导致免疫力低下人群(艾滋病患者、肿瘤患者和长期使用免疫抑制剂的患者等)感染,但对健康人群也存在感染威胁[21],主要由呼吸道吸入和外伤感染,严重时可导致菌血症[22]。此外,诺卡氏菌还对部分动物具有致病性,尤其是会导致许多具有重要经济意义的养殖鱼类患病及死亡[23-24]。YANG等[25]的研究显示在同时患有糖尿病和牙周炎的患者中,因糖尿病导致口腔环境改变,使得空腔诺卡氏菌易定殖于口腔,丰度较健康人群显著上升。
缓症链球菌组包括缓症链球菌、口腔链球菌、东京链球菌[26]和婴儿链球菌等,它们是人类口腔、尤其是牙菌斑中含量最高的共生菌群,缓症链球菌组成员可引起口腔、面部感染,多发于儿童、孕妇和免疫力低下人群中,严重时会进一步导致菌血症和感染性心内膜炎[27-29],而这些病例患者通常都患有牙周炎、龋齿等口腔疾病[30]。其中缓症链球菌与肺炎链球菌有很近的亲缘关系,其本身存在多种毒力因子,通过粘附素、免疫球蛋白A蛋白酶和毒素的表达,使其成功定殖于人类口腔、咽喉等部位,在口腔黏膜受损时,它们可能通过这些毒力因子和免疫调节因子来触发感染。此外,屎肠球菌ID4产生的细菌素还能抑制具有万古霉素耐药性的屎肠球菌ATCC 51559,屎肠球菌E86产生的细菌素也具有此类特性[31]。
目前针对这些菌株感染的治疗方案是选用多种抗生素进行联合干预,然而有研究表明诺卡氏菌和缓症链球菌的药敏性明显下降[30]。因此,如果采用ID4细菌素进行干预,有望降低耐药性菌株产生的风险。
2.4.2 MIC和MBC
如图5所示,与不加细菌素的空白组相比,加入ID4细菌素的指示菌BD 7184的OD600nm值随着细菌素浓度的增加而下降,抑菌效果与细菌素浓度呈正相关。当细菌素蛋白质量浓度达到5.9 μg/mL时,指示菌的生长完全受到抑制,OD600nm值接近未接种指示菌的NC(阴性对照)组。将OD600nm值接近NC组的培养液吸取100 μL涂布于固体平板上,培养24 h后,结果显示23.6、47.2 μg/mL细菌素浓度的平板上无菌落生长,11.8 μg/mL的平板上有少量菌落生长,5.9 μg/mL的平板上有大量菌落生长。所以ID4细菌素对指示菌BD 7184的MIC为5.9 μg/mL,MBC(4×MIC)为23.6 μg/mL。以相同方法测定了该细菌素对缓症链球菌和耐万古霉素屎肠球菌的MIC为11.8 μg/mL。
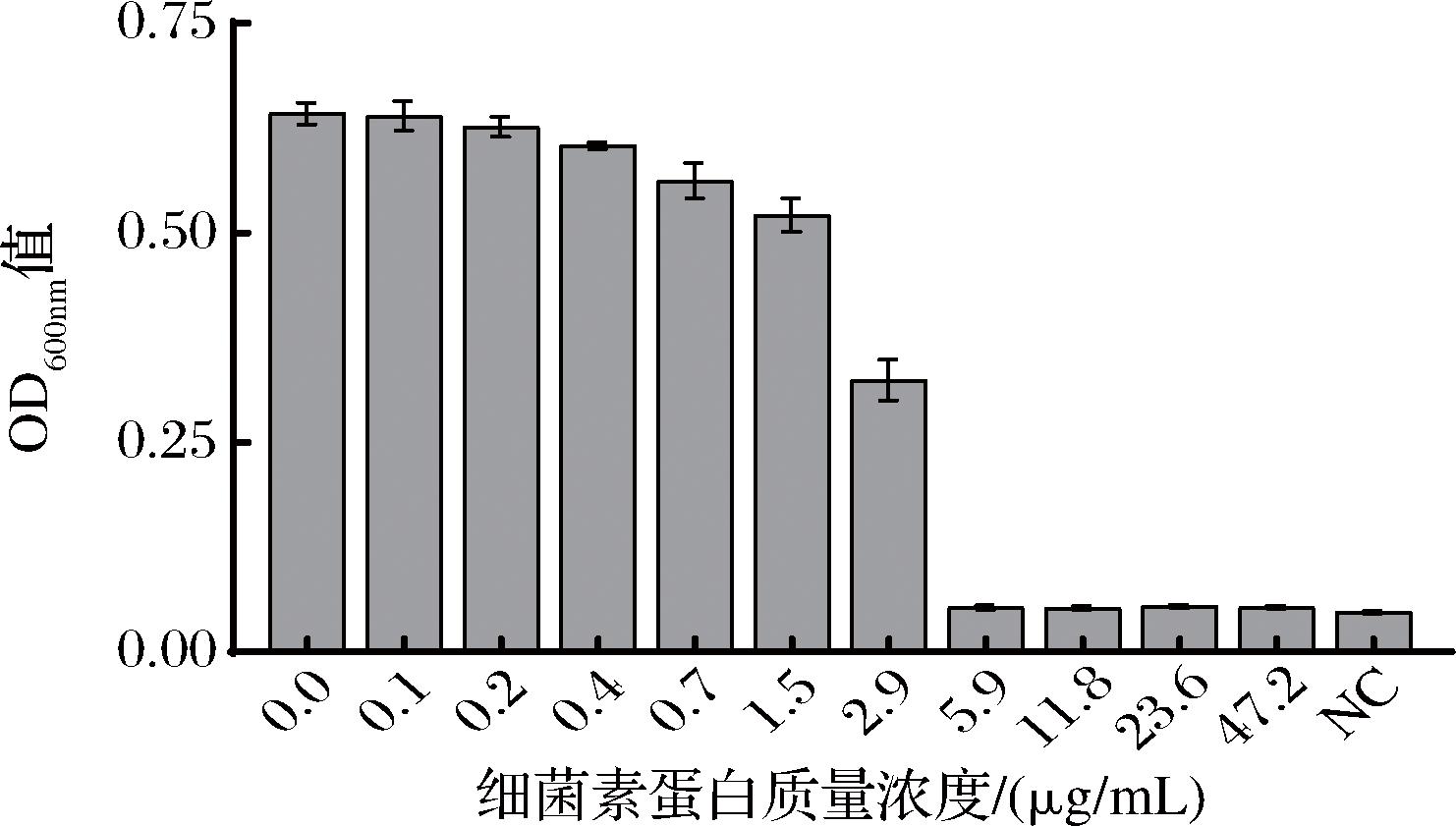
图5 不同浓度ID4细菌素对指示菌BD 7184的抑菌或杀菌作用
Fig.5 Bacteriostatic or bactericidal effects of different concentrations of ID4 bacteriocins on the indicator bacterium BD 7184
注:阴性对照组(negative control,NC)。
2.4.3 时间-杀菌曲线
在1/4×MIC和1/2×MIC细菌素存在时,指示菌BD 7184的生长受到一定的抑制。当细菌素的浓度增加到1×MIC时,指示菌BD 7184的生长被完全抑制(图6-a)。指示菌BD 7184经过2×MIC处理6 h后,活菌数降低了3.3 lg CFU/mL(杀灭率99.9%);经过4×MIC细菌素处理2 h后,活菌数降低了3 lg CFU/mL(杀灭率99.9 %)(图6-b)。结果表明ID4细菌素具有杀菌效果,杀菌作用依赖于浓度和时间,与CAO等[13]和郭行[14]的研究结果类似。
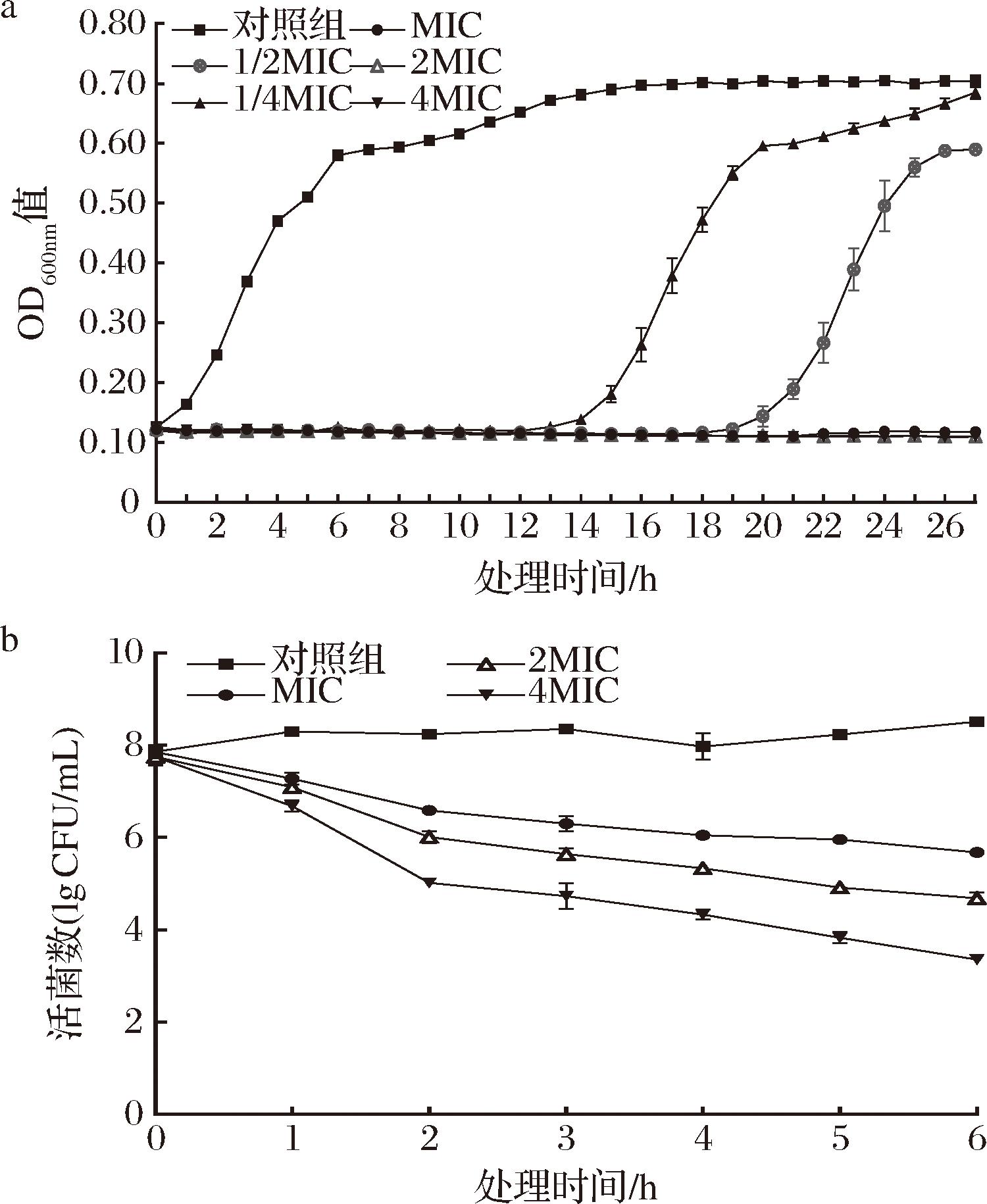
a-ID4细菌素对指示菌BD 7184生长的影响;b-时间-杀菌曲线
图6 ID4细菌素对指示菌BD 7184的动力学杀菌作用
Fig.6 Kinetic bactericidal effect of ID4 bacteriocins on the indicator bacterium BD 7184
2.5 细菌素抗菌机制研究
2.5.1 胞内ATP泄露
如图7所示,指示菌BD 7184细胞经ID4细菌素作用10 min后,胞内ATP含量下降,在作用30 min后ATP含量下降趋于稳定。胞内ATP含量减少,表明细菌素使指示菌细胞膜的通透性增加,导致小分子ATP泄露。与GUPTA等[32]的研究结果类似。另外,SHI等[33]的研究结果显示,细菌素改变细胞膜的通透性,使单增李斯特菌的K+外流,质子动力消散;总ATP量下降,但胞外ATP量无明显上升,研究者推测是细菌为恢复质子动力而水解胞内ATP,导致胞内ATP被耗竭。
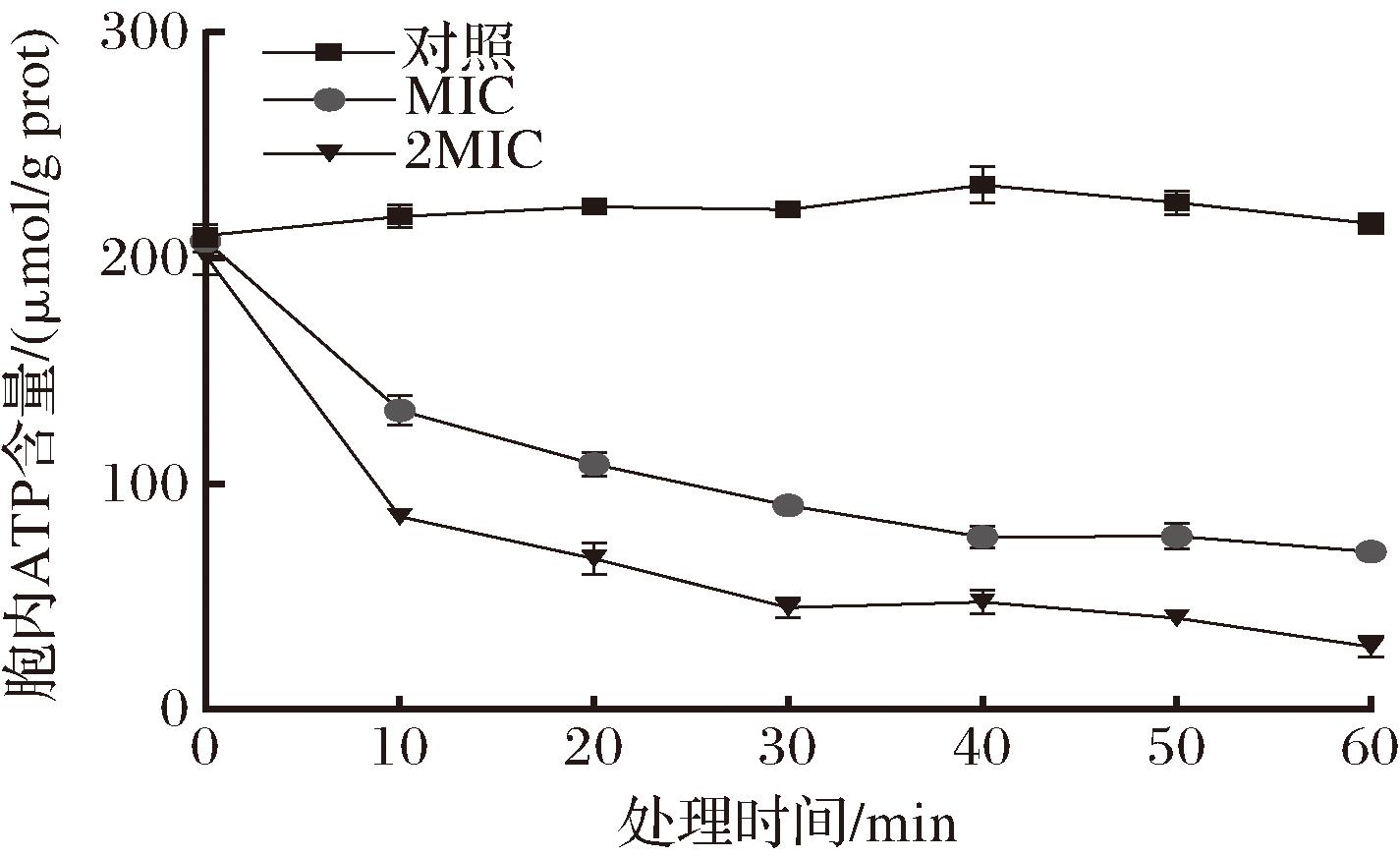
图7 ID4细菌素处理导致指示菌BD 7184细胞ATP的泄漏
Fig.7 Leakage of intracellular ATP of the indicator bacterium BD 7184 under ID4 bacteriocin treatment
2.5.2 紫外吸收物质泄漏
细胞膜能维持细胞环境的稳定,是细胞的重要组成部分。可以通过分析细胞内大分子质量物质(蛋白质和核酸)的泄漏来评估细胞膜的完整性。其中蛋白质是生命活动的物质基础和主要承载者,与各种形式的生命密切相关,核酸则携带独特的遗传信息,参与细胞翻译,转录和DNA复制。如图8所示,指示菌BD 7184与ID4细菌素共孵育1 h后,无细胞上清液的值OD260nm值(核酸)和OD280nm值(蛋白质)开始上升,表明指示菌细胞发生渗漏。当细菌素浓度增加到2×MIC时,指示菌细胞泄露程度显著增加。表明ID4细菌素破坏了指示菌细胞膜的完整性,从而造成大分子内容物的泄露。

a-细胞内核酸的泄漏;b-细胞内蛋白质的泄露
图8 ID4细菌素处理引发指示菌BD 7184细胞内大分子物质的泄漏
Fig.8 Leakage of intracellular macromolecules of the indicator bacterium BD 7184 under ID4 bacteriocin treatment
2.5.3 电镜实验
SEM结果表明未经处理的指示菌BD 7184细胞表面光滑圆润,具有完整的细胞结构(图9-a);经过2×MIC的细菌素处理2 h后,指示菌表面出现明显的皱缩、变形和凹陷,细胞膜上出现了明显的穿孔,穿孔周围存在少量内容物质,表明指示菌细胞发生了裂解(图9-b、图9-c)。
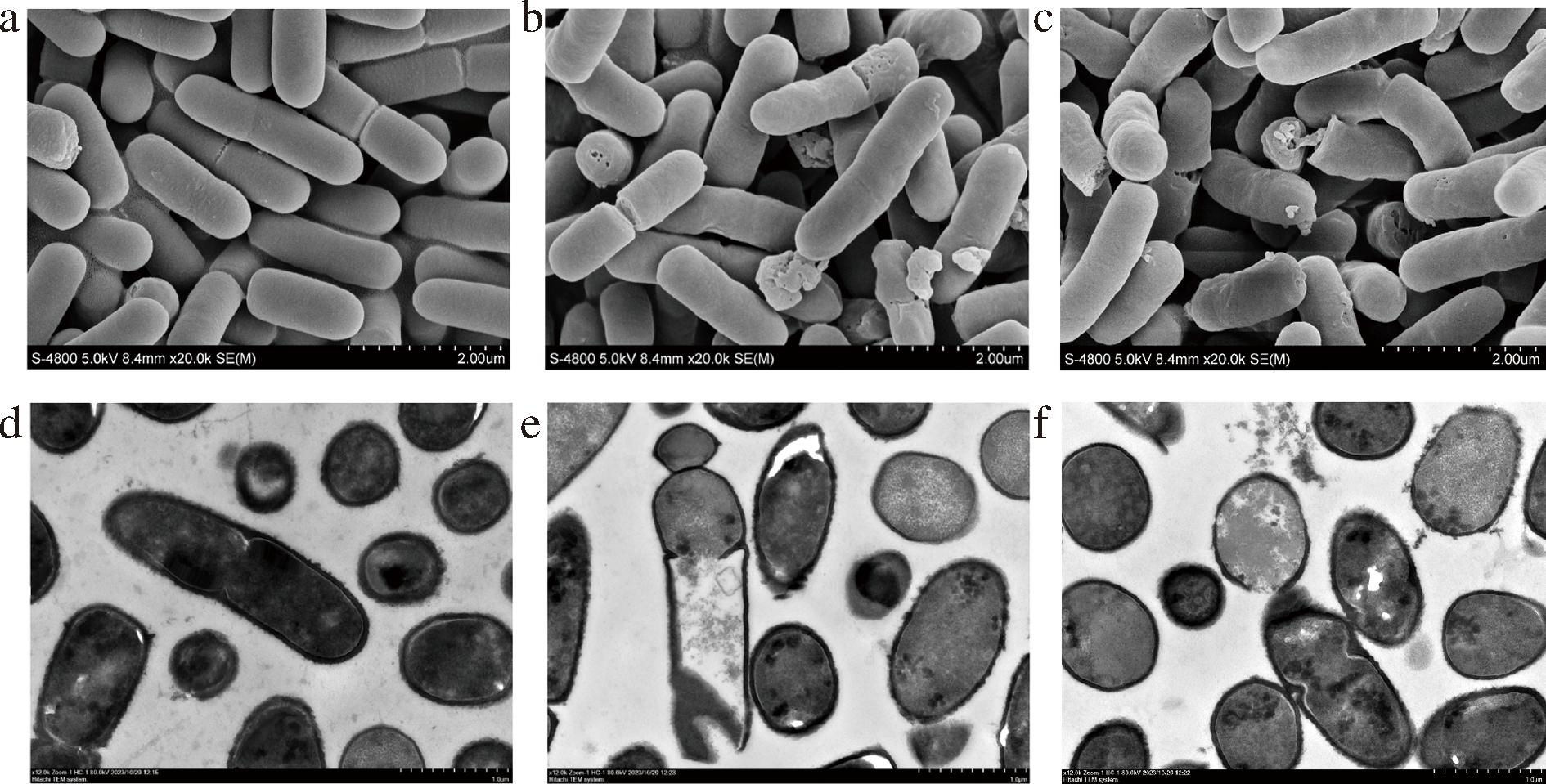
a、b、c-SEM观察指示菌的细胞形态,其中a- 对照组;b、c-用2×MIC细菌素处理2 h的实验组;d、e、f-TEM观察指示菌的细胞形态,其中d- 对照组;e、f-用2×MIC细菌素处理2 h的实验组
图9 细菌素处理后对指示菌BD 7184细胞形态的影响
Fig.9 Effect of bacteriocin treatment on the cell morphology of the indicator bacterium BD 7184
TEM测试结果表明对照组指示菌细胞的截面为杆状或椭圆形,细胞壁清晰明显,且与细胞膜边界清晰;细胞质分布均匀,整体呈深灰色,核区呈黑色;细胞周围无杂质、碎片等(图9-d)。当使用2×MIC浓度的细菌素处理指示菌2 h后,大部分细菌出现明显的变形,细胞壁部分位置变薄;细胞内部物质分散,颜色发生改变,变为浅灰色,细胞的浅色象征着整个细胞环境的不平衡,聚集在细胞中心区域的核酸可能由于DNA的损伤和释放而消失[34];在部分细胞的中部和边缘出现空腔,同时观察到细胞表面出现明显穿孔,内容物大量流出(图9-e、图9-f)。由电镜观察到的结果可以判断ID4细菌素通过使指示菌细胞膜穿孔受损发挥杀菌作用,与已报道的肠球菌细菌素对革兰氏阳性菌的作用机制一致[13,34]。
2.6 安全性实验
2.6.1 溶血性实验
为了评估ID4细菌素的溶血活性,在血琼脂平板上进行溶血性实验。如图10所示,对照组1%的TritonX-100稀释到第7次时没有出现明亮溶血圈,实验组ID4细菌素样品在最高质量浓度94.3 μg/mL(16×MIC)时也没有出现溶血圈,说明ID4细菌素有一定的生物安全性,但还需要经溶血活性定量实验进一步验证。如郭行[14]的实验结果,在血平板上时,其研究的4种细菌素中仅有S137细菌素在1×MIC浓度时开始出现轻微溶血圈,而pH25、S68和S81都未表现出溶血效果;但在溶血活性定量实验中,在32×MIC浓度时,S68和S137表现出明显溶血性。

a-不同浓度的TritonX-100;b-ID4细菌素
图10 不同浓度ID4细菌素的溶血活性
Fig.10 Hemolytic activity of different concentrations of ID4 bacteriocin
注:1~8代表细菌素质量浓度为94.3~0.74 μg/mL。
2.6.2 细胞毒性实验
Caco-2细胞模型与人小肠上皮细胞同源性好,广泛用于口服给药的吸收、转运和细胞直接毒作用研究[35]。如图11所示,在低浓度细菌素的作用下,Caco-2细胞的存活率没有显著性降低(P>0.05),当质量浓度增加到94.3 μg/mL(16×MIC)时,细胞存活率显著性降低(P=0.010 2),存活率降为94.07%,表明此细菌素在低和中浓度时具有一定的生物安全性。研究显示,大部分细菌素在低浓度时没有显著性毒性作用,在高浓度时表现出低毒作用,如细菌素AS-48在浓度提升至10倍或100倍时对人乳腺癌细胞活力有明显影响[36];细菌素HA2-5在最高质量浓度256 μg/mL处理人永生表皮细胞后,细胞活力仍保留了97%[37];细菌素CH3在低浓度时使人真皮纤维细胞存活率下降至90%左右,但对细胞形态进行观察,与对照组相比没有明显变化[38]。

图11 不同浓度ID4细菌素处理后Caco-2细胞的存活率
Fig.11 Viability of Caco-2 cells under treatment with different concentrations of ID4 bacteriocins
3 结论
在屎肠球菌ID4的基因组上预测到其可能产生肠球菌素P,属于IIa类细菌素,理论分子质量为4 493 Da,具有广谱抑菌性,特点是有很好的抗李斯特菌作用[31]。在本研究中,ID4产生的细菌素分子质量约为6.5 kDa,热稳定性、蛋白酶敏感性和抑菌谱与肠球菌素P不同,推测可能属于另一种新的细菌素。与ID4细菌素分子量和稳定性相似的细菌素LR/6显示对藤黄微球菌有抑制作用,需要后续进行验证。
屎肠球菌ID4产生的细菌素有相对较窄的抑菌谱,主要针对空腔诺卡氏菌和缓症链球菌组的链球菌。该细菌素的杀菌作用具有浓度和时间依赖性,其作用机制为将细胞膜穿孔受损,致使内容物泄露。另外,血平板溶血性实验显示ID4细菌素没有溶血性,细胞毒性实验显示在低到中浓度时ID4细菌素对Caco-2细胞存活率没有显著性影响,表明ID4细菌素具有较好的安全性。
本研究为开发该细菌素作为口腔感染治疗剂提供了基础,在后续的研究中需要对纯化后的细菌素进行结构表征同时,通过动物实验评估其在体内对诺卡氏菌、缓症链球菌或耐万古霉素屎肠球菌感染的清除作用。
[1] MINTY M, CANCEIL T, SERINO M, et al.Oral microbiota-induced periodontitis:A new risk factor of metabolic diseases[J].Reviews in Endocrine &Metabolic Disorders, 2019, 20(4):449-459.
[2] DEL GIUDICE C, VAIA E, LICCARDO D, et al.Infective endocarditis:A focus on oral microbiota[J].Microorganisms, 2021, 9(6):1218.
[3] THOMAS C, MINTY M, VINEL A, et al.Oral microbiota:A major player in the diagnosis of systemic diseases[J].Diagnostics, 2021, 11(8):1376.
[4] ALM R A, LAHIRI S D.Narrow-spectrum antibacterial agents-benefits and challenges[J].Antibiotics, 2020, 9(7):418.
[5] ALMEIDA-SANTOS A C, NOVAIS C, PEIXE L, et al.Enterococcus spp.as a producer and target of bacteriocins:A double-edged sword in the antimicrobial resistance crisis context[J].Antibiotics, 2021, 10(10):1215.
[6] TAO Y, HUANG F Q, ZHANG Z H, et al.Probiotic Enterococcus faecalis Symbioflor 1 ameliorates pathobiont-induced miscarriage through bacterial antagonism and Th1-Th2 modulation in pregnant mice[J].Applied Microbiology and Biotechnology, 2020, 104(12):5493-5504.
[7] ALLEN S J, MARTINEZ E G, GREGORIO G V, et al.Probiotics for treating acute infectious diarrhoea[J].Cochrane Database of Systematic Reviews, 2010, 2010(11):CD003048.
[8] LAUKOV A, CZIKKOV
A, CZIKKOV S.Antagonistic effect of enterocin CCM 4231 from Enterococcus faecium on “bryndza”, a traditional Slovak dairy product from sheep milk[J].Microbiological Research, 2001, 156(1):31-34.
S.Antagonistic effect of enterocin CCM 4231 from Enterococcus faecium on “bryndza”, a traditional Slovak dairy product from sheep milk[J].Microbiological Research, 2001, 156(1):31-34.
[9] SNYDER A B, WOROBO R W.Chemical and genetic characterization of bacteriocins:Antimicrobial peptides for food safety[J].Journal of the Science of Food and Agriculture, 2014, 94(1):28-44.[10] KASIMIN M E, SHAMSUDDIN S, MOLUJIN A M, et al.Enterocin:Promising biopreservative produced by Enterococcus sp.[J].Microorganisms, 2022, 10(4):684.
[11] VAN HEEL A J, JONG A D, SONG C X, et al.BAGEL4:A user-friendly web server to thoroughly mine RiPPs and bacteriocins[J].Nucleic Acids Research, 2018, 46W1:W278-W281.
[12] BLIN K, SHAW S, KLOOSTERMAN A M, et al.antiSMASH 6.0:Improving cluster detection and comparison capabilities[J].Nucleic Acids Research, 2021, 49(W1):W29-W35.
[13] CAO S, DU R P, ZHAO F K, et al.The mode of action of bacteriocin CHQS, a high antibacterial activity bacteriocin produced by Enterococcus faecalis TG2[J].Food Control, 2019, 96:470-478.
[14] 郭行. 鼠李糖乳杆菌LS-8中新型细菌素的挖掘及抑菌机制的研究[D].西安:西北农林科技大学, 2021.GUO X.Mining novel bacteriocins from Lactobacillus rhamnosus LS-8 and study of their antibacterial mechanism[D].Xi’an:Northwest A&F University, 2021.
[15] FU X M, LYU L, WANG Y, et al.Safety assessment and probiotic characteristics of Enterococcus lactis JDM1[J].Microbial Pathogenesis, 2022, 163:105380.
[16] CHOEISOONGNERN T, SIRILUN S, WADITEE-SIRISATTHA R, et al.Potential probiotic Enterococcus faecium OV3-6 and its bioactive peptide as alternative bio-preservation[J].Foods, 2021, 10(10):2264.
[17] ÖZTÜRK H, GENI B, TUNCER B Ö, et al.Bacteriocin production and technological properties of Enterococcus mundtii and Enterococcus faecium strains isolated from sheep and goat colostrum[J].Veterinary Research Communications, 2023, 47(3):1321-1345.
B, TUNCER B Ö, et al.Bacteriocin production and technological properties of Enterococcus mundtii and Enterococcus faecium strains isolated from sheep and goat colostrum[J].Veterinary Research Communications, 2023, 47(3):1321-1345.
[18] KUMAR M, TIWARI S K, SRIVASTAVA S.Purification and characterization of enterocin LR/6, a bacteriocin from Enterococcus faecium LR/6[J].Applied Biochemistry and Biotechnology, 2010, 160(1):40-49.
[19] LIU D L, LIU J, LI J Y, et al.A potential food biopreservative, CecXJ-37 N, non-covalently intercalates into the nucleotides of bacterial genomic DNA beyond membrane attack[J].Food Chemistry, 2017, 217:576-584.
[20] NDLOVU B, SCHOEMAN H, FRANZ C M A P, et al.Screening, identification and characterization of bacteriocins produced by wine-isolated LAB strains[J].Journal of Applied Microbiology, 2015, 118(4):1007-1022.
[21] MEHTA H H, SHAMOO Y.Pathogenic Nocardia:A diverse genus of emerging pathogens or just poorly recognized?[J].PLoS Pathogens, 2020, 16(3):e1008280.
[22] MARGALIT I, LEBEAUX D, TISHLER O, et al.How do I manage nocardiosis?[J].Clinical Microbiology and Infection:The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases, 2021, 27(4):550-558.
[23] HAN H J, KWAK M J, HA S M, et al.Genomic characterization of Nocardia seriolae strains isolated from diseased fish[J].MicrobiologyOpen, 2019, 8(3):e00656.
[24] 张媛, 张媛媛, 李振军, 等.诺卡氏菌研究进展[J].中国人兽共患病学报, 2012, 28(6):628-634.ZHANG Y, ZHANG Y Y, LI Z J, et al.Research progress on Nocardia[J].Chinese Journal of Zoonoses, 2012, 28(6):628-634.
[25] YANG Y, LIU S L, WANG Y H, et al.Changes of saliva microbiota in the onset and after the treatment of diabetes in patients with periodontitis[J].Aging, 2020, 12(13):13090-13114.
[26] WAJIMA T, HAGIMOTO A, TANAKA E, et al.Identification and characterisation of a novel multidrug-resistant streptococcus, Streptococcus toyakuensis sp.nov., from a blood sample[J].Journal of Global Antimicrobial Resistance, 2022, 29:316-322.
[27] 胡田田, 陶艳玲.达托霉素用于治疗缓症链球菌血症并化脓性脑膜炎1例[J].中国感染与化疗杂志, 2022, 22(2):220-222.HU T T, TAO Y L.Daptomycin for the treatment of Streptococcus mitis bacteremia and purulent meningitis:A case report[J].Chinese Journal of Infection and Chemotherapy, 2022, 22(2):220-222.
[28] 湛玉晓, 张俭, 樊彩芳, 等.儿童急性淋巴细胞白血病化疗后血流感染的病原体分布与耐药变迁分析[J].中国当代儿科杂志, 2022, 24(2):176-181.ZHAN Y X, ZHANG J, FAN C F, et al.Distribution and drug resistance profiles of pathogens causing bloodstream infection after chemotherapy in children with acute lymphoblastic leukemia[J].Chinese Journal of Contemporary Pediatrics, 2022, 24(2):176-181.
[29] CHAEMSAITHONG P, LERTRUT W, KAMLUNGKUEA T, et al.Maternal septicemia caused by Streptococcus mitis:A possible link between intra-amniotic infection and periodontitis.Case report and literature review[J].BMC Infectious Diseases, 2022, 22(1):562.
[30] COLOMBA C, GARBO V, BONCORI G, et al.Streptococcus mitis as a new emerging pathogen in pediatric age:Case report and systematic review[J].Antibiotics, 2023, 12(7):1222.
[31] FARIAS F M, TEIXEIRA L M, VALLIM D C, et al.Characterization of Enterococcus faecium E86 bacteriocins and their inhibition properties against Listeria monocytogenes and vancomycin-resistant Enterococcus[J].Brazilian Journal of Microbiology, 2021, 52(3):1513-1522.
[32] GUPTA A, TIWARI S K, NETREBOV V, et al.Biochemical properties and mechanism of action of enterocin LD3 purified from Enterococcus hirae LD3[J].Probiotics and Antimicrobial Proteins, 2016, 8(3):161-169.
[33] SHI F, WANG Y W, LI Y F, et al.Mode of action of leucocin K7 produced by Leuconostoc mesenteroides K7 against Listeria monocytogenes and its potential in milk preservation[J].Biotechnology Letters, 2016, 38(9):1551-1557.
[34] SHU Q, NIU Y W, ZHAO W J, et al.Antibacterial activity and mannosylerythritol lipids against vegetative cells and spores of Bacillus cereus[J].Food Control, 2019, 106:106711.
[35] 孟云, 徐宇航, 吴龙, 等.Caco-2单细胞模型及共培养模型的应用进展[J].中国药学杂志, 2023, 58(14):1271-1275.MENG Y, XU Y H, WU L, et al.Progress in application of caco-2 single cell model and co-culture model[J].Chinese Pharmaceutical Journal, 2023, 58(14):1271-1275.
[36] CEBRI N R, RODR
N R, RODR GUEZ-CABEZAS M E, MART
GUEZ-CABEZAS M E, MART N-ESCOLANO R, et al.Preclinical studies of toxicity and safety of the AS-48 bacteriocin[J].Journal of Advanced Research, 2019, 20:129-139.
N-ESCOLANO R, et al.Preclinical studies of toxicity and safety of the AS-48 bacteriocin[J].Journal of Advanced Research, 2019, 20:129-139.
[37] 何梦妮. 痤疮丙酸杆菌拮抗菌的筛选及抑菌机制研究[D].无锡:江南大学, 2023.HE M N.Screening of antagonistic bacteria against Cutibacterium acnes and study on the antibacterial mechanism[D].Wuxi:Jiangnan University, 2023.
[38] KRISHNAMOORTHI R, SRINIVASH M, MAHALINGAM P U, et al.Antimicrobial, anti-biofilm, antioxidant and cytotoxic effects of bacteriocin by Lactococcus lactis strain CH3 isolated from fermented dairy products—An in vitro and in silico approach[J].International Journal of Biological Macromolecules, 2022, 220:291-306.