冬枣作为我国的特有水果和优质鲜食枣品种之一,栽培面积广,产量大,附加值高,其果实口感酥脆、营养丰富、深受枣农和消费者的喜爱。然而在自然条件下冬枣采后不易贮藏[1],极易受微生物侵染[2-3],严重影响采后冬枣的商品价值和产业的健康发展[4]。研究发现,链格孢菌(Alternaria alternata)是引起冬枣采后浆胞病和果柄基腐病的主要病害菌之一[5],其在侵入冬枣组织后产生的毒素严重威胁人类的健康[6-7]。研究表明,低温结合化学杀菌剂能够有效控制冬枣采后病害,但长期使用化学杀菌剂不仅会造成药剂残留与环境污染,而且会使病原菌产生抗药性[8]。因此,开发有针对性防治链格孢菌且安全健康的生物保鲜剂就变得尤为重要。
植物提取物中存在的各种酚类化合物与抗菌活性密不可分[9]。连翘为木犀科连翘属植物,以果实入药并收载于中国药典,具有抗菌、抗氧化、抗病毒作用[10-11],连翘中富含连翘苷、连翘酯苷、熊果酸等活性成分,在叶子中的含量远高于果实[12]。研究表明,连翘叶提取物与壳聚糖复配物以5∶1比例混合后对圣女果的保鲜效果最好[13]。潘婷婷等[14]研究发现,连翘叶提取液对冷藏猪肉具有较好的保鲜效果,可以延长冷藏猪肉的货架期和提高冷藏猪肉品质。原江锋等[15]的研究表明连翘叶提取物在中性和弱酸性环境中的抑菌活性较强;连翘叶提取物可影响枯草芽孢杆菌和金黄色葡萄球菌活性。目前,连翘叶作为一种重要的天然产物资源,已在中药制剂、化妆品、功能性食品、食品添加剂、饲料添加剂等方面展现出良好的应用前景[16-18]。前期课题组以连翘叶提取液作为有效活性成分制备连翘生物保鲜剂,有效降低冬枣病原真菌侵染率和品质劣变率,但是连翘生物保鲜剂处理对冬枣果实采后链格孢菌病害的抑菌作用尚不清楚。因此,本实验对冬枣果实的致腐病原真菌(链格孢菌)进行致病性实验,并采用连翘生物保鲜剂进行抑菌性实验,研究连翘生物保鲜剂对采后冬枣链格孢菌的抑菌机理,从而为冬枣病害的有效防控提供科学依据,并对中草药活性成分在冬枣上抑菌应用提出展望,以期为连翘等中草药活性成分在水果保鲜中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
连翘叶,于6月份采摘自山西长治;冬枣,于10月份采摘自山西临猗,采收成熟度为白熟果;A.alternata菌株由山西农业大学农产品贮藏保鲜研究中心实验室分离保存。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、马铃薯葡萄糖肉汤液体培养基(potato dextrose broth,PDB)、液体沙氏培养基(Sabauraud dextrose broth,SDB)、磷酸盐缓冲液(phosphate buffered saline,PBS),青岛高科技工业园海博生物技术有限公司;还原型辅酶-四钠盐(β-nicotinamide adenine dinucleotide 2′-phosphate reduced,NADPH-Na4)、氧化型谷胱甘肽(glutathione disulfide,GSSG),上海阿拉丁生化科技股份有限公司;磷酸盐缓冲液、葡萄糖溶液,天津博迪化工有限公司;过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(glutathione reductase,GR)检测试剂盒,南京建成生物科技有限公司;Na+/K+-ATPase检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
WH-A150高速多功能粉碎机,南京好又多电器有限公司;LC-WB-1力辰智能恒温水浴锅,上海力辰邦西仪器科技有限公司;DL-CJ-2N双人双面洁净工作台,华威科创(武汉)科技有限公司;RE52-99旋转蒸发器,上海亚荣生化仪器厂;XH-C漩涡混合器,上海双旭电子有限公司;SHA-C水浴恒温振荡器,江苏金坛市金城国盛实验仪器厂;DSA75-XN-2L超声波清洗机,福州德森精工有限公司;UX620H电子天平,深圳市三利化学品有限公司;DH4 000A电热恒温培养箱,天津市通利信达仪器厂;EPP0 WUIC溶解氧测定仪,天津天尔分析仪器有限公司;OLYMPUS BX5微分干涉相差显微镜,苏州锐纳微光学有限公司;Pharmacic Ultrospec 2000紫外/可见分光光度计,厦门市莱驰电子科技有限公司。
1.3 实验方法
1.3.1 连翘生物保鲜剂的制备
连翘叶提取液:取一定量已粉碎的连翘叶,按1∶9(g∶mL)的料液比加70%乙醇浸提2.0~2.5 h,超声提取温度35~40 ℃,提取时间为1 h,浸提液先后经4层纱布及滤纸过滤,吸取滤液后蒸发浓缩,浓缩至相对密度为1.10~1.21 g/L,立即加入70%乙醇混匀静置24 h后取上清液,旋转蒸发至1.21~1.30 g/L,即得连翘叶提取液。
壳聚糖膜液:将壳聚糖作为成膜剂(4 g)溶解在1%(质量分数)冰乙酸溶液(150 mL)中,搅拌1 h以去除气泡,然后再与0.96 g作为增塑剂的甘油充分搅拌,静置2 h后备用。
连翘生物保鲜剂:选取100 mL连翘叶提取液作为母液,随后加入1%(质量分数)褪黑素搅拌均匀,冷藏24 h,再与壳聚糖膜液混合于三角瓶中,置于37 ℃水浴,1 h后超声30 min,即为连翘生物保鲜剂。
1.3.2 链格孢菌的菌株培养、孢子悬浮液制备及菌丝富集
菌株培养:将链格孢菌在PDA斜面培养基上于4 ℃保存。使用时将链格孢菌接种在PDA培养基上在恒温培养箱27 ℃下培养5~8 d。
孢子悬浮液制备:根据高春丽等[19]的方法并略作修改。将链格孢菌接种在PDA培养基并经27 ℃培养8 d后用无菌水冲洗,经无菌纱布过滤后得到孢子悬浮液,并用血球计数板将其浓度调整至1×108 CFU/mL,备用。
菌丝富集:将1 mL孢子悬浮液接种至PDB液体培养基中,在28 ℃、180 r/min振荡培养45 h后,静置1 h后冷冻离心(14 000 ×g,10 min,2 ℃),收集菌丝,并用无菌水洗涤链格孢菌菌丝3次后备用。
1.3.3 连翘生物保鲜剂对链格孢菌菌丝的最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)
MIC、MBC的测定:将连翘生物保鲜剂稀释成不同质量浓度梯度(10、25、40、55、70、85、100 mg/L),然后用无菌移液枪吸取不同质量浓度的连翘生物保鲜剂溶液于PDA平板并混匀,待其冷却后使用直径为5 mm的打孔器在平板中心打一孔,再将链格孢菌菌饼接入孔中,用封口膜封住后置于27 ℃的恒温培养箱中培养5 d,每隔1 d测量其生长直径,MIC为培养48 h时平板中无菌落生长的最低质量浓度,MBC为生长120 h时平板中完全没有菌落生长的最低质量浓度,对照组中加入相应体积的无菌蒸馏水。链格孢菌的抑制率按公式(1)计算。实验重复3次。
抑制率![]()
(1)
式中:dc为对照组生长直径,mm;dt为处理组生长直径,mm。
1.3.4 链格孢菌孢子存活率和菌丝生物量
孢子存活率的测定:在无菌蒸馏水中加入质量浓度为0、25、50、75、100 mg/L的连翘生物保鲜剂溶液,再加入适量的链格孢菌孢子悬浮液,使其终浓度为1×103个/mL,23 ℃下静置16 h,取50 μL混合液于PDA培养基上涂布培养120 h,记录培养基上的菌落总数。以无菌蒸馏水作为对照,重复3次。按照公式(2)计算:
孢子存活率![]()
(2)
菌丝生物量的测定:加入100 μL链格孢菌孢子悬浮液(5×105个/mL)至SDB液体培养基后于(28±2) ℃、150 r/min振荡培养120 h,室温下静置30 min,然后加入25 mL连翘生物保鲜剂溶液(终质量浓度分别为0、25、50、75、100 mg/L),继续振荡培养10 h后用滤纸过滤培养液收集菌丝,用去离子水冲洗2次以洗去培养液并收集菌丝,将收集到的链格孢菌菌丝于80 ℃下干燥12 h后分别称质量,以表征菌丝生物量。
1.3.5 链格孢菌细胞成分释放
参照孙月等[20]的方法对连翘生物保鲜剂作用链格孢菌后大分子物质泄漏情况进行分析。吸取适量链格孢菌孢子悬浮液于PDB液体培养基中,调整孢子浓度为5×105 CFU/mL,于25 ℃、180 r/min摇床培养5 d。取0.5 g链格孢菌菌丝体加入5 mL含有0、25、50、75、100 mg/L连翘生物保鲜剂的无菌水后取上清液,每8 h使用紫外分光光度计测定核酸泄漏量和可溶性蛋白含量,以添加等量无菌水的实验组作为对照组。
1.3.6 链格孢菌细胞膜通透性
丙二醛(malondialdehyde,MDA)含量测定:参照TAO等[21]的方法并稍作修改,吸取适量链格孢菌孢子悬浮液于PDB液体培养基中,调整孢子浓度为5×105 CFU/mL,于25 ℃、180 r/min摇床培养7 d。随后分别向PDB液体培养基中加入适量500 μL/mL的连翘生物保鲜剂溶液,使每个PDB液体培养基中连翘生物保鲜剂的质量浓度为0、25、50、75、100 mg/L,连续培养24 h,每8 h收集培养液,测定MDA含量。实验重复3次。
相对电导率测定:参照1.3.5节细胞成分释放测定法收集菌丝体,28 ℃、180 r/min摇床培养7 d后取上清液,加入0、25、50、75、100 mg/L连翘生物保鲜剂溶液测定相对电导率。实验重复3次。
1.3.7 链格孢菌菌丝形态
将链格孢菌菌饼接种至PDA培养基中,于27 ℃培养8 d后挑取菌丝于载玻片中央,滴入5 μL无菌水后盖上盖玻片后使用微分干涉相差显微镜拍照观察菌丝形态。实验重复3次。
1.3.8 链格孢菌麦角甾醇质量浓度的测定
参照TIAN等[22]的方法并稍作修改。从50 mL PDB液体培养基中收集培养5 d后的链格孢菌菌丝体,加入连翘生物保鲜剂溶液,以无菌蒸馏水作为对照,使其终质量浓度分别为0、25、50、75、100 mg/L,将含有不同浓度连翘生物保鲜剂的菌丝体研磨成菌粉,加入8 mL 25%(质量浓度)氢氧化钾-醇溶液后混匀,于80 ℃下静置2 h冷却,加入1 mL无菌水和3 mL 正戊烷混合均匀并静置10 min,在超净工作台内用无菌纱布过滤后吸取上清液,于A282nm下测定麦角甾醇质量浓度。
1.3.9 链格孢菌菌丝体Na+/K+-ATPase活力
根据崔醒等[23]的方法并稍作修改,将链格孢菌活化2次培养后冷冻离心(14 000×g,10 min,2 ℃)后去其上清液,并重悬于PBS缓冲液中,将连翘生物保鲜剂溶液加入至含有链格孢菌菌体沉淀的溶液中,使其终质量浓度分别为0、25、50、75、100 mg/L。将不同浓度的连翘生物保鲜剂分装于离心管中,并置于水浴锅里恒温培养37 ℃,6 h后离心取上清液,收集链格孢菌菌丝体细胞沉淀再次重悬于PBS缓冲液,然后超声40 s、每隔10 s超声一次。利用Na+/K+-ATPase试剂盒检测胞内酶活力。
1.3.10 链格孢菌呼吸代谢
呼吸抑制率的测定:根据李倩等[24]的方法略做修改。将7.2 mL磷酸盐缓冲液(pH 7.0)置于玻璃管中,加入2 mL链格孢菌孢子悬浮液(5×105个/mL)混匀,再加入0.8 mL 1%(质量分数)葡萄糖溶液在室温下静置20 min,然后加入1 mL连翘生物保鲜剂溶液(最终质量浓度分别为0、25、50、75、100 mg/L)混匀后静置30 min,用溶解氧测定仪测定其溶解氧浓度C0,在30 min 之后再次测定连翘生物保鲜剂溶液的溶解氧浓度C30min,并计算30 min内连翘生物保鲜剂溶液溶解氧浓度变化(R=C30min-C0)。呼吸抑制率的计算如公式(3)所示:
呼吸抑制率![]()
(3)
式中:R0和R1分别为空白组和连翘生物保鲜剂处理组在30 min内溶解氧浓度变化。
1.3.11 链格孢菌氧化应激
谷胱甘肽还原酶(glutathione reductase,GR)活力的测定:按1.3.2节获得连翘生物保鲜剂溶液处理后的链格孢菌菌丝,分别加入2.7 mL 0.1 mol/L磷酸钠缓冲液(含EDTA)、40 μL NADPH-Na4溶液、0.1 mL GSSG溶液混匀后吸取上清液备用。参照GR活力检测试剂盒的处理方法,测定340 nm波长处吸光度并利用10 s与80 s的差值计算GR活力。
过氧化氢酶(catalase,CAT)活力的测定:按1.3.2节获得连翘生物保鲜剂溶液处理后的链格孢菌菌丝,PBS洗涤后,称取1 g菌丝体,加入10 mL pH 7.0 50 mmol/L磷酸钠缓冲液,于冰浴研磨后冷冻离心(14 000×g,15 min,2 ℃),吸取上清液备用。参照CAT活力检测试剂盒的处理方法,测定240 nm波长处吸光度,计算CAT活力。
1.4 数据统计与分析
采用Excel 2010软件进行数据处理,使用Origin 2022软件作图和SPSS 16.0软件进行单因素方差分析,采用邓肯事后检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 连翘生物保鲜剂对链格孢菌的MIC、MBC
如表1所示,随着连翘生物保鲜剂质量浓度的增大,连翘生物保鲜剂对链格孢菌的抑制作用逐渐增强。在整个培养过程内,10 mg/L的连翘生物保鲜剂对链格孢菌的抑制作用较弱。40~70 mg/L的连翘生物保鲜剂对链格孢菌的抑制作用相近;在整个培养时间内,培养2 d时,25 mg/L的连翘生物保鲜剂可以完全抑制链格孢菌的生长;培养5 d时,100 mg/L的连翘生物保鲜剂可以完全抑制链格孢菌的生长,说明连翘生物保鲜剂抑制链格孢菌生长的MIC和MBC分别为25 mg/L和100 mg/L。
表1 连翘生物保鲜剂对链格孢菌的MIC、MBC
Table 1 MIC and MBC of Forsythia suspensa biological preservative against Alternaria alternata
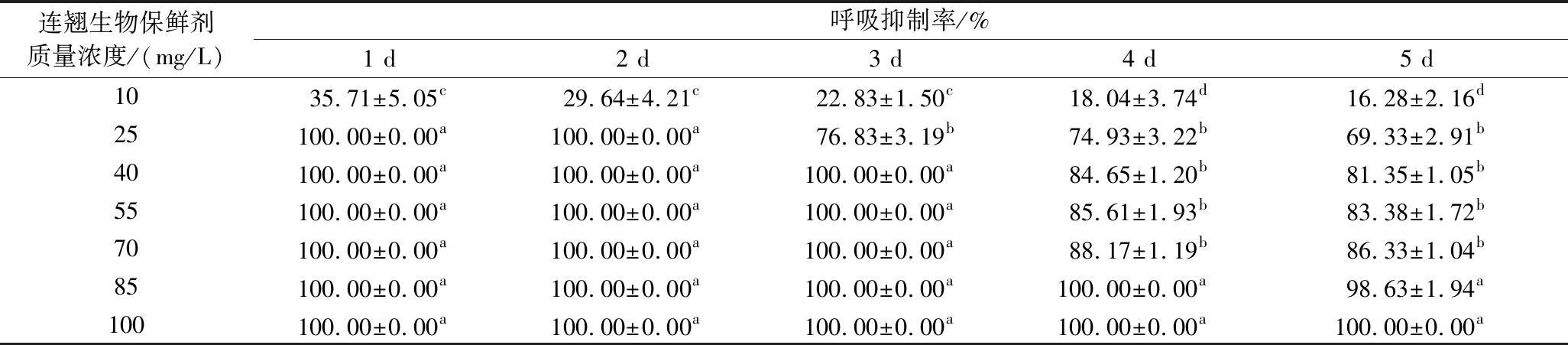
注:同列肩标小写字母不同表示差异显著(P<0.05)(下同)。
连翘生物保鲜剂质量浓度/(mg/L)呼吸抑制率/%1 d2 d3 d4 d5 d1035.71±5.05c29.64±4.21c22.83±1.50c18.04±3.74d16.28±2.16d25100.00±0.00a100.00±0.00a76.83±3.19b74.93±3.22b69.33±2.91b40100.00±0.00a100.00±0.00a100.00±0.00a84.65±1.20b81.35±1.05b55100.00±0.00a100.00±0.00a100.00±0.00a85.61±1.93b83.38±1.72b70100.00±0.00a100.00±0.00a100.00±0.00a88.17±1.19b86.33±1.04b85100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a98.63±1.94a100100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a
2.2 连翘生物保鲜剂对链格孢菌孢子存活率和菌丝生物量的影响
连翘生物保鲜剂所对应的MIC可以用孢子存活率和菌丝生物量来体现。如图1-A所示,对照组孢子存活率为98%,随着连翘生物保鲜剂质量浓度的增加,孢子存活率逐渐下降,25、50、75、100 mg/L的连翘生物保鲜剂处理组孢子存活率分别为73%、42%、36%和21%,这说明连翘生物保鲜剂可在一定程度上降低链格孢菌的孢子存活率,使其丧失繁殖能力。如图1-B所示,链格孢菌菌丝生物量随着连翘生物保鲜剂质量浓度的增加而下降,对照组在振荡培养24 h后的菌丝生物量显著高于其他处理组,与对照组相比,经过25 mg/L连翘生物保鲜剂处理后,菌丝生物量的降低效果明显,且100 mg/L的连翘生物保鲜剂处理组的菌丝生物量最低,为11.2 mg。由此可知,25 mg/L的连翘生物保鲜剂可以抑制菌丝的生长。

A-孢子存活率;B-菌丝生物量
图1 连翘生物保鲜剂处理后链格孢菌孢子存活率和菌丝生物量
Fig.1 Spore survival rate and mycelium biomass of Alternaria sp.treated with Forsythia biological preservative
注:不同小写字母不同表示差异显著(P<0.05)(下同)。
2.3 连翘生物保鲜剂对链格孢菌细胞成分释放的影响
细胞膜系统遭到损伤会造成微生物细胞内部多种重要生物大分子(核酸、蛋白质、糖类等)泄漏,从而影响正常的合成代谢功能,胞内核酸和蛋白质分别在260 nm和280 nm有最大吸收峰,可以间接表征细胞膜的完整性[25-26]。连翘生物保鲜剂处理能显著增加冬枣链格孢菌细胞成分的释放,如图2-A所示,经连翘生物保鲜剂处理后,链格孢菌上清液的OD260nm值较对照组显著增加。对照组的核酸泄露量最低,处理8 h时,25、50、75、100 mg/L处理组OD260nm值波动最小,24 h后,25、50、75、100 mg/L处理组OD260nm值分别为0.57±0.017、0.68±0.026、0.79±0.029、0.95±0.019,显著高于对照组(0.008±0.001)(P<0.05),说明连翘生物保鲜剂处理可破坏链格孢菌细胞膜完整性并使细胞严重受损,导致细胞内大分子泄漏,影响细胞代谢差异,从而使OD260nm值明显增加。

A-OD260nm值;B-OD280nm值
图2 连翘生物保鲜剂对链格孢菌细胞成分释放的影响
Fig.2 Effect of Forsythia suspensa biological preservative on the release of cell components of Alternaria alternata
如图2-B所示,OD280nm值随着连翘生物保鲜剂浓度的增加和时间的延长而增长。在整个处理时间内,8 h时,OD280nm值最低,在16 h之后,25 mg/L连翘生物保鲜剂处理后的可溶性蛋白含量显著高于对照组(P<0.05),分别为对照组的1.18倍、1.39倍、1.6倍、1.72倍,处理24 h之后,可溶性蛋白含量达到峰值。说明连翘生物保鲜剂处理可以增加链格孢菌细胞的通透性,随着连翘生物保鲜剂质量浓度的增加,链格孢菌可溶性蛋白含量明显增加,表明连翘生物保鲜剂处理对冬枣链格孢菌细胞膜具有一定的破坏作用。
2.4 连翘生物保鲜剂对链格孢菌细胞膜通透性的影响
细胞膜通透性作为抗真菌作用的常用靶标,是衡量抑菌效果的重要依据[27-28]。MDA是细胞膜脂质过氧化的重要产物,能够间接表达细胞膜氧化受损的程度[29]。如图3-A所示,随着连翘生物保鲜剂质量浓度和处理时间的延长,MDA含量呈现上升的趋势。处理8 h时,25、50、75、100 mg/L连翘生物保鲜剂处理组的MDA含量增加较缓慢,处理24 h后,25、50、75、100 mg/L连翘生物保鲜剂处理组的MDA含量分别为0.99、1.27、1.55、1.75 nmol/g,对照组MDA含量(0.233 nmol/g)显著低于各处理组(P<0.05)。从图3-B可以看出,各组处理的相对电导率值随着连翘生物保鲜剂质量浓度的升高而增加,处理8 h时,0、25、50 mg/L的相对电导率值最低,处理24 h后,25、50、75、100 mg/L连翘生物保鲜剂处理组的相对电导率值分别为20.02%、29.15%、36.41%、44.65%,显著高于对照组(P<0.05)。结果表明,连翘生物保鲜剂处理能够加剧链格孢菌细胞膜脂过氧化,使细胞膜相对电导率增加,可能是连翘生物保鲜剂处理破坏了链格孢菌的细胞膜结构,使细胞内离子泄露,胞内外渗透压失衡,导致其产生不可逆的损伤,从而有效抑制链格孢菌的生长。

A-MDA含量;B-相对电导率
图3 连翘生物保鲜剂对链格孢菌细胞膜通透性的影响
Fig.3 Effect of Forsythia suspensa biological preservative on cell membrane permeability of Alternaria alternata
2.5 连翘生物保鲜剂对菌丝形态的影响
如图4-A所示,对照组链格孢菌菌丝表面光滑,质地均匀,隔膜较为明显,而经过连翘生物保鲜剂处理的链格孢菌菌丝表面颜色较浅并出现溶解现象(图4-B)。表明连翘生物保鲜剂处理可以对链格孢菌的细胞结构造成不同程度的破坏,使细胞成分发生泄露,从而影响链格孢菌的正常生理功能,这与处理组OD260nm、OD280nm值升高的结果相吻合。

A-对照组;B-连翘生物保鲜剂
图4 连翘生物保鲜剂对菌丝形态的影响
Fig.4 Effect of Forsythia suspensa biological preservative on mycelium morphology
2.6 连翘生物保鲜剂处理对麦角甾醇的影响
麦角甾醇是真菌特有的固醇,是真菌细胞膜的主要固醇成分,具有维持细胞功能和完整性的作用[30]。由图5可知,麦角甾醇含量随着连翘生物保鲜剂质量浓度的增加而减少,与对照组相比,连翘生物保鲜剂处理后的麦角甾醇含量显著降低,25、50、75、100 mg/L连翘生物保鲜剂处理组麦角甾醇含量分别下降40.9%、53.4%、76.1%、85.27%,这可能是因为连翘生物保鲜剂中的连翘中含有抗氧化活性连翘脂苷,通过破坏麦角甾醇的生物合成途径以达到抑菌效果,导致链格孢菌细胞膜中麦角甾醇含量下降,这与钱沈安等[31]研究结果相一致。
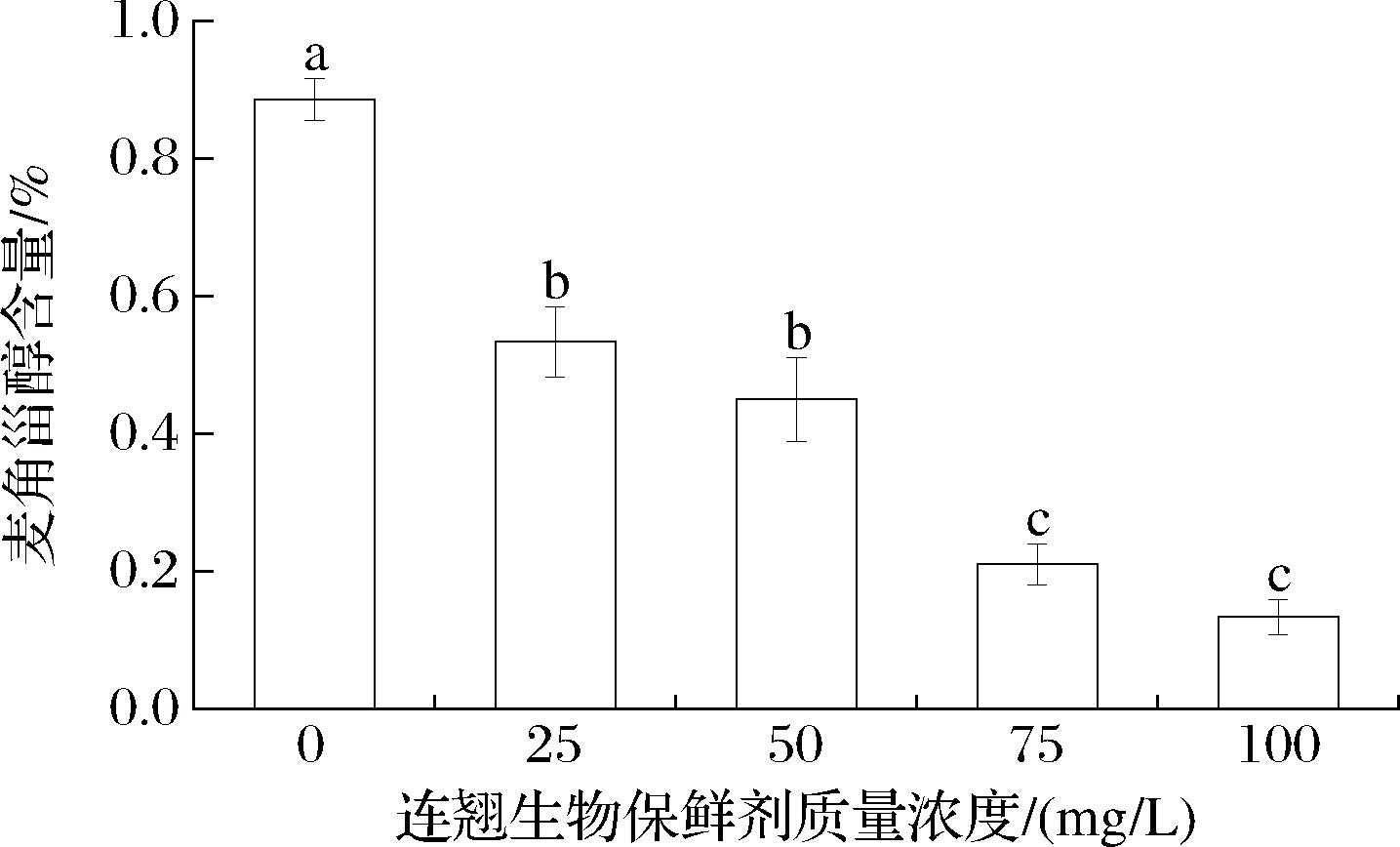
图5 连翘生物保鲜剂对麦角甾醇的影响
Fig.5 Effect of Forsythia suspense biological preservative on ergosterol
2.7 连翘生物保鲜剂对菌丝体Na+/K+-ATPase活力的影响
Na+/K+-ATPase是一种蛋白酶,存在于组织细胞内,通过细胞内Na+/K+-ATPase活力的变化可以反映连翘生物保鲜剂对链格孢菌细胞能量代谢的影响[32-33]。如图6所示,在整个处理期间,连翘生物保鲜剂处理浓度越大,链格孢菌菌丝体Na+/K+-ATPase活力就越低,对照组在处理8 h时,链格孢菌菌丝体Na+/K+-ATPase活力最大,处理24 h之后,链格孢菌菌丝体Na+/K+-ATPase活力逐渐降低。这表明连翘生物保鲜剂能有效抑制链格孢菌Na+/K+-ATPase活力,影响细胞的正常能量代谢。
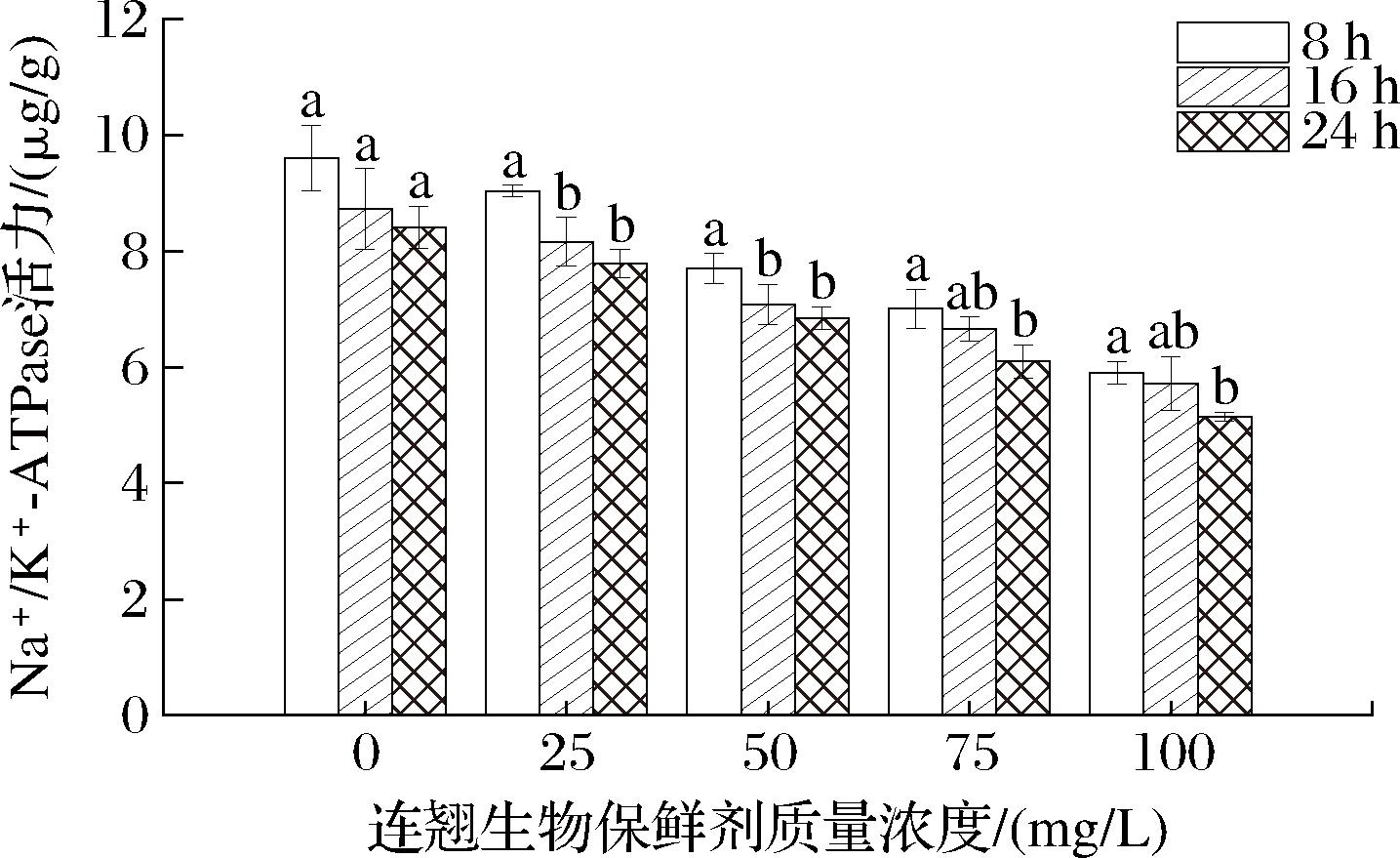
图6 连翘生物保鲜剂对菌丝体Na+/K+-ATPase活力的影响
Fig.6 Effect of biological preservative on Na+/K+-ATPase activity of mycelium of Forsythia suspensa
2.8 连翘生物保鲜剂对链格孢菌呼吸代谢的影响
通过检测细胞外溶液中的溶解氧,能够了解链格孢菌消耗氧气的情况,进而通过计算呼吸抑制率分析连翘生物保鲜剂对链格孢菌呼吸的抑制作用。如图7 所示,在整个处理期间,链格孢菌的呼吸抑制率随着连翘生物保鲜剂质量浓度的增加而逐渐升高,100 mg/L连翘生物保鲜剂处理组达到高峰。与对照组相比,实验组对链格孢菌的呼吸抑制率呈现剂量依赖关系。25、50、75、100 mg/L连翘生物保鲜剂处理组的呼吸抑制率分别为15.34%、28.12%、34.76%、47.85%。这可能是因为连翘生物保鲜剂中的连翘与壳聚糖协同作用对真菌的呼吸代谢有抑制效果。
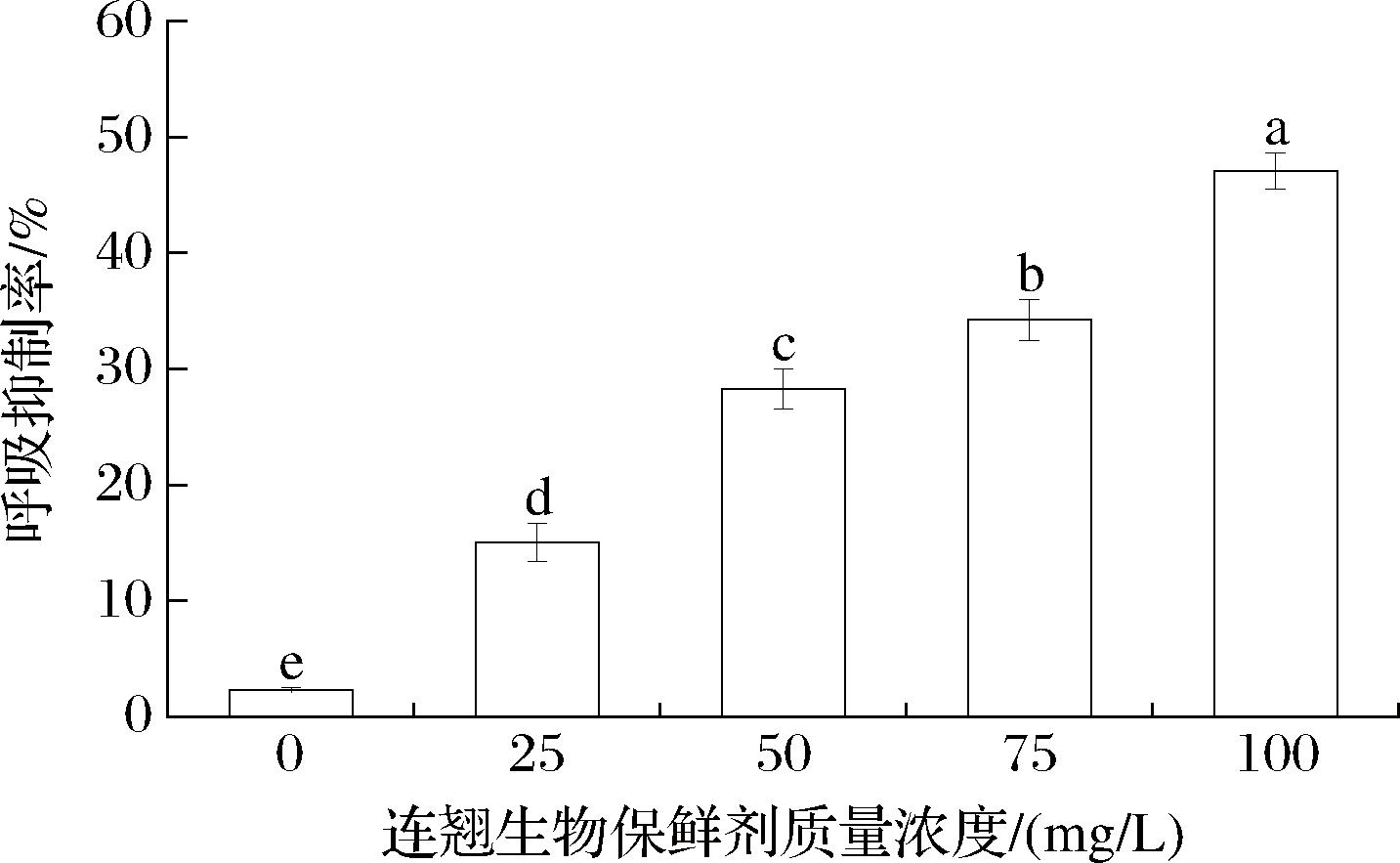
图7 连翘生物保鲜剂对链格孢菌呼吸代谢的影响
Fig.7 Effect of Forsythia suspensa biological preservative on respiratory metabolism of Alternaria alternata
2.9 连翘生物保鲜剂对链格孢菌氧化应激的影响
促进真菌细胞活性氧生成、诱导氧化应激、加重氧化损伤是许多天然植物成分发挥抑菌作用的重要机制之一[34]。本研究通过测定GR、CAT活力考察连翘生物保鲜剂对链格孢菌氧化应激的影响。
如图8-A所示,连翘生物保鲜剂对GR活力有明显的抑制效果,其随着连翘生物保鲜剂质量浓度的增加而逐渐降低。由此可见,GR活力的降低可能会使细胞更易受到过氧化氢和自由基的伤害,从而导致细胞凋亡。不同于GR,CAT活力先升高后降低(图8-B),质量浓度为25、50、75、100 mg/L连翘生物保鲜剂处理组的CAT活力分别是对照组的1.93倍、2.19倍、2.45倍和2.2倍。CAT是最主要的H2O2清除酶,在低质量浓度连翘生物保鲜剂作用下链格孢菌细胞通过CAT活力的升高抵御氧化损伤,而高质量浓度连翘生物保鲜剂则可能打破细胞的氧化应激平衡并诱发损伤凋亡,使得CAT活力下降。

A-GR活力;B-CAT活力
图8 连翘生物保鲜剂对链格孢菌氧化应激的影响
Fig.8 Effect of Forsythia suspensa biological preservative on oxidative stress of Alternaria alternata
3 讨论
链格孢菌是冬枣贮藏期间的主要致病菌,其潜伏期较长,具有较强的侵染性,易导致冬枣腐烂变质,给果农造成重大损失。开发绿色、安全、高效的保鲜剂是目前冬枣贮藏亟待解决的关键问题。连翘是山西特色中草药,其叶子中含有的连翘苷和连翘酯苷具有良好抗菌和抗氧化活性。已有研究表明,连翘叶提取物对大肠杆菌、表皮葡萄球菌具有良好的抑制作用[35-36],而壳聚糖具有无毒、抑菌、生物相容性好等特点[37],其与连翘叶提取液协同可增强抑菌作用,因此本研究中连翘生物保鲜剂是由连翘叶提取液与壳聚糖复合配制而成,将其作为绿色的防控方式,有作为天然保鲜剂的潜在价值。
连翘生物保鲜剂展现出了对冬枣采后链格孢菌的抑制潜力,MIC和MBC是反映抗菌物质抗菌活性的指标,连翘生物保鲜剂抑制链格孢菌生长的MIC和MBC分别为25 mg/L和100 mg/L,说明其可有效延缓或抑制冬枣链格孢菌的菌丝生长。连翘生物保鲜剂质量浓度越高,抑菌作用越明显。在本研究中,孢子存活率和菌丝生物量的测定结果可以反映抑菌效果,对照组处理后的链格孢菌孢子存活率和菌丝生物量较高,通过微分干涉相差显微镜对链格孢菌菌丝形态观察发现,对照组菌丝外观具有良好的完整性,当连翘生物保鲜剂质量浓度进一步增加至100 mg/L时,孢子存活率和菌丝生物量分别为23.3%和11.2 mg,显著低于对照组(P<0.05),观察到链格孢菌菌丝出现部分溶解,菌丝体的生长几乎被完全抑制,菌丝体表面出现不可逆的形态变化,出现干枯等现象。这与李瑞一等[29]的研究结果相一致。实验结果表明,当使用25、50、75、100 mg/L的连翘生物保鲜剂处理后,冬枣链格孢菌的OD260nm、OD280nm值、MDA含量、相对电导率随着处理时间延长和连翘生物保鲜剂质量浓度的增加而增加,且连翘生物保鲜剂质量浓度为100 mg/L时,均在处理24 h后达到最高峰。以上结果表明,连翘生物保鲜剂质量浓度越高,越可以轻松黏附于链格孢菌细胞表面,渗透到细胞内破坏胞内物质,使其细胞膜通透性增大,造成细胞组分渗出,最终致使细胞凋亡。
破坏细胞膜完整性是抑制病原微生物生长繁殖的主要作用方式。经连翘生物保鲜剂处理后链格孢菌麦角甾醇含量显著低于对照组(P<0.05),且不同质量浓度连翘生物保鲜剂处理组麦角甾醇含量差异显著。研究结果表明,连翘生物保鲜剂处理后的Na+/K+-ATPase活力下降,可能是因为连翘生物保鲜剂阻碍Na+/K+-ATPase调节细胞内钠/钾离子浓度,使细胞内Na+、K+的跨膜运输缺少能量支持,这与刘耀耀等[38]的研究结果一致。此外,经连翘生物保鲜剂处理后的链格孢菌呼吸代谢逐渐增强,并在质量浓度为100 mg/L时达到高峰,显著高于对照组(P<0.05),而经连翘生物保鲜剂处理后的链格孢菌GR活性显著低于对照组(P<0.05),CAT活力却呈现先上升后下降趋势,这说明在处理冬枣链格孢菌时,连翘生物保鲜剂发挥抗菌活性具有发展潜力。连翘生物保鲜剂处理通过破坏微生物细胞膜,导致膜脂质过氧化程度加深,引起细胞内外渗透压失衡,胞内渗透性增强,由胞内向胞外泄漏,使其OD260nm、OD280nm对应物质流失,破坏了蛋白质和遗传物质结构,同时降低了病原微生物的氧化应激水平,最终抑制微生物对果蔬的侵染[25-26]。本实验中经100 mg/L连翘生物保鲜剂处理后,增强了细胞膜通透性,导致OD260nm、OD280nm、MDA含量和相对电导率分别显著上升0.45倍、0.98倍、2.17倍、2.6倍。这与孙月等[20]的研究结果基本一致。另外,连翘生物保鲜剂对链格孢菌的作用靶标集中在细胞膜上,导致麦角甾醇含量降低和细胞内Na+/K+-ATPase活力下降,干扰细胞能量代谢过程,诱导细胞凋亡,从而抑制链格孢菌的生长繁殖。
4 结论
本研究通过体外抑菌实验发现,连翘生物保鲜剂可以有效抑制链格孢菌的菌丝生长和呼吸代谢、降低孢子存活率、增加相对电导率、使MDA含量上升,加剧了链格孢菌细胞膜脂过氧化,破坏了细胞膜完整性,降低了麦角甾醇含量,导致细胞内OD260nm、OD280nm对应物质泄漏,抑制了链格孢菌胞内Na+/K+-ATPase、GR和CAT活力,从而影响细胞的正常能量代谢,达到抑菌效果。
[1] 宋威. 金褐霉素对冬枣的保鲜效果及机制研究[D].沈阳:辽宁大学,2016.SONG W.Fresh-keeping effects and mechanism of Chinese winter jujube using Aureofuscin treatments[D].Shenyang: Liaoning University, 2016.
[2] 郭宇逍, 雷兴梦, 刘摇 等.超声波联合水杨酸处理对冬枣采后黑斑病的防控研究[J].食品与发酵工业, 2024, 50(4):68-76.GUO Y X, LEI X M, LIU Y, et al.Prevention and control of postharvest black spot disease of jujube by ultrasonic combined with salicylic acid treatment[J].Food and Fermentation Industries, 2024, 50(4):68-76.
[3] 武杰, 张引成, 李梅玲 等.3种处理方式对冬枣货架期品质的影响[J].食品科学, 2012,33(6):278-282.WU J, ZHANG Y C, LI M L, et al.Effects of different treatments on storage quality of Dongzao jujube fruits during shelf-life period[J].Food Science, 2012, 33(6):278-282.
[4] GATTO M A, IPPOLITO A, LINSALATA V, et al.Activity of extracts from wild edible herbs against postharvest fungal diseases of fruit and vegetables[J].Postharvest Biology and Technology, 2011, 61(1):72-82.
[5] 蒋卉, 朱丽霞, 郭东起.冬枣采后黑腐病病原菌分离鉴定及控制研究[J].北方园艺, 2014(9):133-136.JIANG H, ZHU L X, GUO D Q.Study on the isolation, identification and control of black mould pathogen of winter jujube after postharvest[J].Northern Horticulture, 2014(9):133-136.
[6] 康慧芳, 乔勇进, 刘晨霞, 等.二氧化氯气体对葡萄链格孢菌的抑制作用[J].食品与发酵工业, 2021, 47(2):95-101.KANG H F, QIAO Y J, LIU C X, et al.Inhibitory effect of chlorine dioxide gas on Alternaria alternata[J].Food and Fermentation Industries, 2021, 47(2):95-101.
[7] 蔡蜨, 雷兴梦, 王文军, 等.CaCl2处理增强Debaryomyces nepalensis对冬枣采后黑斑病的控制效果及机制[J].食品与发酵工业, 2023, 49(19):274-281.CAI D, LEI X M, WANG W J, et al.Effectiveness and mechanism of CaCl2 treatment in enhancing Debaryomyces nepalensis against postharvest black spot of jujube[J].Food and Fermentation Industries, 2023, 49(19):274-281.
[8] 杨阳阳, 刘志恬, 李永才,等.吡啶-2,6-二羧酸处理对梨果采后黑斑病控制作用及其抑菌机理[J].食品科学, 2022, 43(11):163-170.YANG Y Y, LIU Z T, LI Y C, et al.Control effect of pyridine-2,6-dipicolinic acid treatment on postharvest black spot of pear fruit and possible antifungal mechanism[J].Food Science, 2022, 43(11):163-170.
[9] BANDEIRA G, P S T S, SACCOL E M H, et al.Potential uses of Ocimum gratissimum and Hesperozygis ringens essential oils in aquaculture[J].Industrial Crops and Products, 2017, 97:484-491.[10] QU H H, ZHANG Y M, WANG Y, et al.Antioxidant and antibacterial activity of two compounds (Forsythiaside and forsythin) isolated from Forsythia suspensa[J].Journal of Pharmacy and Pharmacology, 2008, 60(2):261-266.
S T S, SACCOL E M H, et al.Potential uses of Ocimum gratissimum and Hesperozygis ringens essential oils in aquaculture[J].Industrial Crops and Products, 2017, 97:484-491.[10] QU H H, ZHANG Y M, WANG Y, et al.Antioxidant and antibacterial activity of two compounds (Forsythiaside and forsythin) isolated from Forsythia suspensa[J].Journal of Pharmacy and Pharmacology, 2008, 60(2):261-266.
[11] SHAO S Y, ZHANG F, YANG Y N, et al.Neuroprotective and anti-inflammatory phenylethanoidglycosides from the fruits of Forsythia suspensa[J].Bioorganic Chemistry, 2021, 113:105025.
[12] DENG R X, ZHOU S N, YANG X, et al.Two new furofuran lignan glycosides from Forsythia suspensa leaves[J].Phytochemistry Letters, 2021, 41:34-37.
[13] 潘婷婷, 高彩玲.连翘叶提取物与壳聚糖复配物对圣女果保鲜作用的研究[J].陕西农业科学, 2020, 66(5):44-47.PAN T T, GAO C L.Study on the fresh-keeping effect of Forsythia suspensa leaf extract and chitosan complex on cherry tomatoes[J].Shaanxi Journal of Agricultural Sciences, 2020,66(5):44-47.
[14] 潘婷婷, 尹慧娟.连翘叶提取物对冷藏猪肉的保鲜效果研究[J].商洛学院学报,2019, 33(6):30-34.PAN T T, YIN H J.A study on fresh-keeping effect of Forsythia leaves extract from different harvesting periods on chilled pork[J].Journal of Shangluo University, 2019, 33(6):30-34.
[15] 原江锋, 王大红, 何灵美, 等.连翘叶提取物抑菌作用以及稳定性研究[J].食品工业科技, 2013, 34(5):57-59;65.YUAN J F, WANG D H, HE L M, et al.Study on antimicrobial activity and stability of Forsythia suspensa leaves extract[J].Science and Technology of Food Industry, 2013, 34(5):57-59;65.
[16] LI X G, NI J, SHEN S, et al.Pharmacokinetic interaction of Forsythia suspensa extract and azithromycin injection after single and co-intravenous administration in rats[J].Chinese Journal of Natural Medicines, 2020, 18(3):234-240.
[17] 齐建红, 赵咏梅.连翘苷对几种动物油脂的抗氧化作用[J].食品与发酵工业, 2012, 38(6):119-121.QI J H, ZHAO Y M.Study the antioxidant activity of phillyri on edible oil and fat[J].Food and Fermentation Industries, 2012, 38(6):119-121.
[18] 龙沈飞, 王文涛, 朴香淑.连翘的作用机理及其在猪和鸡生产中的应用[J].动物营养学报, 2019, 31(4):1499-1510.LONG S F, WANG W T, PIAO X S.Mechanism and application of Forsythia suspensa in pig and chicken production[J].Chinese Journal of Animal Nutrition, 2019, 31(4):1 499-1 510.
[19] 高春丽, 李永才, 毕阳, 等.采后亚硒酸钠处理对杏果黑斑病的控制及贮藏品质的影响[J].食品科学, 2016, 37(14):258-263.GAO C L, LI Y C, BI Y, et al.Effects of sodium selenite treatment on black spot disease and storage quality of postharvest apricot fruit[J].Food Science, 2016, 37(14):258-263.
[20] 孙月, 曾朝懿, 李梓钰, 等.山苍子精油对白假丝酵母菌细胞膜屏障影响的机理[J].食品科学, 2023, 44(17):29-35.SUN Y, ZENG C Y, LI Z Y, et al.Mechanism for the effect of Litsea cubeba essential oil on Candida albicans cell membrane barrier[J].Food Science, 2023, 44(17):29-35.
[21] TAO N G, OU YANG Q L, JIA L.Citral inhibits mycelial growth of Penicillium italicum by a membrane damage mechanism[J].Food Control, 2014, 41:116-121.
[22] TIAN J, BAN X Q, ZENG H, et al.The mechanism of antifungal action of essential oil from dill (Anethum graveolens L.) on Aspergillus flavus[J].PLoS One, 2012, 7(1):e30147.
[23] 崔醒, 朱秋劲, 侯瑞, 等.丁香酚、香芹酚和百里香酚对禾谷镰刀菌的抑菌活性及机制[J].食品科学, 2022, 43(23):10-18.CUI X, ZHU Q J, HOU R, et al.Antibacterial activity and mechanism of eugenol, carvacrol and thymol against Fusarium graminearum[J].Food Science, 2022, 43(23):10-18.
[24] 李倩, 赵颖, 乔苏瑞, 等.二氢杨梅素抑制黄曲霉菌生长的机制[J].食品科学, 2022, 43(13):8-14.LI Q, ZHAO Y, QIAO S R, et al.Antifungal mechanism of dihydromyricetin against Aspergillus flavus[J].Food Science, 2022, 43(13):8-14.
[25] MEI C C, WANG X, CHEN Y C, et al.Antibacterial activity and mechanism of Litsea cubeba essential oil against food contamination by Escherichia coli and Salmonella enterica[J].Journal of Food Safety, 2020, 40(4):e12809.
[26] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control, 2016, 59(1):282-289.
[27] 彭洋, 杨书珍, 张美红, 等.橙子果皮诱导抗病组分对意大利青霉的抑菌活性及作用机制[J].食品科学, 2019, 40(9):1-6.PENG Y, YANG S Z, ZHANG M H, et al.Antifungal activity and possible mode of action of induced disease-resistant components in orange peels against Penicillium italicum[J].Food Science, 2019, 40(9):1-6.
[28] 孙畅, 李湘, 王银红, 等.山苍子精油对柑橘意大利青霉的抑菌活性及作用机制[J].食品科学, 2023, 44(11):17-25.SUN C, LI X, WANG Y H, et al.Antibacterial activity and mechanism of Litsea cubeba essential oil against Penicillium italicum in Citrus fruits[J].Food Science, 2023,44(11):17-25.
[29] 李瑞一, 吴伟杰, 房祥军, 等.紫苏醛对杨梅主要致病菌桔青霉的抑菌活性及作用机制[J].食品科学, 2023, 44(15):196-203.LI R Y, WU W J, FANG X J, et al.Antifungal activity and mechanism of perillaldehyde against Penicillium citrinum, a major fungal pathogen of Myrica rubra[J].Food Science, 2023,44(15):196-203.
[30] KISHIMOTO T, YAMAMOTO T, TANAKA K.Defects in structural integrity of ergosterol and the Cdc50p-Drs2p putative phospholipid translocase cause accumulation of endocytic membranes, onto which actin patches are assembled in yeast[J].Molecular Biology of the Cell, 2005, 16(12):5592-5609.
[31] 钱沈安, 胡政, 于伊楠, 等.1-辛烯-3-醇对禾谷镰刀菌的抑制活性及作用机理[J].食品科学, 2023, 44(18):93-101.QIAN S A, HU Z, YU Y N, et al.Inhibition activity and mechanism of 1-octen-3-ol on the growth and deoxynivalenol biosynthesis of Fusarium graminearum[J].Food Science, 2023,44(18):93-101.
[32] 谭小丽, 龙春燕, 李路, 等.脱氢乙酸钠抑制指状青霉的作用机制[J].食品科学, 2022, 43(23):19-26.TAN X L, LONG C Y, LI L, et al.Antifungal mechanism of sodium dehydroacetate against Penicillium digitatum[J].Food Science, 2022, 43(23):19-26.
[33] 万倩, 黄晓英, 李启明, 等.乳酸链球菌素Q13的纯化及其对保加利亚乳杆菌的抑菌机理[J].食品科学, 2022, 43(18):159-165.WAN Q, HUANG X Y, LI Q M, et al.Purification of Nisin Q13 and its antibacterial mechanism against Lactobacillus bulgaricus[J].Food Science, 2022, 43(18):159-165.
[34] KUMAR A, KUJUR A, SINGH P P, et al.Nanoencapsulated plant-based bioactive formulation against food-borne molds and aflatoxin B1 contamination:Preparation, characterization and stability evaluation in the food system[J].Food Chemistry, 2019, 287:139-150.
[35] 闫瑞平. 发酵连翘叶提取物抗炎活性筛选及作用机制研究[D]. 太原: 山西大学, 2023.YAN R P. Screening of anti-inflammatory activity and mechanism of extracts from fermented Forsythia suspensa leaves[D]. Taiyuan: Shanxi University, 2023.
[36] 王学方. 连翘叶化学成分的提取分离及抗氧化和抗肿瘤作用研究[D]. 郑州: 河南农业大学, 2022.WANG X F. Extraction and separation of chemical constituents from Forsythia suspensa leaves and their antioxidant and antitumor effects[D]. Zhengzhou: Henan Agricultural University, 2022.
[37] XIE Q W, LIU G S, ZHANG Y L, et al.Active edible films with plant extracts:A updated review of their types, preparations, reinforcing properties, and applications in muscle foods packaging and preservation[J].Critical Reviews in Food Science and Nutrition, 2023, 63(32):11425-11447.
[38] 刘耀耀, 刘哲, 李珊, 等.青藏高原狭果茶藨子对蜡样芽孢杆菌的抑菌活性及作用机理[J].食品与发酵工业, 2021, 47(6):99-104.LIU Y Y, LIU Z, LI S, et al.Antibacterial activities and mechanisms of Ribes stenocarpum Maxim in Qinghai-Tibet Plateau against Bacillus cereus[J].Food and Fermentation Industries, 2021, 47(6):99-104.