长期持续反复暴露于环境、工作、饮食、生活节律、心理认知等压力下,机体会发生应激反应[1],这种应激反应被称为慢性不可预知温和应激(chronic unpredictable mild stress, CUMS),会引起一系列心理和生理损伤[2],主要表现为抑郁、焦虑、失眠、肠黏膜损伤、消化道功能紊乱、系统性炎症、肠道菌群紊乱及系统代谢障碍等,对人体的生命健康造成极大的威胁。据报道,目前抑郁症患者已占全世界人口的3%~5%[3],在我国比例更高,给社会经济带来极大的负担。然而,目前针对慢性应激引起的抑郁样行为及其机体损伤的干预措施效果有限,已成为全世界共同面临的卫生健康难题,寻求高效的控制措施已成为全社会关注的热点。
长期以来临床上针对抑郁症的治疗主要采用心理干预和服用单胺类、三环类等精神类药物[4],但效果有限,且使用的药物多数具有较大的副作用。近年来,连翘、逍遥散等中药成分药物也被广泛用于抗抑郁干预,但其仍存在机制不清且具有一定毒副作用等缺陷,不适合用于预防;同样,益生菌在某些研究中被用于缓解CUMS引起的抑郁样行为,但其个体间效果差异较大,存在较大的不确定性[5]。因此,开发毒副作用小、干预效果好、适合用于日常预防的活性物质,已成为近年来国内外的研究热点。
食物源成分具有高安全性特点,可以满足人们对安全性的要求。然而目前实践中利用膳食对CUMS引起的抑郁样行为进行预防式干预的研究较为鲜见。随着近年来“微生物-肠-脑”轴观念的提出[6],研究学者们发现肠道微生物代谢与CUMS引起的抑郁样行为有着密切关联[7],但针对肠道微生物代谢的干预措施相对匮乏。团队前期研究发现,CUMS模型小鼠肠道菌群某些特定氨基酸和糖代谢水平过度升高,会导致特定菌群丰度改变,引起肠道黏膜损伤、肠道通透性增加,诱发机体炎症,并导致抑郁样行为的发生。但目前尚缺乏针对慢性应激诱发的肠道菌群氨基酸与糖类代谢紊乱进行干预以缓解机体抑郁样行为的研究。
本研究拟针对慢性应激诱发的肠道特定氨基酸与糖的缺乏,采用一种广泛分布于南海海域的深海鱼红笛鲷的膳食粗蛋白[8]与特定寡糖组成复合粉,对慢性不可预知温和应激模型小鼠进行预防式干预,评价其对慢性应激诱发的小鼠行为学、系统炎症、肠道损伤以及肠道菌群相关典型指标的影响,为开发高效安全预防慢性压力环境下机体行为学异常的食物源产品提供支撑。
1 材料与方法
1.1 材料与试剂
肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin -6,IL-6)、白细胞介素1β(interleukin-β,IL-1β)、白细胞介素10(interleukin-10,IL-10)ELISA 试剂盒,深圳欣博盛生物科技股份有限公司;脂多糖(lipopolysaccharides,LPS)试剂盒,厦门鲎试剂生物科技股份有限公司;无水乙醇,杭州宏达化工仪器有限公司,二甲苯,国药集团化学试剂有限公司;牛血清白蛋白、苏木素染液、二氨基联苯胺,杭州浩克生物科技有限公司。
1.2 仪器与设备
旷场反应箱、高架十字迷宫、5810R 台式冷冻离心机,艾本德中国有限公司;H1650-W台式高速离心机,湖南湘仪实验室仪器开发有限公司;脱水机、生物组织自动包埋机、石蜡包埋机(冷台),湖北贝诺医疗科技有限公司;LCMS-8030 超快速液相色谱串联质谱仪,岛津(日本);Varioskan Flash全自动酶标仪,赛默飞世尔科技有限公司;HistoCoreBIOCUT转轮式切片机,徕卡显微系统上海有限公司,;HGPF-50烤箱,上海跃进医疗器械有限公司;51A011-KD-P组织摊片机,浙江金华科迪仪器设备有限公司;710510载玻片及盖玻片,江苏汇达医疗器械有限公司;DP260s达科为染色机,深圳市达科为医疗科技有限公司。
1.3 实验方法
1.3.1 复合粉样品的制备
当地购买的新鲜红笛鲷鱼,在冷藏条件下转移至实验室。对整鱼去皮、去鳞、去骨,参照TASKAYA等[9]的方法并作适当调整,提取蛋白。鱼肉样品与蒸馏水以1∶6(料液比,g∶mL)进行混合匀浆,均质10 min,用氢氧化钠溶液(1 mol/L)调节均质液pH值至11.2,充分均质后离心(10 000×g, 10 min, 4 ℃),弃去表层脂肪与底层沉淀,得可溶性蛋白溶液,用盐酸溶液(6 mol/L)调节蛋白溶液pH值至5.5,混合均匀后离心(10 000×g, 10 min, 4 ℃),弃去上清液,沉淀烘干后得蛋白含量为90.7%的红笛鲷鱼肉粗蛋白。其主要成分为谷氨酸、赖氨酸、天冬氨酸、酪氨酸、苏氨酸等氨基酸[10]。
红鲷鱼粗蛋白充分粉碎后,加入一定量低聚麦芽糖、低聚果糖、半乳甘露聚糖,充分混匀,得红笛鲷蛋白与寡糖复合粉,装入封口袋中,于4 ℃保存,备用。红笛鲷蛋白与寡糖复合粉配方见表1。
表1 红笛鲷蛋白与寡糖复合粉配方
Table 1 Formulation of Lutianus erythropterus crud protein and oligosaccharide compound powder

成分红笛鲷鱼肉蛋白粉低聚麦芽糖低聚果糖半乳甘露聚糖含量/%(质量分数)66.688.3316.668.33
1.3.2 动物分组与处理
80只雄性7周龄SPF级C57BL/6小鼠,体重18~20 g,购买于珠海百试通生物科技有限公司,实验动物许可证号SCXK(粤)2020-0051;实验小鼠饲养于广东海洋大学食品科技学院SPF级动物房(许可证号:SYKX(粤)2014-0053),实验控制温度为(22±3) ℃、湿度为(60±10)%;除特定应激条件需求,对动物进行12 h光/暗循环,并给予标准饮食和自由饮水。动物实验伦理批号:GDOU-LAE-2022-007。
在实验开始前,给予动物7 d适应期。将80只小鼠平均分成4组,分别为空白对照组(CON)、模型组(CUMS)、阳性对照组(FLU)、干预组(PRSP)。从CUMS建模第1天,同时开始对小鼠用事先确定好的干预物质进行干预。空白组和模型组小鼠灌胃等量生理盐水,阳性对照组灌胃10 mg/(kg·d)氟西汀,干预组灌胃1.8 g/(kg·d)红笛鲷蛋白与寡糖复合粉PRSP。
1.3.3 CUMS过程
根据文献方法[11]修改后,对模型组、阳性对照组和干预组给予压力源进行应激。这些压力源分别为禁食(24 h)、禁水(24 h)、束缚(4~6 h)、连续黑暗(24 h)、倾斜鼠笼(24 h)、噪音(1 h)、频闪(8 h)、潮湿垫料(24 h)、不加垫料(24 h),它们在6周内重复随机给予且分布均匀。
1.3.4 糖水试验
在第6周CUMS应激结束后,对各组小鼠进行糖水试验(sucrose preference test,SPT)。试验方法参照文献[12]进行修改,记录各笼消耗的蔗糖溶液与水的体积,并按照公式(1)计算蔗糖偏好:
蔗糖偏好![]()
(1)
1.3.5 悬尾试验
在第6周CUMS应激结束后,对各组小鼠进行悬尾试验(tail suspension test,TST)。试验方法参照文献[13]进行少许修改,并记录后4 min内小鼠不动的时长。
1.3.6 旷场试验
在第6周CUMS应激结束后,对各组小鼠进行旷场试验(open field test,OFT)。试验方法参照文献[14]进行少许修改,记录6 min内小鼠进入中心区域的次数及停留时间。
1.3.7 结肠组织染色切片
迅速取出小鼠消化道各段组织,生理盐水冲洗肠道内容物,立即投入10%(体积分数)中性甲醛固定液中充分固定。固定24 h后,经修剪、取材,石蜡包埋后进行病理切片、苏木精-伊红(hematoxylin-eosin,HE)染色、光镜下观察组织病理学变化,并根据表2进行评分。
表2 结肠黏膜损伤评分表
Table 2 Colonic mucosal injury scale
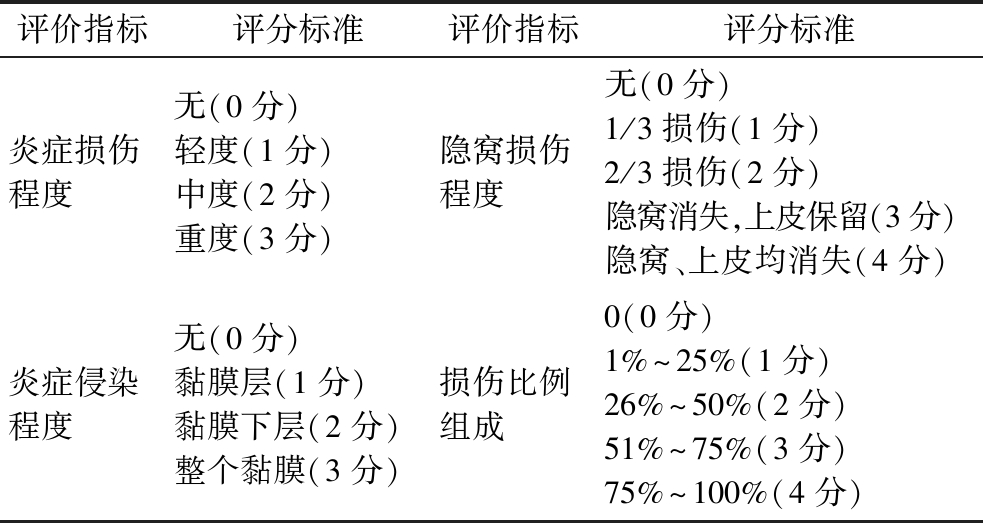
评价指标评分标准评价指标评分标准炎症损伤程度无(0分)轻度(1分)中度(2分)重度(3分)隐窝损伤程度无(0分)1/3损伤(1分)2/3损伤(2分)隐窝消失,上皮保留(3分)隐窝、上皮均消失(4分)炎症侵染程度无(0分)黏膜层(1分)黏膜下层(2分)整个黏膜(3分)损伤比例组成0(0分)1%~25%(1分)26%~50%(2分)51%~75%(3分)75%~100%(4分)
1.3.8 免疫组化观察黏液蛋白2和闭锁小带蛋白1含量变化
在试验结束后,立即解剖小鼠,并在冰上迅速分离小鼠消化道各段组织,生理盐水冲洗肠道内容物,立即投入10%中性甲醛固定液中充分固定。冲水,脱水,石蜡包埋,切片。脱蜡后切片于乙二胺四乙酸抗原修复液中进行高温抗原修复,3%(体积分数)双氧水阻断内源性过氧化物酶,3%(质量分数)牛血清白蛋白进行血清封闭,一抗和二抗孵育后,二氨基联苯胺显色,苏木素染色,自来水和返蓝液返蓝,组织切片进行梯度酒精脱水,封片。用光学显微镜观察,通过Image J18.0软件进行图像分析黏液蛋白2(mucin-2, MUC2)和闭锁小带蛋白1(zonula occluden-1, ZO-1)相对含量。
1.3.9 酶联免疫吸附试验测定小鼠血清中炎性指标
在试验结束后,对小鼠进行眼球取血。血液收集进无热源离心管中,离心(4 ℃,8 000 r/min)10 min,分离并收集血清。采用微板显色法测定血清中D-乳酸(D-lactic acid,D-LA)和LPS浓度。采用酶联免疫吸附法测定血清中TNF-α、IL-6、IL-1β和IL-10。
1.3.10 16S rDNA 微生物高通量测序及生物信息学分析
在CUMS造模结束后,用无菌离心管收集小鼠新排出粪便。粪便样本由杭州谷禾信息技术有限公司通过Illumina NovaSeq6000高通量测序平台进行16S rDNA基因高通量测序。通过与数据库对比,获取样品的菌群组成及代谢预测相关信息。
1.4 统计分析
采用SPSS 23.0统计软件对数据进行分析,各组间比较用单因素方差分析(one-way ANOVA),两两比较用最小显著差数法(LSD-t)检验,统计结果以“平均数±标准差”(x±SD)表示。P<0.05表示存在显著性差异,P<0.01表示存在极显著性差异。
2 结果与分析
2.1 PRSP对蔗糖消耗率的影响
由图1可知,CUMS组在经过6周的CUMS应激后,小鼠的蔗糖消耗率显著降低(P<0.05)。与CUMS组相比,FLU组与PRSP干预组蔗糖消耗率均显著升高(P<0.05),恢复至空白水平,在改善CUMS引起的快感缺失方面,PRSP具有与氟西汀相似的效果。

图1 PRSP对蔗糖消耗率的影响
Fig.1 Effect of PRSP on sucrose consumption rate
注:*,#表示显著差异(P<0.05)(下同)。
2.2 PRSP对TST静止时间的影响
由图2可知,与CON组相比,CUMS组小鼠的TST静止时间极显著延长(P<0.01)。与CUMS组相比,阳性对照组与PRSP干预组TST静止时间均极显著缩短(P<0.01),均可减少小鼠绝望时间至空白水平。
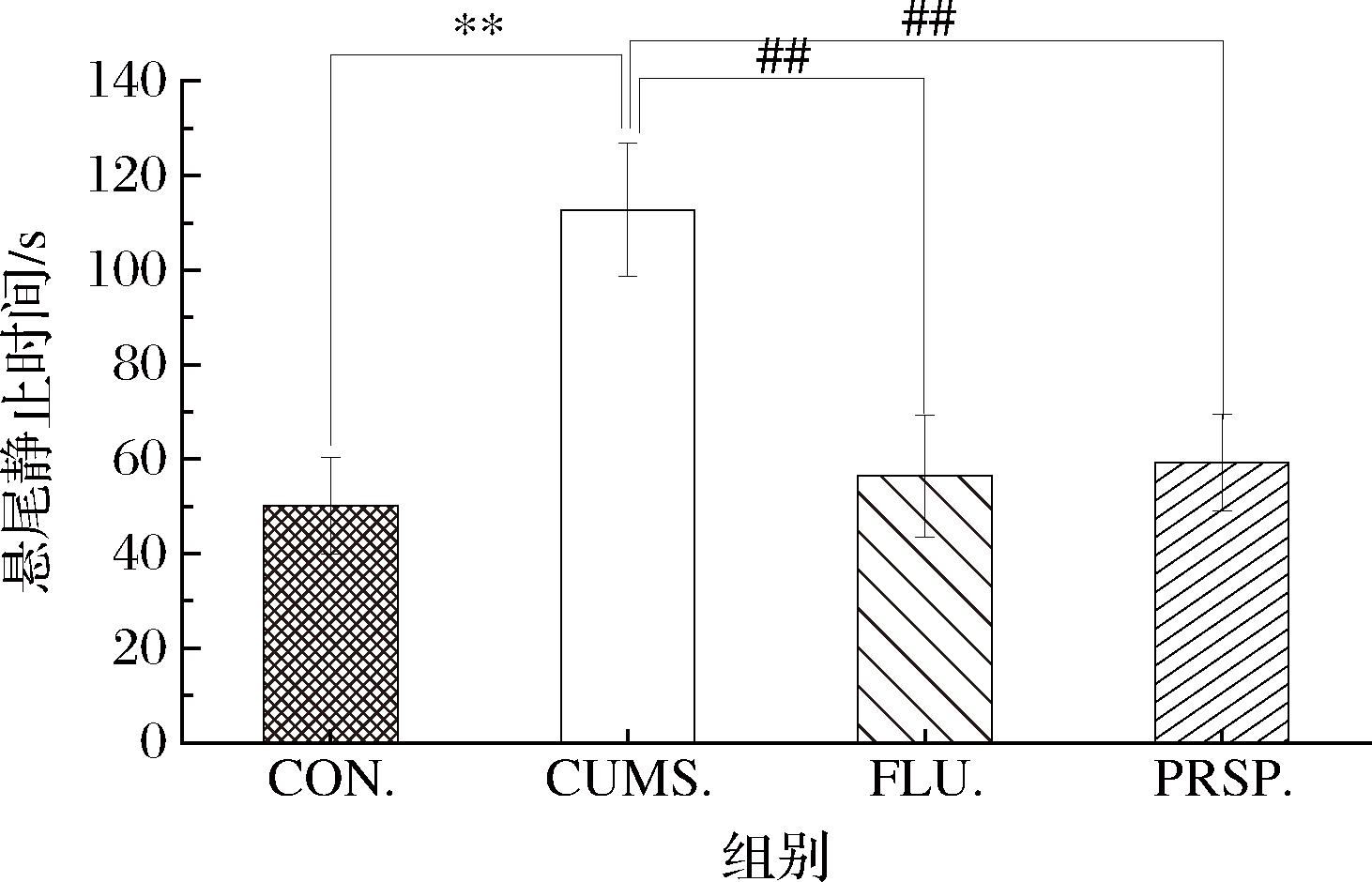
图2 PRSP对TST静止时间的影响
Fig.2 Effect of PRSP on TST resting time
注:**,##表示极显著差异(P<0.01)(下同)。
2.3 PRSP对OFT中心区域停留时间的影响
由图3可知,与CON组相比,CUMS组小鼠在中心区域停留时间显著延长(P<0.05),探索欲望降低。与CUMS组相比,FLU组中心区域停留时间无显著缩短,PRSP干预后中心区域停留时间显著缩短(P<0.05),小鼠探索行为恢复至空白水平,效果优于氟西汀。
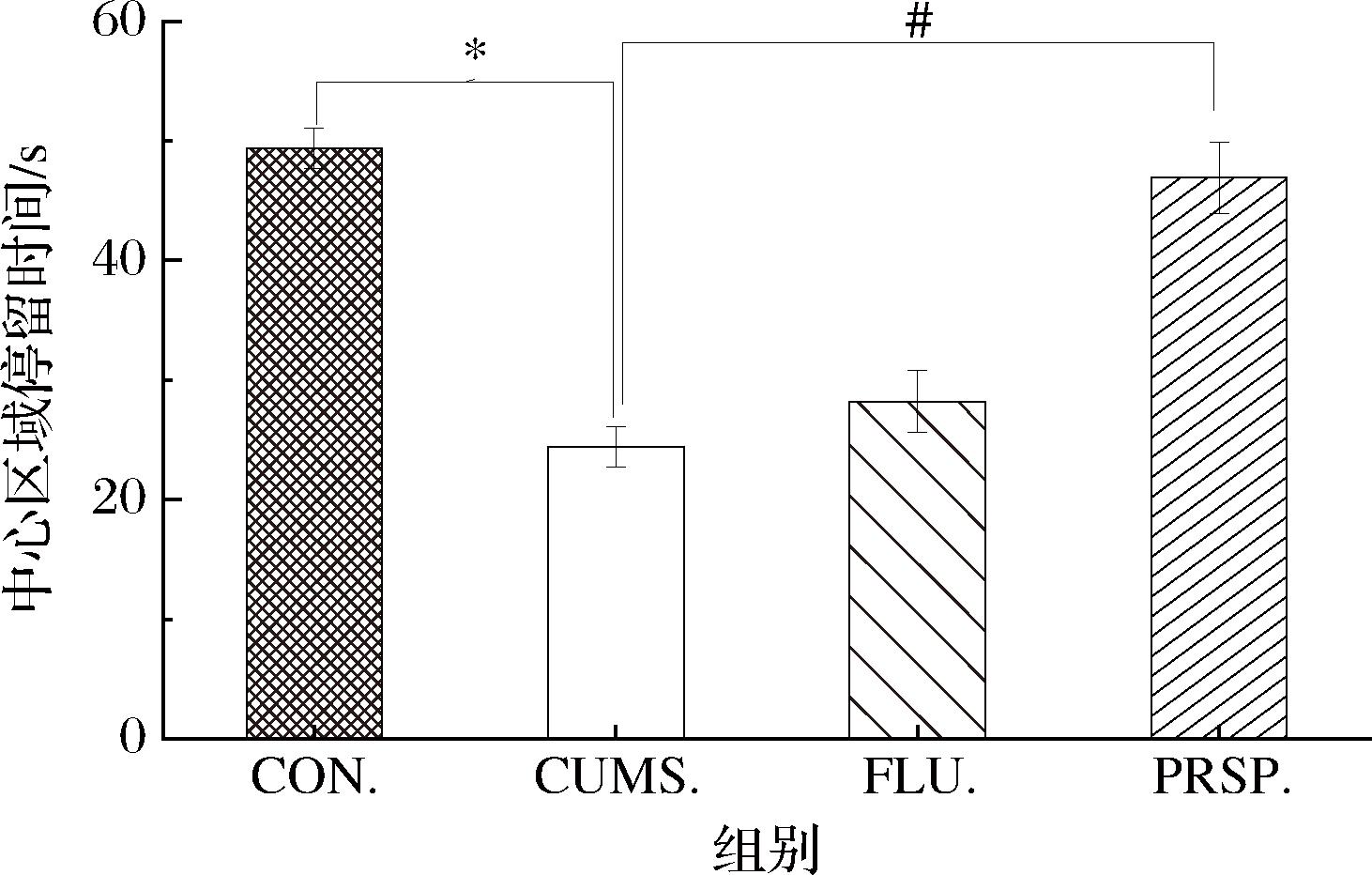
图3 PRSP对OFT中心区域停留时间的影响
Fig.3 Effect of PRSP on residence time in the central region of the OFT
2.4 PRSP对结肠黏膜形态的影响
由图4-a~图4-d可知,空白组隐窝形态正常,黏膜柱状细胞间存在大量杯状细胞且整齐排列;CUMS组结肠黏膜形态受损严重,隐窝形态变短,杯状细胞大量减少;与CUMS组相比,PRSP干预组结肠黏膜形态恢复正常,隐窝长度与接触面积增加,黏膜柱状细胞间杯状细胞数量基本恢复。
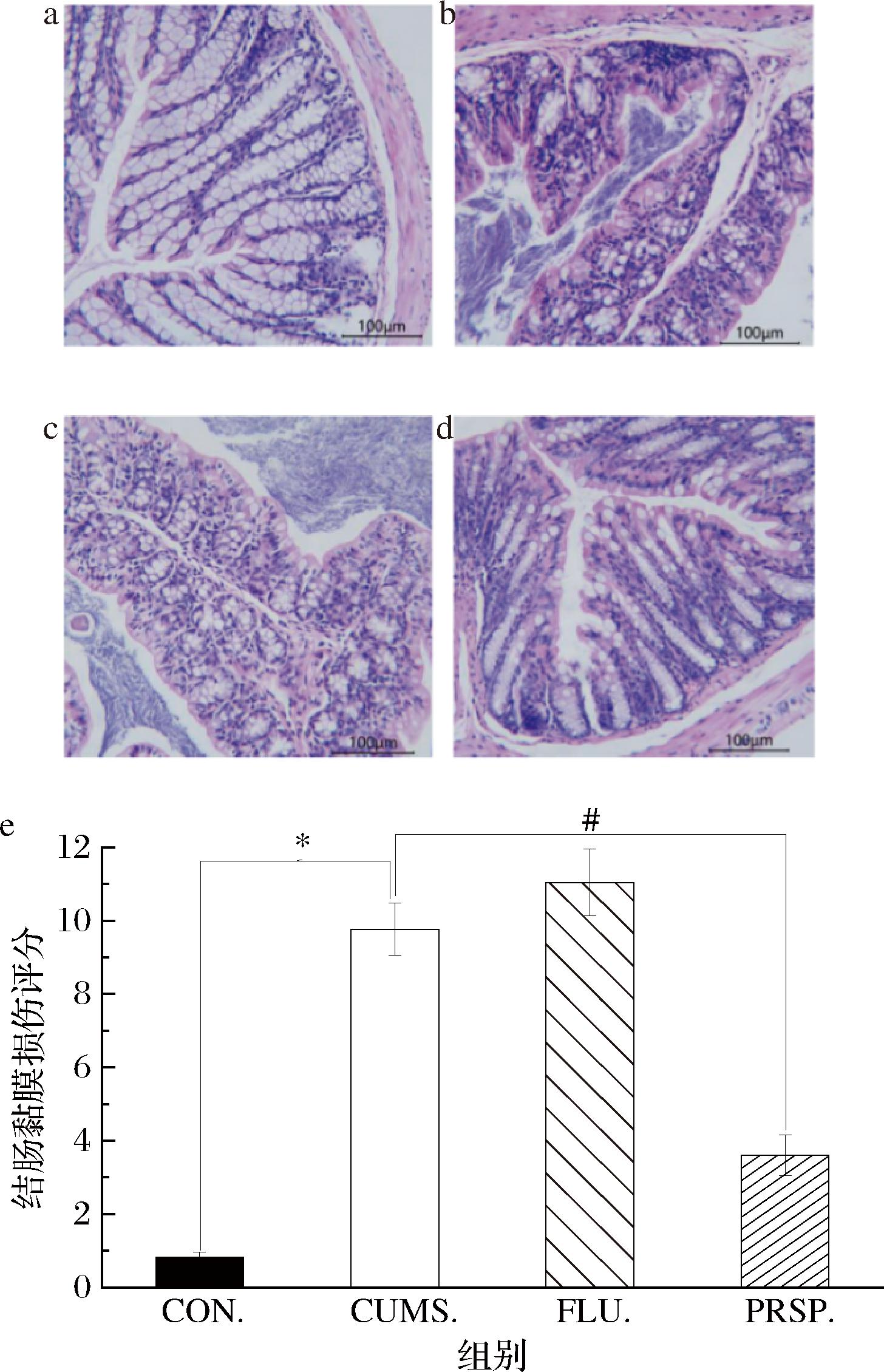
a-CON组;b-CUMS组;c-FLU组;d-PRSP组;e-结肠黏膜损伤评分
图4 PRSP对结肠黏膜形态的影响
Fig.4 Effect of PRSP on the morphology of colonic mucosa
由图4-e可知,与CON组相比,CUMS组小鼠结肠黏膜损伤评分显著增加(P<0.05)。与CUMS组相比,PRSP干预组结肠黏膜损伤评分显著降低(P<0.05),显示PRSP可以有效改善CUMS引起的肠道屏障损伤。
2.5 PRSP对结肠黏膜黏液蛋白MUC2表达的影响(免疫组化法)
由图5可知,各组结肠黏膜表面均有MUC2表达,与CUMS组相比,CON组和PRSP组表达量较高。通过Image J18.0软件进行图像分析MUC2含量,结果如图,与空白组相比,模型组小鼠结肠黏膜MUC2含量降低55.52%(P<0.01)。与CUMS组相比,PRSP组小鼠结肠黏膜MUC2含量增加114.20%(P<0.01),恢复至空白水平。

a-CON组;b-CUMS组;c-FLU组;d-PRSP组;e-各组结肠MUC2表达量
图5 PRSP对结肠黏膜黏液蛋白MUC2表达的影响
Fig.5 Effect of PRSP on the expression of colonic mucosal mucin MUC2

a-CON组;b-CUMS组;c-FLU组;d-PRSP组;e-各组结肠ZO-1表达量
图6 PRSP对结肠黏膜紧密连接蛋白ZO-1表达的影响
Fig.6 Effect of PRSP on the expression of colonic mucosal tight junction protein ZO-1
2.6 PRSP对结肠黏膜紧密连接蛋白ZO-1表达的影响(免疫组化法)
由图6可知,各组结肠黏膜表面均有ZO-1表达,FLU组表达量较低。通过Image J18.0软件进行图像分析ZO-1含量,与CON组相比,CUMS组小鼠结肠黏膜ZO-1含量降低13.69%,FLU组ZO-1表达显著下降(P<0.05)。与CUMS组相比,PRSP组小鼠结肠黏膜ZO-1含量增加10.65%,无显著差异(P>0.05)。
2.7 PRSP对肠黏膜通透性的影响
由图7可知,与CON组相比,CUMS组小鼠血清中D-LA和LPS含量分别升高72.80%(P<0.01)和153.60%(P<0.01)。与CUMS组相比,PRSP干预组小鼠血清中D-LA和LPS含量分别降低18.87%(P<0.05)和67.18%(P<0.01),接近空白水平。
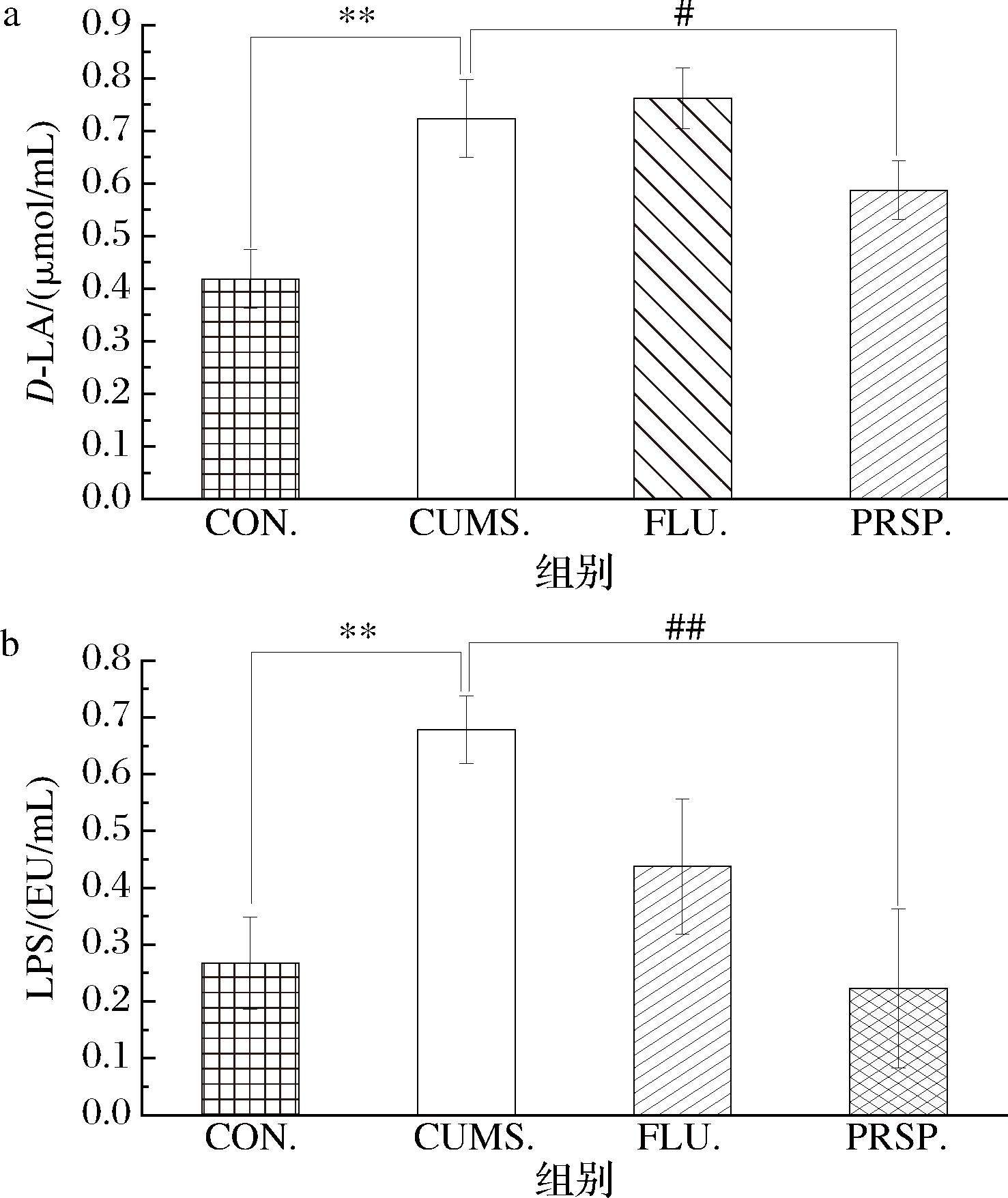
a-D-LA;b-LPS
图7 PRSP对血清中D-LA及LPS水平的影响
Fig.7 Effect of PRSP on serum levels of D-LA and LPS
2.8 PRSP对炎症因子水平的影响
由图8可知,与CON组相比,CUMS组小鼠血清中的TNF-α、IL-6和IL-1β的水平显著上升,分别升高52.15%、69.99%和93.63%(P<0.05)。经过PRSP干预后,小鼠血清中的TNF-α和IL-6水平显著降低,分别下降24.27%和44.94%(P<0.05);IL-1β的水平降低25.50%。CUMS与PRSP干预对小鼠血清中IL-10水平的影响均不显著。

a-血清中TNF-α浓度;b-血清中IL-6浓度;c-血清中IL-1β浓度;d-血清中IL-10浓度
图8 PRSP对血清中炎症因子水平的影响
Fig.8 Effect of PRSP on serum levels of inflammatory factors
注:***表示极显著差异(P<0.001)。

a-小鼠肠道菌群OTUs数目韦恩图;b-小鼠肠道菌群结构的PCoA图;c-小鼠肠道菌群门水平组成;d-小鼠肠道菌群属水平组成
图9 PRSP对小鼠肠道微生物组成的影响
Fig.9 Effect of PRSP on gut microbiological composition in mice
2.9 PRSP对肠道微生物组成的影响
韦恩图(图9-a)显示了各组间共有与特有分类单元(operational taxonomic units, OTUs)数目的差异。与空白组相比,模型组特有OTUs数目显著下降;而PRSP干预组的OTUs数目相比于模型组显著升高。主坐标分析(图9-b)通过样品之间的间距显示各组在β多样性上没有显著差异。
图9-c显示了各组间肠道菌群组成在门水平上的差异。在门水平上,CON组拟杆菌门(Bacteroidetes)丰度为64.8%,厚壁菌门(Firmicutes)丰度为34.0%;CUMS组Bacteroidetes丰度为35.6%,Firmicutes丰度为63.5%;CUMS组菌群Firmicutes与Bacteroidetes丰度之比(F/B)显著高于CON组(P<0.05)。PRSP干预组Bacteroidetes丰度为60.2%,Firmicutes丰度为38.7%,相比于CUMS组F/B显著降低(P<0.05),恢复至空白水平。
图9-d显示了各组间肠道菌群组成在属水平上的差异。在属水平上,CON组优势菌群及其丰度分别占比拟杆菌属(Bacteroides)41.9%、毛螺菌属(Lachnospiraceae)22.3%、罗氏菌属(Oscillibacter)4.0%、另枝菌属(Alistipes)3.6%;CUMS组优势菌群及其占比分别为Bacteroides(30.2%)、Lachnospiraceae(16.7%)、Oscillibacter(3.1%)、Alistipes(7.1%);与CON组相比,CUMS组Bacteroides、Lachnospiraceae、Oscillibacter的丰度显著下降(P<0.05),Alistipes的丰度占比显著升高(P<0.05)。PRSP干预组优势菌群及其丰度占比分别为Bacteroides(43.3%)、Lachnospiraceae(20.0%)、Oscillibacter(3.9%)、Alistipes(3.6%);相比于CUMS组,PRSP干预组Bacteroides、Lachnospiraceae、Oscillibacter的丰度显著升高(P<0.05),Alistipes的丰度显著降低(P<0.05),各菌属丰度均恢复至空白水平。
2.10 PRSP对肠道微生物氨基酸代谢及糖类代谢的影响
由图10可知,与CON组相比,CUMS组小鼠结肠内菌群酪氨酸降解Ⅰ、谷氨酸降解Ⅰ、谷氨酰胺降解Ⅱ、苏氨酸降解Ⅰ显著升高(P<0.05)。与CUMS组相比,PRSP干预组小鼠结肠内菌群酪氨酸降解Ⅰ、谷氨酸降解Ⅰ、谷氨酰胺降解Ⅱ、苏氨酸降解Ⅰ显著降低(P<0.05),恢复至空白水平。

a-酪氨酸降解Ⅰ;b-谷氨酸降解Ⅰ;c-谷氨酰胺降解Ⅱ;d-苏氨酸降解Ⅰ
图10 小鼠结肠内容物氨基酸代谢预测结果
Fig.10 Predicted amino acid metabolism of mouse colon contents

a-半乳糖降解;b-果糖降解;c-蔗糖降解Ⅰ;d-麦芽糖降解
图11 小鼠结肠内容物糖类代谢预测结果
Fig.11 Predicted results of sugar metabolism in mouse colon contents
由图11可知,与CON组相比,CUMS组小鼠结肠内菌群半乳糖降解、果糖降解、蔗糖降解Ⅰ、麦芽糖降解显著升高(P<0.05)。与CUMS组相比,PRSP干预组小鼠结肠内菌群半乳糖降解、果糖降解、蔗糖降解Ⅰ、麦芽糖降解显著降低(P<0.05),恢复至空白水平。
3 讨论
CUMS常用来模拟机体在长期压力环境下的生理病变及行为变化,这些变化可通过糖水试验、悬尾试验、旷场试验等行为学试验进行评估。其中,糖水试验、悬尾试验、旷场试验分别为评价快感缺失、抗压能力、自发活动行为的行为学指标。本研究显示,糖水试验中模型组小鼠的蔗糖消耗率较空白组小鼠显著降低,表明小鼠甜味偏好减少,PRSP干预后蔗糖消耗率显著升高, 表明PRSP起到较好食物抑制作用,且其干预效果优于氟西汀。悬尾试验中模型组小鼠的悬尾静止时间较空白组小鼠显著延长,氟西汀与PRSP均能明显抑制上述行为改变。旷场试验中模型组小鼠在中央格停留时间较空白组小鼠明显缩短,表明小鼠探索性显著下降,PRSP及氟西汀干预后小鼠探索性得到显著提高。上述行为学指标均表明,PRSP可有效抑制CUMS诱发的抑郁样行为,其效果与传统抗抑郁药物氟西汀相似, 对部分抑郁样行为指标的干预效果甚至优于氟西汀。
研究表明,CUMS引起的抑郁样行为与肠道屏障损伤存在一定联系[15]。本研究结果显示,CUMS作用下, 结肠组织形态出现明显损伤,PRSP干预后结肠组织形态得到显著改善,表明PRSP具有良好的保护肠道的作用。MUC2是肠上皮细胞分泌黏液中的主要糖蛋白,糖基化的MUC2能维持屏障完整性[16],对维持肠黏膜稳态至关重要。紧密连接是维持肠黏膜上皮机械屏障和通透性的重要结构[17],ZO-1是其重要构成[18]。本研究显示,相比空白组,CUMS小鼠结肠中MUC2表达显著降低,说明肠黏膜黏蛋白层遭到破坏;而ZO-1表达无显著差异,说明CUMS对小鼠肠道屏障连接结构影响较小。总之, 上述结果表明CUMS可能主要通过破坏肠黏膜黏蛋白层诱发结肠黏膜损伤,而PRSP复合粉可调节MUC2的表达有效抑制肠道黏膜黏液层损伤。
血清中D-LA、LPS含量是评价肠上皮细胞通透性的典型指标[19]。本研究显示,CUMS小鼠血清中D-LA与LPS含量均显著升高,而经PRSP干预后显著降低, 并基本恢复至对照组水平, 这说明PRSP可有效抑制长期压力环境下肠道通透性增加。
血清中的炎症因子TNF-α、IL-6、IL-1β水平显著升高与机体炎症、抑郁样行为等密切相关[20]。本研究显示,CUMS小鼠血清中TNF-α、IL-6和IL-1β含量均显著升高,PRSP干预后血清中上述炎症因子含量恢复至对照组水平,说明PRSP可有效抑制CUMS诱发的机体炎症, 具有良好的抗炎潜力。
生物体长期暴露于压力环境中,易诱导肠道微生物的结构组成改变[21],引起机体肠道黏膜损伤、通透性增加,进而引发机体炎症反应,导致抑郁样行为的发生[22]。本研究显示,CUMS组小鼠结肠内容物特有OTUs数目显著下降,Firmicutes与Bacteroidetes丰度之比(F/B)显著升高,PRSP干预后小鼠结肠内容物特有OTUs数目及F/B恢复至空白水平, 表明PRSP能够有效预防CUMS诱发的小鼠结肠内菌群紊乱。此外,CUMS小鼠结肠中Lachnospiraceae与Oscillibacter丰度显著下降、Alistipes丰度显著上升,经PRSP干预后三者丰度均恢复正常。据报道,Lachnospiraceae和Oscillibacter是肠道微生物群中重要的短链脂肪酸产生菌[23],可为结肠上皮细胞提供能量,维持肠道屏障功能[24]。Alistipes会降解肠道中的色氨酸[25],间接减少机体血清素的合成,进而影响宿主的精神健康。由此说明,PRSP可通过调节肠道中Lachnospiraceae、Oscillibacter及Alistipes的丰度改善小鼠的慢性应激损伤。
另外,本研究通过菌群代谢预测发现,CUMS小鼠结肠菌群的谷氨酸、谷氨酰胺、酪氨酸、苏氨酸、半乳糖、果糖、蔗糖、麦芽糖等代谢通路基因丰度均显著升高,PRSP干预后上述代谢通路基因丰度均明显恢复到空白对照组水平,说明CUMS模型小鼠肠道菌群同时存在特定氨基酸和糖代谢水平过度升高,可能会诱发结肠中某些特定氨基酸及糖缺失。红笛鲷蛋白作为海洋源优质蛋白,富含谷氨酸、谷氨酰胺、酪氨酸、苏氨酸,与CUMS小鼠肠道缺失的特定氨基酸对应度高,同时,复合粉中的寡糖组成富含低聚麦芽糖、低聚果糖、半乳甘露聚糖、麦芽糖、果糖、蔗糖和半乳糖,使PRSP可以同时补充小鼠肠道因慢性应激而被过度消耗的特定氨基酸和糖类,避免了结肠中氨基酸和糖的失衡,进而逆转了肠道菌群结构紊乱和维护肠黏膜屏障完整性。总之,PRSP通过维持CUMS小鼠肠道菌群结构平衡抑制小鼠血清炎性因子分泌,改善CUMS小鼠系统炎症,进而有效预防CUMS小鼠抑郁样行为的出现。
4 结论
本研究针对CUMS诱发小鼠结肠中菌群特定氨基酸与糖的过度代谢,采用红笛鲷的膳食粗蛋白与特定寡糖组成复合粉探究其预防抑郁样行为及机体相关损伤的作用。研究结果表明,该复合粉可以抑制慢性应激诱发的小鼠结肠菌群结构紊乱及其特定的氨基酸和糖代谢异常升高,并阻止机体系统炎症及结肠损伤的发生,对抑郁样行为起到很好的预防作用,研究结果可为高效安全预防抑郁症的食物源产品的开发提供理论支撑。
[1] WILLNER P.The chronic mild stress (CMS) model of depression:History, evaluation and usage[J].Neurobiology of Stress, 2017, 6:78-93.
[2] TURNER A I, SMYTH N, HALL S J, et al.Psychological stress reactivity and future health and disease outcomes:A systematic review of prospective evidence[J].Psychoneuroendocrinology, 2020, 114:104599.
[3] QIAO H, LI M X, XU C, et al.Dendritic spines in depression:What we learned from animal models[J].Neural Plasticity, 2016, 2016:8056370.
[4] STREKALOVA T, LIU Y Z, KISELEV D, et al.Chronic mild stress paradigm as a rat model of depression:Facts, artifacts, and future perspectives[J].Psychopharmacology, 2022, 239(3):663-693.
[5] DIDARI T, MOZAFFARI S, NIKFAR S, et al.Effectiveness of probiotics in irritable bowel syndrome:Updated systematic review with meta-analysis[J].World Journal of Gastroenterology, 2015, 21(10):3072-3084.
[6] SUN Q Y, CHENG L, ZENG X X, et al.The modulatory effect of plant polysaccharides on gut flora and the implication for neurodegenerative diseases from the perspective of the microbiota-gut-brain axis[J].International Journal of Biological Macromolecules, 2020, 164:1484-1492.
[7] LI N N, WANG Q, WANG Y, et al.Fecal microbiota transplantation from chronic unpredictable mild stress mice donors affects anxiety-like and depression-like behavior in recipient mice via the gut microbiota-inflammation-brain axis[J].Stress, 2019, 22(5):592-602.
[8] 区又君, 柳琪, 刘泽伟.3种笛鲷的含肉率、肥满度、比肝重和肌肉营养成分的分析[J].大连水产学院学报, 2006, 21(3):287-289.QU Y J, LIU Q, LIU Z W.Addressed rates, condition factors, hepatosomatic index and approximate compositions of muscles in emperor snapper (Lutjanus sebae), red snapper (L.erythopterus) and silver snapper (L.argentimaculatus)[J].Journal of Dalian Fisheries University, 2006, 21(3):287-289.
[9] TASKAYA L, CHEN Y C, BEAMER S, et al.Texture and colour properties of proteins recovered from whole gutted silver carp (Hypophthalmichthys molitrix) using isoelectric solubilisation/precipitation[J].Journal of the Science of Food and Agriculture, 2009, 89(2):349-358.
[10] 陈涛, 李伟峰.红鳍笛鲷肌肉营养成分分析[J].海洋湖沼通报, 2016,38(6):67-72.CHEN T, LI W F.Analysis of muscle nutrients of Lutjanus erythopterus[J].Transactions of Oceanology and Limnology, 2016,38(6):67-72.
[11] ANTONIUK S, BIJATA M, PONIMASKIN E, et al.Chronic unpredictable mild stress for modeling depression in rodents:Meta-analysis of model reliability[J].Neuroscience &Biobehavioral Reviews, 2019, 99:101-116.
[12] 王玉露, 芦锰, 王月月, 等.蒲郁胶囊对抑郁小鼠行为学、HPA轴及海马CREB-BDNF通路表达的影响[J].中国中药杂志, 2020, 45(20):4971-4977.WANG Y L, LU M, WANG Y Y, et al.Effect of Puyu Capsules on behavior, HPA axis and CREB-BDNF pathway expression in hippocampus of depressed mice[J].China Journal of Chinese Materia Medica, 2020, 45(20):4 971-4 977.
[13] 刘欢, 张孟历, 于猛, 等.醋制香附挥发油抗抑郁活性及化学成分分析[J].药物评价研究, 2020, 43(3):436-442.LIU H, ZHANG M L, YU M, et al.Antidepressant activity evaluation and GC-MS analysis of volatile oil from vinegar-made Cyperi rhizome[J].Drug Evaluation Research, 2020, 43(3):436-442.
[14] WEI Y Y, WANG G H, WANG H L, et al.Sex-dependent impact of different degrees of maternal separation experience on OFT behavioral performances after adult chronic unpredictable mild stress exposure in rats[J].Physiology &Behavior, 2018, 194:153-161.
[15] ORAND A, NALIBOFF B, GADD M, et al.Corticotropin-releasing hormone receptor 1 (CRH-R1) polymorphisms are associated with irritable bowel syndrome and acoustic startle response[J].Psychoneuroendocrinology, 2016, 73:133-141.
[16] JOHANSSON M E V, GUSTAFSSON J K, HOLMÉN-LARSSON J, et al.Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis[J].Gut, 2014, 63(2):281-291.
[17] ZEISEL M B, DHAWAN P, BAUMERT T F.Tight junction proteins in gastrointestinal and liver disease[J].Gut, 2019, 68(3):547-561.
[18] KUO W T, ZUO L, ODENWALD M A, et al.The tight junction protein ZO-1 is dispensable for barrier function but critical for effective mucosal repair[J].Gastroenterology, 2021, 161(6):1924-1939.
[19] 张智涵, 许丹语, 陈冠源, 等.抑郁症与肠道通透性相互作用机制的研究进展[J].四川大学学报(医学版), 2023, 54(2):257-262.ZHANG Z H, XU D Y, CHEN G Y, et al.Latest findings on the interaction mechanism between depressive disorder and intestinal permeability[J].Journal of Sichuan University(Medical Sciences), 2023, 54(2):257-262.
[20] LEONARD B E.Impact of inflammation on neurotransmitter changes in major depression:An insight into the action of antidepressants[J].Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2014, 48:261-267.
[21] ALBENBERG L G, WU G D.Diet and the intestinal microbiome:Associations, functions, and implications for health and disease[J].Gastroenterology, 2014, 146(6):1564-1572.
[22] LI H W, WANG P, ZHOU Y P, et al.Correlation between intestinal microbiotal imbalance and 5-HT metabolism, immune inflammation in chronic unpredictable mild stress male rats[J].Genes, Brain and Behavior, 2022, 21(6):e12806.
[23] 王萍, 王颖, 万红, 等.代谢综合征患者肠道菌群特征探析[J].广西医学, 2020, 42(19):2501-2504.WANG P, WANG Y, WAN H, et al.Characteristics of gut microbiota in patients with metabolic syndrome[J].Guangxi Medical Journal, 2020, 42(19):2501-2504.
[24] FADEN H.The role of Faecalibacterium, Roseburia, and butyrate in inflammatory bowel disease[J].Digestive Diseases, 2022, 40(6):793-795.
[25] PARKER B J, WEARSCH P A, VELOO A C M, et al.The genus Alistipes:Gut bacteria with emerging implications to inflammation, cancer, and mental health[J].Frontiers in Immunology, 2020, 11:906.