沙枣(Elaeagnus angustifolia L., EA),别称银柳、七里香、刺柳、俄罗斯洋橄榄等[1],在沙枣果实中含有多糖、多酚、类黄酮、有机酸、硫胺素、核黄素和膳食纤维等物质;其中,多糖含量比较丰富,平均含量约为9.76%[2]。大果沙枣(Elaeagnus moorcroftii Wall., EM)作为沙枣中主要的细分品种,多分布在我国新疆的南疆地区,其成熟树种可用于防风固沙,其花、叶、果实等具有良好的经济价值与开发意义[3]。此外,大果沙枣因含有多种营养成分,故常被用于食品、医药、饲料等领域,相关研究已见报道[4]。研究表明植物多糖是由多种不同单糖分子脱水缩合而成的复杂高分子化合物,具有抗氧化、免疫调节、降血糖、抗肿瘤、乳化及提升乳液稳定性等多种生物活性[5]。
基于植物多糖的多层乳剂或纳米乳剂在输送生物活性成分方面具有突出优势。多层乳剂是一种新式递送系统,具有独特的控释特性。一般来讲,添加多层聚合物可以提高乳液在各种条件(不同pH值、离子强度和温度)下的稳定性,改善封装成分的化学稳定性,继而提高对封装成分释放速率的控制水平[6]。研究发现,在有外层囊衣存在的情况下,液滴在pH值为4~7具有优异的聚集稳定性,此外,双层乳液能够改变鱼油的渗融效果,具体表现为双层封装提高了空间位阻效应,进而提高乳液的稳定性,有利于将鱼油融入食品和饮料中[7]。纳米级多层乳剂是粒径<200 nm的微乳剂,研究表明,用乳清分离蛋白制备的微乳剂在各种离子强度、热处理和贮存条件下都具有良好的稳定性[8]。基于乳剂的包埋技术是一种用于天然活性成分且前景广阔的生物技术,具有以下优点:提高活性成分的理化稳定性;防止其在食品加工过程中变质;提高其在各种食品中的适用性。本研究旨在获得一种来自大果沙枣的多糖,对其进行结构表征,然后通过分子间自组装技术制备多酚-蛋白质-多糖复合物,继而探究乳铁蛋白、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和多糖之间的相互作用,即将乳铁蛋白、EGCG和植物多糖制备成复合乳液体系,并探讨在不同pH环境中共价复合物对乳液的物理性质及稳定性的影响,可为开发新式的递送系统提供重要的理论参考。
大果沙枣(Elaeagnus moorcroftii Wall., EM)原料,采集自新疆喀什地区疏附县托克扎克镇;95%乙醇、磷酸等,国药集团化学试剂上海有限公司;硫酸、氢氧化钠、碳酸钠、盐酸等,福晨(天津)化学试剂有限公司;大孔树脂、木瓜蛋白酶、考马斯亮蓝G-250、牛血清白蛋白、可溶性淀粉等,大连美仑生物技术有限公司;EGCG,陕西中鸿生物工程有限公司;β-半乳糖、透析袋(5 kDa)、乳铁蛋白(lactoferrin,LF),北京索莱宝科技有限公司;标准葡聚糖(纯度≥99%)和其他标准单糖(AR),美国Sigma-Aldrich公司。上述试剂均为分析纯。
FW-1粉碎机,北京市永光明医疗仪器厂;SHJ-2磁力搅拌水浴锅,杭州旌斐仪器科技有限公司;SN-RE-201D旋转蒸发仪,上海尚普仪器设备有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;Vertex 80傅里叶红外光谱仪,德国Bruker光谱仪器公司;Gemini SEM 460扫描电镜,德国Zeiss公司;Zetasizer Nano ZS90纳米粒度电位仪,英国Malvern公司;FA2204 N分析天平,群安科学仪器有限公司;5430R台式高速离心机,德国Eppendorf公司;TGA-55热重分析仪,美国TA公司;Waters 1515高效液相色谱仪,美国Waters公司。
大果沙枣洗净去核,50 ℃烘干、粉碎、过筛(≥100目),称取一定质量的枣粉,用95%(体积分数)乙醇在80 ℃条件下水浴加热,搅拌提取1 h,除去脂溶性成分,过滤。滤渣按料液比1∶30(g∶mL)加入超纯水,在80 ℃恒温中浸提3 h,趁热过滤,收集滤液,重复提取3次[9];将提取3次的滤液合并,于65 ℃ 恒温下用旋转蒸发仪浓缩。随后,向滤液中加入一定体积的无水乙醇,冷藏沉淀24 h,过滤收集沉淀,冷冻干燥得到大果沙枣粗多糖。采用大孔树脂法对多糖溶液进行脱色,并对脱色后的多糖溶液采用木瓜蛋白酶法[10]去除蛋白质,制得大果沙枣多糖(polysaccharide from Elaeagnus moorcroftii Wall.of Kashgar, EMP-K)。
以系列浓度的葡萄糖标准溶液为参照,采用苯酚-硫酸法测定EMP-K的总糖含量[11]。以系列浓度的牛血清白蛋白标准溶液为参照,采用考马斯亮蓝法测定EMP-K的蛋白质含量[12]。以系列浓度的β-半乳糖标准溶液为参照,采用硫酸-咔唑法测定EMP-K的糖醛酸含量[13]。
1.5.1 分子质量测定
使用高效凝胶渗透色谱法(high performance liquid gel permeation chromatography, HPGPC)测定样品的分子质量。样品处理方法:称取样品5.0 mg,用1 mL 的0.05 mol/L NaCl溶剂配制成5 mg/mL供试样品溶液,离心,用0.22 μm微孔滤膜过滤,备用。标准曲线绘制:使用不同分子质量(1.0~ 670 kDa)、质量浓度为 5 mg/mL的葡聚糖建立线性校准曲线。色谱条件:Waters高效液相色谱仪;聚合物基质水溶性SEC(GFC)色谱柱(8 mm×300 mm);0.05 mol/L NaCl溶液,流速0.6 mL/min;柱温和检测器温度均为40 ℃;进样量为30 μL。
1.5.2 单糖组成测定
采用LC分析样品的单糖组成。多糖的衍生化:在适量样品中加入2 mL的3 mol/L三氟乙酸,然后于120 ℃下将混合物水解3 h,将酸水解液快速转移至1.5 mL试管中,用氮气吹干,之后加入水5 mL涡旋混合,取反应完全的溶液50 μL,同950 μL去离子水混合,随即在12 000 r/min转速下离心5 min,收集上清液;同样的方法用于处理由多种单糖标准制成的混合溶液。色谱条件:ZORBAX EclipseXDB-C18色谱柱,乙腈与磷酸盐缓冲液按照体积比17∶83配成流动相,流速0.8 mL/min,柱温为30 ℃,检测波长为250 nm,进样量为10 μL。
1.5.3 傅立叶变换红外扫描
称取2.0 mg干燥的EMP-K与光谱级溴化钾粉末充分研磨、混匀,然后将得到的混合物压缩成薄片,以标准溴化钾制成的薄片为对照,使用傅立叶变换红外光谱仪在400~4 000 cm-1的波数范围进行扫描分析。
1.5.4 扫描电镜检测
使用导电双面胶带将5.0 mg干燥的EMP-K样品粘贴到导电碳膜上,然后将其放入样品处理室进行喷金、涂层,之后将样品取出并转移至扫描电子显微镜的观察室内,在3 kV的加速电压下以500~10 000 倍的不同放大倍数进行观察。
1.5.5 热稳定性能测试
称取5.0 mg干燥的EMP-K样品,以氮气作为保护气体,使用TGA-55热重分析仪测定样品的热稳定性。待测样品在10 ℃/min的恒定速率下,其测试温度从45 ℃升温到800 ℃,将观测数据绘制成热重(thermal gravimetric analysis, TGA)曲线和微商热重(derivative thermo gravimetry, DTG)曲线,以反映EMP-K通过热转换引起的物理变化过程。
1.5.6 粒度分布与电位测定
精确称取适量干燥的EMP-K样品,配制成2.0 mg/mL的多糖样品溶液。使用激光粒度仪测定溶液体系的粒度分布和Zeta电位变化,平衡时间为120 s,测量温度为25 ℃。
1.6.1 制备LF-EGCG共价复合物
采用碱性环境下的热诱导法制备二元共价复合物[7]。将一定质量的LF和EGCG溶于50 mL去离子水中,其中,蛋白质溶液的浓度控制在质量分数为0.5%,EGCG 的浓度控制在质量分数为0.1%,之后用0.2 mol/L NaOH将2种溶液的pH值调节至9.0,静置过夜,以确保它们完全水合。在持续搅拌下,将2种处理过的溶液按体积比1∶1混合。混合物在空气中暴露24 h,然后用去离子水透析48 h。每隔6 h换1次水,以透析除去未参与反应的游离EGCG,并将样品放入冷冻干燥装置中减压干燥2 d,收集得到冻干的LF-EGCG样品。不含EGCG的LF作为对照组,其处理方法同上。
1.6.2 LF-EGCG共价复合物的颗粒特性
将制备好的 LF-EGCG 溶液倒入20 mL试管中,并调节溶液的pH值至9.0,然后,放入90 ℃水浴中加热20 min,在热处理过程中不搅拌样品,热处理结束,将溶液从水浴环境中取出,置于室温下冷却、静置24 h,进而制得热处理样品 H(LF-EGCG)。颗粒特性分析:将H(LF-EGCG)样品配制成溶液,测定溶液在不同pH值(2、3、4、5、6、7、8、9)环境中的粒度分布和Zeta电位变化;LF空白组、LF-EGCG样品组,2组的处理方法同上。
1.6.3 LF-EGCG-EMP-K复合乳液的制备及颗粒特性
依据前人研究方法[14]并稍作修改,通过热处理结合静电自组装制备 LF-EGCG- EMP-K复合乳液。参考1.6.2节所述方法制备H(LF-EGCG)二元复合物溶液,用适量去离子水配制质量分数为1%的EMP-K溶液,然后将复合物溶液与多糖溶液等体积混合,完全溶解后,用0.2 mol/L HCl或NaOH将复合物溶液的pH值调至8.0,静置过夜,将三元乳液转移到试管中,在90 ℃下加热20 min,冷却至室温,调节溶液的pH至不同值(2、3、4、5、6、7、8、9);不含 EMP-K 的混合体系作为空白组,称为 H(LF-EGCG)-B,处理方法同上。颗粒特性分析:使用激光纳米粒度电位仪测定H(LF-EGCG)-B组、H(LF-EGCG)-EMP-K组在不同pH值环境中的粒度分布和zeta电位变化。
1.6.4 多元复合乳液体系的稳定性
将三元乳液置于4 ℃的冰箱中,用激光纳米粒度仪测量优选乳液体系在不同贮存时间(0、3、7、14 d)下的Zeta电位变化,以分析其贮存稳定性。
所有试验均设置平行参照,数据以“平均数±标准差”表示。数据处理和统计分析使用 Microsoft Office 2019、Origin Pro 2019和Graph Pad Prism。
本研究成功制备多糖EMP-K,其基本指标测定如下:总糖含量为(89.95±1.03)%,蛋白质含量为(1.83±0.92)%,葡萄糖醛酸含量为(18.12±1.17)%。研究结果表明,EMP-K是一种总糖含量高,蛋白质、葡萄糖醛酸等含量低的多糖,与已报道的沙枣多糖的相关指标略有差异[15],此可能归因于沙枣的种源信息不尽相同。
2.2.1 分子质量分布
由图1和表1可知,多糖EMP-K是具有多个分子质量分布的同源混合物,拟合图谱信息计算出其平均分子质量为7 491 Da。图1信息显示,流动相的盐峰出现在48.0 min左右,即47.862 min处、49.517 min处均为流动相的响应值;多糖EMP-K在保留时间36.358、39.121、37.773、41.507、44.375、45.258、46.142 min的重均分子质量Mw分别为 42 389、13 826、5 254、1 642、1 148、802 Da,与时间对应的分布系数为α=MW/Mn,分别为1.505、1.424、1.357、1.281、1.259 和 1.236。一般来说,α值越大,表明分子质量分布越广,当α为1时,分子质量可被确定为均匀体系。与已报道的沙枣多糖EAP-1a比较[15],EMP-K的分子质量分布更具分散性,其分子质量的不均匀性可为进一步纯化不同分子质量的EMP-K提供参考信息。
表1 大果沙枣多糖的分子质量分布结果
Table 1 The results of molecular weight distribution of EMP-K
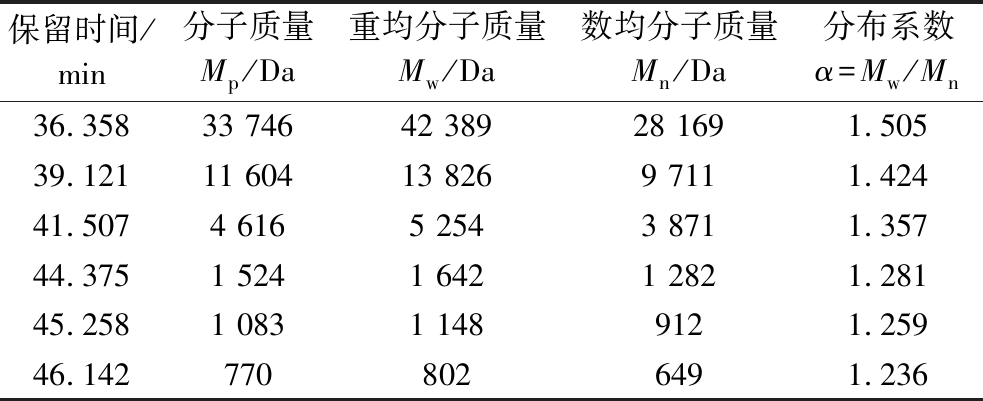
保留时间/min分子质量Mp/Da重均分子质量Mw/Da数均分子质量Mn/Da分布系数α=Mw/Mn36.35833 74642 38928 1691.50539.12111 60413 8269 7111.42441.5074 6165 2543 8711.35744.3751 5241 6421 2821.28145.2581 0831 1489121.25946.1427708026491.236

图1 EMP-K的HPGPC结果
Fig.1 The HPGPC results of EMP-K
2.2.2 单糖组成分析
大多数植物多糖被认为是杂多糖,同样,EMP-K是由多个单糖组分通过糖苷键结合而成的物质(图2)。与11 种混合标准品的液相信息比较可知,EMP-K中含有甘露糖、盐酸氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖成分,各成分在EMP-K中的比例分别为0.879、1.151、9.767、1.901、14.993、23.357、20.760和27.191,其中阿拉伯糖的比例最高。本研究中获得的多糖,其单糖组成与已有报道[15]不完全相同,可能归结于沙枣的种类、生长环境、遗传信息及多糖的提取方式等存在差异。
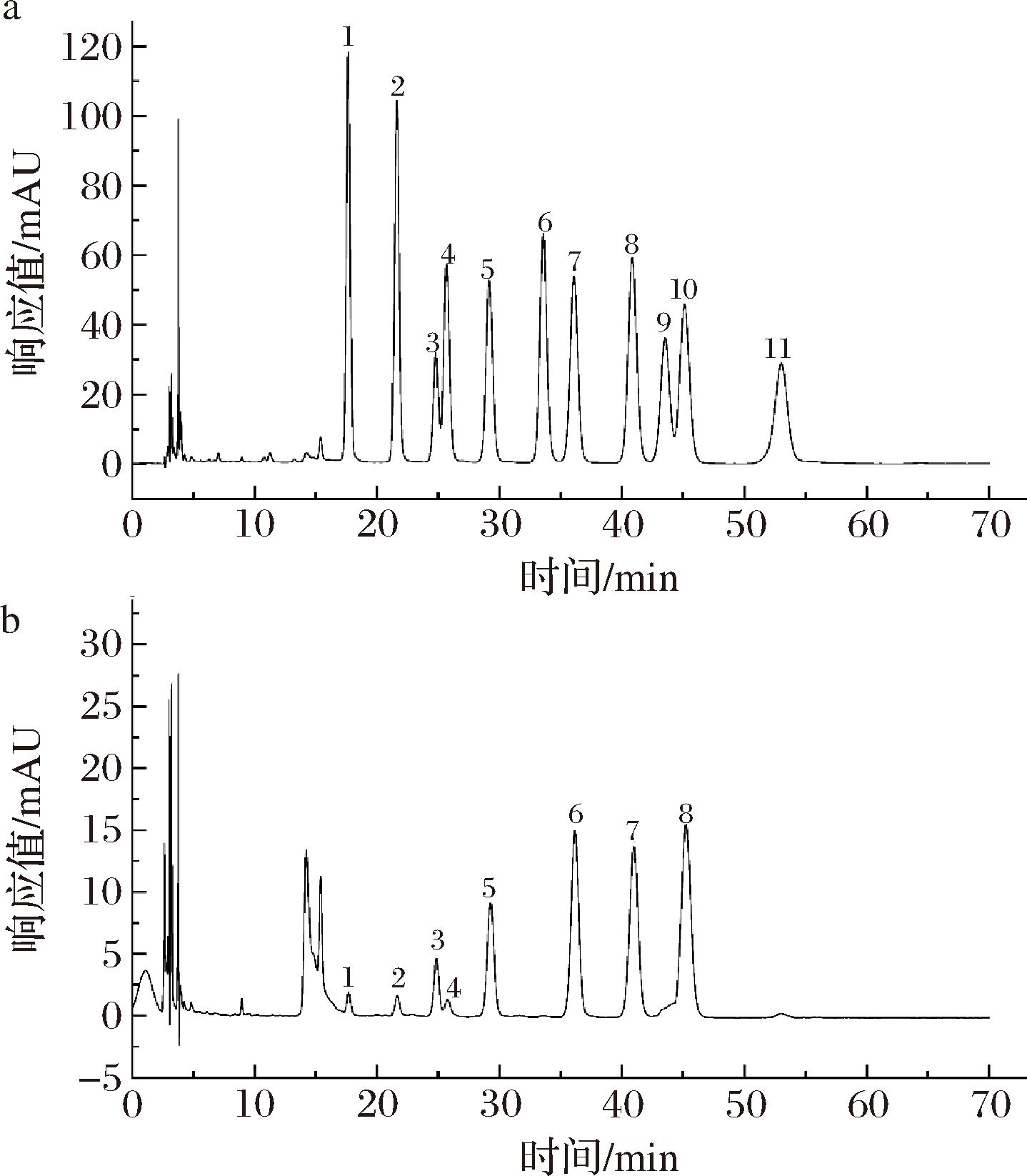
1-甘露糖;2-盐酸氨基葡萄糖;3-鼠李糖;4-葡萄糖醛酸;5-半乳糖醛酸;6-氨基半乳糖盐酸盐;7-葡萄糖;8-半乳糖;9-木糖;10-阿拉伯糖;11-岩藻糖
a-标准单糖;b-EMP-K
图2 单糖组成结果
Fig.2 The results of monosaccharide composition
2.2.3 FI-IR分析
EMP-K的红外光谱结果如图3所示,在3 394 cm-1处观察到的一个突出而宽广的峰值可归因于O—H伸展振动,它产生于多糖网络中分子间和分子内的氢键相互作用,这一峰值是几乎所有多糖中共有的显著特征[16]。此外,2 935 cm-1处的窄吸收峰,表明存在来自甲基或乙酰基的C—H伸展振动;1 618 cm-1和1 402 cm-1处的吸收峰分别对应于不对称和对称C—O伸缩振动。1 261 cm-1处的吸收峰可能与O—H角振动有关[17]。另外,在1 074 cm-1处观察到的吸收峰表示C—O—C基团的振动和糖苷桥的重叠环振动[18-19],779 cm-1 处的吸收峰则与吡喃环β端基团的C—H角振动有关。

图3 EMP-K 的红外光谱分析
Fig.3 The infrared spectroscopy of EMP-K
2.2.4 扫描电镜形态
扫描电镜检测是常见的研究多糖形态最直接的方法之一[20]。作为大分子聚集体,多糖具有复杂的网络结构,其微观结构与分子聚集状态密切相关。如图4所示,4幅图像分别是EMP-K在放大500、1 000、5 000、10 000倍下的扫描电镜照片。在500、1 000 倍视野下,多糖样品呈现出大部分聚集、少部分分散的结构,聚集部分颗粒饱满。颗粒的形态呈不规则球状,颗粒之间有许多致密的孔隙,表明分散性良好。这种现象可归因于大分子之间强大的分子间吸引力[17]。在5 000、10 000倍视野下,可以观察到分子排列致密、表面光滑的球体逐层堆叠,质地更加细腻,分子间隙减少,表明大分子之间的交联作用很强。

a-0.5K×;b-1.0K×;c-5.0K×;d-10.0K×
图4 EMP-K的扫描电镜图
Fig.4 The scanning electron microscope images of EMP-K
2.2.5 热稳定性能
热重分析是广泛应用于研究多糖热稳定性和探索大分子降解与温度之间关系的检测技术,此方法为了解多糖的热行为提供了宝贵的信息,对于评估多糖在食品工业中的潜在应用至关重要。图5为多糖EMP-K的TGA曲线和DTG曲线。在45~770 ℃的温度范围内,EMP-K成分的质量变化情况可分为3个不同的阶段。第一阶段涉及样品中溶剂的热降解与热行为,在142 ℃时EMP-K 的质量损失为 4.595%,这可能是由于自由水或结合水的损失造成的[21]。热降解的第二阶段发生在200~550 ℃,在这一温度范围内,EMP-K表现出快速的失重过程,失重率很高,表明发生了强烈的分解反应[22],TGA结果显示,在第二阶段,EMP-K的质量减少了约40.842%。最后,第三阶段出现在550 ℃以上的温度范围,此阶段中EMP-K的质量保持稳定,形成了主要由矿物组成的固体残留物。
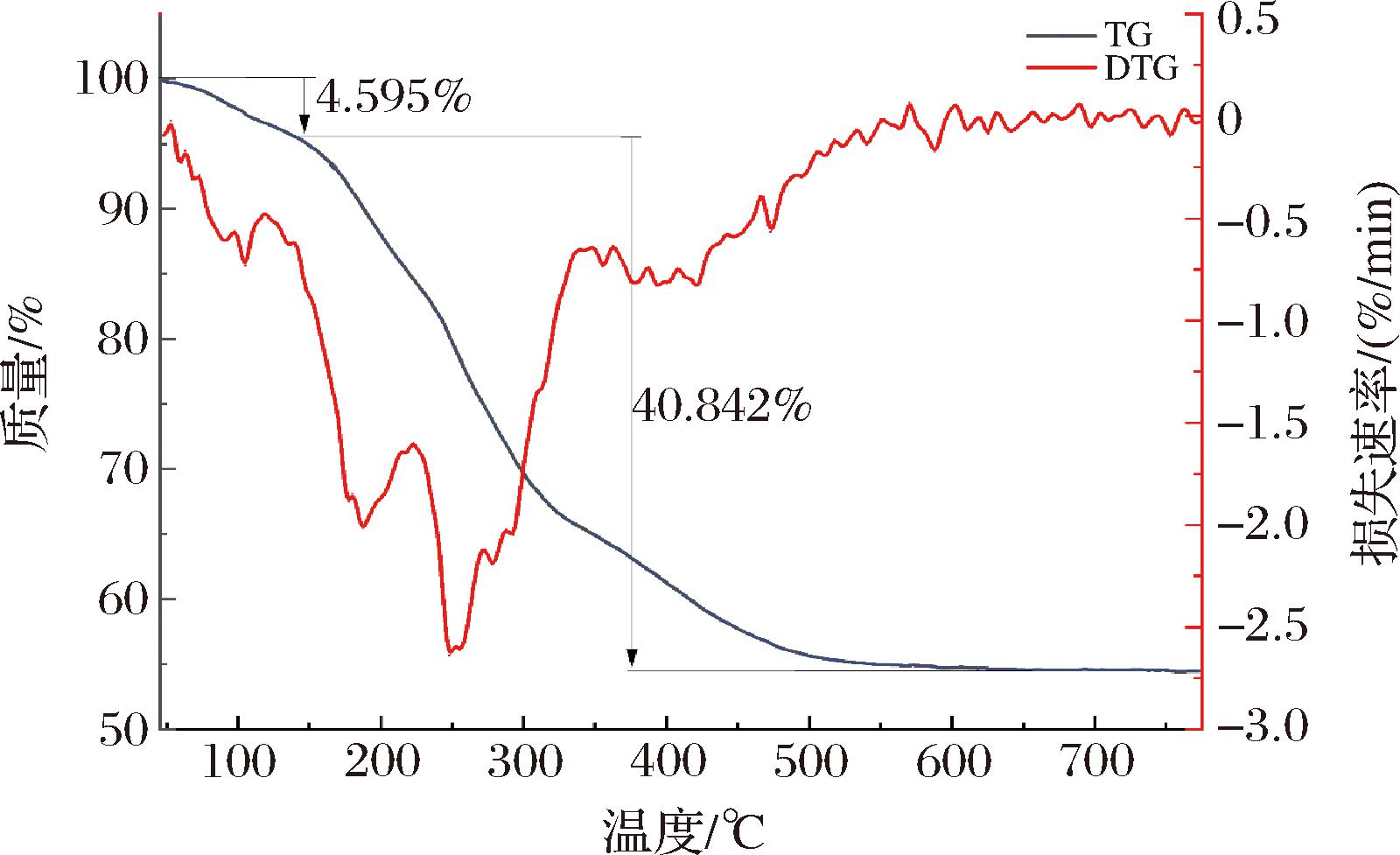
图5 EMP-K的热重分析
Fig.5 The thermal analysis of the EMP-K
2.2.6 颗粒特性
溶液或近溶液体系的粒度测定有多种方法,包括透射电子显微镜、扫描电子显微镜、X射线衍射、激光粒度分析等。其中,激光因其独特的单色性和光浓度,已广泛应用于材料、生物、食品和制药等领域的微观表征。此外,激光法的一个重要参数是聚合物分散系数(polymer dispersion index, PDI)。理论上,PDI 值无限趋向于零,溶液系统无限趋向于单分散体系。在此基础上,用激光法测定多糖EMP-K的粒度分布和Zeta电位分别如图6、图7所示,相应的数据信息如表2所示。EMP-K的粒径分布主要集中在100~1 000 nm区域,平均粒径为(900.1±81.98) nm,PDI为 0.749±0.201;相应地,EMP-K的Zeta电位主要集中在0~35 mV区域,平均电位为(-19.4±1.27) mV,漂移速度为(-1.517±0.101) μmcm/Vs。前述结果表明,EMP-K分子之间没有明显的聚集行为。不过,从分散系数来看,多糖溶液的PDI稍大,这是因为溶液中的多糖分子通常处于布朗运动状态,存在分子碰撞和官能团相互作用,特别地,多糖的粒径与分子质量在数值上存在正相关,不同分子质量的单糖组分在多糖体系中形成不同大小的聚集结构进而影响粒径分布[23],因此,在分散规律方面,多糖EMP-K的粒径与分子质量具有趋同性。
表2 EMP-K的粒径与Zeta电位
Table 2 The size and Zeta potential of EMP-K

粒径/nm分散系数PDIZeta电位/mV漂移速度/(μmcm/Vs)EMP-K900.1±81.980.749±0.201-19.4±1.27-1.517±0.101
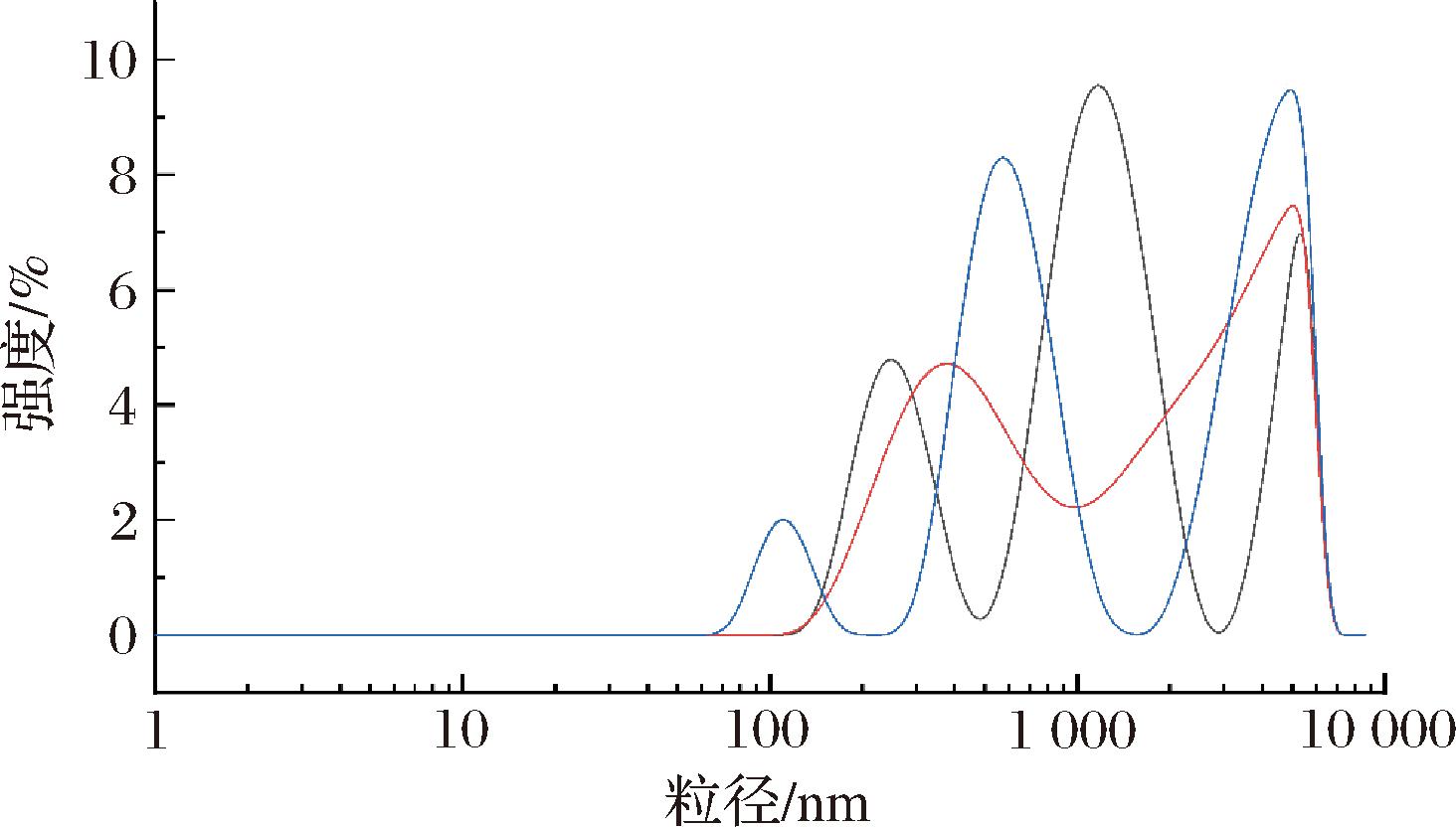
图6 EMP-K的粒径分布图
Fig.6 Size distribution by intensity of EMP-K
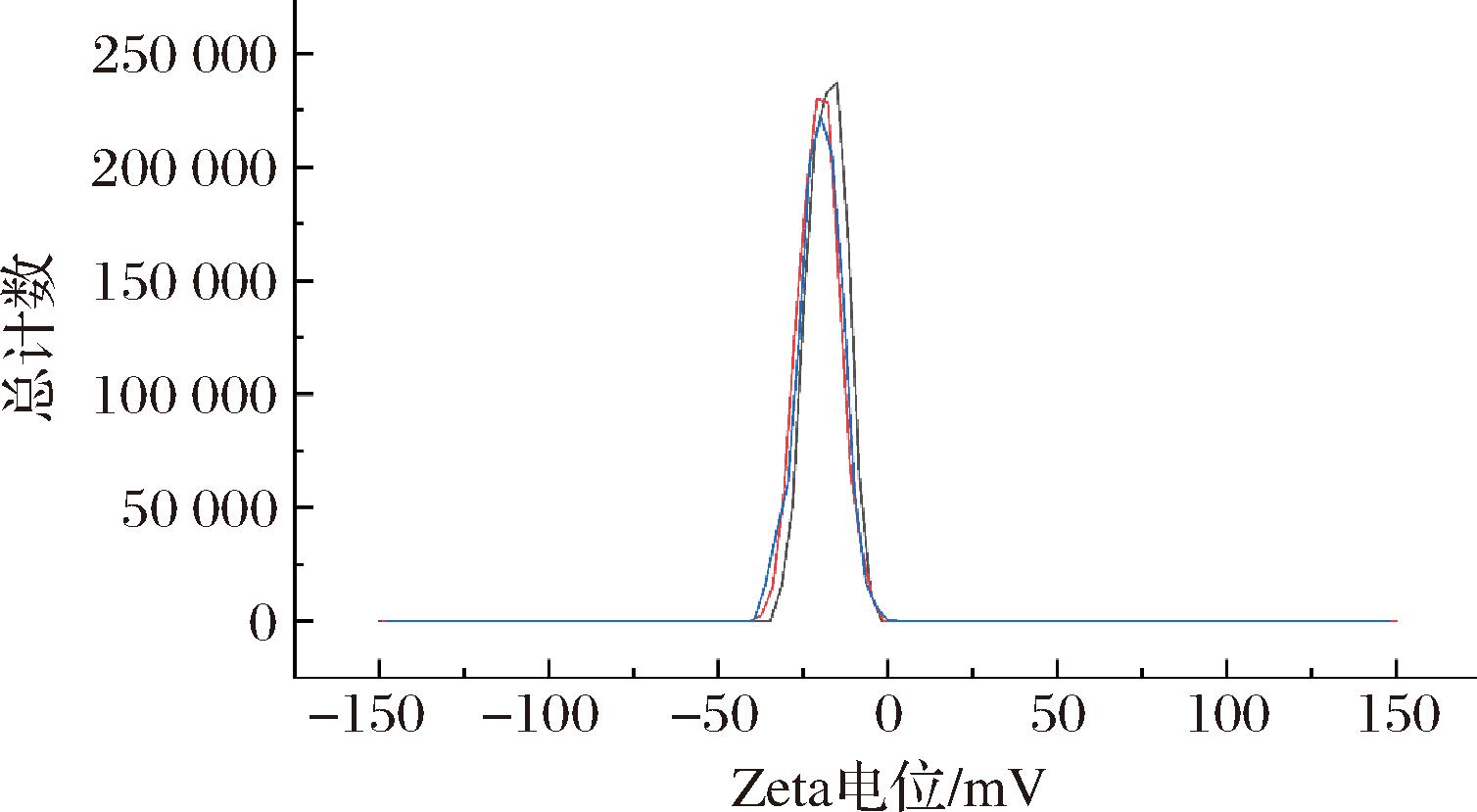
图7 EMP-K的Zeta电位
Fig.7 Zeta potential by counts of EMP-K
2.3.1 不同pH值对LF-EGCG体系中颗粒特性的影响
根据pH值的不同,蛋白质可带正电或负电,当蛋白质被多酚共价修饰时,会导致其等电点发生变化[24]。现有研究表明,乳铁蛋白是一种碱性蛋白质,等电点较高(pH值为8.5),等电点相对较高的原因是乳铁蛋白末端有明显的碱性区域,可与酸性分子结合[25]。从图8-a中可以看出,随着 pH 值的升高,乳铁蛋白颗粒的大小曲折地减小,在等电点附近达到最小值,在pH值为3时达到最大值。与LF相比,LF同EGCG结合后的二元复合纳米粒子的尺寸明显减小。结果表明,EGCG与LF之间的共价键使LF的结构在碱性环境中更加致密。同时,不同复合样品的粒度和电位在加热处理后变化不大,而加热会导致蛋白质疏水基团暴露,形成更稳定的纳米颗粒。因此,选择加热的LF-EGCG 进行后续试验。从图8-b可以看出,随着pH值的升高,LF溶液的电位值先升高后降低,当pH>8时,电位值由正变负,说明LF的等电点为8~9,这与XU等[26]的研究结果一致。LF-EGCG复合纳米粒子的等电点为4~5,这说明EGCG与LF共价结合后,蛋白质的电荷性质发生了变化,经过多酚修饰后,LF的等电点大大降低。
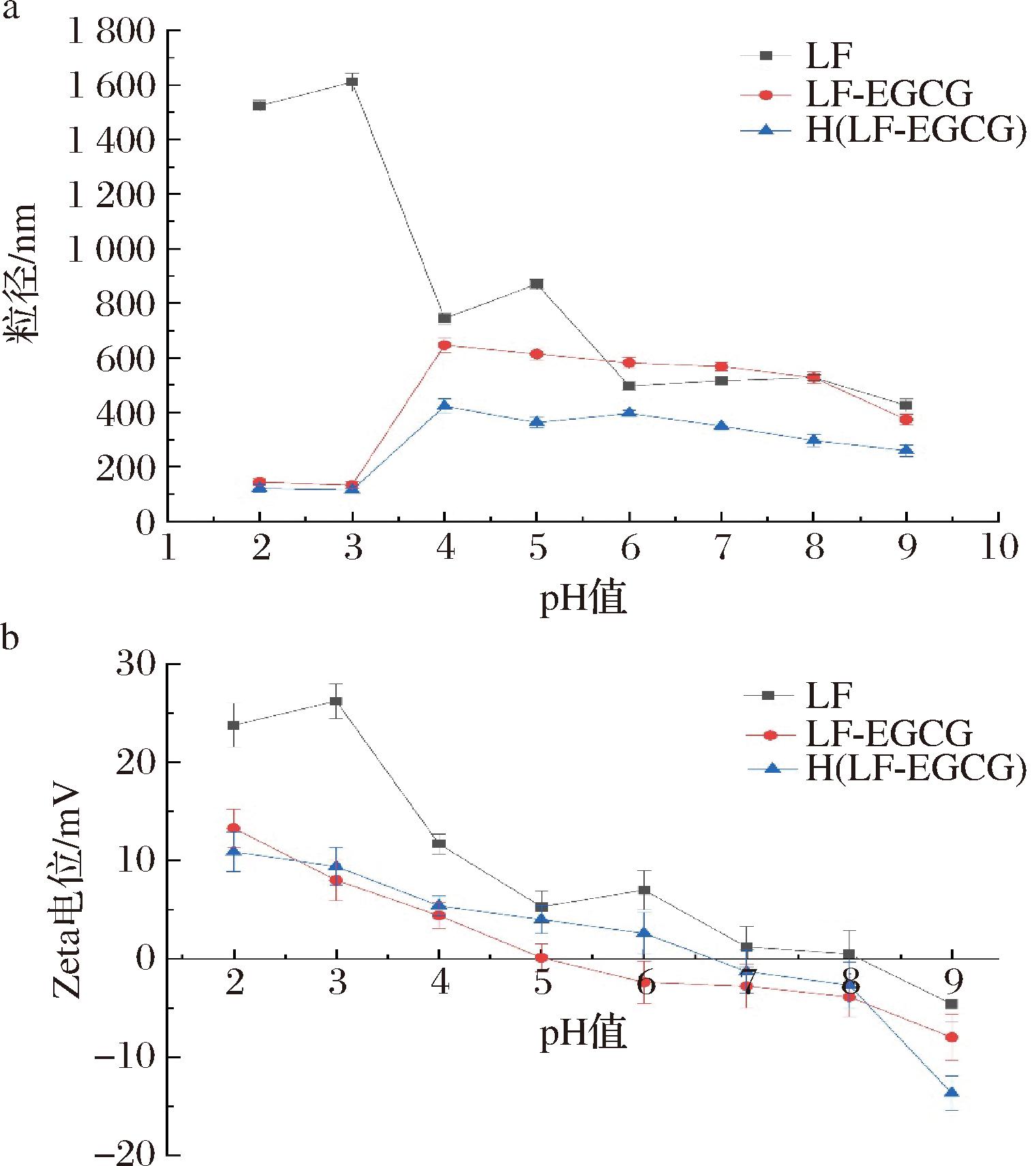
a-粒径;b-Zeta电位
图8 不同pH值对不同样品的粒径、Zeta电位的影响
Fig.8 Size and Zeta potential of different samples at different pH values
2.3.2 不同pH值对LF-EGCG-EMP-K体系中颗粒特性的影响
静电作用、氢键和疏水作用对蛋白质-多糖聚集体的粒度和稳定性起着重要作用。如图9-a所示,随着EMP-K的加入,三元复合粒子的粒径明显增大。类似地,空白对照组即 H(LF-EGCG)-B 体系,其粒径变化也呈现出随着 pH 值的升高而先增大后减小的趋势,但几乎没有观察到粒径的稳定期。通过比较2种复合物可以发现,H(LF-EGCG)-EMP-K的粒径相对较小,而且随着环境中pH值升高,粒径大小逐渐趋于稳定,可能是因为静电排斥的存在使EMP-K与H(LF-EGCG)结合得更紧密。在一定的 pH 值范围内,多糖链主链上的基团会与蛋白质分子发生静电作用,最终影响到蛋白质-多糖混合体系的稳定性[27]。如图9-b所示,H(LF-EGCG)-EMP-K溶液体系的电位值随着pH值的变化始终为负,在零电荷点之后,带电量随着 pH 值的增加而增加。在H(LF-EGCG)-B体系中加入多糖后,三元复合体系与 H(LF-EGCG)-B相比,其带电情况发生了显著变化。蛋白-多酚-多糖复合体系的净电位介于单个蛋白质和多糖之间,零电荷点<4。三元复合物的电位变化趋势与二元复合物相似,而且等电点的出现明显低于二元复合物。此外,多糖分子在溶液中的电位均为负值,这可能是由于多糖是含有羧基官能团(pKa≈3.5)的阴离子生物聚合物。参考不同pH值对三元复合乳液体系中颗粒特性的影响结果可知,优选的H(LF-EGCG)-EMP-K体系共存pH值为6,并可用于后续探究复合乳液体系的稳定性。

a-粒径;b-Zeta电位
图9 不同pH值对不同样品的粒径、Zeta电位的影响
Fig.9 Size and Zeta potential of different samples at different pH values
2.3.3 复合乳液体系的贮存稳定性分析
优选的三元复合乳液体系在不同贮存时间(0、3、7、14 d)的贮存稳定性变化如图10所示,乳液体系在贮存期间的电位值为负值。数据显示,多糖嵌入液滴的电位从-22.6 mV变为-22.9 mV,表明带负电荷的多糖成功吸附在H(LF-EGCG)形成的稳定的乳液液滴表面。此现象主要归因于:多糖通过静电结合吸附在乳铁蛋白表面,以及LF上暴露的疏水基团产生的疏水相互作用[28]。因此,可以得出结论:EGCG与LF的共价结合或多糖的吸附,可触发乳液液滴之间产生强烈的静电排斥,从而保持乳液良好的物理稳定性。
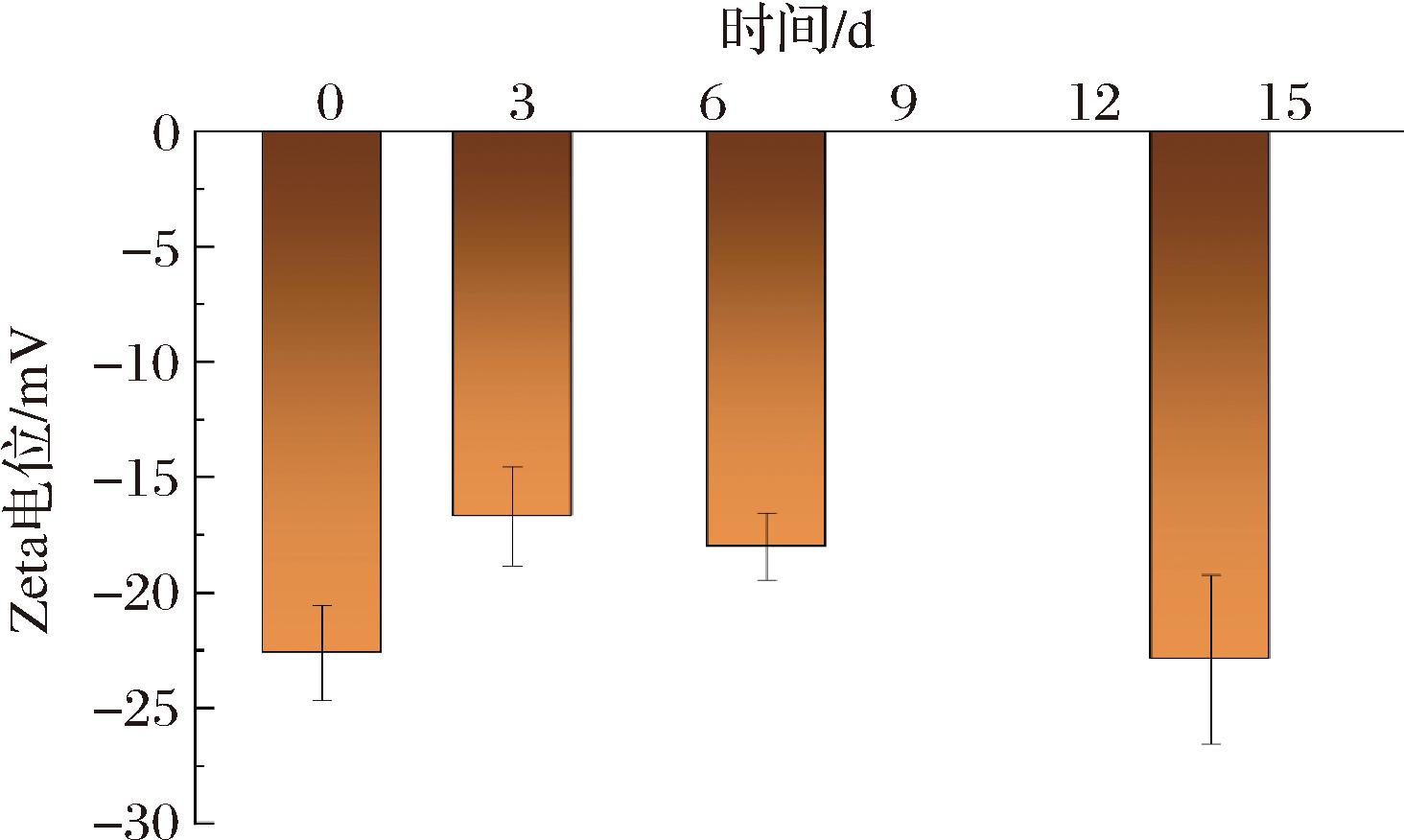
图10 三元复合乳液体系的贮存稳定性
Fig.10 The storage stability of composite emulsion system determined by Zeta potential
多糖的乳化性能与蛋白质、疏水基团、分子质量等密切相关;另外,空间位阻、静电排斥、糖链交联等均可限制聚集或凝结现象,有益于提高乳液体系的稳定性[29]。特别地,温度、pH值、颗粒特性等亦是改变乳化稳定性过程中不可忽视的因素。温度能够增大乳液粒径、影响布朗运动的往复性,进而改变液相之间的分离速率;多糖中的阴离子基团(如羧基等)使得多数食品级多糖自带负电荷,体系中pH值的变化既可中和多糖的电荷也可改变分子的微构象,并且通过液滴碰撞发挥改变乳液黏度、界面张力及粒径大小等作用;多糖粉末的颗粒特性主要指粒径、电位等,粉末粒径的大小与水化速率、溶胶体系的稳定性直接相关,易水化的多糖容易形成稳定且均一的溶胶体系,且可在调整乳液黏度、改善流变性能方面发挥优势作用[30]。
本研究采用水提醇沉法从大果沙枣中提取出多糖组分EMP-K,并利用FT-IR、HPGPC和激光粒度仪等对其进行理化性质分析,揭示EMP-K是一种杂多糖且具有植物多糖的典型特征。成功制备LF-EGCG-EMP-K复合乳液体系,进而研究蛋白质-多酚共价复合物与多糖之间的相互作用。结果发现,与单独使用LF、LF-EGCG或热处理的二元复合物H(LF-EGCG)相比,添加多糖EMP-K能在液滴表面提供更紧密的保护层,从而有效防止液滴破裂,提高乳液的稳定性。综上所述,开发大果沙枣多糖EMP-K在为新疆地区大果沙枣资源的精细化利用以及构建多糖基复合乳液体系方面具有切实的科学意义。
[1] MINEAU M M, BAXTER C V, MARCARELLI A M.A non-native riparian tree (Elaeagnus angustifolia) changes nutrient dynamics in streams[J].Ecosystems, 2011, 14(3):353-365.
[2] ABIZOV E A, TOLKACHEV O N, MAL’TSEV S D, et al.Composition of biologically active substances isolated from the fruits of Russian olive (Elaeagnus angustifolia) introduced in the European part of Russia[J].Pharmaceutical Chemistry Journal, 2008, 42(12):696-698.
[3] HOSSEINZADEH H, RAMEZANI M, NAMJO N.Muscle relaxant activity of Elaeagnus angustifolia L.fruit seeds in mice[J].Journal of Ethnopharmacology, 2003, 84(2-3):275-278.
[4] 刘巧玲, 刘丽燕, 盛玮.新疆大果沙枣果实营养分析及开发利用[J].现代园艺, 2021, 44(9):54-56.LIU Q L, LIU L Y, SHENG W.Nutritional analysis and development of E. moorcroftii Wall.Ex Schlecht[J].Xiandai Horticulture, 2021, 44(9):54-56.
[5] LIWO A, BARANOWSKI M, CZAPLEWSKI C, et al.A unified coarse-grained model of biological macromolecules based on mean-field multipole-multipole interactions[J].Journal of Molecular Modeling, 2014, 20(8):2306.
[6] GU Y S, DECKER E A, JULIAN MCCLEMENTS D.Application of multi-component biopolymer layers to improve the freeze-thaw stability of oil-in-water emulsions:β-lactoglobulin-ι-carrageenan-gelatin[J].Journal of Food Engineering, 2007, 80(4):1246-1254.
[7] TAHERIAN A R, BRITTEN M, SABIK H, et al.Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion[J].Food Hydrocolloids, 2011, 25(5):868-878.
[8] LI M, MA Y, CUI J.Whey-protein-stabilized nanoemulsions as a potential delivery system for water-insoluble curcumin[J].LWT-Food Science and Technology, 2014, 59(1):49-58.
[9] ZHAO M, HAN Y, LI J E, et al.Structural characterization and antioxidant activity of an acetylated Cyclocarya paliurus polysaccharide (Ac-CPP0.1)[J].International Journal of Biological Macromolecules, 2021, 171(28):112-122.[10] CHEN H L, TAN H L, YANG J, et al.Inhibitory effect of polysaccharide of Sargassum weizhouense on PCV2 induced inflammation in mice by suppressing histone acetylation[J].Biomedicine &Pharmacotherapy, 2019, 112:108741.
[11] LIU W, LIU Y M, ZHU R, et al.Structure characterization, chemical and enzymatic degradation, and chain conformation of an acidic polysaccharide from Lycium barbarum L.[J].Carbohydrate Polymers, 2016, 147:114-124.
[12] YANG Y, LEI Z X, ZHAO M M, et al.Microwave-assisted extraction of an acidic polysaccharide from Ribes nigrum L.:Structural characteristics and biological activities[J].Industrial Crops and Products, 2020, 147:112249.
[13] XU Y Q, NIU X J, LIU N Y, et al.Characterization, antioxidant and hypoglycemic activities of degraded polysaccharides from blackcurrant (Ribes nigrum L.) fruits[J].Food Chemistry, 2018, 243:26-35.
[14] MA Z Y, YAO J Q, WANG Y Y, et al.Polysaccharide-based delivery system for curcumin:Fabrication and characterization of carboxymethylated corn fiber gum/chitosan biopolymer particles[J].Food Hydrocolloids, 2022,125:107367.
[15] 刘晓庆, 刘会平, 赵范, 等.沙枣多糖结构的初步研究[J].食品工业科技, 2015, 36(13):138-142;149.LIU X Q, LIU H P, ZHAO F, et al.Purification and preliminary analysis of Elaeagnus angustifolia L.polysaccharide[J].Science and Technology of Food Industry, 2015, 36(13):138-142;149.
[16] LIN S, LI H Y, YUAN Q, et al.Structural characterization, antioxidant activity, and immunomodulatory activity of non-starch polysaccharides from Chuanminshen violaceum collected from different regions[J].International Journal of Biological Macromolecules, 2020, 143:902-912.
[17] LI X, WANG X H, DONG Y, et al.Preparation, structural analysis, antioxidant and digestive enzymes inhibitory activities of polysaccharides from Thymus quinquecostatus Celak.leaves[J].Industrial Crops and Products, 2022, 175:114288.
[18] GUO H Y, ZHANG L, WANG Y, et al.Mechanisms of HuR in regulation of epithelial cell apoptosis in rat ulcerative colitis[J].Cellular Signalling, 2021, 82:109957.
[19] YUAN J, CHEN S X, WANG L P, et al.Preparation of purified fractions for polysaccharides from Monetaria moneta Linnaeus and comparison their characteristics and antioxidant activities[J].International Journal of Biological Macromolecules, 2018, 108:342-349.
[20] LIU Y, ZHANG Y Q, MEI N J, et al.Three acidic polysaccharides derived from sour jujube seeds protect intestinal epithelial barrier function in LPS induced Caco-2 cell inflammation model[J].International Journal of Biological Macromolecules, 2023, 240:124435.
[21] GETACHEW A T, LEE H J, CHO Y J, et al.Optimization of polysaccharides extraction from Pacific oyster (Crassostrea gigas) using subcritical water:Structural characterization and biological activities[J].International Journal of Biological Macromolecules, 2019, 121:852-861.
[22] LIU X Y, YU H Y, LIU Y Z, et al.Isolation and structural characterization of cell wall polysaccharides from sesame kernel[J].LWT, 2022,163:113574.
[23] RAM MURTHY PALADUGU S &RAMA SREEKANTH P S.Review on influence of radiation, particle size and molecular weight on thermo-mechanical properties of UHMWPE composites[J].Materials Today:Proceedings, 2022, 56:1086-1090.
[24] XU E B, CAMPANELLA O H, YE X Q, et al.Advances in conversion of natural biopolymers:A reactive extrusion (REX)-enzyme-combined strategy for starch/protein-based food processing[J].Trends in Food Science &Technology, 2020, 99:167-180.
[25] MOREL J, MD ZAIN S N, ARCHER R.Comparison of drying techniques for bovine lactoferrin:Iron binding and antimicrobial properties of dried lactoferrin[J].International Dairy Journal, 2022, 124:105142.
[26] XU B M, JIA Y Y, LI B, et al.Ultrastable emulsions constructed by self-assembly of two protein-polyphenol- anionic polysaccharide ternary complexes-stablized high internal phase emulsions[J].LWT, 2023, 176:114517.
[27] HE X, YANG W S, QIN X S.Ultrasound-assisted multilayer Pickering emulsion fabricated by WPI-EGCG covalent conjugates for encapsulating probiotics in colon-targeted release[J].Ultrasonics Sonochemistry, 2023, 97:106450.
[28] KUSHWAHA P, PRABHU N P.Aromatic vs alicyclic:Hydrophobicity of the ionic liquid on protein stability and fibril formation[J].Journal of Molecular Liquids, 2024, 395:123920.
[29] 王春朋. 罗布麻茶多糖的乳化特性研究[D].武汉:湖北工业大学, 2021.WANG C P.Emulsification properties for the Apocynum venetum L.tea polysaccharide conjugates[D].Wuhan:Hubei University of Technology, 2021.
[30] 赵玲玲. pH、Na+及萃取剂对大豆种皮多糖乳化性影响研究[D].锦州:渤海大学, 2019.ZHAO L L.Study on the effect of pH, Na+and extractant on emulsifying properties of soy hull polysaccharide[D].Jinzhou:Bohai University, 2019.