地参又名地笋,为唇形科地笋属植物毛叶地笋(Lycopus lucidus Turcz. var.hirtus Regel)的干燥根茎,多分布在西南、西北等地,属多年生药食同源植物[1]。我国拥有较丰富的地参资源,现代研究表明地参中含有三萜酸、酚类、多糖、矿物质等成分[2-4],具有良好的保肝、抗氧化、抗肿瘤、降血糖血脂、增强免疫等作用[5-8]。地参中氨基酸含量丰富,黄小兰等[9]在对不同产地地参氨基酸测定中发现,必需氨基酸占总氨基酸高达29.36%,药用氨基酸占总氨基酸比例最高为74.16%;李蕾等[10]在对野生地参的营养成分进行研究时,测得地参中共有18种氨基酸,在各氨基酸组分中,天冬氨酸含量最高为0.58 g/100 g;张荣平等[11]在测定地参中氨基酸类成分时,测得地参中包含19种氨基酸,总含量为2.72 g/100 g,其中包括6种人体必需氨基酸。
不同干燥方式和干燥温度会影响中药材和果蔬粉的氨基酸含量。周思静等[12]研究发现,真空干燥下铁皮石斛粉的色泽、氨基酸和多糖等含量较高。高萌等[13]发现冷冻干燥和40~70 ℃的真空干燥可保留蟾蜍肉中氨基酸类成分,并作为蟾蜍肉生产实际的干燥方法。真空冷冻干燥处理的苦竹笋粉总氨基酸及各呈味氨基酸含量和黄花菜粉的氨基酸含量均较高[14-15]。现有地参的研究主要集中在不同组分不同产地、不同部位地参成分分析,而对地参干燥加工方式尚未见其深入。本实验研究了晒干、阴干、远红外(40~60 ℃),鼓风(40~60 ℃)、真空(40~60 ℃)、真空冷冻-80 ℃等12种不同干燥方式对地参中17种氨基酸成分的影响,并通过主成分分析、相关性分析、聚类分析研究不同干燥方式下含量的差异,以期为地参的加工方式和综合利用提供科学依据。
1 材料与方法
1.1 材料与试剂
地参采自重庆市万州区恒合乡地参栽培基地,经重庆三峡学院周浓教授鉴定为唇形科植物毛叶地瓜苗(Lycopus lucidus Turcz.var.hirtus Regel)的根茎。将采摘的同一批地参分别置于晒干(S1)、自然阴干(S2)、远红外40 ℃(S3)、远红外50 ℃(S4)、远红外60 ℃(S5)、鼓风干燥40 ℃(S6)、鼓风干燥50 ℃(S7)、鼓风干燥60 ℃(S8)、真空干燥40 ℃(S9)、真空干燥50 ℃(S10)、真空干燥60 ℃(S11)、真空冷冻-80 ℃(S12),干至恒重,粉碎后过40目筛,备用。
天冬氨酸(批号DST190806-897纯度≥98%)、谷氨酸(批号GG202002,纯度≥98%)、丝氨酸(批号SS021655,纯度≥98%)、甘氨酸(批号VB202110,纯度≥98%)、组氨酸(批号ZH002106,纯度≥98%)、精氨酸(批号JA202005,纯度≥99%)、苏氨酸(批号ST170008,纯度≥99%)、丙氨酸(Ala,批号JB161270,纯度≥98%)、脯氨酸(Pro,批号PP202001,纯度≥98%)、酪氨酸(批号TL202003,纯度≥99%)、缬氨酸(批号XV20191127,纯度≥99%)、异亮氨酸(批号YI191221,纯度≥99%)、亮氨酸(批号LL201912,纯度≥98%)、苯丙氨酸(批号CB210061,纯度≥98%)、甲硫氨酸(批号JM202002,纯度≥99%)、半胱氨酸(批号BG001167,纯度≥98%)、赖氨酸(批号LS201911,纯度≥99%),BOMEI公司;乙硫氰酸苯酯(phenyl isothiocyanate,PITC),麦克林试剂有限公司;乙腈(色谱纯),德国默克公司;冰乙酸、盐酸、乙酸钠、三乙胺、正己烷、苯酚(均为化学分析纯),成都科龙化工试剂厂;实验用水为娃哈哈纯净水。
1.2 仪器与设备
LC-20AT型高效液相色谱仪,日本岛津公司;JC-WD-12型圆形水浴氮吹仪,青岛聚创环保集团有限公司;HDL-4型台式离心机,金坛市鸿科仪器厂;FD-1A-50型冷冻干燥机,江苏天翎仪器有限公司;YHG-400-BS-II型远红外快速干燥箱,青岛明博环保科技有限公司;HT101-2E(B)型鼓风干燥箱,镇江市海天化验设备有限公司;Secura324-1CN型分析天平,江苏讯迪仪器科技有限公司。
1.3 实验方法
1.3.1 地参样品溶液的配制
1.3.1.1 地参样品的水解
参照黄小兰等[9]的实验方法略做修改,准确称取0.5 g(精确至0.000 1 g)不同干燥方式的地参粉末(粉末过40目筛)倒入顶空瓶中,加入6 mol/L盐酸溶液10 mL,待样品充分溶解后加入苯酚3滴于顶空瓶中,摇匀,然后密封。将顶空瓶置于110 ℃的干燥箱内,加热水解22 h后,取出冷却至室温,将地参水解液进行过滤,残渣用少量纯水冲洗,并至20 mL量瓶中。取水解液0.4 mL于氮吹管中,置于50 ℃水浴中氮吹至近干,加入0.4 mL 0.1 mol /L 盐酸溶液复溶。
1.3.1.2 氨基酸的衍生化处理
精密移取地参样品溶液及混合对照品溶液各0.4 mL于EP管中,分别加入1.0 mol/L三乙胺-乙腈溶液、0.1 mol/L PITC-乙腈溶液各0.2 mL,摇匀,在室温衍生1 h,每隔30 min涡旋1次,加入正己烷1 mL,涡旋振荡12 min,5 000 r/min离心8 min,萃取反应过剩的PITC,弃去上清液,将下层溶液用纯水定容至2 mL,过0.22 μm微孔滤膜,备用。
1.3.2 对照品溶液制备
精密称取精密称取Asp、Glu、Ser、Gly、His、Arg、Thr、Ala、Pro、Tyr、Val、Met、Cys、Ile、Leu、Phe、Lys对照品适量,用0.1 mol /L 盐酸溶解并定容于5 mL量瓶中,配制成质量浓度分别为3.098、0.500、1.438、2.268、1.924、1.426、1.554、1.606、0.834、0.882、1.74、1.816、2.832、1.856、1.834、1.956、1.976 mg/mL的对照品贮备溶液,与地参样品同样方法进行衍生处理,即得。
1.3.3 色谱条件
色谱柱为Venusil AA(4.6 mm×250 mm,5 μm);检测波长254 nm;柱温35 ℃;进样量20 μL;流速0.8 mL/min;流动相:A为0.1 mol/L V(乙酸钠)∶V(乙腈)=93∶7溶液(冰醋酸调pH=6.5),B为80%的乙腈溶液;梯度洗脱:0~10 min,0~10%B;10~17 min,10%~15%B;17~27 min,15%~27%B;27~32 min,27%B;32~38 min,27%~33%B;38~42 min,33%~50%B;42~46 min,50%~80%B。
1.3.4 标准曲线的制作
精密吸取1.3.2节混合对照品溶液0.1、0.2、0.4、0.8、1.6、3.2、4.0 mL分别置于5 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度,摇匀,制得不同质量浓度的混合对照品工作液,按照1.3.3节色谱条件进行分析。
1.3.5 方法学考察
1.3.5.1 精密度实验
精密吸取同一浓度混合对照品溶液,按照1.3.3节色谱条件连续进样6次,测定各氨基酸组分峰面积,计算17种氨基酸的相对标准偏差。
1.3.5.2 稳定性实验
平行称取同一地参样品(S3)0.5 g,按照1.3.1节进行地参样品溶液的制备,按照1.3.3节下色谱条件,分别在0、2、4、8、16、24 h进样,测定各氨基酸组分峰面积,计算地参样品中17种氨基酸的相对标准偏差。
1.3.5.3 重复性实验
平行称取6份同一地参样品(S3)0.5 g,按照1.3.1节进行地参样品溶液的制备,按照1.3.3节色谱条件测定,测定各氨基酸峰面积,计算地参样品中17种氨基酸含量的相对标准偏差。
1.3.5.4 加标回收实验
准确称取已知含量的地参粉末0.25 g(S3),分别加入17种氨基酸对照品适量,按照1.3.1节方法制备样品溶液和衍生,按照1.3.3节色谱条件测定,分别计算各氨基酸成分的回收率和相对标准偏差。
1.3.6 营养评价
据联合国粮食和农业组织和世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization, FAO/WHO),计算氨基酸比值(ratio of amino acid,RAA)、氨基酸比值系数(RAA/ratio coefficient, RC)、氨基酸比值系数分(score of ratio coefficient of amino acid,SRCAA),其中RAA=待测样品中氨基酸含量/WHO/FAO模式氨基酸含量;RC=RAA/RAA平均值;SRC=100×(1-RC标准差/RC平均值),对地参氨基酸营养价值进行评价。
1.4 数据处理
采用 Microsoft Excel 2019 软件对测定数据进行处理、计算,采用origin 2021对数据分别进行相关性、聚类分析绘图,采用SPSS 26.0 软件对数据进行主成分分析。
2 结果与分析
2.1 方法学考察
17种氨基酸在各自质量浓度的线性范围内关系良好,相关系数均r≥0.999 0,17种氨基酸回归方程见表1,氨基酸液相色谱图见图1。精密度测定17种氨基酸RSD为0.39%~1.42%,均小于2%,表明仪器精密度良好。稳定性实验中氨基酸RSD为0.76%~2.65%,表明样品溶液在24 h内稳定性良好。重复性实验中测定氨基酸含量RSD为0.46%~1.99%,均小于2%,表明实验方法的重复性良好,可用于地参中氨基酸测定。17种氨基酸成分的平均回收率为96.79%~103.94%,RSD为0.73%~2.97%,该方法回收率高。综上,建立的方法可靠。

1-天冬氨酸 (Asp);2-谷氨酸 (Glu);3-丝氨酸 (Ser);4-甘氨酸(Gly);5-组氨酸 (His);6-精氨酸 (Arg);7-苏氨酸(Thr);8-丙氨酸(Ala);9-脯氨酸(Pro);10-酪氨酸 (Tyr);11-缬氨酸 (Val);12-甲硫氨酸 (Met);13-半胱氨酸(Cys);14-异亮氨酸(Ile);15-亮氨酸(Leu);16-苯丙氨酸 (Phe);17-赖氨酸 (Lys)
A-混合对照品;B-供试品
图1 氨基酸高效液相色谱图
Fig.1 HPLC chromatogram of mixed reference substance and test substance
表1 十七种氨基酸的标准曲线、线性范围、相关系数、精密度、稳定性、重复性、加标回收率
Table 1 Standard curves, linear range, correlation coefficients, precision, stability, repeatability, and spiked recovery rates of 17 amino acids
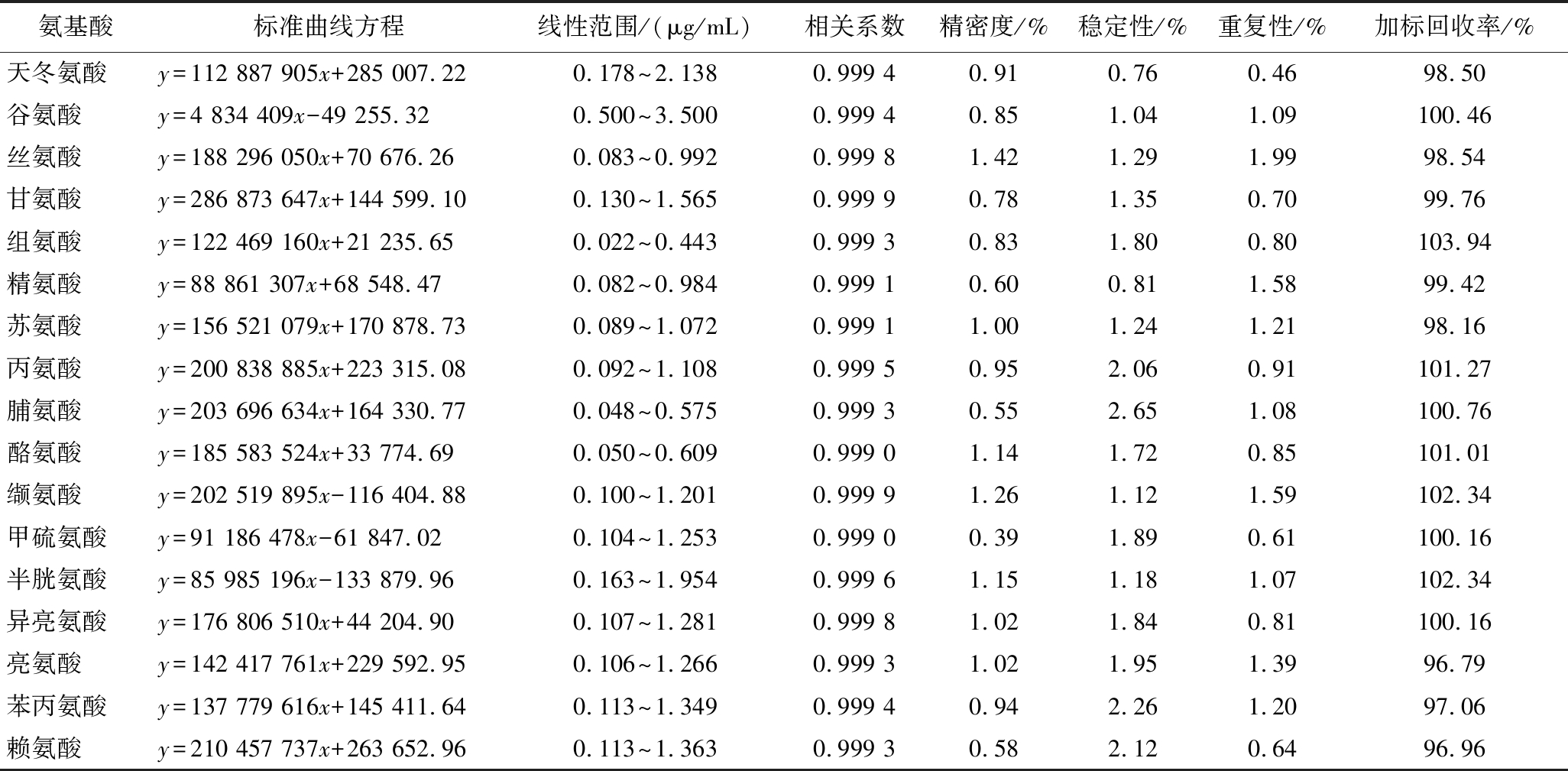
氨基酸标准曲线方程线性范围/(μg/mL)相关系数精密度/%稳定性/%重复性/%加标回收率/%天冬氨酸y=112 887 905x+285 007.220.178~2.1380.999 40.910.760.4698.50谷氨酸y=4 834 409x-49 255.320.500~3.5000.999 40.851.041.09100.46丝氨酸y=188 296 050x+70 676.260.083~0.9920.999 81.421.291.9998.54甘氨酸y=286 873 647x+144 599.100.130~1.5650.999 90.781.350.7099.76组氨酸y=122 469 160x+21 235.650.022~0.4430.999 30.831.800.80103.94精氨酸y=88 861 307x+68 548.470.082~0.9840.999 10.600.811.5899.42苏氨酸y=156 521 079x+170 878.730.089~1.0720.999 11.001.241.2198.16丙氨酸y=200 838 885x+223 315.080.092~1.1080.999 50.952.060.91101.27脯氨酸y=203 696 634x+164 330.770.048~0.5750.999 30.552.651.08100.76酪氨酸y=185 583 524x+33 774.690.050~0.6090.999 01.141.720.85101.01缬氨酸y=202 519 895x-116 404.880.100~1.2010.999 91.261.121.59102.34甲硫氨酸y=91 186 478x-61 847.020.104~1.2530.999 00.391.890.61100.16半胱氨酸y=85 985 196x-133 879.960.163~1.9540.999 61.151.181.07102.34异亮氨酸y=176 806 510x+44 204.900.107~1.2810.999 81.021.840.81100.16亮氨酸y=142 417 761x+229 592.950.106~1.2660.999 31.021.951.3996.79苯丙氨酸y=137 779 616x+145 411.640.113~1.3490.999 40.942.261.2097.06赖氨酸y=210 457 737x+263 652.960.113~1.3630.999 30.582.120.6496.96
2.2 不同干燥方式下氨基酸含量分析
不同干燥方式下地参样品中均检测出17种氨基酸类成分(表2),每种干燥方式下地参氨基酸占该地参氨基酸类成分总量比值不同。12种干燥方式的地参中天冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、酪氨酸、缬氨酸、甲硫氨酸、半胱氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸的总平均含量分别为1.405、4.125、0.818、0.991、0.148、1.050、0.881、0.795、1.411、0.669、1.083、0.387、0.869、0.772、1.378、0.971、0.944 mg/g,其中谷氨酸含量最高为2.371~7.729 mg/g,平均含量为4.125 mg/g,占氨基酸总量的22.06%,组氨酸含量最低为0.019~0.370 mg/g,平均含量为0.148 mg/g,占氨基酸总量的0.79%,氨基酸总含量为13.085~28.988 mg/g,平均含量为18.70 mg/g。对比不同干燥方式下氨基酸总含量,从高到低排序为S12>S2>S4>S10>S3>S6>S1>S9>S5>S7>S8>S11,其中S12总氨基酸含量最高为28.988 mg/g,与测量枣花中氨基酸含量相近[16],除丝氨酸、丙氨酸、酪氨酸、半胱氨酸、赖氨酸外,其余12种氨基酸在S12的含量均高于其他11种干燥方式。可能是由于S12真空低温下,美拉德反应和蛋白质氧化反应程度较低,使氨基酸损失较少[17]。
表2 不同干燥方式下地参中氨基酸含量![]() 单位:mg/g
单位:mg/g
Table 2 Amino acid content in Lycopus lucidus Turcz.var.hirtus Regel with different drying methods

注:同列不同小字母表示在P<0.05水平差异显著。
干燥方式天冬氨酸谷氨酸丝氨酸甘氨酸组氨酸精氨酸苏氨酸丙氨酸脯氨酸酪氨酸缬氨酸甲硫氨酸半胱氨酸异亮氨酸亮氨酸苯丙氨酸赖氨酸S11.490±0.003f4.039±0.008f0.810±0.001g0.988±0.001f0.042±0.001h0.987±0.003g0.793±0.001g0.926±0.003d1.132±0.002k0.738±0.002c1.051±0.003f0.389±0.005e0.385±0.001h0.689±0.007g1.401±0.002e0.964±0.020d0.710±0.001hS21.890±0.002c6.547±0.009b1.244±0.003a1.047±0.003e0.211±0.003d1.235±0.004b1.242±0.003a1.273±0.003a1.184±0.001j0.816±0.002b1.510±0.006b0.524±0.006b0.349±0.007h1.019±0.007b1.870±0.003b1.246±0.006b1.572±0.003aS31.799±0.002d4.506±0.005d0.826±0.011f0.909±0.002h0.235±0.001c1.134±0.001d0.898±0.001d0.850±0001e1.325±0.002f0.708±0.002d1.144±0.002d0.393±0.005e0.608±0.037g0.794±0.010d1.467±0.003d0.971±0.002d1.106±0.001cS41.952±0.002b5.435±0.005c0.907±0.001c0.920±0.007g0.109±0.001gh1.224±0.001c0.926±0.001c0.953±0.002c1.236±0.001h0.732±0.003c1.136±0.003e0.341±0.001g0.619±0.011g0.757±0.007e1.408±0..004e0.968±0.003d1.031±0.002dS50.726±0.002k2.361±0.005l0.727±0.002h1.127±0.001c0.033±0.002i0.858±0.002h0.863±0.006e0.601±0.010i1.666±0.034c0.915±0.002a0.853±0.003i0.455±0.002c0.855±0.007e0.657±0.009h1.021±0.003j1.245±0.003b0.307±0.002iS61.028±0.002h4.000±0.004g0.832±0.003e1.191±0.003b0.027±0.002j1.048±0.008f0.890±0.029de0.788±0.006f1.701±0.002b0.635±0.002e1.185±0.003c0.436±0.005d1.022±0.005c0.843±0.003c1.637±0.003c1.051±0.005c1.015±0.003eS71.034±0.026h3.108±0.004h0.625±0.001i0.823±0.002k0.112±0.002g0.785±0.003j0.679±0.002h0.625±0.011h1.355±0.002e0.635±0.002e0.894±0.001g0.287±0.001j0.880±0.004e0.628±0.003i1.138±0.003g0.737±0.005g0.738±0.002gS80.787±0.001j2.636±0.005i0.560±0.002j0.866±0.002j0.019±0.001k0.764±0.001k0.608±0.002i0.542±0.002j1.216±0.007i0.552±0.005g0.836±0.002j0.297±0.001i0.846±0.002e0.594±0.002j1.115±0.003h0.698±0.006h0.707±0.003hiS91.146±0.002g2.541±0.005j0.733±0.001h0.897±0.007i0.207±0.001e1.073±0.016e0.833±0.004f0.621±0.027h1.353±0.008e0.499±0.008h0.863±0.007h0.314±0.002h1.439±0.018b0.727±0.010f1.075±0.012i0.756±0.002f0.949±0.006fS101.583±0.002e4.232±0.004e0.847±0.002d1.077±0.003d0.246±0.002b1.226±0.001b0.995±0.001b0.658±0.001g1.568±0.004d0.586±0.038f1.130±0.005e0.383±0.004f1.729±0.080a0.846±0.003c1.223±0.002f0.865±0.003e1.103±0.002cS110.827±0.003i2.371±0.004k0.540±0.002k0.708±0.001l0.171±0.002f0.841±0.002i0.597±0.001ij0.523±0.005k1.277±0.001g0.408±0.002i0.772±0.002k0.266±0.006k0.946±0.009d0.566±0.003k1.016±0.003k0.602±0.003i0.655±0.020iS122.597±0.002a7.729±0.002a1.160±0.002b1.334±0.012a0.370±0.001a1.424±0.002a1.253±0.016a1.184±0.002b1.918±0.002a0.803±0.002b1.623±0.004a0.561±0.004a0.745±0.009f1.139±0.002a2.167±0.011a1.546±0.003a1.436±0.007b
2.3 不同干燥方式下地参中必需氨基酸组分比较
以FAO/WHO所提出的氨基酸模式谱理论为对照,将不同干燥方式下地参中氨基酸组成与模式谱标准进行比较,结果见表3。必需氨基酸的总含量为4.473~9.724 mg/g,平均含量为6.416 mg/g,必需氨基酸含量由高到低为亮氨酸>缬氨酸>苯丙氨酸>赖氨酸>苏氨酸>异亮氨酸>甲硫氨酸。必需氨基酸(essential amino acid,EAA)占总氨基酸(total amion acid,TAA)的比值(EAA/TAA)为31.80%~36.51%,平均值为34.36%,必需氨基酸与非必需氨基酸(non essential amion-acids,NEAA)的比值(EAA/NEAA)为46.62%~57.51%,平均值为52.42%,必需氨基酸的总含量从高到低排序为S12>S2>S6>S3>S4>S10>S1>S9>S5>S7>S8>S11,与FAO/WHO标准中规定标准EAA/TAA为40%,EAA/NEAA为60%有一定差距,与黄小兰等[9]报道一致,表明地参营养不均衡且不同干燥方式下地参也存在一定差异。
表3 不同干燥方式地参样品的氨基酸种类分析
Table 3 Analysis of amino acid species in Lycopus lucidus Turcz.var. hirtus Regel samples under different drying methods
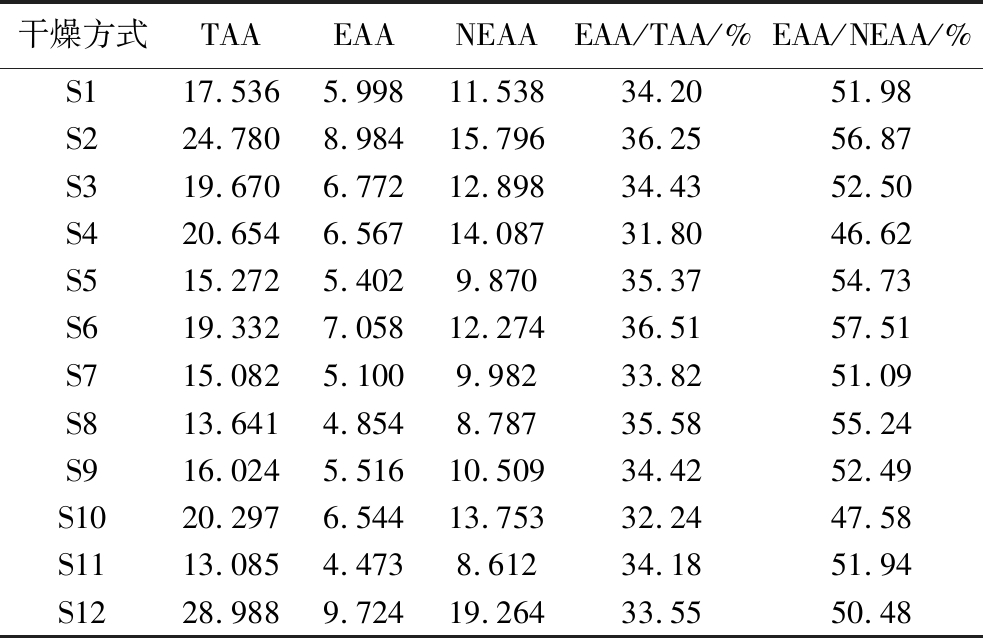
干燥方式TAAEAANEAAEAA/TAA/%EAA/NEAA/%S117.5365.99811.53834.2051.98S224.7808.98415.79636.2556.87S319.6706.77212.89834.4352.50S420.6546.56714.08731.8046.62S515.2725.4029.87035.3754.73S619.3327.05812.27436.5157.51S715.0825.1009.98233.8251.09S813.6414.8548.78735.5855.24S916.0245.51610.50934.4252.49S1020.2976.54413.75332.2447.58S1113.0854.4738.61234.1851.94S1228.9889.72419.26433.5550.48
2.4 不同干燥方式下地参中氨基酸比值系数评价
根据公式进行计算地参中RAA、RC、SRC值评价地参氨基酸营养价值,其中RC>1,表示该氨基酸相对过剩,RC<1时,表示该氨基酸相对不足,RC最小的氨基酸为该蛋白质的限制性氨基酸。由表4可得到,S1、S4、S5、S6、S7、S8、S9、S11、S12干燥方式下Lys为第一限制性氨基酸;S2干燥方式下Met+Cys为第一限制性氨基酸;S3干燥方式以Ile为第一限制性氨基酸;S10中Leu最小,为第一限制性氨基酸,其他氨基酸略高或低于WHO/FAO规定值,可通过其他食物进行弥补和调节。SRC反馈的是食物中氨基酸与模式氨基酸在“质”的差别,SRC越接近100,其营养价值相对较高[18],12种干燥方式下地参样品的SRC为45.305~88.268,不同地参样品存在区别,由高到低S2>S12>S3>S4>S1>S6>S7>S8>S11>S9>S10>S5,说明S2、S12干燥下,营养价值更高,有较好开发前景。
表4 地参样品中必需氨基酸的RAA、RC、SRC值
Table 4 RAA, RC, and SRC values of essential amino acids in Lycopus lucidus Turcz.var.hirtus Regel samples

干燥方式参数ThrValMet+CysIleLeuPhe+TyrLysSRCS1RAA1.1311.1991.2620.9821.1411.6180.73676.681RC0.9811.0401.0950.8520.9901.4030.638S2RAA1.2531.2181.0071.0281.0781.3871.15488.268RC1.0801.0500.8670.8860.9291.1950.994S3RAA1.1411.1631.4531.0091.0661.4221.02284.475RC0.9650.9831.2290.8540.9011.2030.865S4RAA1.1211.1001.3280.9160.9741.3720.90782.895RC1.0160.9981.2050.8310.8831.2440.823S5RAA1.4131.1182.4511.0760.9552.3570.36645.305RC1.0160.8041.7620.7740.6871.6950.263S6RAA1.1511.2262.1561.0901.2101.4540.95569.835RC0.8720.9291.6330.8260.9161.1010.723S7RAA1.1251.1862.2111.0401.0781.5160.89065.314RC0.8710.9171.7110.8050.8341.1730.688S8RAA1.1141.2252.3931.0891.1671.5270.94363.510RC0.8240.9071.7710.8060.8641.1300.698S9RAA1.2991.0773.1261.1340.9581.3051.07746.637RC0.9120.7562.1940.7950.6720.9150.756S10RAA1.2261.1142.9721.0420.8611.1910.98845.634RC0.9130.8302.2150.7760.6410.8880.737S11RAA1.1411.1802.6461.0811.1091.2870.91055.937RC0.8540.8831.9800.8090.8300.9630.681S12RAA1.0801.1201.2870.9821.0681.3500.90185.694RC0.9711.0061.1570.8830.9601.2140.810
2.5 不同干燥方式下地参药用氨基酸组成分析
药用氨基酸种类齐全,包括甲硫氨酸、苯丙氨酸、亮氨酸、赖氨酸、酪氨酸、天冬氨酸、谷氨酸、甘氨酸和精氨酸9种,12种干燥方式均检测出(表5),其含量为7.693~19.597 mg/g,平均含量为11.920 mg/g;药用氨基酸占TAA含量的57.72%~67.84%,平均占比63.12%,与枸杞[19]、石斛[20]等中药含量相当,其中S12>S2>S4>S3>S10>S6>S1>S7>S9>S5>S8>S11。不同干燥方式地参的药用氨基酸含量相差较大,主要集中在天冬氨酸、谷氨酸和赖氨酸,均在鼓风、远红外、真空各干燥方式60 ℃下含量较低,可能是当干燥温度过高,蛋白酶逐渐失去活性,不能分解蛋白质,且温度过高也导致氨基酸被破坏[21]。但其在总氨基酸中所占比例相差不大。其中S12干燥方式药用氨基酸含量最高为19.597 mg/g,S11药用氨基酸含量最低为7.693 mg/g,与氨基酸总含量具有基本一致性。其中谷氨酸、天冬氨酸、精氨酸含量较高,研究表明谷氨酸是脑内最丰富的兴奋性神经递质,在学习记忆、神经营养及诱发神经再生方面具有一定的生理功能[22];天冬氨酸改善心血管疾病、增强肝脏功能,治疗糖尿病[23-24];精氨酸具有抗氧化、抗炎、抗细胞凋亡[25]等作用。
表5 不同干燥方式地参药用氨基酸组分
Table 5 Medicinal amino acid components of Lycopus lucidus Turcz.var.hirtus Regel with different drying methods

干燥方式药用氨基酸质量分数药用氨基酸占TAA比例/%S111.70666.76S216.74867.58S312.99266.05S414.01167.84S59.01659.04S612.04262.29S79.28561.56S88.42261.74S99.24957.72S1012.27760.49S117.69358.79S1219.59767.60
2.6 不同干燥方式地参氨基酸含量主成分分析
利用SPSS 26.0软件对原始数据作标准化处理,进行Kaiser-Meyer-Olikin(KMO)和Bartelett 球形度检验,得出KMO=0.705,Bartelett 球形度检验卡方统计量=1 825.254,P<0.001,表明数据适合做主成分分析。对12种干燥方式下地参中17种氨基酸组分进行主成分分析,特征值>1为标准。得到主成分特征值及贡献率,提取出3个特征值>1的主成分(表6),其中主成分1的特征值为11.862,特征值贡献率为69.774%,主成分2的特征值为1.993,特征值贡献率为11.726%,主成分3的特征值为1.927,特征值贡献率为11.334%。
表6 主成分的特征值及方差贡献率
Table 6 Eigenvalues and variance contribution rate of principal components

主成分特征值方差贡献率/%累积方差贡献率/%111.86269.77469.77421.99311.72681.50031.92711.33492.832
根据提取的3个主成分载荷矩阵,结果见表7,在主成分1中,除半胱氨酸外其余16种氨基酸均为正向影响,除脯氨酸载荷值较低,其余均大于0.612。主成分2中组氨酸的载荷值最高为0.643;主成分3脯氨酸中载荷值最高为0.852。结果表明,主成分1、主成分2和主成分3可以用于代替氨基酸指标对12种干燥方式制备的地参进行综合评价。
表7 主成分载荷矩阵
Table 7 Principal component loading matrix

主成分因子载荷值F1F2F3Asp0.8820.239-0.226Glu0.9540.084-0.205Ser0.968-0.013-0.122Gly0.768-0.2630.540His0.6120.6430.066Arg0.8900.3390.021Thr0.9640.0470.083Ala0.916-0.109-0.368Pro0.429-0.0290.852Tyr0.621-0.6960.032Val0.9820.050-0.081Met0.898-0.3150.213Cys-0.3090.5980.686Ile0.9740.1540.105Leu0.939-0.023-0.112Phe0.876-0.3930.231Lys0.8240.440-0.232
对提取的主成分进行主成分得分计算和排序,计算公式:
F1=0.259Asp+0.281Glu+0.283Ser+0.224Gly+0.183His+0.206Arg+0.283Thr+0.268Ala+0.126Pro+0.184Tyr+0.289Val+0.265Met-0.096Cys+0.286Ile+0.276Leu+0.258Phe+0.240Lys;
F2=0.187Asp+0.080Glu-0.015Ser-0.257Gly+0.462His+0.358Arg+0.033Thr-0.040Ala-0.111Pro-0.456Tyr+0.038Val-0.232Met+0.299Cys+0.080Ile-0.008Leu-0.286Phe+0.307Lys;
F3=-0.131Asp-0.136Glu-0.093Ser+0.347Gly+0.137His+0.070Arg+0.070Thr-0.277Ala+0.606Pro-0.040Tyr-0.052Val+0.117Met+0.550Cys+0.087Ile-0.086Leu+0.118Phe-0.117Lys;
F=0.697 74F1+0.117 26F2+0.113 34F3,并进行排序。结果如表8所示,综合排序由高到低为S12>S2>S10>S3>S6>S4>S1>S5>S9>S7>S11>S8,不同干燥方式下地参的F值为-2.667~5.225,表明不同干燥方式下地参中氨基酸含量差异明显,S12、S2、S10干燥方式较好保留地参中氨基酸成分,而S8、S11易导致地参中氨基酸类成分的流失(表8)。
表8 地参样品主成分得分、综合得分及排序
Table 8 Principal component scores, comprehensive scores, and sorting of Lycopus lucidus Turcz.var.hirtus Regel samples

干燥方式F1F2F3F合排序S1-0.552-1.223-1.731-0.7257S25.0170.284-1.9973.2222S30.9120.953-0.7790.6514S40.6410.129-1.6210.2686S5-1.399-2.4371.688-1.0648S60.462-1.3951.2520.2825S7-2.7050.273-0.289-1.83910S8-3.780-0.289-0.524-2.66712S9-2.2991.3110.836-1.3069S100.4601.7532.0050.7603S11-4.1211.698-0.244-2.61911S127.3650.5111.3275.2251
2.7 不同干燥方式地参氨基酸含量相关性分析
对不同干燥方式下地参中17种氨基酸含量进行相关性分析,结果如图2所示,图中红色代表成分之间呈正相关,蓝色代表呈负相关,白色代表成分之间不存在显著性相关性(P>0.05)。相关性矩阵表明,半胱氨酸除与组氨酸和脯氨酸外,其余表现为负相关或无显著性相关性,其余氨基酸之间表现为正相关(P<0.05)。脯氨酸除与甘氨酸外,与其他15种氨基酸表现为无显著相关性,其余氨基酸组分之间多成正相关且呈显著性,在153组数据组有70组氨基酸呈极显著正相关(P<0.01),17组数据间呈显著性正相关(P<0.05),说明地参中的不同氨基酸组分之间具有协同增量作用(图2)。

图2 十二种干燥方式下地参的相关性分析
Fig.2 Correlation analysis of Lycopus lucidus Turcz.var.hirtus Regel with 12 drying methods
注:*P≤0.05,**P≤0.01。
2.8 不同干燥方式地参氨基酸含量聚类分析
对12种干燥方式下地参中17种氨基酸进行聚类分析(图3),12种干燥方式分为四类,S2和S12为一类,该干燥方式下地参品质较高;S5为一类,氨基酸品质中等;S1、S3、S4、S6、S9、S10为一类,氨基酸品质较低,S7、S8、S11为一类,氨基酸品质最低。结合主成分分析进行综合评价,热图中第一类同为主成分综合得分前两名,主成分分析结果基本一致。聚类分析结果体现了12种干燥方式下地参氨基酸类成分含量差异较大,这些差异性为地参的药用开发提供理论依据。
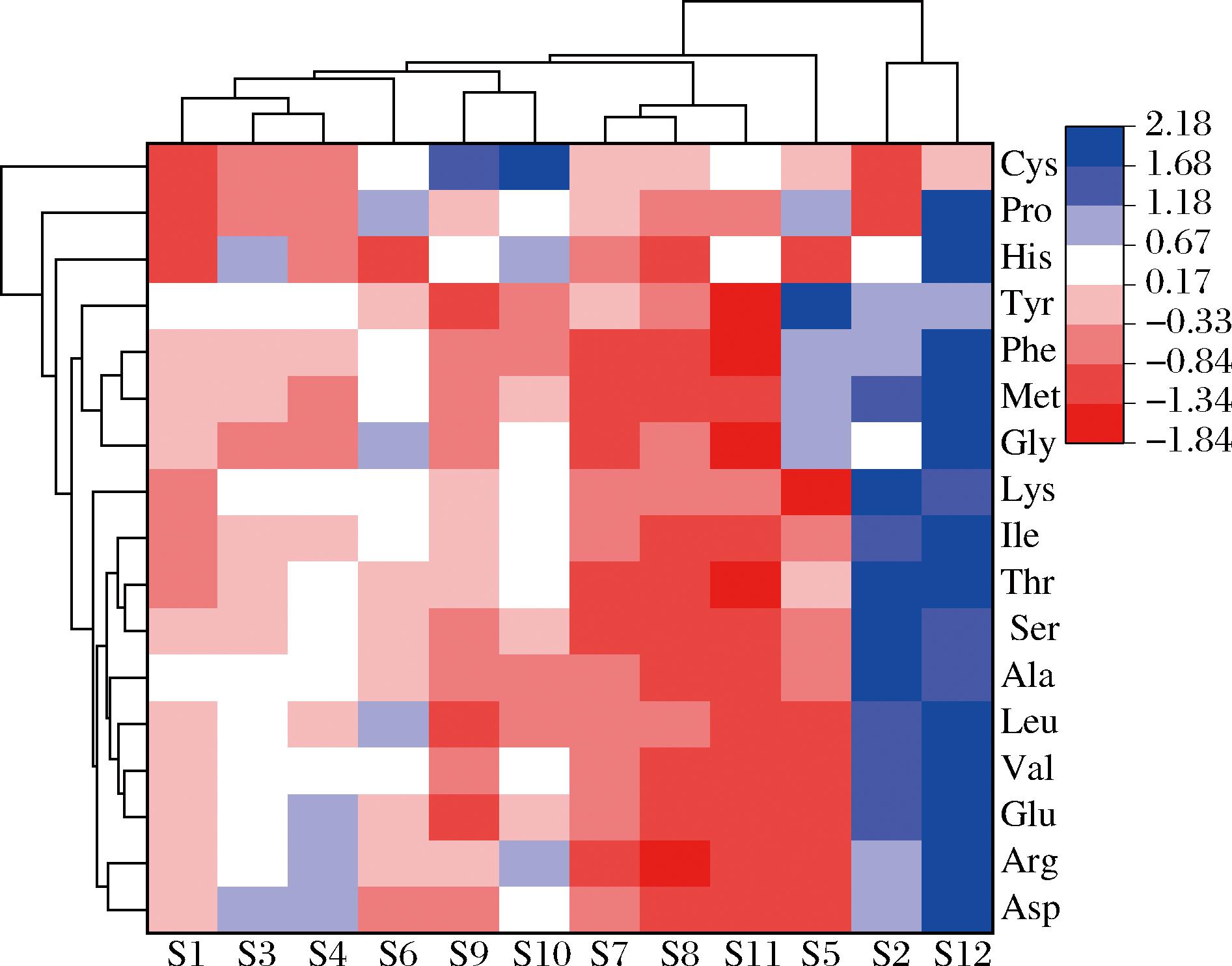
图3 不同干燥方式下地参氨基酸含量聚类分析
Fig.3 Cluster analysis of amino acid content in Lycopus lucidus
Turcz.var.hirtus Regel with different drying methods
3 结论与讨论
从地参的种植、加工、销售等各个环节均对地参的品质产生影响。大多数中药材在干燥处理过程中能引起中药材中多种活性成分的显著变化[26]。因此,干燥加工是影响地参品质好坏的关键因素。
本研究采用阴干、晒干、远红外、真空冷冻等12种不同干燥方式,发现地参的氨基酸各组分种存在显著的差异,总氨基酸含量为13.08~28.98 mg/g,含量差异约为2.2倍。朱金霞等[27]通过比较热风干燥、真空微波干燥、真空冷冻干燥3种方式对黄伞子实体营养品质影响,发现真空冷冻干燥下总游离氨基酸、呈味氨基酸含量最高;赵金梅等[28]通过真空冷冻干燥、热风干燥、自然阴干3种不同的干燥方式,对沙枣花品质进行了研究,发现真空冷冻下总氨基酸含量最高,而本研究中地参在真空冷冻-80 ℃下总氨基酸、7种必需氨基酸和9种药用氨基酸含量最高,S12能最大程度保留氨基酸成分,这可能是低温和真空条件下,在一定程度上防止了蛋白质降解;通过主成分法构建地参氨基酸成分综合评价得出,S12样品综合得分最高,氨基酸品质最佳。通过聚类评价分析得出,S12和S2聚为一类,营养品质较高。此外,加工方式是影响中药材品质的重要因素之一,不同干燥方法与地参本身的水分含量及化学成分密切相关,目前评价地参品质的指标较为单一,不能全面系统地反映品质,因此需要建立多成分指标评价体系,不仅依据成分含量,更应结合药效、疗效。课题组的研究中发现,不同干燥方式下三萜酸、酚酸等有机酸的含量也存在较大的差异。因此,对于地参的最适宜的干燥方式,还需要系统深入的研究。
本研究利用PITC柱前衍生化HPLC法测定了地参中17种氨基酸的含量,该方法灵敏度高,分离效果好,结果稳定可靠;同时比较了12种干燥方式对地参氨基酸含量的差异,得出真空冷冻-80 ℃下总氨基酸、必需氨基酸、药用氨基酸含量均最高,且营养价值较高,为地参资源的加工和利用提供理论依据。
[1] 国家中医药管理局中华本草编委会. 中华本草.2[M].上海:上海科学技术出版社, 1999:76-77.State Administration of Traditional Chinese Medicine Chinese Materia Medica. 2[M].Shanghai:Shanghai Science and Technology Press, 1999:76-77.
[2] 李金金, 孟琦, 崔馨燕, 等.响应面法优化地参三萜酸提取工艺及抗氧化活性分析[J].南方农业学报, 2022, 53(8):2261-2271.LI J J, MENG Q, CUI X Y, et al.Optimization of extraction process by response surface methodology and antioxidant activity analysis of triterpenic acid from Lycopus lucidus Turcz[J].Journal of Southern Agriculture, 2022, 53(8):2261-2271.
[3] 黄小兰, 何旭峰, 杨勤, 等.HPLC-PDA同时测定地笋中7种酚酸的含量[J].中国实验方剂学杂志, 2020, 26(15):156-162.HUANG X L, HE X F, YANG Q,et al.Simultaneous determination of 7 phenolic acids in Lycopus lucidus var.hirtus rhizome by HPLC-PDA[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(15):156-162.
[4] 黄小兰, 何旭峰, 周祥德, 等.不同产地地参中22种元素的测定与分析[J].食品与发酵工业, 2020, 46(20):229-235.HUANG X L, HE X F, ZHOU X D, et al.Determination and analysis of 22 elements in Lycopus lucidus var.hirtus Regel from different habitats[J].Food and Fermentation Industries, 2020, 46(20):229-235.
[5] 黄小兰, 何旭峰, 周祥德, 等.地参主要化学成分及生物活性研究进展[J].中国野生植物资源, 2021, 40(2):51-56.HUANG X L, HE X F, ZHOU X D, et al.Research progress on main chemical composition and biological activities of Lycopus lucidus var.hirtus Regel[J].Chinese Wild Plant Resources, 2021, 40(2):51-56.
[6] 陈友霞. 地参主要酚类化合物单体对肝细胞损伤体外保护作用的研究[D].大理:大理大学, 2020.CHEN Y X.Study on the in vitro protective effect of main phenolic compounds monomers of Lycopus lucidus var.hirtus Regel on liver cell damage[D].Dali:Dali University, 2020.
[7] 李媛丽. 地参酚类化合物对酒精致肝细胞损伤保护作用的研究[D].大理:大理大学, 2023.LI Y L.A study on the protective effect of Lycopus lucidus Turcz.phenolic compounds on alcohol induced liver cell damage[D].Dali:Dali University, 2023.
[8] 黄丽金, 陈贵元.地参多糖抗肿瘤作用研究进展[J].医学研究杂志, 2023, 52(4):16-18.HUANG L J, CHEN G Y.Research progress on the anti-tumor effect of Lycopus lucidus Turcz.polysaccharides[J].Journal of Medical Research, 2023, 52(4):16-18.
[9] 黄小兰, 何旭峰, 杨勤, 等.不同产地地参中17种氨基酸的测定与分析[J].食品科学, 2021, 42(2):255-261.HUANG X L, HE X F, YANG Q, et al.Determination of 17 amino acids in the dried rhizome of Lycopus lucidus Turcz.var.hirtus Regel from different habitats[J].Food Science, 2021,42(2):255-261.
[10] 李蕾, 王永, 云兴福.地笋生长发育规律及营养成分的初步研究[J].华北农学报, 2005, 20(5):50-53.LI L, WANG Y, YUN X F.Primary study of nutrients and law of growth and development Disun (Lycopus lucidus Turcz)[J].Acta Agriculturae Boreali—Sinica, 2005, 20(5):50-53.
[11] 张荣平, 周宁娜, 罗天诰.地参中氨基酸、粗蛋白和元素分析[J].中医药研究, 1998(5):52-53.ZHANG R P, ZHOU N N, LUO T G.Analysis of amino acids, crude proteins, and elements in Lycopus lucidus Turcz[J].Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 1998(5):52-53.
[12] 周思静, 乔宇琛, 刘桂君, 等.不同干燥方式对铁皮石斛粉品质的影响[J].食品研究与开发, 2019, 40(16):11-16.ZHOU S J, QIAO Y C, LIU G J, et al.Effiects of different drying methods on the quality of Dendrobium officinale Kimura et Migo powder[J].Food Research and Development, 2019, 40(16):11-16.
[13] 高萌, 牟丽燕, 张科卫, 等.基于指纹图谱结合多元统计分析不同干燥方式蟾蜍肉氨基酸类成分[J].中国现代中药, 2023, 25(6):1287-1295.GAO M, MOU L Y, ZHANG K W, et al.Analysis of amino acids of Bufo gargarizans meat from different drying methods based on fingerprint and multivariate statistics[J].Modern Chinese Medicine, 2023, 25(6):1287-1295.
[14] 杨双喜, 马尧, 张海红, 等.干燥方式对黄花菜粉营养、色泽及氨基酸含量的影响[J].中国食品学报, 2022, 22(10):232-241.YANG S X, MA Y, ZHANG H H, et al.Effects of drying methods on the nutrition, color and amino acid content of daylily powder[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):232-241.
[15] 胡强, 王延云, 王燕, 等.两种干燥方式对苦竹笋粉营养成分的影响[J].乐山师范学院学报, 2023, 38(8):21-26.HU Q, WANG Y Y, WANG Y, et al.Effects of two drying methods on nutrient components of bitter bamboo shoot powder[J].Journal of Leshan Normal University, 2023, 38(8):21-26.
[16] SYAMALADEVI R M, INSAN S K, DHAWAN S, et al.Physicochemical properties of encapsulated red raspberry (Rubus idaeus) powder:Influence of high-pressure homogenization[J].Drying Technology, 2012, 30(5):484-493.
[17] 林宝妹, 邱珊莲, 郑开斌.2种干燥方式下蚕豆氨基酸品质的比较分析[J].福建农业科技, 2021, 52(6):52-57.LIN B M, QIU S L, ZHENG K B.Comparative analysis on the amino acid quality of Vicia faba under two kinds of drying methods[J].Fujian Agricultural Science and Technology, 2021, 52(6):52-57.
[18] 李美凤, 刘娟汝, 陈艳, 等.3个不同产地的松露氨基酸组成及营养价值评价[J].食品工业, 2021, 42(1):342-346.LI M F, LIU J R, CHEN Y, et al.Amino acid composition and nutritional quality evaluation of truffles from 3 different growing regions[J].The Food Industry, 2021, 42(1):342-346.
[19] 吴有锋, 谭亮, 沈建伟, 等.柴达木枸杞中17种氨基酸的测定与分析[J].食品工业科技, 2017, 38(1):281-286.WU Y F, TAN L, SHEN J W, et al.Determination and analysis of 17 amino acids in Qaidam Chinese wolfberry[J].Science and Technology of Food Industry, 2017, 38(1):281-286.
[20] 王晓媛, 王彦兵, 陈玉芹, 等.6种石斛属植物氨基酸组成及营养价值评价[J].天然产物研究与开发, 2019, 31(4):601-607.WANG X Y, WANG Y B, CHEN Y Q, et al.Amino acid composition and nutritional value evaluation of 6 species of Dendrobium[J] Natural Product Research and Development, 2019, 31(4):601-607.
[21] 李弋, 黄文文, 周歧存.不同干燥方式对鱼粉营养价值及新鲜度的影响[J].宁波大学学报(理工版), 2017, 30(3):1-5.LI Y, HUANG W W, ZHOU Q C.Effect of different drying methods on the freshness and nutritive value of fish meal[J].Journal of Ningbo University (Natural Science and Engineering Edition), 2017, 30(3):1-5.
[22] 薛兰, 巩鹏, 王喆, 等.谷氨酸在抑郁症发病和治疗中的神经生物学机制[J].国际精神病学杂志, 2023, 50(4):600-604.XUE L, GONG P, WANG Z, et al.The neurobiological mechanism of glutamate in the pathogenesis and treatment of depression[J].Journal of International Psychiatry, 2023, 50(4):600-604.
[23] 贾志鑫, 潘明霞, 刘力榕, 等.基于代谢组学的速效救心丸抗心肌缺血作用机制研究[J].中草药, 2022, 53(15):4719-4729.JIA Z X, PAN M X, LIU L R, et al.Mechanism of Suxiao Jiuxin Pills against myocardial ischemia based on metabolomics[J].Chinese Traditional and Herbal Drugs, 2022, 53(15):4 719-4 729.
[24] DORNFELD K, MADDEN M, SKILDUM A, et al.Aspartate facilitates mitochondrial function, growth arrest and survival during doxorubicin exposure[J].Cell Cycle, 2015, 14(20):3282-3291.
[25] 张苗苗, 郭瑜洁.精氨酸的药理作用研究进展[J].科学咨询(科技·管理), 2022(1):62-65.ZHANG M M, GUO Y J.Research progress on the pharmacological effects of arginine[J].Scientific Consultation (Science and Technology&Management), 2022(1):62-65.
[26] 李玉姗, 邱勋荣, 齐娅汝, 等.中药材干燥过程中的活性成分变化机制研究现状[J].中国中药杂志, 2024, 49(2):315-324.LI Y H, QIU X R, QI Y R, et al.Mechanisms of changes of active components in Chinese medicinal materials during drying:A review[J].China Journal of Chinese Materia Medica, 2024, 49(2):315-324.
[27] 朱金霞, 田莉, 冯锐, 等.不同干燥方式对黄伞子实体营养品质及抗氧化活性的影响[J].中国食用菌, 2023, 42(5):99-104;115.ZHU J X, TIAN L, FENG R, et al.Effects of different drying methods on nutritional quality and antioxidant activity of fruit bodies of Pholiota adiposa[J].Edible Fungi of China, 2023, 42(5):99-104;115.
[28] 赵金梅, 孙蕊, 巩丽莉, 等.干燥方式对沙枣花品质和挥发性风味成分的影响[J].食品科学, 2020, 41(22):265-270.ZHAO J M, SUN R, GONG L L, et al.Effects of different drying methods on nutritional and volatile aroma components in flowers of Elaegnus angustifolia[J].Food Science, 2020, 41(22):265-270.