高节竹(Phyllostachys prominens)为禾本科竹亚科刚竹属,是一种笋材两用竹种,生态适应性强,具有高产量、优品质、适宜加工等特点,主要生长于浙江、江苏、江西等省份,重庆、福建等地已有引种栽培[1-3]。目前,关于高节竹,在栽培技术对产量及品质的影响上已有较为系统的研究,涉及该竹种及其副产物中活性成分的研究较少,仅在雷竹、毛竹、方竹等竹种上开展大量研究[4-5]。因此,选择此品种可以在一定程度上丰富竹种资料,提高资源利用率。
竹笋可食用部分约占笋体的1/3,剩余部分为副产物,常用作饲料或丢弃,造成资源浪费并易污染环境[6]。竹笋副产物与笋肉中的营养物质相差无几,富含膳食纤维、蛋白质、多酚等多种营养成分,属于高纤维产品,可改善人体健康,促进消化,降低血糖和胆固醇,预防肠癌[7-8]。膳食纤维(dietary fiber,DF)按照溶解度,可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)[9]。其中,SDF含量较IDF含量相对较低,包含可溶性半纤维素、果胶、藻酸钠、葡聚糖、低聚糖等物质,具有更高的生理活性和保健作用,是影响生理功能的主要因素,通过在肠道中的吸附作用及被微生物酵解,能控制体重及血糖、血脂,增强人体免疫力[10-12]。
SDF的制备方法繁多,包括物理、化学、生物3种制备技术。化学法利用酸碱处理,具有操作简单,低成本的优点。然而,它易降低SDF的品质及功能性能,并造成化学试剂残留[13]。物理、生物法包含超声波提取、微波处理、高温蒸煮、蒸汽爆破、挤压、酶水解。其中,超声波提取可因机械效应和空化效应使SDF能被更好地溶解、溶出;微波处理利用微波热能打破细胞膜,形成小孔,让胞内物质释放;酶水解易操作,反应条件温和,对环境友好,且能破坏纤维素、半纤维素和木质素,使IDF有效地转化为SDF [13-15]。通常,多种方法联合制备能有效地弥补单一制备法的缺陷。目前关于超声-微波联合酶法对高节竹笋头SDF理化、结构及功能的影响未见报道,对物理法联合物理法(超声-微波法)、物理法联合生物法制备的SDF性质差异尚不清楚。因此,本研究拟采用4种方法制备SDF,比较分析不同联合方法对SDF组成、理化、结构和功能特性的影响,以期为高节竹笋头SDF的研究提供启示,为高节竹笋头的利用提供理论依据。
1 材料与方法
1.1 材料与试剂
高节竹笋头,重庆市全伦生态农业综合开发有限公司;纤维素酶、木瓜蛋白酶、糖化酶、α-淀粉酶、α-葡萄糖苷酶、4-硝基苯基-β-D-呋喃葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,PNPG),北京索莱宝科技有限公司;阿卡波糖,合肥博美生物科技有限公司;胰蛋白酶、牛磺胆酸钠、甘胆酸钠、邻苯二甲醛、奥利司他、月桂酸4-硝基苯酯,上海麦克林生化科技有限公司;胰脂肪酶,上海源叶生物科技有限公司。其余试剂均为国产分析纯。
1.2 仪器与设备
KQ-300B 超声波清洗器,昆山市超声仪器有限公司;TPN26MSS-SSL 微波炉,广东美的电器制造有限公司;FD-1A-50 真空冷冻干燥机,北京博医康仪器有限公司;Nicolet iS5 傅里叶变换红外光谱仪,赛默飞世尔科技公司;Ultma IV X-射线衍射仪,日本理学株式会社;TGA2 热重分析仪,瑞士梅特勒集团;ZEISS Sigma 300 扫描电子显微镜,德国卡尔·蔡司股份公司;UV-1200 紫外可见分光光度计,上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 高节竹笋头SDF的制备
预处理:新鲜高节竹笋头去杂质,切片,放入-20 ℃保存,待用。
可溶性膳食纤维的制备:将笋头与蒸馏水按1∶3(g∶mL)的料液比研磨成浆。在300 W、55 ℃下进行超声939 s和300 W下微波1 min的处理,后调pH值至5.5。添加1.6%(质量分数)复合酶(纤维素酶∶木瓜蛋白酶∶糖化酶=1∶1∶1,质量比),55 ℃下水浴117 min,立即灭酶。抽滤得到澄清液体,旋蒸浓缩至1/5。醇沉后用蒸馏水复溶,放入-80 ℃保存。冷冻干燥后得到粉末状样品。按上述方法分别得到超声-微波处理(MU-SDF)、超声-酶处理(UE-SDF)、微波-酶处理(ME-SDF)、和超声-微波-酶处理(MUE-SDF)的可溶性膳食纤维。
1.3.2 高节竹笋头SDF理化性质的测定
1.3.2.1 基本组成成分的测定
水分、灰分、脂肪、蛋白质、总糖、总酚、糖醛酸含量均采用国家标准中的方法测定。
1.3.2.2 理化性质的测定
a)持水力
按CHEN等[16]方法,稍作修改。称取0.2 g样品(m1),溶于20 mL蒸馏水,25 ℃下混合静置2 h。5 000 r/min离心10 min,收集沉淀物并称重(m2)。依据公式(1)计算持水力:
持水力![]()
(1)
b)持油力
按LI等[17]方法,稍作修改。称取0.1 g样品(m1),加入10 mL玉米油,25 ℃下混合静置2 h。5 000 r/min离心10 min,去除游离油,收集沉淀物并称量(m2)。依据公式(2)计算持油力:
持油力![]()
(2)
c)膨胀力
按JIA等[18]方法,稍作修改。称取0.1 g样品(m)于刻度试管中,加入5 mL蒸馏水,记录此时体积(V1)。25 ℃下放置24 h,记录此刻体积(V2)。依据公式(3)计算膨胀力:
膨胀力![]()
(3)
d)溶解率
按CHENG等[19]方法,稍作修改。称取0.1 g样品(m0),溶于10 mL蒸馏水,在25 ℃下搅拌1 h。5 000 r/min离心10 min后,将上清液移至已恒重的培养皿(m1)中,烘干至恒重,称重(m2)。依据公式(4)计算溶解率:
溶解率![]()
(4)
1.3.3 高节竹笋头SDF结构表征
1.3.3.1 傅里叶变换红外光谱
取干燥样品于研钵中,按料液比1∶100(g∶mL)加入溴化钾粉末,研细,压片。在波数400~4 000 cm-1,分辨率4 cm-1下,扫描32次、采集光谱图。
1.3.3.2 X-射线衍射
冻干样品在电流20 mA、电压30 kV、扫描范围10°~50°,速度2°/min的条件下,经射线衍射,收集谱图。
1.3.3.3 扫描电镜
取适量干燥样品直接黏在导电胶上,喷金45 s,用扫描电子显微镜观察。
1.3.3.4 热重分析
在氮气(20 mL/min)氛围下,以20 ℃/min速率升温,利用热重分析仪测定样品在50~600 ℃内的稳定性。
1.3.4 高节竹笋头SDF功能特性的测定
1.3.4.1 体外降血糖能力的测定
a)α-淀粉酶抑制率
分别吸取0.5 mL不同浓度样品与α-淀粉酶于离心管中,37 ℃静置20 min后,加入0.5 mL 1%的可溶性淀粉,37 ℃水浴10 min。再加DNS试剂,沸水反应3 min,冷却,稀释后在540 nm处测量吸光度。以阿卡波糖作为阳性对照,蒸馏水替代样品为空白,磷酸盐缓冲液替代α-淀粉酶为对照。α-淀粉酶抑制率按公式(5)计算:
α-淀粉酶抑制率![]()
(5)
式中:A2,样品组的吸光度;A1,对照组的吸光度;A0,空白组的吸光度。
b)α-葡萄糖苷酶抑制率
吸取10 μL样液与同体积的α-葡萄糖苷酶于96孔酶标板中,37 ℃水浴10 min。再加20 μL 1.5 mmol/L PNPG溶液,于37 ℃反应20 min,加入150 μL 1 mol/L碳酸钠溶液,在405 nm处测吸光度。以阿卡波糖作为阳性对照,蒸馏水替代样品为空白,磷酸盐缓冲液替代α-葡萄糖苷酶为对照。α-葡萄糖苷酶抑制率按公式(6)计算:
α-葡萄糖苷酶抑制率![]()
(6)
式中:A2,样品组的吸光度;A1,对照组的吸光度;A0,空白组的吸光度。
1.3.4.2 体外降血脂能力的测定
a)胆固醇吸附能力
取新鲜鸡蛋的蛋黄与蒸馏水按体积比1∶9混合。准确称取0.1 g样品,将其与5 mL混合液混匀,再分别调节为pH 2、7,在37 ℃摇床中反应2 h。离心后取1 mL上清液按邻苯二甲醛法测吸光度值。胆固醇吸附能力根据公式(7)计算:
胆固醇吸附能力![]()
(7)
式中:m2,吸附前胆固醇的含量,mg;m1,吸附后胆固醇的含量,mg;m0,样品质量,g。
b)胰脂肪酶抑制率
将20 μL待测液、40 μL磷酸盐缓冲液、60 μL 1 mg/mL胰脂肪酶溶液、80 μL 0.8 mg/mL月桂酸-4-硝基苯酯溶液加到96孔板中,37 ℃水浴一段时间,于405 nm处测吸光度值。把奥利司他作为阳性对照,以不添加样品溶液为空白组,不添加胰脂肪酶为对照组[20]。胰脂肪酶抑制率按公式(8)计算:
胰脂肪酶抑制率![]()
(8)
式中:A2,样品组的吸光度;A1,对照组的吸光度;A0,空白组的吸光度。
c)胆酸盐结合能力
配制0~0.3 mmol/L的胆酸盐准溶液,取2.5 mL标准液和3倍体积的60%(体积分数)浓硫酸,70 ℃保温20 min,冰浴后在387 nm处吸光度值。取1 mL样液于试管中,加1 mL 10 mmol/L的胰蛋白酶溶液,37 ℃、120 r/min摇床中消化1 h。调节至pH 6.3,加4 mL 10 mmol/L的胃蛋白酶溶液,继续在同样条件下消化1 h。消化完全后,加4 mL 0.3 mmol/L胆酸盐溶液,在摇床中反应1 h。结束后,离心取2.5 mL上清液,按测标准曲线的方法操作。胆酸盐结合率按公式(9)计算:
胆酸盐结合率![]()
(9)
式中:c1,样品组胆酸盐浓度,mmol/L;c0,空白组胆酸盐浓度,mmol/L。
1.4 数据处理
利用SPSS 27.0处理并分析数据,采用ANOVA方差分析进行显著性分析,P<0.05为差异显著。应用Origin 2022绘图。
2 结果与分析
2.1 制备方法对SDF得率和理化性质的影响
2.1.1 SDF的得率及基本组成成分
利用不同方法制备的SDF的得率和基本组成成分含量见表1。不同方法制备SDF的得率为3.51%~10.98%,表明不同的方法对得率有影响。其中,MUE-SDF的得率最高,为10.98%,分别是MU-SDF、UE-SDF、ME-SDF的3.1倍、1.8倍、2.4倍,这可能是因为超声波的空化和机械效应、微波的热效应联合破坏细胞,使其胞内更多可溶性物质释放。同时,酶解处理将部分IDF转化为SDF,使不溶性半纤维素分解成可溶性半纤维素及高溶解度的葡聚糖[21]。MU-SDF的蛋白质含量最高,其次是UE-SDF、ME-SDF、MUE-SDF,这是由于酶解时蛋白质分解,降低了蛋白质含量,更有利于提高SDF纯度。此外,在不同方法制备的SDF中发现少量糖醛酸和酚类物质,表明这几种SDF可能含有酸性多糖。
表1 SDF的得率和基本组成成分
Table 1 Extraction yield and basic components of SDF
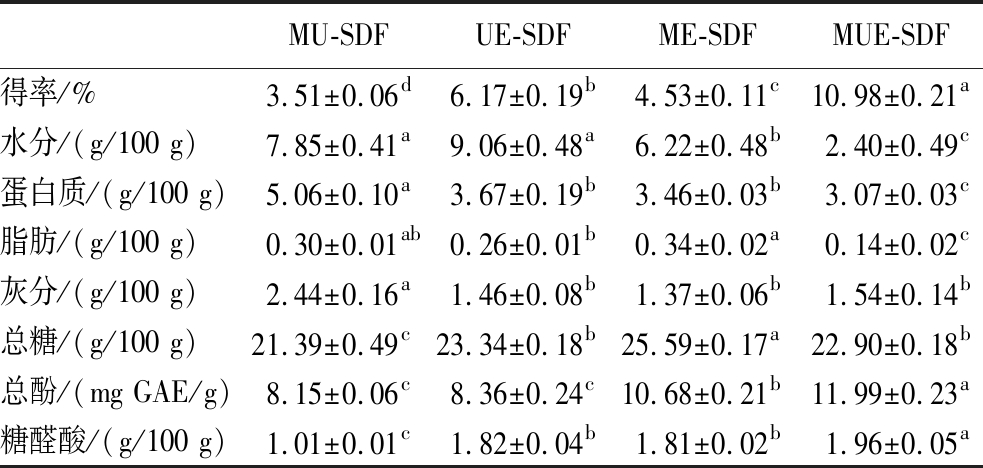
注:同行数据后不同小写字母表示差异显著(P<0.05)。
MU-SDFUE-SDFME-SDFMUE-SDF得率/%3.51±0.06d6.17±0.19b4.53±0.11c10.98±0.21a水分/(g/100 g)7.85±0.41a9.06±0.48a6.22±0.48b2.40±0.49c蛋白质/(g/100 g)5.06±0.10a3.67±0.19b3.46±0.03b3.07±0.03c脂肪/(g/100 g)0.30±0.01ab0.26±0.01b0.34±0.02a0.14±0.02c灰分/(g/100 g)2.44±0.16a1.46±0.08b1.37±0.06b1.54±0.14b总糖/(g/100 g)21.39±0.49c23.34±0.18b25.59±0.17a22.90±0.18b总酚/(mg GAE/g)8.15±0.06c8.36±0.24c10.68±0.21b11.99±0.23a糖醛酸/(g/100 g)1.01±0.01c1.82±0.04b1.81±0.02b1.96±0.05a
表2 SDF的理化性质
Table 2 Physicochemical properties of SDF

注:同列数据后不同小写字母表示差异显著(P<0.05)。
组别持水力/(g/g)持油力/(g/g)膨胀力/(mL/g)溶解率/%MU-SDF0.54±0.04c1.20±0.21b5.39±0.55d79.73±1.36bcUE-SDF0.45±0.05c1.21±0.08b7.62±0.32c78.06±2.26cME-SDF0.71±0.06b1.26±0.05b11.81±0.98b82.60±0.74bMUE-SDF1.39±0.06a3.87±0.20a21.76±1.05a86.69±0.62a
2.1.2 SDF的理化性质
持水力、持油力、膨胀力和溶解率是衡量SDF理化性质的重要指标,数值越大,反映生物活性越好[22]。结果显示,MUE-SDF表现出最高的持水力(1.39 g/g)、持油力(3.87 g/g)、膨胀力(21.76 mL/g)和溶解率(86.69%),这可能是酶法处理导致MUE-SDF的结构相对疏松,使其比表面积增大,暴露更多亲水基团,从而使膨胀体积更大,显著提高持水力、膨胀力和溶解率[23]。此外,因其复杂的多孔结构而暴露更多官能团,导致油更容易被吸附到SDF中,使MUE-SDF的持油力最高[24]。
2.2 制备方法对SDF结构的影响
2.2.1 SDF的红外光谱分析
利用红外光谱对4种SDF的化学结构进行了分析。如图1所示,4种SDF具有相似的傅里叶变换红外光谱图,仅吸收强度略有差异,在400~4 000 cm-1内呈现典型的多糖吸收峰。在3 420 cm-1附近观察到由纤维素和半纤维中的—OH伸缩振动产生的吸收峰,相较于MU-SDF,其余3种SDF的峰均有增强,表明联合酶法处理会使纤维素和半纤维素降解暴露出—OH,有利于提高其水合性[25-26]。2 940 cm-1附近的吸收峰是甲基或亚甲基上的C—H伸缩振动所致,是多糖类物质典型特征吸收峰[27]。1 636 cm-1处的吸收峰归因于离子羧基的C![]() O的伸缩振动,表明4种SDF中含有糖醛酸,可能属于酸性多糖[28]。1 405、1 322 cm-1(1 200~1 500 cm-1)处的峰与C—H的变角振动有关[25]。1 078 cm-1附近的吸收峰由纤维素和半纤维素C—O—C 中C—O的伸缩振动产生,表明SDF中可能存在阿拉伯糖和木聚糖[29]。880 cm-1附近出现的小峰与β-糖苷键中的β-CH弯曲振动有关,说明4种SDF中糖苷键以β-构型为主[15]。
O的伸缩振动,表明4种SDF中含有糖醛酸,可能属于酸性多糖[28]。1 405、1 322 cm-1(1 200~1 500 cm-1)处的峰与C—H的变角振动有关[25]。1 078 cm-1附近的吸收峰由纤维素和半纤维素C—O—C 中C—O的伸缩振动产生,表明SDF中可能存在阿拉伯糖和木聚糖[29]。880 cm-1附近出现的小峰与β-糖苷键中的β-CH弯曲振动有关,说明4种SDF中糖苷键以β-构型为主[15]。
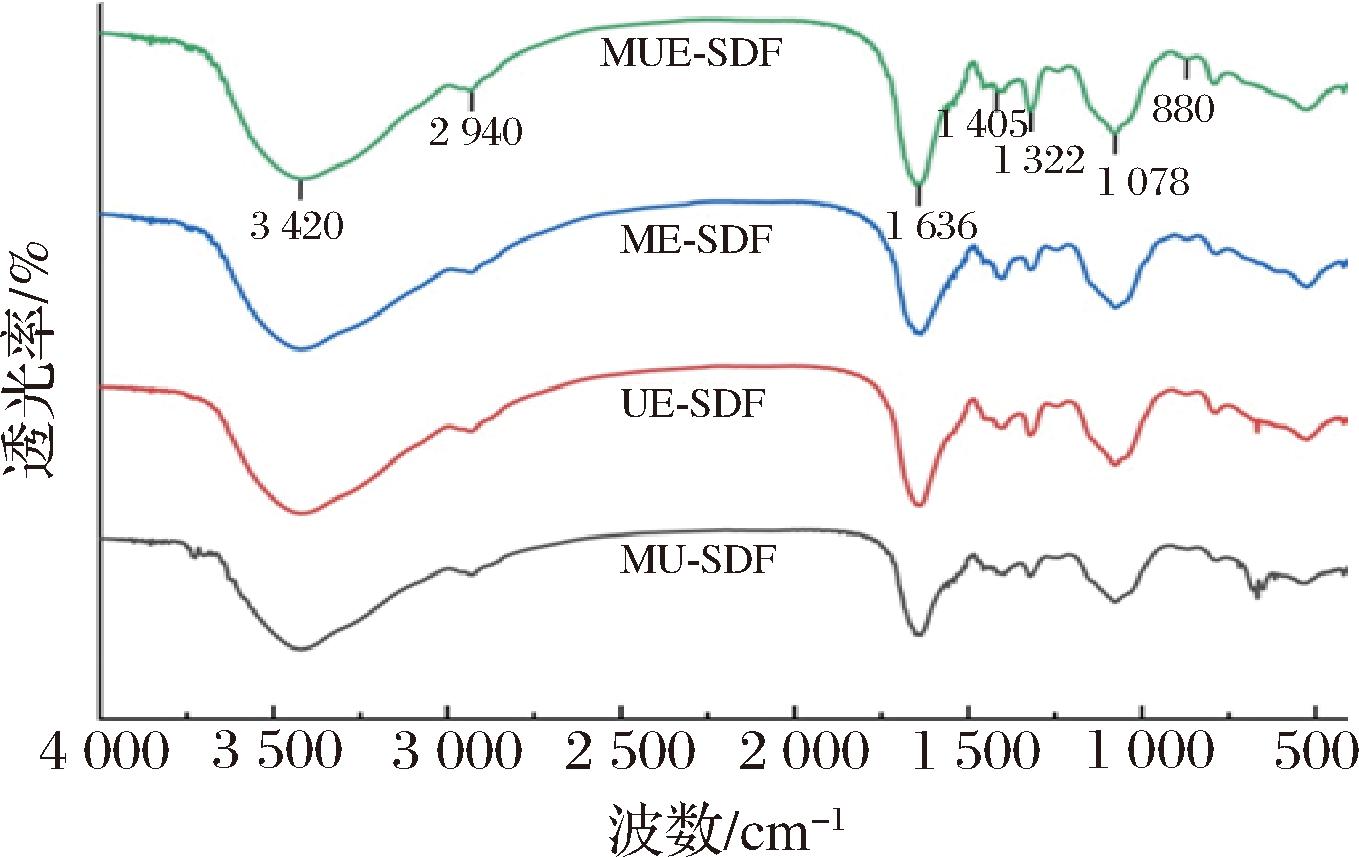
图1 不同方法制备的SDF的红外光谱图
Fig.1 Infrared spectra of SDF prepared by different methods
2.2.2 SDF的晶体结构分析
X-射线衍射峰形反映晶体类型,峰强度表示结晶度,结晶度越高,其结构越紧密,耐热性、强度等性能越好。如图2所示,4种SDF在5°~50°的2θ处的X射线衍射谱相似,都有一个宽峰,MU-SDF、UE-SDF、ME-SDF、MUE-SDF分别出现在2θ=21.91°、22.36°、23.80°、24.71°处,无明显差异。这表明酶法及多种联合方法处理不会改变SDF的晶型,均为纤维素Ⅰ型晶体结构,且结晶区和非结晶区共存,这与DU等[30]的发现一致。4种SDF的峰高及峰面积有所不同,反映峰强度有所差异,相较于MU-SDF(33.48%),其他3种SDF的结晶度均有下降,这可能是由于酶法处理,导致纤维素降解,破坏更多结晶区,增加非结晶的比例,从而使其结晶度降低。此外,MUE-SDF的结晶度最低,说明多种联合方法处理可以降低分子聚合度,使结晶区从有序状态变为无序状态,呈现非结晶区的特征,让其结构更松散,这有助于提高SDF的持水力、持油力等功能性质[8]。
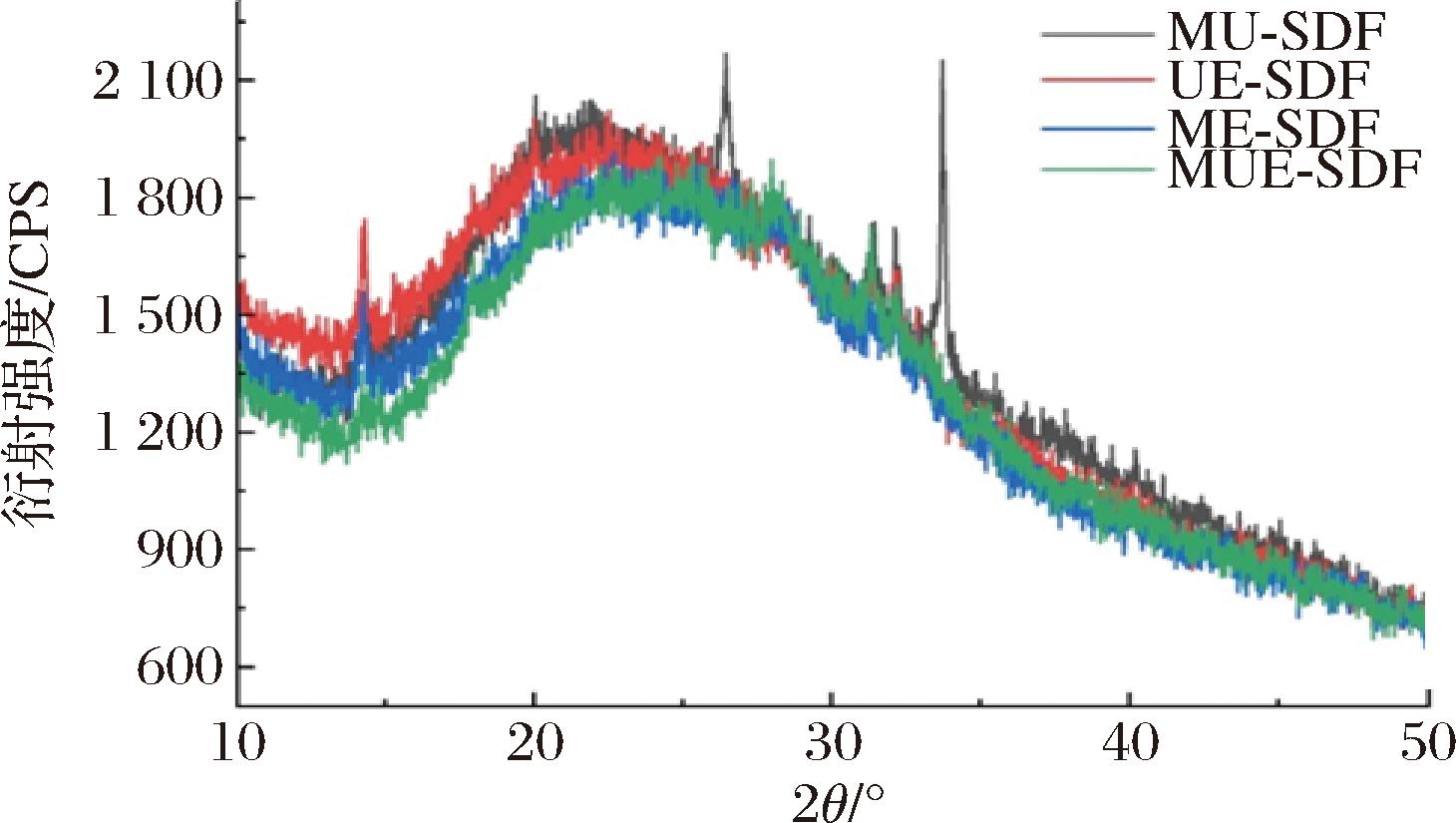
图2 不同方法制备的SDF的X-射线衍射图
Fig.2 X-ray diffraction patterns of SDF prepared by different methods
2.2.3 SDF的微观结构分析
样品在电子显微镜的形态特性如图3所示,4种SDF的形态结构相似,呈蜂窝结构,由不均匀堆积的颗粒组成,但在颗粒大小、致密程度上有所差异。MU-SDF因超声波强烈的空化和剪切力及微波的热效应破坏了SDF分子间的交联,形成了致密的蜂窝结构,孔隙较小[31-32]。然而UE-SDF和ME-SDF 在纤维素酶的处理下进一步破坏了膳食纤维的结构,形成了许多孔洞。与UE-SDF相比,ME-SDF 表面孔隙更多,这说明不同物理方法结合酶法制备的SDF具有差异,这可能是由于微波的能量和超声波的机械作用使细胞破裂程度不一致所导致。其中,MUE-SDF经超声波、微波和酶的多重处理,组织间断裂,内部结构更为裸露,气孔增多,导致结构疏松,这有利于增加基团的暴露,影响吸附性。因此,不同方法制备SDF可能会改变其结构进而影响功能性质。

A-MU-SDF;B-UE-SDF;C-ME-SDF;D-MUE-SDF
图3 不同方法制备的SDF的扫描电镜图
Fig.3 Scanning electron microscopy of SDF prepared by different methods
注:图3-A~图3-D分别为MU-SDF、UE-SDF、ME-SDF、MUE-SDF在20.00kx下的结果。
2.2.4 SDF的热重分析
为了解SDF在食品加工中的热稳定性,分析了4种SDF的热重。图4显示,4种方法制备的SDF的质量变化主要发生在3个阶段(50~135、135~450、450~600 ℃),均具有显著性变化,并表现出相似的变化趋势,但失重率在3个阶段内有所不同。在第1阶段(30~135 ℃),4个样品的质量均略有损失,约为5%,这是由样品中水的蒸发引起。在第2个阶段(135~450 ℃),所有样品表现出快速的质量损失,约50%,这可能与碳水化合物的热分解相关。当温度上升到最后1个阶段(450~600 ℃)时,质量损失因焦炭的热分解而减缓。在600 ℃时,MUE-SDF(38.86%)的残留质量显著低于MU-SDF(42.03%)、UE-SDF(41.16%)、ME-SDF(41.56%)(P<0.05),表明多种方法联合制备会导致SDF的热稳定性降低,这与TANG等[31]的研究结果相似,这可能与其低结晶度有关,结晶度越低,则分解SDF的晶体结构时所需能量更少,从而导致热稳定性越低,但会因其低结晶度使SDF结构稀疏,有利于化合物的吸附。
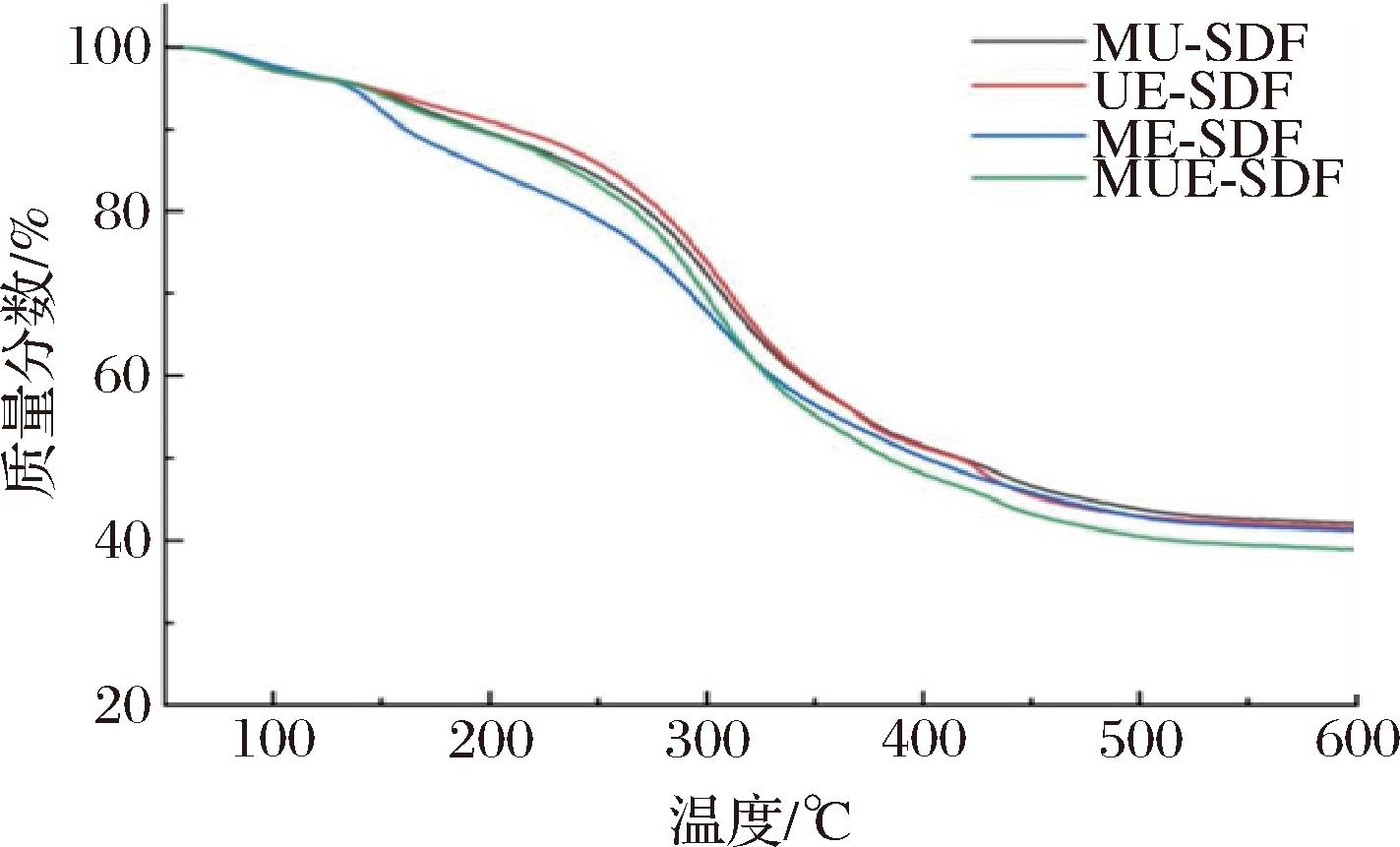
图4 不同方法制备的SDF的热特性
Fig.4 Thermal properties of SDF prepared by different methods
2.3 制备方法对SDF体外功能的影响
2.3.1 制备方法对SDF体外降血糖的影响
抑制α-淀粉酶和α-葡萄糖苷酶活性可延长碳水化合物消化时间,降低葡萄糖在肠道中的生成速率,控制血糖水平。由图5可知,4种SDF对α-淀粉酶和α-葡萄糖苷酶有抑制作用,经计算,IC50值分别为1.96~6.62 mg/mL、0.001~1.075 mg/mL。当SDF质量浓度为2.0 mg/mL时,MUE-SDF对2种酶的抑制效果最佳。这可能与高含量的酚类物质相关,化合物的氢键和疏水相互作用时,改变酶的构象,抑制了活性,与表1结果一致[25-26]。同时,膳食纤维可与酶结合形成酶-膳食纤维-底物复合物,使膳食纤维在该复合物中作为α-淀粉酶的活性抑制剂,且高膨胀力、持水力、多孔形态的SDF可增加胃肠道黏液的黏度,降低流动性,将底物与酶包裹在纤维结构中,减少接触,从而提高SDF对酶的抑制能力[33-34]。此外,相关研究称,α-葡萄糖苷酶抑制作用与SDF相对分子质量、酯化度、高含量的糖醛酸、底物电荷也有关,与酯化度成正相关,低分子质量的样品会增加与酶活性位点的接触,电荷越多,越易与其形成大分子络合物,导致酶活性被阻断,提高抑制率[35-36]。因此,物理法联合生物法制备的SDF具有更好的降血糖能力。
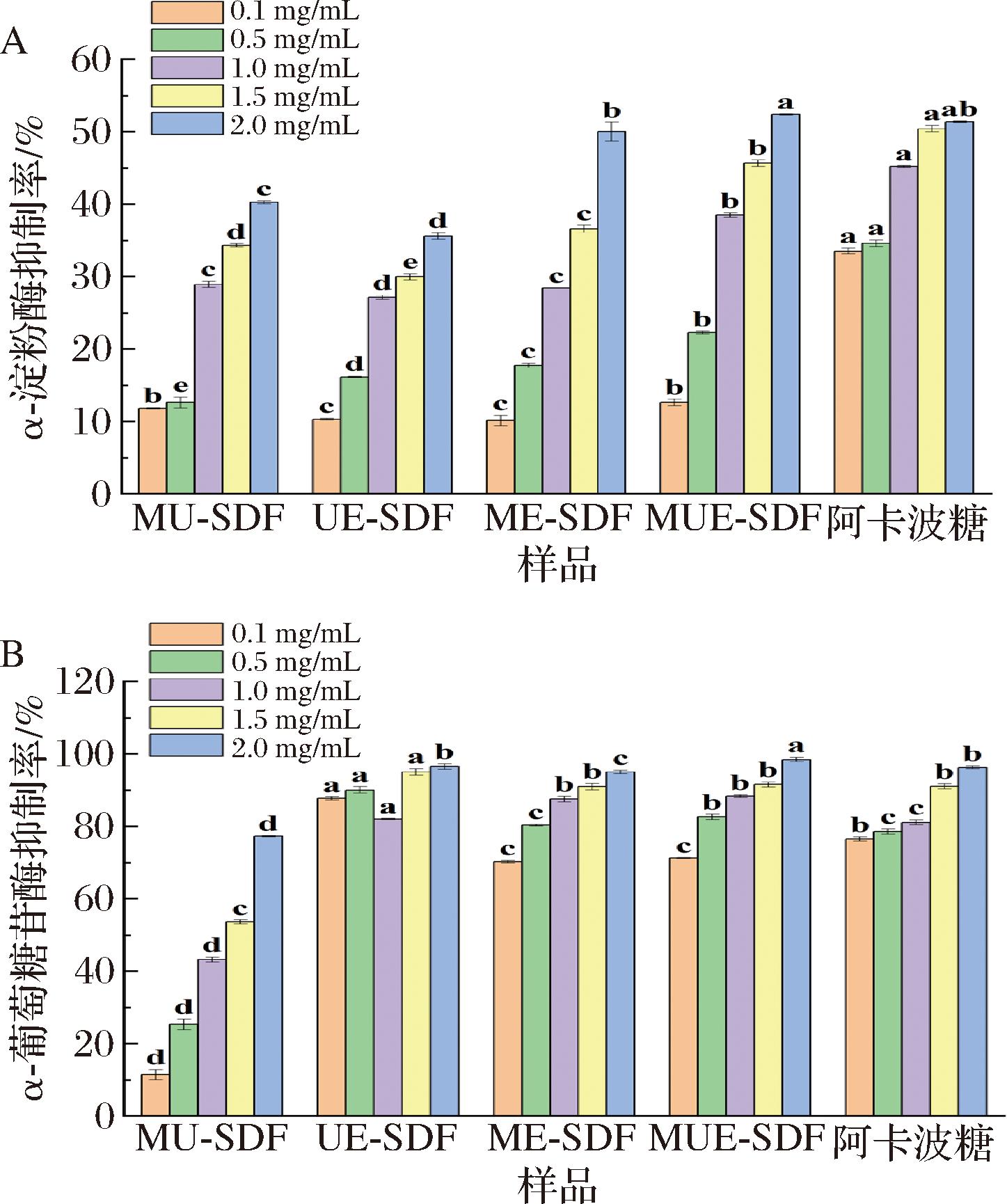
A-α-淀粉酶抑制率;B-α-葡萄糖苷酶抑制率
图5 不同制备方法对SDF体外降血糖的影响
Fig.5 Effect of different preparation methods on in vitro hypoglycemia of SDF
注:相同浓度下不同样品间的不同小写字母表示差异显著(P<0.05)(下同)。
2.3.2 制备方法对SDF体外降脂能力的影响
2.3.2.1 SDF对胆固醇吸附能力和胰脂肪酶抑制率的影响
胆固醇吸附能力和胰脂肪酶抑制能力可减少胆固醇、脂质沉积,降低血脂水平,是评价材料体外降血脂能力的重要指标。如图6-A所示,MU-SDF、UE-SDF、ME-SDF、MUE-SDF在pH=7时的吸附量分别是pH=2 时的2.8倍、1.6倍、3.4倍、2.3倍,这表明SDF在肠道环境下对胆固醇的吸附效果更好。这是由于胆固醇和SDF所带的部分正电荷与酸性环境中的氢离子相互排斥,导致吸附力减弱。当体系变为中性环境后,SDF中的羧基解离,转化为羧基阴离子与胆固醇结合,进而提高了SDF对胆固醇的吸附能力[13]。如图6-B所示,4种SDF对胰脂肪酶均有抑制作用,进而根据浓度与抑制率之间的关系,推算出4种SDF对胰脂肪酶抑制率的IC50值分别为4.40 mg/mL (MU-SDF)、3.21 mg/mL(UE-SDF)、1.80 mg/mL(ME-SDF)、0.87 mg/mL(MUE-SDF),IC50值越小,则抑制能力越强,即4种SDF对胰脂肪酶的抑制的强弱为:MUE-SDF>ME-SDF>UE-SDF>MU-SDF,这表明联合酶法处理提高了SDF对胰脂肪酶的抑制能力。其中,MUE-SDF对胆固醇的吸附量和胰脂肪酶抑制率均显著高于其他3种SDF(P<0.05),这可能与微观结构有关,3种方法联合处理使SDF的无定型区域增多,结构疏松,表面孔隙变大,粗糙的蜂窝状结构能吸附更多脂肪和胆固醇,同时暴露出更多活性基团与胆固醇结合,酶抑制基团阻碍酶与脂肪反应,SDF的疏水基团与胰脂肪酶形成结合位点,减少与脂肪的接触,从而达到降血脂的目的。此外,高持水力和膨胀力使SDF形成凝胶状,结合胆固醇,减少了胆固醇的吸收[30]。因此,具有高水合性、结构疏松的MUE-SDF对胆固醇的吸附能力和胰脂肪酶抑制能力更强。

A-胆固醇吸附量;B-胰脂肪酶抑制率
图6 不同方法制备的SDF对胆固醇的吸附能力和胰脂肪酶的抑制能力
Fig.6 Adsorption capacity of cholesterol and inhibition of pancreatic lipase of SDF prepared by different methods
2.3.2.2 SDF对胆酸盐结合力的影响
胆汁酸通常以胆盐的形式贮存在胆囊中,样品结合胆酸盐的能力越强,则将胆固醇转化为胆汁酸的速度越快,降胆固醇的效果越好,降血脂活性越强。如图7所示,4种SDF对牛磺胆酸钠和甘胆酸钠的结合率随着浓度的增加而增大,其范围分别为39.99%~56.89%、28.11%~34.05%,由此范围可推算出不同样品的IC50值,其中MUE-SDF在所有样品中对牛磺胆酸钠和甘胆酸钠的结合率的IC50值均最低,分别为1.99 mg/mL和10.92 mg/mL,这表明MUE-SDF对牛磺胆酸钠的结合率显著高于对甘胆酸钠的结合率(P<0.05),与周世林[37]的结论相同,主要是由于牛磺胆酸钠的磺酸基酸性强于甘胆酸钠的羧基酸性,更易离子化,增加了结合力,使降血脂效果显著。同时,酶法联合超声或微波制备的SDF对2种胆酸盐的结合率均低于仅物理法制备的SDF,这可能是因为笋头经酶解后,破坏了SDF的成分,降低了结合率。而MUE-SDF对胆酸盐的结合能力最强,可能是因为多种方法联合处理后,更为松散的蜂窝状结构有利于束缚胆酸盐。此外,总糖含量和单糖组成也是影响胆酸盐结合率的重要因素[38]。因此,不同方法制备的SDF在体外均具有良好的降血脂活性。

A-牛黄胆酸钠结合率;B-甘胆酸钠结合率
图7 不同方法制备的SDF的胆酸盐结合能力
Fig.7 Cholate binding capacity of SDF prepared by different methods
3 结论
MU-SDF、UE-SDF、ME-SDF、MUE-SDF 4种方法制备的SDF均为纤维素Ⅰ型晶体结构,糖苷键以β-构型为主,适合在180 ℃以下加工。MUE-SDF制备的SDF含量显著增加,形成更多的孔洞和更疏松的形态结构,MUE-SDF的持水力、持油力、膨胀力和溶解性,对胆固醇、胆酸盐的吸附能力均最高,对α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶具有较强的抑制活性,其物理和功能性质较其他SDF存在显著优势,表明物理法联合生物法是制备SDF的有效方法,可为高节竹笋头SDF的开发利用提供理论依据。
[1] 徐小博, 徐萍, 岳永德, 等.高节竹竹叶次生代谢产物和土壤微生物的季节变化及其相关性[J].东北林业大学学报, 2020, 48(9):101-106.XU X B, XU P, YUE Y D, et al.Seasonal changes and correlation of secondary metabolites in bamboo leaves of Phyllostachys prominens and soil microorganisms[J].Journal of Northeast Forestry University, 2020, 48(9):101-106.
[2] 徐小博, 王选年, 徐萍, 等.不同产地高节竹竹叶次生代谢物与土壤微生物的关系分析[J].西南林业大学学报(自然科学), 2021, 41(4):18-24.XU X B, WANG X N, XU P, et al.Secondary metabolites of bamboo leaves from phyllostachys prominens and their relationship with soil microorganism in different producing areas[J].Journal of Southwest Forestry University(Natural Sciences), 2021, 41(4):18-24.
[3] 黄真. 忠县竹产业发展现状及对策研究[D].重庆:重庆三峡学院, 2021.HUANG Z.Research on the development status and countermeasures of bamboo industry in Zhongxian County [D].Chongqing:Chongqing Three Gorges University, 2021.
[4] 时俊帅, 章超, 陈双林, 等.高节竹笋出土后外观,营养和食味品质的时序变化[J].林业科学研究, 2019, 32(6):137-143.SHI J S, ZHANG C, CHEN S L, et al.Temporal variation of appearance, nutrition and eating quality of Phyllostachys prominens shoots after unearthed[J].Forest Research, 2019, 32(6):137-143.
[5] 张杰, 郭仁聪, 吴良如, 等.竹笋膳食纤维应用研究进展[J].食品与发酵工业, 2024,50(18):384-390.ZHANG J, GUO R C, WU L R, et al.Research progress of bamboo shoots dietary fiber and its application[J].Food and Fermentation Industries, 2024,50(18):384-390.
[6] 汤娇娇, 李珂, 张智鑫, 等.竹笋加工副产物功能成分研究进展[J].食品与机械, 2021, 37(7):233-240.TANG J J, LI K, ZHANG Z X, et al.Progress on utilization of bamboo shoot by-products and functional components[J].Food &Machinery, 2021, 37(7):233-240.
[7] PARK E J, JHON D Y.The antioxidant, angiotensin converting enzyme inhibition activity, and phenolic compounds of bamboo shoot extracts[J].LWT-Food Science and Technology, 2010, 43(4):655-659.
[8] YANG M, WU L R, CAO C J, et al.Extrusion improved the physical and chemical properties of dietary fibre from bamboo shoot by-products[J].International Journal of Food Science &Technology, 2021, 56(2):847-856.
[9] WU L, TANG C H, CHEN L L, et al.Modified dietary fiber from soybean dregs by fermentation alleviated constipation in mice[J].Food Chemistry:X, 2023, 19:100810.[10] ZOU X Q, XU X L, CHAO Z H, et al.Properties of plant-derived soluble dietary fibers for fiber-enriched foods:A comparative evaluation[J].International Journal of Biological Macromolecules, 2022, 223:1196-1207.
[11] MASSA M, COMPARI C, FISICARO E.On the mechanism of the cholesterol lowering ability of soluble dietary fibers:Interaction of some bile salts with pectin, alginate, and chitosan studied by isothermal titration calorimetry[J].Frontiers in Nutrition, 2022, 9:968847.
[12] HUWILER V V, SCHÖNENBERGER K A, SEGESSER VON BRUNEGG A, et al.Prolonged isolated soluble dietary fibre supplementation in overweight and obese patients:A systematic review with meta-analysis of randomised controlled trials[J].Nutrients, 2022, 14(13):2627.
[13] PENG F, REN X, DU B, et al.Structure, physicochemical property, and functional activity of dietary fiber obtained from pear fruit pomace (Pyrus ussuriensis maxim) via different extraction methods[J].Foods, 2022, 11(14):2161.
[14] LI S, HU N N, ZHU J Y, et al.Influence of modification methods on physicochemical and structural properties of soluble dietary fiber from corn bran[J].Food Chemistry:X, 2022, 14:100298.
[15] XIONG M, FENG M, CHEN Y L, et al.Comparison on structure, properties and functions of pomegranate peel soluble dietary fiber extracted by different methods[J].Food Chemistry:X, 2023, 19:100827.
[16] CHEN H, XIONG M, BAI T M, et al.Comparative study on the structure, physicochemical, and functional properties of dietary fiber extracts from quinoa and wheat[J].LWT, 2021, 149:111816.
[17] LI B, YANG W, NIE Y Y, et al.Effect of steam explosion on dietary fiber, polysaccharide, protein and physicochemical properties of okara[J].Food Hydrocolloids, 2019, 94:48-56.
[18] JIA F J,YANG S F, MA Y Y, et al.Extraction optimization and constipation-relieving activity of dietary fiber from Auricularia polytricha[J].Food Bioscience, 2020, 33:100506.
[19] CHENG L, ZHANG X M, HONG Y, et al.Characterisation of physicochemical and functional properties of soluble dietary fibre from potato pulp obtained by enzyme-assisted extraction[J].International Journal of Biological Macromolecules, 2017, 101:1004-1011.
[20] 陈嘉慧, 吴雪辉.金花茶叶皂苷提取工艺优化及抑制脂肪酶活性研究[J].食品与机械, 2020, 36(8):159-165.CHEN J H, WU X H.Extraction process optimization of saponin from the leaves of Camellia nitidissima Chi and its inhibition of lipase activity[J].Food &Machinery, 2020, 36(8):159-165.
[21] 万仁口, 贺杨正, 李功景, 等.酶解制备竹笋可溶性膳食纤维及其抗氧化活性研究[J].中国食品学报, 2021, 21(3):153-160.WAN R K, HE Y Z, LI G J, et al.Preparation and antioxidant activity of bamboo shoot soluble dietary fiber extracted by enzyme method[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):153-160.
[22] ALFREDO V O, GABRIEL R R, LUIS C G, et al.Physicochemical properties of a fibrous fraction from chia (Salvia hispanica L.)[J].LWT-Food Science and Technology, 2009, 42(1):168-173.
[23] 汪楠, 黄山, 张月, 等.高温蒸煮协同纤维素酶改性竹笋膳食纤维[J].食品与发酵工业, 2020, 46(4):13-18.WANG N, HUANG S, ZHANG Y, et al.Modification of bamboo shoot dietary fiber by high temperature cooking combined with cellulase[J].Food and Fermentation Industries, 2020, 46(4):13-18.
[24] JIA M Y, CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloids, 2019, 94:468-474.
[25] WANG C R, LIN M F, LI Y B, et al.Improvement of soluble dietary fiber quality in Tremella fuciformis stem by steam explosion technology:An evaluation of structure and function[J].Food Chemistry, 2024, 437:137867.
[26] YUAN Q, HE Y, XIANG P Y, et al.Influences of different drying methods on the structural characteristics and multiple bioactivities of polysaccharides from okra (Abelmoschus esculentus)[J].International Journal of Biological Macromolecules, 2020, 147:1053-1063.
[27] 王雅怡, 付晓康, 贺便, 等.不同处理方法对洋蓟膳食纤维结构及理化性质的影响[J].食品工业科技, 2022, 43(22):83-89.WANG Y Y, FU X K, HE B, et al.Effects of different treatments on the structure and physicochemical properties of artichoke dietary fiber[J].Science and Technology of Food Industry, 2022, 43(22):83-89.
[28] HU Y C, HU J L, LI J, et al.Physicochemical characteristics and biological activities of soluble dietary fibers isolated from the leaves of different quinoa cultivars[J].Food Research International, 2023, 163:112166.
[29] CHEN H S, HE S D, SUN H J, et al.A comparative study on extraction and physicochemical properties of soluble dietary fiber from glutinous rice bran using different methods[J].Separations, 2023, 10(2):90.
[30] DU X J, WANG L, HUANG X, et al.Effects of different extraction methods on structure and properties of soluble dietary fiber from defatted coconut flour[J].LWT, 2021, 143:111031.
[31] TANG C D, YANG J L, ZHANG F S, et al.Insight into the physicochemical, structural, and in vitro hypoglycemic properties of bamboo shoot dietary fibre:Comparison of physical modification methods[J].International Journal of Food Science &Technology, 2022, 57(8):4998-5010.
[32] MA Q W, YU Y, ZHOU Z K, et al.Effects of different treatments on composition, physicochemical and biological properties of soluble dietary fiber in buckwheat bran[J].Food Bioscience, 2023, 53:102517.
[33] TAN Y Y, LI S X, LI C F, et al.Glucose adsorption and α-amylase activity inhibition mechanism of insoluble dietary fiber:Comparison of structural and microrheological properties of three different modified coconut residue fibers[J].Food Chemistry, 2023, 418:135970.
[34] 李杨, 胡淼, 孙禹凡, 等.提取方式对大豆膳食纤维理化及功能特性的影响[J].食品科学, 2018, 39(21):18-24.LI Y, HU M, SUN Y F, et al.Effect of different extraction methods on physicochemical and functional properties of soybean dietary fiber[J].Food Science, 2018, 39(21):18-24.
[35] WU D T, HE Y, FU M X, et al.Structural characteristics and biological activities of a pectic-polysaccharide from okra affected by ultrasound assisted metal-free Fenton reaction[J].Food Hydrocolloids, 2022, 122:107085.
[36] GUO H, FU M X, ZHAO Y X, et al.The chemical, structural, and biological properties of crude polysaccharides from sweet tea (Lithocarpus litseifolius (Hance) Chun) based on different extraction technologies[J].Foods, 2021, 10(8):1779.
[37] 周世林. 刺梨多糖的提取及其体外降脂活性研究[D].广州:华南理工大学, 2022.ZHOU S L.Extraction and hypolipidemic activity of polysaccharides from Rosa roxburghii Tratt fruit in vitro[D].Guangzhou:South China University of Technology, 2022
[38] YANG Y Q, ZHAO M M, LIN L Z.Effects of extraction methods on structural characteristics and bile acid-binding capacities of Moringa oleifera leaf polysaccharide fractions[J].International Journal of Food Science &Technology, 2020, 55(4):1539-1546.