大曲是白酒生产中必不可少的发酵剂(含有多种粗酶和功能菌群)和主要的原料之一[1-2]。根据控温峰值、生产周期和所需原料的不同可将其分为高温、中温和低温3种主要类型[3]。以小麦为原料,制坯时添加母曲,成型曲坯经约40 d调湿控温发酵及贮存3~6个月[4],形成群落结构、酶组成和香气独特的高温大曲。类似诸多的传统工艺,高温酱香大曲生产迄今依然采用手工操作、自然发酵的作坊式方式。这种生产方式不仅费时费力,且妨碍了机械化及人工智能制造技术的应用,限制了产业的持续发展。最近研究的结果表明,以内、外源功能菌(群)质源,通过扰动技术不仅能有效改善浓香型大曲的品质,且能促进机械化技术的应用。XU等[5]以Bacillus licheniformis(地衣芽孢杆菌)和Bacillus velezensis(贝莱斯芽孢杆菌)构成的合成菌群扰动中温大曲发酵,提高了糖化力和液化力。LI等[6]用产香酵母扰动大曲的发酵,显著提高了己酸乙酯的含量。崔香香等[7]以Eurotium chevalieri(谢瓦散囊菌)扰动大曲发酵,改善了酿造特性,创建了1-辛烯-3-醇和芳樟醇为主的茶香型风味特色大曲生产技术。揭示了传统与架式发酵方式生产的大曲主要理化性质和挥发性成分及含量具有差异[8],架子曲的空间异质性及层次间驱动因子的差异改变了其种属间的互作关系及共现模式[9]。但在高温大曲的相关研究至今鲜见报道。
本研究以高温大曲生产工艺为对象,应用多种检测技术探讨了传统(T)与架式(J)生产工艺及Monascus分离株间扰动生产大曲的理化性质和代谢组分的差异,采用KEGG富集分析,构建了微生物、酶和代谢物的全局代谢网络,解析了其风味调控机理,为改进高温大曲的生产技术提供了理论基础。
1 材料与方法
1.1 材料与试剂
小麦和母曲:四川泸州老窖股份有限公司提供。
微生物菌株:Monascus floridanus-H14、Monascus floridanus-H26和Monascus floridanus-H30,本实验室从高温大曲中分离,鉴定并保藏。
辛酸甲酯和2-氯-L-苯丙氨酸标准品,Sigma-Aldrich公司;其余化学试剂(分析纯),本地化学试剂供应商。
1.2 仪器与设备
DVB/CAR/PDMS固相微萃取头(50/30 μm),美国色谱科公司;Trace 1300-TSQ9000气相色谱-质谱联用仪(GC-MS),美国赛默飞世尔科技公司;1290 infinity Ⅱ-G6546A超高效液相-四级杆高分辨质谱仪(liquid chromatography-quadrupole-time of flight mass spectrometry,LC-Q/TOF-MS),美国安捷伦公司。
1.3 实验方法
1.3.1 红曲霉菌种子麦曲的制备
小麦粉和水以质量比63∶37拌和均匀,浸润30 min,121 ℃湿热灭菌20 min,冷却至40 ℃以下,分别接种活化的3株分离株的孢子3~4环,置于30 ℃培养箱中培养3~5 d,45 ℃下干燥36 h,粉碎备用。
1.3.2 高温大曲的生产
传统制曲方式的生产工艺及过程工艺关键点的控制参考邓皖玉等[10]的方法稍有改进。架式制曲方式则是将曲坯安放在8层曲架上后,其四周及墙壁挂满稻草,通过开门开窗调节发酵过程温度,发酵45 d后转房贮存。扰动曲:分别将3%纯培养麦曲接种到曲坯中,常规曲则是加入6%的优质母曲。
转房时,从各组样品中随机取3块成曲,粉碎并堆积成圆锥型,采用5点取样500 g,分为2份,其中一份置于-20 ℃下保存,用于理化指标和代谢组分的分析,另一份置于-80 ℃保存用于微生物群落结构分析。传统工艺简写为T,其中传统扰动曲简写为H14-T、H26-T和H30-T,传统常规曲简写为ML。类似地,架式工艺简写为J,其中架式扰动曲简写为H14-J、H26-J和H30-J,架式常规曲简写为MJ。
1.3.3 理化性质的测定
水分、酸度、氨基酸态氮、糖化力、液化力、发酵力及酯化力等参数的分析参照QB/T 4257—2011《酿酒大曲通用分析方法》的方法。
1.3.4 大曲代谢组分的测定
挥发性代谢组分的测定:参照ZHENG等[11]的方法,采用顶空-固相微萃取-气相色谱-质谱(headspace solid phase micro extraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)法进行测定。
非挥发性代谢组分的测定:参照MU等[12]的方法,采用LC-Q-TOF/MS法进行测定。
1.3.5 微生物群落数量及结构多样性的检测
菌群总数测定:准确称取5.000 g均匀研磨的曲粉,置于装有15 mL无菌生理盐水及玻珠的50 mL的三角瓶中,充分打散并计数(血球计数),无菌生理盐水10倍梯度稀释,均匀涂布在麦芽汁琼脂培养基平板,30 ℃下培养2~3 d,进行真菌菌落计数;菌悬液80 ℃水浴10 min后,均匀涂布在牛肉膏蛋白胨琼脂培养基平板,在37 ℃下培养1~2 d,计数其耐热细菌菌落数;细菌菌落数的测定同耐热细菌,但菌悬液未进行热水浴处理。
微生物群落结构的测定:参照HE等[13]所述的方法分别提取大曲总DNA、进行PCR扩增和测序。原始测序数据采用QIIME(quantitative insights into microbial ecology)切除序列的引物片段,删除低质量、错误或模糊序列,然后采用DADA2完成序列的质控、去噪、拼接和去除嵌合体处理。得到的序列按100%的序列相似度进行聚类为扩增子序列变体(amplicon sequence variant,ASV)。最后,利用Silva(https://www.arb-silva.de/)和UNITE(https://unite.ut.ee/)数据库分别对16S rRNA和核糖体基因内转录间隔区(ribosomal internal transcribed spacer,ITS)的每个序列进行分类聚为不同的ASV。根据Mothur 1.31.2的结果计算Shannon多样性指数和Chao1丰富度指数。
1.4 数据处理
原始数据采用SPSS 25.0软件进行单因素方差分析,检验其差异显著性,在P<0.05时表示在统计学上有显著性差异;采用Simca 14.1软件对挥发性与非挥发性风味物质进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA);采用Spearman算法构建优势属共现网络(|ρ|>0.60,P<0.05),经Cytoscape可视化;采用KEGG数据库对基因功能进行注释并分析关键代谢通路;采用Origin 2021和TBtools软件绘图。
2 结果与分析
2.1 制曲工艺和分离株扰动对大曲理化性质的影响
如表1所示,制曲工艺显著影响了大曲的理化性质。类似赵巧珍等[8]报道的结果,同传统常规曲ML比,架式工艺(MJ)显著提高了其淀粉的水解能力(糖化力和液化力)、发酵力和氨基酸态氮含量,但降低了酯化力和酸度。除H26外,其余分离株扰动大曲发酵,2种工艺间的理化性质差异与常规曲类似,但酸度和氨基酸态氮的含量略有波动,不同菌株扰动大曲理化性质的贡献差异显著。同常规曲相比,分离株H30使传统工艺大曲糖化力、液化力、发酵力和酯化力分别提高了2.02、3.67、2.25和0.24倍,使架式工艺大曲的则分别提高了0.33、1.00、5.50和2.50倍。分离株H14则使传统工艺大曲的液化力和发酵力分别提高了0.67和7.25倍,使架式工艺大曲的发酵力提高了6.25倍,但降低了糖化力和液化力。分离株H26使传统工艺大曲液化力提高了6.00倍,且使传统工艺和架式工艺的发酵力分别提高了1.50倍和4.38倍。
表1 不同大曲间理化性质的差异
Table 1 Difference of physicochemical property among different Daqu

注:同一列的不同字母表示差异显著(P<0.05)。
大曲编号水分/[g/(100 g)]糖化力/[mg/(g · h)]液化力/[g/(g · h)]发酵力/[g/(0.5 g · 72 h)]酯化力/[mg/(50 g · 7 d)]酸度/(mmol/10 g)氨基酸态氮/(g/kg)H14-J9.80±0.38d96.68±0.66f0.12±0.00e0.58±0.00a80.06±4.30g1.58±0.01c4.20±0.00fH26-J10.06±0.41d128.79±0.50d0.20±0.00c0.43±0.00c96.62±2.40f1.61±0.01b5.10±0.01bH30-J13.47±0.31c214.87±0.69a0.28±0.00a0.52±0.01b265.66±4.03e1.26±0.01f3.56±0.01hMJ19.32±0.09a161.23±0.97b0.14±0.00d0.08±0.01g76.60±2.30h0.85±0.02g5.54±0.01aH14-T10.02±0.08d75.75±0.44g0.05±0.00f0.33±0.01d410.80±1.99d1.54±0.01d4.47±0.01eH26-T16.00±0.09b153.34±1.77c0.21±0.00b0.10±0.00f429.41±1.58c1.53±0.01d4.99±0.02cH30-T9.08±0.26e99.07±1.00e0.14±0.00d0.13±0.00e690.13±1.93a1.65±0.01a4.64±0.01dML9.64±0.31d32.76±0.66h0.03±0.00g0.04±0.00h557.02±5.14b1.31±0.01e4.05±0.01g
2.2 制曲工艺和分离株扰动对大曲代谢组分轮廓的影响
2.2.1 挥发性代谢组分差异
这些样品共检出了56种挥发性成分,包括酯(23种)、醇(6种)、酸(3种)、醛(5种)、吡嗪(3种)和其他化合物(16种)等六类组分。如图1-A和图1-B所示,制曲工艺显著影响了挥发性成分的含量及组成轮廓。传统工艺大曲的总挥发性成分的含量都高于对应架式工艺的,其中常规曲提高17.87%,扰动曲H14、H26和H30的分别提高49.32%、63.13%和63.81%。传统工艺曲中的酯类成分含量显著高于架式工艺的,后者则是醇类成分含量显著增高。两种工艺大曲组间共享21种不同的成分,传统工艺和架式工艺分别独有的成分有23和12种(图1-E),而组内共享的成分为12和9种,且分离株H14、H26和H30扰动曲独有成分分别是1、7和5种及1、3和7种,常规曲独有的为2和5种(图1-F)。

A-挥发性组分含量;B-总挥发性组分含量;C-PLS-DA;D-特征挥发性组分;E-传统曲与架式曲的韦恩图;F-不同工艺扰动曲与常规曲的韦恩图
图1 不同大曲各类挥发性组分含量、总挥发性组分含量、PLS-DA、特征挥发性组分、传统曲与架式曲的韦恩图、不同工艺扰动曲与常规曲的韦恩图
Fig.1 Contents of volatile components in different Daqu, total volatile components, PLS-DA and characteristic volatile components,Venn diagram of traditional Daqu and shelf Daqu, and Venn diagram of enhanced Daqu and ordinary Daqu
注:图E和 F中T表示传统曲、J表示架式曲,H14、H26和H30表示扰动曲、M表示常规曲。
发酵方式也显著影响分离株对其挥发性成分含量的贡献。分离株H14、H26和H30在传统工艺中使酯类组分含量较相应的常规曲提高了473.48%、88.91%和131.34%,在架式工艺中则使醇类组分含量分别提高了74.59%、107.85%和33.54%,降低了酯和醛类组分的含量。
PLS-DA解析其挥发性成分差异的结果如图1-C所示。传统工艺和架式工艺大曲分别位于PLS1的负半轴和正半轴,且传统工艺的H26曲则单独位于第Ⅳ象限。基于变量投影重要度(variable importance in projection,VIP)>1.0,筛选了21种差异成分(图1-D),包括苯乙醇、2,3,5,6-四甲基吡嗪、棕榈酸甲酯、亚油酸甲酯、异戊醛、2-甲基丁酸甲酯和十二烷等,都是曾报道的高温大曲的重要香气成分[14-16]。赋予玫瑰花香的苯乙醇在架式工艺的增量显著高于传统工艺的,赋予烘焙香的2,3,5,6-四甲基吡嗪的含量则是在传统工艺曲的含量高于对应架式工艺扰动曲的。H26在2种制曲工艺的贡献显著不同,在架式工艺是使苯乙醇含量达0.72 mg/kg,而在传统工艺是使2,3,5,6-四甲基吡嗪的含量达0.38 mg/kg。
2.2.2 非挥发性代谢组分差异
这些大曲中共检测了322种可靠的非挥发性成分,正离子模式68种,负离子模式254种,根据其化学结构特征,分别是有机酸及衍生物(112)、氨基酸及衍生物(33)、小分子肽(73)、碳水化合物(26)、杂环化合物(49)、生物碱(14)、胺(12)和核苷酸(3)等8类组分。有机酸和氨基酸及其衍生物是优势组分,含量的比例>55.00%。类似挥发性代谢成分的结果,传统工艺大曲总非挥发性物质的含量显著高于架式工艺的,主要是有机酸及其衍生物的贡献(图2-A)。

A-非挥发性组分含量;B-PLS-DA负极;C-PLS-DA正极;D-特征非挥发性组分
图2 不同大曲各非挥发性组分含量、PLS-DA(负极~正极)、特征非挥发性组分
Fig.2 Contents of nonvolatile components in different Daqu, PLS-DA (negative and positive electrode), and characteristic nonvolatile components
功能菌株扰动因提高了氨基酸及其衍生物、碳水化合物和杂环化合物等的含量,使其总含量亦显著高于常规曲。同样地,较常规曲的增量,因培养方式和菌株不同而异,H26使传统工艺曲的总非挥发性物质含量提高了20.74%,含量达1 062.45 mg/kg,在架式工艺中显著提高了氨基酸及其衍生物的含量,使其达242.26 mg/kg。H30则使架式工艺曲的总非挥发性物质含量仅略增,在传统工艺中则是有机酸及衍生物高达521.58 mg/kg。有机酸和氨基酸是合成酯和吡嗪类的前体物,有益呈风味成分含量的提高[17-18]。
PLS-DA解析正离子和负离子模式下大曲的非挥发性成分的结果如图2-B和图2-C所示。基于VIP>1.0分别从2种模式下筛选到67种和16种差异代谢物(图2-D),揭示了非挥发成分组成轮廓的差异。传统工艺主要富集有机酸及其衍生物,功能菌的作用提高氨基酸及其衍生物的含量,尤其是H14和H26分别在架式和传统工艺的贡献尤为突出。
2.3 可培微生物及群落多样性的差异
2.3.1 可培微生物
如表2所示,在常规曲中,ML细菌总数较MJ的高2.19倍,而耐热细菌和真菌总数分别减少了3.79和4.20倍。在扰动曲中,M.floridanus的作用因培养方式不同而异,传统工艺中的H14、H30和H26分别较对应架式工艺的细菌和真菌总数高30.42和1.93倍、89.14和5.65倍及1.97和7.12倍,耐热细菌则分别高9.23、28.79和1.75倍。此外,分离株扰动作用在传统工艺中更为明显,其中H26分别使细菌和真菌总数分别较常规曲的提高了8.55和13.45倍,且耐热细菌数提高了99.86倍,而H14和H30则使细菌和耐热细菌数量分别提高了8.75和48.09倍及22.62和75.34倍。
表2 不同大曲可培微生物计数
Table 2 Counts of culturable microorganisms in different Daqu

大曲编号细菌/(CFU/g)耐热细菌/(CFU/g)真菌/(CFU/g)H14-J(6.27±0.29)×105(4.44±0.17)×105(1.44±0.11)×104H26-J(6.49±0.14)×106(3.24±0.79)×106(3.56±0.63)×104H30-J(5.07±0.20)×105(2.36±0.23)×105(2.00±0.54)×103MJ(6.33±0.25)×105(4.47±0.14)×105(1.04±0.08)×105H14-T(1.97±0.02)×107(4.58±0.07)×106(4.22±0.63)×105H26-T(1.93±0.05)×107(9.41±0.51)×106(2.89±0.63)×105H30-T(4.57±0.08)×107(7.03±0.26)×106(1.33±0.00)×104ML(2.02±0.10)×106(9.33±0.22)×104(2.00±0.05)×104
2.3.2 群落的α和β多样性的差异
如表3所示,架式工艺显著提高了常规曲的群落α多样性。分离株的作用则因培养方式不同而异,传统工艺中扰动曲的群落α多样性较常规曲增高,但H30仅使真菌的增高,而大部分架式工艺大曲的减少,且除H14外,其α多样性都低于MJ的。
表3 群落α多样性的差异
Table 3 Effects of bioaugmentation on microbial α-diversity of Daqu
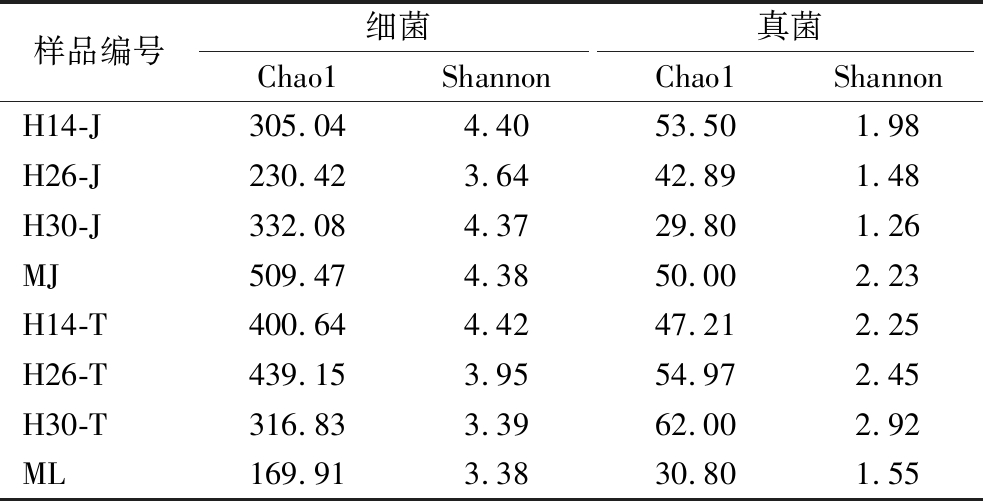
样品编号细菌真菌Chao1ShannonChao1ShannonH14-J305.044.4053.501.98H26-J230.423.6442.891.48H30-J332.084.3729.801.26MJ509.474.3850.002.23H14-T400.644.4247.212.25H26-T439.153.9554.972.45H30-T316.833.3962.002.92ML169.913.3830.801.55
基于Bray-Curtis距离矩阵的PCoA分析结果如图3所示。群落都分为传统工艺和架式工艺2个组,其中架式工艺显著影响功能菌对群落的贡献,扰动曲的都远离MJ的结构,但扰动曲之间的距离较近。而传统工艺扰动曲中的群落结构都远离ML曲,且都较分散。
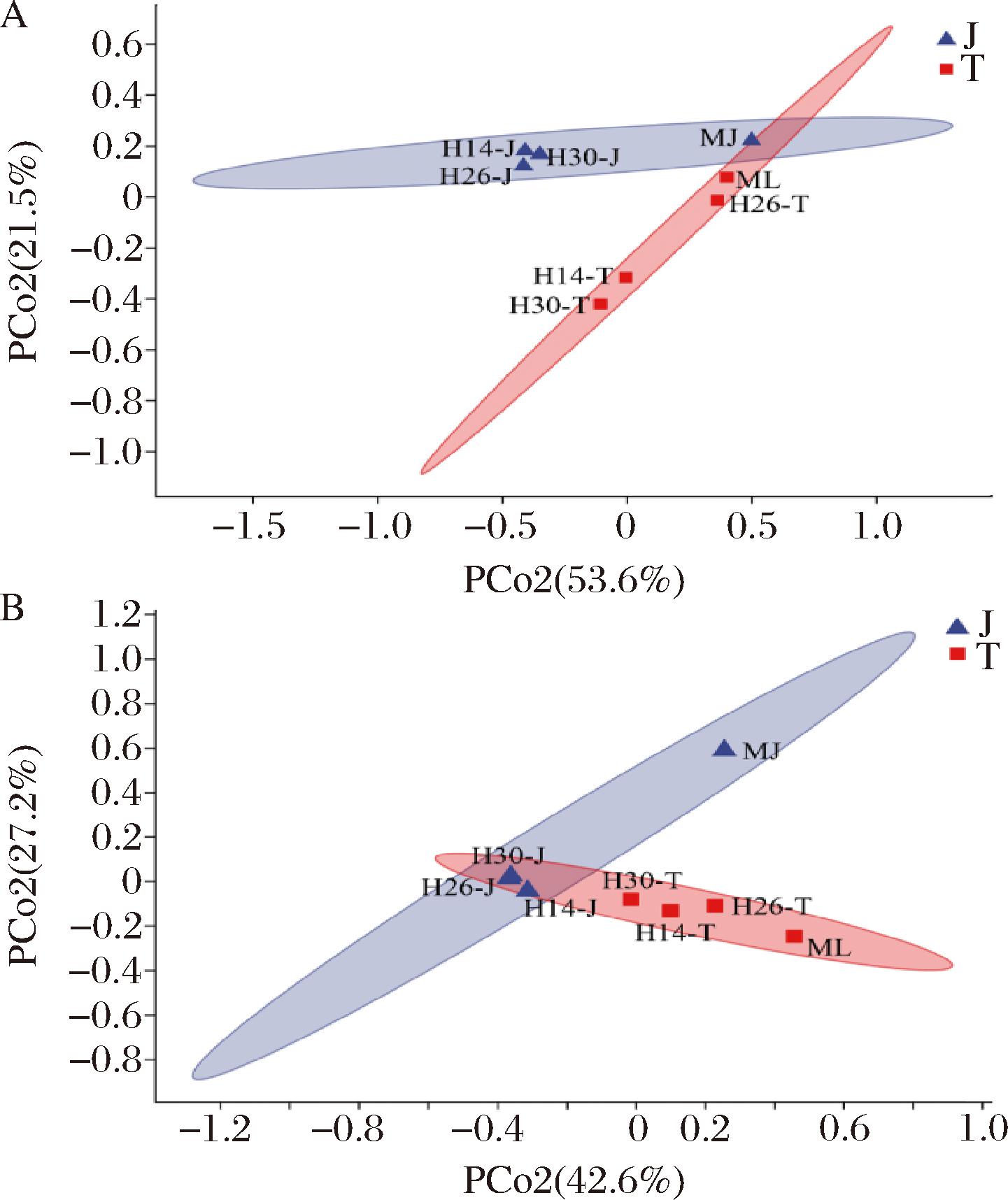
A-大曲细菌;B-真菌
图3 不同大曲细菌和真菌的β-多样性
Fig.3 β-diversity of bacteria and fungi in different Daqu
2.3.3 群落的微生物组成
属水平的相对丰度(relative abundance,RA)前20的群落结构轮廓如图4所示。检出的126种细菌属和79种真菌属中,2种制曲工艺共享分别有59种细菌和28种真菌,架式工艺曲独享细菌种类高于传统工艺的(图4-C~图4-D)。共享细菌中的糖多孢菌属(Saccharopolyspora)、克罗彭斯特菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces)、枝芽孢杆菌属(Virgibacillus)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)和伪诺卡氏菌属(Pseudonocardiaceae)等都是已确定的高温大曲的优势细菌。如图4-A~图4-B所示,功能菌扰动曲中,除H26外,Saccharopolyspora的RA都高于相应的常规曲,传统工艺大曲也都高于对应架式工艺的,尤其是在H30-T曲中高达54.65%。Kroppenstedtia的RA在传统工艺大曲的高于架式工艺的,H26-T的高达63.86%,而在架式工艺的曲中,Thermoactinomyces和Bacillus的RA都高于对应传统工艺的,且高于常规曲MJ的,扰动使之更高。这些结果揭示,架式工艺及M. floridanus分离株的扰动都能提高Bacillus的RA。嗜热子囊菌属(Thermoascus)、嗜热丝孢菌属(Thermomyces)、红曲霉属(Monascus)、曲霉属(Aspergillus)、丝衣霉菌属(Byssochlamys)、毛霉菌属(Rhizomucor)等不仅是共享真菌,亦是高温大曲的优势菌。传统工艺大曲的Thermoascus的RA高于对应架式工艺的,但Thermomyces的则是反之,且后者在H30-J的RA高达65.73%。Monascus在传统和架式2种工艺大曲的RA都高于相应的常规曲,且在H26-T中高达42.57%。
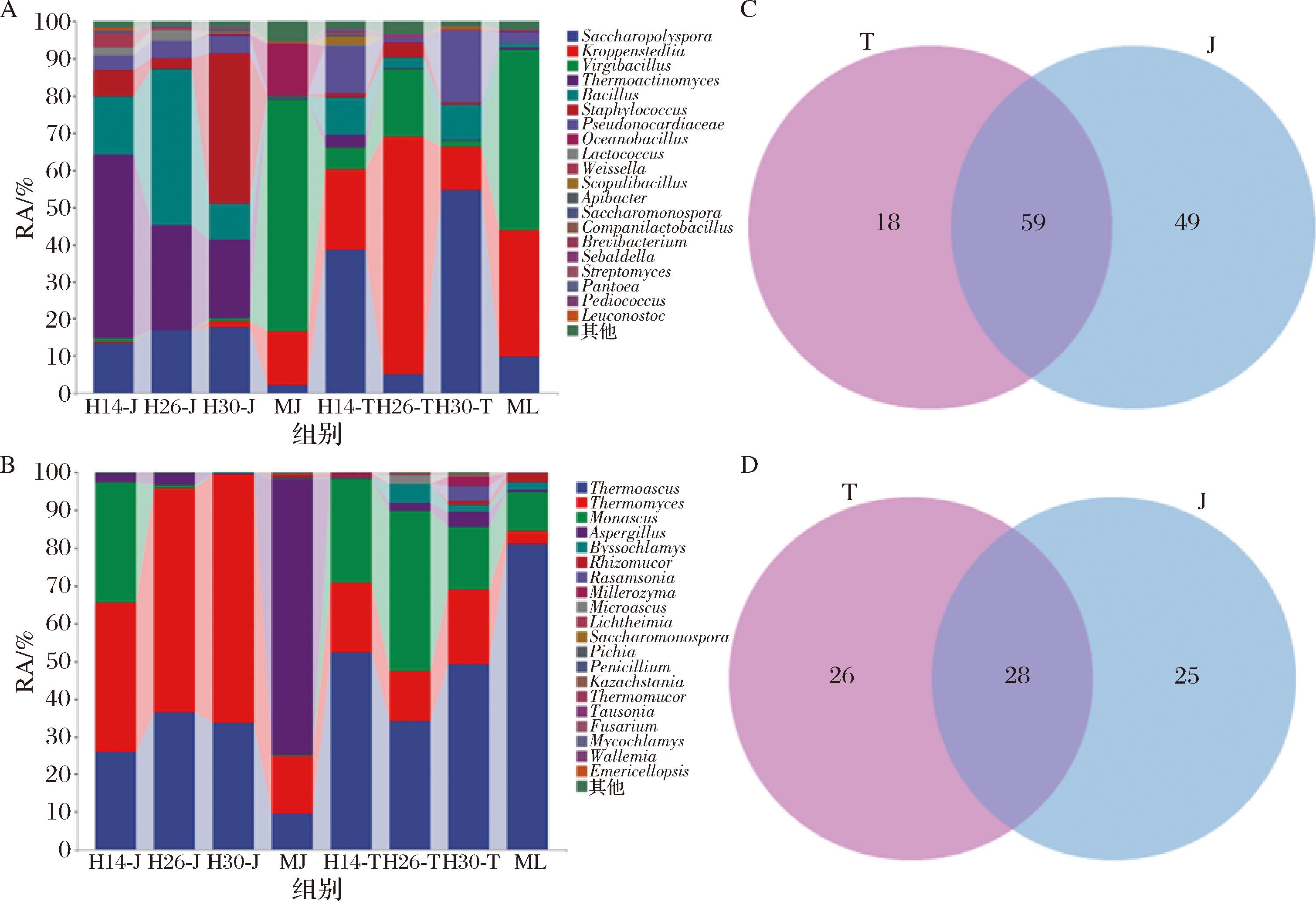
A、C-细菌;B、D-真菌
图4 不同大曲属分类水平上微生物群落组成
Fig.4 Composition of microbial communities at genus level of different Daqu
注:海洋芽孢杆菌属(Oceanobacillus);魏斯氏菌属(Weissella);类芽孢杆菌属(Scopulibacillus);蜜蜂杆菌属(Apibacter);伴乳杆菌属(Companilactobacillus);短杆菌属(Brevibacterium);塞巴尔德氏菌属(Sebaldella);链霉菌属(Streptomyces);片球菌属(Pediococcus);明串珠菌属(Leuconostoc);图中T表示传统曲;J表示架式曲;雷氏菌属(Rasamsonia);米勒酵母属(Millerozyma);小囊菌属(Microascus);毕赤酵母属(Pichia);青霉属(Penicillium);哈萨克斯坦酵母属(Kazachstania);Thermomucor(一种嗜热的毛霉属的菌);陶氏菌属(Tausonia);镰刀菌属(Fusarium);菌衣属(Mycochlamys);瓦勒米菌属(Wallemia);踝节菌属(Emericellopsis)。
探讨属间互作关系的结果如图5所示。共现网络由39个节点和266条边构成,正、负相关比例分别为54.89%和45.11%。共现网络主要涉及10个属(连接边数≥ top 10),分别是Thermomyces、Thermoactinomyces、乳球菌属(Lactococcus)、Bacillus、糖单孢菌属(Saccharomonospora)、泛生菌属(Pantoea)等6个细菌属和Virgibacillus、横梗霉属(Lichtheimia)、Rhizomucor和Kroppenstedti等4个真菌属,前后2个菌群的组内属间多呈正相关,而组间的属间则多呈负相关,这些互作关系显著影响群落及代谢调控规律[19-22]。

图5 不同大曲属分类水平上主要微生物的共现网络
Fig.5 Co-occurrence network of main microorganisms at genus level of different Daqu
注:酵母属(Saccharomycopsis);蓝色表示正相关,红色表示负相关,线的粗细与Spearman相关系数成正比;每个节点扇形图的大小与连接的数量成正比;每个扇形的不同颜色占比表示不同样品中微生物的相对丰度。
2.4 优势微生物与理化性质的相关性分析
冗余分析(redundancy analysis,RDA)评估大曲中优势属水平(RA ≥ top 10)的微生物与理化性质的相关性的结果表明,对细菌和真菌群落的解析度分别为82.83%和80.14%(图6)。Monascus和Pseudonocardiaceae与水分呈正相关。Lactococcus和Bacillus与酸度呈正相关,大部分真菌与酸度呈负相关,可能由于高温大曲产酸主要依靠细菌的代谢[20]。Saccharopolyspora、Bacillus和Thermomyces与糖化力正相关,尤其在架式工艺的曲中,因Thermomyces分泌淀粉酶能力强[23],RA增高,则糖化力显著高于对应传统工艺曲的(除H26-T)。Saccharopolyspora和多数真菌与液化力正相关。Thermoactinomyces和Thermomyces与发酵力正相关,因在架式工艺曲中RA较高,则发酵力高于对应传统工艺的。Virgibacillus和Aspergillus与酯化力正相关[19,24],Kroppenstedtia分泌蛋白酶[25]的能力强,所以与氨基酸态氮正相关,且多数真菌亦与氨基酸态氮正相关。
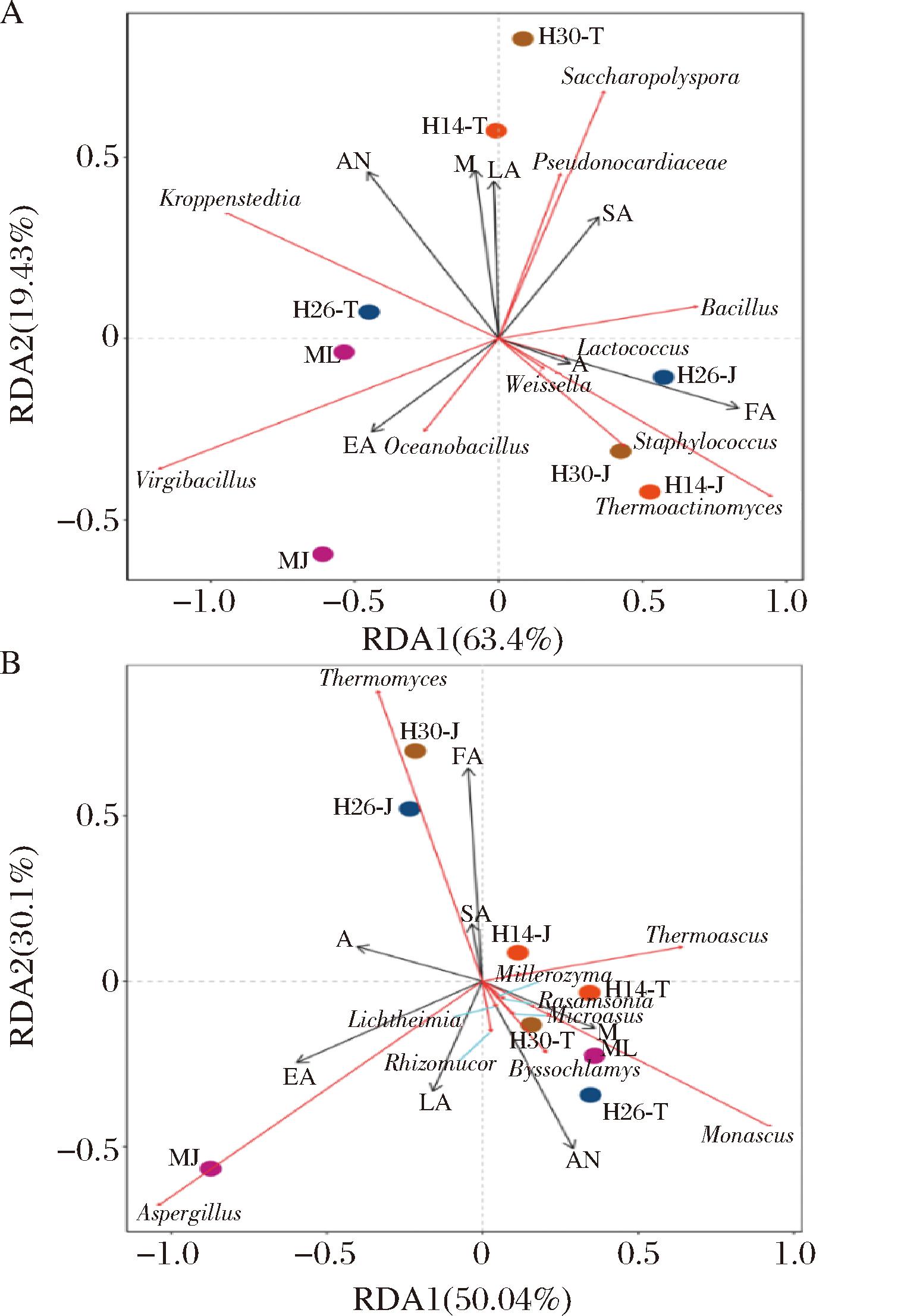
A-细菌;B-真菌
图6 优势属、理化参数和酶学特征之间的冗余分析
Fig.6 Redundancy analysis among dominant genera, physicochemical parameters, and enzymatic characteristics
注:M、A、AN、LA、SA、EA和FA分别表示水分、酸度、氨基酸态氮、液化力、糖化力、酯化力和发酵力。
2.5 微生物与代谢产物的相关性分析
基于Spearman相关系数评估20种优势属(真菌和细菌各10种)、21种挥发性和83种非挥发性特征代谢成分相关性的结果如图7所示。细菌与大部分挥发性组分呈显著负相关,如Thermoactinomyces、Staphylococcus和Oceanobacillus与9种挥发性物质呈显著负相关,虽然曾报道Thermoactinomyces与醇、内酯和酸类等多种挥发性组分显著负相关[26],但Staphylococcus和Oceanobacillus与其香气组分相关性鲜见报道。细菌与大部分非挥发性呈正相关,如Kroppenstedtia和Thermoactinomyces与29种非挥发性物质显著正相关。Kroppenstedtia是整个酱香型白酒生产的过程中核心功能菌,产生多种酶,对多种风味化合物的形成至关重要[25, 27],且与多数小分子肽显著正相关,解释了氨基酸态氮含量高的原因。真菌则与大多数挥发性组分和非挥发性组分均呈显著正相关,如Byssochlamys、Microascus和Lichtheimia与9种挥发性物质和61种非挥发性物质显著正相关,有益代谢产物的积累,尤其是Microascus和Lichtheimia与多数有机酸及衍生物和氨基酸及衍生物显著正相关。其中Lichtheimia是高温曲中核心的功能真菌,耐热性强,产蛋白酶和脂肪酶能力高[28]。
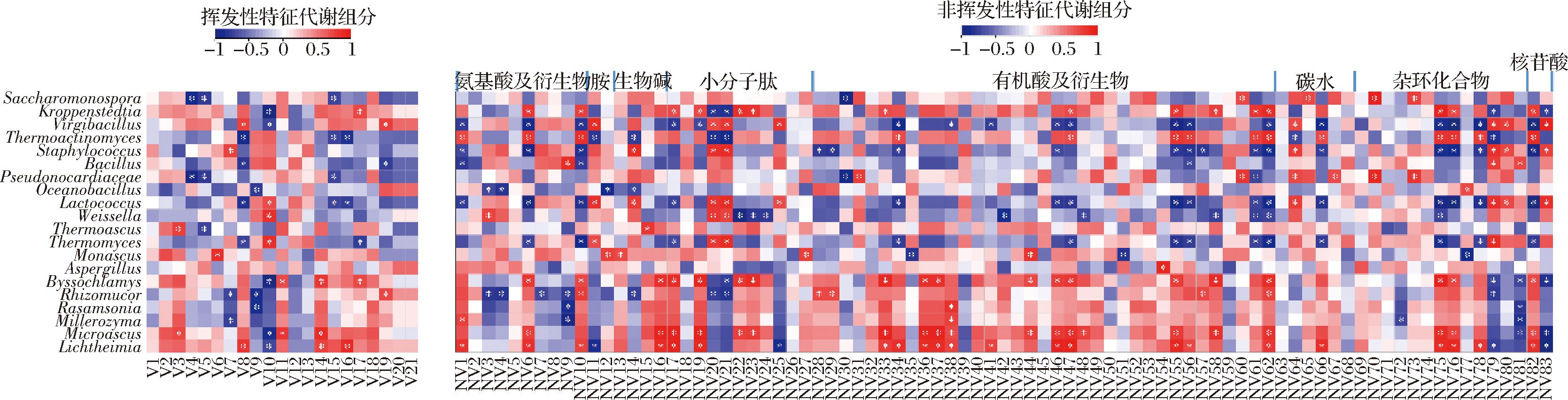
图7 优势属、特征挥发性和非挥发性代谢组分的相关性分析
Fig.7 Correlation analysis of dominant genera, characteristic volatile, and nonvolatile metabolic components
注:*表示显著正相关(|ρ|>0.7,P<0.05),红色和蓝色分别表示正相关和负相关。
2.6 代谢通路差异分析
主要差异代谢物的KEGG富集分析的结果如图8所示,这些差异涉及葡萄糖、乙醇、乙偶姻、苯乙醇、酯等组分的生成,主要代谢途径包括糖酵解、三羧酸循环、谷氨酸代谢等。小麦富含淀粉和纤维素[29],生产过程激活的内源酶及菌群生产的水解酶,将其水解的分解物进而为菌群的繁殖提供能量。在注释了7种与之代谢相关的酶中,架式工艺生产样品中的EC:2.4.1.8(麦芽糖磷酸化酶)和EC:3.2.1.3(葡聚糖1,4-α-葡萄糖苷酶)的丰度高于传统工艺生产的。而催化淀粉糊化的EC:3.2.1.1(α-淀粉酶)则反之。阐明了2种工艺生产大曲的淀粉水解力差异的原因。在注释的涉及糖酵解途径8种酶中[30],大多数酶在传统工艺的曲中的丰度都高于架式工艺曲的;4种参与丙酮酸代谢转化为乙醇代谢的酶中,EC:1.2.4.1(丙酮酸脱氢酶)和EC:1.1.1.2(乙醇脱氢酶)亦是在前者中丰度较高,解释了发酵力高的原因。谷氨酸代谢可形成氨,涉及的关键酶EC:1.4.1.3(谷氨酸脱氢酶)和EC:1.4.1.4(谷氨酸脱氢酶)的丰度在架式工艺扰动曲低于传统工艺的,可能导致架式工艺扰动曲中氨含量较低。氨既可进入尿素循环,也可与乙偶姻反应形成四甲基吡嗪[31],进入尿素循环的关键酶EC:2.1.3.3(鸟氨酸氨基甲酰转移酶)在架式工艺扰动曲中丰度更高,可能加速氨进入尿素循环,降低了与乙偶姻反应的通量,致使架式工艺扰动曲中的四甲基吡嗪含量降低。苯丙氨酸经转氨酶和脱羧酶催化生产苯乙醛,随之经脱氢酶催化转化合成苯乙醇是苯乙醇生产的主要代谢途径[32]。在这个代谢途径注释5种相关的酶中,EC:2.6.1.1(谷氨酸-天冬氨酸转氨酶),架式工艺曲中的丰度高于传统工艺的,前者苯乙醇含量较高的原因之一。相反地,在传统工艺曲中注释到的4种与酯合成相关酶中,提高脂肪酸积累量的EC:6.3.4.14(生物素羧化酶)丰度更高,可能与其酯含量较高有关。

A-主要代谢途径;B-相关酶的功能基因的丰度差异
图8 大曲的主要代谢途径及相关酶的功能基因的丰度差异
Fig.8 The main metabolic pathway of Daqu and the difference of functional genes of related enzymes
3 结论与讨论
以高温大曲为对象,探讨了传统(T)和架式(J)2种不同制曲工艺及3株分离株扰动对成曲理化性质、微生物群落及代谢组分的影响。传统工艺的细菌属的数量高于架式工艺的,两者的群落结构差异显著,共享59个属的细菌和28个属的真菌。Monascus分离株扰动提高了大曲中Bacillus、Saccharopolyspora和Thermoactinomyces等功能菌的丰度,改善了群落结构和互作关系。架式工艺提高发酵力及醇类的含量及丰富度,降低了酯化力,且提高了苯乙醇的含量。这些大曲中Saccharopolyspora、Kroppenstedtia等6个属是共享的关键物种,Thermomyces和Kroppenstedtia分别与淀粉水解力和氨基酸态氮呈正相关,Kroppenstedtia、Thermoactinomyces等5个属与多种非挥发组分正相关。架式工艺曲的相关代谢途径中的EC:2.6.1.1的表达丰度高是致使苯乙醇高,而EC:1.4.1.3及EC:1.4.1.4和EC:6.3.4.14的表达丰度高较是传统工艺中四甲基吡嗪和酯类组分高的原因之一。研究结果奠定了构建高温大曲主要优势组分的定向调控技术的重要的基础。
[1] SAKANDAR H A, HUSSAIN R, FARID KHAN Q, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters):A review[J].Food Research International, 2020, 138(Pt B):109830.
[2] 张清玫, 赵鑫锐, 李江华, 等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业, 2022, 48(10):1-8.ZHANG Q M, ZHAO X R, LI J H, et al.The relationship between microbial community and flavors of three types of Daqu[J].Food and Fermentation Industries, 2022, 48(10):1-8.
[3] 刘文虎, 柴丽娟, 张立强, 等.基于宏基因组学解析不同质量等级中温大曲微生物组的异质性[J].微生物学报, 2023, 63(11):4383-4398.LIU W H, CHAI L J, ZHANG L Q, et al.Metagenomics unveils the microbiome heterogeneity of medium-temperature Daqu with different quality grades[J].Acta Microbiologica Sinica, 2023, 63(11):4383-4398.
[4] 谢丹, 吴成, 毕远林, 等.酱香型白酒高温大曲储存过程中微生物群落演替与理化因子相关性研究[J].食品工业科技, 2023, 44(15):151-158.XIE D, WU C, BI Y L, et al.Study on the correlation between microbial community succession and physicochemical factors during the storage of Maotai-flavor liquor in Daqu at high temperature[J].Science and Technology of Food Industry, 2023, 44(15):151-158.
[5] XU B Y, XU S S, CAI J, et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT, 2022, 160:113214.
[6] LI W W, FAN G S, FU Z L, et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International, 2020, 129:108837.
[7] 崔香香, 白飞荣, 于学健, 等.谢瓦散囊菌CICC 41584产香特性及在浓香型白酒大曲生产中的应用[J].食品与发酵工业, 2019, 45(21):60-67.CUI X X, BAI F R, YU X J, et al.Aroma characteristics of Eurotium chevalieri CICC 41584 and its application in aroma Baijiu Daqu production[J].Food and Fermentation Industries, 2019, 45(21):60-67.
[8] 赵巧珍, 吕志远, 张梦梦, 等.地堆曲与架子曲制曲过程中理化差异性研究[J].酿酒, 2022, 49(3):92-97.ZHAO Q Z, LYU Z Y, ZHANG M M, et al.Study on physical and chemical differences between Didui Koji and traditional medium and high temperature Daqu[J].Liquor Making, 2022,49(3):92-97.
[9] 唐慧芳, 黄钧, 周荣清, 等.空间异质性对大曲微生物群落的影响[J].食品科学, 2023, 44(14):206-215.TANG H F, HUANG J, ZHOU R Q, et al.Effect of spatial heterogeneity on the microbial community of Daqu, a fermentation starter for Chinese Baijiu[J].Food Science, 2023, 44(14):206-215.
[10] 邓皖玉, 许永明, 陈波, 等.制曲工艺关键控制点对冬季高温大曲质量的影响[J].中国酿造, 2023, 42(8):153-157.DENG W Y, XU Y M, CHEN B, et al.Effect of key control points of Daqu-making process on the quality of high-temperature Daqu in winter[J].China Brewing, 2023, 42(8):153-157.
[11] ZHENG J, LIANG R, WU C D, et al.Discrimination of different kinds of Luzhou-flavor raw liquors based on their volatile features[J].Food Research International, 2014, 56:77-84.
[12] MU Y, HUANG J, ZHOU R Q, et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing, volatile analysis and metabolomics[J].Food Chemistry, 2023, 403:134440.
[13] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[14] 黄娜, 张明, 李子健, 等.不同颜色酱香型大曲微生物群落结构及功能比较[J].食品与发酵工业, 2024, 50(4):260-266.HUANG N, ZHANG M, LI Z J, et al.Comparative analysis of microbial community structure and function in Jiangxiang Daqu with different colors[J].Food and Fermentation Industries, 2024, 50(4):260-266.
[15] 张小龙, 邱树毅, 王晓丹, 等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造, 2020, 39(12):51-57.ZHANG X L, QIU S Y, WANG X D, et al.Relationship between volatile compounds of sauce-flavor Daqu and metabolic compounds of microorganisms[J].China Brewing, 2020, 39(12):51-57.
[16] 何猛超, 邬子璇, 西玉玲, 等.通过外源添加芽孢杆菌提升北方地区高温大曲的品质[J].食品工业科技, 2024, 45(1):145-154.HE M C, WU Z X, XI Y L, et al.Enhancing the quality of high-temperature Daqu in Northern China by adding exogenous Bacillus spores[J].Science and Technology of Food Industry, 2024, 45(1):145-154.
[17] 周会娴, 熊琴琴, 刘志勇, 等.中高温大曲发酵中小麦籽粒营养组分的动态变化分析 [J].食品与发酵工业, 2024,50(15):48-55.ZHOU H X, XIONG Q Q, LIU Z Y, et al.Dynamic analysis of nutritional quality of wheat grain in medium-high temperature Daqu fermentation[J].Food and Fermentation Industries, 2024,50(15):48-55.
[18] 骆茂香, 陈仁远, 徐兴江, 等.酱香型白酒轮次基酒中非挥发性风味物质的差异研究[J].食品与发酵工业, 2023, 49(19):282-288.LUO M X, CHEN R Y, XU X J, et al.Difference of non-volatile flavor substances in different rounds of Daqu sauce-flavor Baijiu[J].Food and Fermentation Industries, 2023, 49(19):282-288.
[19] ZHU C T, CHENG Y X, ZUO Q C, et al.Exploring the impacts of traditional crafts on microbial community succession in Jiang-flavored Daqu[J].Food Research International, 2022, 158:111568.
[20] 左乾程, 黄永光, 郭敏, 等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学, 2021, 42(18):150-156.ZUO Q C, HUANG Y G, GUO M, et al.Succession of bacterial community during mechanized fermentation of Maotai-flavor Daqu[J].Food Science, 2021, 42(18):150-156.
[21] 向凡舒, 蔡文超, 田龙新, 等.襄阳地区高温大曲真菌群落结构及其风味品质解析[J].食品科学, 2023, 44(24):211-219.XIANG F S, CAI W C, TIAN L X, et al.Analysis of fungal community structure and flavor quality of high-temperature Daqu from Xiangyang, China[J].Food Science, 2023, 44(24):211-219.
[22] 陈绍依, 郎莹, 邱树毅, 等.茅台镇不同区域酱香大曲微生物群落结构及生产性能对比[J].食品科学, 2023, 44(14):134-143.CHEN S Y, LANG Y, QIU S Y, et al.Comparative studies on microbial community structure and production performance of Jiang-Flavor Daqu in different areas of Maotai town[J].Food Science, 2023, 44(14):134-143.
[23] CERDA A, EL-BAKRY M, GEA T, et al.Long term enhanced solid-state fermentation:Inoculation strategies for amylase production from soy and bread wastes by Thermomyces sp.in a sequential batch operation[J].Journal of Environmental Chemical Engineering, 2016, 4(2):2 394-2 401.
[24] 陈晓茹, 黄钧, 周荣清, 等.强化曲贮存过程中群落与代谢组分的变化规律[J].食品与发酵工业, 2022, 48(3):63-69.CHEN X R, HUANG J, ZHOU R Q, et al.Changes of community and metabolic components during the storage of fortified Daqu[J].Food and Fermentation Industries, 2022, 48(3):63-69.
[25] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[26] 王洋, 谢菲, 杜礼泉, 等.酿酒专用小麦大曲中挥发性风味成分与微生物群落相关性分析[J].中国酿造, 2024, 43(2):71-81.WANG Y, XIE F, DU L Q, et al.Correlation analysis of volatile flavor components and microbial community in Daqu made by special wheat for brewing[J].China Brewing, 2024, 43(2):71-81.
[27] 张晶. 酱香型白酒发酵过程脂肪酸合成核心微生物及其影响因素解析[D].无锡:江南大学, 2023.ZHANG J.Revealing core microbiota related with fatty acid synthesis and influencing factors in fermentation of soy sauce aroma type liquor[D].Wuxi:Jiangnan University, 2023.
[28] 唐佳代, 石雨菲, 赵益梅, 等.不同感官特性酱香型大曲理化指标与霉菌群落关联分析[J].食品工业科技, 2024, 45(3):153-161.TANG J D, SHI Y F, ZHAO Y M, et al.Correlation analysis of physical and chemical indicators and mold community in sauce-flavored Daqu with different sensory characteristics[J].Science and Technology of Food Industry, 2024, 45(3):153-161.
[29] 柳习月, 朱琪, 杨帆, 等.多组学解析酱香型大曲风味物质的形成[J].食品与发酵工业, 2021, 47(22):35-41.LIU X Y, ZHU Q, YANG F, et al.Multi-omics reveal the formation of flavor compounds in sauce-flavor Daqu[J].Food and Fermentation Industries, 2021, 47(22):35-41.
[30] 李娜, 李莹, 孙悦.酿酒酵母乙醇代谢调控机制及低产乙醇菌株选育方法研究进展[J].食品与发酵工业, 2024,50(15):315-323. LI N, LI Y, SUN Y.Research progress on regulation mechanism of ethanol in Saccharomyces cerevisiae and breeding of low-yielding strains[J].Food and Fermentation Industries, 2024,50(15):315-323.
[31] SHI X S, ZHAO S M, CHEN S X, et al.Tetramethylpyrazine in Chinese Baijiu:Presence, analysis, formation, and regulation[J].Frontiers in Nutrition, 2022, 9:1004435.
[32] 杜闪, 王雪花, 杨政茂, 等.生物转化合成β-苯乙醇代谢途径及其调控的研究[J].食品与发酵工业, 2014, 40(1):168-173.DU S, WANG X H, YANG Z M, et al.Study on metabolic pathways of β-phenyl ethanol bioconversion and regulation[J].Food and Fermentation Industries, 2014, 40(1):168-173.