呕吐毒素(deoxynivalenol, DON)是镰刀菌次生代谢产物,由受污染的玉米、小麦和其他谷物中的镰刀菌产生[1]。由于DON具有稳定的化学性质,通过食品和饲料进入人类和动物的食物链,对人类和动物的健康以及食品经济构成了极大的威胁[2]。DON会导致免疫调节功能受损[3],长期摄入还会导致发育障碍和繁殖障碍[4]等。我国对DON在玉米的含量制定了严格的限量标准,GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定谷物及其制品中DON含量不允许超过1 000 μg/kg[5-6]。
目前,用于检测DON的方法主要分为大型仪器检测法和快速检测方法。大型仪器检测方法有高效液相色谱法[7],超高效液相色谱-串联质谱法[8]等,这些方法灵敏度高,可进行精确定量分析,但由于设备不易携带且检测时间过长,需要专业人员进行检测,因此不适用于大规模的现场快速检测[9]。快速检测方法包括酶联免疫吸附法[10]、免疫层析试纸条法(immunochromatographic test strip, ICTS)[11]等。其中免疫层析试纸条法具有检测时间短、不受检测地点限制、操作简单,携带便捷等优点[12]。
传统的免疫层析试纸条是基于胶体金作为信号标签,但由于胶体金稳定性较差,受温度影响大等问题,导致其存在检测灵敏度低,定量困难,结果不准确等缺点[13]。纳米材料是影响试纸条显色度和灵敏度的关键,因此多种纳米材料被引入试纸条中用于提高灵敏度[14],比如量子点(quantum dots,QDs)[15],可以大大提高试纸条的检测灵敏度,但其需要特殊的荧光仪器进行检测,而金属有机框架(metal organic framework,MOF)[16]则与抗体标记过程繁琐。金纳米花(gold nanoflowers, AuNFs)具有独特的突刺状结构,减少了蛋白质与其表面的空间位阻,能更好的固定抗体[17]。目前大都采用胶体金免疫层析试纸条法检测DON,AuNFs作为显色材料鲜少应用于单一检测DON,且已有文献报道使用AuNFs提高目标检测物的灵敏度[18],因此本研究采用100 nm的AuNFs作为显色材料,提高试纸条的灵敏度。AuNFs与DON单克隆抗体标记过程简单,且可以通过肉眼对检测线上富集产生的颜色信号进行定性分析,并可以借助免疫层析定量分析仪进行定量分析。在最优条件下对基于AuNFs的免疫层析试纸条灵敏度和特异性进行评价,并用于玉米加标检测,该方法为食品安全检测提供技术支撑。
1 材料与方法
1.1 材料与试剂
柠檬酸三钠、对苯二酚、叠氮化钠(NaN3,纯度≥99.5%),Sigma-Aldrich公司;四氯金酸·三水合物(HAuCl4,纯度≥99.9%)、海藻糖(纯度≥99%),阿拉丁试剂(上海)有限公司;牛血清白蛋白(bovine serum albumin,BSA),生工生物工程(上海)股份有限公司;金标垫、吸水垫、样品垫、PVC底板、羊抗鼠抗体(goat anti-mouse,Ab),上海捷宁生物科技有限公司;硝酸纤维素膜CN 140,Sartorius公司;DON单克隆抗体(DON monoclonal antibody, DON-mAb)、DON人工抗原(DON-BSA),山东美正生物公司;DON标准品、赭曲霉毒素标准品(ochratoxin, OTA)、玉米赤霉烯酮标准品(zearalenone,ZEN)标准品、黄曲霉毒素M1标准品(aflatoxin M1, AFM1)、黄曲霉毒素B1标准品(aflatoxin B1,AFB1)、黄曲霉毒素G1标准品(aflatoxin G1,AFG1),Sigma公司;吐温-20(Tween-20,纯度96%),北京索莱宝科技有限公司;聚乙烯吡咯烷酮K30(polyvinylpyrrolidone K30,PVP K30),上海易恩化学技术有限公司;0.22 μm过滤器,月旭科技(上海)股份有限公司。
1.2 仪器与设备
SN-MS-6D磁力加热搅拌器,上海尚普仪器设备有限公司;XYZ3020划膜喷金一体机、CM3030切条机、JH-450免疫层析定量分析仪,上海捷宁生物科技有限公司;TGL-16M台式高速冷冻离心机,湖南户康离心机有限公司;BZF-50真空干燥箱,上海博讯医疗生物仪器股份有限公司;ULUP--II-10T超纯水机,西安优普仪器设备有限公司;HT7700透射电子显微镜,日本日立HITACHI公司;UV-1800紫外-可见分光光度计,日本岛津公司;磁力搅拌子,生工生物工程(上海)股份有限公司;ZWY-240恒温培养振荡器,上海智城分析仪器制造有限公司。
1.3 实验方法
1.3.1 金纳米花的制备
种子液的制备:将1 mL 10 mg/mL的HAuCl4加入到99 mL的超纯水中,在磁力加热搅拌器上加热直至沸腾,再加入2 mL 10 mg/mL的柠檬酸三钠,剧烈搅拌。溶液颜色由黄色变为酒红色后,在沸腾状态下继续加热10 min,待冷却至室温后放在4 ℃冰箱保存。
AuNFs的制备:采用金种子法制备AuNFs。在剧烈搅拌下,将0.75 mL 10 mg/mL HAuCl4添加到100 mL的超纯水中,再迅速加入0.5 mL的金种子液、220 μL的柠檬酸三钠和1 mL 0.03 mol/L的对苯二酚,将溶液在室温下搅拌30 min后放在4 ℃冰箱保存。
1.3.2 金标探针的制备
取1 mL AuNFs于含有搅拌子的小烧杯中,加入10 g/L K2CO3调节溶液的pH值。将DON-mAb加入到AuNFs溶液中,用磁力搅拌器搅拌30 min,再加入150 μL 0.1 g/mL的BSA继续搅拌15 min,封闭剩余位点。制好的标记液在4 ℃,12 000 r/min条件下离心15 min 后,去上清液,并将离心后的沉淀用金标探针重悬液(60 g/L海藻糖,10 g/L BSA,0.5 g/L NaN3溶于20 mmol/L的硼酸盐缓冲液)重悬,将制备好的探针放于4 ℃冰箱保存。
1.3.3 免疫层析试纸条的组装
免疫层析试纸条由PVC底板、金标垫、样品垫、硝酸纤维素膜(nitrocellulose filter membrane,NC膜)和吸水纸组成。将金标垫和样品垫用20 mmol/L的硼酸盐缓冲液处理30 min。用画膜喷金一体机将DON-BSA和羊抗鼠二抗以0.5 μL/cm的速度喷洒在NC膜上,分别生成检测线(test-line,T线)和控制线(control-line,C线)。将处理过的金标垫、样品垫和NC膜放在真空干燥箱中37 ℃干燥过夜。如图1-B所示,将NC膜、金标垫、样品垫、吸水纸依次粘贴到PVC底板上,连接部分各重叠2~3 mm,确保探针和样品能够通过毛细管力流动。最后,用切条机将组装垫切割成3 mm宽的试纸条,并贮存在密封袋中保持干燥。
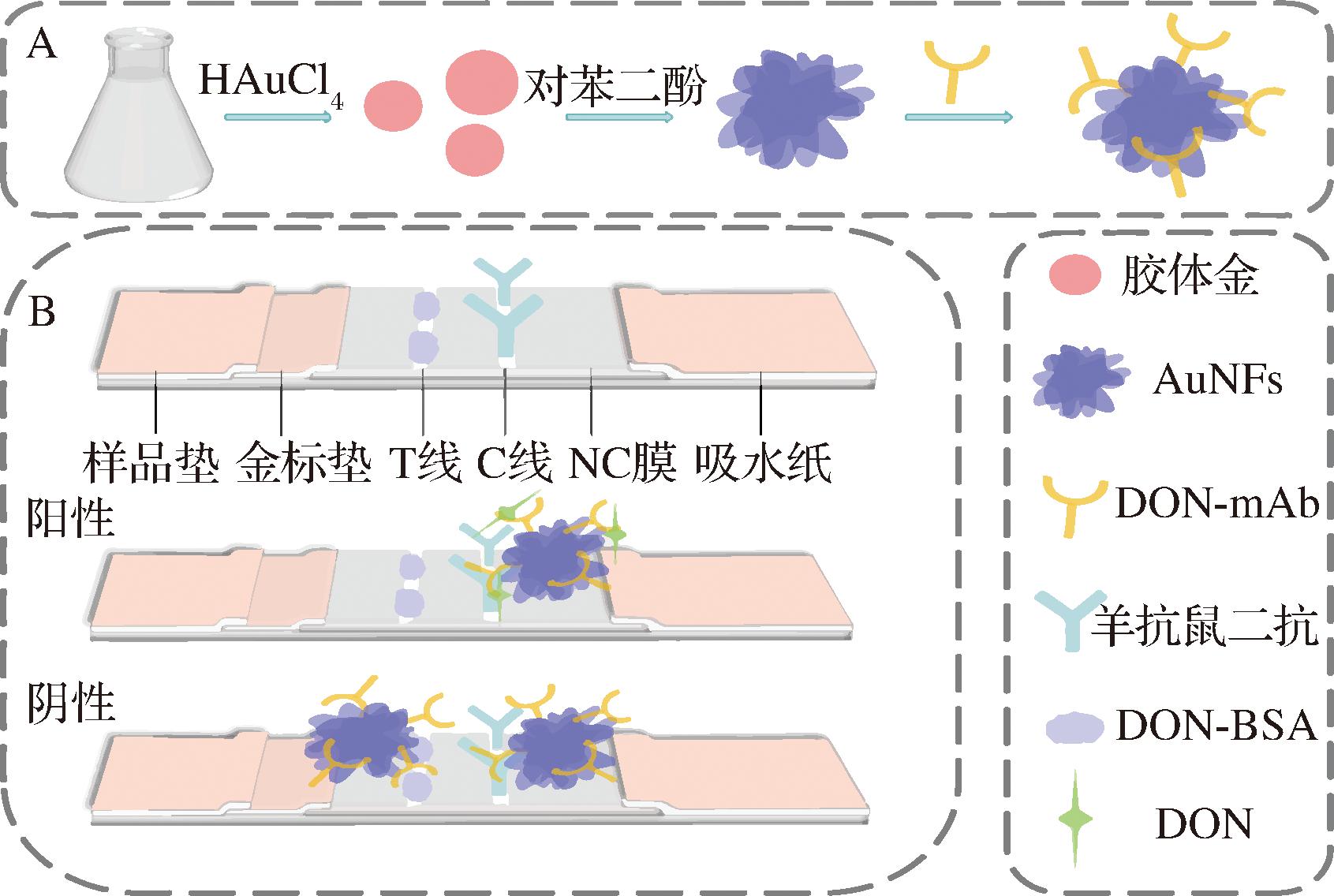
A-AuNFs的合成及探针的制备;B-试纸条的组成及竞争法原理
图1 免疫层析试纸条的检测原理
Fig.1 Detection principle of the immunochromatographic test strips
1.3.4 免疫层析试纸条工作条件优化
1)pH值的优化:在AuNFs溶液中分别加入不同量的10 g/L K2CO3,使其pH值为:7、7.5、8、8.5。每组加入15 μL抗体,在磁力搅拌器下450 r/min搅拌30 min,加入100 μL 0.1 g/mL BSA溶液,搅拌15 min后离心,将重悬后的探针滴加在金标垫上,吸取50 μL 的上样缓冲液(硼酸盐缓冲液0.01 mol/L,pH 7.4,含0.5 g/L Tween-20,10 g/L PVP K30)滴加到样品垫上,10 min后通过免疫层析定量分析仪检测试纸条的T线颜色强度和T/C值来判断最佳pH值。
2)抗体量的优化:在最优pH条件下,分别在AuNFs溶液中加入0.4、0.6、0.8、1 μL的DON-mAb制备免疫探针。后续封闭、离心、重悬、反应同1.3.4节1)。10 min后通过免疫层析定量分析仪检测试纸条的T线颜色强度和T/C值来判断最佳DON-mAb添加量。
3)上样缓冲液浓度的优化:将金标探针滴加在金标垫上,选取5、10、30、50 g/L PVP K30+PBST的上样缓冲液滴加到样品垫上,10 min后通过免疫层析定量分析仪检测试纸条的T线颜色强度和T/C值来判断最优浓度的上样缓冲液。
4)T线浓度和金标探针量的优化:对T线浓度和探针量同时进行优化,在最优pH和抗体量条件下,将2、3、4、5 μL的探针分别滴加在T线质量浓度为0.05、0.1、0.2 mg/mL的试纸条金标垫上。10 min后通过免疫层析定量分析仪检测试纸条的T线颜色强度和T/C值来判断最优T线浓度和探针量。
1.3.5 免疫层析试纸条的性能评价
1)检出限:基于已建立的ICTS方法,以阴性玉米为基质,开展DON的系列梯度加标实验,即加标量分别为2、10、20 μg/kg。准确称重5 g阴性玉米粉。在每个样品中分别加入DON标准溶液,在室温下振荡混匀5 min。随后,加入10 mL超纯水,将混合物在6 000 r/min和4 ℃的恒温培养振荡器中振荡30 min。离心20 min后,收集上清液,用0.22 μm过滤器过滤,吸取3 μL的探针在金标垫上,分别吸取50 μL上述加标量的缓冲液,反应10 min后,观察T线与C线颜色强度,该实验进行了3次。以T线颜色强度明显弱于C线的DON最低浓度作为本方法的检出限。
2)交叉反应:基于已建立的ICTS方法,以阴性玉米为基质,开展真菌毒素的交叉反应实验。选取DON和其他真菌毒素(OTA、ZEN、AFM1、AFB1、AFG1),各真菌毒素加标量均为10、20、50 μg/kg,吸取3 μL的探针在金标垫上,分别吸取50 μL上述真菌毒素的加标缓冲液,反应10 min后,观察T线与C线颜色强度,重复3次,以验证该方法的交叉反应情况。
3)与参比方法一致性分析:随机选取阴性玉米4份,设置3个加标样品(DON加标量:100、150、200 μg/kg)和1个空白样品。采用本方法和国家现行有效标准(GB 5009.111—2016《食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定》)对同一样品进行测定,以分析评价该方法与参比方法的一致性。
4)稳定性:随机选取检测卡干燥密封,分别放置于4、25和37 ℃下贮存,7 d后取出。选用1倍检出限加标样品(DON加标量:20 μg/kg)和阴性样品,分别对样品进行分析与结果判定,每个贮存温度下分别进行3次加标样品与阴性样品的测定,以验证该方法的稳定性。
5)其他性能指标:选取阴性玉米样品100份。设置空白样品,0.5倍检出限,1倍检出限和2倍检出限3个浓度水平,每个基质每个浓度水平各25份。对样品进行分析与结果判定,并根据《食品快速检测产品符合性评价技术要求》(国市监食检规〔2023〕1号)计算得出该方法的灵敏度、假阳性率、假阴性率。
6)实际应用:从不同超市购买10份玉米样品,并对样品分别用本方法与参比方法进行检测,用以评价本方法的实际应用效果。
1.4 数据处理
每个实验均重复3次,实验结果以“平均值±标准偏差”表示。采用Origin 2021进行数据处理并绘图。原理图采用PowerPoint 2019绘制。表格采用word 2019进行绘制。试纸条图片由iPhone 11拍摄。
2 结果与分析
2.1 免疫层析试纸条的检测原理
基于金纳米花为显色标签的试纸条的原理图如图1所示。如图1-A所示,通过种子法合成了金纳米花,并通过静电吸附与DON-mAb结合形成信号探针。试纸条的组成如图1-B所示,T线上包被DON-BSA,C线上包被羊抗鼠二抗。当检测液中含有DON时(阳性),DON会与金标垫上的信号探针结合,并在缓冲液的推动下流经T线,因探针上抗体的结合位点被DON占据,所以不会被T线上的DON-BSA捕获,但仍会被C线上的二抗捕获,结果T线不显色,C线显色。当检测液中没有DON时(阴性),探针上抗体的结合位点没有被占据,流经T线时被DON-BSA捕获,多余的探针流经C线时被C线捕获,结果T、C线均显色。
2.2 胶体金和金纳米花的表征
通过紫外-可见吸收光谱和透射电子显微镜(transmission electron microscope,TEM)对胶体金和金纳米花进行表征。通过TEM对胶体金和金纳米花的形貌及大小进行观察。如图2-A所示(放大倍数为8万倍),胶体金为椭圆形,尺寸在40 nm左右。对胶体金进行紫外扫描(图2-B),发现在521 nm波长处有最大吸收峰,表明胶体金的成功制备。通过观察AuNFs的TEM图(图2-C,放大倍数为10万倍),发现合成的纳米材料为明显的花状结构,尺寸均一,粒径在100 nm左右。通过紫外吸收光谱(图2-D)可得AuNFs的最大吸收峰在675 nm处,表明合成的AuNFs粒径较大分支较多。
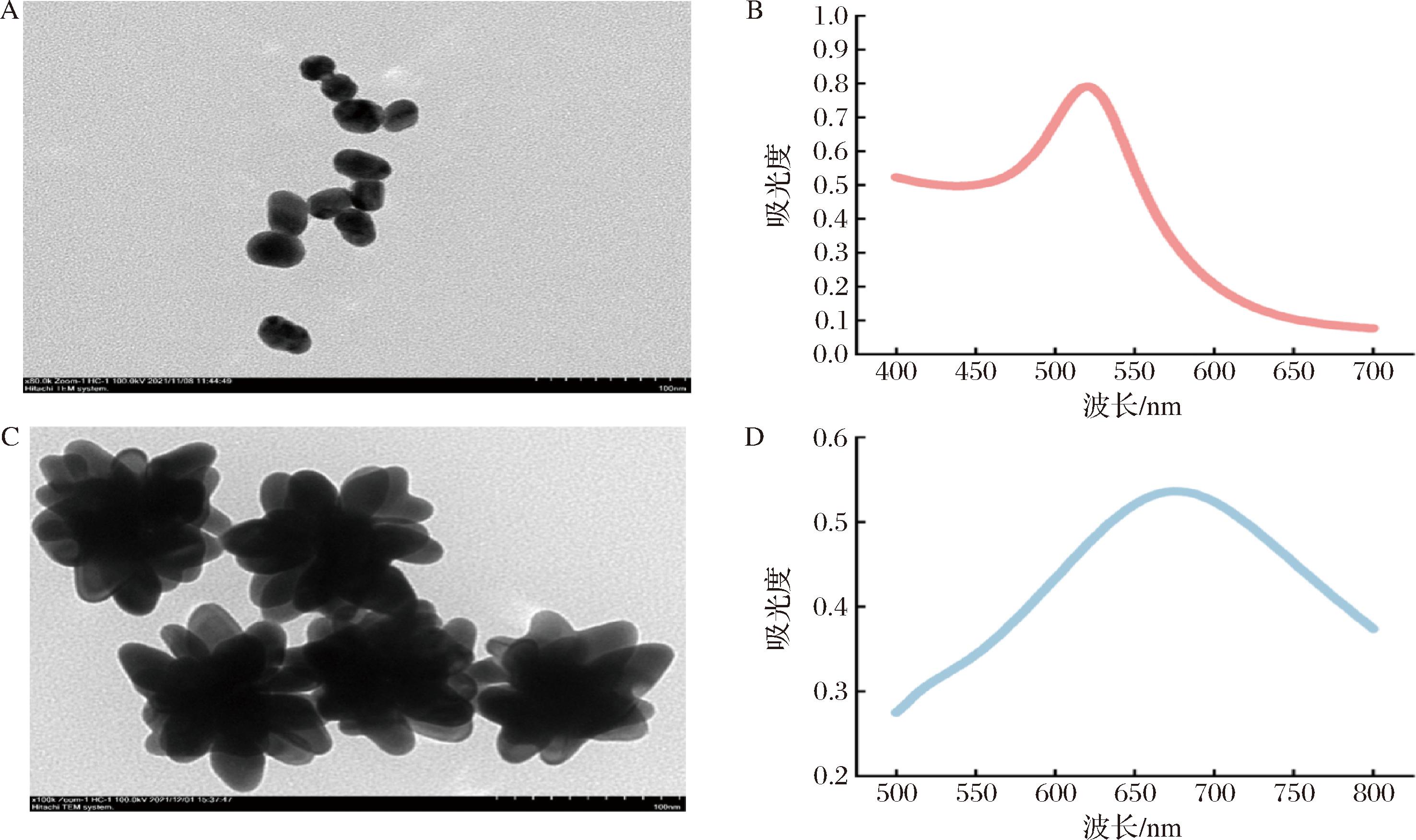
A-胶体金TEM图;B-胶体金的紫外吸收光谱图;C-AuNFs的TEM图;D-AuNFs的紫外吸收光谱图
图2 材料表征
Fig.2 Material characterization
2.3 条件优化
2.3.1 pH值的优化
AuNFs溶液的pH值影响探针的稳定性和试纸条的灵敏度。通过添加不同量的10 g/L K2CO3将AuNFs溶液的pH值调至最适值,使AuNFs与抗体之间形成稳定的键。如图3所示,当pH值为7.5时,T线的显色强度最好,试纸条的C线和T线颜色为最佳清晰度,其T/C值接近于1,因此,确定AuNFs溶液的最佳pH值为7.5。

图3 pH值的优化
Fig.3 Optimization of pH
2.3.2 抗体量的优化
抗体量会影响试纸条的灵敏度,过少的抗体会影响试纸条的显色度,过量的抗体会造成不必要的浪费。如图4所示,随着抗体量的增加,T线颜色强度逐渐增加,T/C值也逐渐增加。当抗体量为1 μL时,T线颜色强度最高,且T/C值趋于平衡,表明T线能捕获的探针量趋于饱和。因此选用1 μL的抗体量用于偶联AuNFs形成信号探针。

图4 抗体量的优化
Fig.4 Optimization of antibody volume
2.3.3 上样缓冲液浓度的优化
上样缓冲液运载着探针流动,其浓度影响探针在免疫层析试纸条上的爬速,同时也影响着探针与检测线的免疫反应。上样缓冲液浓度过低,会导致探针过快流经T线,使探针来不及与DON-BSA反应,从而导致T线颜色较浅。上样缓冲液浓度过高,则会导致探针爬速缓慢,容易发生非特异性吸附。如图5所示,当上样缓冲液中PVP K30的质量分数为1%,T线显色度最强,T/C值也接近于1。

图5 上样缓冲液浓度的优化
Fig.5 Optimization of sample buffer concentration
2.3.4 T线浓度和探针量的优化
T线浓度与探针量同时影响试纸条的显色度和灵敏度。如表1所示,当金标探针量过多时,检测物与金标探针结合后,过量未被结合的探针仍会被T线上的人工抗原所捕获,造成阴性结果,降低灵敏度;金标探针量过少,会造成检测阴性样品时结合到T线上的金标抗体不足,从而导致T线不显色。因此选择0.1 mg/mL的检测抗原质量浓度以及3 μL的金标探针的量。
表1 不同T线浓度和探针量对T值和T/C值的影响
Table 1 The impact of varying T-line concentrations and probe quantities on T and T/C values

探针量/μL0.05 mg/mL0.1 mg/mL0.2 mg/mLT值T/C值T值T/C值T值T/C值2151.11±350.593251.47±110.868352.21±161.5493243.30±70.671290.44±180.994385.59±411.8624355.79±680.889422.90±341.117537.43±361.8965434.90±401.043442.03±211.20571.24±172.112
2.4 试纸条性能评价
2.4.1 检出限
检出限是评价AuNFs-ICTS性能的重要参数。由表2可知,DON在玉米基质中的检出限为20 μg/kg。
表2 目标物的检出限
Table 2 Detection limit of the target substance

注:“+”阳性;“-”阴性(下同)。
基质目标检测物添加水平/(μg/kg)检测结果0.0-玉米DON2-10-20+
同其他基于纳米材料定量检测DON的ICTS法进行比较(表3)。与基于胶体金的方法相比,灵敏度得到了提高。基于荧光微球作为信号标签的试纸条虽然反应时间迅速,但需要特殊的荧光仪器才能目视结果。而基于普鲁士蓝纳米粒子的ICTS法目视检出限虽然较低,灵敏度高,但是材料制备方法与金纳米花制备方法相比更复杂。
表3 基于不同纳米材料的免疫层析法检测DON的对比
Table 3 Comparison of DON detection using immunochromatographic methods based on different nanomaterials

标记物LOD/(μg/kg)反应时间/min参考文献胶体金1005[19]荧光微球2510[20]荧光微球1205[21]普鲁士蓝纳米粒子515[22]聚多巴胺包被金属锆-有机框架6010[23]金纳米花2010本研究
2.4.2 交叉反应性
由表4可知,DON和其他真菌毒素在加标水平时无交叉反应。
表4 交叉反应实验结果
Table 4 Cross-reactivity test results

目标检测物其他真菌毒素添加水平/(μg/kg)检测结果DON赭曲霉毒素、玉米赤霉烯酮、黄曲霉毒素M1、黄曲霉毒素B1、黄曲霉毒素G110-20-50-
2.4.3 与参比方法一致性分析
为证实本方法的准确性,分析比对本方法与参比方法的检测结果。由表5可知,本方法与参比方法的检测结果相同,符合率达到100%。
表5 本方法与参比方法检测玉米中DON含量的对比
Table 5 Comparison of DON content in corn detected by this method and the reference method

目标检测物基质添加水平/(μg/kg)本方法参比方法检测结果/(μg/kg)DON玉米0.0--100+100.02±0.06150+149.94±0.02200+199.73±0.05
2.4.4 稳定性
选用加标和阴性样品验证检测卡在不同温度下的贮存稳定性。由表6可知,药物的添加水平为1倍检出限时,检测结果呈阳性,且检测同一样品时,不同批次检测卡检测结果相同。由阿伦尼乌斯公式换算可知,在37 ℃保存1 d相当于在25 ℃下保存4.01 d,因此试纸条至少可以在常温干燥条件下(25 ℃)保存28 d以上。
表6 稳定性实验
Table 6 Stability determination
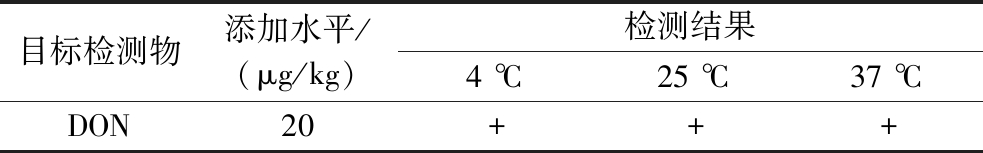
目标检测物添加水平/(μg/kg)检测结果4 ℃25 ℃37 ℃DON20+++
2.4.5 其他性能指标
本方法按照《食品快速检测产品符合性评价技术要求》计算各项性能指标。结果如表7所示,灵敏度≥99%、假阳性率≤1%、假阴性率≤1%。
表7 性能指标评价结果
Table 7 Results of performance index evaluation

注:灵敏度p是指方法在实验条件下达到的实际检出限时,检出阳性结果的阳性样品数占总阳性样品数的百分比;假阳性率是指方法在实验条件下达到的检出限时,阴性样品中检出阳性结果的最大概率(以百分比计),p-为阴性样品中检出阴性结果的样品数;假阴性率是指方法在实验条件下达到的检出限时,阳性样品中检出阴性结果的最大概率(以百分比计),p+为阳性样品中检出阳性结果的样品数。
样品情况检测结果阳性阴性总数阳性991100阴性199100总数100100100灵敏度(p)/%p=99/100×100=99假阳性率(pf+)/%pf+=100-p-=1假阴性率(pf-)/%pf-=100-p+=1
2.4.6 实际应用
由表8可知,参比方法在1份玉米中检出DON,本方法的检测结果也呈阳性,与参比方法检测结果一致。
表8 购买的玉米样品中DON的检测结果
Table 8 Detection results of DON in purchased corn samples

基质样品序号参比方法本方法玉米1--2--3--4--5--6--7129.47 μg/kg+8--9--10--
3 结论
建立基于金纳米花的免疫试纸条,实现DON的灵敏快速检测。利用金纳米花制备简单、比表面积大、摩尔消光系数高的优点,将其作为信号标签,增加抗体的负载量,实现信号放大。对反应条件进行优化,该方法的最优pH值为7.5,最佳抗体添加量为1 μL,最适上样缓冲液浓度为PBST+1%PVP K30,最好的T线质量浓度为0.1 mg/mL以及探针量为3 μL。在此条件下建立标准曲线,该方法的检出限为20 μg/kg,灵敏度≥99%、假阳性率≤1%、假阴性率≤1%,与其他真菌毒素无特异性反应。结果表明该方法建立的试纸条灵敏度高,特异性强,准确性好,检测时间短。基于金纳米花的免疫层析试纸条法在检测真菌毒素方面的良好应用,表明其在食品安全检测方面有广阔的应用前景。同时也可将其用于农药残留,重金属污染等领域,未来扩大其商品化,保障食品质量安全。
[1] LIAO B Y, HU L L, LI H G, et al.Toxicity of the mycotoxin deoxynivalenol on early cleavage of mouse embryos by fluorescence intensity analysis[J].Microscopy and Microanalysis, 2023, 29(2):754-761.
[2] ZHANG Y L, OUYANG B B, ZHANG W L, et al.Deoxynivalenol:Occurrence, toxicity, and degradation[J].Food Control, 2024, 155:110027.
[3] VIDAL A, BOUZAGHNANE N, DE SAEGER S, et al.Human mycotoxin biomonitoring:conclusive remarks on direct or indirect assessment of urinary deoxynivalenol[J].Toxins, 2020, 12(2):139.
[4] GANESAN A R, MOHAN K, KARTHICK RAJAN D, et al.Distribution, toxicity, interactive effects, and detection of ochratoxin and deoxynivalenol in food:A review[J].Food Chemistry, 2022, 378:131978.
[5] 曾运婷, 李再新.小麦中呕吐毒素检测方法的研究进展[J].广东化工, 2023, 50(21):142-144.ZENG Y T, LI Z X.Review on detection methods for vomiting toxins in wheat[J].Guangdong Chemical Industry, 2023, 50(21):142-144.
[6] 朱海华, 张梦雪, 胡骁飞, 等.食品中呕吐毒素检测方法的研究进展[J].食品科技, 2021, 46(11):314-320.ZHU H H, ZHANG M X, HU X F, et al.Research progress on the detection method of vomitoxin in food[J].Food Science and Technology, 2021, 46(11):314-320.
[7] 陈冉, 邱艳, 都晓慧, 等.粮食中呕吐毒素检测技术研究[J].粮食储藏, 2023, 52(3):39-42.CHEN R, QIU Y, DU X H, et al.Study on detection of deoxyniverenol in grain[J].Grain Storage, 2023, 52(3):39-42.
[8] WANG W, MA J J, YU C C, et al.Simultaneous determination of masked deoxynivalenol and some important type B trichothecenes in Chinese corn kernels and corn-based products by ultra-performance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2012, 60(46):11638-11646.
[9] 谭林, 陆阳, 王正珅.玉米中真菌毒素检测技术的研究进展[J].粮食加工, 2023, 48(6):111-114.TAN L, LU Y, WANG Z S.Research prograss of detection technology of mycotoxin contamination of maize[J].Grain Processing, 2023, 48(6):111-114.
[10] 刘云翔, 周荣荣, 詹志来, 等.薏苡仁中呕吐毒素酶联免疫检测方法的建立[J].中国中药杂志, 2022, 47(24):6581-6586.LIU Y X, ZHOU R R, ZHAN Z L, et al.Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for determination of vomitoxin (DON) in Coicis Semen[J].China Journal of Chinese Materia Medica, 2022, 47(24):6581-6586.
[11] 王振芳, 王平东, 邓庆, 等.高灵敏度呕吐毒素时间分辨荧光快速定量检测卡的研发和应用[J].粮食加工, 2024, 49(1):102-107.WANG Z F, WANG P D, DENG Q, et al.Development and application of high sensitivity time-resolved fluorescent rapid quantitative detection card for deoxynivalenol[J].Grain Processing, 2024, 49(1):102-107.
[12] 刘以晴, 黄亚伟, 王小庆, 等.粮食中真菌毒素快速检测方法研究进展[J].粮食与饲料工业, 2023(2):66-71.LIU Y Q, HUANG Y W, WANG X Q, et al.Research progress on rapid detection methods of mycotoxins in grain[J].Cereal &Feed Industry, 2023(2):66-71.
[13] 李华英, 闫文婧, 李进春, 等.粮油中多种真菌毒素检测技术研究进展[J].农产品加工, 2023(12):67-70.LI H Y, YAN W J, LI J C, et al.Research progress on detection technology of mycotoxins in grains and oils[J].Farm Products Processing, 2023(12):67-70.
[14] 周菊桃, 何军意, 肖国强, 等.基于纳米材料的呕吐毒素生物传感研究与应用[J].化学传感器, 2023, 43(2):8-18.ZHOU J T, HE J Y, XIAO G Q, et al.Research and application on deoxynivalenol biosensors based on nanomaterials[J].Chemical Sensors, 2023, 43(2):8-18.
[15] WANG X Y, SUN T Q, SHEN W L, et al.A lateral flow immunochromatographic assay based on nanobody-oriented coupling strategy for aflatoxin B1 detection[J].Sensors and Actuators B:Chemical, 2023, 394:134419.
[16] WU W J, LI Y, XU Q B, et al.Polydopamine-coated HKUST MOFs-based strip lateral flow immunoassay for on-site ultrasensitive detection of aflatoxin B1 in foods[J].Food Control, 2023, 152:109864.
[17] 金玉, 刘仁荣, 裘雪梅.基于金纳米花标记的免疫层析法检测牛奶中黄曲霉毒素M1[J].食品研究与开发, 2019, 40(13):164-170.JIN Y, LIU R R, QIU X M.Sensitive detection of aflatoxin M1 in milk by immunochromatography based on gold nanoflower labeled[J].Food Research and Development, 2019, 40(13):164-170.
[18] CHEN X R, ZHANG J Y, XIE J H, et al.Development of two immunochromatographic test strips based on gold nanospheres and gold nanoflowers for the rapid and simultaneous detection of aflatoxin B1 and aristolochic acid a in dual-use medicinal and food ingredients[J].Microchemical Journal, 2023, 186:108307.
[19] HUANG X, HUANG X Y, XIE J H, et al.Rapid simultaneous detection of fumonisin B1 and deoxynivalenol in grain by immunochromatographic test strip[J].Analytical Biochemistry, 2020, 606:113878.
[20] ZHOU S Y, XU L G, KUANG H, et al.Fluorescent microsphere immunochromatographic sensor for ultrasensitive monitoring deoxynivalenol in agricultural products[J].Microchemical Journal, 2021, 164:106024.
[21] SUN J D, WANG L Z, SHAO J D, et al.One-step time-resolved fluorescence microsphere immunochromatographic test strip for quantitative and simultaneous detection of DON and ZEN[J].Analytical and Bioanalytical Chemistry, 2021, 413(26):6489-6502.
[22] 章铜, 沈央红, 张雯, 等.基于普鲁士蓝纳米粒子的免疫层析法检测小麦中的呕吐毒素[J].食品与发酵工业, 2024, 50(4):286-293.ZHANG T, SHEN Y H, ZHANG W, et al.Based on Prussian blue nanoparticles for immunochromatographic detection of deoxynivalenol in wheat[J].Food and Fermentation Industries, 2024, 50(4):286-293.
[23] LI R, BU T, ZHAO Y J, et al.Polydopamine coated zirconium metal-organic frameworks-based immunochromatographic assay for highly sensitive detection of deoxynivalenol[J].Analytica Chimica Acta, 2020, 1131:109-117.