黄曲霉毒素B1(aflatoxins B1,AFB1)毒性大、致癌性强,且因理化性质稳定而不易被去除,污染广泛且严重,对粮食农作物、食品、动物饲料和中药材均可污染,低剂量长期暴露就能产生严重的慢性毒性[1-2],AFB1的污染问题已得到了世界范围内的广泛关注,在欧盟标准,食品中AFB1可接受的水平为2 ng/g(ng/mL)[3]。AFB1在食品样品中痕量存在,食品样品基质又复杂多样,因此,快速和精准的检测AFB1对保障消费者的身体健康和国内外贸易的顺利开展具有重要意义。
在AFB1检测方法中,以液相和气相技术为基础的色谱检测方法虽然精确度和灵敏度高,但也存在检测成本高、需大型仪器和复杂的样品制备过程、检测时间长、需要配备训练有素的技术人员、检测过程中使用大量的有毒有害的有机化学试剂等缺点[4]。基于免疫的分析技术具有样品处理简单、灵敏度高、精准度高等优点[5],传统ELISA是将辣根过氧化物酶(horseradish peroxidase,HRP)标记在抗体上,在H2O2的辅助下实现对底物{3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB)、2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐[diammonium 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ATBS]和鲁米诺}的催化,再以可视化和化学发光的信号输出。但是,由于标记在抗体上的HRP数量有限,传统的ELISA方法检测限无法满足日益增长的检测要求,其灵敏度和稳定性有待进一步提高[6]。为了提高灵敏度、降低检测限、增加稳定性,可以从开发效率高的信号传导标记物[7-10]和寻求良好的信号传导方式[8-11]2个方面着手。
对于效率高的信号传导标记物开发,通常利用纳米材料大的比表面积实现对酶的负载,进而实现对输出信号的放大,如:ZHANG等[7]通过多壁碳纳米管对酶标二抗的负载实现对共济失调症突变蛋白的灵敏检测;DENG等[8]利用氧化石墨烯大的比表面积实现对生物素/链霉亲和素的负载进而对目标物的高灵敏度分析;LAI等[9]和DAS[10]等在金纳米粒子上负载抗体和酶实现检测限的降低。羧基聚苯乙烯微球(polystyrene particles,PPs)作为一种新型纳米材料具有较强的亲水性、单分散性、大的比表面积和生物相容性、与抗体等蛋白质分子结合后也不会改变偶联上的蛋白质分子的性质等优点[12]。
对于寻求良好的信号传导方式方面,LAI等[9]和MIAO等[11]通过酶级联放大技术将“酶标记”产生的信号转变为比色信号来进一步提高检测的灵敏度;DAS等[10]利用良好的酶催化体系将目标物识别信号转化为电化学信号实现灵敏检测;DENG等[8]通过酶催化作用将信号转化为质量信号以提高灵敏度。对于寻求良好的信号传导方式方面,在免疫荧光分析方面报道较少,而荧光生物传感信号具有信号响应快、高灵敏度、抗基质干扰能力强、样品用量少等优势[13],已在食品分析和医学检测等多领域广泛使用。硫磺素T (thioflavine-T,ThT)是一种水溶性苯并噻唑盐,本身具有微弱的荧光。大量研究表明,ThT可诱导富G的DNA折叠成G-四链体,从而使ThT的荧光强度显著增强[14-15],G-四链体/ThT荧光探针具有水溶性好、成本低、操作简单、灵敏度高、荧光背景信号低等优点[16]。
在本研究中,以AFB1为研究对象,构建了一种“Turn on”型磁分离荧光免疫分析方法。信号探针[AFB1-鸡卵白蛋白(ovalbumin,OVA)-PPs-葡萄糖氧化酶(glucose oxidase,GOx)]和目标分析物AFB1共同特异性竞争结合AFB1抗体偶联的单分散聚苯乙烯磁性微球构成的捕获探针[单分散聚苯乙烯磁性微球(monodisperse magnetic polystyrene microspheres,MMPMs)-AFB1抗体],通过磁分离后,得到免疫结合物(MMPMs-AFB1抗体-AFB1-OVA-PPs-GOx),其免疫结合物上的GOx能够通过芬顿反应-ThT荧光核酸探针体系进行灵敏的检测。随着分析体系中目标分析物AFB1浓度的增加,捕获探针结合的信号探针的含量逐渐减少,G-四链体/ThT荧光探针的荧光强度逐渐增加,进而实现对目标物AFB1灵敏的检测。
1 材料与方法
1.1 材料与试剂
富鸟嘌呤(G)探针(5′-GGG TTG GGC GGG ATG GGT TTT GGG TTG GGC GGG ATG GGT-3′),金唯智生物技术公司;ThT、GOx(酶活力为168 U/mg)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺{1-ethyl-3-[3- (dimethylamino)propyl] carbodiimide,EDC}、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、牛血清蛋白(bovine serum albumin,BSA),美国Sigma-Aldrich公司;2-(N-吗啡啉)乙磺酸[2-(N-morphine) ethanesulfonic acid,MES],上海生工生物技术有限公司;氯化钾、葡萄糖,上海国药集团化学试剂有限公司;硫酸亚铁,天津市百世化工有限公司;PPs、MMPMs,天津倍思乐色谱技术开发中心。
MES缓冲液:准确称取MES 213.3 mg,溶于 90.0 mL 的超纯水中,用1 mol/L的氢氧化钠溶液调节pH值至6.0,充分摇匀,用超纯水定容至100.0 mL,混匀后备用。
MEST缓冲液(含有吐温-20):准确称取MES 213.3 mg,溶于 90.0 mL的超纯水中,用1 mol/L的氢氧化钠溶液调节pH值至5.5后滴加50 μL吐温-20,充分摇匀,用超纯水定容至100.0 mL,混匀后备用。
1.2 仪器与设备
LUMINA型荧光分光光度计,美国Thermo Fisher公司;SQP型分析电子天平,赛多利斯科学仪器(北京)公司;Milli-Q型超纯水系统,美国Millipore公司;5804R型低温高速离心机,德国 Eppendorf 公司;SK-330-pro型摇床,大龙兴创实验仪器(北京)有限公司。
1.3 实验方法
1.3.1 捕获探针(MMPMs-AFB1抗体)的制备
首先取250 μL 5 g/L MMPMs分散到1 000 μL MEST缓冲液中,在外磁场的作用下去除上清液,反复洗涤2次后去除上清收集沉淀。将上述沉淀物中加入1 000 μL新配制的EDC(5 mg/mL,10 mmol/L MES pH值6.0)和1 000 μL新配制的NHS(5 mg/mL,10 mmol/L MES pH值6.0),充分混匀,在室温振荡1 h 以活化MMPMs表面的羧基。在外磁场的作用下,将上述反应产物用MEST缓冲液反复洗涤3次,反应产物用1 000 μL羟乙基哌嗪乙磺酸缓冲液(piperazine-N-ethanesulfonic acid buffer,HEPES)(10 mmol/L pH值7.2)复溶,加入48 μg AFB1多克隆抗体,低温低速振荡孵育4 h。反应产物在外磁场的作用下固液分离,去除上清,加入2% BSA溶液低温低速振荡孵育1 h,以封闭MMPMs表面未反应的羧基。将制备的抗体标记的磁珠贮存在4 ℃ HEPES缓冲液 (10 mmol/L pH值7.2)中备用。
1.3.2 信号探针(AFB1-OVA-PPs-GOx)的制备
首先取100 μL 25 g/L PPs分散到900 μL MES缓冲液(10 mmol/L pH值6.0)中,漩涡振荡30 s,4 ℃ 14 000 r/min离心6 min,去除上清液,加入900 μL MES缓冲液(10 mmol/L pH 6.0)复溶,再次离心反复洗涤2次,去除上清收集沉淀。将分离得到的沉淀中加入1 000 μL新配制的EDC(2 mg/mL,10 mmol/L MES pH值6.0)和1 000 μL新配制的NHS(2 mg/mL,10 mmol/L MES pH值6.0),充分混匀,在室温振荡2 h以活化PPs表面的羧基。在离心力的作用(4 ℃ 11 000 r/min离心5 min)下,将上述反应产物用MES缓冲液(10 mmol/L pH值5.2)反复洗涤3次,反应产物用1 000 μL MES缓冲液(10 mmol/L pH 5.2)复溶,加入24 μg OVA-AFB1和96 μg GOx,室温低速振荡孵育4 h。反应产物在离心力的作用(4 ℃ 11 000 r/min离心5 min)固液分离,去除上清,加入2% BSA溶液室温低速振荡孵育1 h,以封闭PPs表面未反应的羧基。将制备的AFB1-OVA-PPs-GOx复合物贮存在4 ℃备用。
1.3.3 实验原理
本实验建立了一种“Turn on”型AFB1荧光检测方法,检测体系中使用的2种纳米材料和一种酶级联荧光信号放大体系保证该方法具有良好的检测性能。捕获探针的载体MMPMs具有超顺磁性,良好的悬浮性和亲水性,在检测的过程中借助于外磁场力即可从复杂的食品基质样品中分离出免疫结合物,节约了分离时间,省去了离心设备的使用[6];信号探针的PPs作为纳米载体具有良好的悬浮性,亲水性和大的比表面积[12],能够负载适宜比例的OVA-AFB1和GOx,即可完成抗原-抗体特异性识别反应,又可为芬顿反应-ThT荧光核酸探针体系提供灵敏的信号响应。芬顿反应-ThT荧光核酸探针通过GOx催化底物产生的产物H2O2触及芬顿反应产生羟自由基[17],羟自由基又触发DNA的氧化损伤[18]引起的荧光强度变化的酶级联信号放大体系保证了检测的灵敏度。
具体实验方法设计思路如图1所示。在该检测体系中,负载AFB1多克隆抗体的捕获探针(MMPMs- AFB1抗体)用于竞争性捕获目标物AFB1和信号探针(AFB1-OVA-PPs-GOx),所形成的免疫结合物(MMPMs- AFB1抗体-AFB1-OVA-PPs-GOx)在外磁场的作用下进行固液分离,去除上清液后重悬于芬顿反应-ThT荧光核酸探针体系中,免疫结合物(MMPMs-AFB1抗体-AFB1-OVA-PPs-GOx)上的GOx催化该荧光体系中的葡萄糖生成H2O2,H2O2在Fe2+存在情况下转化为羟自由基[17],羟自由基触发DNA的氧化损伤[18]导致富G-DNA探针裂解为短寡核苷酸片段,裂解的短寡核苷酸片段丧失了形成G-四链体/ThT荧光探针的能力[19],G-四链体/ThT荧光探针的荧光强度大幅度下降,随着分析体系中目标分析物AFB1浓度的增加,捕获探针(MMPMs- AFB1抗体)捕获到的信号探针(AFB1-OVA-PPs-GOx)的量减少,G-四链体/ThT荧光探针的荧光强度得到恢复,进而实现对目标物AFB1的检测。

图1 黄曲霉毒素B1磁分离荧光免疫分析方法的检测原理
Fig.1 Schematic diagram of magnetic separation fluorescence immunoassay for AFB1
1.3.4 检测过程
将100 μL捕获探针(MMPMs-AFB1抗体)与50 μL 系列浓度梯度的标准品(样品)混合,80 μL信号探针(AFB1-OVA-PPs-GOx)加入到上述体系中,室温260 r/min振荡1 h,在外磁场力的作用下固液分离,并用MES缓冲液(10 mmol/L pH值6.0)清洗3次,收集免疫结合物(MMPMs- AFB1抗体-AFB1-OVA-PPs-GOx)。
将免疫结合物(MMPMs-AFB1抗体-AFB1-OVA-PPs-GOx)加入到215 μL GOx检测系统中(包括10 mmol/L MES缓冲液pH值6.0,400 nmol/L富G探针,40 μmol/L Fe2+ and 10 μmol/L葡萄糖)均匀混合后在37 ℃孵育25 min,在外磁场的作用下取上清液,15 μL 500 mmol/L KCl和20 μL 100 μmol/L ThT被添加到上述得到的上清液中。用荧光分光光度计记录487 nm处的荧光强度。
1.3.5 样品分析
从当地超市购买大米样品、玉米样品、啤酒样品和白酒样品,以上所有样品均被证实不含有AFB1。对各个样品进行加标处理,得到终浓度为1、5、20、200 ng/g (ng/mL)的阳性样品。
大米样品和玉米样品用电动研磨机进行粉碎处理,粉碎后的每种样品取1 g,加入一定浓度的AFB1标准溶液,在50 mL的离心管中充分混匀。随后,向每管中加入2 mL的提取液[V(甲醇)∶VHEPES=7∶3]。上述混合物涡旋振荡5 min后离心10 min(6 000 r/min,4 ℃)。上清液用一次性针管过滤器(0.22 μm)过滤,滤液用MES(10 mmol/L, pH值6.0)缓冲液稀释2.5倍后用建立的方法对其进行检测。
啤酒样品和白酒样品不需要任何的提取过程,用MES(10 mmol/L, pH值6.0)缓冲液稀释5倍后用建立的方法对其进行检测。
为了进一步验证该方法检测实际样品的准确性,对含有一定量AFB1的标准玉米质控样品进行分析。
2 结果与分析
2.1 芬顿反应-ThT荧光核酸探针体系对GOx活力的分析
芬顿反应-ThT荧光核酸探针体系中G-四链体/ThT荧光探针对不同质量浓度GOx的荧光强度响应情况如图2所示,随着GOx质量浓度的升高,荧光强度的变化值(F0-F)/F0也逐渐增高,该体系可检测低至0.1 μg/mL GOx,以上结果证实了GOx在该体系存在时可引起DNA核酸探针的氧化损伤,G-四链体/ThT荧光探针的荧光强度随着GOx质量浓度的升高而逐渐下降, 该体系对GOx检测限较低,可为建立荧光免疫分析方法提供先决条件。

图2 (F0-F)/F0与GOx质量浓度的关系
Fig.2 Relationship between the (F0-F)/F0 and the GOx mass concentration
2.2 信号探针(AFB1-OVA-PPs-GOx)添加量的优化
为了获得灵敏的检测信号,磁性捕获探针(MMPMs-AFB1抗体)与信号探针(AFB1-OVA-PPs-GOx)的添加比例是关键,故对其进行优化。在100 μL的磁性捕获探针中分别添加不同体积的信号探针进行反应,结果如图3所示,随着信号探针添加量的增加,芬顿反应-ThT荧光核酸探针体系的荧光强度变化值(F0-F)/F0逐渐增加,当添加量达到80 μL时,荧光强度变化值(F0-F)/F0达到最大值并保持稳定,进一步添加更多的信号探针,检测体系的荧光强度变化值(F0-F)/F0反而有所下降,以上现象说明,在信号探针的添加量为80 μL时,磁性捕获探针与信号探针的结合位点达到饱和,过量的信号探针反而会造成较大的空间位阻。因此,本实验选择信号探针(AFB1-OVA-PPs-GOx)的添加量为80 μL。
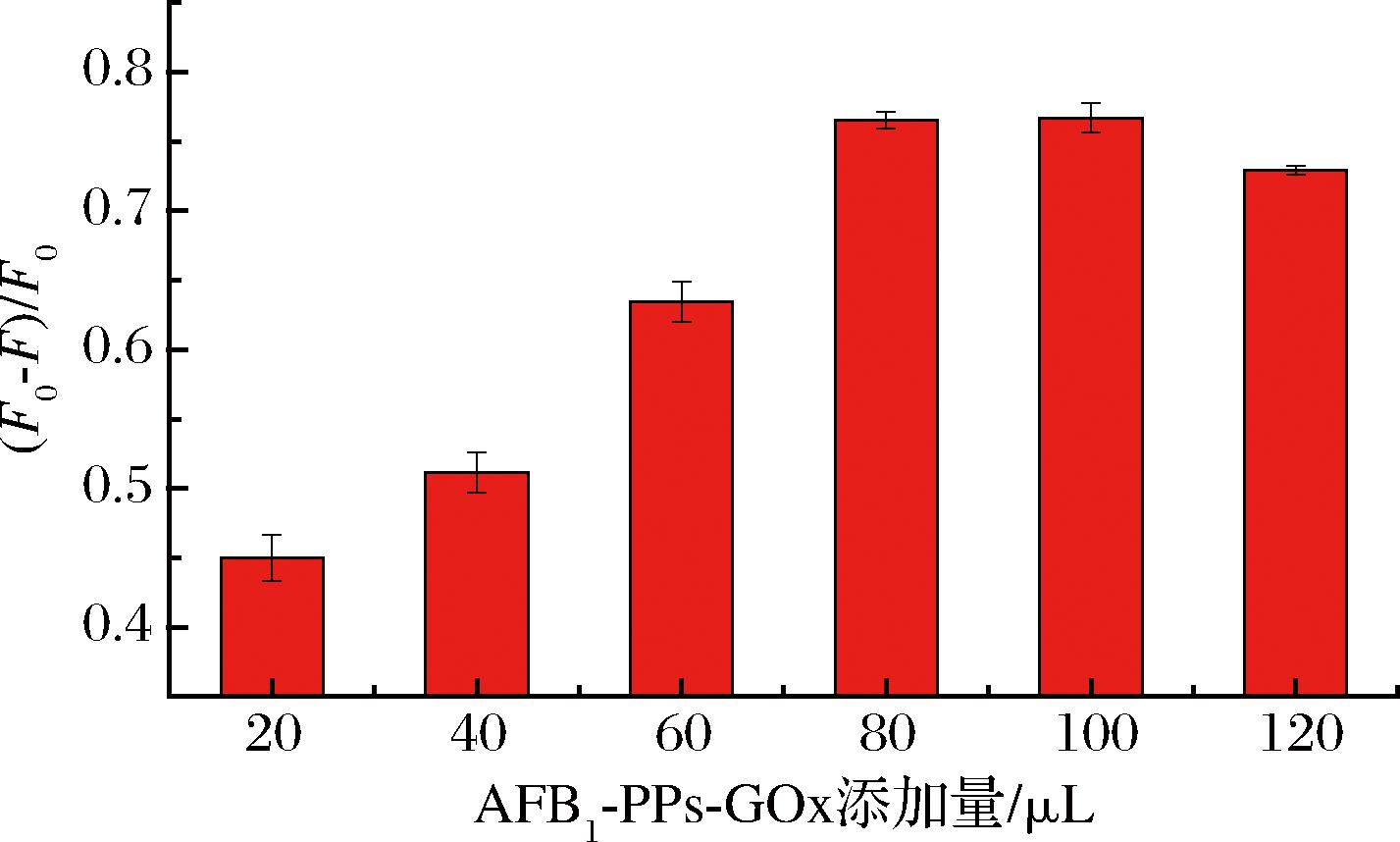
图3 100 μL磁性捕获探针与不同添加量信号探针反应后所得复合物的荧光强度
Fig.3 Fluorescence intensity recorded with various amounts of signal probes after incubation with 100 μL of magnetic capture probes
2.3 灵敏度与特异性
2.3.1 灵敏度
在优化的实验条件下,向检测体系中添加0~50 ng/mL AFB1标准溶液对其进行分析,结果如图4-a所示,在AFB1添加量为0 ng/mL的情况下,荧光发射光谱达到最小值,随着AFB1质量浓度的增加,芬顿反应-ThT荧光核酸探针体系的荧光发射光谱逐渐增加。以AFB1的质量浓度为横坐标,荧光强度变化值[(F-F0)/F0]为纵坐标,图4-b显示了该免疫荧光传感器检测AFB1的标准曲线。根据20个空白样品平均值与3倍的标准偏差的和(standard deviation,3SD)得出本方法的最低检测限(limit of detection,LOD)为0.027 ng/mL AFB1。随着AFB1的质量浓度从0.05逐渐增加到50 ng/mL,荧光强度变化值[(F-F0)/F0]呈现良好线性,线性范围为0.05~50 ng/mL (R2=0.994 75,图4-b)。
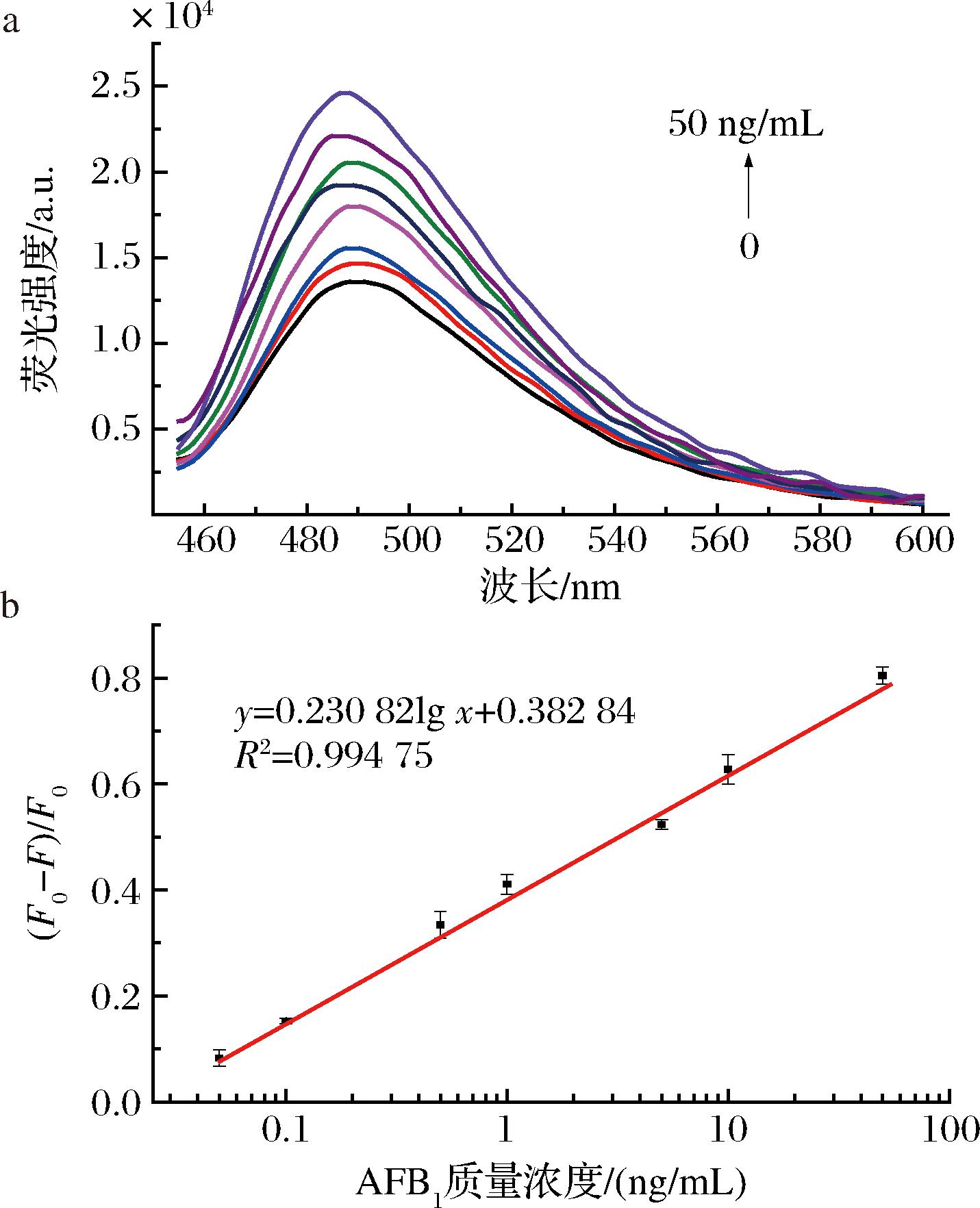
a-AFB1磁分离荧光免疫分析方法在不同AFB1质量浓度下的荧光发射光谱;b-AFB1磁分离荧光免疫分析方法的标准曲线
图4 AFB1磁分离荧光免疫分析方法的荧光强度与AFB1浓度的关系
Fig.4 The relationship of the fluorescence intensity of the AFB1 magnetic separation fluorescence immunoassay method and the mass concentration of AFB1
如表1所示,将本方法与其他的检测AFB1方法进行比较,本方法的灵敏度优于其他免疫分析技术,高于适配体为基础的检测技术,也可与分子印迹、免疫亲和柱为基础的高效液相色谱检测技术相媲美,本方法可在较宽的检测范围内(0.05~50 ng/mL)实现对AFB1的定量检测和灵敏检测。这是由于本研究应用的基于纳米磁珠和纳米微球的液/液相检测系统能够提供更大的反应接触面积和负载更多的GOx,实现信号的放大;本方法用到的基于GOx和芬顿反应-ThT核酸探针体系的酶级联信号放大系统,可灵敏检测含量低至0.1 μg/mL的GOx,为该检测体系的荧光信号灵敏输出提供了保障。
表1 建立的方法与其他AFB1检测方法的比较
Table 1 Comparison of the established method with other AFB1 detection methods

注:—表示不存在。
检测技术信号探针检测时间/minLOD/(ng/mL)检测范围/(ng/mL)参考文献免疫试纸条Dr-GNPs-Ab200.25—[20]比色免疫法Ab-AuNPs-AOX+MnO2/TMB800.10.1~100[21]荧光免疫技术QDs600.010.08~1.97[22]荧光共振能量转移FAM-适配体900.20.25~32[23]竞争型比色法生物素-适配体750.0620.156~15.6[24]MIP-HPLC—450.027 50~20[25]免疫亲和柱-HPLC—500.150.4~7.2[26]磁分离荧光免疫分析方法AFB1-OVA-PPs-GOx+Fenton/ThT荧光核酸体系850.0270.05~50本研究
2.3.2 该方法的特异性
选择8种不同种类的真菌毒素(质量浓度为10 ng/mL)对该AFB1磁分离荧光免疫分析方法的选择性和特异性进行评价。8种真菌毒素包括:AFB1的结构类似物(AFB2、AFG1、AFG2和AFM1)、伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2(FB2)、赭曲霉毒素A(ochratoxin A,OTA)和玉米赤霉烯酮(zearalenone,ZEN)。结果如图5所示,AFB1产生的荧光强度变化值[(F-F0)/F0]明显高于其他真菌毒素的,只有AFB2和AFG1产生较弱的信号变化,这是由于AFB1多克隆抗体本身与AFB2和AFG1有较弱的交叉反应,本结果说明本方法对AFB1具有良好的选择性。
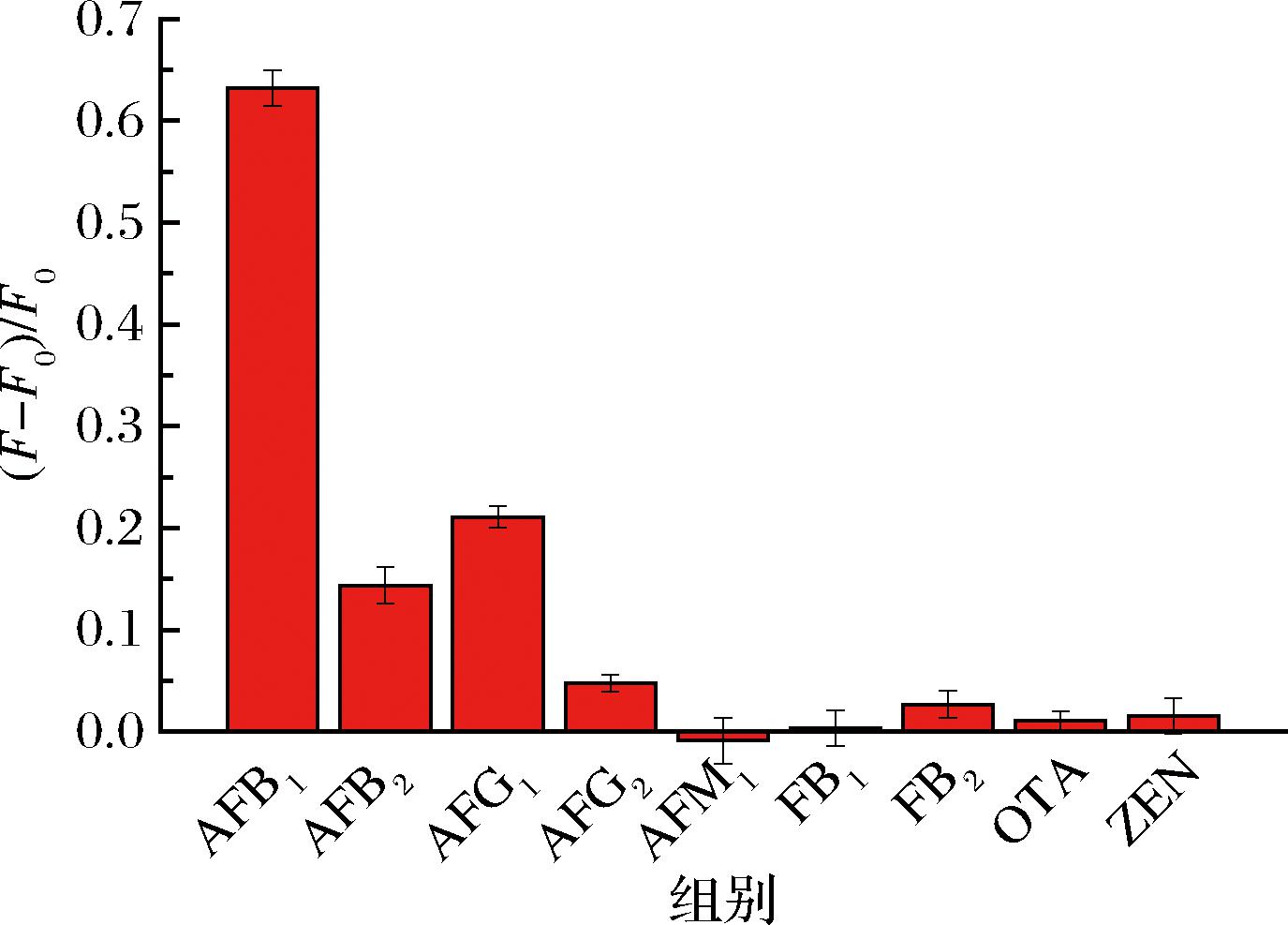
图5 AFB1磁分离荧光免疫分析方法的特异性
Fig.5 Specificity of the AFB1 magnetic separation fluorescence immunoassay method
2.4 样品分析
2.4.1 加标回收样品
选取4种植物源性食品(玉米样品、大米样品、啤酒样品、白酒样品)制得AFB1的添加量为1、5、20、200 ng/g(ng/mL)的加标样品,用本方法对其进行检测,得到AFB1的检测值,计算回收率和变异系数。结果如表2所示,AFB1的回收率为81.6%~112.1%,变异系数为1.2%~15.8%。将本方法测得的加标样品的检测结果与商品化ELISA试剂盒测得的检测结果进行比较,本方法的检测结果与ELISA试剂盒检测结果基本一致。以上结果表明本方法具有较高的准确度、精密度和稳定性。
表2 食品样品中AFB1加标回收的结果(n=3)
Table 2 The results of AFB1 standard addition recovery in food sample (n=3)

样品加标质量浓度/[ng/g(ng/mL)]测得量(平均值±标准偏差)/[ng/g(ng/mL)]本方法ELISA试剂盒回收率/%变异系数/%11.02±0.090.96±0.06101.69.1玉米55.32±0.65.01±0.23106.411.32019.62±0.2320.57±1.5598.11.2200185.80±27.8192.27±5.2892.915.011.00±0.060.99±0.15100.66.3大米54.92±0.295.03±0.3998.46.02021.49±2.4221.64±1.78107.511.3200202.06±11.75194.54±9.43101.035.811.01±0.11.08±0.01100.610.3啤酒54.34±0.184.86±0.3486.84.22017.64±0.619.08±188.23.4200208.99±32.3199.27±7.3104.515.510.92±0.040.94±0.191.84.3白酒54.08±0.55.01±0.3281.612.32022.41±3.5319.15±2.1112.115.8200200.02±16.98201.01±12.4100.018.5
2.4.2 质控样品
用含有一定量AFB1的玉米粉质控样品考察了该方法对于实际食品样品中AFB1的分析准确性,结果表明,测得的玉米粉质控样品中AFB1的含量为(13.20±1.36) ng/g,变异系数为10.32%,该质控样品中的AFB1的含量为(13.96±3.58) ng/g,以上结果表明在实际食品样品的检测中,本方法具有很好的准确性。
3 结论
本文构建了一种基于芬顿反应-ThT荧光核酸探针体系的“Turn on”型AFB1磁分离荧光免疫分析方法用于植物源性食品的分析,该方法具有宽的分析范围(0.05~50 ng/mL),较高的灵敏度(0.027 ng/mL)和不易受外界环境干扰(“Turn on”型荧光检测和磁分离体系)等优点,该免疫检测方法检测植物源性食品中AFB1准确性高,检测结果与ELISA试剂盒的检测结果具有良好的一致性,并成功应用于玉米粉质控样品中,由此可看出,该方法在植物源性食品中AFB1的检测方面具有良好的实用性和明显的优势。
[1] ABBAS H K, ACCINELLI C, SHIER W T. Biological control of aflatoxin contamination in U.S. crops and the use of bioplastic formulations of Aspergillus flavus biocontrol strains to optimize application strategies[J]. Journal of Agricultural and Food Chemistry, 2017, 65(33):7081-7087.
[2] QI D W, FEI T, LIU H, et al. Development of multiple heart-cutting two-dimensional liquid chromatography coupled to quadrupole-orbitrap high resolution mass spectrometry for simultaneous determination of aflatoxin B1, B2, G1, G2, and ochratoxin A in snus, a smokeless tobacco product[J]. Journal of Agricultural and Food Chemistry, 2017, 65(45):9923-9929.
[3] SERGEYEVA T, YARYNKA D, PILETSKA E, et al. Fluorescent sensor systems based on nanostructured polymeric membranes for selective recognition of Aflatoxin B1[J]. Talanta, 2017, 175:101-107.
[4] PELTOMAA R, BENITO-PE A E, MORENO-BONDI M C. Bioinspired recognition elements for mycotoxin sensors[J]. Analytical and Bioanalytical Chemistry, 2018, 410(3):747-771.
A E, MORENO-BONDI M C. Bioinspired recognition elements for mycotoxin sensors[J]. Analytical and Bioanalytical Chemistry, 2018, 410(3):747-771.
[5] VILLA C, MOURA M B M V, COSTA J, et al. β-Lactoglobulin versus casein indirect ELISA for the detection of cow’s milk allergens in raw and processed model meat products[J]. Food Control, 2022, 135:108818.
[6] HU G S, SHENG W, ZHANG Y, et al. Upconversion nanoparticles and monodispersed magnetic polystyrene microsphere based fluorescence immunoassay for the detection of sulfaquinoxaline in animal-derived foods[J]. Journal of Agricultural and Food Chemistry, 2016, 64(19):3908-3915.
[7] ZHANG X R, LIU M S, MAO Y N, et al. Ultrasensitive photoelectrochemical immunoassay of antibody against tumor-associated carbohydrate antigen amplified by functionalized graphene derivates and enzymatic biocatalytic precipitation[J]. Biosensors and Bioelectronics, 2014, 59:21-27.
[8] DENG X D, CHEN M S, FU Q, et al. A highly sensitive immunosorbent assay based on biotinylated graphene oxide and the quartz crystal microbalance[J]. ACS Applied Materials &Interfaces, 2016, 8(3):1893-1902.
[9] LAI W Q, ZHUANG J Y, TANG D P. Novel colorimetric immunoassay for ultrasensitive monitoring of brevetoxin B based on enzyme-controlled chemical conversion of sulfite to sulfate[J]. Journal of Agricultural and Food Chemistry, 2015, 63(7):1982-1989.
[10] DAS J, AZIZ M A, YANG H. A nanocatalyst-based assay for proteins: DNA-free ultrasensitive electrochemical detection using catalytic reduction of p-nitrophenol by gold-nanoparticle labels[J]. Journal of the American Chemical Society, 2006, 128(50):16022-16023.
[11] MIAO Y B, GAN N, REN H X, et al. A triple-amplification colorimetric assay for antibiotics based on magnetic aptamer-enzyme co-immobilized platinum nanoprobes and exonuclease-assisted target recycling[J]. Analyst, 2015, 140(22):7663-7671.
[12] HU G S, SHENG W, ZHANG Y, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J]. Analytical and Bioanalytical Chemistry, 2015, 407(28):8487-8496.
[13] COTTON G J, MUIR T W. Generation of a dual-labeled fluorescence biosensor for Crk-II phosphorylation using solid-phase expressed protein ligation[J].Chemistry &Biology, 2000, 7(4):253-261.
[14] RENAUD DE LA FAVERIE A, GUÉDIN A, BEDRAT A, et al. Thioflavin T as a fluorescence light-up probe for G4 formation[J]. Nucleic Acids Research, 2014, 42(8): e65.
[15] ZHAO D, DONG X W, JIANG N, et al. Selective recognition of parallel and anti-parallel thrombin-binding aptamer G-quadruplexes by different fluorescent dyes[J]. Nucleic Acids Research, 2014, 42(18):11612-11621.
[16] LI Y N, WANG J Y, ZHANG B, et al. A rapid fluorometric method for determination of aflatoxin B1 in plant-derived food by using a thioflavin T-based aptasensor[J]. Mikrochimica Acta, 2019, 186(4):214.
[17] WINTERBOURN C C. Toxicity of iron and hydrogen peroxide: The Fenton reaction[J]. Toxicology Letters, 1995, 82:969-974.
[18] MAO Z G, QING Z H, QING T P, et al. Poly(thymine)-templated copper nanoparticles as a fluorescent indicator for hydrogen peroxide and oxidase-based biosensing[J]. Analytical Chemistry, 2015, 87(14):7454-7460.
[19] LIU C C, SHENG Y J, SUN Y H, et al. A glucose oxidase-coupled DNAzyme sensor for glucose detection in tears and saliva[J]. Biosensors and Bioelectronics, 2015, 70:455-461.
[20] DI NARDO F, BAGGIANI C, GIOVANNOLI C, et al. Multicolor immunochromatographic strip test based on gold nanoparticles for the determination of aflatoxin B1 and fumonisins[J]. Microchimica Acta, 2017, 184(5):1295-1304.
[21] LAI W Q, ZENG Q, TANG J, et al. A conventional chemical reaction for use in an unconventional assay: A colorimetric immunoassay for aflatoxin B1 by using enzyme-responsive just-in-time generation of a MnO2 based nanocatalyst[J]. Mikrochimica Acta, 2018, 185(2):92.
[22] ZHANG F Y, LIU B, ZHANG Y, et al. Application of CdTe/CdS/ZnS quantum dot in immunoassay for aflatoxin B1 and molecular modeling of antibody recognition[J]. Analytica Chimica Acta, 2019, 1047:139-149.
[23] GOUD K Y, SHARMA A, HAYAT A, et al. Tetramethyl-6-carboxyrhodamine quenching-based aptasensing platform for aflatoxin B1: Analytical performance comparison of two aptamers[J]. Analytical Biochemistry, 2016, 508:19-24.
[24] SUN L L, ZHAO Q. Competitive horseradish peroxidase-linked aptamer assay for sensitive detection of aflatoxin B1[J]. Talanta, 2018, 179:344-349.
[25] SEMONG O, BATLOKWA B S. Development of an aflatoxin B1 specific molecularly imprinted solid phase extraction sorbent for the selective pre-concentration of toxic aflatoxin B1 from child weaning food, Tsabana[J]. Molecular Imprinting, 2017, 5(1):1-15.
[26] ALIAKBARZADEH G, MAHMOUDI-MEYMAND M, MAZAHERI M. Verification of a standard method based on immunoaffinity column cleanup and HPLC-FLD analysis for determination of aflatoxins in peanut kernels[J]. Food Control, 2023, 152:109820.